ABSTRACT
PHYTOTOXICITY ADVANCED TEST AND HERBICIDE EFFICACY OF AMINOCYCLOPYRACHLOR IN IMMATURE OIL PALM
(Elaeis guineensis Jacq.)
By
ANISSA INDRA WATI
This research was tested to determine aminocyclopyrachlor herbicide poisoning
symptoms, the severity of toxicity of aminocyclopyrachlor herbicide in immature
oil palm as affected by different doses of herbicide, the effect of
aminocyclopyrachlor herbicides on the plant growth, and the effectiveness of
aminocyclopyrachlor herbicide in controlling weeds in immature oil palm.
The research was conducted from October 2013 – January 2014 in Rajabasa
Village, Bandar Lampung and Plant Science Laboratory, Faculty of Agriculture,
University of Lampung. The research was arranged in Randomized Completely
Block Design with 9 treatments and 4 replications. The treatments: 7,5; 15; 30;
60 g ha-1 aminocyclopyrachlor, 729 g ha-1 glyphosate, 115,2 + 64,8 g ha-1
aminopyralid + trichlopyr, 1297 g ha-1 2,4-D, mechanical control, and control.
Anissa Indra Wati
Tukey's test, and differences in the value being tested with Least Significant
Difference test at 5% level.
The results: (1) aminocyclopyrachlor 15 – 60 g ha-1 cause poisoning symptom on
immature oil palm from 2 – 10 Weeks After Application; (2) aminocyclopyrachlor
60 g ha-1 cause the highest level of toxicity compared to aminocyclopyrachlor 7,5
– 30 g ha-1, but is equivalent with three others comparator herbicides;
(3) aminocyclopyrachlor and three others comparator herbicides cause poisoning
symptom in leaf midrib, decrease the levels of green leaf midrib but not suppress
the addition of plant height; (4) aminocyclopyrachlor 15 – 60 g ha-1 suppress the
leaf midrib length equivalent to aminopiralid + trichlopyr 115,2 + 64,8 g ha-1, and
2,4-D 1297 g ha-1. Aminocyclopyrachlor 60 g ha-1 inhibit root growth of plant;
(5) aminocyclopyrachlor herbicide cannot suppress the total dry weight of weeds,
but aminocyclopyrachlor 30 and 60 g ha-1 suppress the percentage of the total
weeds cover at 4, 8, and 10 WAA. Aminocyclopyrachlor 60 g ha-1 controls the
Asystasia gangetica at 2, 4, and 8 WAA.
ABSTRAK
UJI LANJUTAN FITOTOKSISITAS DAN EFIKASI HERBISIDA AMINOSIKLOPIRAKLOR PADA KELAPA SAWIT
(Elaeis guineensis Jacq.) BELUM MENGHASILKAN
Oleh
ANISSA INDRA WATI
Penelitian dilakukan untuk mengetahui gejala keracunan herbisida
aminosiklopiraklor, tingkat keparahan keracunan herbisida aminosiklopiraklor
pada beberapa taraf dosis herbisida, pengaruh herbisida aminosiklopiraklor
terhadap pertumbuhan tanaman, dan efektivitas herbisida aminosiklopiraklor
dalam mengendalikan gulma pada piringan kelapa sawit.
Penelitian dilaksanakan di Kelurahan Rajabasa, Bandar Lampung dan
Laboratorium Ilmu Tanaman Fakultas Pertanian Universitas Lampung pada bulan
Oktober 2013 – Januari 2014. Penelitian disusun dalam Rancangan Kelompok
Teracak Sempurna dengan 9 perlakuan dan 4 ulangan. Susunan perlakuan:
aminosiklopiraklor 7,5; 15; 30; 60 g ha-1, glifosat 729 g ha-1, aminopiralid +
Anissa Indra Wati
Homogenitas ragam diuji dengan uji Bartlet, aditivitas diuji dengan uji Tukey, dan
perbedaan nilai tengah diuji dengan uji Beda Nyata Terkecil taraf 5%.
Hasil penelitian: (1) aminosiklopiraklor 15 – 60 g ha-1 menyebabkan gejala
keracunan tanaman kelapa sawit belum menghasilkan dari 2 – 10 MSA; (2)
aminosiklopiraklor 60 g ha-1 menyebabkan tingkat keracunan tertinggi
dibandingkan aminosiklopiraklor 7,5 – 30 g ha-1, setara dengan ketiga herbisida
pembanding; (3) herbisida aminosiklopiraklor dan herbisida pembanding
menyebabkan pelepah daun tanaman teracuni, menurunkan tingkat hijau pelepah
daun tetapi tidak menekan penambahan tinggi tanaman; (4) aminosiklopiraklor 15
– 60 g ha-1 menekan panjang pelepah daun setara dengan aminopiralid+triklopir
115,2+64,8 g ha-1 dan 2,4-D 1297 g ha-1. Aminosiklopiraklor 60 g ha-1
menghambat pertumbuhan akar tanaman; (5) herbisida aminosiklopiraklor tidak
menekan bobot kering gulma total, tetapi aminosiklopiraklor 30 dan 60 g ha-1
menekan persentase penutupan gulma total pada 4, 8, dan 10 MSA.
Aminosiklopiraklor 60 g ha-1 mengendalikan Asystasia gangetica pada 2, 4, dan 8
MSA.
UJI LANJUTAN FITOTOKSISITAS DAN EFIKASI HERBISIDA AMINOSIKLOPIRAKLOR PADA KELAPA SAWIT
(Elaeis guineensis Jacq.) BELUM MENGHASILKAN
Oleh
ANISSA INDRA WATI
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA PERTANIAN
Pada
Jurusan Agroteknologi
Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
UJI LANJUTAN FITOTOKSISITAS DAN EFIKASI HERBISIDA AMINOSIKLOPIRAKLOR PADA KELAPA SAWIT
(Elaeis guineensis Jacq.) BELUM MENGHASILKAN
(Skripsi)
Oleh
ANISSA INDRA WATI
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Desa Indra Putra Subing, Kecamatan Bandar Jaya,
Kabupaten Lampung Tengah pada tanggal 06 Mei 1992. Penulis merupakan anak
pertama dari tiga bersaudara, dari pasangan Bapak Bambang Ardiansyah dan Ibu
Sulasih. Penulis menyelesaikan pendidikan Taman Kanak-kanak (TK) PT. Gula
Putih Mataram, Lampung Tengah pada tahun 1998, Sekolah Dasar (SD)
diselesaikan di SDS 01 PT. Gula Putih Mataram, Lampung Tengah pada tahun
2004, Sekolah Menengah Pertama (SMP) di SMP PT. Gula Putih Mataram,
Lampung Tengah pada tahun 2007, dan Sekolah Menengah Atas (SMA) di SMA
Sugar Group, Lampung Tengah pada tahun 2010.
Penulis terdaftar sebagai mahasiswa reguler Jurusan Agroteknologi Fakultas
Pertanian Universitas Lampung pada tahun 2010 melalui jalur SNMPTN (Seleksi
Nasional Masuk Perguruan Tinggi Negeri). Selama menjadi mahasiswa, penulis
mengikuti UKMF LS-MATA (Lembaga Studi Mahasiswa Fakultas Pertanian),
berkesempatan menjadi asisten praktikum Ilmu dan Teknik Pengendalian Gulma
pada tahun 2013. Pada tahun 2014 menjadi asisten Pengelolaan Gulma
Perkebunan D3 Perkebunan dan Dasar-Dasar Perlindungan Tanaman. Pada bulan
Universitas Lampung di Desa Gunung Sangkarang, Kecamatan Blambangan
Umpu, Kabupaten Way Kanan. Pada bulan Juli 2013 penulis mengikuti kegiatan
Praktik Umum (PU) di PT. Gunung Madu Plantations, Desa Gunung Batin,
PERSEMBAHAN
Alhamdulillahirabbilalamin
Dengan Ketulusan Hati dan Rasa Penuh Syukur, Kupersembahkan
Karya ini Kepada :
Kedua Orang Tuaku
“Ayahanda Bambang Ardiansyah dan Ibunda Sulasih”
untuk Kasih
Sayang dan D
o’
a yang Tiada Henti
Adik-adikku
“
Zakia Wafa Putri Karimah dan
M. Hilmi Nur Fakhreza”
yang
Menjadi Kebanggaanku
Teman dan Sahabatku yang Selalu Menemani dalama Suka Duka
Pengetahuan tidaklah cukup, kita harus mengamalkannya.
Niat tidaklah cukup, kita harus melakukannya.
(Johann Wolfgang von Goethe)
Kebanggaan terbesar adalah bukan tidak pernah gagal,
tetapi bangkit setiap kali jatuh.
(Confisius)
Banyak kegagalan dalam hidup ini dikarenakan
orang tidak menyadari betapa dekatnya
mereka dengan keberhasilan,
saat mereka menyerah.
(Thomas Alfa Edison)
SANWACANA
Segala puji dan syukur penulis panjatkan kepada Rabb semesta alam atas
limpahan Rahmat dan Hidayah-Nya, sehingga penulis dapat melaksanakan
penelitian dan menyelesaikan skripsi ini. Penulis menyadari bahwa skripsi ini
tidak akan dapat terselesaikan tanpa bantuan dari berbagai pihak.
Oleh karena itu, pada kesempatan ini penulis mengucapkan terimakasih kepada :
1. Ibu Prof. Dr. Ir. Nanik Sriyani, M.Sc., selaku Pembimbing Utama atas
kesediaannya untuk memberikan bimbingan, nasihat, kritik, dan saran yang
membangun kepada penulis selama pelaksanaan penelitian dan penulisan
skripsi;
2. Bapak Dr. Ir. Rusdi Evizal, M.S., selaku Pembimbing Kedua atas
kesediaannya untuk memberikan bimbingan, nasihat, kritik, dan saran yang
diberikan kepada penulis dalam proses penyelesaian skripsi;
3. Bapak Ir. Dad Resiworo. J. Sembodo, M.S., selaku Penguji atas segala kritik
dan saran yang membangun dalam proses penyelesaian skripsi;
4. Bapak Prof. Dr. Ir.Wan Abbas Zakaria, M.S., selaku Dekan Fakultas
Pertanian Universitas Lampung;
5. Bapak Prof. Dr. Ir. Setyo Dwi Utomo, M. Sc., selaku Ketua Bidang Budidaya
6. Bapak Dr. Ir. Kuswanta F. Hidayat, M.P., selaku Ketua Jurusan
Agroteknologi dan Pembimbing Akademik, untuk bimbingan dan pengarahan
yang diberikan selama penulis menjadi mahasiswa di Universitas Lampung;
7. Kedua orangtua dan adik-adikku tercinta untuk kasih sayang, dukungan, dan
doa yang diberikan kepada penulis;
8. Teman-teman seperjuangan, Mustajab, S.P, Nurjannah Yuliana Hastuti, S.P,
Nana Ratna Wati S.P, terima kasih atas bantuan dan dukungan kalian;
9. Teman-teman AGT’10 KELAS A yang selalu menemani dalam suka dan
duka, Alawiyah, S.P, Ade Yunike Larassati, S.P, Ferdaner Humairah Fazri,
S.P, Agung Ari Brata, S.P, Bangun Ferdian, S.P, Galih Dwi Cahyo, S.P,
Novri, S.P, Septiana Triyani, S.P, Sherly Ardhani Pithaloka, S.P, Tibor Eka
Saputra, S.P dan teman semua yang tidak bisa disebutkan satu per satu;
10. Nico Alfredo, S.P, Rizka Sulung Antika, S.P, Darso Waluyo, S.P, Fernando
Iskandar Damanik, S.P, Anggi V. Ningrum, S.P, atas bantuannya selama
melakukan penelitian;
11. Mas Yono selaku tenaga kebun dan seluruh pegawai Sekolah Global Madani
untuk bantuannya selama melaksanakan penelitian;
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, oleh karena itu
kritik dan saran yang bersifat membangun sangat penulis harapkan dan semoga
hasil penelitian bermanfaat bagi semua pihak.
Bandar Lampung, September 2014
Penulis
DAFTAR ISI
Halaman
DAFTAR TABEL ... xix
DAFTAR GAMBAR ... xxvi
I. PENDAHULUAN ... 1
1.1 Latar Belakang dan Masalah ... 1
1.2 Tujuan Penelitian ... 4
1.3 Landasan Teori ... 4
1.4 Kerangka Pemikiran ... 8
1.5 Hipotesis ... 10
II. TINJAUAN PUSTAKA ... 11
2.1 Tanaman Kelapa Sawit ... 11
2.1.1 Morfologi Kelapa Sawit ... 12
2.1.1.1 Akar ... 12
2.1.1.2 Batang ... 12
2.1.1.3 Daun ... 12
2.1.1.4 Bunga ... 13
2.1.1.5 Buah ... 13
2.1.2 Tipe Kelapa Sawit ... 14
2.2 Syarat Tumbuh Kelapa Sawit ... 15
2.3 Pembibitan Kelapa Sawit ... 15
2.4 Pengendalian Gulma Pada Kelapa Sawit ... 16
xviii
4.4 Penambahan Pelepah Daun Tanaman ... 45
4.5 Pelepah Daun Tanaman Teracuni ... 47
4.6 Panjang Pelepah Daun Muda ... 48
4.7 Tingkat Hijau Daun ... 49
4.8 Bobot Kering Akar ... 51
4.9 Persentase Penutupan Gulma Total ... 52
4.10 Bobot Kering Gulma Total ... 54
4.11 Bobot Kering Gulma Asystasia gangetica ... 55
V. KESIMPULAN DAN SARAN ... 58
5.1 Kesimpulan ... 58
5.2 Saran ... 59
PUSTAKA ACUAN ... 60
DAFTAR TABEL
Tabel Halaman
1. Perlakuan herbisida. ... 31
2. Pengaruh perlakuan herbisida terhadap tingkat keracunan
tanaman kelapa sawit pada 2, 4, 6, 8, dan 10 MSA. ... 43
3. Pengaruh perlakuan herbisida terhadap penambahan tinggi
tanaman kelapa sawit pada 2, 4, 6, 8, dan 10 MSA. ... 44
4. Pengaruh perlakuan herbisida terhadap penambahan pelepah
daun tanaman kelapa sawit pada 2, 4, 6, 8, dan 10 MSA. ... 46
5. Pengaruh perlakuan herbisida terhadap pelepah daun teracuni
tanaman kelapa sawit pada 4, 6, 8, dan 10 MSA. ... 47
6. Pengaruh perlakuan herbisida terhadap panjang daun muda
tanaman kelapa sawit pada 6, 8, 10 dan 12 MSA. ... 49
7. Pengaruh perlakuan herbisida terhadap tingkat hijau daun
tanaman kelapa sawit pada 4, 8, dan 12 MSA. ... 50
8. Pengaruh perlakuan herbisida terhadap bobot kering akar
tanaman kelapa sawit. ... 51
9. Pengaruh perlakuan herbisida terhadap persentase penutupan
gulma total pada 2, 4, 6, 8, dan 10 MSA. ... 53
10. Pengaruh perlakuan herbisida terhadap bobot kering gulma
total pada 2, 4, 6, 8, dan 10 MSA. ... 54
11. Pengaruh perlakuan herbisida terhadap bobot kering gulma
Asystasia gangetica pada 2, 4, 6, 8, dan 10 MSA. ... 57
12. Nilai scoring tingkat keracunan tanaman pada 2 MSA. ... 66
13. Transformasi √√√(x+0,5) nilai scoring tingkat keracunan tanaman
xx 14. Analisis ragam transformasi √√√(x+0,5) nilai scoring tingkat
keracunan tanaman pada 2 MSA. ... 67
15. Nilai scoring tingkat keracunan tanaman pada 4 MSA. ... 67
16. Transformasi √√√(x+0,5) nilai scoring tingkat keracunan tanaman
pada 4 MSA. ... 68
17. Analisis ragam transformasi √√√(x+0,5) nilai scoring tingkat
keracunan tanaman pada 4 MSA. ... 68
18. Nilai scoring tingkat keracunan tanaman pada 6 MSA. ... 69
19. Transformasi √√√(x+0,5) nilai scoring tingkat keracunan tanaman
pada 6 MSA. ... 69
20. Analisis ragam transformasi √√√(x+0,5) nilai scoring tingkat
keracunan tanaman pada 6 MSA. ... 70
21. Nilai scoring tingkat keracunan tanaman pada 8 MSA. ... 70
22. Transformasi √√√(x+0,5) nilai scoring tingkat keracunan tanaman
pada 8 MSA. ... 71
23. Analisis ragam transformasi √√√(x+0,5) nilai scoring tingkat
keracunan tanaman pada 8 MSA. ... 71
24. Nilai scoring tingkat keracunan tanaman pada 10 MSA. ... 72
25. Transformasi √√√(x+0,5) nilai scoring tingkat keracunan tanaman
pada10 MSA. ... 72
26. Analisis ragam transformasi √√√(x+0,5) nilai scoring tingkat
keracunan tanaman pada 10 MSA. ... 73
27. Penambahan tinggi tanaman (cm) pada 2 MSA. ... 73
28. Transformasi √(x+0,5) penambahan tinggi tanaman (cm)
pada 2 MSA. ... 74
29. Analisis ragam transformasi √(x+0,5) penambahan tinggi tanaman
(cm) pada 2 MSA. ... 74
30. Penambahan tinggi tanaman (cm) pada 4 MSA. ... 75
31. Analisis ragam penambahan tinggi tanaman (cm)
pada 4 MSA. ... 75
xxi 33. Analisis ragam penambahan tinggi tanaman (cm)
pada 6 MSA. ... 76
34. Penambahan tinggi tanaman (cm) pada 8 MSA. ... 77
35. Analisis ragam penambahan tinggi tanaman (cm)
pada 8 MSA. ... 77
36. Penambahan tinggi tanaman (cm) pada 10 MSA. ... 78
37. Analisis ragam penambahan tinggi tanaman (cm)
pada 10 MSA. ... 78
38. Penambahan pelepah daun tanaman pada 2 MSA. ... 79
39. Transformasi √√√(x+0,5) penambahan pelepah daun tanaman
pada 2 MSA. ... 79
40. Analisis ragam transformasi √√√(x+0,5) penambahan pelepah
daun tanaman pada 2 MSA. ... 80
41. Penambahan pelepah daun tanaman pada 4 MSA. ... 80
42. Transformasi √√√(x+1) penambahan pelepah daun tanaman
pada4 MSA. ... 81
43. Analisis ragam transformasi √√√(x+1) penambahan pelepah
daun tanaman pada 4 MSA. ... 81
44. Penambahan pelepah daun tanaman pada 6 MSA. ... 82
45. Transformasi √√√(x+4) penambahan pelepah daun tanaman
pada 6 MSA. ... 82
46. Analisis ragam transformasi √√√(x+4) penambahan pelepah
daun tanaman pada 6 MSA. ... 83
47. Penambahan pelepah daun tanaman pada 8 MSA. ... 83
48. Transformasi √√√(x+1) penambahan pelepah daun tanaman
pada 8 MSA. ... 84
49. Analisis ragam transformasi √√√(x+1) penambahan pelepah
daun tanaman pada 8 MSA. ... 84 50. Penambahan pelepah daun tanaman pada 10 MSA. ... 85
51. Transformasi √√√(x+5) penambahan pelepah daun tanaman
xxii 52. Analisis ragam transformasi √√√(x+5) penambahan pelepah
daun tanaman pada 10 MSA. ... 86
53. Pelepah daun teracuni pada 4 MSA. ... 86
54. Transformasi √√√(x+0,5) pelepah daun teracuni pada 4 MSA. ... 87
55. Analisis ragam transformasi √√√(x+0,5) pelepah daun teracuni
pada 4 MSA. ... 87
56. Pelepah daun teracuni pada 6 MSA. ... 88
57. Transformasi √√√(x+0,5) pelepah daun teracuni pada 6 MSA. ... 88
58. Analisis ragam transformasi √√√(x+0,5) jumlah daun teracuni
tanaman (pelepah) pada 6 MSA. ... 89
59. Pelepah daun teracuni pada 8 MSA. ... 89
60. Transformasi √√√(x+0,5) pelepah daun teracuni pada 8 MSA. ... 90
61. Analisis ragam transformasi √√√(x+0,5) pelepah daun teracuni
pada 8 MSA. ... 90
62. Pelepah daun teracuni pada 10 MSA. ... 91
63. Transformasi √√√(x+0,5) pelepah daun teracuni pada 10 MSA. ... 91
64. Analisis ragam transformasi √√√(x+0,5) pelepah daun teracuni
pada 10 MSA. ... 92
65. Panjang pelepah daun muda tanaman (cm) pada 6 MSA. ... 92
66. Analisis ragam panjang pelepah daun muda tanaman (cm) pada
6 MSA. ... 93
67. Panjang pelepah daun muda tanaman (cm) pada 8 MSA. ... 93
68. Analisis ragam panjang pelepah daun muda tanaman (cm) pada
8 MSA. ... 94
69. Panjang pelepah daun muda tanaman (cm) pada 10 MSA. ... 94
70. Analisis ragam panjang pelepah daun muda tanaman (cm) pada
10 MSA. ... 95
xxiii 72. Analisis ragam panjang pelepah daun muda tanaman (cm) pada
12 MSA. ... 96
73. Tingkat hijau daun tanaman (su) pada 4 MSA. ... 96
74. Analisis ragam tingkat hijau daun tanaman (su) pada 4 MSA. ... 97
75. Tingkat hijau daun tanaman (su) pada 8 MSA. ... 97
76. Analisis ragam tingkat hijau daun tanaman (su) pada 8 MSA. ... 98
77. Tingkat hijau daun tanaman (su) pada 12 MSA. ... 98
78. Transformasi √√√(x+0,5) tingkat hijau daun tanaman (su) pada
12 MSA. ... 99
79. Analisis ragam transformasi √√√(x+0,5) tingkat hijau daun
tanaman (su) pada 12 MSA. ... 99
80. Bobot kering akar (g/tanaman) pada 12 MSA. ... 100
81. Analisis ragam bobot kering akar (g/tanaman) pada 12 MSA. ... 100
82. Persentase penutupan gulma total (%) pada 2 MSA. ... 101
83. Analisis ragam persentase penutupan gulma total (%)
pada 2 MSA. ... 101
84. Persentase penutupan gulma total (%) pada 4 MSA. ... 102
85. Analisis ragam persentase penutupan gulma total (%)
pada 4 MSA. ... 102
86. Persentase penutupan gulma total (%) pada 6 MSA. ... 103
87. Analisis ragam persentase penutupan gulma total (%)
pada 6 MSA. ... 103
88. Persentase penutupan gulma total (%) pada 8 MSA. ... 104
89. Analisis ragam persentase penutupan persentase gulma total (%)
pada 8 MSA. ... 104
90. Persentase penutupan gulma total (%) pada 10 MSA. ... 105
91. Analisis ragam persentase penutupan gulma total (%)
xxiv 92. Bobot kering gulma total (g/0,25 m2) pada 2 MSA. ... 106
93. Analisis ragam bobot kering gulma total (g/0,25 m2) pada
2 MSA. ... 106
94. Bobot kering gulma total (g/0,25 m2) pada 4 MSA. ... 107
95. Transformasi √√√(x+0,5) bobot kering gulma total (g/0,25 m2)
pada 4 MSA. ... 107
96. Analisis ragam transformasi √√√(x+0,5) bobot kering gulma
total (g/0,25 m2) pada 4 MSA. ... 108
97. Bobot kering gulma total (g/0,25 m2) pada 6 MSA. ... 108
98. Transformasi √(x+0,5) bobot kering gulma total (g/0,25 m2)
pada 6 MSA. ... 109
99. Analisis ragam transformasi √(x+0,5) bobot kering gulma
total (g/0,25 m2) pada 6 MSA. ... 109
100.Bobot kering gulma total (g/0,25 m2) pada 8 MSA. ... 110
101.Transformasi √(x+0,5) bobot kering gulma total (g/0,25 m2)
pada 8 MSA. ... 110
102.Analisis ragam transformasi √(x+0,5) bobot kering gulma
total (g/0,25 m2) pada 8 MSA. ... 111
103.Bobot kering gulma total (g/0,25 m2) pada 10 MSA. ... 111
104.Analisis ragam bobot kering gulma total (g/0,25 m2)
pada 10 MSA. ... 112
105.Bobot kering gulma Asystasia gangetica (g/0,25 m2)
pada 2 MSA. ... 112
106.Transformasi √√√(x+0,5) bobot kering gulma Asystasia gangetica
(g/0,25 m2) pada 2 MSA. ... 113
107.Analisis ragam transformasi √√√(x+0,5) bobot kering gulma
Asystasia gangetica (g/0,25 m2) pada 2 MSA. ... 113
108.Bobot kering gulma Asystasia gangetica (g/0,25 m2)
pada 4 MSA. ... 114
109.Transformasi √√√(x+0,5) bobot kering gulma Asystasia gangetica
xxv 110.Analisis ragam transformasi √√√(x+0,5) bobot kering gulma
Asystasia gangetica (g/0,25 m2) pada 4 MSA. ... 115
111.Bobot kering gulma Asystasia gangetica (g/0,25 m2) pada
6 MSA. ... 115
112.Transformasi √√(x+0,5) bobot kering gulma Asystasia gangetica
(g/0,25 m2) pada 6 MSA. ... 116
113.Analisis ragam transformasi √√(x+0,5) bobot kering gulma
Asystasia gangetica (g/0,25 m2) pada 6 MSA. ... 116
114.Bobot kering gulma Asystasia gangetica (g/0,25 m2) pada
8 MSA. ... 117
115.Transformasi √(x+0,5) bobot kering gulma Asystasia gangetica
(g/0,25 m2) pada 8 MSA. ... 117
116.Analisis ragam transformasi √(x+0,5) bobot kering gulma
Asystasia gangetica (g/0,25 m2) pada 8 MSA. ... 118
117.Bobot kering gulma Asystasia gangetica (g/0,25 m2)
pada 10 MSA. ... 118
118.Transformasi √√(x+0,5) bobot kering gulma Asystasia gangetica
(g/0,25 m2) pada 10 MSA. ... 119
119.Analisis ragam transformasi √√(x+0,5) bobot kering gulma
Asystasia gangetica (g/0,25 m2) pada 10 MSA. ... 119
120.Jumlah pelepah daun kuncup tanaman kelapa sawit pada
2 – 10 MSA. ... 120
DAFTAR GAMBAR
Gambar Halaman
1. Rumus bangun aminosiklopiraklor. ... 22
2. Rumus bangun aminopiralid. ... 23
3. Rumus bangun triklopir. ... 25
4. Rumus bangun glifosat. ... 26
5. Rumus bangun 2,4-D. ... 28
6. Tata letak percobaan. ... 32
7. Denah area aplikasi herbisida. ... 34
8. Denah area pengambilan gulma. ... 39
9. Gejala keracunan perlakuan herbisida aminosiklopiraklor
60 g ha-1. ... 41
10. Kondisi awal tanaman kelapa sawit sebelum aplikasi
Herbisida. ... 124
11. Gejala keracunan tanaman kelapa sawit pada 10 MSA setelah
I. PENDAHULUAN
1.1 Latar Belakang dan Masalah
Tanaman kelapa sawit (Elaeis guineensis Jacq.) merupakan komoditas
perkebunan primadona Indonesia. Di tengah krisis global yang melanda dunia
saat ini, industri sawit tetap bertahan dan memberi sumbangan besar terhadap
perekonomian negara. Selain mampu menciptakan kesempatan kerja yang luas,
industri sawit menjadi salah satu sumber devisa terbesar bagi Indonesia.
Indonesia adalah negara penghasil minyak kelapa sawit terbesar kedua dunia
setelah Malaysia. Pada tahun 2011, Indonesia merupakan negara dengan
perkebunan sawit terluas di dunia dengan luas areal perkebunan mencapai 3,97
juta ha, dengan produksi CPO (Crude Palm Oil) mencapai 7,97 juta ton. Namun
produksi Indonesia masih rendah jika dibandingkan dengan Malaysia yang
mencapai 11,80 juta ton (Susila, 2011).
Setiap tahunnya terjadi peningkatan luasan areal perkebunan kelapa sawit. Sejak
tahun 2005-2010 sudah terjadi peningkatan sekitar 1439,4 ha dari 3593,4 ha
(Badan Pusat Statistik, 2012). Dengan meningkatnya luasan areal perkebunan
kelapa sawit menyebabkan kebutuhan akan bibit kelapa sawit menjadi meningkat
2
Menurut Solahudin (2004), keberhasilan pertumbuhan tanaman kelapa sawit di
lapangan sangat ditentukan oleh kondisi bibit yang ditanam. Bibit yang
pertumbuhannya baik akan memberikan tanaman yang pertumbuhannya baik pula
di lapangan. Selama proses pembibitan, tanaman belum menghasilkan serta
tanaman menghasilkan kelapa sawit, kehadiran gulma dapat menimbulkan
kerugian yaitu menurunkan produksi karena terjadi persaingan dalam
pengambilan air, unsur hara, sinar matahari, dan ruang hidup.
Untuk meningkatkan hasil produksi kelapa sawit maka diperlukan pengelolaan
gulma. Dalam usaha perkebunan, keberadaan gulma menjadi salah satu masalah
karena membutuhkan tenaga, biaya, dan waktu yang terus menerus untuk
mengendalikannya. Salah satu metode pengendalian gulma yang umum dan
utama pada perkebunan kelapa sawit yaitu pengendalian secara kimia dengan
menggunakan herbisida, karena cara ini lebih efektif, efisien, hemat tenaga, biaya,
dan waktu (Tjitrosoedirjo et al., 1984).
Salah satu kendala dalam pertumbuhan tanaman budidaya dan kaitannya dalam
hal persaingan adalah keberadaan gulma. Gulma juga dapat menurunkan mutu
produksi, mengganggu pertumbuhan tanaman, dan meningkatkan biaya
pemeliharaan. Gulma merupakan tumbuhan yang dapat mengganggu atau
merugikan kepentingan manusia (Sembodo, 2010).
Herbisida yang diaplikasikan dengan dosis tinggi akan mematikan seluruh bagian
tumbuhan dan sebaliknya pada dosis rendah, herbisida tidak merusak atau
mematikan tumbuhan lain. Dengan demikian, pemilihan herbisida yang sesuai
3
penting dengan memperhatikan ada tidaknya toksisitas pada tanaman dan daya
efektivitas herbisida.
Salah satu herbisida selektif adalah herbisida aminosiklopiraklor yang merupakan
herbisida pasca tumbuh dan bersifat selektif terhadap gulma berdaun lebar.
Herbisida aminosiklopiraklor merupakan herbisida yang termasuk dalam kelas
asam karboksilat pirimidin yang memiliki struktur kimia mirip dengan asam
karboksilat piridin yang memiliki cara kerja menghambat pertumbuhan tanaman
dengan cara mengganggu keseimbangan hormon auksin (Strachan et al., 2010).
Berdasarkan uraian di atas maka penggunaan herbisida harus tepat sasaran
sehingga tidak menyebabkan keracunan (fitotoksisitas) pada tanaman budidaya.
Penggunaan herbisida harus memperhatikan efektivitas, efisiensi, dan keamanan
serta efek samping yang mungkin timbul. Oleh karena itu, uji fitotoksisitas
herbisida merupakan salah satu cara untuk mengetahui gejala dan tingkat
keparahan keracunan tanaman kelapa sawit belum menghasilkan akibat aplikasi
herbisida tertentu.
Berdasarkan uraian latar belakang di atas, perumusan masalah dalam penelitian ini
adalah sebagai berikut:
1. Apakah penggunaan herbisida aminosiklopiraklor menimbulkan gejala
keracunan pada kelapa sawit belum menghasilkan?
2. Apakah penggunaan herbisida aminosiklopiraklor mempengaruhi tingkat
keparahan keracunan kelapa sawit belum menghasilkan pada beberapa taraf
4
3. Apakah penggunaan herbisida aminosiklopiraklor mempengaruhi
pertumbuhan tanaman pada kelapa sawit belum menghasilkan?
4. Apakah penggunaan herbisida aminosiklopiraklor mengendalikan gulma pada
piringan kelapa sawit belum menghasilkan?
1.2 Tujuan Penelitian
Berdasarkan latar belakang dan perumusan masalah yang telah dikemukakan,
maka disusun tujuan penelitian sebagai berikut:
1. Untuk mengetahui adanya gejala keracunan herbisida aminosiklopiraklor
pada kelapa sawit belum menghasilkan.
2. Untuk mengetahui tingkat keparahan keracunan herbisida aminosiklopiraklor
pada kelapa sawit belum menghasilkan pada beberapa taraf dosis herbisida
yang berbeda.
3. Untuk mengetahui pengaruh herbisida aminosiklopiraklor terhadap
pertumbuhan tanaman pada kelapa sawit belum menghasilkan.
4. Untuk mengetahui efektivitas herbisida aminosiklopiraklor dalam
mengendalikan gulma pada piringan kelapa sawit belum menghasilkan.
1.3 Landasan Teori
Kehilangan hasil yang disebabkan oleh gulma diperkirakan mencapai 20 – 30 %.
Keberadaan gulma pada areal pertanaman dapat berdampak negatif pada tanaman
karena gulma dan tanaman mempunyai kebutuhan yang sama untuk tumbuh dan
berkembang. Kebutuhan tersebut diantaranya unsur hara, air, cahaya, ruang
5
tanaman tersedia dalam jumlah terbatas, hal ini akan mengakibatkan kebutuhan
tanaman menjadi tidak optimal sehingga dapat menurunkan hasil produksi
tanaman budidaya (Moenandir, 1990).
Pengendalian gulma dengan herbisida selain relatif murah juga bertujuan untuk
mendapatkan pengendalian gulma secara selektif. Pemakaian herbisida yang
selektif terletak pada kemampuannya untuk mematikan gulma tanpa merusak
tanaman budidaya. Penggunaan herbisida yang kurang hati-hati dapat
menimbulkan abnormalitas pada pertumbuhan kelapa sawit, seperti pertumbuhan
yang terpuntir (memilin) (Agustia, 1997).
Penggunaan herbisida bertujuan untuk mendapatkan pengendalian gulma yang
selektif yaitu mematikan gulma tanpa mematikan tanaman budidaya. Selektivitas
herbisida dipengaruhi oleh beberapa faktor diantaranya jenis herbisida, formulasi
herbisida, volume semprot, ukuran butiran semprot dan waktu pemakaian (pra
tanam, pra tumbuh atau pasca tumbuh) (Tjitrosoedirdjo et al., 1984).
Menurut Ashton dan Craft (1981), berdasarkan tingkat selektivitasannya terhadap
tanaman, maka herbisida dibagi menjadi dua yaitu herbisida selektif mempunyai
sifat dimana pada saat diaplikasi maka gulma yang ada akan mati sementara
tanaman pokoknya tetap tidak mengalami gangguan tergantung tingkat
selektivitas dari herbisida tersebut. Herbisida nonselektif tidak memungkinkan
diaplikasikan pada saat ada tanaman budidaya. Kategori selektif ada beberapa
bahan aktif yang cukup terkenal dan banyak dipergunakan oleh petani yaitu metil
6
Kategori nonselektif, paraquat dan glifosat banyak dipergunakan terutama untuk
petani lahan kering dan perkebunan.
Herbisida yang banyak digunakan oleh petani yaitu glifosat dan 2,4-D karena
memiliki daya bunuh gulma secara lebih luas, tetapi tidak meracuni tanaman. Hal
ini didukung dengan pernyataan Mulyati (2004), aplikasi herbisida glifosat 48%
dan campuran herbisida glifosat 24% + 2,4-D 12% pada semua taraf dosis tidak
menunjukkan gejala keracunan pada tanaman kelapa sawit belum menghasilkan.
Selain itu, herbisida glifosat 16% (SPRAG 160 AS) tidak meracuni tanaman
kelapa sawit menghasilkan (Restyningsih, 2002).
Herbisida aminosiklopiraklor cepat diserap oleh daun dan akar dan
ditranslokasikan dengan baik dalam floem dan diperkirakan menumpuk di daerah
meristematik tanaman. Herbisida ini merupakan kelompok zat pengatur tumbuh
yang mempengaruhi keseimbangan hormon auksin. Herbisida tersebut cepat
diserap oleh tumbuhan melalui daun dan akar kemudian ditranslokasikan ke
jaringan meristem tumbuhan serta mengganggu kerja hormon auksin. Penyerapan
maksimum herbisida aminosiklopiraklor di jaringan tanaman hingga mengganggu
pertumbuhan yaitu 24 jam setelah aplikasi herbisida (Bukun et al., 2010).
Cara kerja herbisida aminosiklopiraklor adalah menghentikan pertumbuhan
tanaman dengan mengganggu keseimbangan hormon yang diperlukan untuk
perkembangan akar. Herbisida ini memiliki mekanisme kerja yang menargetkan
kompleks reseptor auksin. Terdapat dua proses biokimia yang terkena dampak
akibat aplikasi herbisida ini yaitu satu set protein penting untuk represi gen dan
7
tanaman yang sesuai (Finkelstein et al., 2008). Hasil penelitian Antika (2014),
herbisida aminosiklopiraklor 7,5 – 60 g ha-1 tidak menekan penambahan tinggi
bibit kelapa sawit.
Adapun penelitian tentang residu aminosiklopiraklor yaitu residu
aminosiklopiraklor pada tanaman tomat di dalam pot berkisar antara 0,5 - 8,0 ppb
(parts per billion), sementara serpihan pohon (mulsa) terkelupas mengandung
1,7 - 14,7 ppb. Residu aminosiklopiraklor dalam pot tanah di bawah mulsa
berkisar di bawah batas kuantitatif yaitu 0,63 ppb. Hasil tersebut menunjukkan
bahwa aminosiklopiraklor dari serpihan kayu dapat larut ke dalam tanah sehingga
menyebabkan keracunan tanaman. Hasil ini menunjukkan bahwa pohon-pohon
yang rusak akibat aminosiklopiraklor tidak dapat digunakan untuk mulsa atau
sebagai bahan kompos (Patton et al., 2013).
Penggunaan herbisida yang kurang tepat jenis herbisida, dosis herbisida,
formulasi herbisida, volume semprot, ukuran butiran semprotan, dan waktu
pemakaian dapat menyebabkan tanaman nontarget menjadi teracuni. Penggnnaan
herbisida harus memperhatikan efektivitas, efisiensi dan keamanan serta efek
samping yang mungkin timbul. Herbisida yang dibutuhkan adalah herbisida yang
mempunyai selektivitas tinggi. Menurut Klingman et al., (1982), herbisida yang
selektif adalah herbisida yang hanya mematikan gulma dan tidak mematikan
8
1.4 Kerangka Pemikiran
Kualitas bibit kelapa sawit di lapang sangat ditentukan oleh proses pembibitan
kelapa sawit yang salah satunya ditentukan oleh pemeliharaan tanaman.
Pemeliharaan tanaman sangat menentukan pertumbuhan dan perkembangan bibit
kelapa sawit. Masalah yang sering dihadapi selama proses pembibitan, tanaman
belum menghasilkan serta tanaman menghasilkan kelapa sawit yaitu keberadaan
gulma. Gulma merupakan tumbuhan yang keberadaan tidak diinginkan oleh
petani dan mengurangi kualitas hasil produksi tanaman kelapa sawit.
Keberadaan gulma di pertanaman kelapa sawit menimbulkan masalah, karena
gulma memiliki potensi untuk menjadi pesaing tanaman dalam memperoleh
sarana tumbuh yang diperlukan dan menurunkan kualitas bibit. Pengelolaan
gulma yang kurang baik akan mengakibatkan pertumbuhan dan perkembangan
TBM kelapa sawit menjadi terhambat. Dengan demikian diperlukan tindakan
pengendalian gulma yang tepat sehingga tidak meracuni tanaman dan menurunkan
hasil produksi tanaman kelapa sawit.
Pengendalian gulma dapat dilakukan dengan beberapa cara, salah satunya adalah
dengan cara kimiawi yaitu menggunakan herbisida yang dianggap efektif untuk
mengendalikan gulma. Pemilihan herbisida yang tepat dan cocok digunakan pada
tanaman kelapa sawit belum menghasilkan (TBM) menjadi sangat penting.
Tanaman kelapa sawit sensitif terhadap penggunaan herbisida. Herbisida yang
tidak tepat dapat berpengaruh negatif terhadap pertumbuhan dan perkembangan
9
Herbisida merupakan bahan kimia yang dapat menghentikan pertumbuhan gulma
dan tidak menghambat pertumbuhan tanaman budidaya. Aplikasi herbisida akan
mempengaruhi satu atau lebih proses fisiologis di dalam jaringan gulma sehingga
menimbulkan gejala keracunan. Pengendalian gulma menggunakan herbisida
memiliki efek samping terjadinya keracunan tanaman kelapa sawit belum
menghasilkan.
Penggunaan herbisida pada tanaman muda yang rentan akan herbisida sehingga
pertumbuhan bibit kelapa sawit mengalami abnormalitas. Penggunaan herbisida
harus memperhatikan selektivitas herbisida tersebut supaya tidak menyebabkan
bibit kelapa sawit teracuni akibat aplikasi herbisida. MAT28 240 SL merupakan
herbisida baru berbahan aktif aminosiklopiraklor yang saat ini sedang dalam tahap
pengujian oleh PT. DuPont Crop Protection.
Aminosiklopiraklor merupakan herbisida kelas asam karboksilat pirimidin yang
cepat diserap oleh daun dan akar dan translokasi ke daerah meristematik tanaman.
Herbisida ini meniru kerja hormon auksin dengan mengganggu keseimbangan
hormon tanaman yang diperlukan untuk pertumbuhan dan perkembangan akar.
Gejala keracunan tanaman akibat herbisida aminosiklopiraklor diantaranya
terjadinya penumpukan daun muda pada batang, daun tidak membuka sempurna,
dan pertumbuhan tanaman kelapa sawit kerdil.
Aminosiklopiraklor memiliki kemampuan mengendalikan gulma berdaun lebar
dan selektif terhadap gulma rumput. Pengujian tingkat keracunan herbisida
aminosiklopiraklor terhadap tanaman kelapa sawit belum menghasilkan sangat
10
efikasi herbisida terhadap keberadaan gulma, dan dosis yang efektif untuk
mengendalikan gulma di pertanaman kelapa sawit namun tidak meracuni tanaman
kelapa sawit.
1.5 Hipotesis
Dari kerangka pemikiran yang telah dikemukakan, maka disusun hipotesis sebagai
berikut:
1. Penggunaan herbisida aminosiklopiraklor menimbulkan gejala keracunan
pada kelapa sawit belum menghasilkan.
2. Penggunaan beberapa taraf dosis herbisida aminosiklopiraklor mempengaruhi
tingkat keparahan keracunan herbisida aminosiklopiraklor pada kelapa sawit
belum menghasilkan.
3. Penggunaan herbisida aminosiklopiraklor mempengaruhi pertumbuhan
tanaman pada kelapa sawit belum menghasilkan.
4. Penggunaan herbisida aminosiklopiraklor mengendalikan gulma pada
II. TINJAUAN PUSTAKA
2.1 Tanaman Kelapa Sawit
Bibit kelapa sawit pertama kali masuk ke Indonesia tahun 1848 yang berasal dari
Mauritus dan Amsterdam sebanyak empat tanaman yang kemudian ditanam di
Kebun Raya Bogor dan selanjutnya disebarkan ke Deli Sumatera Utara.
Perkebunan kelapa sawit pertama dibangun di Tanahitam, Hulu Sumatera
Utara oleh Schad (Jerman) pada tahun 1911 (Lubis, 2008). Adapun taksonomi
kelapa sawit adalah:
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Angiospermae
Sub kelas : Monocotyledoneae
Ordo : Spadiciflorae
Keluarga : Palmaceae
Sub keluarga : Cocoideae
Genus : Elaeis
12
2.1.1 Morfologi Kelapa Sawit
2.1.1.1 Akar
Calon akar muncul dari biji kelapa sawit yang dikecambahkan disebut radikula,
panjangnya dapat mencapai 15 cm, dan mampu bertahan sampai 6 bulan. Akar
primer yang tumbuh dari pangkal batang (bole) ribuan jumlahnya, diameternya
berkisar antara 8 dan 10 mm, panjangnya dapat mencapai 18 cm. Akar sekunder
tumbuh dari akar primer, diameternya 2 – 4 mm. Dari akar sekunder tumbuh akar
tersier berdiameter 0,7 – 1,5 mm dan panjangnya dapat mencapai 15 cm (Lubis,
2008).
2.1.1.2 Batang
Batang kelapa sawit tumbuh tegak lurus (phototropi) dibungkus oleh
pangkal pelepah daun (frond base). Batang ini berbentuk silindris berdiameter
0,5 m pada tanaman dewasa, tidak memiliki kambium, dan umumnya tidak
bercabang. Pada ujung batang terdapat titik tumbuh membentuk daun-daun dan
memanjangkan batang dengan bagian bawah umumnya berukuran lebih besar
(Lubis, 2008).
2.1.1.3 Daun
Produksi pelepah pada tanaman selama setahun dapat mencapai 20 – 30 pelepah,
kemudian berkurang menjadi 18 hingga 25 pelepah tergantung umur tanaman.
Panjang pelepah daun dapat mencapai panjang 9 m, panjang pelepah dipengaruhi
13
pelepah sebanyak 40 hingga 50 buah yang diisi oleh anak daun di kiri dan kanan
tulang daun yang utama atau disebut rachis. Jumlah anak daun tiap pelepah dapat
mencapai jumlah 125 hingga 200 dengan bobot pelepah mencapai 4,5 kg bobot
kering (Lubis, 2008).
2.1.1.4 Bunga
Tanaman kelapa sawit mulai berbunga pada umur 12 – 14 bulan, tetapi baru
ekonomis untuk dipanen pada umur 2,5 tahun (Lubis, 2008). Bunga kelapa sawit
merupakan monoecious, bunga jantan dan bunga betina dalam satu pohon.
Satu inflor dibentuk dari ketiak setiap daun setelah diferensiasi dari pucuk batang.
Jenis kelamin jantan atau betina ditentukan selama 9 bulan setelah inisiasi dalam
selang 24 bulan baru inflor bunga berkembang sempurna. Bunga-bunga betina
dalam satu inflor membuka dalam tiga hari dan siap dibuahi selama 3 – 4 hari.
Sedangkan bunga yang berasal dari inflor jantan melepaskan serbuk sarinya dalam
lima hari. Penyerbukan yang umum terjadi biasanya penyerbukan silang namun
kadang juga sendiri (Mangoensoekardjo dan Semangun, 2008).
2.1.1.5 Buah
Buah kelapa sawit adalah buah batu yang sessile drup yaitu menempel
dan menggerombol pada tandan buah. Jumlah per tandan dapat mencapai 1600,
berbentuk lonjong membulat. Panjang buah 2 – 3 cm, beratnya 30 gram.
Bagian-bagian buah terdiri atas eksokarp atau kulit buah dan mesokrap atau sabut dan biji.
14
cangkang, dan inti atau kernel. Sedangkan inti tersebut terdiri atas endosperma
dan embrio (Mangoensoekardjo dan Semangun, 2008).
2.1.2 Tipe Kelapa Sawit
Kelapa sawit memiliki banyak jenis, berdasarkan ketebalan cangkangnya kelapa
sawit dibedakan menjadi Dura, Pisifera dan Tenera. Dura merupakan sawit yang
buahnya memiliki cangkang tebal sehingga dianggap dapat memperpendek umur
mesin pengolah namun biasanya tandan buahnya besar-besar dan kandungan
minyak berkisar 18%. Pisifera buahnya tidak memiliki cangkang namun bunga
betinanya steril sehingga sangat jarang menghasilkan buah. Tenera adalah
persilangan antara induk Dura dan Pisifera. Jenis ini dianggap bibit unggul sebab
melengkapi kekurangan masing-masing induk dengan sifat cangkang buah tipis
namun bunga betinanya tetap fertil. Beberapa tenera unggul persentase daging
per buahnya dapat mencapai 90% dan kandungan minyak pertandannya dapat
mencapai 28% (Kiswanto et al., 2008).
Menurut PANECO (2010), pembagian tipe kelapa sawit didasarkan pada warna
buah (kulit, eksocarp) dan ketebalan cangkang. Berdasarkan warna buah, tipe
kelapa sawit dibedakan sebagai berikut:
1. Nigrescens: buah muda berwarna ungu kehitam-hitaman, sedangkan buah
masak jingga kehitam-hitaman.
2. Virescens: buah muda berwarna hijau, sedangkan buah masak jingga
kemerahan, tetapi ujung buah tetap hijau.
3. Albescens: buah muda berwarna keputih-putihan, sedangkan buah masak
15
2.2 Syarat Tumbuh Kelapa Sawit
Lama penyinaran matahari yang baik untuk kelapa sawit antara 5 – 7 jam/hari.
Tanaman ini memerlukan curah hujan tahunan 1.500 – 4.000 mm dengan
temperatur optimal 24 – 28oC. Ketinggian tempat yang ideal untuk sawit antara
1 – 500 m dpl (di atas permukaan laut). Kelembaban optimum yang ideal untuk
tanaman sawit sekitar 80 – 90% dan kecepatan angin 5 – 6 km/jam untuk
membantu proses penyerbukan. Kelapa sawit dapat tumbuh pada jenis tanah
podzolik, latosol, hidromorfik kelabu, alluvial atau regosol, tanah gambut saprik,
dataran pantai dan muara sungai. Tingkat keasaman (pH) yang optimum untuk
sawit adalah 5,0 – 5,5. Kelapa sawit menghendaki tanah yang gembur, subur,
datar, berdrainase (beririgasi) baik dan memiliki lapisan solum cukup dalam (80
cm) tanpa lapisan padas. Kemiringan lahan pertanaman kelapa sawit sebaiknya
tidak lebih dari 15o (Kiswanto et al., 2008).
2.3 Pembibitan Kelapa Sawit
Pembibitan kelapa sawit dapat dilakukan dengan satu atau dua tahap kegiatan.
Pembibitan pertama yaitu kecambah kelapa sawit langsung ditanam di polibag
besar atau langsung di pembibitan utama (main nursery). Pembibitan kedua yaitu
penanaman kecambah dilakukan di pembibitan awal (prenursery) terlebih dahulu
menggunakan polibag kecil serta naungan, kemudian dipindahkan ke main
nursery ketika berumur 3 – 4 bulan menggunakan polibag yang lebih besar.
Pembibitan awal lebih banyak digunakan dan memiliki keuntungan yang lebih
besar dibandingkan dengan pembibitan utama. Jika menggunakan pembibitan dua
16
naungan. Keuntungan lainnya, penyiraman menjadi mudah, jadwal pemupukan
menjadi mudah, dan bibit terhindar dari penyinaran matahari secara langsung
sehingga risiko kematian tanaman menjadi kecil (Dalimunthe, 2009).
2.4 Pengendalian Gulma Pada Kelapa Sawit
Menurut Pahan (2008), kehadiran gulma di perkebunan kelapa sawit dapat
menurunkan produksi akibat bersaing dalam pengambilan air, hara, sinar
matahari, dan ruang hidup. Gulma juga dapat menurunkan mutu produksi akibat
terkontaminasi oleh bagian gulma, mengganggu pertumbuhan tanaman, menjadi
inang bagi hama, mengganggu tata guna air, dan meningkatkan biaya
pemeliharaan. Untuk mengurangi segala bentuk kerugian adanya gulma maka
dengan demikian diperlukan tindakan pengendalian gulma.
Selanjutnya Hakim (2007) menambahkan bahwa kelapa sawit mempunyai
masalah gulma yang tinggi sebab salah satu faktornya adalah jarak tanam tanaman
ini lebih lebar, sehingga penutupan tanah oleh kanopi lambat membuat cahaya
matahari masuk mencapai permukaan tanah yang kaya dengan potensi gulma.
Dengan demikian tujuan pengendalian gulma adalah mengurangi jumlah populasi
gulma sampai ambang batas yang tidak merugikan bagi pertumbuhan tanaman
budidaya.
Keuntungan pengendalian gulma secara kimia dibandingkan manual adalah
pekerjaan lebih cepat dan menggunakan tenaga kerja lebih sedikit, kerusakan pada
akar tanaman akibat pengendalian secara manual dapat dihindari, erosi tanah
17
Kelemahan pengendalian secara kimia adalah biaya pengendalian sangat
dipengaruhi oleh biaya herbisida, dibutuhkan tenaga kerja yang terampil,
berkurangnya lapangan pekerjaan, dan adanya kemungkinan tanaman pokok
teracuni (Madkar et al., 1986).
Komposisi gulma pada suatu perkebunan tergantung pada jenis komoditas, cara
pengelolaan kebun dan kondisi lingkungan. Gulma yang biasa terdapat di
perkebunan kelapa sawit yang belum menghasilkan yaitu Chromolaena odorata
(L.), Imperata cylindrica (L.) Beauv., Axonophus compressus (SW.) P.B.,
Echinochloa colonum (I.) LK., Panicum repens L., Scleria sumatrensis Retz.,
Kyllingia monocephala Rottb., Mikania micrantha H.B.K., Ageratum conyzoides
I., Lantana camara L., Mimosa invisa Mart. Ex colla., dan Ottochloa nodosa
(Kunth) Dandy (Lubis, 2008).
2.5 Panen
Tanaman kelapa sawit mulai berbuah setelah 2,5 tahun dan masak 5,5 bulan
setelah penyerbukan. Kelapa sawit dapat dipanen jika tanaman telah berumur 31
bulan, sedikitnya 60% buah telah matang panen dari 5 pohon terdapat 1 tandan
buah matang panen. Ciri tandan matang panen adalah sedikitnya ada 5 buah yang
lepas/jatuh (brondolan) dari tandan yang beratnya kurang dari 10 kg atau
sedikitnya ada 10 buah yang lepas dari tandan yang beratnya 10 kg atau lebih.
Selain itu, ada kriteria lain tandan buah yang dapat dipanen apabila tanaman
berumur kurang dari 10 tahun, jumlah brondolan yang jatuh kurang lebih 10 butir,
18
15 – 20 butir. Waktu panen yang tepat akan diperoleh kandungan minyak
maksimal, tetapi pemanenan buah kelewat matang akan meningkatkan asam
lemak bebas (ALB), sehingga dapat merugikan karena sebagian kandungan
minyaknya akan berubah menjadi ALB dan menurunkan mutu minyak.
Sebaliknya pemanenan buah yang masih mentah akan menurunkan kandungan
minyak, walaupun nilai ALB rendah. Cara pemanenan tandan buah yang matang
dipotong sedekat mungkin dengan pangkalnya, maksimal 2 cm. Tandan buah
yang telah dipanen diletakkan teratur di piringan dan brondolan dikumpulkan
terpisah dari tandan. Kemudian tandan buah atau TBS (tandan buah segar) dan
brondolan tersebut dikumpulkan di tempat pengumpulan hasil (TPH). TBS hasil
panenan harus segera diangkut ke pabrik untuk diolah lebih lanjut. Pada buah
yang tidak segera diolah, maka kandungan ALB akan semakin meningkat. Untuk
menghindari hal tersebut, maksimal 8 jam TBS setelah dipanen harus segera
diolah (Kiswanto et al., 2008).
2.6 Fitotoksisitas
Kerusakan tanaman akibat aplikasi pestisida untuk tanaman dikenal sebagai
fitotoksisitas. Fitotoksisitas biasanya muncul dalam beberapa bentuk, adapun 5
jenis kerusakan yang paling sering terjadi yaitu:
1. Terbakar, jenis kerusakan mungkin muncul di ujung daun seperti bintik-bintik
atau seluruh permukaan daun dapat terlihat seperti terbakar.
2. Nekrosis (kematian jaringan tanaman), mirip dengan terbakar dan
19
3. Klorosis (menguning atau efek pemutihan), mungkin muncul sebagai
bintik-bintik, ujung menguning, atau sebagai klorosis diseluruh daun.
4. Distorsi daun, mungkin muncul sebagai curling, kerutan, atau cupping daun.
5. Pengerdilan atau pertumbuhan abnormal lainnya.
Fitotoksisitas sangat umum menghasilkan kombinasi dari dua atau lebih dari lima
gejala tersebut di atas. Efek fitotoksisitas dapat diamati pada tanaman selama
pertumbuhan atau dapat diekspresikan pada saat panen. Gejala keracunan dapat
mempengaruhi seluruh tanaman atau bagian dari akar, tunas, daun, bunga, buah,
dan bagian tanaman lainnya (Ornamentals Northwest Archives, 1981).
Fitotoksisitas merupakan suatu sifat yang menunjukkan potensi pestisida untuk
menimbulkan efek keracunan pada tanaman yang ditandai dengan pertumbuhan
abnormal setelah aplikasi pestisida. Pestisida yang sebaiknya digunakan adalah
dengan fitotoksisitas rendah. Keracunan tanaman (fitotoksisitas) mengacu pada
penyerapan bahan kimia berbahaya ke dalam struktur penting dari jaringan
tanaman, seperti akar atau sistem reproduksi. Salah satu gejala fitotoksisitas
adalah terhambatnya pertumbuhan. Gejala keracunan tanaman kelapa sawit
akibat herbisida yaitu klorosis, kerdil, kelainan tumbuh, dan jaringan mati atau
kering. Penggunaan satu herbisida dapat menyebabkan satu atau lebih gejala
keracunan pada tanaman (Riadi, 2011).
Adapun percobaan yang dirancang untuk menentukan fitotoksisitas tiga herbisida
preemergen (herbisida oksadiason, oxyflourfen + oryzalin, dan oxyfluorfen +
pendimetalin) diterapkan pada 1, 2, atau 4 kali direkomendasikan tarif empat jenis
20
11 atau 21 ml l-1 langsung ke dedaunan dari 10 spesies pohon sawit. Dua
herbisida preemergen (oxyfluorfen + oryzalin dan pendimethalin + oxyfluorfen)
menunjukkan fitotoksisitas pada daun yang baru muncul dari semua spesies sawit
bila diterapkan pada tingkat yang direkomendasikan. Herbisida oksadiazon
toleran terhadap glifosat meskipun pengerdilan dan deformasi pada daun baru,
hampir semua pohon tumbuh dari gejala ini setelah beberapa minggu (Donselman
dan Broschat, 1981).
2.7 Herbisida
Menurut Wudianto (2006), herbisida adalah senyawa beracun yang dimanfaatkan
untuk membunuh atau mengendalikan gulma. Herbisida ini dapat mempengaruhi
satu atau lebih proses seperti proses pembelahan sel, perkembangan jaringan,
pembentukan klorofil, fotosintesis, dan sebagainya yang sangat diperlukan
tumbuhan untuk mempertahankan kelangsungan hidupnya. Herbisida yang
diaplikasikan dengan dosis tinggi akan mematikan seluruh bagian tumbuhan dan
sebaliknya pada dosis rendah, herbisida akan membunuh tumbuhan dan tidak
merusak tumbuhan lainnya.
Menurut Moenandir (1993), dasar pengklasifikasian herbisida berdasarkan cara
kerja, penggunaan, cara aplikasi, struktur kimiawi, formulasi, dan selektivitas.
Berdasarkan cara kerja, herbisida dikategorikan sebagai herbisida kontak dan
sistemik. Herbisida kontak dikenal karena mengakibatkan efek bakar yang
langsung dapat dilihat terutama pada dosis tinggi, seperti asam sulfat 70%, besi
sulfat 30%, dan tembaga sulfat 40%. Herbisida kontak merusak bagian tumbuhan
21
herbisida sistemik dapat ditranslokasikan ke seluruh tubuh tumbuhan sehingga
pengaruhnya luas, jenis herbisida yang termasuk golongan ini diantaranya amitrol,
arsen, golongan triazin, substitusi urea, urasil, amida, karbamat, 2,4-D, dicamba,
dan picloram.
Menurut tipe gulma yang dikendalikan herbisida dibagi menjadi dua kelompok,
yaitu herbisida selektif dan herbisida nonselektif. Herbisida selektif adalah
herbisida yang bila diaplikasikan dalam suatu komunitas campuran akan
mematikan tumbuhan atau gulma tertentu dan relatif tidak mengganggu tumbuhan
lain, sedangkan herbisida nonselektif mematikan seluruh tumbuhan (Crafts dan
Robbins, 1973).
Penggunaan herbisida harus memperhatikan efektivitas, efisiensi, dan keamanan
serta efek samping yang mungkin timbul. Herbisida yang dibutuhkan adalah
herbisida yang mempunyai selektivitas tinggi. Menurut Klingman et al. (1982),
herbisida yang selektif adalah herbisida yang hanya mematikan gulma dan tidak
mematikan tanaman pokok. Faktor-faktor yang mempengaruhi efektivitas
herbisida adalah herbisida itu sendiri (formulasi, kalkulasi, aplikasi, dan
kalibrasi); gulma sasaran; tanah (kelembaban, keremahan, sifat fisik tanah); cuaca
(suhu, cahaya, hujan); dan pelarut (kejernihan).
2.7.1 Herbisida Aminosiklopiraklor
Aminosiklopiraklor adalah herbisida asam karboksilat pirimidin yang secara
struktural mirip dengan aminopiralid. Satu perbedaan struktural antara
22
klorin pada posisi 2 karbon sedangkan aminosiklopiraklor memiliki kelompok
siklopropil. Selain itu, aminosiklopiraklor didasarkan pada cincin pirimidin (dua
atom nitrogen dalam struktur cincin) dan aminopiralid didasarkan pada cincin
piridin (satu atom nitrogen dalam struktur cincin) (Durkin, 2012).
DPX-MAT28 (MAT28) adalah herbisida berbahan aktif aminosiklopiraklor yang
sedang dalam tahap pengujian oleh PT. DuPont Crop Protection. MAT28 dengan
cepat diserap oleh daun dan akar dan translokasi ke daerah meristematik tanaman.
Aminosiklopiraklor aktif pada kebanyakan spesies gulma berdaun lebar.
Herbisida ini menghentikan pertumbuhan tanaman dengan mengganggu
keseimbangan hormon yang diperlukan untuk perkembangan akar.
Aminosiklopiraklor merupakan famili dari asam karboksilat pirimidin yang
memiliki berat molekul 213, 62 g mol-1 dengan rumus molekul C8H8ClN3O2.
Nama kimia 6-amino-5-kloro-2-cyclopropyl-4-pyrimidine carboxylic acid dengan
struktur kimia seperti pada Gambar 1.
Gambar 1. Rumus bangun aminosiklopiraklor (Finkelstein et al., 2008).
Adapun hasil penelitian mengenai residu herbisida aminosiklopiraklor pada
konsentrasi rendah dapat menyebabkan fitotoksisitas pada tanaman seperti alfalfa,
kapas, kedelai, dan bunga matahari walaupun sudah 1 tahun herbisida tersebut
23
diperkirakan menyebabkan 25% fitotoksisitas untuk alfalfa, kapas, kedelai, dan
bunga matahari sebesar 5,4; 3,2; 2,0; dan 6,2, masing-masing penyerapan
aminosiklopiraklor yaitu 20 sampai 60 kali lebih besar dari batas deteksi (LOD)
metode analisis yang tersedia untuk analisis tanah (Strachan et al., 2011). Dengan
demikian, konsentrasi rendah aminosiklopiraklor di dalam tanah yang bertahan
dalam waktu yang cukup lama akan menyebabkan fitotoksisitas tanaman
nontarget.
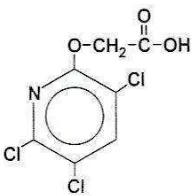
2.7.2 Herbisida Aminopiralid
Aminopiralid adalah herbisida auksin sintetis dari famili asam karboksilat bahan
aktif piridin yang memiliki berat molekul 207,026 g mol-1 dengan rumus molekul
C6H4Cl2N2O2. Nama kimia aminopiralid adalah
4-amino-3,6-dichloropyridine-2-carboxylic acid dengan struktur kimia seperti Gambar 2. Herbisida ini bersifat
sistemik dan diaplikasikan pascatumbuh sehingga mempengaruhi proses
pertumbuhan tanaman. Aminopiralid menyebabkan gejala keracunan tanaman
seperti batang melengkung dan memutar, daun berkerut, daun sempit dengan
jaringan kalus, dan akar membesar (Dow AgroSciences, 2008).
Gambar 2. Rumus bangun aminopiralid (Dow AgroScience, 2008).
Setelah diserap, herbisida aminopiralid bergerak secara sistemik ke seluruh
24
yang tidak merata dalam pembelahan dan pertumbuhan. Aminopiralid mengikat
pada reseptor normal yang digunakan oleh hormon pertumbuhan alami tanaman,
sehingga rentan terjadi kematian spesies tanaman. Dengan demikian herbisida
aminopiralid dengan cepat diserap oleh daun dan akar tanaman. Aminopiralid
tidak beracun untuk burung, ikan, lebah madu, cacing tanah, dan invertebrata air.
Aminopiralid sedikit beracun untuk tiram timur, ganggang, dan vaskular air
tanaman. Herbisida aminopiralid berada di dalam tanah berkisar antara 32 – 533
hari, dengan rata-rata lamanya waktu yaitu 103 hari. Herbisida ini larut dalam air
dan memiliki mobilitas tinggi dengan kemampuan mencemari tanah dan air.
Aminopiralid adalah herbisida yang stabil dalam air tetapi akan memecah dengan
cepat apabila di bawah sinar matahari dengan perkiraan waktu 0,6 hari (Dow
AgroSciences, 2011).
Adapun penelitian yang dilakukan di Kanada untuk mengetahui perbedaan dalam
penyerapan, translokasi, atau metabolisme aktivitas biologis aminopiralid dan
clopiralid pada daun tanaman rossete. Translokasi clopiralid (39%) dari daun
secara signifikan lebih tinggi daripada aminopiralid (17%) dalam 192 jam setelah
perlakuan (Hour After Treatment). Translokasi clopiralid ke atas jaringan (27%)
dan akar (12%), sedangkan translokasi aminopiralid ke atas jaringan (10%) dan
akar (7%) dalam 192 jam setelah perlakuan (HAT). Hasil ini menunjukkan bahwa
struktur kimia aminopiralid mungkin menyediakan aktivitas biologis yang lebih
besar daripada clopiralid, sehingga penyerapan aminopiralid pada daun tanaman
25
2.7.3 Herbisida Triklopir
Triklopir adalah herbisida sistemik selektif untuk gulma berdaun lebar. Triklopir
mengendalikan gulma target dengan meniru hormon auksin (indole acetic acid)
tanaman sehingga menyebabkan pertumbuhan tanaman tidak terkendali. Jenis
herbisida ini membunuh gulma target ketika diberikan pada dosis yang efektif
sehingga menyebabkan pertumbuhan tanaman tidak terkendali dan tidak
terorganisir yang mengarah ke kematian tanaman. Triklopir memiliki berat
molekul 256,46 g mol-1 dan rumus molekul C7H4Cl3NO3. Nama kimia
[(3,5,6-trichloro-2-pyridinyl)oxy] acetic acid dengan struktur kimia seperti pada
Gambar 3. Gejala khas triklopir yaitu epinasti, tangkai batang memutar dan
membungkuk, batang bengkak, serta daun mengeriting (Antunes et al., 2004).
Konsentrasi rendah triklopir dapat merangsang RNA, DNA, dan sintesis protein
menyebabkan pembelahan sel yang tidak terkendali dan pertumbuhan, dan,
akhirnya kerusakan jaringan pembuluh darah. Sebaliknya, konsentrasi tinggi
triklopir dapat menghambat pembelahan sel dan pertumbuhan (Tu et al., 2003).
26
2.7.4 Herbisida Glifosat
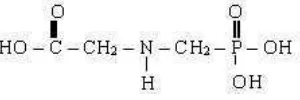
Herbisida glifosat merupakan golongan herbisida pascatumbuh yang bersifat
nonselektif dan bersifat sistemik yaitu herbisida ditranslokasikan dari tempat
terjadinya kontak pertama dengan tumbuhan ke bagian tubuh lainnya. Translokasi
herbisida glifosat dalam tumbuhan berlangsung secara simplastik yaitu melalui
jaringan hidup dengan pembuluh utama floem bersamaan dengan hasil fotosintesis
(Ross dan Lembi, 1985). Herbisida ini bergerak sejalan dengan arah translokasi
hasil fotosintat dan transpor dipicu adanya perbedaan nilai potensial osmotik
dalam floem antara source dan sink (Ashton dan Crafts, 1981).
Glifosat diformulasikan sebagai garam isopropilamina glifosat yang diaplikasikan
sebagai herbisida pascatumbuh. Glifosat memiliki nama kimia
N-(phosponomethyl) glycine dengan rumus molekul C3H8NO5P. Glifosat dapat
mempengaruhi pigmen sampai terjadi klorotik, pertumbuhan terhenti, dan
tumbuhan dapat mati. Herbisida ini juga menghambat lintasan biosintetik asam
amino aromatik (Triharso, 1994). Rumus bangun glifosat terlihat pada Gambar 4.
Gambar 4. Rumus bangun glifosat (Ashton dan Crafts, 1981).
Herbisida glifosat diserap melalui daun dan diangkut ke dalam semua jaringan
tumbuh. Pengaruh penyemprotan akan terlihat setelah 2 – 4 hari pada gulma
27
menghambat aktivitas enzim 5-enolpyruvylshikimic sintase asam-3-fosfat (EPSP),
yang diperlukan untuk pembentukan asam amino aromatik yaitu tirosin, triptofan,
dan fenilalanin (Miller et al., 2010).
Glifosat menghambat pemanjangan akar kecambah, karena masuknya herbisida
glifosat ke dalam tubuh tumbuhan melalui akar menghambat pertumbuhan
terutama pemanjangan akar dan mencegah pertumbuhan akar lateral (Moenandir,
1993).
Menurut Ashton dan Crafts (1981), glifosat di dalam tanah dianggap
nonfitotoksisitas atau tidak meracuni tanaman karena senyawa herbisida tersebut
terikat kuat pada partikel tanah. Pencucian herbisida glifosat oleh air hujan dalam
selang waktu 2 jam setelah aplikasi, tidak mengurangi efektivitas daya bunuh
herbisida (Girsang, 2005).
Menurut Sukman dan Yakup (1995), glifosat termasuk ke dalam golongan
herbisida sistemik yang jika diberikan pada pertumbuhan kemudian diserap oleh
jaringan daun lalu ditranslokasikan ke seluruh bagian tumbuhan seperti titik
tumbuh, akar, dan rimpang maka tumbuhan tersebut akan mengalami kematian
total.
Menurut Sastroutomo (1992), glifosat merupakan herbisida sistemik tidak selektif
termasuk golongan organofosforus yang merupakan turunan asam amino glisin.
Senyawa ini diserap melalui daun dan diangkut ke semua jaringan tumbuhan dan
28
saat pertumbuhan daun aktif sehingga dapat menyerap bahan aktif yang
ditranslokasikan ke seluruh bagian tumbuhan.
Herbisida glifosat selain menanggulangi gulma, juga memperbaiki sifat fisik dan
kimia tanah. Penggunaan herbisida isopropilamina glifosat dapat meningkatkan
laju permeabilitas, ketersediaan P dan KTK (Kapasitas Tukar Kation) tanah
(Lamid et al., 1996). Budidaya tanpa olah tanah dengan aplikasi herbisida
glifosat, ketersediaan N dan C organik serta mikroba tanah meningkat (Niswati et
al., 1995).
2.7.5 Herbisida 2,4-D
2,4-D adalah herbisida selektif yang cara kerjanya meniru hormon auksin
pertumbuhan (indole acetid acid), yang menyebabkan pertumbuhan tidak
terkendali dan akhirnya terjadi kematian tanaman rentan herbisida. Herbisida ini
memiliki rumus molekul C8H6Cl2O3, berat molekul 221,04 g mol-1, nama kimia
(2,4-dichlorophenoxy) acetic acid dengan struktur kimia seperti Gambar 5
(Tomlin, 2003).
Gambar 5. Rumus bangun 2,4-D (Tomlin, 2003).
Konsentrasi rendah 2,4-D dapat merangsang RNA, DNA, dan sintesis protein
menyebabkan pembelahan sel yang tidak terkendali dan akhirnya kerusakan
jaringan tumbuhan. Sebaliknya, konsentrasi tinggi 2,4-D dapat menghambat
pembelahan sel dan pertumbuhan (Tu et al., 2003). Gejala keracunan tanaman C l
C l
29
yang ditimbulkan oleh herbisida 2,4-D antara lain yaitu terjadinya epinasti,
terbentuknya jaringan tumor, batang melengkung dan mudah patah, serta daun
menggulung (Sriyani, 2013).
Menurut Moenandir (1990), herbisida dengan bahan aktif 2,4-D akan
menghambat pertumbuhan gulma dengan mempercepat respirasi, menyebabkan
adanya bahan aktif dapat mempercepat kematian gulma. Cara kerja herbisida
dengan mengganggu keseimbangan produksi bahan-bahan kimia yang diperlukan
tumbuhan. Penambahan konsentrasi herbisida mampu mempercepat proses
kematian gulma.
Zat pengatur tumbuh (ZPT) dari golongan auksin dapat meningkatkan daya
kecambah beberapa jenis tanaman. Salah satu senyawa yang tergolong auksin
adalah ZPT 2,4-D. Senyawa tersebut pada konsentrasi rendah dapat mendorong
pembelahan sel, mendorong pertumbuhan tanaman, dan meningkatkan daya
kecambah benih. Pengaruh Konsentrasi ZPT 2,4-D 0,72 ppm (part per million)
menghasilkan presentase benih berkecambah dan kecepatan benih berkecambah
tertinggi, serta jumlah akar terbanyak sedangkan konsentrasi ZPT 2,4-D 1,20 ppm
menghasilkan pertambahan tinggi terbanyak, panjang akar terpanjang, berat
basah, dan berat kering tanaman tertinggi (Podesta et al., 2008).
Hasil dari penelitian penggunaan herbisida tunggal ametrin (dosis 3 l ha-1), 2,4-D
(dosis 3 l ha-1) serta herbisida campuran 2,4-D + ametrin (dosis 2 l ha-1 + 3 l ha-1)
apabila diaplikasikan 1 kali maupun 2 kali lebih efektif mengendalikan gulma dan
mampu meningkatkan pertumbuhan tanaman tebu vegetatif tanaman tebu jika
III. BAHAN DAN METODE
3.1 Tempat dan Waktu Penelitian
Penelitian ini merupakan penelitian tahap ke-2 (lanjutan) yang dilaksanakan di
Kelurahan Rajabasa, Bandar Lampung dan Laboratorium Ilmu Tanaman Fakultas
Pertanian Universitas Lampung dari bulan Oktober 2013 – Januari 2014. Tahap
pertama telah dilaksanakan pada bulan Februari – Mei 2013.
3.2 Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian adalah tanaman kelapa sawit belum
menghasilkan berumur 16 bulan (tinggi + 140 cm), DPX-MAT28 adalah herbisida
berbahan aktif aminosiklopiraklor yang ditemukan oleh PT. DuPont Crop
Protection, kombinasi herbisida berbahan aktif aminopiralid+triklopir
(Garlon-Mix 480 EW), herbisida berbahan aktif glifosat (Round Up 486 SL), herbisida
berbahan aktif 2,4-D (Lindomin 865 SL) serta air sebagai pelarut herbisida.
Alat-alat yang digunakan pada penelitian ini adalah knapsack sprayer dengan
nosel berwarna kuning, klorofilmeter, gelas ukur, rubber bulb, ember plastik,
timbangan analitik, oven, pengaduk, meteran, cangkul, sabit, kuadran
(50 cm x 50 cm), patok bambu, amplop kertas, kantong plastik, alat tulis, dan alat
31
3.3 Metode Penelitian
Penelitian disusun menggunakan Rancangan Kelompok Teracak Sempurna
(RKTS) dengan 9 perlakuan dan 4 ulangan. Herbisida yang diuji adalah herbisida
aminosiklopiraklor, dan sebagai pembanding digunakan herbisida glifosat,
aminopiralid+triklopir, serta 2,4-D. Masing-masing perlakuan diterapkan pada
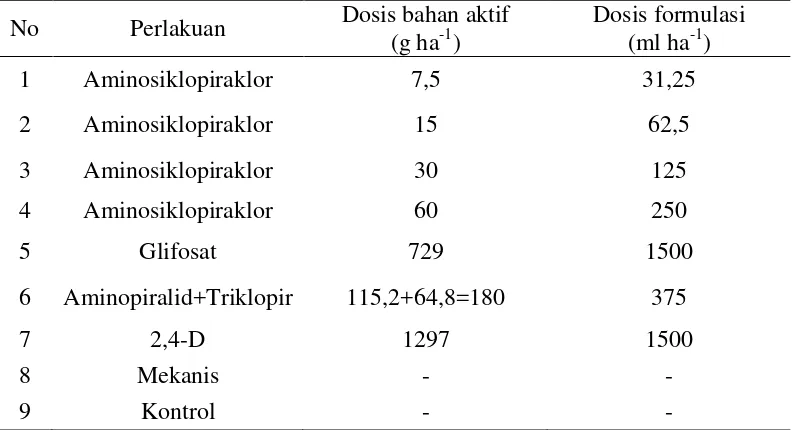
satuan unit percobaan. Susunan perlakuan tertera pada Tabel 1.
Tabel 1. Perlakuan Herbisida
No Perlakuan Dosis bahan aktif (g ha-1)
Dosis formulasi (ml ha-1)
1 Aminosiklopiraklor 7,5 31,25
2 Aminosiklopiraklor 15 62,5
3 Aminosiklopiraklor 30 125
4 Aminosiklopiraklor 60 250
5 Glifosat 729 1500
6 Aminopiralid+Triklopir 115,2+64,8=180 375
7 2,4-D 1297 1500
8 Mekanis - -
9 Kontrol - -
Seluruh data yang diperoleh dianalisis dengan menggunakan ANARA.
Homogenitas data diuji dengan Uji Bartllet dan aditivitas data diuji dengan
Uji Tukey. Sedangkan untuk uji perbedaan nilai tengah perlakuan digunakan uji
32
3.4 Pelaksanaan Penelitian
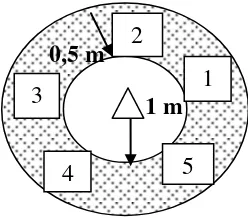
3.4.1 Penentuan Petak Percobaan
Penentuan petak percobaan dilakukan dengan memberi nomor perlakuan pada
patok bambu dengan menggunakan cat. Setiap satuan unit percobaan terdiri dari
satu tanaman kelapa sawit belum menghasilkan dengan rata-rata tinggi + 140 cm
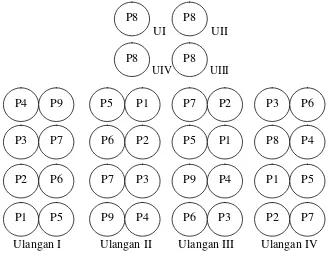
dengan jarak antartanaman 2 m x 2 m. Gambar 1 merupakan skema tata letak
percobaan.
UI UII
UIV UIII
Ulangan I Ulangan II Ulangan III Ulangan IV
Keterangan:
P1 : Aminosiklopiraklor 7,5 g ha-1 P2 : Aminosiklopiraklor 15 g ha-1 P3 : Aminosiklopiraklor 30 g ha-1 P4 : Aminosiklopiraklor 60 g ha-1 P5 : Glifosat 729 g ha-1
P6 : Aminopiralid+Triklopir 115,2+64,8=180 g ha-1 P7 : 2,4-D 1297g ha-1
P8 : Mekanis P9 : Kontrol