KAPAS TRANSGENIK KE KAPAS BUKAN TRANSGENIK
MENGGUNAKAN REAKSI RANTAl POLIMERASE
oleh
MARHAMAH NADIR
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Terima Kasih yaa Allah
...
Atas N i h a t dan Kesempatan yang Kau berikan kepada hambamu
Semoga
seperdk ilmuMU yang Kau berikanBisa bermanfaat bagi Kehidupn Makhluk-MU Ijinkan Aku, mengemban amanah-MU
Sebuah Karya kecil, yang kupersembahkan Kepada orangsrang terkasih
"
yang memberiku Cinta, Spirit dan Kasih Sayang Selama ini : Bapakku Drs. H.M. Nadir Aris clan Ibuku Hj. Nurhandi Dachlan, BA
Serta Adik-adikku terbnta: Mardhiyah Nadir, ST Maryam Nadir, SE Rasyidah Nadir, Amd.Ak
ABSTRAK
MARHAMAH NADIR (99646). Deteksi Penyebaran Gen crylAc dari Kapas Transgenik ke Kapas Bukan Transgenik Menggunakan Reaksi Rantai Polmerase. Dibimbing OLEH MM ANDREAS SANTOSA sebagai ketua komisi dan HAJRlAL ASWIDINNOOR sebagai anggota komisi.
PenelMan menggunakan biji 'kapas bukan transgenik yaitu Deltapine dan Kanesia 7 yang diambil dari lokasi penelitian kapas transgenik sebagai sampel dan biji kapas transgenik bdigard sebagai kontrol positif. Sampel diambil secara acak dengan jarak 2
-
16 meter dad tanaman kapas transgenik. Penelitian lapangan dan pengambilan sampel dilakukan pada bulan September-
Oktober 2001 dilokasi penelitian kapas transgenik di desa Caddika kecamatan Bajeng Kab.
Gowa
.
S-tan. desain pertanaman. persjepan lahan. penanaman danpemeliharaan
Wak dilakukan untuk'peneli ini. Analiis Mdekukr dUalafkansejak Nwembet 2001
-
Agustus 2002. Tujuan penelitian (1) untuk mencari teknikisorcrsi
DNA kapas dari Uji (2) mendeteksi terjadinya penyebaran gen ctyUW dari kapas bansgenikke
kapas bukan bansgenik Delbepine dan Kanesia 7 yang ditanam pada lokasi yangsama
clan
(3) membandikan produk PCR kapas tran~genik dengan kapas bukan transgenik jib terjadi perpindahan gen.Hasil - i n diperoleh teknik isdasi DNA total genom dengan menggunakan
metode
isdasi bii kering tanpa penggerusan dengan menggunakan bufer ekstraksi CTAB dan proitenase-K. Pumkasi dilakukan dengan menggunakan buferDAS
IP dan ekstraksi W o r m lsoamil (24:l) diimbah fenol5%. lsolasi DNA dengan metode ini dapat dilakukan dengan cepat dan memungkinkan d i i h DNA dalam jurnlah yang cukup untuk analisis molekuler menggunakan wksi rantai polimerase (Po/ymmse Chain ReadionlPCR). Kuantitas DNAtotal
yang diperdeh 1.58 pg per biji kapas dengan nilai absorbansi
-
1.82.Deteksi penyebaraan gen crylAc dengan menggunakan teknik PCR menggunakan primer spesifik crylAc dengan &en 5' CTGCTCAGCGAGTTCGTGCC 3' untuk Wwanl dan 5' GGTCTCCACCAGTGAATCCTGG 3' untuk mverse. Hasil ampfifikasi PCR dengan menggunakan kontrd positif dad tanaman
kapas
Bollgard menunjukkan
bahwa
sekuencry
sebesar 1400 bp. Selanjutnya dilakukan analisis PCR pada49
biji kapas bukan transgenik(20
biji Deltapine dan 20 biii Kanesia 7). Hasil PCR menunjukkan bahwadad
20 sampel kapas Deltapine y8ng diinalisis tidak terdapat pita yangsama
dengan kapas Bdlgard. Sedanglcan amplffikasi PCR pada 20 biji kapas Kanesia 7 didapatkan 1 biji yang mempunyai pita sama pada kontrol positif. Dengan demikian dapat dipastikan bahwa terjadi perpindahan gen dad tanaman kapas Bollgard ke Kanesia 7 yang ctitanam pada jarak antara 2-
16 meter. lndikasi biomultiplikasi sekuencry
karena penyebaran gen dari Kapas Bdlgard ke Kanesia 7 diukur dengan alat densitometer menggunakan Soffwarr!Quantity
One @o Rad). Produk akhir PCR pada kapas Bdlgard adalah 2.37 p@pL dan di kapas Kanesia 7 yangpositif
adalah 2.65pglpL.Dari
hasil tersebut menunjukkan tidak terjadi biimultiptikasi sekuencry pada
kapas Kanesia 7 yang diuji. Dari penelitian dapat disimpulkan:(l) diperoleh teknik Lsdasi DNA biji kering dengan perendaman pada buffer ekstraksi, (2) Sekuen genSURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam tesis
saya yang be rjudul
:DETEKSI PENYEBARAN GEN CrylAc DARl KAPAS TRANSGENIK KE KAPAS BUKAN TRANSGENIK MENGGUNAKAN REAKSI RANTAl POLIMERASE
Merupakan gagasan atau hasil penelitian tesis saya sendiri dengan pembimbingan
kornisi pembimbing, kecuali yang dengan jelas ditunjukkan rujukannya. Tesis ini
belum pernah diajukan untuk memperoleh gelar pada program sejenis di Perguruan
Tinggi lain.
Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat
diperiksa kebenarannya.
Bogor,
30
Oktober
2002
DETEKSI PENYEBARAN GEN crylAc DARl
KAPAS TRANSGENIK KE KAPAS BUKAN TRANSGENIK
MENGGUNAKAN REAKSf RANTAl POLIMERASE
MARHAMAH NADIR
99646
1
BIOTEKNOLOGI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains
pada
Program Studi Bioteknologi
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesb : Deteksi Penyebaran Gen CrylAc dari Kapas Transgenik Kapas Bukan Transgenik Menggunakan Reaksi Rantai Polimerase
Nama Mahasiswa : Marhamah Nadir No. Mahasiswa : 99646
Program Studi : Biiteknologi
A
Menyetujui1. Komisi Pembimbing
/
Ketua Anggota2. Ketua Program Studi
GRAM&^,
4 s ~ ~ s A ~ ~ ' bmn
Penulis dilahirkan di Parepare, Sulawesi-Selatan pada tanggal 9 Februari
1973 sebagai anak pertama dari enam bersaudara dari keluarga Drs. H. M. Nadir
Aris dan Hj. Nurhandi Dachlan, BA. Jenjang pendidikan SD di SD Negri 1 Pinrang,
SMP di Pesantren Moderen Putri IMMlM Pangkep dan SMA di SMA Negri 12
Ujungpandang Sulawesi Selatan.
Tahun 1991 diterima di Fakultas Pertanian Universitas Hasanuddin meialui
Ujian Masuk Perguruan Tinggi Negri (UMPTN) pada Program Studi Agronorni dan
.
mernperoleh gelar sarjana pertanian pada tahun 1996. Aktivitas Kemahasiswaan
dilalui sebagai Sekretaris
I SMF Pertanian dan Kehutanan Unhas (1993-1994),
Pengurus Biro Pusat FKK Mahasiswa Agronomi Indonesia (1992
-
1994). Sekretaris
Majalah Agrivisi Fak. Pertanian Unhas (1993
-
1995), Reporter SKK Identitas (1994-
1995), Sekretaris Umum Unit Pers Mahasiswa Unhas (1995 -19961, Pengurus HMI
Cabang Ujungpandang (1995-1996) dan Wakil Sekretaris UmumlSekretaris Korps
HMI Wati (KOHATI) Badan Koordinasi Mahasiswa Islam Sulawesi (1997
-
1999).
Pada tahun 1996, penulis beke rja sebagai staf
penelid
pada Proyek Kultur
Jaringan Tebu kerjasama Universitas Hasanuddin dan PT. Sumber Madu Bukad.
Sejak tahun 1997
-
1999 banyak terlibat pada LSM di SulawesiSelatan untuk
masalah sumberdaya manusia, lingkungan dan pertanian.
Tahun 1999 melanjutkan pendidikan S2 pada Program Studi Bioteknologi
Program Pascasarjana IPB dan pada tahun 2001 rnendapat beasiswa On going
Alhamdulillah. dengan segala
rasa
syukur penulis panjatkan kepada ALLAH SWT, atas segala petunjuk dan kehendaknya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis tentang Deteksi Penyebaran gen aylAC dari Kapas Transgenik ke Kapas Bukan Transgenik Menggunalcan Reaksi Rantai Po(imerase. Penelitian ini merupakan tinjauan resiko lingkungan dari penanaman kapas transgenik yang dikaji secara molekuler.Odam rnenyelesaikan
w i
ini. penulis mendapat bantuan dari berbagai pihak Untuk itu penulis menyampaikan ucapan tetima kasih kepada: 1.Bapak
DR. Ir. Dwi AndreasSantosa
sebagai ketua komisi pernbimbing danBapdr Dr. Ir. Hajrial Aswidinnoor, M.Sc., sebagai anggota komisi pernbimbing atas segala bimbingan dan arahan sejak perencanaan p e n d i n sampai p e n u h n tesis.
2.
Segenap
jajaran Direksi Indonesian Centre for Biodiversity and Biotechnology (ICBB) atas dana penelitian dan dorongan moril yang diberikan selama me-nakan penelitian.3. Bapak Ir. JK. Kristiyono selaku Pimpinan PT. Saraswanti lndo Genetech atas pinjaman fasilitas laboratoriurn dan Saudara Adinogmho Kristiawan, ST atas kerjasama yang diberikan selama kami melaksanakan penelitian.
4. Rem Indriadi, Neni Yuliawati dan k u Kusdianto, atas permhabatan selama kuliah di Program Biieknologi 99 dan dukungan m d l dan keijasarna dalam penelitian. Buat adik Misna dan Syarif di Faperta UNHAS terima kasih atas bantuamya selama penelitian dan pengambilan sampel di Sulawesi-Selatan. 5. Kepada rekakrekan Mahasiswa Pascasarjana IPB dari Sulawesi Selatan,
6. Keluarga Om Mustaldm dan Tante
limy
yang menerima kami sebagai bagian dari keluarga selama menempuh pendidikan di Bogor dan Tante Hasmy di Parepare yang banyak membantu dalam pengumsan beasiswa.A k h i i kepada semua pihak yang telah membantu baik secara mated maupun dukungan motil dalam melaksanakan pendidikan dan penelitian ini penulis rnenyampaikan terima kasih yang tak terhingga, semoga Allah SWT memberikan balasan yang setimpal.
DAFTAR IS1
Halaman DAFTAR GAMBAR
...
X DAFTAR LAM PI RAN...
xi
PENDAHULUAN...
1 Latar Belakang...
1 Tujuan Penelitian...
5 Kegunaan Penelitian...
5...
TINJAUAN PUSTAKA 7
...
miKapas 7
Tacraman Transgenik
...
10 Penyebaran GencryiAc
dari Kapas Transgenik...
12 Analisis Reaksi Rantai ?dimerase...
16B MDAN METODE
...
18 Ternpat dan Waktu Penelidan...
18...
Bahan Tanaman 18
lsdasi DNA Total r m r n
...
19 Uji ReaksiRantai
Polimerase...
22MI
Bimrdtiplikasi Sekuen crylAc...
24HASlL DAN P E M W A N
...
25 Metode lsdasi DNA Total dari Biji...
25 Penyebra gen crylAc dari Kapas Transgenik...
30Deteksi Biomultiplikasi
Sekuen
Gen cry...
37DAFTAR GAMBAR
Halaman 1. Visualisasi gel elektroforesis hasil isolasi DNA total genom dari biji
menggunakan tiga metode isolasi biji pada agarose 0,8%
...
292. Visualisasi gel elektroforesis DNA kapas setelah diamplifikasi PCR
menggunakan primer spesifik crylAc pada kontrol positip (kapas Bollgard) pada agarose 2%
...
32r
3. Visualisasi gel elektroforesis 20 DNA kapas Deltapine setelah diamplifikasi
...
PCR
menggunakan primer spesifik crylAc pada agarose 2% 334. Visualisasi gel eletroforesis kapas Deltapine yang mengalami perpindahan gen transgenik menggunakan 3 primer pada agarose 3%
...
355. Visualisasi gel elektroforesis 19 DNA kapas Kanesia 7 setelah diamplifikasi
...
DAFTAR LAMPIRAN
Halaman
uWWq!P -1 IBH -'
! a m
!Pu~lneuad
P W OOOC y ! w u a r l*
qe&aj.w rxqe w e k u w s eped y!uaSsuarl ueweuq uesrrdald wnpqas '(~ZOOZ '-owes) COOZ
-
968
c
u n w eu~eles e!unp yruntas !P% o m
I W ~ W y!uabuw waq!esen&alu ~ p e y a q unyq
z o d q
wepp B l l q g eunyel eped fw ~ ~ y p m&reA
Wlal COOZ Jwwel W P uep
W
eln! Z'PP
wwJe)req uewl sen1 OOOZ unlletJWW W!
W
! e d ~ a l u L66C un49 epedV
an! P'OC ! P @ ~ W IWWptalu 966Cpod MeWP ey uey!saJ8arlu!!p lnqasfal uaf) '1-uoy w-s uweuel WWJad
n
w~=wsu?p W ~ I W d u ~ n w1-4
JWJW-w
um.
-wp undnelu ueurwq yep leswaq B u d 'ua6 laqwns p-aq yep yaplad!p pdep ,
aturan tersebut mengacu pada protokol intemasional, bahwa sebelum organisme transgenik (hewan, tanaman dan mikmba) dilepaskan ke lingkungan harus melalui uji resiko lingkungan. Khusus untuk tanaman transgenik, uji dilakukan untuk mengetahui pengaruh gen asing yang diintroduksikan ke dalam genom tanaman. Beberapa faktor yang bisa ditimbulkan dari intoduksi gen asing tersebut adalah kernungkhan tejadinya inkompabilitas seksual, atau kemungkinan gen tersebut berpindah dari tanaman ke organisme lain, misalnya pada tanaman sekerabat dan yang tidak sekerabat, mikroba dan hewan (Dale dan Judith, 1995).
Penanaman tanaman transgehik di Indonesia
secara
besar-besaran dimulai pada tahun 2000. Monsanto Co. salah satu perwahaan multinasional Qenghasil benih tratransgenik telah menanam 465 ha kapas brrnsgenik yang mengandung gencrylAc
yang berasal dari B m l b s fhuringmsis di Sulawesi Setatan. Uji coba mulbilokasi dilaksanakan di empat daerah, yaitu Kabupaten Takalar, Bantaeng,Gowa
dan Bulukumba pada tahun 2000. Menindaklanjuti hasil uji muttibkasi,h4entei-i
Pertanian Republik Indonesia melalui SK 107/Kpts/KB.430/2/2001 mengeluarkan ijin pelepasan komersial tanaman kapas bansgenik (NuCOTN 35BBoIlgard) yang tahan tehadap Hek'cove~pa amrigera secara k m i a l pada tujuh kabupaten di SulawesCSdatan, yaitu Gowa, Takalar, Bantaeng, Bulukumba, Bone, Soppeng dan Wajo pada lahan 8.000 ha @EPTAN, 2001).sekerabat atau ke kerabat liamya, misalnya gulma belum dikaji. Kajian terhadap aspek-aspek tenebut harus dipilah-pilah karena tanaman kapas (Gossypum sp) bukan merupakan tanarnan asli Indonesia. Bila kerabat liamya tidak ada di daerah ini maka kekhawatiran akan tejadinya transfer gen ke kerabat liamya tidak mungkin te jadi (Santosa, 2001 a)
Petpindahan gen dari kapas transgenik ke kapas bukan transgenik melalui semk sari dapat tetjadi melalui angin dan serangga walaupun persentasenya sangat rendah, yaitu sekitar 2 %, meskipun demikian aspek tersebut p d u diteliti
-
sebagaisyarat
untuk pengujmn salah satu jenis kultivar sebelum diiomersialkan ke masyarakat (Dale dan Judith. 1995)Peneliian ARL kapas transgenik telah dilalarkan di Australia selama dua tahun, hasil penelitian pada lahan 8 ha menunjukkan bahwa terjadi penyebaran gen dad kapas transgenik sebesar 1.7 % pada plot uji 1 meter dan 0.08 % pada plat uji 4 meter dari 0,15% dari generasi F2 yang diuji dan pada tahun kedua ditemukan sebesar 0.4 % pada plot uji 1 meter dan 0.03% masingmasing pada plot uji 1 meter dan 4 meter dari areal penyangga ( b m r mws) (Liewellyn dan F i i ,1996).
Pmtokol uji analisis lingkungan yang berfaku di suatu wihyah m a - b e d a tergantung agmMirnatologi dan ekosistem wilayah yang akan ditanami tanaman transgenik. Kajiin yang telah dilaksanakan di daerah sub tropis yang kondisi iMim jauh berbeda belum bisa dijadikan ntjukan untuk
pelepasan
tanaman bansgenik di daerah bopis. Mengingat Indonesia merupakan salah satu pusat mega-biodiveersity dunia, maka uji terhadap komponen-komponen tanah. tanaman dan serangga perlu dilakukan lebih teliti.mudah dan akurat jika dibandingkan dengan metode lain misalnya dengan menggunakan pelacak radioaktif ataupun hibridisasi (Brown, 1993).
Analisis PCR membutuhkan DNA yang mumi dan cukup untuk diam~~fikasi. Beberapa teknik isolasi DNA telah diketahui untuk mendapatkan DNA total genom dengan menggunakan jaringan daun. Seiring dengan perkembangan teknik isolasi DNA dari biji, maka dilakukan penelitian untuk mengisolasi DNA total dari biji kapas.
Pengembangan metode isolasi dan purSfikasi DNA dari biji sangat penting untuk mencari gen yang telah diintroduksikan pada tanaman transgenik dan untuk kebutuhan analis biji dalam jumlah besar. Beberapa penelithn isdasi dan purifikasi DNA dari biji yang telah berhasil pada tanaman biji kering seperti gandum, padi, keddai, jagung, sorgum. badey den beberapa biji tanaman sereal lainnya d i i e n a l k a n oleh Chunwongse et a/., (1 993).
Keberhasilan isolasi DNA biji pada tanaman berbiji menjadi acuan untuk melakukan isolasi DNA dari biji kapas. Dengan melakukan beberaps modifikasi dari metode isolasi DNA biji yang telah dikembangkan oleh Chunwongse et a/., (1993) dan Kang et a/., (1998) maka diharapkan dipemleh DNA dari biji dalam jurnlah dan kualiis yang cukup untuk keperluan analisis PCR. Kebemasiian isolasi DNA dari biji sangat bermanfaat untuk rnendeteksi kemumian biji/benih dengan cepat melalui analisis PCR. Dengan demikian deteksi gen transgenik dan kernumian biji dapat dilakukan tanpa melalui perkecambahan biji. sehingga dapat mempercepat proses skrening biji yang diduga mengandung gen transgenik.
yang h a ~ s rnembayar denda kepada perusahaan penghasil benih (Monsanto Co.) karena benih kanola yang ditanam di debt lahan petani transgenik menyerbuk silang sehingga sewaktu dideteksi mengandung gen ketahanan temadap herbisida. Kasus pencemaran genetik tersebut menyebabkan Percy Schmeiser seorang petani di Saskatchewan Kanada haws rnembayar denda kepada perusahaan pemilik benih transgenik karena petani dianggap melanggar paten karena memakai benih transgenik tanpa kin (Fox, 2001).
-- Kapas transgenik yang dikenal dengan nama dagang kapas Bdlgard, - direkayasa secara genetik dengan menggunakan vektuf dari Agmbacten'um hrmefaciem. Melalui veldof tersebut d i i s f e r gen
cryiAc
ke genom tanaman Kapas Coker 31 2 dan Deltapine @P5690), dengan bantuan plasmid biner. Dengan bantuan plasmid binertersebut
kapas Bollgard membawa sekuen gencryiAc,
nplll dan gen aad (Bao, 2001)Tujuan Penelitian
1. Mendapatkan teknik isdasi DNA genm total kapas dad biji.
2. Mendeteksi penyebaran gen crylAc dari tanaman kapas tranenik (ward)ke tanaman kapas bukan transgenik (Kanesia 7 dan Deltapine) menggunakan PCR.
3. Membandiikan hasil PCR
kapas
transgenik denden l a b s brl&an transgenik yang mengalami perpindahan gencfylAc
unhk men$ddlisis biomultilikasi sekuen.Kegunaan Penelitian
TINJAUAN PUSTAKA
Botani Kapas
Tanaman kapas merupakan salah satu jenis tanaman setahun yang berbentuk semak. India merupakan negara yang menjadi pusat keragaman genetik tanaman kapas (botanical home). Di India masyarakat menanam tanaman ini kurang lebih 15 abad SM. C i merupakan negara yang pertama-tama menanam kapas sebagai tanarnan hias, dan setelah abad XI dilakukan penanaman
besar-
besaran di ladang dan sawah
.
Kapas diMasifikasikan pada 8 spesies utama berdasarkan jumlah kromoson hapldd. Spesies yang mempunyai 26 lawnoson haploid dimasukkan dalam kategori kapas dunia baru
(new
w r l d spesies), mempunyai ciri utama berserat panjang dan mudah dipintal. Jumlah kromoson ~ p e s b ini adalah 2n=
52, yaitu 1)Gossypium hirsutum, ciri khas spesies ini adalah kapas berukuran sedang, daun tidak bulat, ukuran bunga sedang dan berwama cream, bakal buah tefdii dari 4-5. Spesies ini paling banyak diinam di Arnerika. genom tanaman adalah AABB; 2)
Gossypum ba&adens, ~ p a k a n spesies yang mempunyai ranting dan percabangan kecil, cabang dan tangai bunga menarik. Kapas
ini
merupakantembaga. Menrpakan spesies asli Arnerika selatan dengan genom EEEE(Brown, 1938; Poehlaman, 1 977; Hasnam, 1 991 ).
Spesies kapas yang terdiri dari 13 kromoson haploid (2n
=
26). dikenal sebagai kapas dunia lama yang berserat pendek dan sulit diiintal. Spesies ini terdiri dari 1) Gossypium arborem. ciri khas spesies ini adalah daun terbelah 2-
3 dengan lebih dalam, bentuk bulat linear, bunga berwarna ungu. Kapas ini NIefUpakan spesies Asiatic dengan genom AA; 2) Gossypium nangking, dri b a s spesies ini daun tidak terbelah, bentuk bulat tapi tidak finear, bunga beiwama merah tua dan berbulu, bakal buah 3-
4 , ukuran bunga lebih besar. Kapas ini rnerupakan spesies Asiatic dengan genom BB; 3) Gossypium henbaceum, ciri khas spesies ini adalah bunga -ma abu-abu, bakal buah terdii dari 4-5, ukuran bunga lebih kedl. Kapas ini rnenlpakan spesies Asiatic dengan genom CC (Brawn, 1938; Fnyxell, 1984).Spesies diploid deh Fnyxell(1979) dibagi atas 3 kelompok geografi, yaitu : a) Kelompok Australia sebanyak 11 spesies yang tersebar dari gwun pasir di tengah Australia sampai ke pantai sebelah
barat
yang beriklii kering. b) Kelompok Amerika sebanyak 12 spesies, diantaranya 10 spesies ditemukan di kepulauan Galapangos. Beberapa spesies ini ditemukan di daerah yang beriklii agak kering sedangkan lainnya di daerah yang bermusim hujan dan kering. c) Kelompok AfmArabia, sebanyak 8 spesies tersebar di Afrika limurke
semanjung Arabia sampai Palestina. Spesies diploid merupakan kapas yang bemiat pendek dan t i a k Msa di@ntal, spesies ini digolongkan sebagai kapas dunia lama (OM W M adfigen).Spesies tetraploid yang telah dibudidayakan adahh Gossypium hinutum dan
Gossypium barbadens
(Fnyxell,
1979). G. Banbadens berasal dari Arnerika Tengah, Amerika Selatan bagin Utara danBarat
India. Pusat asal G. hinutummerupakan jenis kapas Gossypium himdurn yang mempunyai 52 kromoson (2n) yang terdiri dari 13 pasang kromoson besar dan 13 pasang kromoson kecil (Poehlman, 1 977).
Kapas rnerupakan tanaman menyerbuk sendiri (self pdlnation) narnun penyertwkan dapat puia tejadi dengan perantaraan serangga dan angin. Bunga kapas terdiri dari 3 kelopak yang berwarna hijau dan bergerigi, korda terdiri dari 5 petal yang berwama krem ketika bunga mekar dan berwarna merah pada had berikutnya; korola biasanya gugur dua hari setelah bunga mekar. Pembungaan teijadi setelah 35
-
45 had, bunga mekar pada pagi hari dan layu padasore
hari.
Tepung sari dapat mekkat pada kepala putik dikelilingi oleh 90-100 tangkai sari,bakal
buah Wiri dari 3-
5 w n g dan setiap ruang beiisi 8-
10 bakal biji. Kepala sari mengwikan tepung sari yang besarnya 81-
143 mikron yang lengket. sehiiga tidak mudah diierbangkan angin (Hasnam, 1991)Bunga kapas akan mekar 22
-
30 hari setelah kuncup bunga (square) ukurannya idrrckira 3 mm, bunga membuka pada pagi hari dan penyerbukan biasanya terjadi beberapa jam kemudian. Pernbuahan terjadi 30 jam setelah penyerbukan. Tiap bakal bijiharus
dibuahi oleh sebutir tepung sari. bila banyak bakal biii yang t i a k dibuahi, maka buah akan gugur dalam waktu 10 hari (Hasnam, 1991).antara 100 x 30 cm
-
50 x 50 cm, tergantung kondisi tanah dan varietas yang digunakan ( A M , 1988).Kapas Bollgard me~pakan varietas dari DP5690 atau coker 31 2 yang tahan tdadap hama
Helicoverpa
annwra. Kapas ini me~pakan salah satu jenis dariGoswum hinuturn. Morfologi varietas NuCOTN 835 adalah : tinggi tanaman 73- 115 cm, batang tegak dan warna hijau muda, daun hijau dan berbulu jarang, percabangan tanaman kornpak, petal dan tepung sari tanaman bmarna krem dan buahnya berbentuk oval. Umur tanaman 130
-
150 hari dan pembungaan dimulai- -
pada wnur 4550 hari. Tanaman mulai berbunga pada umur 120 hari. Produktivitas tanaman rah-mta 2.210 kg kapas berbijilha dan produksi tertinggi mencapai 3.100 kg kapas berbijUha (DEPTAN, 2001).Tanaman Transgenik
Tanaman transgenik adalah tanaman yang memiliki gen asing yang berfungsi d m Mntegrasi dalam genomnya. Upaya perakitan tanaman transgenik melibatkan organisme lain, baik dari bakteri, tanaman dan hewan. lntegrasi gen asing kedalam genm tanaman diharapkan akan membawa sifat yang diinginkan pada tanaman target dan dapat dilakukan melalui rekayasa genetika (Aswidinnoor, 1995).
Beberapa varietas tanaman yang telah behasil dipemleh melalui rekayasa genetika antara laimjagung Bt, kapas Bt, padi pro vitamin A, jagung tahan hWiida, gandum, keddai. kentang tahan vitus dan beberapa tanaman pangan lainnya (Suwanto,
2000). Beberapa tanaman komersial yang mengandung gen ketahanan
tehadap Bacillus thunngiensis (BQ antara lain adalah kedelai, kentang. jagung, kanola dan kapas.Kapas Bdlgard metupakan tanaman kapas yang telah disisipi gen crylAc.
dari bakteri ke dalam genom tanarnan digunakan promotor CaMV (Cauliflowr mosaik w'ms/35S) yang diisolasi dari v i ~ s tanaman Cauliflower. Penggunaan pmmotor S35 dimaksudkan untuk memperoleh ekspresi yang terus menerus. Selai
gen
cry
juga terdapat gen marker yang mengandung gen antibiotik resisten (npfll), terminatornos,
promotor 35s dan gen aad (Monsanto, 2002).Target dari kristal toksin yang dihasilkan oleh kapas Bollgard adalah serangga lepidoptera lchususnya Helicowtpa armigera yang mewpakan hama pada tanaman kapas. Protein kristal dari gen crylAc diekspresikan pada jaringan daun dan bunga
...
Adanya promotor konstitutive 35s CaMV menyebabkan protein kristal . ." terekspresikan tews menews selama jaringan tanaman tersebut masih hidup (Hofte dan Whieley, 1989; Estradadan
F m , 1994).Protein luistal yang dihasilkan
deh
Bacillus thunngiensis (Bo bersifat racun apabila terhidmlisis dalam usus semngga. Toksin kristal be- dengan menganggu permeabiliis membran sel epitelum usus tengah semngga, sehiigga menyebabkan sel epitelum menggembung dan pecah. Aktivitas bioinsektisida dariBt
spesifik untuk serangga tertentu dan tidak bersifat racun pada hewan (Spear, 1987).Kelompok gen cry tersebut masih memiliki beberapa sub kelompok atau jenis gen. Kelompok cryl diketahui terdiri dari gen cry IA, IB, IC, ID, IE, IF dan cry IG. Gen cMl terdiri dari cryllA dan cryllB. Gen crylll terdiri dari jenisjenis gen crylllA, 111B. IllC dan crylllD. Demikian pula gen crylV terdiri dari cry IVA, IVB, IVC den IVD. Sub kelompok atau jenis gen yang berbeda tersebut menghasilkan toksin yang sensifrtssnya tergantung spesies serangganya (Hofte dan Whiteley, 1989; Estada dan
Ferre.
1 994; Tabashnik et a/, 1994; Tersch et al. 1994).Gen cry dari Bt ini merupakan sumber keragaman genetik baru bagi program . *
pemulian tanaman.
m g a i
tanaman transgenik yang mengandung gen cry telah dihasilkandan
menunjukkan tingkat ketahanan yang kbih baik terhadap hama yang diuji. Jenis tanaman yang blah b e m i l d i i n s f m s i dengan gencry adalah
tanaman
jagung, kapas, tembakau, tomatdan
kentang (Wilson et a/., 1994). -pa tanaman lain seperbi padi. kedelai, kakao, tebu d m tanaman kehutanan telah pula ditransfonnasii dengan gencry
di Indonesia (Loedin et a/.. 2000).Penyebaran gen cry IAc dari Kapas Transgenik
Penyebaran gen dari tanaman transgenik ke kerabat liamya tidak mungldn terjadi selama kerabat liamya tidak ada di lokasi tersebut. Kekhawatiran akan munculnya gulma yang lebih super dan sutit diatasi sulit terjadi karena ada ratusan gen yang bertanggung jawab untuk mengubah tanaman terbudidaya menjadi gulma,
sedangkan
pada tanaman transgenik hanya satu gen yang akan diubah (Suwanto,=I.
Kapas yang bukan mentpakan tanaman asli Indonesia, khususnya daerah Asia Tenggara hampir dipastikan tidak mernpunyai kembat liar di Indonesia. Kekhawaakan akan punahnya nenek moyang tanaman
ini
karena penyebaran gen cry mustahid terjadi.Namun
penyebaran gen cry ke tanaman lain yang sejenis bisa tesjadi, jika tanarnan dapat mervyerbuk silang dengan bantuan angin ataum g g a
dan dinam pada lokasi yang sama (Santosa, 2001a).Peneliian tentang dampak dari Penyebaran gen
(gene
Abw) tanarnan m g e r t i k dapat dibagi pada tiga tahap, yaitu 1) Pembagian group tanaman dalam 3 kebmpok berdasar kemungkinan serbuk silang, yaitu :i. Gnwp I : tanaman dengan kemungkinan minimal adanya gene flow ke tanaman, yaitu kelornpok tanaman yang monocecrs atau benrrnah satu. yang penywbukannya rnembutuhkan bantuan manusia atau vektor lain seperti sermgga dan hewan besar lainnya.
T. Gnwp I1
:
tanaman dengan probabilitas rendah untuk gene flow dengan kompabilitas seksualitas rendah, misalnya tanaman yang rnenyerbuk sendiri dan waktu penyerbukan sangat singkat setelah bunga mekar dan mesa vigor sertwk sari yang terbatas, misalnya tanaman kapas, kelapa sawit dan tanaman yang menyerbuk sendiri.dengan jumlah serbuk sari yang banyak dan dibantu dengan perantaraan angin. Kelompok tanaman ini adalah tanaman yang menyerbuk silang seperti jagung, kanola, wortel, sorgum dan tomat (National Research Centre, 2000;
Hartiko, 2001).
Tejadinya penyebaran gen crylAc ke tanaman kapas lokal yang gunakan sebagai tanaman penyangga pada areal pertanaman yang sama mungkin tejadi. Potensi tanaman kapas yang dominan menyerbuk sendiri dengan kemungkinan penwukan silang yang sangat kedl, yaitu sekitar 2% masih memungkinkan tejadinya serbuk silang, apalagi dalam hasan dan populasi yang besar (Dale dan Judii, 1995)
Penyebaran gen dad tanaman transgenik dari lokasi dapat teQadi melalui organ vegetatif dan generatif seperti him,biji, atau serbuk silang seibuk sari melalui bantuan angin atau vektor lainnya seperti serangga. Kemampuan gen transgenik untuk berpindah melalui mekanisme serbuk silang mungkin tejadi. Secara umum penyebaran gen melalui organ generatif sulit terjadi, melihat dari ukuran biji kapas yang besar dan diselubungi oleh serabut kapas yang keras dan tertutup oleh bol, sehingga penyebaran melalui biji tanpa adanya bantuan vektor pada lokasi plot uji ke lokasi lain sangat suli tefjadi (Umbeck eta/., 1991).
Serbuk silang tanaman kapas melalui serbuk sari sangat minim karena serbuk sari melekat dan besar untuk diierbangkan deh angin. Bentuk morfdogi tangkai sari (stigma) dan waktu penyerbukan yang singkat menyebabkan tanaman ini lebih dominan meny-uk sendiri. Walaupun bunga kapas berukuran besar dan menarik serangga, tetapi lebih banyak bunga tersebut dihasilkan dari penyerbukan sendiri. Penyerbukan s i h g pada beberapa negara di USA tetjadi dengan bantuan
-
serangga, seperti lebah. Beberapa faktor lain yang mempengawhi penyerbukansetempat. Perkiraan ratarata tejadinya penyerbukan silang dan kemungkinan terjadinya penyebaran gen cry dari serbuk sari dapat digunakan sebagai pembanding apakah lokasi tersebut sesuai untuk tanaman tersebut (Liewellyn dan Fii, 1 996).
Hasil penelitian di Cina melaporkan bahwa terjadi penyebaran gen transgenik dari kapas sampai jarak 6 meter dari tanaman penyangga, bahkan penyebaran gen tersebut teridentifikasi sampai jarak 36 meter dad plot kapas transgenik Jenis kapas transgenik yang diuji adalah GK-12 yang mengandung gen
cry dan gen
maricer npnl serta kapas bukan transgenik CCRC 12 dan Xinmian 13 yang ditanam diieiilingnya dengan luas 6x 6
meter
(Shen. Yuzhang dan Yin, 2001).Modifikasi genetik yang disebabkan oleh penyerbukan silang maupun relcayasa genetik dari tanaman ke spesies lain berpotensi menyebabkan paUbahan dan kemampuan organisme yang dimasuki. Walaupun rekayasa genetik hanya rnemindahkan sebagian keal sekuen DNA ke dalam genorn tanaman, namun dapat menyebabkan terjadinya perubahan fenotipe dan dapat menyebabkan timbulnya organisme baru yang berbeda (Wdfenbarger dan Phiier, 2000).
bagi lingkungan dan kesehatan, tapi aturan tersebut h a ~ s ada untuk memberikan kesempatan pada konsumen untuk memilih produk yang mengandung transgenik atau produk pertanian organik
(National
Research Council. 2000).Hasil Penelitian Monsanto yang dilaporkan oleh Tim Sahfy BolgaR Assessment yang dikeluarkan pada Desember 2001 melapodcan bahwa protein
cry
yang terdapat pada serbuk sari t a n a m transgenik berada pada kisaran konsentrasi yang terbatas, yaitu sebesar 11.5 pg/g dari berat bersih serbuk sari. Setelah dilakukan proses pengolahan maka jumlah protein tersebut akan semakin berkwang sehingga tidak d i i u k a n lagi pada biji kapas yang telah diproses memjadi minyak mumi, kain ataupun untuk pakan ternak (Monsanto, 2001)Analibis Reaksi Rantai Polimerase
Teknik PCR adalah teknik ampliikasi DNA yang spesifik dengan cara melakukan pemanjangan rantai nuldeotida dari primer yang merupakan pasangan komplemen dari utas DNA secara simultan (Glick dan Pastemak, 1994). Teknik PCR diiemukan oleh
Kary
Mullis pada tahun 1983.PCR mempakan suatu teknik sangat akurat dan sensitif yang dapat diaplikasikan dalam m ibidang seperti biilogi molekuler, diagnostik, genetika populasi dan analisis forensik Tehik DNA rekombinan blah rnernberikan pembahan yang
r e v o i u s i i r
dalamilmu
genetika karena memungkinkan dilakukan isolasi dan karalderisasi g e m , rnempehjari fungsi d m ekspresi secara rind selama proses perkembangan tersebutdan
sebagai respon terhadap faktor lingkungan (Nasir, 2001)genom (25 OC
-
65OC) dan perpanjangan (elongation) pada temperatur 72%. Perpanman primer pada enzim DNA polimerase ini dimungkinkan dengan adanya basa nuldeotida dATP, dGTP. dCTP dan dTTP. serta MgCI2 yang berfungsi sebagai kofaktor enzim yang ditambahkan ke dalam reaksi. Pengulangan siklus 25-
50 kali akan meningkatkan jumlah fragmen DNA yang diamplifikasi secara eksponensial(Weisii
et 81.. 1 995)Primer yang terdii dari 10-25 nuldeotida akan menempel pada DNA cetakan di dua tempat yang berlawanan arah. Apabila tempat menempel primer yang satu dengan yang lain berada pada jarak yang dapat diamplifikasi, maka diperoleh satu atau lebih fragmen DNA hasil a m p l i k i . Semakin panjang u k m primer yang digunakm maka makin spesifik pita yang terbentuk (Brown, 1993).
PCR menrpakan bagian penting dalam mendeteksi adanya transgen pada DNA genom yaitu untuk melacak adanya gen cry yang berpindah dari tanaman transgenik ke tanaman bukan transgenik. Ampliikasi dilakukan terhadap baa* bagin spesifik dari konstruksi DNA rekombinan. Bagian spesifik yang terampliikasi adatah sekuen cry dan promotor S35 CaMV, sekuen gen penyandi antibiotik resisten npnl (neomycin transferaselkanamisin) dan promotor TRI dan sekuen gen aad (Gerbard dan SmaHa, 1999).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian lapangan dan pengambilan sampel dilaksanakan di lokasi Penelitian Kapas Transgenik di Desa Caddika Kecamatan Bajeng Kabupaten Gowa Sulawesi-Selatan. Denah lokasi pengambilan sample disajikan pada lampiran 1, Penelitian dilaksanakan sejak Septemberi
-
Oktober 2001. Wnipenel-itian lapang, persiapan, penanaman dan pemeliharaan dari tanaman yang dianalisis dan dilaporkan dalam peneliian ini tidak diiesain khusus untuk
penelitian
ini. Materi tanaman dan petak percobaan adalah percobaan yang didesain untuk p e n e l i n Uji Muttilokasi oleh Tim Uji Muttilokasi Kapas Tmsgeni k.Analisis Molekuler dilaksanakan di Laboratorium Bioteknologi Molekuler PT. Saraswanti lndo Genetech berlangsung sejak November 2001 sampai Agustus 2002.
Bahan Tanaman
Bahan tanarnan yang digunakan adalah biji kapas yang terdiri dari kapas : A. Kanesia 7, merupakan kapas Wl yang dihasilkan oleh pemulia di Balai Peneiiian Kapas Malang, kapas
ini
telah lama dibudidayakan oleh petani dibeberapa
daerah di Sulawesi Selatan. Jenis kapasini
tahan tehadapC. Deltapine, adalah varietas yang diintroduksi dari Afrika, kapas ini menpakan isogenik Kapas Bollgard yang telah disisipi oleh gen cry. Karakter agronomis, morfologi dan fisidogi sama dengan Kapas Bollgard.
Sampel biji diperoleh dari plot percobaan seluas 0.6 ha dan diambil dari jarak terdekat 2 meter dan tetjauh 16 meter. Biji diambil dari plot uji dengan jarak tanam 100 x 25
an
dan jarak tanam 100 x 15 cm. Biji diambil muW dari tanaman ketiga dari masing-masing sisi plot dan dikornpositkan. Biji yang dianalisa adelah biji kapas bukan transgenik (Kanesia 7 dan Deltapine), sedangkan biji tanaman tmnsgenik digunakan sebagai kontrol positif.Analisis PCR dilaloukan pada 40 biji kapas bukan transgenik (20 Oeltapine dan 20 Kanesia 7) yang diambil
secara
acak dari plot seluas 10x 15
m yang berdampingan antara kapas transgenik dan bukan transgenik.lsolasi DNA Total Genom
Metode lsolasi yang digunakan pads penelidan ini adalah :
1. Metode CTAB Moditikasi
Biji digenrs dengan mortal, ditimbang 200 pg dan dimasukkan dalam tabung mikro 1,5 ml, ditambahkan 500
CJ
bufer ekstraksi CTAB (1 g CTAB, Tris HCI pH 8 0.6057 g. 4.099 g NaCI, 0,3722 g EDTA dalam 50 mlH&).
S-yadisentrifugasi selama 5 menit pada 11 -700 g, supematan dipindah ke tabung barn
dan diendapkan dengan 350 p1 NaCl 1.2 M dan dan ditambahkan 350 pl MoroformisoamilalkohoI (CI), diinkubasi 30 detik. Tabung mikm dibolak-balik dan diserMuse 11.700 g selama 10 menit. Lamtan bagiin atas dipindahkan ke tabung baru dan ditambahkan
2/3
volume isopropanol. Selanjutnya tabung diientrifugasi pada 11.700 g selama 10 menit. Supematan dibuang dan peiet d i i h k a n etanol 500 pl. Tabung disentrifugasi kembali 12.000 g selama 10 rnenit, cairan dibuang dan pelet disimpan dalam 100 pl H20 pada pH 8.2. Metode lsolasi Biji Kering dengan penggerusan
Serabut dan kulit luar biji dibuka dan digerus bersama pasir lruarsa
dengan
menggunakan mortal. Sebanyak 200 pg sampel dimasukican dalam tabung miko 1.5 ml dan ditambahkan 350 pl bufer CTAB (200 mM Tris-HCI (pH 8), 200 mM NaCI, 25 mM EDTA, 0,5 % SDS) dan proitenase-K 50 pl. Byi yang telah diberikan lamtan bufer diinkubasi selama 1 jam pada suhu 37'C. Selanjtdnya ditambahkan 400 MI lamtan presifiisi CTAB (2% CTAB (wlv), 100 mM Tris-HCI (pH 8), 20 mM EDTA (pH 8), 1.4 M NaCI, 1%W P )
dan d i i t r a k s i kernbaii dengan menambahkan CI (24:l) yang mengandung fend 5%. Larutandisc-
pada 11.700 g pada suhu 4'C selama 10 menit. Larutan bagian atas dipindahkan ke tabung bani dan ditambahkan 2/3 volume isopropanol dan diinkubasi pada suhu niang selarna 10 rnenit untuk mengendapkan DNA. Selanjutnya disenbifugasi pada 11.700 g pada suhu 4'C selama 5 menit. Supematan dibuang dan pelet dibilas dengan etand 70 %. Peiet DNA yang diperoleh daarutkan dalam 50 pl TE.Selanjutnya b ~ t a n disentrifugasi pada kecepatan 11.700 g selam 5 menit pada suhu 4'C. Supernatan dibuang dan pelet diresuspensi dengan 50 pl TE dan 100 pl isopropanol, larutan kembali diintrifugasi selama 5 menit pada kecepatan 11.700 g pada suhu 4'C. Supernatan dibuang. Pelet DNA ditambahkan 70 pl etano! 70% d m disentrifuse selama 3 menit. Supematan dibuang d m pelet DNA diieringkan pada suhu ruang. Selanjutnya diresuspensi ke dalam 50 pl TE.
3. Metode lsolasi DNA Biji kering tanpa Penggerusan
lsdasi DNA total Mji dilakukan dengan menggunakan metode isdasi DNA biji k&ng yang dilakukran
d e h
Kang et al., (1998). Biji kapas dilepas dari serabut dan kulit keras, endosperm diimbil dan diimasukkan dalam tabung mikro 1.5 ml. Bufer ekstraksi CTAB (200 mM Tris-HCI (pH 8). 200 mM NaCI, 25 mM EDTA, 0.5 % SDS) sebanyak 400 pl ditambahkan dan setdah itu d i i h k r a n juga 10 PI Proteinase-K. Biji yang telah diberikan bufer tersebut diiikubasiselama 1 jam pada suhu 40'C. Selanjutnya dihamrkan dengan bantuan glass rod atau ujung tip. Setelah hanafr ditambahkan 400 pl larutan pengendapan CTAB (2% CTAB (wlv), 100 mM TrisHCl (pH 8), 20 mM EDTA (pH 8), 1.4 M NaCI. 1% WP) dan diikstraksi kembali dengan menambahkan CI (243) yang mengandung fend 5%. Larutan disentrSfugasi pada 11.700 g pada suhu 4'C
selama
10 menit. Larutan bagian atas dipindahkan ke tabungbarn
dan diimbahkan 2/3 volume isopropanol dan diinkubasi pada suhu ruang selama 10 menit untuk pengendapan DNA. Tabung d i i g a s i pada 11.700 g pada suhu 4'C selama 5 menit. Supematan dibuang dan w e t dicuci dengan etanol70 %. SeJanjutnya pelet DNA diresuspensi dengan 50 pI TE.Selanjutnya disenbifugasi pada kecepatan 13.000 g
selama
10 menit Larutan dibuang dan pelet DNA yang diperoleh diekstraksi denganlarutan
CI (24:l) yang mengandung fenol5%, larutan dihomogenkan dengan menggunakan vorteks dan disentrifugasi kembali pada kecepatan 13.000 g selarna 10 menit. Lamtan bagianatas dipipet dan dipindahkan ke tabung baru dan ditambahkan 100 pI bopfopand dingin untuk pengendapan. Sdanjutnya larutan disentrifugasi pada kecepatan 13.OGO g d a m 10 menit pada suhu KC. Supematan dibuang dan pelet DNA ditambahkan etanol70% sebanyak 70 pi, disentrifugasi 11.700 g selama 3 menit dan airan dibuang dan dikeringkan pada suhu ruang. Pelet DNA diresuspensi dengan 50 pl TE.
Uji Reaksi Rantai Polimerase (PCR)
Amplikasi DNA dilakukan dengan menggunahn mesin PCR Mastercycler Personal (Eppendorf). DNA hasil isolasi diuji dengan reaksi PCR dengan menggunakan satu pasang primer untuk mendeteksi s e k w ~ dari
gen
struktural yang terdapat dalam DNA total kapas -pine dan Kanesia 7. Desain
primer
yang digunakan untuk mengamplifikasi sekuen dad gen target terdiri dari susunan nukleotida dengan sekuen 5 CTGCTCAGCGAGlTCGTGCC 3' untuk k ~dan dw e m 5' GGTCTCCACCAGTGAATCCTGG 3'
.
Untuk verifikasi diiunakan primer spesifik untuk mendeteksi sekuen pmmotor, yaitu pimer 35s CaMV dengan unrtan nukkotida GCTCCTACAAATGCCATCA dan sekuen dari gen marker menggunakan primer npfll dad Tn5 dengm srrsunan nuldeotida GCATCTCCTGTCATCT.nukleotida GCTCCTACAAATGCCATCA dan sekuen dari gen marker menggunakan
primer npdl dari Tn5 dengan susunan nukleotida GCATCTCCTGTCATCT.
Komposisi reaksi amplifikasi adalah 0,12 pM
forward
dan reverse primer cry IAc, 100 ng DNA template, yang diamplifikasi dengan menggunakan PCR master7,5 pL (Roche, Germany) yang terdn dari 25 U Taq DNA polimerase, 100 mM KCI, 3 mM MgCh, dNTP 0,4 mM dan d H B
.
Volume final reaksi 15 pL ditepatkan dengan menambahkan H20 Milii. Amplikasi dilakukan dengan mengatur reaksi pada mesin PCR, kondisi reaksi dengan 42 siklus, yang terdiri dari pre denaturasi 9S°Cselama 5 menit dan denaturasi DNA dengan pemanasan 9 5 ' ~ selama 1 menit,
tahap selanjutnya pelekatan primer pada suhu 55% selama 40 detik clan
perpanjangan pada suhu 72% selama 40 detik dan tahap akhir perpanjangan 3
menit.
Kondisi PCR dengan menggunakan primer 35s adabh pre denaturasi 95% selama 3 menit dan denaturasi DNA dengan pemanasan 9 5 ' ~ selama 1 rnenit,
sebanyak 35 siklus. Tahap selanjutnya pelekatan primer pada suhu 57% selama 30
detik dan perpanjangan pada suhu 7 2 ' ~ selama 45
detik
dan tahap akhr perpanjangan 3 menit. Kondisi PCR untuk mendeteksi gen marker dengan primer npfll dari Tn5 adalah pre denatwasi 95OC selama 3 menit dan denaturasi DNAdengan pemanasan 9 5 ' ~ selama 1 menit, sebanyak 37 siklus. Tahap selanjutnya
pelekatan primer pada suhu 5 0 ' ~ selama 40 detik dan perpanjangan pada suhu
7 2 ' ~ selama 30 detik dan tahap akhir perpanjangan 3 menit.
Analisis halitatif DNA total dilakukan pada elektroforesis agarose 3%,
-
dengan tegangan 1 10 volt selama 35 menit, hasil elektrofwesis gel diamati dan
Deteksi Biomuldiplikasi Sekuen
Deteksi terhadap indikasi biomultiplikasi sekuen (biimultiplikasi biologis) atau
penggandaan sekuen target dari gen crylAc dari tanaman transgenik (kapas Bollgard) dan kapas bukan transgenik yang mengalami serbuk silang dilakukan dengan menggunakan m o d e
.
-
QuanfifafheCompetitive
(Alkami, 1999) yang telah dimodifikasi. Prosedw yang'dilakukan adalah dengan mengukur konsentrasi (pg/pl)DNA marker yam diiunakan
pada
-is. Konsentrasi marker tersebut digunakan sebagai standar pengukuran.Pengukmn dilakukan dengan mempergunakan alat densitmeter,
yang
dilanjutkan dengan pengukuran konsentrasi produk PCR (pg/pl) dari fragmen
cry.
Hasil yang diperdeh dikonversikan dengan marker standar. Hasil konversi tersebut
mmpakan nilai estimasi dari produk PCR. Prosedur ini menggunakan Soffwafe
HASlL DAN PEMBAHASAN
Metode lsolasi DNA Total dari Biji
lsolasi DNA total genom tanaman mewpakan tahap terpenting dalam analisis biologi molekuler. Faktor ini menrpakan tahap awal bagi analisis selanjutnya misalnya untuk pemotongan dengan enzim restriksi, migmsi pada elelQaforesis dan template untuk pedmnyakan pada mesin PCR. Kualitas DNA yang diukur berdasarkan keutuhan dan kemumiannya penting bagi kebutuhan analisis mdekuler. Keutuhan DNA dapat diiteksi meWui elektrofomsis, dan DNA mumi adalah DNA yang tebebs dari kontaminan berupa polisakarida, pratein dan RNA. Kontaminan pada DNA haUs dihilangkan karena akan menganggu proses sintesis clan analisis selanjutnya (Suharsono. 2000). Untuk mengukur kemumian DNA dapat digunakan spektmfotometer dan DNA dikatakan mumi jika nilai msio absorbansi pada W b a d a l a h 1.8
-
2,O (Sambrook et 81..2001).
Teknik isolasi DNA yang dicoba pada penelitian adalah mengembangkan teknik isolasi DNA biji yang sebelumnya berhasil dilakukan pada tanaman sereal dan kacang-kacangan. Urnumnya teknik isolasi yang banyak digunakan untuk menganalisa g e m tananran kapas adalah isolasi DNA total dad dam menggunakan metode isdasi CTA8 dengan menggenrs daun menggwtakan nitrogen cair atau
pasir
kuarsa. Teknik isolasi ini membutuhkan perkecambahantanaman
dan membutuhkan material yang lebih banyak. Mengingat waktu penyimpanan daun kapas yang terbatas, maka altematif untuk mengisolasi DNA dad biji m p a k a n kajin yang perlu dilakukan.melalui mesin PCR. Metode isdasi DNA menggunakan bufer CTAB yang biasa digunakan untuk mengisolasi DNA genom dari daun tidak bisa diiunakan untuk isolasi DNA dari biji. Hasil ekktroforesis pada gel agarose 0.8% (Gambar 1, sumur 1 dan 2) menunjukkan bahwa DNA biji yang diisdasi dengan metode CTAB modifikasi belum mumi karena masih mengendap pada sumur gel agarose dan pita yang dihasilkan
smear.
Pada bagian bawah gel masih banyak polisakarida dan protein. yang dapat menganggu pmses PCR..
-
Metode isdasi biji kering dengan menggews biji kapas dengan bantuan pasir Icuarsa dan tanpa pasir kuarsa d i i a untuk memperdeh DNA genom dari biji. Metode biji kering pada awalnya dikernbangkanOM
Chunwongse et%I.,
(1993) untuk isdasi biji gandum
dan
padi. Hasil penggenwan dati biji tersebut diikstraksi dengan menggunakan bufer CTAB. Metode ini b W d diperoleh DNA total dalam jumlah yang banyak, tapi DNA yang diperdeh masih belum mumi karena masih terkontaminasi oieh protein dan polisakarida (Gambar 1, sumw 4-
6). Selainitu
pita yang dihasilkansmear
dan DNA masih mengendap setelah dilarutkan dalam TE 1x di tabung mikro dan pada sumur gel agarose 0.8%.Purifikasi dilakukan untuk mengatasi kontaminan dengan melakukan ekstmksi ulang dengan bufer OAS IP yang dikembangkan okh Santosa (2001 b). Purifikasi ini memkrikan hasl yang relatif baik. namun pita DNA yang tampak setelah dilakukan eleMore&s masih menunjukkan banyaknya pdisakarida dibagian bawah dari pita-pita tersebut Kondisi ini bisa mengakibatkan proses amplikasi PCR terganggu.
CTAB, SDS dan proteinase-K dan di inkubasi selama 1 jam pada suhu 40°C. Setelah direndam biji menjadi lunak, dan biji dihancurkan dengan menggunakan ujung tip. Dengan menggunakan metode isolasi biji tanpa penggerusan, berhasil diperdeh DNA mumi dalam jumlah yang cukup untuk analisa PCR. Proses ini tidak membutuhkan waktu untuk menggerus biji menjadi tepung. Proses lisis sel berlangsung setelah dilakukan perendaman bufer ekstraksi dan pemanasan, biji kapas
yang
keras menjadi lunak setelah direndam selama 1 jam.Eksbraksi
biji dengan merendam pada bufer dan inkubasi larutan pada suhu 40°C menyebabkan dinding sel terbuka dan bufer diserap rnasuk kedalam biji. Proses ini melindungi sel-sel dari kerusakan mekanik akibat penggerusan. Ekstraksi dengan menggunakan bufer CTAB yang mengandung SDS dan pr0teinase-K yang berfungsi untuk membuka rnembran sel. Adanya EDTA dalam lamtan membantu menjaga kestabilan DNA dari enzim nuldease dan pemanasan selama 1 jam pada suhu 40 O C (Kang et a/., 1998). Bufer ekstraksi SDS mengandung konsentmsi garam yang tinggi yang berfungsi untuk menghilailgkan polisakarida pada sulit diatas pada isolasi DNA biji (Porebski, Bailey dan Gaum. 1997). Proteinase-K untuk menghilangkan protein serta penambahan pdyvinytpyrrolidone dalam bufer 2x CTAB berfungsi untuk mengikat senyawa fenol (Lodhi et a/., 1 994; Porebski et a/.. 1 997).Perhkuan rnekanik pada biji setelah pernberian bufer mempakan fakbr penting untuk keberhasilan isolasi. DNA total yang utuh, merupakan fakbr yang menunjang keberhasilan isdasi DNA total dad biji. Menurut Wdyastuti (1994) Proitenase-K sangat berperan dalam menguraikan protein yang terdapat dalam kompleks DNA sehingga isolasi DNA berhasil.
cepat dan cukup dilakukan oleh
satu
orang. Penambahan RNAse yang bisa rnenganggu dalam proses PCR t i k dibutuhkan, sehingga dapat mengumngi Maya. Puritikasi DNA dibkukan dengan menggunakan larutan DAS llz danCI
(24:l) yang mengandung fenol 5 %. Purifikasi dengan rnenggunakan metode DAS
IP
danCl
(24:l) fend 5% d i r o l e h pelet DNA yang mumi dan tidak mengandung polisakarida.Konsentrasi proteinase-K yang bekerja baik yang diperdeh dad permMan ini untuk ekstraksi bij kapas adalah 5
-
10 pg/400pL bufer. Komefhsi tembut menjadi pedornan pada isolasi DNA biji dari padi, gandum, ' badey, menthnun dan kedelai. Konsentrasi proteinase-K diatas 50 pg tidak akan rnemberikan penganrh yang lebih baik (Chunwongse et a/., 1993; Kang et a/., 1998).Hasil penelitian Kang et aL, (1998) menunjukkan bahwa kuantitas dan kualiis DNA dengan menggunakan metode isohsi biji kering lebih baik dari purifikasi DNA daun. Uji coba pada tanaman padi dengan membandingkan hasil
metode
isdasi DNA daun dan biji, didapatkan hasil DNA 1.5-
2 pg perbiiiMng,
Kuantitas DNA hasil spektrofotorneter 1.58 pg perbiji kapas dengan tingkat kemumian setelah di absorbansi pada A-
adalah 1.82. Nilai tersebut menunjukkan bahwa DNA tersebut mumi karena berada padaidsaran
1,8-
2.0.Gambar 1. Hasil Ekstraksi DNA genom total dari biji kapas, 1
-
2. Metoda CTAB;3. Marker X Hindlll; 4
-
5. Metoda biji kering gerus; 6-
7. Metode biji kering (gerus+kuarsa); 8-
9. Metode biji kering perendaman bufer yang divisualiasikan pada gel Agarose 0.8 %.
Visualisasi elektroforesis pada gel agarose 0,8% menunjukkan bahwa DNA total yang diperoleh dan' metode CTAB (sumur 1 dan 2 ) dan metode biji kering digerus (4, 5, 6 dan 7 ) dan dengan penggerusan masih belum mumi. Pita DNA yang diperoleh tidak tajam karena masih ada gangguan kontaminan baik berupa protein maupun polisakarida.
Hasil isolasi DNA tersebut dibandingkan dengan rnetode biji kering tanpa penggerusan, yaitu mengisolasi biji kering dengan perendaman pada bufer CTAB dan proteinase-K. Visualisasi dari hasil migrasi pada gel elektroforesis pada dilihat pada gambar 1, sumor 8 dan 9. Dari gel agarose 0,8% terlihat jelas, kualitas DNA yang utuh dan mumi, tanpa kontaminan dari protein dan RNA.
Penyebaran Gen crylAc dari Kapas Transgenik
Penyebaran gen dari tanaman kapas transgenik (kapas Bollgard) ke
tanaman kapas bukan transgenik (Deltapine dan Kanesia 7) melalui serbuk silang tidak dapat dihindari. Kemungkinan tanaman kapas untuk menyerbuk silang
secara alami hanya 2 %. Diketahui bahwa kapas merupakan tanaman yang disukai oleh berbagai jenis serangga. Terdapatnya berbagai jenis serangga di
areal pertanaman kapas merupakan vektor yang sangat baik dalam membantu
terjadinya serbuk silang (Permana, 2000).
Deteksi penyebaran gen dari kapas Bollgard ke tanaman kapas Deltapine
dilakukan melalui amplifikasi PCR pada 20 sampel biji tanaman yang diambil
secara acak pada jarak 2
-
16 meter dari tanaman Bollgard. Pengambilan sampelbiji dilakukan pada plot yang jaraknya 2
-
16 meter dari tanaman transgeniksecara acak merupakan rekomendasi dari hasil penelitian Liwellyn dan Fitt
(1996)
di
Australia yang mendeteksi penyebaran gen dari tanaman kapas transgenik pada jarak 1-
16 meter dari ke kapas bukan transgenik.Namun demikian pada pengambilan sampel tidak dibedakan jarak
pengambilan sehingga tidak diketahui secara pasti bahwa penyerbukan tersebut
terjadi pada jarak tertentu. Tanaman yang digunakan sebagai sampel tidak
diketahui mendapat serbuk sari dari kapas Bollgard dari jarak tertentu, tapi yang
dapat dipaparkan adalah bahwa sampel diambil dari tanaman kapas bukan
transgenik (Deltapine dan Kanesia 7) yang berada pada areal pertanaman yang
sama dengan kapas Bollgard dan diambil dari plot tanaman yang disekitarnya
Kondisi ini merupakan gambaran lokasi pertanaman secara umum dilokasi penanaman kapas transgenik milik masyarakat, karena lahan pertanaman bukan me~pakan hamparan luas yang menanam satu jenis tanaman tertentu. Dengan kondisi lahan yang tidak seragam maka rekomendasi rnanagemen pertanaman yang dikeluarkan oleh Peneliti dari Tim Safety Assessiment of Bollgad Monsanto Co. (2001) sdit diterapkan di lahan masyarakat. Kenyataan di lapangan diketahui bahwa kepemilikan khan petani yang terbatas dan lahan penanaman kapas transgenik dilakukan di lahan kebun yang berbatasan dengan pertanaman lain balk kapas transQenik ataupun kapas bukan transgenik.
Penyebaran gen di deteksi dengan menggunakan primer spesiiik crylAc pada
mesin
PCR. Teknik PCR merupakan teknik yang paling baik yang digunakan untuk mendeteksi adanya sekuen spesif~k pada DNA tanaman, skrining tanaman transgenik, pembuatan peta genetik, ldoning dan modifikasi asam amino (Mc Garvey and Kaper. 1991). Beberapa teknik lain tetah dilakukan yaitu metode ELISA dan hibridisasi. namun teknik PCR dengan menggunakan primer spesifik dari gen target (gencv)
dapat diketahui secara pasti bahwa gen yang tertransfer adalah sekuen yang rnengandung gen target. Teknik PCR diketahui secara jelas ukuran gen target yang ingin dicari, sedangkan dengan metode ELlSA dan hibridisasi, tidak dapat diketahuisecara
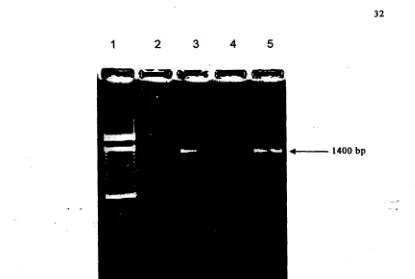
pasti ukuran dari gen target yang di dapatkan (Sambrook et all. 2001).Gambar 2. Hasil uji amplifikasi PCR dengan menggunakan primer spesifik crylAc pada gel agamse 2%. 1 .Marker 100 bp; 2-5. Kontrd positif kapas Bollgard.
Selanjutnya untuk mengetahui terjadinya penyebaran gen crylAc dari tanaman kapas transgenik (Bollgard) ke tanaman kapas bukan transgenik (Deltapine dan Kanesia f ) , dilakukan deteksi dengan menggunakan primer spesifik
cry
dengan susunan nukleotida 5' CTGCTCAGCGAGTTCGTGCC 3'untuk fovward dan reverse 5' GGTCTCCACCAGTGAATCCTGG 3'. Sekuen tanaman bukan transgenik Deitapine dan Kanesia 7 akan teramplifikasi bersama kontrd pasitif yang berasal dari kapas Bollgard.
Hasil amplikasi pada 20 biji kapas Deltapine yang dimbil secara
acak
[image:111.578.99.514.49.328.2]C
Gambar 3. Hasil amplifkasi PCR &a kapas Deltapine menggunakan primer spesifi W A C pada Agamse 3% : No. 1,20 8 21. Marker 100 bp; 2. Kontrol positif(Kapas Bollgard); 3
-
18 dan 22-
25 kapas Deltapine;lS. Kontrol negatif.Beberapa faktor yang menyebabkan tidak terjadinya penyebaran gen dari kapas BolJgard ke kapas Deltapine adalah kemungkinan biji yang dianalisa bukan biji yang menyerbuk silang. Sebab lain adalah serbuk sari kapas sudah menyerbck sendiri karena tanaman kapas memang lebih dominan menyerbuk atau karena sampel yang diuji jumlahnya sedikit, yaitu 20 biji kapas Deltapine.
Selanjutnya dilakukan amplifikasi PCR pada kapas Kanesia 7 yang merupakan kapas varietas asli Indonesia yang diproduksi oleh Balai Penelitian Tanaman Kapas Malang. Kapas Kanesia rnerupakan jenis kapas yang sebelumnya dibudidayakan oleh petani di Sulawesi Selatan. Hasil amplifikasi pada kondisi reaksi dan primer yang sama dengan kontrol positif dari kapas Bollgard menunjukkan adanya ukuran pita yang sama dengan yang terdapat pada kapas Bollgard (Gambar 4). Pola pita tersebut berukuran 1400 bp seperti yang terdapat pada kontrol positif yang berasal dari kapas Bollgard.
Amplifikasi 20 biji kapas Kanesia 7 dengan menggunakan primer spesifik
[image:112.574.77.491.90.642.2]dari kapas Bollgard. Hasil tersebut dapat dilihat pada Gambar 4. Kontrol positif kapas BoUgard seperti pada Gambar 4 (sumur 1,3 dan 7) untuk sekuen yang mernbawa gen transgenik mempunyai pola pita yang sama dengan kapas Kanesia 7. Pita yang menunjukkan te rjadinya transfer gen cry dapat dilihat pada sumuf 8 dengan panjang sekuen 1400 bp, dan untuk verifikasi sekuen cry tersebut diampliikasi bersama
sekuen
yang membawa gen transgenik, yaitu pmmdcw 35s yang menghasilkan pita pada sekuen 173 bp dangen
marker
(gen npill) menghasilkan pita sebesar 195 bp. Untuk perbandingan digunakan konttol negatif dengan rnenggunalcen H20.Terdapatnya
sekuen
cry
dari kapas Bollgad pada kapas kapas Kanesia 7 membuktikan bahwa telah terjadi penyebaran secbuksari
dari kapas transgenikke
kapas bukan transgenik yang di tanam pada areal yang sama atau berdebtan. Penyebaran serbuk sari dapat disebabkan oieh angin, sefangga ataupun d e h vektor lainnya.Untuk mencegah penyetaran gen transgenik rnaka sebelum pdepasan tanaman transgenik perlu dilakukan uji lapang tertmtas. Persyaratan uji lapang terbatas yaitu memperlakukan jarak isolasi minimun, memanen
tanaman
transgenik sebelum berbunga, menghilangkan putik sebelum sedwk
sari
masak atau mernbungkus bunga tanaman transgenik dalam kantong khusus, ataumenanam
didaerah
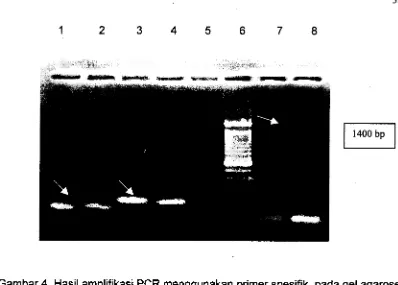
yang tidak ada tanaman sejmiiya atau daerah yang ada tanaman sejenis tetapi umumya jauh berbeda. T i a k a n tersebut ditujukan untuk mengwangi kemungkinan penyebaran serbuk sari dari tanaman transgenik ke tanaman sejenis atau kerabat liamya (Herman, 2001)Gambar 4. Hasil amplifikasi PCR menggunakan primer spesifik pada gel agarose 3%,1. Bollgard 35s;
2.
Kanesia7
35S;3. Bollgardnptll;
4.
Kanesia7
nptll; 5. Kontrol negatif;6. Marker100 bp
7.
Bollgard crylAc;8.
Kanesia7
crylAc.Visualisasi hasil amplifikasi PCR, dengan primer spesifik cry pada 19
sampel kapas Kanesia dapat dilihat pada gambar 5. Dari hasil gel elektroforesis pada agarose 3%, selama 35 menit pada 110 Volt. Hasil tersebut menunjukkan
bahwa 19 biji lainnya tidak terjadi transfer gen dari Bollgard ke Kanesia 7.
Gambar 5. Hasil amplifikasi PCR menggunakan primer spesifik crylAc gel
8 agarose 3%; I . Marker 100 bp ; 2. Kontrol positif ; 3
-
22. KapasPenyerbukan silang kapas Bollgard ke kapas Kanesia 7 yang sulit terjadi
secara
alamiah karena kapas merupakan tanaman yang menyerbuk sendiri. tetapi kemungkinan dalam skala kecil akan selalu ada. Terdapatnya pola pita sekuens gen cry yang sama pada kapas Bollgard dan kapas Kanesia 7. menwrjukkan bahwa serbuk silang terjadi dari kapas transgenik ke kapas bukan bgnsgenik yang ditanam pada areal yang berdekatan. Kapas yang bunganya menarik merupakan faktor yang menaiik bagi serangga, khususnya lebah madu.Kehadiran berbagai jenis serangga di lokasi pertanaman kapas transgenik yang dijadikan lahan pembaan dan tempat pengambitan sampel disebabkan karena lahan tersebut tidak dilakukan penyemprotan inmktisiia. Pada lahan penefitian yang dilakukan di Australia untuk melihat tejadinya perpindahan gen dari kapas transgenik ke kapas lokal, pengambilan sampel pada bhan yang disemprot dengan insektisida dan yang tidak dilakukan penyemprotan. menunjukkan bahwa pada lahan yang disemprot dengan insektisida, persentase tetjadimya transfer gen sangat rendah dibandingkan denga lahan yang tidak d'mprot. Hasil penelitian tersebut disebutkan bahwa lebah madu mrupakan veldot yang berperan sangat penting dalam membantu te jadinya serbuk silang di pertanaman kapas Austraiia (LiweUyn dan Fitt, 1996).
Terjadinya serbuk silang antara kapas Bdlgatd dan Kanesia 7, yang menyebabkan berpindahnya sekuen gen cry ke kapas Kanesb 7 bisa rnenyebabkan inaktifasi gen lain pada genom tanaman yang tersisipi oleh gen
Deteks