STUDI PSEUDOMONAS PENGHASIL ACC DEAMINASE
DALAM MENINGKATKAN PERTUMBUHAN DAN
KETAHANAN TANAMAN KEDELAI TERHADAP PENYAKIT
EDI HUSEN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi ”Studi Pseudomonas
Penghasil ACC Deaminase dalam Meningkatkan Pertumbuhan dan Ketahanan Tanaman Kedelai terhadap Penyakit” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Januari 2012
Edi Husen
ABSTRACT
EDI HUSEN. Study on Pseudomonas Producing ACC Deaminase in Increasing Growth and Survival of Soybean Against Disease. Under direction of ARIS TRI WAHYUDI, ANTONIUS SUWANTO and GIYANTO.
1-aminocyclopropane-1-carboxylate (ACC) deaminase-producing bacteria have been known to help plant growth by preventing the inhibition-effect of increase concentration of ethylene in higher plants, which is commonly triggered by high concentration of indole-3-acetic acid (IAA) and/or by the presence of plant pathogens in the vicinity of the root. The enzyme degrades ACC (precursor
of ethylene) into ammonia and α-ketobutirate as bacterial sole source of nitrogen. This study examined the potential use of Pseudomonas isolates producing ACC deaminase in increasing soybean growth and survival against pathogenic fungi
Fusarium oxysporum, Sclerotium rolfsii and Rhizoctonia solani. Eighty one isolates of IAA-producing Pseudomonas (1.13 to 20.49 µg IAA ml-1) were screened in planta for their ability to promote soybean growth in growth chamber conditions. The selected isolates were assessed in vitro for their ACC deaminase activity and compatibility with root-nodule bacteria Bradyrhizobium japonicum
BJ11 and Sinorhizobium fredii Rif5, and tested to promote soybean growth and reduce disease incidence caused by F. oxysporum, S. rolfsii and R. solani under greenhouse conditions. The results showed that 13 out of 81 isolates significantly increased soybean root length and weight, up to 50% from untreated plants. Of 13 isolates, 11 isolates were able to use ACC as their sole source of nitrogen as an indication of their ACC deaminase activities. Two isolates that did not show ACC deaminase activities had lower capacity to produce IAA (5.45 to 6,31 µg IAA ml -1
). Three out of 11 isolates inhibited at least one strain of root-nodule bacteria, thereby limiting their use for soybean. Eight selected isolates increased soybean height and fresh weight although not all were significantly different from untreated control. On the other hand, most isolates significantly increased the survival rates of soybean in soil containing pathogenic fungi. Disease suppression of the isolates caused by F. oxysporum, S. rolfsii and R. solani was 17.1, 36.4 and 64.5%, respectively. The higher the destructive effect of the pathogens as shown by S. rolfsii and R. solani treatments, the better was the ability of the isolates to reduce the disease. Further work is worth to evaluate whether or not the fertility status of the soil or a particular pathogen influence the beneficial effects of these bacteria on soybean.
Key words: ACC deaminase, Fusarium oxysporum, growth promotion, IAA,
RINGKASAN
EDI HUSEN. Studi Pseudomonas Penghasil ACC Deaminase dalam Meningkat-kan Pertumbuhan dan Ketahanan Tanaman Kedelai terhadap Penyakit. Dibimbing oleh ARIS TRI WAHYUDI, ANTONIUS SUWANTO dan GIYANTO.
Enzim 1-aminocyclopropane-1-carboxylate deaminase (ACC deaminase) (E.C.4.1.99.4) merupakan enzim yang diproduksi oleh beberapa rizobakteri untuk mendegradasi substrat ACC (prekursor hormon etilen) sebagai sumber nitrogen. Degradasi ACC secara aktif oleh rizobakteri akan mengurangi biosintesis hormon etilen. Dalam banyak kasus, biosintesis etilen yang berlebihan dalam jaringan akar akan menghambat perkembangan akar dan melemahkan ketahanan tanaman terhadap serangan penyakit. Beberapa faktor pemicu biosintesis etilen pada tanaman banyak terkait dengan cekaman (stres) akibat kondisi lingkungan yang tidak mendukung, serangan hama penyakit, dan peningkatan konsentrasi hormon asam indol asetat (indole acetic acid, IAA). Dari berbagai hasil penelitian, inokulasi bakteri penghasil ACC deaminase terbukti mampu meningkatkan pertumbuhan tanaman dengan mengoptimalkan peran IAA dalam memacu pertumbuhan tanaman dan meningkatkan daya tahan tanaman terhadap serangan patogen.
Di Indonesia, studi penggunaan rizobakteri penghasil ACC deaminase sebelum penelitian ini belum pernah dilaporkan. Pemanfaatannya pada tanaman kedelai merupakan salah satu alternatif teknologi yang menjanjikan untuk meningkatkan kualitas pertumbuhan tanaman dan mengatasi banyaknya serangan penyakit pada pertanaman kedelai. Penggunaan bakteri ini dapat mengurangi pemakaian senyawa agrokimia sintetik yang berlebihan (pupuk dan pestisida) yang berpotensi mencemari lingkungan. Tantangannya adalah terletak pada kemampuan menapis dan memilih bakteri penghasil ACC deaminase yang unggul yang dapat bekerja secara sinergis dengan bakteri bintil akar kedelai (rhizobia).
Penelitian ini bertujuan untuk mendapatkan isolat-isolat Pseudomonas
lokal penghasil enzim ACC deaminase dan mempelajari kemampuannya meningkatkan pertumbuhan dan ketahanan tanaman kedelai terhadap penyakit melalui serangkaian penelitian di laboratorium dan rumah kaca. Untuk mencapai tujuan ini dilakukan penapisan (screening) isolat secara in planta dan in vitro di laboratorium. Isolat-isolat terbaik selanjutnya diuji keefektivannya pada tanaman kedelai menggunakan tanah steril dan non-steril.
Mikroba yang digunakan mencakup isolat Pseudomonas asal rizosfer tanaman kedelai, yaitu 81 isolat penghasil IAA (1,13 – 20,49 µg IAA ml-1) dan 1 isolat bukan-penghasil IAA; cendawan patogen Rhizoctonia solani, Sclerotium rolfsii, dan Fusarium oxysporium; bakteri bintil akar Bradyrhizobium japonicum
BJ11 dan Sinorhizobium fredii Rif5. Varietas kedelai yang digunakan adalah varietas Wilis. Tanah untuk percobaan pot menggunakan tanah pertanian yang diperoleh dari areal pertanian di sekitar Leuwiliang-Jasinga, Bogor.
Hasil penapisan in planta menggunakan media steril kantong-tumbuh (growth pouch) di ruang penumbuh (growth chamber) diperoleh 13 dari 81 isolat
mendegradasi substrat ACC pada media garam minimal. Hasil yang diperoleh memperlihatkan peran fisologis bakteri penghasil ACC deaminase dalam memacu pertumbuhan tanaman kedelai tanpa terpengaruh oleh peran isolat ini yang juga mampu mensintesis hormon IAA. Dua isolat yang tidak memiliki aktivitas ACC deaminase, yaitu Pseudomonas Crb31 dan Crb86, tergolong isolat yang rendah kemampuannya menghasilkan IAA (5,45 dan 6,31 µg IAA ml-1) dibanding isolat lain.
Hasil uji kompatibilitas isolat dengan bakteri bintil akar menunjukkan bahwa 3 dari 11 isolat Pseudomonas penghasil ACC deaminase bersifat antagonis terhadap bakteri bintil akar B. japonicum Bj11 dan/atau S. fredii Rif5. Sifat antagonis ini diindikasikan oleh zona penghambatan pertumbuhan di sekeliling koloni Pseudomonas yang ditumbuhkan bersama dengan bakteri bintil akar pada media agar. Ketiga isolat ini tidak potensial digunakan untuk tanaman kedelai. Delapan isolat penghasil ACC deaminase yang tidak antagonis terhadap bakteri bintil akar, yaitu Pseudomonas Crb5, Crb12, Crb17, Crb24, Crb46, Crb47, Crb49, dan Crb56.
Inokulasi kedelai dengan masing-masing dari delapan isolat Pseudomonas
penghasil ACC deaminase sebagian mampu meningkatkan pertumbuhan tanaman kedelai (umur 14 hari) pada tanah steril dan non-steril di rumah kaca. Data tinggi dan bobot tanaman yang diinokulasi dengan isolat ini lebih tinggi dibanding tanaman yang tidak diinokulasi (kontrol). Hasil terbaik peningkatan pertumbuhan kedelai pada tanah steril ditunjukkan oleh isolat Pseudomonas Crb5, Crb24, Crb46, dan Crb 56, sedangkan pada tanah non-steril oleh isolat Crb12, Crb17, dan Crb24. Berbedanya respon tanaman kedelai pada tanah steril dan non-steril diduga terkait dengan interaksi isolat terhadap mikroba alami, baik yang bersifat positif maupun negatif terhadap isolat yang diintroduksi. Isolat Crb5, Crb46, dan Crb56 mampu meningkatkan bobot akar pada tanah steril, namun tidak berpengaruh pada tanah non-steril. Sedangkan isolat Crb12, Crb17, dan Crb47 justru efektif meningkatkan pertumbuhan kedelai pada tanah non-steril atau dengan kehadiran mikroba alami. Rendahnya tingkat kesuburan tanah yang digunakan dalam penelitian ini diduga juga berpengaruh terhadap keefektivan isolat dalam meningkatkan pertumbuhan tanaman kedelai.
© Hak cipta milik IPB, tahun 2012 Hak cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
STUDI PSEUDOMONAS PENGHASIL ACC DEAMINASE
DALAM MENINGKATKAN PERTUMBUHAN DAN
KETAHANAN TANAMAN KEDELAI TERHADAP PENYAKIT
EDI HUSEN
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Mayor Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup: Dr. Ir. Suryo Wiyono, MSc.Agr Dr. Ir. Dyah Manohara, MS
Judul Disertasi : Studi Pseudomonas Penghasil ACC Deaminase dalam Meningkatkan Pertumbuhan dan Ketahanan Tanaman Kedelai terhadap Penyakit
Nama : Edi Husen
NRP : G361070062
Disetujui
Komisi Pembimbing
Dr. Aris Tri Wahyudi, M.Si Ketua
Prof. Dr. Ir. Antonius Suwanto, M.Sc Dr. Ir. Giyanto, M.Si
Anggota Anggota
Diketahui:
Koordinator Mayor Mikrobiologi Dekan Sekolah Pascasarjana IPB
Dr. Ir. Gayuh Rahayu Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan kasih sayang-Nya, sehingga disertasi yang berjudul “Studi Pseudomonas
Penghasil ACC Deaminase dalam Meningkatkan Pertumbuhan dan Ketahanan Tanaman Kedelai terhadap Penyakit” telah berhasil diselesaikan.
Terima kasih penulis sampaikan kepada Dr. Aris Tri Wahyudi, Prof. Dr. Antonius Suwanto, dan Dr. Giyanto yang telah memberikan bimbingan dan arahan selama pelaksanaan penelitian dan penulisan disertasi. Penelitian ini terlaksana berkat dukungan dana dari proyek Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) antara Badan Litbang Pertanian dan Institut Pertanian Bogor tahun 2007-2009 dan dari Program Insentif Peningkatan Kapasitas Iptek Sistem Produksi RISTEK tahun 2010-2011 atas nama Dr. Aris Tri Wahyudi. Oleh karena itu, penulis mengucapkan banyak terima kasih. Terima kasih kepada Pimpinan dan seluruh staf Departemen Biologi, FMIPA IPB dan Laboratorium Mikrobiologi atas segala bantuan fasilitas dan penggunaan alat. Terima kasih penulis sampaikan kepada Dr. Sri Rochayati, kepala Balai Penelitian Tanah (Balittanah), Dr. Achmad Rachman (d/h kepala Balittanah), Dr. Muhrizal Sarwani, kepala Balai Besar Litbang Sumberdaya Lahan Pertanian (BBSDLP), dan Prof. Dr. Irsal Las (d/h kepala BBSDLP) atas izin sekolah dan dukungan yang diberikan. Ucapan terima kasih juga penulis sampaikan kepada Pimpinan dan seluruh staf Kelompok Peneliti Biologi dan Kesehatan Tanah dan teman-teman peneliti lingkup Balittanah yang senantiasa memberikan dukungan moril dalam penyelesaian studi.
Terima kasih kepada Dr. Dyah Manohara (Balai Penelitian Tanaman Obat dan Aromatik, Balittro, Bogor) dan Dr. Suryo Wiyono (Departemen Proteksi Tanaman, Fakultas Pertanian, IPB) atas kesediannya sebagai penguji luar komisi pada ujian tertutup dan saran perbaikan yang diberikan. Terima kasih kepada Prof. Dr. Iswandi Anas (Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, IPB) dan Dr. Pingkan Aditiawati (Sekolah Ilmu dan Teknologi Hayati, ITB, Bandung) atas kesediaannya sebagai penguji luar komisi pada ujian terbuka dan saran perbaikan yang diberikan.
Ucapan terima kasih kepada istri, Dra. Asih Hendarsih, dan ananda Mahirawan Setiadhi atas kesabaran dan dukungannya yang senantiasa diberikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Bukittinggi pada tanggal 10 September 1960, sebagai anak keempat dari Bapak Nazaruddin Chatib Basa dan Ibu Masitah. Penulis mengenal pertanian sejak menempuh pendidikan pertanian di Sekolah Pertanian Menengah Atas (SPMA) Negeri Bogor tahun 1978-1981 dan mengenal ilmu tanah setelah menempuh Pendidikan Kedinasan di Pusat Pelatihan Manajemen dan Kepemimpinan Pertanian (PPMKP) (d/h IPLPP) Ciawi, Bogor pada tahun 1981-1982. Pendidikan Sarjana Biologi diselesaikan di Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Pakuan Bogor pada tahun 1987. Pendidikan Master of Science dalam bidang Mikrobiologi Tanah diselesaikan di University of the Philippines, Los Banos (UPLB), Philippines pada tahun 2002 dan memperoleh penghargaan Gamma Sigma Delta dari UPLB. Selanjutnya, penulis melanjutkan sekolah S3 Jalur Penelitian (by Research) di Program Studi Mikrobiologi, Sekolah Pascasarjana, Institut Pertanian Bogor pada tahun 2007.
Penulis adalah staf Peneliti Mikrobiologi Tanah di Balai Penelitian Tanah, Balai Besar Litbang Sumberdaya Lahan Pertanian, Bogor. Selama menjadi mahasiswa S3, penulis telah mempresentasikan sebagian hasil penelitian disertasi pada Seminar Nasional dan Internasional, Perhimpunan Mikrobiologi Indonesia, pada tahun 2008 di Purwokerto dan pada tahun 2010 di Bogor, dengan judul
“Growth Enhancement and Disease Reduction of Soybean by ACC Deaminase-Producing Pseudomonads”. Selain melaksanakan penelitian disertasi, penulis juga aktif dalam kerja sama penelitian dengan lembaga riset nasional dan internasional, antara lain proyek REDD-ALERT (Reducing Emissions from Deforestation and Degradation through Alternative Landuses in Rainforests of the Tropics), khususnya aspek aktivitas mikroba pada gambut. Pada bulan Juli – Agustus 2011 penulis mendapat kesempatan mengikuti pelatihan soil microbiological extraction and quantification techniques, khususnya microbial community fingerprinting using PLFA analysis di Faculty of Bioscience Engineering, University of Gent, Belgia. Penulis juga aktif mempublikasikan berbagai hasil penelitian di media cetak ilmiah maupun populer. Selama masa studi S3, penulis telah mempublikasikan hasil penelitian disertasi ini pada:
1) Microbiology Indonesia, Vol. 2 (3): 107-111, 2008, Prospective use of 1-aminocyclopropane-1-carboxylate deaminase-producing bacteria for plant growth promotion and defense against biotic and abiotic stresses in peat-soil agriculture.
2) Indonesian Journal of Agricultural Science, Vol. 10 (1) 2009: 19-25, Soybean seedling root growth promotion by 1-aminocyclopropane-1-carboxylate deaminase-producing pseudomonads.
3) American Journal of Agricultural and Biological Sciences, Vol. 6 (2) 2011: 273-278, Soybean response to 1-aminocyclopropane-1-carboxylate deaminase-producing Pseudomonas under field soil conditions.
DAFTAR ISI
Halaman
DAFTAR ISI ... ... xix
DAFTAR TABEL ... ... xxi
DAFTAR GAMBAR ... ... xxiii
DAFTAR LAMPIRAN ... ... xxv
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Hipotesis ... 3
Manfaat Penelitian... 4
Temuan Baru (Novelty) ... 4
TINJAUAN PUSTAKA ... 5
Rizobakateri Pemacu Pertumbuhan Tanaman (PGPR) ... 5
Enzim ACC Diaminase dan Etilen ... 5
Bakteri Penghasil ACC Deaminase sebagai Pemacu Tumbuh Tanaman ... 6
Bakteri Penghasil ACC Deaminase sebagai Agen Hayati Pengendali Patogen ... 9
Cendawan Patogen Tular Tanah pada Kedelai ... 9
BAHAN DAN METODE ... 11
Tempat Penelitian ... 11
Bahan Penelitian... 11
Tahapan Penelitian ... 13
Penapisan in plantaPseudomonas Pemacu Tumbuh ... 15
Pengujian Aktivitas Enzim ACC Deaminase ... 18
Uji Kompatibilitas Pseudomonas dengan Rhizobia ... 19
Uji Pemacu Tumbuh di Rumah Kaca ... 20
Uji Penekanan Penyakit ... 21
HASIL DAN PEMBAHASAN ... 27
Hasil Penapisan Psedomonas Pemacu Tumbuh Tanaman Kedelai ... 27
Aktivitas ACC Deaminase ... 31
Uji Kompatibilitas Pseudomonas dengan Rhizobia ... 34
Pengaruh Pseudomonas terhadap Peningkatan Pertumbuhan Kedelai ... 36
Pengaruh Pseudomonas terhadap Penekanan Penyakit ... 37
SIMPULAN DAN SARAN ... 47
Simpulan ... 47
Saran ... 47
DAFTAR PUSTAKA ... 49
DAFTAR TABEL
Halaman
1 Isolat-isolat Pseudomonas dan kemampuannya menghasilkan IAA yang digunakan dalam penelitian ini ... 12
2 Isolat-isolat Pseudomonas pada masing-masing set percobaan ... 16 3 Aktivitas ACC-deaminase pada media garam minimal
Dworkin-Foster (DF) ditambah amonium sulfat dan ACC sebagai sumber N ... 32
4 Reaksi penghambatan (antagonis) isolat Pseudomonas terhadap bakteri bintil akar Bradyrhizobium japonicum Bj11 dan
Sinorhizobium fredii Rif5 pada media cawan agar King’s B... 35 5 Pertumbuhan kedelai (umur 14 hari setelah tanam) yang diinokulasi
dengan isolat Pseudomonas (Crb) penghasil ACC deaminase pada media tanah non-steril di rumah kaca ... 36
6 Penekanan penyakit dan bobot basah tanaman kedelai yang diinokulasi dengan isolat Pseudomonas (Crb) penghasil ACC deaminase pada tanah yang diinfestasi dengan cendawan patogen
Fusarium oxysporum (Fo) di rumah kaca ... 39
7 Penekanan penyakit dan bobot basah tanaman kedelai yang
diinokulasi dengan isolat Pseudomonas (Crb) penghasil ACC deaminase pada tanah yang diinfestasi dengan cendawan patogen
Sclerotium rolfsii (Sr) di rumah kaca... 41 8 Penekanan penyakit dan bobot basah tanaman kedelai yang
diinokulasi dengan isolat Pseudomonas (Crb) penghasil ACC deaminase pada tanah yang diinfestasi dengan cendawan patogen
Rhizoctonia solani (Rs) di rumah kaca ... 43
DAFTAR GAMBAR
Halaman
1 Biosintesis etilen pada tanaman (Diringkas dan digambar ulang dari Ose et al. 2003) ... 6 2 Skema mekanisme penurunan konsentrasi hormon etilen dalam
jaringan tanaman oleh bakteri penghasil enzim ACC deaminae untuk mencegah terbentuknya etilen berlebihan yang dapat menghambat perkembangan akar (Sumber: diadaptasi dari Glick et al. 1998) ... 8 3 Diagram alir tahapan penelitian ... 14 4 Penapisan Pseudomonas pemacu tumbuh pada media steril kantong
tumbuh. Rak kantong tumbuh (A), penempatan kantong tumbuh pada rak (B), dan penempatan kecambah kedelai pada tiap kantong tumbuh (C) ... 15 5 Biji kedelai yang sudah diinokulasi dengan isolat Pseudomonas dan
dikecambahkan pada cawan Petri (A), dan penempatan kecambah kedelai umur 2 hari pada media kantong tumbuh (B) ... 18 6 Skema penempatan pot secara acak dalam uji pemacu tumbuh pada
media tanah steril dan tanah non-steril di rumah kaca (K = kontrol tanpa inokulasi; Crb17 adalah kedelai yang diinokulasi dengan isolat
Pseudomonas Crb17; angka 1 sampai 5 adalah nomor ulangan) ... 21 7 Hambatan perkembangan dan pertumbuhan tanaman kedelai pada
media agar semi-padat yang diinfestasi dengan cendawan patogen F. oxysporum, S. rolfsii, dan R. solani ... 22 8 Skema penempatan pot pada pengujian ketahanan tanaman kedelai
inokulasi dengan Pseudomonas penghasil ACC deaminase terhadap cendawan patogen pada tanah steril (atas) dan non-steril (bawah) di rumah kaca. (FS46-1 = inokulasi tanah steril dengan Fusarium oxysporum dan Pseudomonas Crb46 pada ulangan 1; FN56-3 = inokulasi tanah steril dengan Fusarium oxysporum dan Pseudomonas
Crb56 pada ulangan 3, dan seterusnya) ... 24 9 Pengaruh isolat Pseudomonas terhadap pertambahan panjang dan
bobot akar (%) tanaman kedelai umur 7 hari pada percobaan A. Tanda * = berbeda nyata dibanding perlakuan kontrol ... 28 10 Pengaruh isolat Pseudomonas terhadap pertambahan panjang dan
bobot akar (%) tanaman kedelai umur 7 hari pada percobaan B. Tanda * = berbeda nyata dibanding perlakuan kontrol ... 28 11 Pengaruh isolat Pseudomonas terhadap pertambahan panjang dan
12 Pengaruh isolat Pseudomonas terhadap pertambahan panjang dan bobot akar (%) tanaman kedelai umur 7 hari pada percobaan D. Tanda * = berbeda nyata dibanding perlakuan kontrol ... 29 13 Pengaruh isolat Pseudomonas terhadap pertambahan atau
pengurangan panjang dan bobot akar (%) tanaman kedelai umur 7 hari pada percobaan E. Inokulasi Pseudomonas tidak nyata meningkatkan panjang maupun bobot akar ... 30 14 Pengaruh isolat Pseudomonas terhadap pertambahan atau
pengurangan panjang dan bobot akar (%) tanaman kedelai umur 7 hari pada percobaan E. Inokulasi Pseudomonas tidak nyata meningkatkan panjang maupun bobot akar dan isolat cenderung menghambat panjan dan bobot akar ... 29 15 Pertumbuhan isolat Pseudomonas pada cawan-agar media M26 (A),
DF + amonium sulfat (B), dan DF + ACC (C). ... 31 16 Uji kompatibilitas Pseudomonas dengan rhizobia pada agar cawan
King's B, yaitu reaksi antagonis B. japonicum Bj11 terhadap
DAFTAR LAMPIRAN
Halaman
1 Hasil analisis contoh tanah komposit Ultisols dari daerah Leuwiliang, Jasinga, Bogor untuk penelitian di rumah kaca ... 53 2 Data hasil analisis varian dan rata-rata perlakuan pada tiap set
percobaan di ruang penumbuh (growth chamber) ... 54 3 Daftar publikasi hasil penelitian selama masa studi yang diterbitkan
PENDAHULUAN
Latar Belakang
Berbagai jenis bakteri yang menguntungkan dari kelompok rizobakteri pemacu tumbuh tanaman banyak diteliti dan dikembangkan, antara lain dari genus
Pseudomonas, Enterobacter, Bacillus, Serratia, Acetobacter, Azotobacter, dan
Azospirillum. Selain mampu menghasilkan senyawa pemacu tumbuh dan mengendalikan penyakit, beberapa rizobakteri seperti Pseudomonas juga dikenal sebagai bakteri kompetitif dan paling efisien memanfaatkan sumber hara di lingkungan rhizosfer (Kloepper & Schroth 1981). Manfaat rizobakteri ini terhadap pertumbuhan tanaman telah banyak dilaporkan. Beberapa galur mampu mensintesis zat pengatur tumbuh (fitohormon), menghasilkan enzim
1-aminocyclopropane-1-carboxylate (ACC) deaminase untuk mengurangi sintesis hormon etilen yang berlebihan pada masa pertumbuhan vegetatif tanaman, memfasilitasi penyerapan unsur hara di dalam tanah (Glick 1995; Cattelan et al. 1999; Tenuta 2006), dan menghasilkan senyawa atau metabolit seperti
siderophore, -1,3-glukanase, kitinase, antibiotik, dan sianida untuk menekan aktivitas patogen (Kloepper 1993; Cattelan et al. 1999; Wang et al. 2000). Di antara berbagai peran penting ini, bakteri penghasil enzim ACC deaminase mulai banyak diteliti untuk membantu pertumbuhan tanaman.
Rizobakteri penghasil ACC deaminase mampu memacu pertumbuhan dan meningkatkan daya tahan tanaman terhadap cekaman (stress) yang disebabkan berbagai faktor biotik dan abiotik (lingkungan) yang ekstrim, antara lain tingginya hormon IAA (Mayak et al. 1997), genangan (Grichko & Glick 2001), kekeringan (Mayak et al. 2004), adanya polutan organik dan anorganik (Reed & Glick 2005; Belimov et al. 2001), tingginya kadar garam (Saravanakumar & Samiyappan 2007), dan serangan patogen (Wang et al.2000; Dey et al. 2004; Shaharoona et al. 2006). Enzim ini berperan mendegradasi ACC (prekursor hormon etilen) menjadi
2
hormon etilen pada awal masa pertumbuhan tanaman menghambat perkembangan akar (Glick 1995; Mayak et al. 1997) dan pembentukan bintil akar (Ma et al. 2003), dan dalam banyak kasus melemahkan ketahanan tanaman terhadap penyakit (Wang et al. 2000; 2006; Dey et al. 2004). Tanaman yang terinfeksi patogen juga dilaporkan sering mengalami cekaman etilen dengan diproduksinya hormon ini dalam jumlah yang berlebihan, sehingga memperparah serangan penyakit (Lund et al. 1998; Van Loon et al. 2006). Dengan demikian, pemanfaatan rizobakteri penghasil ACC deaminase untuk mengendalikan sintesis etilen, terutama pada masa pertumbuhan vegetatif, merupakan salah satu upaya untuk meningkatkan pertumbuhan dan ketahanan mereduksi tanaman terhadap penyakit.
Di Indonesia, studi penggunaan rizobakteri penghasil enzim ACC deaminase sebelum penelitian ini belum pernah dilaporkan. Pemanfaatannya bagi budidaya tanaman kedelai di Indonesia merupakan salah satu alternatif teknologi yang menjanjikan untuk mengatasi rendahnya kualitas pertumbuhan tanaman yang dapat disebabkan oleh faktor tanah, air maupun penyakit. Selain itu, penggunaan bakteri penghasil ACC deaminase ini dalam sistem budidaya tanaman kedelai akan dapat mengurangi pemakaian senyawa agrokimia sintetik yang berlebihan (pupuk dan fungisida) yang saat ini harganya semakin mahal dan berpotensi mencemari lingkungan. Bakteri dari genus Pseudomonas penghasil IAA yang dipilih sebagai model dalam penelitian ini dikenal kompetitif dan paling efisien dalam memanfaatkan sumber hara di lingkungan rhizosfer (Kloepper & Schroth 1981). Tiga jenis penyakit tular tanah yang juga digunakan sebagai model dalam penelitian ini adalah penyakit busuk kecambah dan busuk akar yang disebabkan oleh cendawan patogen Rhizoctonia solani dan Fusarium oxysporum, dan penyakit hawar batang yang disebabkan oleh cendawan patogen
3
mencapai 15,5% dari total serangan penyakit. Tantangan dalam pemanfaatan bakteri penghasil ACC deaminase ini pada tanaman kedelai terletak pada kemampuan menapis dan memilih bakteri penghasil ACC deaminase yang unggul, kompetitif, dan dapat bekerja secara sinergis dengan bakteri bintil akar (rhizobia).
Tujuan Penelitian
Penelitian ini bertujuan mendapatkan isolat-isolat Pseudomonas penghasil enzim 1-aminocyclopropane-1-carboxylate (ACC) deaminase yang mampu meningkatkan pertumbuhan dan ketahanan tanaman kedelai terhadap penyakit melalui serangkaian penelitian di laboratorium, ruang penumbuh (growth chamber), dan rumah kaca. Secara rinci, tujuan penelitian ini dicapai melalui 3 tahapan utama, sebagai berikut:
1. Penapisan (screening) isolat-isolat Pseudomonas pemacu pertumbuhan kedelai secara in planta di ruang penumbuh (growth chamber) dan pengukuran aktivitas ACC deaminase secara in vitro di laboratorium.
2. Seleksi isolat-isolat Pseudomonas penghasil ACC deaminase yang unggul dan tidak antagonis terhadap bakteri bintil akar melalui uji kompatibilitas.
3. Pengujian kemampuan isolat-isolat Pseudomonas penghasil ACC deaminase dalam meningkatkan pertumbuhan dan ketahanan tanaman kedelai terhadap penyakit yang disebabkan oleh cendawan patogen Fusarium oxysporum,
Sclerotium rolfsii, dan Rhizoctonia solani melalui percobaan di rumah kaca pada media tanah steril dan non-steril.
Hipotesis
4
Manfaat Penelitian
Pemanfaatan Pseudomonas penghasil ACC deaminase sebagai agen hayati dalam sistem budidaya tanaman kedelai di Indonesia akan mendukung upaya peningkatan produksi yang selama ini lebih banyak bertumpu pada penggunaan bahan kimia sintetik (pupuk dan fungisida). Pemanfaatan bakteri ini secara tepat akan mengurangi penggunaan pupuk dan fungisida kimia sintetik yang harganya terus semakin mahal dan pemakaiannya yang berlebihan berpotensi mencemari lingkungan. Sifat bakteri ini yang tidak antagonis terhadap rhizobia dapat bekerja secara sinergis dengan bakteri bintil akar penambat N yang alami (native) maupun yang diaplikasikan secara bersamaan. Fungsi ganda karakter ACC deaminase yang dimiliki bakteri ini selain mampu melindungi tanaman dari berbagai cekaman biotik (serangan penyakit) juga diharapkan dapat melindungi tanaman dari berbagai cekaman abiotik (lingkungan ekstrim). Sebagai agen hayati,
Pseudomonas penghasil ACC deaminase dapat diperbanyak dan diperbaharui, sehingga dapat digunakan secara berkelanjutan.
Temuan Baru (Novelty)
TINJAUAN PUSTAKA
Rizobakteri Pemacu Pertumbuhan Tanaman (PGPR)
Rizobakteri pemacu tumbuh tanaman yang populer disebut plant growth promoting rhizobacteria (PGPR) diperkenalkan pertama kali oleh Kloepper dan Schroth (1978). Rizobakteri merupakan kelompok bakteri rhizosfer yang memiliki kemampuan mengkolonisasi rizosfer secara agresif dan memberi keuntungan bagi tanaman (Kloepper & Schroth 1978; Schroth & Hancock 1982). Berbagai jenis bakteri telah diidentifikasi sebagai PGPR. Sebagian besar berasal dari kelompok Gram negatif dengan jumlah galur paling banyak dari genus Pseudomonas dan
Serratia (Kloepper 1993).
Aktivitas rizobakteri di lingkungan perakaran memberi keuntungan bagi pertumbuhan tanaman dengan kemampuannya menyediakan atau memfasilitasi penyerapan berbagai unsur hara dalam tanah serta mensintesis dan mengubah konsentrasi berbagai zat pengatur tumbuh (fitohormon). Selain itu, bakteri ini juga memiliki kemampuan menekan aktivitas patogen dengan cara menghasilkan berbagai senyawa atau metabolit seperti siderophore, -1,3-glukanase, kitinase, antibiotik, dan sianida (Kloepper 1993; Cattelan et al. 1999; Tenuta 2006) dan enzim aminocyclopropane carboxylate (ACC) deaminase (Glick 1995).
Enzim ACC Deaminase dan Etilen
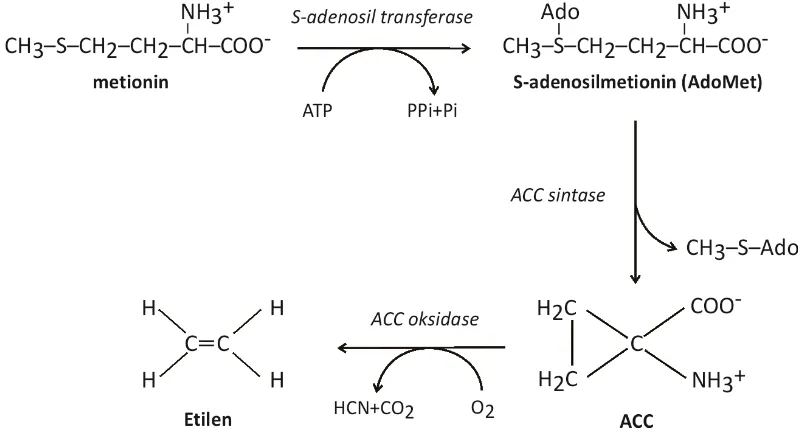
Enzim 1-aminocyclopropane-1-carboxylate deaminase (E.C.4.1.99.4), disingkat ACC deaminase, merupakan enzim sitoplasma yang diproduksi oleh beberapa mikroba. Honma dan Shimomura (1978) menemukan enzim ini pertama kali pada bakteri Pseudomonas sp galur ACP. Enzim ACC deaminase berperan mendegradasi asam amino siklopropanoid 1-aminocyclopropane-1-carboxylic acid atau ACC menjadi α-ketobutirat dan amonia. Asam amino ACC merupakan prekursor hormon etilen pada tanaman, sehingga ketersediaanya menjadi faktor utama dalam biosintesis hormon etilen.
6
Gambar 1. Biosintesis etilen pada tanaman (Diringkas dan digambar ulang dari Ose et al. 2003)
Etilen tergolong hormon senesen yang berperan dalam pematangan buah dan penuaan (Abeles et al. 1992; Mathews & Van Holde 1996). Etilen dalam konsentrasi yang rendah pada masa perkecambahan mempercepat proses perkecambahan atau memecah masa dormansi biji. Namun apabila konsentrasi etilen terus meningkat, perkembangan akar menjadi terhambat. Berbagai hasil penelitian membuktikan bahwa selain berperan dalam pematangan buah, etilen juga berfungsi sebagai antagonis atau modulator bagi berbagai fitohormon lain untuk mencegah pertumbuhan tanaman yang berlebihan (Lieberman & Kunishi 1972; Imaseki 1986; Arshad & Frankenberger 1993). Degradasi prekursor etilen (ACC) oleh bakteri penghasil ACC deaminase melalui interaksi hubungan bakteri-tanaman terbukti mampu mengurangi biosintesis hormon etilen, sehingga perkembangan akar tidak terganggu.
Bakteri Penghasil ACC Deaminase sebagai Pemacu Tumbuh Tanaman
7
penelitian lain memperlihatkan keterkaitan antara produksi hormon IAA dengan hormon etilen. Okon dan Kapulnik (1986) dan Abbas dan Okon (1993) melaporkan bahwa IAA yang dihasilkan oleh beberapa bakteri Azospirillum brasilense dan Azotobacter paspali mampu meningkatkan jumlah bulu akar dan akar lateral tanaman, sehingga meningkatkan penyerapan air dan unsur hara dari tanah. Namun peningkatan pertumbuhan ini terjadi pada tanaman yang diberi IAA dalam konsentrasi rendah (0,005 µg ml-1) dan tanaman yang diinokulasi dengan bakteri yang kemampuan memproduksi IAA-nya rendah. Sintesis IAA yang berlebihan justru menghambat pertumbuhan tanaman (Beyeler et al. 1997). Konsentrasi IAA yang tinggi di lingkungan akar dapat memicu pembentukan ACC, dan ACC yang terbentuk akan dioksidasi menjadi etilen yang dalam konsentrasi tinggi dapat menghambat perkembangan akar (Glick et al. 1998; Mayak et al.1997; Shah et al. 1997).
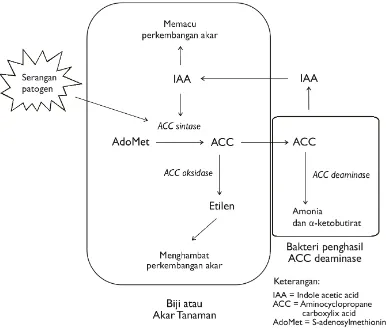
Hasil penelitian Glick et al. (1998) membuktikan bahwa Pseudomonas
penghasil enzim ACC deaminase mampu mengurangi pengaruh penghambatan pertumbuhan tanaman karena meningkatnya hormon etilen dengan cara menghidrolisis ACC yang terbentuk dalam jaringan akar. Mekanisme proses penurunan konsentrasi etilen di dalam lingkungan akar disajikan pada Gambar 2. Pada Gambar 2 terlihat bahwa hormon IAA yang diproduksi oleh mikroba di lingkungan rizosfer (eksogenus) sebagian masuk ke jaringan akar melalui proses kesetimbangan. Hormon IAA ini selain memacu perkembangan sel dan pembentukan akar muda, juga merangsang pembentukan enzim ACC sintase untuk pembentukan ACC. Dalam proses kesetimbangan, sebagian ACC dikeluarkan akar yang selanjutnya didegradasi oleh bakteri penghasil enzim ACC
8
9
Bakteri Penghasil ACC Deaminase sebagai Agen Hayati Pengendali Patogen
Selain memacu pertumbuhan tanaman, bakteri penghasil ACC deaminase juga berperan dalam meningkatkan daya tahan tanaman terhadap cekaman (stress) yang ditimbulkan oleh berbagai faktor biotik (serangan patogen) maupun abiotik (lingkungan). Bakteri ini mampu mengurangi tingkat cekaman tanaman dengan mengendalikan pembentukan hormon etilen yang dipicu oleh berbagai faktor biotik dan abiotik ekstrim. Berbagai hasil penelitian menunjukkan bahwa peningkatan konsentrasi etilen pada tanaman, khususnya pada awal masa pertumbuhan vegetatif, menghambat perkembangan akar dan melemahkan ketahanan tanaman terhadap serangan penyakit (Wang et al. 2000; Glick et al. 2007).
Studi yang dilakukan Wang et al. (2000; 2006) membuktikan kemampuan beberapa bakteri penghasil ACC deaminase dalam mengendalikan berbagai penyakit akar tanaman yang disebabkan oleh cendawan patogen, seperti penyakit layu rebah (damping off) pada mentimun dan busuk akar pada tomat dan kentang. Hasil penelitiannya membuktikan kemampuan bakteri penghasil ACC deaminase dalam menekan serangan cendawan patogen Pythium ultimum penyebab layu rebah. Tanaman yang terinfeksi patogen sering mengalami cekaman etilen (etilen diproduksi dalam jumlah banyak), sehingga akan memperparah serangan penyakit (Van Loon et al. 2006). Inokulasi bakteri penghasil ACC deaminase terbukti mampu menekan pembetukan hormon etilen dan memperkuat daya tahan tanaman terhadap serangan patogen.
Cendawan Patogen Tular Tanah pada Kedelai
Berbagai penyakit tanaman kedelai yang disebabkan oleh cendawan di dalam tanah yang populer dikenal sebagai patogen tular tanah (soilborne disease) sudah banyak diidentifikasi. Beberapa diantaranya adalah cendawan patogen
Fusarium oxysporum penyebab busuk akar (root rot) dan tanaman mati mendadak (sudden death syndrome), Sclerotium rolfsii penyebab layu (damping-off) dan hawar batang atau busuk pangkal batang (stem rot), dan Rhizoctonia solani
10
diakibatkan oleh cendawan ini di Indonesia cukup besar yaitu sekitar 12,5 ribu ton dari total 147,5 ribu ton kehilangan panen kedelai pada tahun 1998 (Wrather et al. 2001). Hasil penelitian Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian (2005) memperlihatkan bahwa intensitas serangan cendawan patogen tular tanah R. solani mencapai 15,5% dari total serangan penyakit.
Gejala penyakit yang ditimbulkan oleh Fusarium menurut Roy et al. (1997) adalah daun menguning (yellowing), khlorosis dan nekrosis pada daun muda, diskolorasi pada batang, dan busuk akar. Hasil penelitian Mueller et al.
BAHAN DAN METODE
Tempat Penelitian
Penelitian ini dilakukan di laboratorium, ruang penumbuh (growth chamber), dan rumah kaca. Penelitian di laboratorium dan ruang penumbuh dilaksanakan di Laboratorium Biologi dan Kesehatan Tanah, Balai Penelitian Tanah, Bogor. Sedangkan percobaan di rumah kaca dilakukan di Instalasi Rumah Kaca, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Cimanggu, Bogor.
Bahan Penelitian
Penelitian ini menggunakan isolat bakteri Pseudomonas; cendawan patogen Fusarium oxysporum, Sclerotium rolfsii, dan Rhizoctonia solani; bakteri bintil akar Bradyrhizobium japonicum Bj11 dan Sinorhizobium fredii Rif5; benih kedelai varietas Wilis; plastik kantong tumbuh (growth pouches); dan tanah untuk pengujian tanaman di rumah kaca.
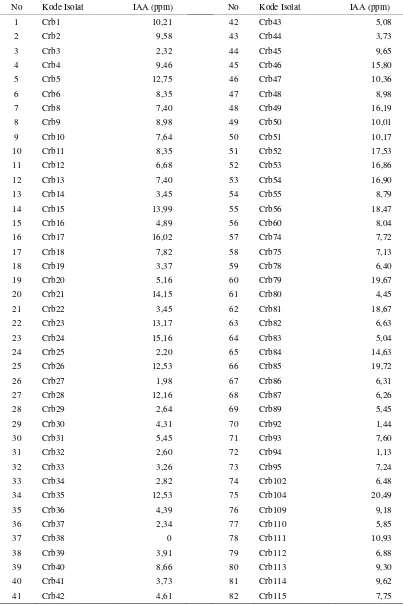
Bakteri Pseudomonas yang diuji adalah sebanyak 82 isolat Pseudomonas
non-patogen yang diisolasi dari rizosfer tanaman kedelai di daerah Plumbon, Cirebon, Jawa Barat. Sebanyak 81 isolat merupakan isolat penghasil hormon asam indol asetat (IAA) dengan kemampuan sintesis secara in vitro berkisar dari 1,13 – 20,49 µg ml-1 (Wahyudi et al. 2007). Isolat Pseudomonas tersebut adalah isolat dengan kode Crb1 sampai Crb6, Crb8 sampai Crb37, Crb39 sampai Crb56, Crb60, Crb74, Crb75, Crb78 sampai Crb87, Crb89, Crb92 sampai Crb95, Crb102, Crb104, dan Crb109 sampai Crb115. Satu isolat yang bukan penghasil IAA, yaitu
12
Tabel 1. Isolat-isolat Pseudomonas dan kemampuannya menghasilkan IAA yang digunakan dalam penelitian ini.
No Kode Isolat IAA (ppm) No Kode Isolat IAA (ppm)
1 Crb1 10,21 42 Crb43 5,08
2 Crb2 9,58 43 Crb44 3,73
3 Crb3 2,32 44 Crb45 9,65
4 Crb4 9,46 45 Crb46 15,80
5 Crb5 12,75 46 Crb47 10,36
6 Crb6 8,35 47 Crb48 8,98
7 Crb8 7,40 48 Crb49 16,19
8 Crb9 8,98 49 Crb50 10,01
9 Crb10 7,64 50 Crb51 10,17
10 Crb11 8,35 51 Crb52 17,53
11 Crb12 6,68 52 Crb53 16,86
12 Crb13 7,40 53 Crb54 16,90
13 Crb14 3,45 54 Crb55 8,79
14 Crb15 13,99 55 Crb56 18,47
15 Crb16 4,89 56 Crb60 8,04
16 Crb17 16,02 57 Crb74 7,72
17 Crb18 7,82 58 Crb75 7,13
18 Crb19 3,37 59 Crb78 6,40
19 Crb20 5,16 60 Crb79 19,67
20 Crb21 14,15 61 Crb80 4,45
21 Crb22 3,45 62 Crb81 18,67
22 Crb23 13,17 63 Crb82 6,63
23 Crb24 15,16 64 Crb83 5,04
24 Crb25 2,20 65 Crb84 14,63
25 Crb26 12,53 66 Crb85 19,72
26 Crb27 1,98 67 Crb86 6,31
27 Crb28 12,16 68 Crb87 6,26
28 Crb29 2,64 69 Crb89 5,45
29 Crb30 4,31 70 Crb92 1,44
30 Crb31 5,45 71 Crb93 7,60
31 Crb32 2,60 72 Crb94 1,13
32 Crb33 3,26 73 Crb95 7,24
33 Crb34 2,82 74 Crb102 6,48
34 Crb35 12,53 75 Crb104 20,49
35 Crb36 4,39 76 Crb109 9,18
36 Crb37 2,34 77 Crb110 5,85
37 Crb38 0 78 Crb111 10,93
38 Crb39 3,91 79 Crb112 6,88
39 Crb40 8,66 80 Crb113 9,30
40 Crb41 3,73 81 Crb114 9,62
41 Crb42 4,61 82 Crb115 7,75
13
Biakan murni cendawan patogen akar kedelai R. solani diperoleh dari Laboratorium Biologi dan Kesehatan Tanah, Balai Penelitian Tanah, Bogor, sedangkan F. oxysporum dan S. rolfsii diperoleh dari Dr. Abjad Asih Nawangsih, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB), Bogor. Bakteri bintil akar B. japonicum Bj11 diperoleh dari Dr. Aris Tri Wahyudi, Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB Bogor; sedangkan
S. fredii Rif5 diperoleh dari Laboratorium Biologi dan Kesehatan Tanah, Balai Penelitian Tanah, Bogor.
Benih kedelai varietas Wilis diperoleh dari Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor. Tanah untuk penelitian di rumah kaca adalah tanah Ultisol lapisan atas (0-20 cm) yang berasal dari tanah pertanian di daerah Leuwiliang-Jasingga, Bogor.
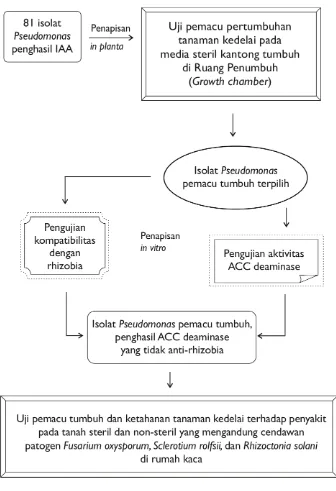
Tahapan Penelitian
Penelitian dimulai dengan kegiatan penapisan (screening) isolat-isolat
Pseudomonas yang mampu memacu pertumbuhan tanaman kedelai pada media steril kantong tumbuh (growth pouch) yang dilaksanakan di ruang penumbuh (growth chamber). Isolat-isolat yang mampu meningkatkan pertumbuhan tanaman kedelai, selanjutnya diuji aktivitas ACC deaminase dan kompatibilitasnya dengan bakteri bintil akar B. japonicum Bj11 dan S. fredii Rif5 secara in vitro.
14
15
Penapisan in plantaPseudomonas Pemacu Tumbuh
[image:38.595.116.511.189.311.2]Penapisan kemampuan isolat-isolat Pseudomonas memacu pertumbuhan tanaman kedelai dilakukan pada media steril kantong tumbuh yang ditempatkan pada rak-rak di ruang penumbuh (Gambar 4).
Gambar 4. Penapisan Pseudomonas pemacu tumbuh pada media steril kantong tumbuh. Rak kantong tumbuh (A), penempatan kantong tumbuh pada rak (B), dan penempatan kedelai pada tiap kantong tumbuh (C).
Prosedur penapisan dengan kantong tumbuh mengikuti protokol pengujian Liftshitz et al. (1987). Kantong tumbuh terbuat dari plastik tebal tahan panas berukuran 18 cm (lebar) x 19 cm (panjang). Di dalam tiap kantong diberi 3 potongan kertas saring, masing-masing selebar 5 cm dengan panjang seukuran bagian dalam kantong tumbuh. Bagian atas kertas saring diberi lipatan untuk dudukan biji kedelai yang ditumbuhkan. Kantong tumbuh sebelum digunakan disterilisasi dengan autoklaf selama 3 hari berturut-turut (1 jam per hari).
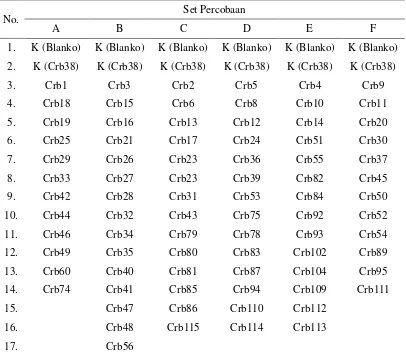
Penapisan isolat dilakukan dalam 6 set percobaan (A sampai dengan F), masing-masing set terdiri atas 14 sampai dengan 17 perlakuan (termasuk perlakuan kontrol tanpa inokulasi isolat dan kontrol inokulasi dengan isolat bukan-penghasil IAA Crb38). Isolat Pseudomonas yang digunakan pada masing-masing set percobaan disajikan pada Tabel 2.
16
Tabel 2. Isolat-isolat Pseudomonas pada masing-masing set percobaan.
No. Set Percobaan
A B C D E F
1. K (Blanko) K (Blanko) K (Blanko) K (Blanko) K (Blanko) K (Blanko) 2. K (Crb38) K (Crb38) K (Crb38) K (Crb38) K (Crb38) K (Crb38)
3. Crb1 Crb3 Crb2 Crb5 Crb4 Crb9
4. Crb18 Crb15 Crb6 Crb8 Crb10 Crb11
5. Crb19 Crb16 Crb13 Crb12 Crb14 Crb20
6. Crb25 Crb21 Crb17 Crb24 Crb51 Crb30
7. Crb29 Crb26 Crb23 Crb36 Crb55 Crb37
8. Crb33 Crb27 Crb23 Crb39 Crb82 Crb45
9. Crb42 Crb28 Crb31 Crb53 Crb84 Crb50
10. Crb44 Crb32 Crb43 Crb75 Crb92 Crb52
11. Crb46 Crb34 Crb79 Crb78 Crb93 Crb54
12. Crb49 Crb35 Crb80 Crb83 Crb102 Crb89
13. Crb60 Crb40 Crb81 Crb87 Crb104 Crb95
14. Crb74 Crb41 Crb85 Crb94 Crb109 Crb111
15. Crb47 Crb86 Crb110 Crb112
16. Crb48 Crb115 Crb114 Crb113
17. Crb56
Keterangan: K (Blanko) = tanpa inokulasi dengan isolat; K (Crb38) = inokulasi kedelai dengan isolat yang tidak menghasilkan IAA.
Biji kedelai sebelum digunakan disterilisasi dengan alkohol 70% dan larutan natrium hipokhlorida (NaOCl 0,21 M). Biji dibasahi alkohol 70% selama 1 menit, kemudian direndam dalam larutan sodium hipokhlorida (NaOCl) selama 5 menit. Pembilasan untuk menghilangkan sisa NaOCl menggunakan akuades steril, kemudian HCl 0,01 M, dan terakhir dengan akuades steril sebanyak 5 kali. Biji kedelai yang sudah steril diinokulasi dengan masing-masing suspensi sel.
Suspensi sel disiapkan dengan menumbuhkan masing-masing isolat dalam
17
dilarutkan dalam 1000 ml akuades. Sterilisasi media dilakukan dengan autoklaf pada suhu 121oC dan tekanan 0,1 MPa selama 15 menit. Suspensi sel pada media cair M26 (setelah ditumbuhkan selama 24 jam pada mesin pengocok pada kecepatan 125 rpm) disentrifus pada kecepatan 4000 g selama 10 menit untuk mendapatkan pelet sel. Pelet sel dibilas dengan akudes steril dan selanjutnya disuspensikan kembali dalam larutan 100 mM MgSO4 steril (pH 7). Suspensi sel diatur pada absorbansi 0,5 dengan panjang gelombang 780 nm yang jumlah selnya setara dengan 108 - 109 sel ml-1.
Inokulasi biji kedelai steril dilakukan dengan merendam biji dalam masing-masing suspensi sel isolat (108 - 109 sel ml-1) sesuai dengan masing-masing perlakuan selama 1 jam. Perlakuan kontrol tanpa inokulasi merupakan biji kedelai steril yang direndam pada larutan 100 mM MgSO4 tanpa sel. Biji yang sudah diinokulasi kemudian dikecambahkan pada kertas saring lembab steril pada cawan Petri dan ditempatkan pada ruang gelap pada suhu 28oC selama 2 hari. Tiga kecambah kedelai (panjang radikel 1 cm) ditumbuhkan pada tiap kantong tumbuh steril yang diberi 20 ml akuades steril (Gambar 5). Kantong tumbuh yang berisi kecambah kedelai diletakkan tegak lurus pada rak. Kecambah ditumbuhkan selama 7 hari di ruang tumbuh dengan suhu 24oC dengan intensitas cahaya harian sebesar 1300 lux selama 12 jam dan masa gelap harian selama 12 jam.
18
Gambar 5. Biji kedelai yang sudah diinokulasi dengan isolat Pseudomonas dan dikecambahkan pada cawan Petri (A), penempatan kecambah kedelai umur 2 hari pada media kantong tumbuh (B).
Pengujian Aktivitas Enzim ACC Deaminase
Pengujian aktivitas ACC deaminase dilakukan pada isolat Pseudomonas
yang mampu meningkatkan panjang dan bobot akar kedelai secara in planta di ruang penumbuh. Media yang digunakan adalah media garam minimal Dworkin-Foster (DF) (Dworkin & Dworkin-Foster 1958) yang diperkaya dengan substrat
1-aminocyclopropane-1-carboxylate (ACC) atau amonium sulfat sebagai sumber nitrogen mengikuti prosedur Glick et al. (1995). Komposisi media DF adalah 4 g KH2PO4; 6 g Na2HPO4; 0,2 g MgSO4.7H2O; 1 mg FeSO4.7H2O; 10 µg H3BO3; 10 µg MnSO4; 70 µg ZnSO4; 50 µg CuSO4; 10 µg MoO3; 2 g glukosa; 2 g asam glukonat, 2 g asam sitrat; 12 g agar (untuk media padat) yang dilarutkan dalam 1000 ml akuades. Jumlah ACC atau amonium sulfat yang ditambahkan ke dalam media DF, masing-masing adalah 0,3033 g ACC atau 2 g amonium sulfat.
Kecuali bahan ACC yang tidak tahan panas (heat-labile), semua bahan media disterilisasi dengan autoklaf selama 15 menit pada suhu 121oC dan tekanan 0,1 Mpa. Bahan ACC disterilisasi dengan membran filter berukuran 0,2 µ m sebelum ditambahkan (dicampurkan) ke dalam bahan yang sudah disterilkan.
19
isolat pada media cair dimonitor tiap 6 jam selama 48 jam dengan mengukur kerapatan optik biakan pada panjang gelombang 600 nm mengadaptasi metode yang dijelaskan oleh Wang et al. (2000). Nilai kerapatan optik 0,05 atau lebih, khususnya isolat yang ditumbuhan pada media DF + ACC, mengindikasikan bahwa isolat memiliki aktivitas enzim ACC deaminase. Begitu pula dengan media padat yang inokulasi dengan isolat dengan teknik gores. Isolat yang mampu tumbuh pada salah satu media DF + ACC atau DF + amonium sulfat menjadi indikasi adanya aktivitas enzim ACC deaminase. Penggunaan media DF saja (tanpa ACC maupun amonium sulfat) digunakan sebagai kontrol untuk mengetahui apakah isolat yang digunakan tergolong bakteri diazotrof yang mampu mendapatkan sumber N dengan menambat N2 dari udara.
Uji Kompatibilitas Pseudomonas dengan Rhizobia
Pengujian menggunakan bakteri bintil akar Bradyrhizobium japonicum
Bj11 dan Sinorhizobium fredii Rif5. Suspensi B. japonicum Bj11 (fase log, 100 µl dengan jumlah sel 107 per ml) diinokulasikan ke agar cawan dengan cara disebar. Media agar yang digunakan adalah media King’s B yang mampu menumbuhkan
B. japonicum Bj11 atau S. fredii Rif5 dan isolat Pseudomonas. Bulatan kertas saring steril (diameter 1 cm) dicelupkan ke suspensi isolat Pseudomonas (dari biakan 24 jam), kemudian diinokulasikan ke media agar cawan yang sudah diinokulasi B. japonicum Bj11 atau S. fredii Rif5. Media diinkubasi pada suhu 28°C selama 5 hari. Pengamatan dilakukan dengan mengamati zona hambatan oleh Pseudomonas. Sebaliknya, untuk mengetahui zona hambatan oleh rhizobia dilakukan dengan prosedur yang sama, tetapi B. japonicum Bj11 atau S. fredii
20
Uji Pemacu Tumbuh di Rumah Kaca
Pengujian dilakukan terhadap isolat terbaik, yakni Pseudomonas penghasil ACC deaminase yang mampu memacu pertumbuhan kedelai di ruang penumbuh (growth room) dan kompatibel dengan rhizobia atau tidak bersifat antagonis terhadap B. japonicum Bj11 ataupun S. fredii Rif5. Prosedur pengujian pada tanah di rumah kaca mengikuti metode seperti yang diterapkan Cattelan et al. (1999). Contoh tanah percobaan diayak dengan ayakan 2 mm dan ditempatkan dalam pot plastik polietilen seberat 0,5 kg/pot (tanah steril) dan 2 kg/pot (tanah non-steril). Tanah dalam polibag plastik polietilen disterilkan dengan autoklaf pada suhu 121oC dan tekanan 0,1 Mpa, sebanyak 2 kali, masing-masing selama 1 jam dengan interval waktu 2 hari. Sterilisasi pot plastik polietilen dilakukan dengan cara sterilisasi permukaan plastik dengan alkohol 95%. Contoh tanah sebelum percobaan dianalisis untuk penetapan tekstur, pH, C-organik, N, P, K, dan kandungan kation dapat-tukar (basa-basa) di Balai Penelitian Tanah, Bogor. Hasil analisis tanah disajikan pada Lampiran 1.
Berdasarkan hasil analisis tanah dan kriteria Balai Penelitian Tanah (2005) tanah yang digunakan bertekstur lempung liat berdebu, pH masam (pH H2O 4,5), kandungan C-organik dan nitrogen tergolong rendah (C = 1,69% dan N = 0,13%), kandungan P tersedia sangat rendah (P2O5 Bray 1 = 2,7 ppm), kandungan K terekstrak HCl 25% tergolong rendah (K2O HCl 25% = 11 mg/100 g tanah), kapasitas tukar kation (KTK) dan kejenuhan basa (KB) tergolong rendah (KTK = 13,67 cmol(+)/kg dan KB = 40%). Berdasarkan sifat tanah dan kriteria yang diuraikan di atas, maka tanah yang digunakan tergolong memiliki kesuburan rendah .
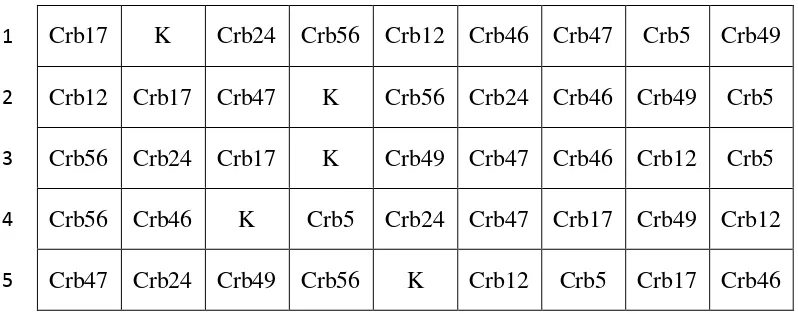
Percobaan menggunakan rancangan acak lengkap (RAL), masing-masing perlakuan diulang 5 kali. Sebagai perlakuan adalah kedelai yang diinokulasi dengan masing-masing 8 isolat Pseudomonas terpilih dan kedelai tanpa inokulasi sebagai kontrol. Penempatan pot di rumah kaca disajikan pada Gambar 6.
21
setebal 1 cm. Kadar air tanah pada pot diatur dengan penyiraman harian untuk mendapatkan potensial air tanah (soil water potential) yang setara dengan -0,03 MPa. Penjarangan dilakukan setelah tanaman muncul ke permukaan dan hanya satu tanaman yang dipelihara per pot. Tanaman ditumbuhkan selama 14 hari.
1 Crb17 K Crb24 Crb56 Crb12 Crb46 Crb47 Crb5 Crb49
2 Crb12 Crb17 Crb47 K Crb56 Crb24 Crb46 Crb49 Crb5
3 Crb56 Crb24 Crb17 K Crb49 Crb47 Crb46 Crb12 Crb5
4 Crb56 Crb46 K Crb5 Crb24 Crb47 Crb17 Crb49 Crb12
5 Crb47 Crb24 Crb49 Crb56 K Crb12 Crb5 Crb17 Crb46
Gambar 6. Skema penempatan pot secara acak dalam uji pemacu tumbuh pada media tanah steril dan tanah non-steril di rumah kaca (K = kontrol tanpa inokulasi; Crb17 adalah kedelai yang diinokulasi dengan isolat
Pseudomonas Crb17; angka 1 sampai 5 adalah nomor ulangan).
Parameter pemacu tumbuh yang diukur meliputi tinggi tanaman dan bobot basah tajuk dan akar. Perbedaan hasil antar perlakuan dianalisis dengan analisis sidik ragam yang dilanjutkan dengan uji beda nyata bertingkat DMRT (Duncan multiple range test) antar perlakuan menggunakan perangkat lunak SAS system for Windows v6.12.
Uji Penekanan Penyakit
[image:44.595.119.518.198.355.2]22
Gambar 7. Hambatan pertumbuhan tanaman kedelai pada media agar semi-padat yang diinfestasi dengan cendawan patogen F. oxysporum, S. rolfsii, dan R. solani.
Pengujian penekanan penyakit dilakukan pada media tanah steril dan non-steril di rumah kaca mengikuti prosedur Wang et al. (2000) dan Cattelan et al. (1999). Pengujian pada media tanah steril menggunakan campuran 400 g tanah dan 100 g pasir kuarsa yang disterilisasi 2 kali dengan autoklaf, masing-masing selama 1 jam dengan interval waktu 2 hari. Sterilisasi pot plastik polietilen dilakukan dengan cara sterilisasi permukaan plastik dengan alkohol 95%.
[image:45.595.222.345.84.330.2]23
propagul R. solani per gram tanah. Kepadatan populasi biakan cendawan yang digunakan dihitung berdasarkan kurva standar yang ditetapkan dengan teknik pengenceran bertingkat dan pencawanan. Tingkat kepadatan populasi cendawan patogen per gram tanah mengikuti tingkat kepadatan cendawan yang digunakan Cattelan et al. (1999), yaitu minimal 103 propagul per gram tanah.
Pada pengujian dengan tanah steril, tanah diinokulasi dengan isolat
Pseudomonas. Inokulasi ini dilakukan satu hari setelah infestasi cendawan patogen ke tanah. Isolat Pseudomonas diperbanyak dalam media kaya M26 seperti prosedur yang diuraikan di atas. Kepadatan isolat Pseudomonas yang diinokulasikan ke tanah adalah sebanyak 107 cfu per g tanah mengikuti prosedur Wang et al. (2000). Kecambah kedelai dari hasil inokulasi biji (seperti diuraikan di atas) ditanam pada pot sesuai masing-masing perlakuan, masing-masing 4 tanaman tiap pot.
Penempatan pot percobaan mengikuti rancangan acak kelompok (RAK). Jumlah perlakuan adalah 10 perlakuan, yaitu 8 perlakuan adalah kedelai yang diinokulasi dengan isolat Pseudomonas terpilih, 1 perlakuan dimana kedelai tidak diinokulasi dengan isolat tetapi tanah pada pot diinfestasi dengan cendawan patogen (kontrol positif), dan 1 perlakuan kedelai tidak diinokulasi dengan isolat serta tanah juga tidak diinfestasi dengan cendawan patogen (kontrol negatif). Tiap perlakuan diulang 3 kali (3 kelompok), tiap ulangan terdiri atas 4 pot, dan tiap pot terdiri atas 4 tanaman (Gambar 8). Kadar air tanah pada pot diatur dengan penyiraman harian untuk mendapatkan potensial air tanah (soil water potential) yang setara dengan -0,01 MPa (tanah lebih lembab).
Prosedur pengujian pada tanah non-steril hampir sama dengan prosedur pengujian pada tanah steril seperti diuraikan di atas. Tanah yang digunakan adalah 2 kg per pot. Tanah hanya diinfestasi dengan cendawan patogen mengikuti prosedur Cattelan et al. (1999), sedangkan inokulasi dengan suspensi sel isolat
24
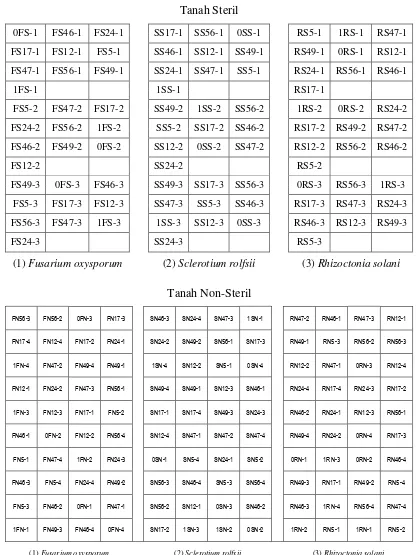
Tanah Steril
0FS-1 FS46-1 FS24-1 SS17-1 SS56-1 0SS-1 RS5-1 1RS-1 RS47-1
FS17-1 FS12-1 FS5-1 SS46-1 SS12-1 SS49-1 RS49-1 0RS-1 RS12-1
FS47-1 FS56-1 FS49-1 SS24-1 SS47-1 SS5-1 RS24-1 RS56-1 RS46-1
1FS-1 1SS-1 RS17-1
FS5-2 FS47-2 FS17-2 SS49-2 1SS-2 SS56-2 1RS-2 0RS-2 RS24-2
FS24-2 FS56-2 1FS-2 SS5-2 SS17-2 SS46-2 RS17-2 RS49-2 RS47-2
FS46-2 FS49-2 0FS-2 SS12-2 0SS-2 SS47-2 RS12-2 RS56-2 RS46-2
FS12-2 SS24-2 RS5-2
FS49-3 0FS-3 FS46-3 SS49-3 SS17-3 SS56-3 0RS-3 RS56-3 1RS-3
FS5-3 FS17-3 FS12-3 SS47-3 SS5-3 SS46-3 RS17-3 RS47-3 RS24-3
FS56-3 FS47-3 1FS-3 1SS-3 SS12-3 0SS-3 RS46-3 RS12-3 RS49-3
FS24-3 SS24-3 RS5-3
(1) Fusarium oxysporum (2) Sclerotium rolfsii (3) Rhizoctonia solani
Tanah Non-Steril
FN56-3 FN56-2 0FN-3 FN17-3 SN46-3 SN24-4 SN47-3 1SN-1 RN47-2 RN46-1 RN47-3 RN12-1
FN17-4 FN12-4 FN17-2 FN24-1 SN24-2 SN49-2 SN56-1 SN17-3 RN49-1 RN5-3 RN56-2 RN56-3
1FN-4 FN47-2 FN49-4 FN49-1 1SN-4 SN12-2 SN5-1 0SN-4 RN12-2 RN47-1 0RN-3 RN12-4
FN12-1 FN24-2 FN47-3 FN56-1 SN49-4 SN49-1 SN12-3 SN46-1 RN24-4 RN17-4 RN24-3 RN17-2
1FN-3 FN12-3 FN17-1 FN5-2 SN17-1 SN17-4 SN49-3 SN24-3 RN46-2 RN24-1 RN12-3 RN56-1
FN46-1 0FN-2 FN12-2 FN56-4 SN12-4 SN47-1 SN47-2 SN47-4 RN49-4 RN24-2 0RN-4 RN17-3
FN5-1 FN47-4 1FN-2 FN24-3 0SN-1 SN5-4 SN24-1 SN5-2 0RN-1 1RN-3 0RN-2 RN46-4
FN46-3 FN5-4 FN24-4 FN49-2 SN56-3 SN46-4 SN5-3 SN56-4 RN49-3 RN17-1 RN49-2 RN5-4
FN5-3 FN46-2 0FN-1 FN47-1 SN56-2 SN12-1 0SN-3 SN46-2 RN46-3 1RN-4 RN56-4 RN47-4
1FN-1 FN49-3 FN46-4 0FN-4 SN17-2 1SN-3 1SN-2 0SN-2 1RN-2 RN5-1 1RN-1 RN5-2
(1) Fusarium oxysporum (2) Sclerotium rolfsii (3) Rhizoctonia solani
Gambar 8. Skema penempatan pot pada pengujian ketahanan tanaman kedelai yang inokulasi dengan Pseudomonas penghasil ACC deaminase terhadap cendawan patogen pada tanah steril (atas) dan non-steril (bawah) di rumah kaca. (FS46-1 = tanah steril yang diinfestasi dengan
Fusarium oxysporum dan Pseudomonas Crb46 pada ulangan 1; FN56-3 = inokulasi tanah steril dengan Fusarium oxysporum dan
[image:47.595.74.491.82.637.2]25
HASIL DAN PEMBAHASAN
Hasil Penapisan Pseudomonas Pemacu Tumbuh Tanaman Kedelai
Hasil pengujian terhadap 81 isolat Pseudomonas penghasil asam indol asetat (IAA) pada media steril kantong tumbuh disajikan pada Gambar 9 sampai dengan 14. Data hasil analisis varian disajikan pada Lampiran 2.
Dari 81 isolat yang diuji, 13 isolat secara nyata meningkatkan panjang akar atau bobot akar atau keduanya, yaitu pada percobaan A, B, C, dan D (Gambar 9 sampai 12). Peningkatan panjang dan bobot akar ini mencapai 50% lebih tinggi daripada perlakuan kontrol (tanpa inokulasi). Ketigabelas isolat tersebut adalah Pseudomonas Crb46 dan Crb49 (Gambar 9); Crb26, Crb47, dan Crb56 (Gambar 10); Crb17, Crb31, dan Crb86 (Gambar 11); Crb5, Crb12, Crb24, Crb53, dan Crb94 (Gambar 12). Pada percobaan E dan F (Gambar 13 dan 14), isolat tidak nyata meningkatkan panjang atau bobot akar dibanding perlakuan kontrol. Pada percobaan F (Gambar 14), sebagian besar isolat yang digunakan cenderung menghambat perkembangan akar kedelai.
28
Gambar 9. Pengaruh isolat Pseudomonas (Crb) terhadap pertambahan panjang dan bobot akar (%) tanaman kedelai umur 7 hari pada percobaan A. Tanda * = berbeda nyata dibanding perlakuan kontrol.
Gambar 10. Pengaruh isolat Pseudomonas (Crb) terhadap pertambahan panjang dan bobot akar (%) tanaman kedelai umur 7 hari pada percobaan B. Tanda * = berbeda nyata dibanding perlakuan kontrol.
*
*
*
0 10 20 30 40 50 C rb3 8 C rb1 C rb1 8 C rb1 9 C rb2 5 C rb2 9 C rb3 3 C rb4 2 C rb4 4 C rb4 6 C rb4 9 C rb6 0 C rb7 4 Se lis ih t e rh a d a p ko n tro l (%)
A
Panjang akar Bobot akar
*
*
*
0 10 20 30 40 50 C rb3 8 C rb3 C rb1 5 C rb1 6 C rb2 1 C rb2 6 C rb2 7 C rb2 8 C rb3 2 C rb3 4 C rb3 5 C rb4 0 C rb4 1 C rb4 7 C rb4 8 C rb5 6 Se lis ih t e rh a d a p ko n tro l (%)
B
[image:50.595.90.478.433.632.2]29
Gambar 11. Pengaruh isolat Pseudomonas (Crb) terhadap pertambahan panjang dan bobot akar (%) tanaman kedelai umur 7 hari pada percobaan C. Tanda * = berbeda nyata dibanding perlakuan kontrol.
Gambar 12. Pengaruh isolat Pseudomonas (Crb) terhadap pertambahan panjang dan bobot akar (%) tanaman kedelai umur 7 hari pada percobaan D. Tanda * = berbeda nyata dibanding perlakuan kontrol.
*
*
*
0 10 20 30 40 50 C rb3 8 C rb2 C rb6 C rb1 3 C rb1 7 C rb2 2 C rb2 3 C rb3 1 C rb4 3 C rb7 9 C rb8 0 C rb8 1 C rb8 5 C rb8 6 C rb1 1 5 Se lis ih t e rh a d a p ko n tro l (%)
C
Panjang akar Bobot akar
*
*
*
*
*
*
*
0 10 20 30 40 50 60 C rb3 8 C rb5 C rb8 C rb1 2 C rb2 4 C rb3 6 C rb3 9 C rb5 3 C rb7 5 C rb7 8 C rb8 3 C rb8 7 C rb9 4 C rb1 1 0 C rb1 1 4 Se lis ih t e rh a d a p ko n tro l (%)
D
[image:51.595.116.511.397.594.2]30
Gambar 13. Pengaruh isolat Pseudomonas (Crb) terhadap pertambahan atau pengurangan panjang dan bobot akar (%) tanaman kedelai umur 7 hari pada percobaan E. Inokulasi Pseudomonas tidak nyata meningkatkan panjang maupun bobot akar.
Gambar 14. Pengaruh isolat Pseudomonas (Crb) terhadap pertambahan atau pengurangan panjang dan bobot akar (%) tanaman kedelai umur 7 hari pada percobaan E. Inokulasi Pseudomonas tidak nyata meningkatkan panjang maupun bobot akar dan isolat cenderung menghambat panjang dan bobot akar.
C rb4 C rb1 4 C rb1 1 2 -40 -30 -20 -10 0 10 20 30 40 C rb3 8 C rb1 0 C rb5 1 C rb5 5 C rb8 2 C rb8 4 C rb9 2 C rb9 3 C rb1 0 2 C rb1 0 4 C rb1 0 9 C rb1 1 3 Se lis ih t e rh a d a p ko n tro l (% )
E
Panjang akar Bobot akar
C rb3 8 C rb9 C rb1 1 C rb2 0 C rb3 0 C rb3 7 C rb4 5 C rb5 0 C rb5 2 C rb5 4 C rb8 9 C rb9 5 C rb1 1 1 -70 -60 -50 -40 -30 -20 -10 0 10 S el is ih ter ha da p ko ntr o l (%)
F
[image:52.595.89.478.418.591.2]31
Aktivitas ACC Deaminase
[image:53.595.168.459.384.644.2]Hasil pengujian aktivitas ACC deaminase terhadap 13 isolat yang mampu memacu pertumbuhan tanaman kedelai di ruang penumbuh disajikan pada Tabel 3 dan Gambar 15. Dari 13 isolat Pseudomonas tersebut, 11 isolat memiliki aktivitas ACC deaminase. Hasil ini ditunjukkan oleh kemampuan isolat tersebut tumbuh dalam media garam minimal Dworkin-Foster (DF) baik yang diperkaya dengan amonium sulfat maupun dengan ACC sebagai sumber nitrogen (Gambar 15). Aktivitas ACC deaminase juga ditunjukkan oleh nilai kerapatan optik (600 nm) 0,05 atau lebih dalam media DF yang diperkaya ACC yang mengindikasikan bahwa isolat mampu mendegradasi substrat ACC sebagai satu-satunya sumber N. Pada media garam minimal DF tanpa sumber N tidak ada isolat yang mampu tumbuh yang mengindikasikan bahwa isolat tidak tergolong bakteri diazotrof yang dapat menambat N2 udara.
32
Tabel 3. Aktivitas ACC deaminase pada media garam minimal Dworkin-Foster (DF) ditambah amonium sulfat dan ACC sebagai sumber N.
No. Pseudomonas IAA
(µg ml-1)*
Aktivitas ACC deaminase
DF+ACC cair (OD600)a
DF+ACC agarb
DF+AmS agarb
1 Crb5 12,75 0,054 + +
2 Crb12 6,68 0,057 +/- +
3 Crb17 16,02 0,064 + +
4 Crb24 15,16 0,056 + +
5 Crb26 12,53 0,061 +/- +
6 Crb31 5,45 0,014 - -
7 Crb46 15,80 0,067 + +
8 Crb47 10,36 0,073 + +
9 Crb49 16,19 0,096 +/- +
10 Crb53 16,90 0,057 + +
11 Crb56 18,47 0,101 + +
12 Crb86 6,31 0,011 - -
13 Crb94 1,13 0,051 +/- +
14 Crb38 0,0 0,111 +/- +
Keterangan:
* = Data hasil penelitian Wahyudi et al. (2007)
a
Berdasarkan nilai kerapatan optik pertumbuhan isolat dalam media cair garam minimal DF + ACC pada 600 nm menggunakan UV spectrophotometer. Kerapatan optik > 0,05 mengindikasikan aktivitas ACC deaminase (Wang et al. 2000).
b
33
Data pada Tabel 3 memperlihatkan bahwa 2 dari 13 isolat terpilih, yaitu
Pseudomonas Crb31 dan Crb86, tidak memiliki aktivitas ACC deaminase. Namun kedua isolat ini mampu meningkatkan panjang atau bobot akar kedelai. Kemampuan kedua isolat ini memproduksi IAA relatif rendah dibanding isolat lainnya, yaitu masing-masing 5,45 dan 6,31 µg ml-1 (Tabel 3). Hasil ini mengindikasikan bahwa IAA yang dihasilkan oleh kedua isolat ini diduga tidak cukup tinggi untuk memicu biosintesis hormon etilen yang dapat menghambat perkembangan akar. Pada bagian lain, Pseudomonas Crb38 yang memiliki aktivitas ACC deaminase, namun bukan penghasil IAA, juga tidak mampu meningkatkan panjang dan bobot akar. Hasil ini mengindikasikan bahwa terdapat peran fisiologis ACC deaminase dalam mengoptimalkan fungsi IAA dalam memacu pertumbuhan kedelai seperti diuraikan oleh Glick at al. (2007).
Hasil penelitian tentang keterkaitan hormon IAA dengan etilen dalam meningkatkan pertumbuhan tanaman sudah banyak dihasilkan dan dibahas. Hormon IAA merangsang proliferasi dan pemanjangan sel tanaman. Namun, IAA juga memicu terbentuknya enzim ACC sintase yang mengubah senyawa S-adenosylmethionine (AdoMet) menjadi ACC yang selanjutnya dioksidasi menjadi etilen oleh ACC oksidase (Kende 1993). Sebagai hormon senesen, etilen berperan penting dalam mempercepat proses pembungaan dan pematangan buah. Namun, peningkatan konsentrasi etilen pada awal pertumbuhan vegetatif justru menghambat perkembangan akar (Glick 1995; Mayak et al. 1997; Shah et al. 1997). Dengan adanya bakteri penghasil ACC deaminase di lingkungan rizosfer, ACC yang diproduksi dan dikeluarkan akar atau biji tanaman, mengikuti proses kesetimbangan antara ACC di dalam dan di luar jaringan tanaman seperti diuraikan oleh Glick et al. (1998), akan didegradasi oleh bakteri. Degradasi ACC secara terus menerus oleh bakteri penghasil ACC deaminase akan menurunkan sintesis hormon etilen dalam jaringan akar, sehingga peran hormon IAA dalam meningkatkan perkembangan akar tidak terganggu.
34
penghasil ACC deaminase dalam lingkungan akar yang mampu mendegradsai ACC, sehingga konsentrasi ACC dan etilen meningkat. Dari hasil uji in planta
dan uji aktivitas ACC deaminase secara in vitro seperti diuraikan di atas diperoleh 11 isolat Pseudomonas penghasil IAA yang mampu menghasilkan ACC deaminase dan meningkatkan panjang dan bobot akar kedelai. Kesebelas isolat tersebut adalah Pseudomonas Crb5, Crb12, Crb17, Crb24, Crb26, Crb46, Crb47, Crb49, Crb53, Crb56, dan Crb94 yang selanjutnya diuji kompatibilitasnya dengan bakteri bintil akar rhizobia.
Uji Kompatibilitas Pseudomonas dengan Rhizobia
Hasil pengujian kompatibilitas isolat Pseudomonas dengan 2 isolat rhizobia lokal Bradyrhizobium japonicum Bj11 dan Sinorhizobium fredii Rif5 disajikan pada Tabel 4 dan Gambar 16.
Dari 11 isolat Pseudomonas penghasil ACC deaminase, 3 isolat bersifat antagonis terhadap salah satu atau kedua bakteri bintil akar B. japonicum Bj11 dan S. fredii Rif5. Isolat Pseudomonas Crb26 menghambat perkembangan B. japonicum Bj11, isolat Crb53 agak menghambat perkembangan S. fredii Rif5, dan isolat Crb94 menghambat perkembangan kedua bakteri bintil akar (Tabel 4). Reaksi penghambatan isolat Pseudomonas yang menjadi indikasi aktivitas anti rhizobia (sifat antagonis) ditunjukkan oleh zona terang di sekeliling koloni isolat
Pseudomonas yang ditumbuhkan bersama dengan rhizobia pada cawan agar King’s B (Gambar