PENGARUII SUPLEMENTASI PMSG DAN hCG PADA PROSES FERTlLlSASI IN MTRO DAN KULTUR
KLON EMBRIO SAP1 DENGAN IGF-I
Oleh
Machammad Sasmito Djati 92536/BIO
PROGRAM PASCASARJANA INSTITUT PERTANIAN BOGOR
THE EFFECT OF SUPLEMENTATION O F PMSG AND hCG ON IN VITRO FERTILIZATION AND IGF-I ON CLONE BOVINE EMBRYO CULTURE
Mochamrnad Sasmito Djati
(Under supervision of H-Yuhara Sukra. EI-Soewondo Djojosoebagjo, Syahrun Hamdani Nasution,Bambang Purwantara,H.Ahmad Ansori Mattjik)
ABSTRACT
The objectives of this study were to examine the combination effect of PMSG, hCG and FCS on maturation of bovine oocyte, fertilization. and in vitro embryo development and suplementation o f IGF-I in cloned demi-embryo culture medium.
Oocytes were aspirated and selected according to the quallt? of oocytes. The basic medium used for oocytes in vitro maturation (IVM) and embryo development (IVD) was TCM 199. This medium was suplemented by either 10 % FCS. 10 IU PMSG, 10 IU hCG or their combination. The maturation period was 22 to 24 hours. Incubation was done at 39°C and 5 O h C 0 2 in humidified air. Matured oocytes were evaluated base on cumulus expansion and nuclear transformation. Capacitation, acrosomc reaction and viability of sperm were evaluated by sperm CTC staining method and tert~lization rate were evaluated by aceto orcein method. IVD was suplemented by the combination of 10% FCS, 3 IU PMSG and 3
ILT
hCG. Bovine embryo were microsurgically bisected and resulting in zona free clone demi-embroys.The results of these experiments indicate that the suplcmentation of 10 % FCS, I0 IU PMSG, and 10 IU hCG showed the highest maturation raic.96.8 % of cumulus enclosed were fully expanded and 88,l % reached metaphase 11. Modified BO heparin-caffeine with 37 mM concentration of NaHC03 had an effect on sperm penetrabilty (p<0,01). However, capacitation and acrosome reacted sperm pattern were not affected by the presence of cumulus cell (p>0,05). When cumulus enclosed oocytes were fertilized and incubated, high proportion of oocytes were penetrated by spermatozoa (91%) and there was low proportion of polyspemic evidence (26,4%), in contrast denuded oocytes showed high proportion of polyspemic evidence (44,4 %). It was found that spermatozoa has the ability to penetrate oocytes within 2 hours of incubation. Furthermore, it was also found that 8 hours of incubation that support penetration rate of 90,3 % yields cleaving rate of 90,O % after removing in IVD.The result indicates that TCM 199 suplemented by 10 % of FCS, 3 IU PMSG and 3 IU hCG under cumulus cells coculture system can support the development of embryo reach blastocysts stage (3 1,3 %). This showed the highest viability
as compare to other combination. The best way to produce a pair of clone demi-embryos was microsurgically at blastocysts developmental stage of embryo and cultured in TCM
199 suplemented by IGF-I and FCS or FCS suplemented only.
MOCEAMMAD SASMITO DJATL 1998 .Pengar& Suplementasi PMSG dan hCG Pada Proses Fertilisasi In Vitro hCG Dan Kultur klon Embrio Sapi Dengan IGF-I. Dibawah bimbingan El-YUHARA SUKRA sebagai ketua. H. SOEWONDO D.SOJOSOEBAGJ0 (almarhum), SYAHRUN HAMDANI
NASUTION,
BAMBANG PURWANTARA, dan H. A. ANSHORI MATIrJIK sebagai anggota.Sapi merupkan salah satu jenis ternak yang telah memberikan kontribusi besar guna memenuhi kebutuhan protein hewani masyarakat Indonesia Peran sapi semakin penting, karena meskipun masih dalam keadaan laisis ekonomi kebutuhan daging maupun susu diperkirakan masih cukup tinggi. Kebutuhan
akan
sapi tersebut kurang diimbangi produktifitas sapi-sapi Indonesia, sehingga Indonesia mengimpor sapi baik berupa bakdan, bibit sapi perah maupun susu. Kondisi sernacam iniharus
segera diatasi, agar kondisi tidak menjadi lebih buruk.Salah satu dtematif untuk mengatasinya adalah memanfatkan teknologi rekayasa biologi. Menurut Sukra (1986) salah satu bagim dari rekayasa biologi adalah teknologt manipulasi embrio. Teknologi manipuiasi embrio yang paling s e d e r b adalah pembuatan klon embrio, yaitu teknik kloning sederhana untuk membuat embrio kembar identik. Pernanfaatan teknologi ini dapat meningkatkan stok embrio dengan kualitas k e u n d a n sama dengan tetua. Peningkatan embrio bibit unggul diharapkan dapat meningkatkan pasokan embrio kepusat-pusat embrio transfer, sehingga dalam jangka panjang produksi daging dan susu dapat meningkat secara esensial. Disamping itu telmologi ini juga &pat dimanfaatkan pada teknologi sexing, yaitu dengan memadaatkan sebagian sel-sel embrio
untuk d i d i s i s dengan kariotiping atau PCR, sedangkan bagian yang lain dibekukan dan ditransfer sesuai dengan jenis kelamin yang dikehendaki (Hochman dkk., 19%). Aplikasi penentuan jenis kelarnin ini mem* perencaman pembanguam berdasarkan struktur populasi ternak.
Teknologi manipulasi embrio membutuhkan embrio berkualitas baik, sehingga diperlukan teknik-teknik fertilisasi in vitro yang &pat menghasilkan embrio-embrio siap di rnani~ulasi. Meski~un hasil peneiitian fertilisasi in vitro pada hewan percobaan maupun sapi kenunjukkan-perkernbanw yang cw berarti, t A p i penera- a pada teGak- ternak sam modukt~f keberhasxlannva relahfmasib belum memuaskan. Zendala a~likasi fertilisasi' i; vitro adalah pem& oosit (Kanagawa
dkk.,
1989; Tervit, -1991; Pinyopwnintr dan Bavster, 1991) dan kttpasitasi sperma reaksi-om
( Fraserdkk.,
1995; Niwa dkk., 1992; Wang dkk., 1992) serta fenomena sel blok pada kdtur pertumbuhan embrio (Sparks
dkk.,
1992; McGinnins dan Youngs,1992).
Sedangkan pada kuitur Mon embrio masalah utama adalah adanya cekamm dan pemrdihan kondisi sel-sel blastomer ataupun inner cell mass yangrusak
akibat adanya penyayatan emtnio (William dkk., 1985; Baker dm Shea, 1985; Takeda dlck.,1985; Gray dkk., 1991; Kippax dkk.,1991).
penelitian ini dicobakan pendayagunaan PMSG dan hCG sebagai gonadotropin yang lebih
murah untuk pematangan oosit dan pertumbuhan embrio.Modifikasi BO sebagai medium
FIV serta peranan sel-sel kumulus pada
saatFIV.Disamping itu perlu metode kultur klon
embrio dengan berbagai modifikasinya dan pemanfaatan IGF-I dan FCS pada medium
Lultur, sehingga akan dihasilkan klon embrio siap alih.
Penelitian dilakukan selama 27 bulan dari bulan Februari 1996 sampai dengan
April 1998 dilaksanakan di
Animal Reproduction Luboratoty, Division ofAnimal
S - '
c~ence
und 7'eclmology. Fucul/y of Agrrculrure.
Okayama
UniversiN
Japan
dan
dilanjutkan di
Laboratorium Sentral Biologi Molekuler dan Seluler Universitas Brawijaya Malang.
Oosit yang digunakan dalam penelitian ini berasal
dari:
Japanese Black, Japanese
Hntwn,
F H
yang berasal dari Rumah Potong Hewan di Okayama. Semen beku adalah
semen
./upnese Bluck
yang diperoleh dari Okayama
Animal Husbandry Research Station.
Disamping itu digunakan pula oosit yang berasal dari PFH dari
Rumah
Potong Hewan
Malang dan Semen Beku FH yang diperoleh dari Balai Inseminasi Buatan (BIB) Singosari.
Malang. Peralatan inkubasi digunakan inkubator
C025 persen dengan kelembaban
maksimum (sekitar 95 persen). Pewarnaan oosit untuk pengamatan transfomasi inti
clan
angka penetrasi menggunakan asetoorcein, pengamatan dilakukan dengan menggunakan
mikroskop inversi sedangkan pewarnaan sperma dengan menggunakan pewarnaan CTC
pengamatan digunakan mikrokop fluoresensi Medium koleksi ovarium adalah NaCl
fisiologis dengan penambahan penicilin 100 IU/ml dan streptomisin 100 lU/ml. Medium
dasar yang digunakan dalam pematangan oosit dan pertumbuhan embrio serta kultur
embrio adalah TCM 199, sedangkan untuk fertilisasi adalah medium BO kafein-heparin
(Niwa, 1991). Suplemantasi medium adalah PMSG dan hCG pada medium pematangan
oosit masing-masing 10 IUIml, pada medium pertumbuhan embrio
3
N/ml, pada kultur
klon embrio dengan IGF-I rekombinan IOngIml dan FCS.
Ovarium dibawa dari RPH ke laboratorium dengan menggunakan medium koleksi
ovarium &lam suhu 25-35°C &lam waktu 2-3 jam. Oosit diaspirasi dengan menggunakan
jarum dan di cuci serta diseleksi dengan menggunakan medium Pematangan sesuai dengan
perlakuan, dikultur dengan menggunakan medium &lam bentuk tetesan (drop) yang
ditutup dengan parafin oil dan diinkubasikan selama 24
jam.
Evaluasi pematangan oosit
dilakukan dengan pengamatan ekspansi sel-sel kumulus dan transformasi inti setelah oosit
diwarnai dengan metode asetoorcein (Niwa dkk., 1991).
Semen beku setelah dithawing dan disentrifugasi, diinseminasikan kedalam tetesan
BO-heparin-kafein yang berisi oosit, kemudian diinkubasikan selama 8 jam atau sesuai
dengan perlakuan. Angka penetrasi dapat Qamati dengan metode pewarnaan aseto-orcein
seperti yang dilakukan oleh Niwa (1992). Sedangkan kapasitasi
dan
reaksi akrosom diamati
dengan menggunakan metode pewarnaan spema CTC seperti yang dikembangkan oleh
Fraser dkk.(1995).
W i p u l a s i embrio digunakan metode manipulasi tanpa menggunakan pipet holder, penyayatan embrio dilakukan dengan membuat torehan salib sumbu pada bagian
dasar
cawan petri sebagai tempat kedudukan embrio, penyayatan dilakukan ditempat kedudukan tersebut dengan menggunakan microblade sehingga embrio morula dan blastosis menjadi dua bagian yang sama besar. Setelah dikultur selama 24 jam klon embrio dievaluasi dan dimasukan dalam katagori I (istimewa),II
(cukup), dan III(degenerasi). Medium kulturyang digunakan dalam kultur embrio adalah TCM 199, FCS 10 persen dan (1GF)-I 10 ng/ml.
Data dianalisis dengan menggunakan Rancangan Acak Lengkap seperti yang dikernukakan oleh Steel dan Torrie (1987) yaitu untuk menganalisis angka pematangan oosit
dan
angka-an& fertilisasi. Sedangkan untuk menganalisis percobaan pertumbuhan embrio dan klon embrio digmidcan analisis profil seperti yang dilakukan oleh Momson (1976).Hssil percobaan seleksi oosit dengan mengklasifikasikan oosit menjadi A, B, C, dan D menunjukkan bahwa oosit yang dapat digunakan claim percobaan ini adalah oosit &lam Mas A dan B saja, oosit tersebut bila dikultur selama 24 jam, 90,2 persen
dan
90,3 persen mencapai metafase 2. Sedangkan apabila oosit A dan B dikultur bangsa maupun kondisi Iingkungan tidak memberikan pengaruh yang nyata (*0,05) terhadap pematangan oosit.Suplementasi PMSG dan hCG pada medium pematangan memberikan pengaruh
yang nyata terhadap ekspansi kumulus (p-=0,05) yaitu 96,7 persen dari sel-sel kurnulus akan terekspansi secara sempurna. Menurut Lu dkk. (1987) ekspansi sef-sel kumulus ini akibat dari -&atan CAMP intraseluler untuk mengaktiflcan resumsi meiosis. Demikian pula pada proses transformasi inti oosit, kombinasi PMSG dan hCG dengan konsentrasi masing-masing 10 IUIml merupakan kombinasi terbaik dibandingkan penarnbban PMSG atau hCG saja, yaitu transformasi inti oosit mencapai tithap metafase 2 dengan medium tersebut sebesar 88,I pers.cn. Proses pematangan oosit mempakan proses meiosis ysurg
diawali dengan segregasi kromosom (kondensasi DNA) pada spindel meiosis yang bersifat haploid dari perkursor garnet yang bersifat diploid (Whitaker, 1996). Masalah yang sering dihadapi &lam kultur pematangan oosit adalah adanya faktor pengharnbat meiosis yaitu
OM1 (Oocyte mumration inhibitor), OM1 merupakan polipeptida yang b e r m &lam menghambat transformasi inti oosit secara in vivo (Ookata dkk;1992), tetapi sel-sel kumullts aasih mensekresi OM' pada saat in vih.0 disekresi sel-sel kumulus (Tsafriri clkk., 1975; Sat0 dan Ishibashi, 1990). Menurut Tsafiiri (1988) untuk mengumngi peran O M secara in vitro perlu ada penambabn FSH
pada
medium kultur. Sedangkan menurut pen&pat Talamantes dan Ogren (1988) peran FSH dapat digantikan oleh PMSG karena 90 persenPMSG clan FSH bersifat homolog, perbedam Mya 14 peptida asatn amino yang terpasang
pada a-FSH, sedangkan f3-hCG 80 persen homolog dengan PLH.
Hasil penelitian menunjukkan bahwa konsentrasi NaHC03 dalam medium 30 ideal -prig diperlukan untuk menunjang proses firtilisasi adalah 37rnM, kondisi ideal ini
larutan penyangga. dengan adanya komponen penyangga ini proses fisiologis sel dapat berlangsung secara normal, sehingga memungkinkan terjadi influx ca2+ k e d a h spermatozoa (Lee dan Storey, 1986), reaksi akrosorn dan hiperaktifasi (Neil1 dan Olds- Clarke, 1987). Hasil penelitian ini juga ditunjang dari percobaan angka penetrasi sperma terhadap oosit, dimana Larutan 30 dengan konsentrasi NaHCO, 37 rnM terdapat 92.3 persen oosit terpenetrasi, sedangkan untuk 21 mM dan 45 m M secara berturut-turut adalah 72.2 dan 71,1 persen oosit terpenetrasi.
Lama inkubasi sperma--it d a m medium FIV terbaik adalah 8 jam, karena pa& masa tersebut terjadi proses kapasitasi, reaksi akrosom sperma, pematangan oosit, penetrasi sperma terhadap oosit dan pembentukan pronukleus jantan dan betina (Niwa dkk.,
1991; Abeydeera, 1994; Clarke dan Matsui, 1986). Dari hasil penelitian rnenunjukkan bahwa sejak 2 jam di inkubasi sudah terjadi proses penetrasi sperma terhadap oosit (14,lpersen), meningkat setelah 5 jam dan 8 jam yaitu sebesar 60 persen dan 90,3 persen, tetapi apabila inkubasi dilanjutkan 1 1 jam dan 14 jam tidak menunjukkan peningkatan yang nyata yaitu 89,s dan 91,5 persen. Lama inkubasi sperma-oosit dalam medium FIV
juga memberikan efek yang nyata pada kultur embrio pasca fertilisasi ( ~ O , 0 5 ) , embrio yang berasal dari sistim lama inkubasi 2 jam pertumbuhannya terhenti pada tahap pertumbuhan 8 sel, sedangkan sistim lama inkubasi sperma-oosit 5, 8, 11 dan 14 jam mencapai tahap perkembangan blastosis yaitu sebesar 21,7 persen, 36,7 persen, 6,6 persen dan 8,6 persen. Menurut Kaye (1986) diperkirakan sistim lama inkubasi lebih dan 8 jam mengakibatkan pertumbuhan ganggum terhadap embrio, karena kebutuhan nuhisional dan lingkungan yang tidak memenuhi syanrt untuk perkembangan embrio pada medium FIV. Menurut Niwa dkk. (1991) lama inkubasi sperma- omit selama 8 jam memberikan kesempatan pada spermatozoa melakukan penetrasi terhadap oosit secara sempuma.
Apabila sperma di inkubasi dengan oosit berkumulus penuh, 2/3 dan 1/3 serta tanpa sel-sel kumulus menunjukkan pola kapasiwi dan reaksi akrosom yang berbeda (+,05), data ini menunjukkan bahwa sel-sel kumulus mempunyai peranan dalam proses kapasitasi dan reaksi akrosom (Salustri dkk., 1992). Hal ini disebabkan karena sel-sel kurndus kaya
akan hyaluronidase (Veselsky dkk., 1992). disisi lain sel-sel kumulus mempunyai peran dalam mengharnbat terjadinya polispermi, dimana oosit tanpa sel kumulus mengalami kejadian polispermi terbanyak (44,4 persen).
Suplementasi FCS, PMSG
dan
hCG dengan sistim kokultur sel-sel kurnulus memberikan pengaruh nyata pada pertumbuhan embrio *0,05) dan juga menghasilkan angka blastosis tertinggi (31,3 persen). DiperkirakaTl sel-sel kumulus mempunyai peran dalam katabolisme glukosa, menurut Kreshner dkk, (1989) peran sel kurnulus memberikan kontribusi perkembangan embrio melewati sel blok.Dari hasil diketahui teknik terbaik dalam rnembuat klon embrio adalah
PENGARUH SUPLEMENTASI
PMSG
DAN hCG PADA
PROSES FERTILISASI
IN
VITRO
D A N KULTUR KLON
EME3RTO
SAP1
DENGAN IGF-I
Oleh
Mocharnmad Sasmito Djati 92536BIO
Disertasi sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Biologi
Program Pascasarjana,Institut Pertanian Bogor.
P R O G R A M PASCASARJANA
IN STITUT
PERTAN IAN
BOGOR
Judul :PENGARUH SUPLEMENTASI PMSG DAN hCG PADA PROSES FERTILISASI IN WTRO DAN KULTUR KLON EMBRIO SAP1 DENGAN IGF-I
Nama Mahasiswa :Mochammad Sasmito Djati Nomor pokok :92536/BIO
Menyetujui: K OPembimbing ~
-
(Prof.Dr.H.Yuhara Sukra,M.Sc.)Ketua
(Dr.Syahrun Hamdani Nasution) (Dr.Bambang Purwantara,M.Sc.)
Anggota Anggota
@r.Ir.H.A.Ansori Mattjik,M.Sc.) Anggota
Ketua Program Studi Biologi
RIWAYAT EIDUP
MOCHAMMAD SASMlTO DJATI, lahir di Yogyakarta pada tanggal 4 Maret 196 1, dari pasangan ayah Drs.KSoedarpo Mas'udhy Mustari dan ibu Rr Soekiniwati Ermi Darmani.
Penulis mengikuti pendidikan sekolah dasar di SDN Jember Kidul 11 tamat 1973, SMPN IV Surabaya tamat 1976 dan SMAN V I Surabaya tamat 1980. Kemudian penulis meneruskan pendidikan di Fakultas Peternakan Universitas Brawijaya OJNEBRAW) dan memperoleh geiar insinyur pada Agustus 1986. Pada 1987 mengikuti pendidikan pascasarjana S2 di Fakultas Pascasajana Universitas Padjadjaran ( W A D ) memperoleh gelar Magister Sains pa& tahm 1990. Sejak 1992 penulis melanjutkan studi Program S3 di Program pascasajana IPB, Program Studi Biologi, melalui program sandwich penulis melakukan penelitian disertasi di Universitas Okayama Jepang pada 1996-1997.
Beberapa pengalaman penulis semasa menjadi mahasiswa S1 di UNIBRAW, adalah: Wakil Ketua BPM (Badan Perwakilan U i s w a ) 1980-1982 clan Ketua umum
BPM 1982-1984, Ketm umum Unit Akiifitas Perguruan Seni Bela diri Indonesia "Tapak
Suci", Ketua Asrama Mahasiswa 1984-1985. Di Bidang olahraga penulis pemah menjadi Pesilat Teladan pada porseni rnahasiswa 1981, beberapa kali menjadi juara di dalam kejuaraan mahasiswa maupun &wasa putra dari berbagai kelas yang be- dan terakhir menjadi Juanr III nasional kelas 75 kg dewasa pufra pada Kejurnas Perguruan Seni Bela Diri "Tapak Suci" pa& tahw 1986 di Surabaya.
Karir kerja di rnulai pada 1990, yaitu sejak penulis diangkat menjadi dosen tetap ai Badan Penelitian dan Pengabdian pada Masyarakat (BPPM) Universitas Muhammadiyah Jember. Sejak 1994 penulis kembdi ke almamater diangkat menjadi pegawai negeri di lingkungan FMIPA jutusan Biologi, UNIBRAW.
Pada tahun 1990 penulis menikah dengan Dra Rustaningsih Mulyono dan kini di karuniai seorang putri yang diberi nama Nabilah Azzahra Jatiatmaja. Pada saat ini penulis beserta istri &m seorang tinggal di J1 Rogonoto 150 Singosari
Maim
Telp/Fax (034 1)450724.UCAPAN TERLlMAKASIH
Puji syukur yang sangat dalarn ke hadirat Allah swt, karena hanya dengan l i m m a n kasih sayangnya penulis dapat menyelesaikan serangkaian m d i yang hams ditempuh unhrk menyelesaikan program pendidikan S3 di Program Pascasajana lnstitut Pertanian Bogor.
Pada kesemparan ini penulis ingin sampaikan ucapan terirnakasih kepada ketua komisi pembimbing yaitu Bapak Prof Dr.H. Yuhara Sukra. M.Sc., sebagai ketua komisi beliau telah mernberikan perhatian yang sangat besar terhadap proses pendidikan 53 penulis, perhatian beliau bukan hanya curahan waktu dan tenaga saja, tetapi juga memprakarsai penulis untuk mendapatkan beastswa program Sarrdwhich dari
ALEJ
(Associaiion of l~ernafzonal Ed-ion, Japun) dari pemerintah Jepang. tanpa adanya
sarana ini suiit rasanya penulis akan berhasil menjalani proses penelitian ini
.
Disamping itu ada ha1 yang menarik dari beliau, sebagai seorang guru besar, beliau mempunyai panclangan dan wawasan yang cukup Iuas, sehingga menurut hemat penulis beliau mempakan figur yang patut diteladani bagi para dosen dan peneliti mu&.Selanjutnya penulis ucapkan terimakasih kepada almarhum bapak Prof Dr. H. Soewndo Djojosoebagdjo meskipun beliau tidak &pat meny&ikan penulis menyeiesaikan studi tetapi saran maupun perhatian beliau cukup berarti bagi penulis. Begitu pula penulis ucapkan tezima kasih cian penghargaan yang setinggi-tingginya kepada
Tidak lupa pula penulis juga ucapkan penghargaan clan terimakasih pada semua staf Iaboratorium Embriologi
FKH
IPB sepem. Ibu drh. Ita Djuwita. M.Phil., drh. M. Fachrudln yang telahbanyak
rnembantu penulis pada saat awal penelitian berlangung.Penulis juga sampaikan ucapan terima kasih dan pengkgaan khusus kepeda Sensei Prof Dr. Koji Niwa, guru besar di Fakultas Pertanian Universitas Okayama, Dr Iliroaki Funahashi, Dr Kiyoshi Okuda serta seIuwh teman-teman di laboratorium reproduksi he\\an Universitas Okayama seperti Kasoke Iga, Ken Sawai, Chikage Nobuoka, Park Kwang Hook, Choi S u n Ho, Oh Seh Hoon, Song Xue Xiong d m semuanya yang belurn sempat
saya sebutkan namanya, atas segala bantuannya di laboratorium dan di Rumah Pntang Hewan Okayama, serta keakraban mereka diluar kegiatan penelitian, membuat penulis banyak belajar dari mereka baik dari segi etos keja, ketelitian kerja dan banyak ha1 lain yang cukup berarti bagi penutis.
Talc lupa penulis ucapkan banyak terima kasih kepada Bapak D r Sutiman B. Sumitro yang telah mernberikan sarana laboratorium pada saat penulis melanjutkan penelitian di FMPA UNIBRAW, dan beberapa teman sejawat yang membantu proses penelitian say% sehingga proses penelitian dapai berlangsung dengan baik.
Penghargaan setinggi-tingginya juga penulis sampaikan kepada bapak Ir. Dm. A.
Asri Harahap, Ketua Yayasan pembinaan Masyarakat Islam, atas segala bantuan yang tulus
Selanjutnya penulis mengucapkan terirna kasih kepada Team Manajemen Program
Doktor (TMPD) Ditjen Dikti, dimana penulis sejak 1995 hingga saat ini telah memberikan
beasiswa kepada pcnulis. Demikian pula kepada Rektor lPB, Direktur Program Pascasarjana dan Ket ua Program Studi Biologi, serta staf pengajar IPB, karyawan, maupun
segenap keluarga bssar IPB .
Tak lupa pula penulis ucapkan banyak terima kasih pada pengurus Lembaga
Swadaya Masyarakat PHP (I'euce Happiness und Prosperity) terutama bapat Robert
J.Wargo, yang telah mernbantu finansial penulis dalarn penyelesaian akhir disertasi ini.
Terakhir dan tcristimewa kepada seluruh sanak keluarga, Ayah dan Bunda yang
selalu rnernbesarkan penulis dengan penuh kasih sayang serta Istri tercinta yang telah
berkorban sedcm~kian besar derni keberhasilan studi penulis, begitu pula sikecil Nabilah
yang lahir tatkala penulis sedang sibuk-sibuknya penelitian, semua pengorbanan mereka
DAFTAR IS1 ... ABSTRACT ... RINGKASAN ... RIWAYAT HIDUP ...
UCAPAN TERIMAKASI t l
... DAFTAR IS1 ... DAFTAR TABEL ... DAFTAR GAMBAR ... DAFTAR LAMPIRAN ... PENDAHLILIJAN
Latar belakang ... . .
Tujuan penelltlan ... . .
Manfaat penel~t~an ... Hipotesis ...
...
TINJAUAN PUSTAKA
Pertumbuhan gamet. fenilisasi. dan c . l e v r ~ . r r ~ c . ... ... Pertgrnbuhan garnet
Oosit ... ... Spermatozoa
. . .
Fert~llsas~ ... Kapasitasi dan reaksi akrosom ... Proses masuknya spermatozoa k e dalam oosit ...
C.leuvuge ... Terjadinya kernbar identik alamiah ... Pematangan garnet. fertilisasi. dan pertumbuhan embrio in
... virro
...
Pematangan oosit in vitro (PIV)
Kapasitasi dan reaksi akrosom spermatozoa in vitro ... ... Fertilisasi in vitro {FZV,
... Pertumbuhan embrio in vitro
Bahan-bahan yang diperlukan dalam medium kultur in vilro ...
...
Karbohidrat
... Asam amino
Faktor penumbuh ... ... Gonadotropin
Lemak ... ... Zat-zat bioaktif lainnya
... Serum
Mineral dan unsur jarang ...
Halaman 1 . . i i vii ...
V l l l X I
xiv
x \'
Pemanfaatan sel-sel kumulus dalam sistim kokultur ...
Embrio kembar buatan (Kloning embrio) ...
MATERI DAN METODE PENELITIAN ...
Tempat percobaan ... Percobaan pendahuluan ... Percobaan pematangan oosit, fertilisasi, dan perturnbuhan embrio in
virro ...
Percobaan pembuatan klon embrio ...
Pelaksanaan percobaan ... . .
Materi penel~t~an ...
. .
Metodologi penel~t~an ...Tahap I : Percobaan pematangan oosit ... ...
Persiapan pembuatan medium
...
Klasifikasi ovarium
Koleksi ovarium ...
. .
... Asp~rasi oosit
... Evaluasi pemetangan oosit
... Tahap II : Percobaan fertilisasi i17 vifro
... Medium fertilisasi in . . . vitro
... Fert111sas1 in vifro
Evaluasi sperma ... ... Evaluasi penetrasi sperma terhadap oosit
... Tahap 111 : Percobaan pertumbuhan embrio in virro
... Medium pertumbuhan embrio
... Tahap IV ~Percobaan pembuatan klon embrio
...
Medium manipulasi embrio
... Medium kultur klon embrio
...
Pembuatan klon embrio
. . .
.
...
Analisls s a t ~ s t ~ k a
HASIL DAN PEMBAHASAN ... Pematangan oosit in vilro ...
Pengaruh perbedaan kualitas oosit terhadap pematangan in ... virro
Pengaruh perbedaan bangsa sapi terhadap pematangan oosit in vitro ... Pengaruh musim terhadap oosit in vitro ... Pengaruh suplementasi PMSG dan hCG terhadap ekspansi ... sel-sel kumulus dan transformasi inti in vifro
Fenilisas~ in vitro
...
Pengaruh NaI-ICQ3 pada medium fertilisasi in vitro Pengaruh lama -iakubasi sperma-oosit pada medium
Pengaruh keberadaan sel-sel kumulus pada saat fertilisasi in
vilro.
..
..
. . ..
. .. . .
. . .. . .
. . ..
. . .. .
.. . .
. . ..
. .... . .
.
.. Perturnbuhan ernbrio in vilro ...Pengaruh suplementasi PMSG dan hCG untuk
perturnbuhan dengan sistem kokultur ... .. . Kultur klon ernbrio ... . .
Kultur klon embrio yang berasal dari embrio dengan tahap perkembangan dan kondisi medium yang berbeda ...
KESIMPlIl,AS DAN SARAN
Kcslmpulan.. .. . . .. . . . ... . . .. . . .
.
. .. ... . ... . . . .. . . .. . . ... . ... .... .... .. .
. .... . . . ..... .
... .
. .DAFTAR TABEL
No Teks
1 Pengaruh keberadaan sel-sel kumulus pada oosit pada saat pematangan oosit terhadap tingkat fertilisasi (hawk,dkk., 1 992).
...
....
... .. . .... . . . .. . . .. . .
2 Konsumsi oksigen dan konsentrasi CAMP dalam spermatozoa sapi sesaat sebelum clan sesudah inkubasi dengan kokultur dan tanpa sel-sel epitel sapi (White,dkk.,l992) ...
.
... . ... .... . . ....
3 Prosentase pembelahan embrio sapi yang dihasilkan melalui fertilisasi in vitro dengan kokultur sel-sel ephitel ovidak
(Xu,dkk., 1992). ... ... .
.
.. . . ... . . .... . . ....
.... .
. . ... ....
... . ...4 Pengaruh serum fetus sapi terhadap kejadian penetrasi sperrna pada oosit in vitro (Widt dkk., 1992) ...
5 Tingkat kebuntingan sapi dara dan induk resipien hasil transfer embrio paruh dua buah embrio perempatan (Brebbacka, dkk.,1992) ... . ... . Desain perwbaan pematangan oosit ... ...
.
... ..
Desain percobaan tingkat penetrasi oosit .... .
... ... . ... Kondisi viabilitas sperma, sperma terkapasitasi, reaksi akrosom sperma..Lama inkubasi terhadap angka penetrasi sperma pada oosit ... Tingkat penetrasi sperma terhadap oosit dengan kondisi sel kumulus berbeda.. .. . . .
.
. . .. . . .
..
. . ..
. . . .. . .. . .
.. . .
. . .. . .
. ... .
. ..
.. .
..
. . . .Pengaruh suplementasi hormon PMSG dan hCG pada medium PIV terhadap tingkat penetrasi sperma terhadap oosit sapi
... .
... . ...Kategorisasi pasangan klon embrio yang berasal dari embrio morula maupun blastosis .... . ... ... . ... . . . ... .. . . Jumlah klon embrio kategori I d i M t u r s.d. 96 jam ...
Kategorisasi pasangan klon embrio yang dikultur dengan kondisi medium berbeda selarna 24 jam ...
DAFTAR GAMBAR
Teks
Diagram proses spermatogenesis ... ...
.
....llustrasi proses fertilisasi secara lengkap sampai terjadinya singami ...
Diagram proses te qadmya kembar monosigotik .. . ... Oosit yang telah diaspirasi dan di cuci siap untuk di kultur ... Teknik penyayatan embrio menjadi dua bagian yang sama besar ... Pengaruh perbedaan kualitas oosit (A,B,C,dan D) terhadap
transformasi inti oosit yang dikultur secara in vitro selama 24 jam
...
Transfomasi inti oosit pada saat meiosis ...Kualitas oosit hasil aspirasi dari ovarium sapi yang berbeda bangsa ... Perbedaan transformasi inti oosit setelah dikultur selama 24 jam dengan oosit yang berasal dari ovarium yang berbeda bangsa ... Oosit hasil aspirasi dengan kualifikasi A ... Konsep umum pengaruh keadaan lingkungan terhadap mekanisme reproduksi pada mamalia ... Pengaruh musim terhadap kualitas yang dihasilkan oleh Japanese Black cow
Transfomasi inti oosit yang di aspirasi dari ovarium sapi pada musim yang berbeda dan setelah di M t u r secara in virro selama 24 jam. . .
. . .
. . ..
. .. .
.. . .
. . ..
. . . .. . .
.. .
..
. . ..
. . .Pengaruh suplementasi hormon PMSG dan hCG pada medium pernatangan oosit in vitro terhadap tingkat ekspansi sel-sel kumulus.. Pengaruh suplementasi PMSG dan hCG pada medium PIV terhadap transfomasi inti oosit sapi ... Model hipotetik mekanisme transduksi LH modifikasi dari Mattioli ( 1994).
.
... . . .
. . . .. .
. . ..
. .. . .. .
, , . , . . .. . .
. .. .
. . . .. . .Kualifikasi ekspansi sel-sel kumulus pada tingkat 2 (sel-sel kumulus terekspansi secara sempurna) setelah dikultur selama 24 jam ... Viabilitas sperma yang diinkubasi selama 8 jam dengan konsentrasi NaHCO, dalam BO yang berbeda ...
.
.
...
26 Embrio tahap blastosis awal (a) dan blastosis akhirlexpanded (b) 84
pada hari ke 6 kultur dan (c) embrio degenerasi ... .
...
27 Blastosis tetas pada han ke 23 tampak ICM (Inner Cell M a s s ) ... 84
DAFTAR LAMPIRAN
Halaman
Komponen-komponen medium 199 ... . ... .. ... ... . . ...
Media Fertilisasi
. . .
... . .. ... . .. ...
. .... .
... . . ... Bahan-bahan kimia untuk pembuatan medium . . ...Peralatan penel~t~an..
.
. . .. . .
..
. . ..
.. . .
. . .. . .
. . ..
.. . .
Pengaruh perbedaan kualitas oosit (A,B,C,D) terhadap transformasi inti oosit yang dikultur secara in vitro selama 24 jam ...Kualitas oosit hasil aspirasi dari ovarium yang berasal dari sapi-sapi berbeda bangsa.. . .
.
.... . . .. .. .... . .
. . . .... ...
... ..... .
.. . . .. . ... .......
.... . .. . ... .. . . ... Perbedaan bangsa sapi terhadap transformasi inti oosit yang dikultur selama 24 jam ...Pengaruh musim terhadap kualitas oosit pa& oosit Japanese Black. ..
. .
Pengaruh musim terhadap transformasi inti oosit Japanese Black ...
. . ..
. Pengaruh suplernentasi PMSG dan hCG pada medium pematangan oosit m vitro terhadap ekspansi sel-sel kumulus ...Pengamh suplementasi hormon PMSG dan hCG pada medium PIV terhadap tingkat pematangan oosit sapi ... Lama inkubasi terhadap angka penetrasi sperma pada oosit ...
.
... Pengaruh lama inkubasi terhadap pertumbuhan embrio pasca FIV ...Angka penetrasi sperma terhadap oosit dengan kondisi BO medium yang konsentrasi NaHC03 berbeda ... . .. ...
.
... . . ... . , . . ..PENDAaULUAN Latar belabng
Sapi merupakan salah satu jenis temak yang tetah memberikan kontibusi besar dalam memenuhi kebutuhan protein hewani masyarakat Indonesia. Diperkirakan kebutuhan daging maupun susu
di
masa yang akan &tang semakin meningkat sebagai akibat turnbuhnya kesadaran masyarakat untuk mengkonsumsi protein hewani.Disisi lain, perkembangan kuantitas maupun kualitas petemakan sapi rakyat yang merupaksn pemasok terbesar kebutuhan daging maupun susu masyarakat, berlangsung
sangat lambat. Sebagai akibatnya, sejak tahun 1986 Indonesia mulai mengimpor daging maupun sapi potong guna meningkatkan pasokart daging masyarakat (BPS, 1987). Kondisi semacam ini bila di biarkan, akan semakin memperparah keadaan. Hal ini memperbesar peningkatan impor sapi, dagng dan susu dari negara fain yang berakibat pemborosan devisa negara. Gejala ini menjadi lebih buruk pa& saat Indonesia mengalami krisis ekonomi. Pada sektor pertanian subsektor peternakan mengalami
pukulan terberat dibanding subsektor lainnya. Untuk itu diperlukan upaya strategis pembangunan peternakan yang terencana dan terarah khususnya di bidang pengadaan bibit.
Salah satu alternatrf untuk mengatasi kondisi tersebut adalah pemanfaatan
teknologi reproduksi berupa transfer embrio. Dengan teknologi ini diharapkan embrio- embrio bibit unggul dapat didistribusikan kedaerah-daerah pusat pembibitan dan produksi daging serta susu untuk perbaikan mutu genetik dan produktifitasnya.
upaya untuk meningkatkan jurnlah embrio dapat dilakukan dengan memanfaatkan
teknologi embrio Honing sederhana
guna
memproduksi kernbar identik. Teknologimanipulasi embrio ini merupakan teknologi yang dilakukan dengan cara pemisahan blastomer (splitting) embrio menjadi dua bagian. Teknik ini akan menghasilkan klon embrio yang mempunyai genotip sama dengan tetua. Diharapkan dengan metode
semacam ini dapat meningkatkan jurnlah embrio dengan tidak mengurangi kualitas.
Menurut King dkk.(1992) klon embrio ini juga dapat dibekukan Dengan teknologi
pembekuan, klon embrio dapat disimpan dan dikirirnkan tanpa hambatan waktu dan j d a h . Oleh karena itu teknologi manipulasi embrio merupakan bagian integral dari
rekayasa biologi yang diolah berdasarkan pendekatan padat i h u clan teknologi, serta mencerminkan unsur prod* proses dan pelayanan (Sukra, 1986). TeknoIogi ini juga dapat dirnanfaatkan untuk embryo sexing. Bagian dari sel-sel embrio hasil manipulasi &pat dirnanfaatkan untuk dianalisis jenis kelaminnya dengan menggunakan teknik kariotiping atau PCR (Hochrnan dkk-, 1996).
Teknologi manipdasi embrio membutuhkan ernbrio berkualitas baik, sehingga
diperlukan teknik fertilisasi in vitro yang dapat menghasilkan embrio-embrio siap di manipulasi. Meskipun hasil penelitian fertilisasi in vitro pa& hewan percobaan maupun pada sapi menunjukkan perkembangan yang cukup berarti, tetapi penerapannya pada
ternak-temak sapi procluktif keberhasilannya relatif masih belum memuaskan. Kendala
aplikasi fertilisasi in vitro adalah pematangan oosit clan kapasitasi sperma (Kanagawa dkk. 1989; Tervit, 1991 ; Pinyopumintr clan Bavister, 1991).
tingkat pembelahan meiosis, yaitu suatu proses pembelahan seI-sel gamet dari yang bersifat diploid menjadi haploid (Whitaker, 1996). Proses ini merupakan rangkaian
peristiwa yang berawal dari tahap pembelahan profase, metafase I, anafase I, telofase I, sampai metafase fl.Tahap ini merupakan tahap a i r terjadinya ovulasi secara alamiah
pa& sapi indikator pematangan oosit (Campbell dkk., 1996; Chian dkk., 1992; Sirard dan Coenon, 1995). Pada omit. secara mikroskopis proses miosis ini dapat diamati
melaiui transformasi inti oosit, yaitu berupa tahap germinal vesicle (GV), germinal
vesicle break down (GVBD), prometafase (PM), metafase I, sampai dengan metafase I1 (Abeydeera dan Niwa, 1992; Yoshida, 1992).
Salah satu kondisi yang sangat penting pa& tahap pematangan oosit adalah
kondisi fisioiogis pematangan oosit sampai terjadinya proses ovulasi. Dari beberapa penelitian menunjukkan bahwa ada beberapa hormon penting yang sangat berperan
&lam proses pematangan oosit yaitu FSH, LH. Estradiol (Gerrity, 1992; Kakenkintepe dkk., 1994; Pawshe dkk., 1996). Hormon-hormon ini bekeja sama diantaranya dengan
faktor penumbuh insulin like growth factor-1 IGF-I (Yallampalli dkk.,1992), IGF-I ini
b e h g s i merangsang sel-sel granulosa untuk mensekresi hormon FSH dan LH (Lavranos dkk.,1996). Fungsi dan peran hormon-hormon gonadotropin secara teoritis
&pat digantikan oleh honnon-hormon sejenis lainnya seperti PMSG (pregnant mare
serum gonadotropin) dm hCG (human chorionlc gonudofropin). Menurut Solomon
(1988) kedua hormon ini mempunyai bioaktifitas m ~ n p FSH dan LH, sehingga dengan
Sel-sel kumulus adalah sel-sel granulosa yang menempel pada oosit dan dindingnya berhngsi sebagai agen "komunikasi" antara sel dan penghubung mekanisme hormonal dari menuju oosit, karena pa& sel-sel kumulus terdapat banyak reseptor FSH dan LH yang juga dapat berfungsi sebagai reseptor PMSG dan hCG (Moore dan Ward, 1980; Licht dkk., 1979; Gillou dan Combamus, 1983; Stewart dan Allen, 1981; Haresign dkk.,1994). Disamping itu berperan juga dalarn pemasokan nutrisi terhadap oosit. Sel-sel
kumdus akan mengalami ekspansi (mengembang) apabila terstimulasi akibat adanya peningkatan aktifitas peran hormon gonadotropin d m metabolisme seluler tersebut (DeHaan, 1 994; Konishi dkk., 1996; Wandji dkk.. 1996). Sel-sel kumulus berperan sangat penting dalam proses pematangan oosit dan dengan pengamatan tingkat ekspansinya
dapat dievaluasi tingkat kematangannya. Peranan lain yang sangat penting dari sel-sel
kumulus pada saat fertilisasi in vifro adalah peranan sel-sel tersebut dalarn reaksi
akrosom spermatozoa fBavister,l982). Peran ini dikarenakan set-sel kumdus banyak
mengandung asam hyaluronat (Talbot dan DiCarlantonio, 1984), sehingga sel-sel kumulus tidak perlu dlepaskan dari oosit pa& saat fertilisasi in vifro.
Sel-sel kurnulus dapat pula mensekresikan hormon-hormon progresteron, estradiol, clan prostaglandin dengan kadar yang relatif cukup tinggi dan dapat berperan dalam proses suplai nutrisi yang dibutuhkan oleh embrio (Canipari. 1994; Liu dkk.,1987;
Mattioli, 1994, Ny dkk.,1987). Dari pendapat ini sel-sel kumulus ini masih dapat dimanfaatkan untuk kultur embno. Pada saat setelah fertilisasi banyak terdapat sel-sel kumulus yang rusak dan hancur, sehingga diperlukan penambahan hormon-hormon
PMSG dan K G , PMSG secara in vitro &pat mengoptimalisasikan stimulasi sel-sel kumulus tersisa untuk mensekresikan progresteron.
Fertilisasi adalah merupakan rangkaian proses yang dimulai ckri adanya peristiwa penetrasi spermatozoa ke dalam oosit sampai te jadinya proses singami dari pronukleus
jantan dan betina (Yanagimachi. 1988; Kanagawa
dkk,
1989). Peristiwa ini dapat dilakukan secara buatan melalui teknologi fertilisasi jn vifro. Hambatan utama d a l m aplikasi teknologi fertilisasi in vitro ( F N ) adalah adanya perbedaan men&sar kondisi in vzvodan
in vitro. Hambatan dalarn fertilisasi in vitro dapat diatasi dengan menggunakanmedium fertilisasi yang sesuai dan mendekati kondisi in vivo. Salah satu medium dasar FIV yang digunakan adalah medium BO (Brackett dan Oliphant. 1975). Medium BO
pa& dasarnya pengembangan dari medium yang digunakm untuk
FIV
pada kelinci dan hewan percobaan laimya, sehingga perlu adanya modifikasi. Modifikasi BO tersebutdilakukan dalam bentuk konsentrasi bahan kimia tertentu yang berbeda dengan medium BO sebagairnana dilakukan pada FIV kelinci.
Senyawa penting yang berperanan dalam proses kapasitasi adalah sodium
bikarbonat (NaHC03, (Salustri dkk.,1992). Senyawa ini berperan sebagai penyangga dalam medium FIV (Thompson,l996), dengan adanya senyawa penyangga &lam
medium FIV virtbiltas sperma akan tetap tejaga, sehingga proses kapasitasi, reaksi akrosom,
dan
motilitas sperma selama di dalam media kultur akan tetap te jaga. Dengan penambahan senyawa NaHC03 dengan konsentrasi tertentu dan dikuitur dalam waktu tertentu, diharapkan spermatozoa akan mampu melakukan penetrasi terhadap oosit. Dengan demikian suplementasi medium fertilisasi in virro (BO) dengan kafein danPada kultur klon embrio masalah utama yang dihadapi adalah cekarnan
dan
pemulihan kondisi sel-sel blastomer ataupun
inner cell
mass
yang
rusak
akibat adanya
penyayatan embrio (Williams
dkk.,
1985; Baker
dan
Shea, 1985; ~ a k e d a
dkk.,
1985;
Gray
dkk.,
1991;
Kippax
dkk
1991). Untuk mengatasi kendala tersebut, medium
manipulasi
di tambah dengan senyawa penyangga HEPES
yang
dapat berpentnan
untuk
mengatasi cekaman mekanis akibat manipulasi embrio. Pemulihan kondisi embrio akibat
manipulasi memerlukan penambahan bioaktif tertentu yang dapat mempercepat proses
pemulihan kembali klon embrio tersebut. Salah satu alternatifnya
adalah
penambahan
*
faktor penumbuh IGF-I.
IGF-I
ini merupakan faktor penumbuh yang berfungsi
untuk
menstimulir pembelahan mitosis, proliferasi, differensiasi, dan morfogenesis set-sel
embrio (Armstrong dan Xia, 1993;Heyner dkk.,l993;Simmen
dkk.,
1993). Penambahan
IGF-I
klon embrio dapat mempercepat rekonstmksi
inner cell
mass
dan blastomer
sehingga berkembang menjadi embrio barn.
Berdasarkan ha1 tersebut diatas, maka perlu dilakukan upaya penelitian guna
perbaikan sistem kultur
pada
fertilisasi
invirro.
Upaya tersebut diantaranya melalui
proses pematangan oosit, kapasitasi dan reaksi akrosam sperma,
serta
pertumbuhan
embrio maupun klon embrio. Dalam penelitian ini di cobakan pendayagunaan PMSG
dan hCG sebagai gonadotropin yang lebih murah untuk pematangan oosit dan
pertumbuhan embrio. Moditikasi BO sebagai memum FIV serta peranan sel-sel kumulus
pada saat FIV. Disamping itu perlu adanya metode kultur klon embrio dengan berbagai
modifikasinya dan pemanfaatan IGF-I clan FCS pada medium kultur, sehingga akan
Penerapan teknik fertilisasi
in vitrodihadapkan
pada
adanya kesenjangan
kondisi lingkungan antara in
vitrodan
in vivo,serta adanya cekaman oosit terlepas dari
folikel secara
tidak
alamiah. Kondisi lingkungan tersebut berupa kondisi lingkungan
fisiologis serta kebutuhan nutrisi, hormon maupun faktor biokimiawi lainnya
mtuk
pematangan oosit, kapasitasi dan akrosom reaksi sperma, mailpun tumbuh kembang
embrio. Sedangkan
pada
teknologi manipulasi embrio disebabkan karena
adanya
cekaman
pa&
saat embrio
di
manipulasi berupa kerusakan blastomer, matriks pengikat
antar blastomer, inner cell
mass(ICM),
maupun trofoblas.
Dari
pemikiran-pemikiran
.
tersebut
&pat
diidentifikasikan pennasalahan utama
dari
p e l i t i a n ini yaitu
bagaimanakah tingkat keberhasilan pembuatan
medium
kultur terhadap proses aplikasi
teknologi pematangan oosit, fertilisasi, kultur embrio dengan memanfaatkan FCS,
PMSG
dan hCG sebagai suplemen pada
TCM
199 dan suplementasi
pada
kultur klon embrio in
vitro
pada temak sapi dengan IGF-1 dan
FCS
pada
TCM
199.
Tujuan pcnrlitian
Adapun tujuan penelitian ini adalah untuk mengetahui
:1.
Keberhasilan pembuatan sistem kultur dengan suplementasi serum anak sapi (FCS),
hormon
PMSG
dan hCG serta sistem kokultu) dengan menggunakan sel-sel kumulus
sebagai sel dampingan untuk pematangan oosit, fertilisasi, maupun perkembangan
embrio
in
vitro.2.
Modifikasi sistim lama inkubasi fertilisasi
m vrtro(FIV)
,
peranan sel-sel kumulus pada
Keberhasilan pernbuatan klon embrio dengan memanipulasi embrio pada tahap perkernbangan embrio yang berbeda.
Keberhasilan suplementasi dengan kombinasi serum anak sapi (FCS) dan IGF-I pada TCM199 untuk kultur klon embrio in vitro.
Manfaat penelitian
Meningkatkan efisiensi aplikasi FIV sebagai dasar pengembangan bioteknologi berupa embrio kloning, sexing embrio dan transgenik di Indonesia.
Meningkatkan ketersediaan embrio berkuditas tinggi dengan rnernanfaatkan klon
embrio, sehingga klon embrio tersebut dapat disebarluaskan ke pusat-pusat embrio
transfer dan lembaga-lembaga penelitian.
Memperkaya perbendaharaan dan penguasaan ilmu pengetahuan di bidang reproduksi hewan khususnya fisiologi pertumbuhan sel-sel garnet dan embriologi.
Hipotesis.
Suplementasi serum anak sapi Cfetal caCfserum/FCS), PMSG dan hCG pada TCM 199
serta pemanfaatan sel-sel kumulus untuk sistem kokultur berpengaruh untuk pematangan oosit in vitro (PIV) dan perkembangan embrio in virro.
Fertilisasi in virro (FIV) dapat dilakukan dengan modifikasi sistem inkubasi dan rnernanfaatkan oosit berkumulus serta modifikasi konsentrasi NaHCO, pada medium FIV (SO).
Pembuatan klon embrio dengan tahap perkembangan embrio yang berbeda
TINJAUAN PUSTAKA
Pertumbuhan garnet, fertilisasi dan cleavage. Pertumbuhan sel gamet.
Sel gamet mempakan sel-sel hapIoid yang pembentukannya berlangsung melalui
proses pembelahan mitosis maupun meiosis (Gilbezt, 1988). Terbentuknya sel ketamin
betina berasal dari sel germinal primordial yang berpindah menuju gonad clan -menjadi oogonia, oogonia ini masih merupakan sel diploid Melalui beberapa proses pembelahan
mitosis akhirnya oosit berkembang menjadi oosit primer, pada saat profase oosit primer mulai mengalami pemhlahan meiosis. Pada saat meiosis pertarna terbentuk benda kutub pertama, setelah proses meiosis kedua, terbentuklah ootid dan benda kutub kedua, ootid
merupakan sel gamet haploid. Oosit sekunder ini merupakan oosit yang dikeluarkan pada
saat ovulasi (Becker, 1990; Homa d m Brown, 1992).
Proses terlepasnya oosit sekunder dari ovariurn diawali kejadian pembesaran folikei, akhimya pecah di bagian permukaan ovarium, setelah itu oosit sekunder memasuki ovidak clan tuba falopii. Semua proses pematangan oosit dan ovulasi ini berlangsung di bawah kontrol hormonal (Wassarman, 1988). Kejadian tahaptahap pembelahan ini tidak selalu berurutan dengan kejadian ovulasi. Biasanya pada saat diestrus bersamaan dengan waktu istirahat pembelahan sel gamet yaitu fase profase I. Daiam waktu yang cepat sebelum
tejadinya ovulasi, oosit berpeluang mengalami fase meiosis tahap kedua, pa& saat itu
benda kutub kedua terbentuk (Kanagawa dkk..1989).
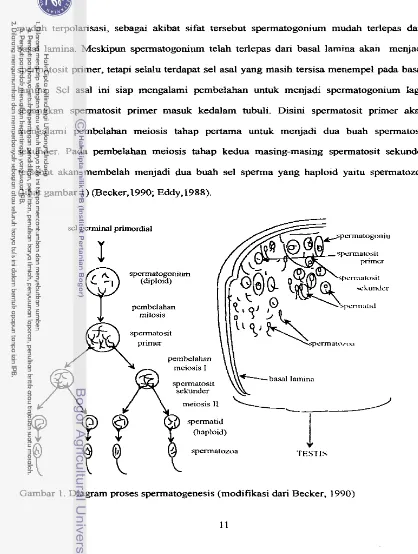
Menurut Becker { 1990) sebuah oogonium primer akan menjadi sebuah msit, sedangkan sebuah spermatosit primer akan berkernbang menjadi empat buah spermatozoa. Spermatogonia mengalami pembelahan mitosis di tubuli seminiferi testis, spermatogonia
tersebut berasosiasi dengan basal lamina dari garis epitel tubuli. Spennatogoniurn bersifat
rnudah terpolarisasi, sebagai akibat sifat tersebut spermatogonium mudah terlepas dari basal lamina. Meskipun sperrnatogoniwn telah terlepas dan basal lamina akan menjadi spermatosit primer, tetapi seIalu terdapat sel asal yang masih tersisa menempel pa& basal lamina. Sel asztl ini siap mengalami pembelahm untuk menjadi spermatogoniwn lag, sedangkan spermatosit primer masuk kedalam tubuli. Disini spermatosit primer akan mengalami pembelahan meiosis tahap pertarna untuk menjadi dua buah spermatosit sekunder. Pada pembelahan meiosis tahap kedua masing-masing spermatosit sekunder tersebut akan membelah menjadi dua buah sel sperma yang haploid yaitu spermatozoa
(lihat gambar 1) (Becker, 1990; Eddy,1988).
sel germinal primordial
[image:31.513.39.457.26.580.2]spermatozoa TESTIS
Spermatozoa setelah mengalami pematangan, akan terlepas menuju lumen tubuli serniniferi pa& saat sudah matang (Ashdown dan Hanock, 1987; Eddy, 1988). Kedua tahap meiosis tersebut berlangsung secara seimbang dan terus menerus dimana pada
akhirnya sebuah sel spermatogonium yang diploid akan menghasilkan empat buah sel
spermatozoa. Secara kuantitatif pada proses spermatogenesis akan menghasilkan banyak sel gamet dibandingkan oogenesis ( H a f e ~ 1987; Gamer dan Hafez. 1987).
Oosit.
Fertilisasi dimuiai pads saat benda kutub pertama terekshaksi, saat itu pula spermatozoa mulai melakukan penetrasi terhadap oosit yang sedang mengalami
pembelahan meiosis tahap kedua. Kejadian ini tejadi di bagian arnpula ovidak
(Yanagimachi, 1988). Pada saat memasuki ampula, sel-sel oosit terbungkus dalarn bungkusan mukosa protein yang di sebut zona pelusida dan rnasih ditempeli sel-sel granulosa berasal dari sel-sel foliket ovmi yang tertinggal, pada tahap ini sel-sel granulosa sering disebut seI kumulus. Selanjutnya oosit yang tidak terpenetrasi dengan spermatozoa
akan mengalami degenerasi (Kanagawa dlrk., 1989).
Spermatozoa.
Menurut Kanagawa dkk. (1989) meskipun jumlah total spermatozoa pada saat ejakulasi sampai ratusan juta. tetapi yany mampu sampai ke ampula tidak banyak. Ada
beberapa spermatozoa yang sampai kt: tempat fertilisasi sangat cepat kira-kira 15 menit setelah perkawinan. Setelah itu spermatozoa mengalami pembahan yang sering disebut
kapasitasi. Setelah spermatozoa mengalami kapasitasi penuh, oosit sarnpai di ampula. Masa subur oosit ini sangat pendek pa& sapi 8
-
12 jam, sedangkan masa subur spermatozoa sapiKeberhasilan fertilisasi banyak tergantung terhadap banyaknya spermatowa di
daerah ampula bertepatan dengan adanya oosit di daerah tersebut. Hal ini menunjukkan
besarnya peluang pertemuan -sit dengan spermatozoa. Sel-sel kumdus juga berfungsi untuk membantu penangkapan spermatozoa yang berada berdekatan dengan oosit, sel-sel
kumulus ini juga mempunyai peranan dalam proses kapasitasi spermatozoa. Disamping itu morfologi spermatozoa juga sangat berperan dalam penetrasi spermatozoa terhadap zona pelusida (Liu dan Baker,1992).
Fertilisasi.
Fertilisasi merupakan suatu proses peleburan antara dua buah sel gamet yaitu oosit dari hewan betina dan spermatozoa dari hewan jantan untuk membentuk sebuah sel tunggal yang disebut sigot (Mc Laren, 1987). Terjadinya proses fertilisasi tersebut melalui
peristiwa-peristiwa sebagai berikut :
Kapasitasi dan akrosom reaksi sperma.
Sperma masak yang berasal dari epididimis atau sperma ejakulat masih belum mampu membuahi sel-sel telur, sperma hams melalui traktus genitalis betina berahi
sebelurn meningkatkan kemampuannya untuk membuahi sel telur. Pa& saat itu sperma
mengalami perubahan-perubahan fisiologis, sehingga mampu melakukan pembuahan,
proses ini sering disebut kapasitasi (Yanagimachi, 1988). Selama proses kapasitasi ini
sperma mengalami motilisasi dan sering disebut hiperaktifasi (Yanagimachi dalam Luconi
perubahan fisiologis bagian akrosom
dan
kepala spermatozoa, sehlngga memudahkan
sperma menembus zona pelusida (Fulka, 1991). Setelah tejadi kedua proses tersebut
sperma berpeluang
untuk
membuahi oosit yang sudah
masak.
Proses masuknya spermatozoa ke dalrm oosit
Untuk memasuki oosit, spermatozoa
harus
melakukan penetrasi
pada
kumpulaif sel-
sel kumulus, zona pelusida
dan
membran vitelin. Spermatozoa memasuki sel-sel kurnulus
sesuai dengan kemampuan motilitas, yaitu dengan
cara
membuat akses
untuk
menernbus
matriks asam hyaluronit. Spermatozoa tersebut mempunyai enzim hyaluronidase, asam ini
bermanfaat
untuk
melarutkan kumpulan set-sel kumulus. Dari keadaan ini dapat diketahui
hanya sperma tertentu yang mendapat kesempatan melakukan penetrasi pada zona pelusida
(Gray dalam Slavik
clan
Fulka, 1992). Proses penetrasi spermatozoa terhadap oosit adalah
dengan cara menempelnya spermatozoa pada dinding vitelus. Secara bertahap kepala
spermatozoa tersebut berasosiasi dengan permukaan vitelus dan akhimya tejadi fusi
dengan oosit. Setelah itu terbentuk pronukleus jantan dan
betina,
setelah melalui proses
singami yaitu kedua pronukleus tersebut rnelebur menjadi satu, terbentuklah sigot (lihat
gambar Z)(Kanagawa dkk.,1989).
Menurut Yanagimachi (1988)
hambatan sperma berikutnya adalah untuk
menembus zona pelusida yang mengandung glikoprotein.
Pada tahap ini oosit
memproduksi substansi yang disebut lirtllizin yang rnempunyai fungsi khusus untuk proses
penggumpalan
pa&saat fertilisasi. Proses penggumpalan ini tidak berlangsung lama, pada
saat ini sperma menernpel membentuk lorong sempit pada zona pelusida. Pada tahap ini
[image:34.534.44.483.66.683.2]penembusan ini berlangsung dibantu oleh enzim proteolitik sehingga spermatozoa dapat menembus zona pelusida.
Garnbar 2. Ilustrasi proses fertilisasi secara lengkap sampai te jadinya singarni (Kanagawa dkk., 1989)
Shamsudin clan Rodriguez-Martinez (1993) melakukan penelitian dengan menggunakan 380 oosit sapi dan diperlakukan inseminasi dengan metoda yang berbeda, temyata kisaran oosit yang teqxnetrasi 51,9 s.d. 7 4 9 persen, sedangkan tejadinya polispermi pada masing-masing perlakuan tidak menunjukkan perbedaan yang nyata.
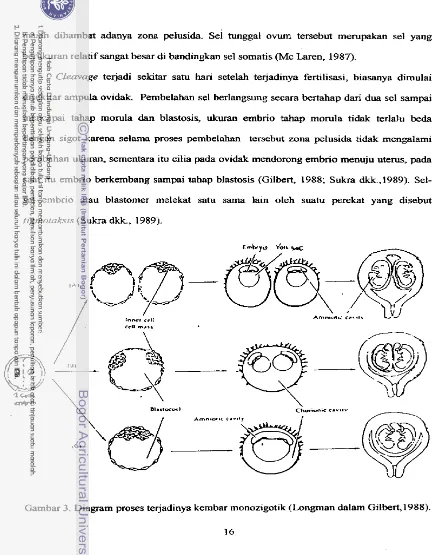
Cieavnge.
masih dihambat adanya zona pelusida. Sel tunggal ovum tersebut merupakan sel yang
berukuran relatif sangat besar di bandingkan sel somatis (Mc Laren, 1987)
Cleavage terjadi sekitar satu hari setelah te jadinya ferttlisasi, biasanya dimulai disekitar ampula ovidak. Pembelahan sel berlangsung secara bertahap dari dua sel sarnpai mencapai tahap morula clan blastosis, ukuran embrio tahap momla tidak terlafu beda dengan sigot karena selarna proses pembelahan tersebut zona pelusida tidak mengalami
perubahan ukuran, sementara itu cilia pada ovidak mendorong embrio menuju uterus, pa& saat itu embrio berkembang sarnpai tahap blastosis (Gilbert, 1988; Sukra dkk.,i989). Sel- sel embrio atau blastomer melekat satu sama lain oleh suatu perekat yang disebut
tigmotaksis (Sukra dkk., 1989).
[image:36.509.36.470.22.577.2]Innrl trt: Am....*-. <...,\
Gambar 3. Diagram proses te jadinya kembar monozigotik (longman dalam Gilbert,1988).
Terjadin ya kembar identik alamiah
Menurut Longman dalam Gilbert (1988), te rjadinya kembar identik secara alamiah
dimunglunkan melalui beberapa peristiwa sebagai berikut:
A. Terjadinya awal kennbar sebelum terbentuknya trofektoderm, sehingga tiap
kembar mempunyai chorion dan amnion sendiri.
B.Tejadinya awal kembar setelah terbentuknya trofektoderm tetapi sebelum
terbentuk amnion sehingga menghasilkan kembar mempunyai kantung amnion sendiri
tetapi memanfaatkan satu chorion bersama.
C.Terjadi awal kembar setelah pembentukan amnion sehingga kembar mempunyai
satu kantung amnion dan chorion (Gambar 3 ) .
Pematangan garnet, fertilisasi, dan pertumbuhan ernbrio in vitro.
Fertilisasi in vifro adalah proses fertilisasi buatan yang dilakukan oleh manusia
dengan memanfaatkan oosit maupun sperma diluar tub& hewan. Menurut Fulka (1991)
proses fertilisasi in vitro dilakukan dengan cara membuat imitasi kondisi lingkungan yang tejadi pada saat fertilisasi in vivo. Kondisi tersebut berupa kondisi fisiologis berupa
hormonal, nutrisional, serta kondisi lainnya yang mendukung terjadinya fertilisasi. Proses
ini terdiri dari pematangan oosit in vitro, kapasitasi dan turnbuh kembang embrio In vitro, proses tersebut adalah sebagai berikut:
Pematangan oosit in vitro
(PIV).
Langkah awal dari PIV adalah seleksi oosif menurut Machatkova dkk., (1996) salah
menurut faktor lain yang sangat penting adalah kondisi oosit
pada
pertumbuhan folikelnya,
kondisi oosit
ini
berkaitan dengan metode clan lama kultur yang di gunakan
untuk
pematangan oosit (Telfer, 1996; Crozet
dkk.,
1995; Cecconi
dkk.,
1996). Metode kultur
oosit dan yang embrio banyak dikembangkan oleh para peneliti adalah
conditioned medium
(Hernandez-ledezma
dkk.,
1996; Shamsudin
dkk.,
1993; Duran
dkk.,
1996),
Chemicaily
defined medium
(Lim
dkk.,
1994; Iritani
dkk.,
1984)
dan
kokultur (Rehman
'dkk.,
1994;Goto dkk., 1988; Goto dkk., 1994;Sakkas
dkk.,
1989; Shamsudin, 1993
).Salah satu problem utama dalam fertilisasi in
vitro
adalah pematangan oosit.
Menurut Xu
dan
Greve (1988) pematangan oosit sapi merupakan sebuah proses
pematangan sitoplasma yang dilengkapi dengan pematangan inti sel, proses ini merupakan
bagian terpenting bagi oosit
untuk
fertilisasi. Menurut Sirard dkk.(1992) proses
pematangan melalui peristiwa meiosis tejadi secara spontan apabila oosit terlepas dari
folikelnya. Pada kultur oosit
in ritro,
oosit sapi berasal
dari
folikel belum masak dapat
dilakukan pematangan sampai tahap siap dibuahi meskipun rata-rata perkembanga~ya
masih sangat terbatas.
Boone clan Shapiro dalam Shamsudin
dkk.(1993)
menyatakan proses pematangan
oosit adalah merupakan proses reorganisasi organela-organela tersebut di dalam sitoplasma
yang
berguna
untuk
memobilisasi organela-organela dari granula kortikal menuju darrah
subplasmalema, proses ini bukan akibat pengaruh kondisi medium kultur. Kondisi
Lulturyang mempengaruhi proses pematangan oosit adalah adanya gonadotropin, steroid, slstern
buffer, komposisi gas, keadaan fisiologis, dan fisik serta parameter kimiawi lainnya.
Menurut Shamsudin
dkk.
(1993) secara berumtan proses pematangan oosit
sap8
Tahap I.
Organela-organela sitoplasma, sebagian besar merupakan mitokondria, membentuk
kumpulan kecil dan menyebar disekitar periferi oosit. Butir-butir lemak, gelembung- gelembung menyebar merata di bagian tengah oosit. Pada tahap ini butir-butir lam&
d m
gelembung-gelembung berjumlah lebih banyak serta berukuran lebih besar dibandingkantahaptahap selanjutnya.
Tahap
II.
Beberapa mitokondria telah tidak berada di daerah kortikal dan menyebar di daerah ooplasma. Butir-butir lemak dan gelembung-gelembung jumlahnya berkurang serta
h n n y a mengecil dan mulai pindah dari bagian tengah menuju ke periferi. Setelah 12 jam masa inkubasi semua oosit memasuki masa ini.
Tahap 111.
Organela-organela sitoplasma, butir-butir lernak dan gelembung-gelembung bercampur secara merata diseluruh ooplasma. Mitokondria telah meninggalkan daerah
kortikal dan bercampur dengan retiMum endoplasma. Granula-granula kortikal telab di rnobilisasikan ke dalam daerah subplasmalema. Kejadian ini tejadi setelah 20 jam di inkubasi, terlepas dari kondisi medium h l t u r .
adanya drbutyril cyclic adenostn 3'5'-monophosphare (20 pM). Secara bersama-sama
tejadi pula segmentasi, perubahan-perubahan degeneratif dengan penambahan bovine
fblliculair fluid-glycosaminoglycans pada konsentrasi 250 fig/ml. Dari h a i l ini
menunjukkan bahwa pemaiangan, aktivasi maupun degenerasi oosit sapi &pat dimodulasikan oleh bahan-bahan biokimiawi tersebut.
Hawk dkk. (1992) juga mencoba sel-sel kumulus pada oosit sapi temyata juga dapat meningkatkan angka fertilisasi (Lihat tabel 1). Percobaan lain juga dilakukan pada tikus oleh Eppig dkk. (1992) ternyata penambafian hormon FSH dan LH pa& medium kultur rnernberikan pengaruh terhadap pematangan oosit.
Tabel 1. Pen& keberadaan sel-sel kurnulus pada oosit pada saat pematangan oosit terhadap tingkat fertilisasi (Hawk dkk., 1992).
LJkuran Oosit dengan kumulus ~ e n u h
-
oosit den- kurnulus sebaeian tidak di pipet di pipet tidak dip;- di pipet-Ova yg diuj i 142 121 132 135
~ e r t i l 39 6 8 81 101
polispermi 2 6 5 12
2 pronukleus 15 56 66 85
Menurut Amstrong dkk.( 1992) perbandingan tingkat pematangan oosit yang berasal dari pedet-pedet di superovulasi dan dari sapi dewasa tidak menunjukkan perbedaan yang nyata. Penelitian lain menunjukkan pada oosit sapi yang sudah mas& dapat pula dilakukan kriopreservasi, tetapi setelah dilakukan fertilisasi in vifro keberhasilan berkembang menjadi embrio sampai tahap blastosis lebih rendah dibandingkan embrio
[image:40.513.38.472.17.593.2]Kapasitasi dan reaksi akrosom sperma in vitro.
Menurut Hatings dan Kay (1992) kapasitasi ini &pat pula dilakukan secara in
vih.o.Iritani dkk. (1984), memodifikasi larutan Krebs bikarbonat (Lamtan KRB) untuk
digunakan sebagai bahan kapasitasi spermatozoa sapi dibandingkan dengan sistem
kapasitasi uterus sapi estrus, ternyata larutan KRB dapat digunakan pula sebagai bahan kapasitasi spermatozoa dengan hasil yang baik. Salah satu bahan biokimiawi yang sangat
potensial sebagai aktifator &lam proses kapasitasi sperma sapi secara in virro, adalah heparin. Leclerc dkk.(1992) menambahkan disamping heparin bahan yang berperanan
dalam kapasitasi sperma adalah calrnodulin (CaM), Calmodulin ini beke jasama dengan heparin secara antagouistik daiam proses kapasitasi sperma. Heparin sebagai salah satu
bahan biokimiawi yang berperan dalam proses kapasitasi juga berperan dalam proses reaksi
akrosom pada kepaIa spermatozoa. Fraser (1987) ca2+ dibutuhkan untuk meningkatkan
kapasitasi, akrosom reaksi, rnotilitas, penetrasi Zona pelusida dan h i garnet pada percobaan FIV tikus.
White dkk. (1992) rnelakukan penelitian dengan mengamati perubahan-perubahan zat metabolit pada saat spermatozoa sapi sedang mengalami kapasitasi. Penelitian tersebut
dilakukan dengan mengamati konsumsi oksigen dan adanya CAMP dalam spermatozoa sesaat sebelum d m setelah spermatozoa di inkubasikan dengan sistem ko-kultur dan tanpa
kokultur (lihat tabel 2).Spermatozoa yang telah mengalami kapasttasi berpeluang untuk
melakukan penetrasi pada zona pelusida menurut Liu clan Beker (1992) menyatakan bahwa zona pelusida rnernpunyai kemampuan yang sangat tinggi dalam menseleksi spermatozoa
untuk melakukan penetrasi, meskipun spermatozoa tersebut mempunyai morfologi yang
Tabel 2. Konsumsi oksigen dan konsentrasi CAMP &lam spermatozoa sapi sesaat sebelum dan sesudah inkubasi dengan ko-kulhu - dan tanpa sel ephitil ovidak sapi (White - .
dkk.
1992).Percobaan waktu Oksigen Uptake cAMf
(ml/l~~sperma/jam) (pmoU 1 08spem) inkubasi (jam) kontrol kokultur kontro t kokultur
1 0 25.3k3.1
----
12,9?3,8---
Fertilisasi in vitro.
Fertilisasi in v i ~ o adalah fertilisasi buatan yang dilakukan oleh manusia dengan
memanfaatkark oosit maupun sperma diluar tubuh hewan (Kanagawa, dkk. 1989). Spermatozoa dapat rnelakukan penetrasi terhadap zona pelusida memerlukan beberapa
proses biokimiawi, proses ini disamping membantu proses penetrasi juga membentuk zona
pelusida blok untuk rnenghindari sigot polispermi (disarikan dari Shabanowitz dan O'Rand,1988). Proses fertilisasi di awali dengan pengenalan masing-masing gamet
(sperma-oosit) melalui molekul-molekul proteidglikoprotein pa& masing-masing membran (Vacquier d m Lee, 1993), dilanjutkan dengan proses htndrtzg Jan fusi antara sperma dan oosit (Ash dkk., 1995). Setelah tejadi penetrasi terbentuklah pronukleus jantan d m betina (Zirkin dkk.. 1989; Perreult,l990; Hoshi dkk.. 199.1; Funahashi dkk., 1994) dan diikuti singami sehingga terbentuk sigot (Kanagawa dkk