PENGARUH pH, PENGGOYANGAN MEDIA DAN EKSTRAK
DAUN SIRIH MERAH (Piper crocatum Linn.) TERHADAP
Rhizoctonia sp.
IMUN MULYANINGSIH
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pengaruh pH, Penggoyangan Media dan Ekstrak Daun Sirih Merah (Piper crocatum Linn.) terhadap
Rhizoctonia sp. Nama Mahasiswa : Imun Mulyaningsih
NRP : E44080024
Disetujui oleh
Dr Ir Achmad, MS Pembimbing
Diketahui oleh
Prof Dr Ir Nurheni Wijayanto, MS Ketua Departemen
IMUN MULYANINGSIH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Silvikultur
PENGARUH pH, PENGGOYANGAN MEDIA DAN EKSTRAK
DAUN SIRIH MERAH (Piper crocatum Linn.) TERHADAP
Rhizoctonia sp.
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan,penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi berjudul pengaruh pH,
penggoyangan media dan ekstrak daun sirih merah (Piper crocatum Linn.) terhadap Rhizoctonia sp. adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi atau lembaga manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir skripsi.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2013
ABSTRAK
IMUN MULYANINGSIH. Pengaruh pH, Penggoyangan Media dan Ekstrak Daun
Sirih Merah (Piper crocatum Linn.) terhadap Rhizoctonia sp. Dibimbing oleh ACHMAD.
Penyakit tanaman merupakan salah satu faktor penghambat peningkatan produksi bibit di persemaian. Mati pucuk merupakan salah satu penyakit yang menyerang di persemaian. Penyebab mati pucuk salah satunya adalah Rhizoctonia sp. Penelitian ini bertujuan untuk menguji ekstrak daun sirih merah (Piper crocatum Linn.) sebagai bahan pestisida alami untuk mengembangkan metode pengendalian hayati yang ramah lingkungan dan menguji pengaruh pemberian pH serta menguji pengaruh penggoyangan media terhadap pertumbuhan Rhizoctonia sp. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan tiga ulangan. Hasil penelitian menunjukkan bahwa semakin tinggi konsentrasi ekstrak daun sirih merah, maka pertumbuhan diameter koloni Rhizoctonia sp. semakin terhambat. Perlakuan pH pada media PDA (Potato Dextrose Agar) menunjukkan bahwa isolat Rhizoctonia sp. tidak mengalami pertumbuhan pada pH 2. Hasil perlakuan penggoyangan media PDB (Potato Dextrose Broth) diperoleh bobot kering miselia tertinggi pada penggoyangan 100 rpm.
Kata kunci: mati pucuk, pengendalian hayati, penggoyangan media, pH, Piper crocatum, Rhizoctonia sp.
ABSTRACT
IMUN MULYANINGSIH. Effect of pH, Media Shake and Sirih Merah Leaf
Extract (Piper crocatum Linn.) Against Rhizoctonia sp. Supervised by ACHMAD.
Plant diseases is one of the factors inhibiting the increased production of seedlings in the nursery. Dieback is a disease that strikes one in the nursery. Dieback causes one of which is Rhizoctonia sp. This research used Completely Randomized Design (CRD) with three replications. The results showed that the higher the concentration of sirih merah leaf extract, the colony diameter growth Rhizoctonia sp. increasingly hampered. pH treatment on PDA (Potato Dextrose Agar) showed that isolates Rhizoctonia sp. did not grow at pH 2. PDB (Potato Dextrose Broth) treatment results obtained shakes highest mycelial dry weight at 100 rpm shake.
PRAKATA
Puji syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan hidayahNya, sehingga penulis dapat menyelesaikan skripsi ini sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan pada Fakultas Kehutanan Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Dr Ir Achmad MS selaku pembimbing, Dr Dra Nining Puspaningsih MSi selaku penguji sidang komprehensif, Tutin Suryatin BScF selaku Teknisi Laboratorium Pathologi Hutan Fakultas Kehutanan IPB serta Ai Rosah S. Hut yang telah banyak memberikan
saran. Disamping itu, penghargaan penulis sampaikan kepada staf Laboratorium
Bioteknologi Kehutanan Pusat Antar Universitas (PAU) Bioteknologi IPB, staf Laboratorium Mikoriza Puslitbang Kehutanan Bogor, staf Laboratorium Mikologi Departemen Proteksi Tanaman Fakultas Pertanian IPB, yang telah membantu selama pengumpulan data. Ungkapan terimakasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga dan sahabat atas do’a dan kasih sayangnya.
Penulis menyadari bahwa karya ilmiah ini jauh dari sempurna. Akhir kata, semoga karya kecil ini dapat memberikan manfaat bagi pembaca dan bagi dunia ilmu pengetahuan.
Bogor, Juli 2013
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 1
Manfaat Penelitian 1
METODOLOGI
Waktu dan Tempat Penelitian 2
Bahan dan Alat 2
Prosedur Penelitian 2
HASIL DAN PEMBAHASAN
Hasil 6
Pertumbuhan Diameter Koloni Rhizoctonia sp. pada Media PDA
dengan Beberapa Tingkat pH 7
Pertumbuhan Biomassa Miselia Rhizoctonia sp. pada Media PDL
dengan Beberapa Tingkat pH 8
Pertumbuhan Biomassa Miselia Rhizoctonia sp. pada Media PDL
dengan Penggoyangan Media 9
EDSM denganTingkat Konsentrasi yang Berbeda terhadap
Rhizoctonia sp. Secara In Vitro 10
Pembahasan 11
Pertumbuhan Diameter Koloni Rhizoctonia sp. pada Media PDA
dengan Beberapa Tingkat pH 11
Pertumbuhan Biomassa Miselia Rhizoctonia sp. pada Media PDL
dengan Beberapa Tingkat pH 12
Pertumbuhan Biomassa Miselia Rhizoctonia sp. pada Media PDL
dengan Penggoyangan Media 12
Penghambatan EDSM dengan Tingkat Konsentrasi yang Berbeda
terhadap pertumbuhan Rhizoctonia sp. Secara In Vitro 13 SIMPULAN DAN SARAN
Simpulan 14
Saran 14
DAFTAR PUSTAKA 14
DAFTAR TABEL
1. Pembuatan larutan ekstrak daun sirih merah (EDSM) dengan
beberapa tingkat konsentrasi 5
2. Ringkasan hasil sidik ragam pertumbuhan Rhizoctonia sp. 7
DAFTAR GAMBAR
1. Koloni Rhizoctonia sp. setelah diinkubasi selama 3 hari pada media
PDA dengan beberapa tingkat pH 7
2. Miselia Rhizoctonia sp. (a) Percabangan membentuk tegak lurus;
(b) Memiliki sekat 8
3. Pertambahan panjang diameter Rhizoctonia sp. pada media PDA
PDA dengan berbagai tingkat pH 8
4. Bobot kering miselia Rhizoctonia sp. pada setiap perlakuan enam HST 9 5. Penyaringan biomassa miselia Rhizoctonia sp. setelah diinkubasi selama
6 hari pada media PDL
dengan beberapa tingkat pH 9
6. Rata-rata bobot kering miselia Rhizoctonia sp. pada setiap perlakuan
penggoyangan media. 10
7. Biomassa Rhizoctonia sp. setelah diinkubasi selama 6 hari pada media PDL dengan beberapa tingkat penggoyangan media 10 8. Pertumbuhan diameter koloni Rhizoctonia sp. pada media PDA
dengan berbagai konsentrasi ekstrak daun sirih merah 10 9. Koloni Rhizoctonia sp. setelah diinkubasi selama 3 hari dengan
berbagai perlakuan kosentras ekstrak daun sirih merah 11
DAFTAR LAMPIRAN
1. Komposisi media pertumbuhan Rhizoctonia sp. 16 2. Bobot kering miselia Rhizoctonia sp. dengan perlakuan pH yang
dibiakkan pada media PDL 17
3. Bobot kering miselia Rhizoctonia sp. dengan perlakuan penggoyangan
media yang dibiakkan pada media PDL 17
4. Pertumbuhan diameter koloni Rhizoctonia sp. pada perlakuan
pemberian EDSM 17
5. Hasil sidik ragam pertumbuhan Rhizoctonia sp. diameter koloni
6. Hasil sidik ragam pertumbuhan Rhizoctonia sp. diameter koloni
Rhizoctonia sp. perlakuan pH hari ke-2 18
7. Hasil sidik ragam pertumbuhan Rhizoctonia sp. diameter koloni
Rhizoctonia sp. perlakuan pH hari ke-3 18
8. Hasil sidik ragam bobot kering miselia Rhizoctonia sp. dengan perlakuan
tingkatan pH 18
9. Hasil sidik ragam bobot kering biomassa miselia Rhizoctonia sp. dengan perlakuan pemberian penggoyangan media 18 10. Hasil sidik ragam pengaruh pemberian ekstrak daun sirih merah
terhadap pertumbuhan diameter koloni Rhizoctonia sp. 18
1
PENDAHULUAN
Latar Belakang
Penyakit tanaman merupakan salah satu faktor penghambat peningkatan produksi bibit di persemaian (Hardaningsih 2008). Salah satu penyakit yang menyerang di persemaian adalah mati pucuk. Gejala serangan mati pucuk diawali dengan menguningnya daun kemudian daun mengering hingga akhirnya semai mati kering. Menurut Siregar (2005), penyakit mati pucuk banyak terjadi pada persemaian umur 3 – 12 bulan.
Penyakit mati pucuk disebabkan oleh fungi. Salah satu fungi yang menyerang adalah Rhizoctonia sp. Pengendalian penyakit mati pucuk pada umumnya dilakukan secara kimiawi dengan menggunakan berbagai jenis pestisida sintetis. Pengendalian ini dilakukan karena praktis dalam aplikasinya. Menurut Soetikno (1992), banyak organisme pengganggu tanaman (OPT) menjadi kebal terhadap pestisida sintetis. Serangan OPT yang tidak terkendali akan menyebabkan hilangnya investasi yang telah ditanam. Beberapa kasus serangan OPT justru menunjukkan peningkatan setelah penyemprotan pestisida sintesis dilakukan. Kasus ini sering dikenal dengan istilah resurgensi.
Selain itu pengaruh residu yang ditinggalkan dapat mencemari lingkungan dan membahayakan kesehatan manusia. Menurut Andoko (2004), menyatakan bahwa usaha pengendalian penyakit tanaman akhirnya justru mengakibatkan seluruh lingkungan tercemar sehingga menyebabkan ancaman penyakit dan kematian bahkan untuk manusia itu sendiri. Salah satu cara pengendalian yang ramah lingkungan yang perlu dikembangkan adalah dengan cara pengendalian hayati. Pengendalian hayati adalah pengendalian OPT dengan melibatkan peranan musuh alami dari OPT tersebut. Tanaman sirih merah (Piper crocatum) merupakan salah satu tanaman yang berpotensi sebagai antibakteri.
Sudewo (2005) menyatakan bahwa tanaman sirih merah (Piper crocatum) memiliki kandungan senyawa kimia seperti alkaloid, flavonoid, tanin dan minyak atsiri. Flavonoid pada sejumlah tumbuhan obat dilaporkan memiliki sifat antibakteri, antiinflamasi, antialergi, antimutagenik, antiviral, antineoplastik, dan antitrombotik. Oleh karena itu, penelitian ini dilakukan untuk menguji ekstrak daun sirih merah (Piper crocatum) sebagai alternatif solusi pengendalian hayati terhadap fungi Rhizoctonia sp.
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari pengaruh pH, penggoyangan media terhadap pertumbuhan Rhizoctonia sp. dan mempelajari pemanfaatan ekstrak daun sirih merah (Piper crocatum) untuk pengendalian hayatinya.
Manfaat Penelitian
2
penyakit mati pucuk yang disebabkan oleh fungi Rhizoctonia sp. agar tidak mencemari lingkungan dan tidak membahayakan kesehatan manusia.
METODOLOGI
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Mei 2012 sampai dengan Februari 2013. Penelitian dilaksanakan di Laboratorium Pathologi Hutan Fakultas Kehutanan IPB, Laboratorium Bioteknologi Kehutanan Pusat Antar Universitas (PAU) Bioteknologi IPB, dan Laboratorium Mikoriza Puslitbang Kehutanan Bogor, Laboratorium Mikologi Departemen Proteksi Tanaman Fakultas Pertanian IPB.
Bahan dan Alat
Alat-alat yang digunakan dalam penelitian ini ialah cawan petri, blender, timbangan analitik, labu erlenmeyer, autoclave, laminar air flow, oven, gelas ukur, pH meter, MS. Office 2007, SAS 9.1, alat tulis, laptop, dan kamera.
Bahan yang digunakan dalam penelitian ialah isolat Rhizoctonia sp., daun sirih merah, media PDA, media PDB, alkohol 70%, NaOH 1%, dan HCL 1%.
Prosedur Penelitian
Persiapan Pembuatan Media PDA (Potato Dextrose Agar)
Satu liter PDA dibuat dari 200 gram kentang yang diiris halus dan direbus dalam aquades lalu diambil/disaring ekstraknya, kemudian ditambahkan dekstrosa/glukosa 20 gram untuk membuat PDA, lalu ditambahkan lagi aquades, sehingga larutan menjadi 1000 ml. Kemudian ditambahkan 15 gram agar. Larutan dimasukkan ke dalam erlenmeyer yang telah dipersiapkan, masing-masing sebanyak 100 ml. Setelah itu masing-masing larutan dalam erlenmeyer dititrasi dengan HCl dan NaOH 1% untuk mengatur pH media menjadi pH 2, pH 4, pH 6, dan pH 8. Media disterilkan dengan menggunakan autoclave pada tekanan 1 atm dan suhu 121 °C selama 15 menit.
Persiapan Pembuatan Media PDB (Potato Dextrose Broth)
3
erlenmeyer yang telah dipersiapkan, masing-masing sebanyak 100 ml. Setelah itu masing-masing larutan dalam labu erlenmeyer dititrasi dengan HCl dan NaOH 1% untuk mengatur pH media menjadi pH 2, pH 4, pH 6, dan pH 8. Media PDB disterilkan menggunakan autoclave pada tekanan 1 atm dan suhu 121 °C selama 15 menit.
Ekstraksi Daun Sirih Merah (EDSM)
Ekstraksi dilakukan dengan cara pemanasan pada suhu 100 °C selama 1 jam. Daun sirih merah segar sebanyak 100 gram dicuci kemudian dikering anginkan. Setelah itu dihancurkan dengan blender ± 5 menit, kemudian direbus dengan 100 ml aquades dalam keadaan tertutup selama 1 jam. Ekstrak daun sirih disaring dan dimasukkan dalam labu erlenmeyer kemudian disterilkan menggunakan autoclave pada tekanan 1 atm dan suhu 121 °C selama 15 menit (Suryana 2009).
Sumber Fungi
Isolat yang dipergunakan adalah isolat murni Rhizoctonia sp. yang diisolasi dari daun tanaman Anthocepalus cadamba yang menunjukkan gejala mati pucuk. Isolasi dilakukan dengan menanam miselia dari permukaan daun yang terserang, kemudian diperbanyak pada medium PDA (Potato Dextrose Agar) dalam cawan petri dan dimurnikan.
Pemurnian dan Peremajaan
Pemurnian dan peremajaan biakan dilakukan sehingga diperoleh biakan yang homogen, bebas dari kontaminasi dan memiliki viabilitas yang cukup tinggi.
Sterilisasi Bahan, Peralatan dan Ruang Inokulasi
Peralatan yang akan digunakan disterilkan dengan cara memasukkan ke dalam oven selama 24 jam dalam suhu 60 °C, sedangkan untuk sterilisasi cork borer dan sudip dilakukan pada saat pelaksanaan inokulasi dengan cara dibakar pada api bunsen hingga membara. Strerilisasi ruang inokulasi (laminar air flow) dilakukan dengan menyemprotkan alkohol 70 % dan sinar Ultra Violet (UV).
Pertumbuhan Diameter Koloni Rhizoctonia sp. dengan Media PDA pada Beberapa Tingkat pH
a. Metode Pengujian Respon Pertumbuhan
4
pengamatan dilakukan tiap 24 jam dengan mengukur diameter koloni sampai miselia menutupi seluruh permukaan cawan (Pratomo 2006).
b. Pengambilan Data Diameter Koloni Rhizoctonia sp.
Perhitungan pertumbuhan diameter miselia Rhizoctonia sp. dilakukan dengan cara mengukur diameter arah radial. Rumus perhitungannya sebagai berikut :
Pertumbuhan Biomassa Miselia Rhizoctonia sp. dengan Media PDB pada Beberapa Tingkat pH
Penelitian disusun dalam Rancangan Acak Lengkap (RAL) dengan tiga ulangan. Satu potong koloni Rhizoctonia sp. (Ø 8 mm) ditanam pada media PDB dengan lima tingkatan pH, yaitu: pH 2, pH 4, pH 6, pH 8 dan kontrol (6.25). Pada hari ke enam setelah tanam, dihitung bobot kering miselianya.
Pada hari ke enam setelah tanam biakan Rhizoctonia sp. dipisahkan antara media PDB dengan miselianya. Pemisahan ini dilakukan dengan menyaring miselia Rhizoctonia sp. dari media tumbuhnya dengan kertas saring yang telah diketahui berat keringnya (dioven 24 jam pada suhu 60 °C). Miselia Rhizoctonia sp. pada kertas saring kemudian dioven selama 24 jam pada suhu 60 °C, sehingga akan didapatkan bobot kering miselia Rhizoctonia sp. dan kertas saring (Pratomo 2006). Bobot kering miselia didapatkan dengan perhitungan sebagai berikut:
Pertumbuhan Biomassa Miselia Rhizoctonia sp. pada Media PDB dengan Penggoyangan Media
Penelitian disusun dalam Rancangan Acak Lengkap (RAL) dengan tiga ulangan. Perlakuan penggoyangan media menggunakan shaker. Satu potong koloni Rhizoctonia sp. (Ø 8 mm) ditanam pada media PDB dengan empat tingkatan penggoyangan media, yaitu: 50 rpm, 100 rpm, 150 rpm dan kontrol (0 rpm). Pada hari ke enam setelah tanam, dihitung bobot kering miselianya.
Pada hari ke enam setelah tanam biakan Rhizoctonia sp. dipisahkan antara media PDB dengan miselianya. Pemisahan ini dilakukan dengan menyaring miselia Rhizoctonia sp. dari media tumbuhnya dengan kertas saring yang telah diketahui berat keringnya (dioven 24 jam pada suhu 60 °C). Miselia Rhizoctonia sp. pada kertas saring kemudian dioven selama 24 jam pada suhu 60 °C, sehingga akan didapatkan bobot kering miselia Rhizoctonia sp. dan kertas saring. Sedangkan bobot kering miselianya didapatkan dengan perhitungan sebagai berikut:
Øy
Øx
Bobot kering miselia = (Bobot kering kertas saring+Bobot kering miselia)–Bobot kering kertas saring
5
Ekstrak Daun Sirih Merah (EDSM) dengan Tingkat Konsentrasi yang Berbeda terhadap Fungi Rhizoctonia sp. Secara In Vitro.
Penelitian disusun dalam Rancangan Acak Lengkap (RAL) dengan tiga ulangan. Satu potong koloni Rhizoctonia sp. (Ø 8 mm) ditanam pada media PDB dengan enam tingkatan konsentrasi larutan ekstrak daun sirih merah, yaitu: 0%, 20%, 40%, 60%, 80% dan 100%.
Pembuatan larutan ekstrak daun sirih berbagai konsentrasi dilakukan dengan mencampurkan EDSM dengan air steril berdasarkan perbandingan volume hingga diperoleh volume akhir larutan 10 ml ditampilkan dalam Tabel 1.
Tabel 1 Pembuatan larutan ekstrak daun sirih merah (EDSM) dengan beberapa tingkat konsentrasi
Konsentrasi EDSM (%) Volume EDSM
(%)
Pengujian pengaruh EDSM terhadap pertumbuhan Rhizoctonia sp. disiapkan dengan prosedur berikut. Ke dalam cawan petri berdiameter 9 cm dituangkan 2 ml ekstrak daun sirih merah sesuai konsentrasi yang diujikan, kemudian ditambahkan 10 ml media PDA. Untuk tingkat konsentrasi ekstrak daun sirih 0% (kontrol) maka yang ditambahkan adalah 2 ml air steril dan 10 ml media PDA. Cawan kemudian digoyang-goyang agar ekstrak dan media tercampur merata, selanjutnya didiamkan agar media membeku dan dingin. Selanjutnya dilakukan penanaman potongan inokulum Rhizoctonia sp. di tengah-tengah cawan petri tiap perlakuan. Seluruh pekerjaan dilakukan dalam kondisi aseptik. Selanjutnya seluruh cawan beserta isinya diinkubasi pada suhu kamar.
Perhitungan pertumbuhan diameter miselia Rhizoctonia sp. dilakukan dengan cara mengukur diameter arah radial. Rumus perhitungannya sebagai berikut: diameter koloni Rhizoctonia sp., kondisi fungi secara makroskopis, dan mikroskopis. Pengamatan waktu fungi untuk memenuhi cawan petri dilakukan dengan mengamati pertumbuhan miselia per hari sampai miselia memenuhi cawan petri.
Øy
6
Pengamatan kondisi makroskopis fungi dilakukan dengan mengamati tipis tebalnya miselia dan warna miselia. Pengamatan mikroskopis fungi dilakukan dengan cara miselia yang akan diamati diambil dengan menggunakan jarum ose dan diletakkan pada gelas objek setelah itu ditutup dengan kaca penutup menjadi preparat basah. Preparat basah diletakkan dalam cawan perti yang telah diberikan kapas basah agar miselia dapat tumbuh. Miselia fungi dibiarkan satu hari agar pada pengujian ektraksi daun sirih merah adalah diameter koloni Rhizoctonia sp. Pengamatan waktu fungi untuk memenuhi cawan petri dilakukan dengan mengamati pertumbuhan miselia per hari sampai miselia memenuhi cawan petri.
Analisis Data
Analisis data penelitian ini bertujuan untuk mengetahui pengaruh pH, penggoyangan media, dan pengaruh ekstrak daun sirih merah terhadap pertumbuhan Rhizoctonia sp. Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) dengan 3 (tiga) kali ulangan pada tingkat kepercayaan 95% dan taraf α 0,05 dan kemudian dilanjutkan dengan uji Duncan. Semua data dianalisis dengan menggunakan program SAS 9.1.
Model umum yang digunakan:
Yij : μ + αi + εij Keterangan:
Yij = Nilai respon pertumbuhan diameter koloni Rhizoctonia sp. pada masing-masing percobaan (pH, penggoyangan media dan konsentrasi EDSM) ke-i dan ulangan ke-j
μ = Nilai rata-rata umum
αi = perlakuan (pH, penggoyangan media dan EDSM) ke-i
εij = Galat (kesalahan percobaan) percobaan perlakuan konsentrasi (pH, penggoyangan media dan EDSM) ke-i dan ulangan ke-j
HASIL DAN PEMBAHASAN
Hasil
7
Tabel 2 Ringkasan hasil sidik ragam pertumbuhan Rhizoctonia sp.
Pertumbuhan Rhizoctonia sp. Perlakuan, Peubah
Pertumbuhan diameter pemberian pH *
Pertumbuhan diameter pemberian ekstrak daun sirih merah *
Bobot kering miselia perberian pH *
Bobot kering miselia dengan penggoyangan media *
Berbeda nyata pada α 0.05
Pertumbuhan Diameter Koloni Rhizoctonia sp. pada Media PDA dengan Beberapa Tingkat pH
Hasil pengamatan secara visual pengaruh pH terhadap pertumbuhan miselia Rhizoctonia sp. pada media padat PDA menunjukkan pertumbuhan yang beragam. Meski pun pada pH 4, pH 6, pH 8 dan kontrol (pH 6.8) miselia dapat memenuhi cawan petri dalam tiga hari setelah tanam (HST), tetapi masing-masing perlakuan memiliki pertambahan panjang yang berbeda pada tiap harinya.
Rata-rata pertambahan panjang diameter koloni Rhizoctonia sp. per hari yang paling maksimal adalah pada media PDA dengan pH kontrol (pH 6.8), yaitu sebesar 2.38 cm pada hari pertama, kemudian sebesar 6.35 cm pada hari kedua, dan sebesar 9 cm pada hari ketiga. Koloni pada media pH 2 tidak mengalami pertambahan diameter.
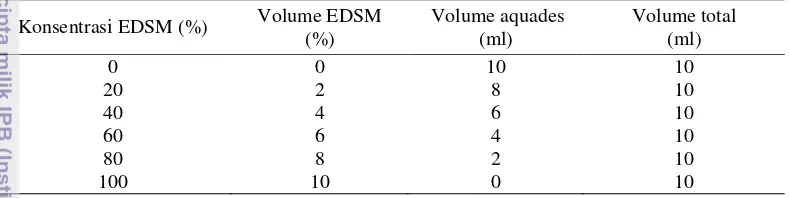
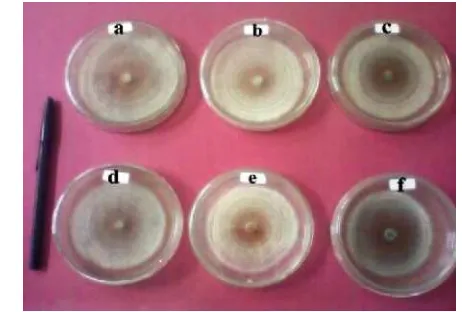
Penampakan visual pertumbuhan miselia Rhizoctonia sp. tampak berbeda antar perlakuan. Berdasarkan pengamatan pertumbuhan miselia, pada pH kontrol (pH 6.8) menunjukkan penampakan paling baik dengan miselia terlihat lebih tebal dibandingkan pada pH yang lainnya. Penampakan koloni Rhizoctonia sp. pada media PDA ditampilkan pada Gambar 1.
Gambar 1 Koloni Rhizoctonia sp. setelah diinkubasi selama 3 hari pada media PDA dengan beberapa tingkat pH (a) pH kontrol (pH 6.8); (b) pH 2; (c) pH 4; (d) pH 6; (e) pH 8
8
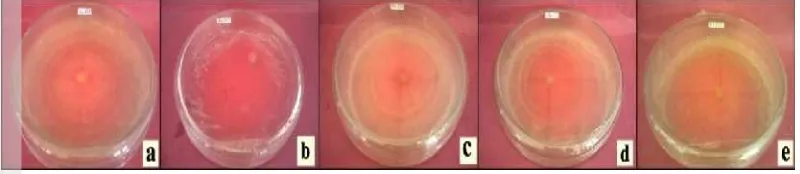
Gambar 2 Miselia Rhizoctonia sp. (a) Percabangan membentuk tegak lurus; (b) Memiliki sekat (perbesaran 400 kali)
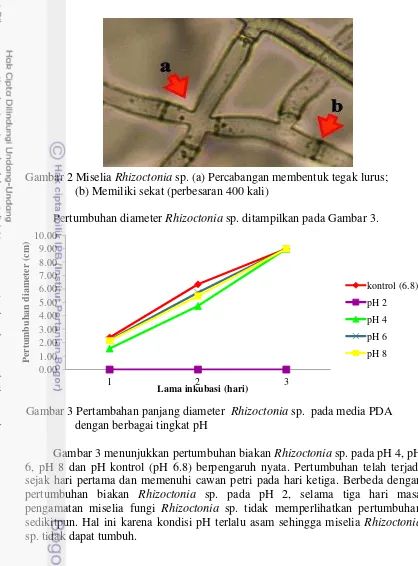
Pertumbuhan diameter Rhizoctonia sp. ditampilkan pada Gambar 3.
Gambar 3 Pertambahan panjang diameter Rhizoctonia sp. pada media PDA dengan berbagai tingkat pH
Gambar 3 menunjukkan pertumbuhan biakan Rhizoctonia sp. pada pH 4, pH 6, pH 8 dan pH kontrol (pH 6.8) berpengaruh nyata. Pertumbuhan telah terjadi sejak hari pertama dan memenuhi cawan petri pada hari ketiga. Berbeda dengan pertumbuhan biakan Rhizoctonia sp. pada pH 2, selama tiga hari masa pengamatan miselia fungi Rhizoctonia sp. tidak memperlihatkan pertumbuhan sedikitpun. Hal ini karena kondisi pH terlalu asam sehingga miselia Rhizoctonia sp. tidak dapat tumbuh.
Pertumbuhan Biomassa Miselia Rhizoctonia sp. pada Media PDB dengan Beberapa Tingkat pH
Hasil analisis ragam uji pertumbuhan in vitro biomassa miselia Rhizoctonia sp. menunjukan bahwa perlakuan pH pada media PDB berpengaruh nyata terhadap bobot kering miselia.
9 turut 0.135 gram, 0.133 gram, 0.126 gram, dan 0.092 gram.
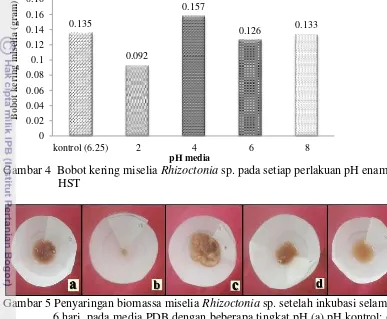
Bobot kering miselia Rhizoctonia sp. pada setiap perlakuan pH enam HST ditampilkan pada Gambar 4 dan 5.
Gambar 4 Bobot kering miselia Rhizoctonia sp. pada setiap perlakuan pH enam HST
Gambar 5 Penyaringan biomassa miselia Rhizoctonia sp. setelah inkubasi selama 6 hari pada media PDB dengan beberapa tingkat pH (a) pH kontrol; (b)
pH 2; (c) pH 4; (d) pH 6; (e) pH 8
Pertumbuhan Biomassa Miselia Rhizoctonia sp. pada Media PDB dengan Penggoyangan Media
Hasil analisis ragam uji pertumbuhan in vitro biomassa miselia Rhizoctonia sp. pada 6 HST menunjukkan bahwa perlakuan penggoyangan pada media PDB berpengaruh nyata terhadap bobot kering miselia.
Hasil inkubasi Rhizoctonia sp. pada media PDB dengan perlakuan penggoyangan 0 rpm, 50 rpm, 100 rpm, dan 150 rpm secara berturut-turut memiliki bobot kering miselia sebagai berikut: 0.025 gram, 0.205 gram, 0.232 gram, dan 0.044 gram. Rata-rata bobot kering miselia Rhizoctonia sp. terendah adalah pada media 0 rpm atau tanpa penggoyangan yaitu sebesar 0.025 gram. Sedangkan rata-rata bobot kering miselia Rhizoctonia sp. tertinggi adalah pada media dengan penggoyangan 100 rpm yaitu mencapai 0.232 gram.
10
Konsentrasi ekstrak daun sirih merah (%)
Gambar 6 Rata-rata bobot kering miselia Rhizoctonia sp. pada setiap perlakuan penggoyangan media
Gambar 7 Biomassa Rhizoctonia sp. setelah diinkubasi selama 6 hari pada media PDB dengan beberapa tingkat penggoyangan media (a) kontrol (0 rpm); (b) penggoyangan 50 rpm; (c) penggoyangan 100 rpm;
(d) penggoyangan 150 rpm
Penghambatan EDSM dengan Tingkat Konsentrasi yang Berbeda terhadap Pertumbuhan Rhizoctonia sp. Secara In Vitro
Berdasarkan hasil analisis ragam yang dilakukan, pemberian ekstrak daun sirih merah memberikan pengaruh nyata terhadap pertumbuhan diameter koloni Rhizoctonia sp. Semakin tinggi konsentrasi ekstrak daun sirih merah, maka pertumbuhan diameter koloni Rhizoctonia sp. semakin terhambat. Pertumbuhan diameter koloni Rhizoctonia sp. pada masing-masing perlakuan ditampilkan pada Gambar 8 dan 9.
Gambar 8 Pertumbuhan diameter koloni Rhizoctonia sp. pada media PDA dengan berbagai konsentrasi ekstrak daun sirih merah
11
Gambar 9 Koloni Rhizoctonia sp. setelah diinkubasi selama 3 hari dengan berbagai perlakuan kosentras ekstrak daun sirih merah (a) kontrol; (b) konsentrasi 20%; (c) konsentrasi 40%; (d) konsentrasi 60%; (e) konsentrasi 80%; (f) konsentrasi 100%
Penghambatan pertumbuhan diameter koloni Rhizoctonia sp. dihitung untuk mengetahui sejauh mana ekstrak daun sirih merah dapat memberikan pengaruh penghambatan. Hasil pengukuran pertumbuhan diameter koloni Rhizoctonia sp. menunjukkan bahwa semakin besar konsentrasi ekstrak daun sirih merah yang diberikan maka pertumbuhan diameter koloni Rhizoctonia sp. semakin terhambat. Oleh karena itu, daun sirih merah dapat digunakan sebagai bahan pestisida alami.
Pembahasan
Pertumbuhan Diameter Koloni Rhizoctonia sp. pada Media PDA dengan Beberapa Tingkat pH
Menurut Sarles et al. (1956), semua mikroorganisme mempunyai pH optimum, mereka dapat tumbuh baik, serta pH minimum saat sebagian besar reaksinya asam, sehingga pertumbuhan mereka akan terhambat. Sebagian besar pH maksimum reaksinya adalah alkali atau basa yang memungkinkan mereka tumbuh.
Berdasarkan pengujian pertumbuhan in vitro Rhizoctonia sp. pada media PDA menunjukkan bahwa pada pH 2 fungi tidak mengalami pertumbuhan pH 4, pH 6, pH 8, dan kontrol (pH 6,8) sama-sama memenuhi cawan petri dengan diameter 9 cm pada 3 HST, akan tetapi memiliki pertambahan panjang diameter koloni per hari yang berbeda antar perlakuan pH. Pertambahan diameter koloni paling tinggi terjadi pada perlakuan pH kontrol (pH 6.8). Hasil penelitian ini sesuai dengan pernyataan Goswami (2011), menyatakan bahwa Rhizoctonia sp. tumbuh pada kisaran pH 4-8 dengan pH optimum untuk pertumbuhannya adalah pH 6-7.
12
Penampakan visual pertumbuhan miselia Rhizoctonia sp. berdasarkan hasil penelitian menunjukkan adanya perbedaan pada pH kontrol (pH 6.8) dengan yang lainnya. Pada pH kontrol menunjukkan penampakan visual miselia Rhizoctonia sp. yang paling baik dengan miselia terlihat paling tebal dan warna miselia terlihat paling coklat dibandingkan dengan pH yang lainnya.
Pertumbuhan Biomassa Miselia Rhizoctonia sp. pada Media PDB (Potato
Dextrose Liquid) dengan Beberapa Tingkat pH
Fungi bersifat heterotrof. Fungi mendapatkan nutrisinya melalui penyerapan (absorption) molekul-molekul organik kecil dari medium di sekitarnya. Menurut Smith dan Onions (1994), sebagian besar fungi tumbuh baik antara pH 3-7 walaupun ada pula yang dapat tumbuh pada pH 2 dan kurang dari pH 2.
Menurut Kucharek (1994), Rhizoctonia sp. memiliki toleransi hidup pada selang pH yang lebar sehingga harus diwaspadai. Selain itu Rhizoctonia sp. dapat menyebabkan penyakit pada sejumlah spesies tanaman dengan kondisi lingkungan yang beragam.
Hasil uji pertumbuhan in vitro biomassa miselia Rhizoctonia sp. pada perlakuan pemberian pH dengan media PDB pertumbuhan terbaik terjadi pada pH 4. Perlakuan pemberian pH terbaik terjadi pada pH kontrol (pH 6.8). Lilly dan Barnett (1951) menemukan bahwa selang pH dari banyak fungi bervariasi pada media yang berbeda dan menyimpulkan bahwa selang pH yang paling luas diperoleh pada media yang baik, dalam hal ini media PDB dan PDA yang memiliki sumber karbon dekstrosa/glukosa.
Pertumbuhan Biomassa Miselia Rhizoctonia sp. pada Media PDB dengan Penggoyangan Media
Penggoyangan ditujukan untuk meningkatkan kadar oksigen dalam larutan, dengan mekanisme seperti dalam ruang yang terisolasi, larutan yang dikocok molekul H2O nya akan lebih banyak mengikat oksigen dari udara (Stanier et al. 1979).
Menurut Stakman dan Harrar (1957) sebagian besar patogen tanaman adalah aerob. Oleh karena itu memerlukan persediaan oksigen untuk mencapai pertumbuhan yang maksimum. Chang dan Miles (1997) menjelaskan bahwa komponen dari udara yang paling banyak digunakan adalah oksigen dan karbondioksida. Fungi merupakan spesies aerobik sehingga memerlukan oksigen yang cukup untuk pertumbuhan miselia.
Hasil analisis ragam uji pertumbuhan in vitro biomassa miselia Rhizoctonia sp. pada 6 HST menunjukkan bahwa perlakuan penggoyangan pada media PDB berpengaruh nyata terhadap bobot kering miselia.
13
Penghambatan EDSM dengan Tingkat Konsentrasi yang Berbeda terhadap Pertumbuhan Rhizoctonia sp. Secara In Vitro
Komponen penyusun terbesar dalam minyak atsiri daun sirih merah adalah senyawa fenol. Senyawa fenol yang terdapat dalam minyak atsiri daun sirih kemungkinan bersifat antimikroba.
Pelczar dan Chan (1988), menjelaskan bahwa semakin tinggi konsentrasi suatu zat antimikroba maka semakin tinggi daya antimikrobanya, artinya banyak bakteri akan terbunuh lebih cepat bila konsentrasi zat tersebut lebih tinggi. Suatu antimikroba dapat bersifat fungistatik atau fungitoksik. Fungistatik merupakan keadaan yang menggambarkan kerja suatu bahan fungisida yang menghambat pertumbuhan fungi. Fungitoksik merupakan keadaan yang menggambarkan kerja suatu bahan fungisida yang menghentikan pertumbuhan fungi. Fungistatik dapat diubah menjadi fungitoksik dengan cara menaikkan konsentrasi suatu antimikroba sampai titik kritis, sehingga fungi dapat dibunuh oleh fungisida tersebut.
Berdasarkan hasil analisis ragam yang dilakukan, pemberian ekstrak daun sirih merah pada media PDA memberikan pengaruh nyata terhadap pertumbuhan diameter koloni Rhizoctonia sp. Semakin tinggi konsentrasi ekstrak daun sirih merah, maka pertumbuhan diameter koloni Rhizoctonia sp. semakin terhambat.
Menurut Oktaviani (2012), kandungan kimia yang terdapat pada tanaman sirih merah mengandung metabolit sekunder yang menyimpan senyawa aktif seperti alkali, flavonoid, polivenol, tanin, minyak atsiri, saponin, hidroksikaficol, kavicol, kavibetol, karbavakrol, cyanogenic, eugenol, cineole, kadimen, glucoside, isoprenoid, nonprotein amino acid, terpenena, dan fenil propada. Kandungan zat kimia pada daun sirih merah yang memiliki efek antifungi:
1. Karvakrol
Menunjukkan anti jamur dan desinfektan, sehingga dapat digunakan sebagai obat antiseptik.
2. Flavonoid
Memiliki sifat antioksidan, senyawa fenol yang bersifat sebagai antidiabetik, antifungi, antikanker, antioksidan, antiseptik, antihepatotoksik, antihiperglikemik, dan antiinflamasi.
3. Alkaloid
Memiliki sifat antimikroba, penghambat pertumbuhan sel kanker. 4. Eugenol
Memiliki kandungan analgetik (mengurangi rasa sakit atau nyeri). 5. Saponin
Menunjukkan efek antijamur dan antibakteri.
14
SIMPULAN DAN SARAN
Simpulan
Diameter koloni Rhizoctonia sp. untuk perlakuan pH paling baik adalah pada media PDA dengan pH kontrol (6.8). Bobot kering miselia Rhizoctonia sp. dengan perlakuan pH paling baik adalah pada media PDB dengan pH 4 yaitu sebesar 0.157 gram. Bobot kering miselia paling tinggi pada perlakuan penggoyangan media dengan media PDB yaitu pada kecepatan penggoyangan 100 rpm diperoleh bobot kering miselia sebesar 0.232 gram. Koloni Rhizoctonia sp. yang paling terhambat pertumbuhannya adalah yang diberi ekstrak daun sirih merah dengan konsentrasi 100%.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai uji in vivo pengaruh pemberian ekstrak daun sirih merah terhadap serangan Rhizoctonia sp.
DAFTAR PUSTAKA
Alexopoulos CJ, Mims CW, Blackwell M. 1996. Introductory Mycology 4th Ed. New York (US): John Wiley & Sons, Inc.
Andoko, A. 2004. Budi Daya Padi Secara Organik. Jakarta (ID): Penebar Swadaya.
Chang St, Miles PG. 1997. Mushroom Biology Concise Basics and Current Development. Singapore (SG): World Scientific Publishing.
Hardaningsih S. 2008. Penyakit ubi kayu dan pengendaliannya. Di dalam Hardaningsih S, editor. Prosiding Seminar Ilmiah dan Pertemuan Tahunan PEI PFI XIX Komisariat Daerah Sulawesi Selatan [internet]. [waktu dan tempat pertemuan tidak diketahui]. Sulawesi Selatan (ID): Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian. Hlm 1-6; [diunduh 2013 Mei 5]. Tersedia pada: http://www.peipfi-komdasulsel.org/wp- content/uploads/2011/06/23-SRI-HARDANINGSIH-Penyakit-Ubikayu-219-224.pdf
Kucharek T. 1994. Rhizoctonia seedling blights of vegetables and field crops. [internet]. [diunduh 2013 Mei 21]. Tersedia pada: university.uog.edu/cals/people/.../VH00500.pdf.
Lilly VG, Barnett HL. 1951. Physiology of the Fungi. New York (US): McGraw- HillBook Company, Inc.
15
ovale pada penderita berketombe [skripsi]. Semarang (ID): Universitas Diponegoro.
Pelczar MJ Jr, Chan ECS. 1988. Dasar-Dasar Mikrobiologi. Volume ke-2. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta (ID): UI Press. Terjemahan dari: Elements of Microbiology.
Pratomo R. 2006. Pengaruh macam pH dan penggoyangan media terhadap pertumbuhan fungi Rhizoctonia sp. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Sarles WB, William CF, Joe WB, Stanley GK. 1956. Microbiology General and Applied 2nd ed. New York (US): Harper and Brother.
Sastrahidayat IR. 1990. Ilmu Penyakit Tumbuhan. Surabaya (ID): Penerbit Usaha Nasional.
Siregar EBM. 2005. Penyakit tanaman pinus [skripsi]. Sumatera Utara (ID): Universitas Sumatera Utara.
Soetikno. 1992. Dasar-Dasar Pestisida dan Dampak Penggunaannya. Jakarta (ID): Gramedia Pusat Utama.
Smith D, Onions HS. 1994. The Preservation and Maintenance of Living Fungi 2nd ed. London (GB): Commonwealth Agricultural Bureau International. Stakman EC, JG Harrar. 1957. Principles of Plant Pathology. New York (US):
The Ronald Press Company.
Stanier RY, Edward A Adelberg, John Ingraham. 1976. Dunia Mikroba 1. Gunawan AG, Angka SL, Ko GL, Haswoto, Bibiana L, penerjemah; Tjitrosomo SS, Editor. Jakarta (ID): Penerbit Bhatara Karya Aksara;
Terjemahan dari: Microbial world 1.
Suharti M. 1973. Penyebab dan Pengaruh Lingkungan Hidup Terhadap Timbulnya Penyakit “damping off” pada Persemaian Pinus merkusii Jungh et de Vries. Bogor (ID): Lembaga Penelitian Hutan.
Suryana I. 2009. Pengujian Aktivitas Daun Sirih (Piper betle Linn.) Terhadap Rhizoctonia sp. Secara In Vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor.
16
LAMPIRAN
Lampiran 1 Komposisi media pertumbuhan Rhizoctonia sp.
No Komposisi Media Jumlah
1 Potato Dextrose Agar (PDA) Kentang
17
Lampiran 3 Bobot kering miselia Rhizoctonia sp. dengan perlakuan penggoyangan media yang dibiakkan pada media PDB
Perlakuan
Lampiran 4 Pertumbuhan diameter koloni Rhizoctonia sp. pada perlakuan pemberian EDSM
Perlakuan
konsentrasi Ulangan
Pengamatan diamter (cm) hari ke-
18
Lampiran 5 Hasil sidik ragam pertumbuhan Rhizoctonia sp. diameter koloni Rhizoctonia sp. perlakuan pH hari ke-1
SK Db JK KT F hit Pr > F
Perlakuan 4 11.458 2.864 324.27 <0.0001*
Sisa 10 0.009 0.009
Total 14 11.546
Lampiran 6 Hasil sidik ragam pertumbuhan Rhizoctonia sp. diameter koloni Rhizoctonia sp. perlakuan pH hari ke-2
SK Db JK KT F hit Pr > F
Perlakuan 4 78.621 19.655 644.43 < 0.0001*
Sisa 10 0.305 0.030
Total 14 78.926
Lampiran 7 Hasil sidik ragam pertumbuhan Rhizoctonia sp. diameter koloni Rhizoctonia sp. perlakuan pH hari ke-3
SK Db JK KT F hit Pr > F
Perlakuan 4 194.400 48.600 Infty <0.0001*
Sisa 10 0.000 0.000
Total 15 194.400
Lampiran 8 Hasil sidik ragam bobot kering miselia Rhizoctonia sp. dengan perlakuan tingkatan pH
SK Db JK KT F hit Pr > F
Perlakuan 4 0.007 0.002 9.36 0.0021*
Sisa 10 0.002 0.0002
Total 14 0.008
Lampiran 9 Hasil sidik ragam bobot kering biomassa miselia Rhizoctonia sp. dengan perlakuan pemberian penggoyangan media
SK Db JK KT F hit Pr > F
Perlakuan 5 6.194 1.239 307.57 < 0.0001*
Sisa 12 0.048 0.004
Total 17 6.242
Lampiran 10 Hasil sidik ragam pengaruh pemberian ekstrak daun sirih merah terhadap pertumbuhan diameter koloni Rhizoctonia sp.
SK Db JK KT F hit Pr > F
Perlakuan 3 0.103 0.034 48.77 <0.0001*
Sisa 8 0.006 0.0007
Total 11 0.108
19
RIWAYAT HIDUP
Penulis dilahirkan di Kabupaten Kuningan Provinsi Jawa Barat pada tanggal 23 April 1990 dari ayah Ondi Waryo dan ibu Emay Maemunah. Penulis adalah putri ke tiga dari tiga bersaudara. Tahun 2002 penulis lulus dari SDN Dukuh Picung 1, kemudian pada tahun yang sama penulis melanjutkan pendidikan ke MTs Model Cigugur Kuningan hingga tahun 2005. Setelah itu penulis melanjutkan pendidikan ke MAN Model Babakan Ciwaringin Cirebon dan lulus tahun 2008. Pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur USMI (Undangan Seleksi Masuk IPB) dan diterima di Departemen Silvikultur Fakultas Kehutanan.
Selama menuntut ilmu di IPB, penulis aktif di sejumlah organisasi seperti BEM TPB IPB sebagai Sekretaris Departemen Kewirausahaan tahun 2008/2009, kemudian aktif di LDK Al Hurriyyah sebagai staff Lembaga Pengajaran Al Qur’an tahun 2008/2009, pengajar Bina Baca Qur’an Asrama Putri TPB IPB tahun 2008/2009. Penulis juga aktif di DKM ‘Ibaadurrahmaan sebagai sekretaris umum tahun 2009/2010, aktif di organisasi mahasiswa daerah (OMDA) Kuningan, dan sebagai anggota TGC (Tree Grower Community).
Pada tahun 2009 penulis menjadi Juara III MTQ IPB Cabang Tilawah, kemudian pada tahun 2010 menjadi Juara 1 Tulis Puisi Tingkat Nasional. Tahun 2011 dan 2012 penulis memperoleh dana hibah dari Pendidikan Tinggi karena mengikuti Program Kreatifitas Mahasiwa bidang kewirausahaan dan pengembangan masyarakat.
Penulis telah menyelesaikan praktek pengenalan ekosistem hutan (PPEH) yang bertempat di Suaka Margasatwa Gunung Sawal dan Cagar Alam Pangandaran pada tahun 2010. Penulis juga telah menyelesaikan praktek pengelolaan hutan (PPH) di Hutan Pendidikan Gunung Walat, Sukabumi tahun 2011. Penulis juga telah menyelesaikan praktek kerja profesi di Perum Perhutani Unit III Jawa Barat dan Banten selama 2 bulan tahun 2012.