ISOLASI
Candida albicans
DARI BEBERAPA PETERNAKAN
AYAM DI WILAYAH BOGOR DAN KERAGAMAN
KEPEKAAN TERHADAP ANTICENDAWAN
DESI JAYANTI SINAGA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Isolasi Candida albicans dari Beberapa Peternakan Ayam di Wilayah Bogor dan Keragaman Kepekaan Terhadap Anticendawan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
DESI JAYANTI SINAGA. Isolasi Candida albicans dari Beberapa Peternakan Ayam di Wilayah Bogor dan Keragaman Kepekaan Terhadap Anticendawan. Dibimbing oleh EKO SUGENG PRIBADI.
Penelitian ini bertujuan untuk mengisolasi C. albicans pada beberapa peternakan ayam. Litter, sumber air bersih yang digunakan dipeternakan, sumber air yang digunakan oleh penduduk di sekitar peternakan, sumber air yang dipakai di toilet peternakan dan contoh air pembuangan dikumpulkan dari wilayah Bogor. Cendawan yang telah diisolasi kemudian diidentifikasi dan diuji kepekaannya terhadap anticendawan ketokonazol, itrakonazol dan griseofulvin. C. albicans hanya diisolasi dari air pembuangan dan litter di dua peternakan. Semua C. albicans yang telah diisolasi masih peka terhadap ketokonazol, itrakonazol dan griseofulvin.
Kata kunci : anticendawan, Candida albicans, peternakan ayam
ABSTRACT
DESI JAYANTI SINAGA. Isolated Candida albicans of Poultry Farms in Bogor and Their Sensitivity to Antifungal. Supervised byEKO SUGENG PRIBADI.
The research aims to isolated Candida albicans at some poultry farm in Bogor. Litters, water drawn from farm wells, neighbor wells and restrooms, and disposal water samples were collected from four farms. Isolated fungi were identified and were examined their properties to antifungal of ketoconazole, itraconazole and griseofulvin. Candida albicans has been isolated from disposal water and litters at two farms. The all isolated Candida albicans were still sensitive to ketoconazole, itraconazole and griseofulvin.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
ISOLASI
Candida albicans
DARI BEBERAPA PETERNAKAN
AYAM DI WILAYAH BOGOR DAN KERAGAMAN
KEPEKAAN TERHADAP ANTICENDAWAN
DESI JAYANTI SINAGA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Isolasi Candida albicans dari Beberapa Peternakan Ayam di Wilayah Bogor dan Keragaman Kepekaan Terhadap Anticendawan
Nama : Desi Jayanti Sinaga NIM : B04080024
Disetujui oleh
Dr drh Eko S Pribadi, MS Pembimbing
Diketahui oleh
drh Agus Setiyono MS Ph.D APVet. Wakil Dekan Fakultas Kedokteran Hewan
Institut Pertanian Bogor
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini dilaksanakan sejak bulan Juli 2011 sampai Juli 2012 dengan judul Isolasi Candida albicans dari Beberapa Peternakan Ayam di Wilayah Bogor dan Keragaman Kepekaan Terhadap Obat Anticendawan.
Terima kasih penulis ucapkan kepada drh. Eko Sugeng Pribadi selaku pembimbing skripsi yang telah membantu selesainya tulisan ini, serta drh. Adi Winarto selaku pembimbing akademik. Di samping itu, penghargaan penulis sampaikan kepada Bapak Agus, Ibu Selin, Ibu Adeh beserta seluruh staf laboratorium bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Fakultas Kedokteran Hewan Institut Pertanian Bogor dan juga drh. Zainal yang telah membantu selama pengambilan contoh untuk penelitian. Ungkapan terima kasih juga disampaikan kepada Ayah, Ibu, Bang Christopel, Kak Surya, Bang Romi, Kak Nani, Bang Tulus, Erika, seluruh keluarga, Hamdanah, Alvi, Kak Uwen, Kak Budi, Sarah, Nita, Patricia, Kazia, Fardi, Anjani, Yuning, Febri, Dara, Mita, Hera, Desy, Atu, Kak Lora, Nidia, Aulia, Yuni, Yeti, Leo dan seluruh teman-teman atas segala doa, dukungan dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Hipotesis 3
TINJAUAN PUSTAKA 3
Candida albicans 3
Kejadian kandidiasis pada Peternakan Ayam 3
Antibiotika dan Anticendawan dalam Budidaya Ayam 4
METODE 5
Waktu dan Tempat Penelitian 5
Bahan dan Alat 5
Rancangan Penelitian 6
Analisis Data 9
HASIL DAN PEMBAHASAN 10
Pengambilan Contoh 10
Identifikasi Candida albicans 11
Penentuan Kadar Hambat Minimal 13
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 17
DAFTAR TABEL
1 Lokasi dan jumlah pengambilan contoh 11
2 Hasil uji tabung kecambah dan asimilasi gula-gula terhadap beberapa
isolat yang diduga sebagai Candida albicans 12
3 Jumlah contoh yang diperiksa dan jumlah contoh yang terdapat isolat
Candida albicans 13
4 Kadar tertinggi anticendawan yang digunakan untuk terbentuknya zona hambat terhadap beberapa isolat C. albicans yang diperoleh dari contoh 15 5 Nilai MIC ketokonazol, itrakonazol dan griseofulvin terhadap beberapa
isolat C. albicans yang diperoleh dari contoh 15
DAFTAR GAMBAR
1 Sel khamir (blastospora) 7
2 Uji tabung kecambah (germ tube test) 8
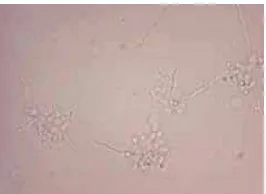
3 Lantai litter pada peternakan Rudi Jaya Farm 10
4 Hasil pemeriksaan natif yang diwarnai dengan LPCB memperlihatkan C. albicans dalam bentuk sel khamir (blastospora) yang membentuk
tunas (budding cell) 11
5 Tabung kecambah (tanda panah) yang dibentuk oleh isolat khamir yang
diduga C. albicans 12
PENDAHULUAN
Latar Belakang
Peternakan merupakan subsektor pembangunan pertanian yang menjadi bagian untuk memperkuat pelaksanaan kebijakan dan program revitalisasi pertanian. Pengembangan usaha peternakan memiliki peran penting dalam peningkatan kesejahteraan dan taraf hidup masyarakat khususnya bagi peternak, penyedia lapangan kerja bagi masyarakat, penopang sistem ekonomi pedesaan, serta mendukung pemenuhan kebutuhan akan protein hewani bagi masyarakat Indonesia (Mariyah 2010). Peternakan unggas menjadi industri utama di sub sektor peternakan di Indonesia karena permintaan produk ternak terus meningkat, sejalan dengan pertambahan penduduk dan perkembangan perekonomian nasional. Hal ini juga didukung dengan aspek teknis yang cukup sederhana dan relatif cepat menghasilkan dan produksi telur yang dapat dipanen setiap hari turut mendukung tumbuh kembangnya usaha ternak unggas (Diwyanto et al. 2005; Mariyah 2010).
Menurut Ditjennakkeswan (2013), konsumsi protein hewani dari pangan asal ternak masyarakat Indonesia sebesar 7,17 gram/kapita/hari yang meliputi daging sebesar 3,92 gram, telur sebesar 2,15 gram, dan susu sebesar 1,10 gram. Unggas merupakan salah satu sumber protein hewani yang mudah dan murah diperoleh. Sumbangan daging unggas dalam perekonomian di Indonesia terus meningkat dari 20% pada tahun 70-an menjadi 67,1% pada tahun 2010, dan saat ini menyumbang 64,7% terhadap produksi daging nasional. Tingkat konsumsi ini diproyeksikan akan semakin meningkat dengan meningkatnya populasi penduduk Indonesia, peningkatan pendapatan, urbanisasi, perubahan gaya hidup serta meningkatnya kesadaran akan pentingnya protein hewani dalam meningkatkan kecerdasan anak bangsa.
Peternakan ayam modern pada umumnya telah memperhatikan penggunaan bibit unggul, makanan dengan jumlah yang sesuai dan memenuhi kebutuhan gizi yang cukup, faktor lingkungan dan dibawah kendali penanganan profesional. Faktor genetik (bibit) merupakan faktor kebakaan yang mencerminkan produktivitas ternak dan faktor lingkungan merupakan faktor pendukung pencapaian produktivitas maksimal. Bibit unggul yang digunakan tidak akan mencapai produktivitas maksimal jika tidak didukung faktor lingkungan (Nuriyasa et al. 2010). Menurut Jamin (2011), faktor lingkungan dapat menyebabkan imunosupresi (gangguan sistem imun) terkait dengan masalah pengelolaan seperti air yang tidak memadai atau pasokan pakan, amonia, cekaman suhu, interaksi sosial di dalam kawanan dan cekaman lingkungan, seperti cendawan. Salah satu cendawan yang dapat ditemukan pada peternakan ayam yaitu Candida sp. yang dikenal sebagai penyebab kandidiasis.
2
saluran pencernaan pada hewan serta paling sering menginfeksi unggas dan menyebabkan lesi pada mukosa mulut, esofagus, dan tembolok (Taboada 2012).
Kandidiasis dapat dijumpai pada berbagai peternakan ayam komersial yang tersebar di berbagai daerah Indonesia, terutama yang dipelihara pada lingkungan yang mempunyai tingkat higienis yang kurang memadai. Menurut Tabbu (2000), faktor pemicu kandidiasis berupa sanitasi kandang ataupun peralatan, kondisi kandang dengan populasi yang padat, serta timbulnya cekaman. Pemberian antibiotika ke dalam pakan sebagai imbuhan pakan (feed additive) dapat merangsang pertumbuhan dan meningkatkan jumlah khamir secara sangat nyata dalam tembolok ayam pedaging. Hal ini disebabkan oleh adanya kemampuan khamir menggunakan antibiotika untuk merangsang pertumbuhannya (Hastiono 1987).
Mengingat kondisi wilayah Indonesia yang memiliki dua musim, yakni musim hujan dan musim kemarau atau pada saat peralihan kedua musim, maka kejadian kandidiasis dipandang cukup strategis pada usaha peternakan. Menurut Tabbu (2000), kandidiasis tidak menular dari ayam satu ke ayam lainnya. Penyakit ini dapat menular melalui oral karena memakan pakan, meminum air minum atau karena kontak dengan bahan/lingkungan yang tercemar oleh khamir. Penyakit ini dapat menular dengan mudah melalui air minum yang tercemar oleh C. albicans. Pakan atau bahan baku pakan, misalnya jagung yang tercemar oleh khamir tersebut dapat merupakan sumber infeksi bagi ayam.
Perumusan Masalah
Penelitian ini dirancang dengan memperhatikan beberapa permasalahan yang ada di lingkungan peternakan ayam, terutama yang berkaitan dengan keberadaan C. albicans.
Oleh karena itu, rencana penelitian ini disusun dengan memperhatikan hal-hal sebagai berikut:
(a) apakah lingkungan peternakan (litter, sumber air bersih, toilet, air pembuangan peternakan, sumur penduduk) merupakan sumber dari keberadaan C. albicans? (b) bagaimanakah keragaman dari isolat C. albicans yang diperoleh?
(c) bagaimanakah kepekaan C. albicans yang diisolasi dari lingkungan peternakan ayam peka terhadap beberapa obat anticendawan?
Tujuan Penelitian
3 Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
H0: Isolat C. albicans yang diisolasi dari lokasi peternakan ayam masih peka terhadap anticendawan.
H1: Isolat C. albicans yang diisolasi dari lokasi peternakan ayam sudah tidak peka lagi terhadap anticendawan.
TINJAUAN PUSTAKA
Candida albicans
Perkembangan infeksi C. albicans di Indonesia cukup strategik karena Indonesia termasuk wilayah yang beriklim tropik dengan udara yang lembab, sanitasi yang kurang, lingkungan yang padat dan tingkat sosio-ekonomi yang rendah (Ariningsih 2009). C. albicans adalah khamir dimorfik komensal atau patogen oportunistik yang mampu menyebabkan berbagai infeksi (He et al. 2007). Menurut Treagan (2011) bahwa C. albicans diklasifikasikan sebagai berikut:
Kingdom : Fungi Filum : Ascomycota Kelas : Hemiascomycetes Ordo : Saccharomycetales Famili : Candidaceae Genus : Candida Spesies : C. albicans
C. albicans termasuk sel ragi uniseluler yang memperbanyak diri secara bertunas yang disebut dengan blastospora dan blastospora ini akan terus memanjang membentuk hifa semu (Sudbery 2011). Pada umumnya candida sp. tumbuh baik pada medium agar Sabouraud dekstrosa. Pada medium tersebut organisme ini membentuk koloni seperti ragi (yeast-like colony) yang berbentuk bulat dengan diameter 2–4 mm, berwarna putih kekuningan, dengan permukaan yang halus. Candida sp. merupakan organisme eukariot uniseluler secara mikroskopik. Sel ragi dan sel tunas umumnya berbentuk bulat, oval sampai hampir silindris dengan ukuran 2–7 × 3–8,5 µm (Tyasrini et al. 2006).
Kejadian Kandidiasis pada Peternakan Ayam
4
disebabkan ole h Candida sp. yang masuk ke dalam tubuh dari lingkungan. Air yang tercemar oleh Candida sp. merupakan salah satu sumber pencemar eksogen.
Kandidiasis biasanya merupakan penyakit ikutan dan umumnya lebih sering menyerang ayam muda. Namun kenyataannya, semua golongan umur bisa terinfeksi. Gejala yang tampak pada hewan yang terserang kandidiasis tidak terlalu spesifik. Namun, akibat penyakit ini pertumbuhan ayam menjadi terhambat, bulu berdiri atau ayam mengalami diare. Selain itu, terdapat luka serius, terutama disaluran pencernaan bagian atas seperti mulut, faring, esofagus, dan tembolok. Namun luka ini juga bisa tumbuh di proventikulus (Fadilah dan Polana 2004).
Secara normal, C. albicans ada di saluran pencernaan ayam. Kemunculan penyakit bisa terjadi bila kondisi normal mikroflora di dalam saluran pencernaan berubah. Kondisi ini menyebabkan khamir ini akan berkembang dan menyerang mukosa sehingga menghasilkan luka di saluran pencernaan. Pencegahan kandidiasis hanya bisa dilakukan dengan meningkatkan tingkat sanitasi, menghindari pemberian antibiotika, koksidiostat, dan menghindari stimulan pertumbuhan yang berlebihan yang dapat mempengaruhi mikroflora di sepanjang saluran pencernaan (Fadilah dan Polana 2004).
Antibiotika dan Anticendawan dalam Budidaya Ayam
Menurut Kementan (2013), pada tahap praproduksi penggunaan obat hewan memiliki peranan yang sangat penting agar produktivitas ternak dapat dipertahankan atau ditingkatkan. Dari pengamatan di lapang pemakaian antibiotika terutama pada peternakan ayam pedaging dan petelur cenderung berlebihan tanpa memperhatikan aturan pemakaian yang benar. Hampir semua pabrik pakan menambahkan obat hewan berupa antibiotika ke dalam pakan komersial sehingga sebagian besar bahan pakan komersial yang beredar di Indonesia mengandung antibiotik. Keadaan ini diperkuat oleh informasi bahwa sebagian besar contoh pakan ayam dari Cianjur, Sukabumi, Bogor Tangerang dan Bekasi positif mengandung residu antibiotika golongan tetrasiklin dan obat golongan sulfanamide (Balitvet 1991).
Pemakaian antibiotika dengan dosis yang tidak tepat dapat menyebabkan timbulnya kekebalan kuman terhadap jenis antibiotika tertentu. Efek samping dari pemakaian antibiotika adalah terganggunya keseimbangan populasi normal mikroflora. Bila hal ini terjadi, maka keadaan ini akan menyebabkan keadaan superinfeksi dan meningkatkan pertumbuhan Candida sp. Berkurangnya bakteri menyebabkan Candida sp.dapat tumbuh dengan subur karena tidak ada persaingan dalam memperoleh makanan/nutrisi yang menunjang pertumbuhan Candida sp. tersebut (Wahyuningsih et al. 2008).
5 Ketokonazol
Ketokonazol merupakan obat anticendawan sintetik berspektrum luas. Menurut Prima dan Habib (2007), ketokonazol mempunyai kadar hambat minimal dan kadar bunuh minimal masing-masing sebesar 2,5 μg/mL. Sedangkan berdasarkan kriteria resistensi dan kepekaan anticendawan, equivalent MIC breakpoint menunjukkan ketidakpekaan ketokonazol sebesar > 0,8 µg/mL dan kepekaan terhadap ketokonazol ≤ 0,8 µg/mL (Forbes et al. 2000). Perbedaan kadar hambat minimal ketokonazol terhadap C. albicans dapat saja terjadi di tiap negara. Hal ini disebabkan oleh perbedaan pola persebaran variasi genetik C. albicans dan perbedaan tingkat penggunaan ketokonazol pada masing-masing negara.
Itrakonazol
Itrakonazol adalah anticendawan triazol yang lebih baru dan memiliki spektrum kerja luas. Itrakonazol merupakan golongan triazole, sangat lipofilik, bersifat fungistatik dan efektif untuk dermatofita (Niewerth dan Korting 2000). Menurut Koga et al. (2008), nilai kadar hambat minimum itrakonazol yang masih tergolong peka terhadap C.albicans berada pada kisaran 0,125–4 µg/mL.
Griseofulvin
Griseofulvin adalah anticendawan yang dihasilkan oleh Penicillium griseofulvum. Griseofulvin merupakan golongan miscellaneous dan menjadi satu-satunya obat dari jenis golongan ini (Ali 2008). Obat ini mematikan sel cendawan muda yang bermetabolisme aktif dan hanya bersifat menghambat pertumbuhan sel cendawan yang lebih tua. Menurut Tjay dan Rahardja (2007), mekanisme kerja obat ini melalui penghambatan sintesis RNA (sama seperti kolkisin). Penyerapannya di usus kurang baik karena sukar larut dalam air. Akan tetapi, tingkat penyerapan obat ini dapat diperbaiki dengan membentuknya serbuk yang sangat halus (microfine) atau diminum dengan makanan berlemak. Kadar hambat minimum untuk griseofulvin adalah 800 µg/mL (Sehgal et al. 2005).
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Juli 2011 sampai dengan bulan Juli 2012. Kegiatan ini dilakukan di Laboratorium Bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Bahan dan Alat
6
Bahan yang digunakan adalah antibiotika, anticendawan dan reagen yang digunakan antara lain Lactophenol Cotton Blue (LPCB), KOH 10%, Sabouraud dextrose agar (SDA), potatoes dextrose agar (PDA), putih telur bebek, NaCl 0,9%, air suling sucihama, antibiotika kloramfenikol dengan dosis 0,05 mg/mL medium, dan anticendawan (griseofulvin, itrakonazol, ketokonazol).
Contoh yang digunakan dalam penelitian ini adalah litter dari kandang ayam di peternakan, contoh air yang digunakan sebagai sumber air bersih, contoh air yang digunakan di toilet peternakan, contoh air yang digunakan oleh penduduk di sekitar peternakan dan contoh limbah pembuangan peternakan (parit/sungai).
Rancangan Penelitian
1. Pengambilan Contoh
Pengambilan contoh dilakukan pada beberapa peternakan di sekitar wilayah Kabupaten Bogor yaitu Quansu Farm, Dian Layer Farm, Caringin Farm dan di daerah Depok yaitu Rudi Jaya Farm. Contoh yang diambil berupa litter yang dipakai di peternakan, sumber air bersih yang digunakan dipeternakan, sumber air bersih yang dipakai di toilet peternakan, limbah air peternakan (parit/sungai), dan sumber air yang digunakan oleh penduduk di sekitar peternakan. Pada saat pengmbilan contoh, contoh dimasukkan pada kantung plastik kosong sucihama berkode lengkap, dan di bawa ke laboratorium dengan menggunakan media transport.
2. Perlakuan Contoh
Contoh diproses di laboratorium. Tahapan-tahapan dari proses pembiakan contoh ini dipaparkan di bawah ini.
2.1Litter
Contoh Litter yang diambil ditimbang seberat 10 g, kemudian dilarutkan dalam 90 mL air suling sucihama sehingga diperoleh larutan dengan tingkat pengenceran 10-1. Sebanyak 1 mL diambil dari tabung pengenceran tersebut dan dimasukkan ke dalam tabung kedua yang berisi 9 mL air suling sucihama (diperoleh tabung pengenceran 10-2). Demikian seterusnya hingga diperoleh tabung pengenceran 10-6. Sebanyak 1 mL diambil dari setiap tabung pengenceran dan dituangkan ke dalam cawan petri sucihama. Kemudian, media SDA cair yang telah siap memadat dituangkan ke dalam cawan tersebut. Cawan digoyang-goyangkan mengikuti angka delapan agar suspensi dan media tercampur sempurna. Media tersebut didiamkan sampai memadat dan diinkubasi pada suhu 37 ºC selama tiga hari.
2.2Air
7 sehingga diperoleh tingkat pengenceran 10-2. Sebanyak 1 mL dari setiap pengenceran dituangkan ke dalam cawan petri sucihama. Kemudian, media SDA cair siap memadat dituangkan ke dalam cawan tersebut. Cawan digoyang-goyangkan mengikuti angka delapan agar suspensi dan media tercampur sempurna. Media tersebut didiamkan sampai memadat dan diinkubasi pada suhu 37 ºC selama tiga hari.
3. Pengamatan Hasil Inkubasi
Pengamatan dilakukan terhadap koloni khamir yang tumbuh pada pembiakan setelah masa inkubasi dicapai. Pengamatan yang dilakukan meliputi warna, bentuk, dan baunya koloni. Pengamatan mikroskopik dilakukan dengan pewarnaan LPCB, untuk melihat ukuran, bentuk sel dan sel bertunas (budding cell), dan cirri-ciri morfologi lainnya terhadap koloni yang diduga sebagai koloni Candida sp. Koloni yang diduga sebagai koloni Candida sp. berdasarkan pengamatan makro- dan mikroskopik, dibuatkan subkultur di media agar miring PDA dan diinkubasi pada suhu 25–27 oC selama tiga hari.
4. Identifikasi Isolat
Kegiatan mengidentifikasi koloni-koloni yang diduga sebagai koloni Candida sp. dilakukan dengan mengacu pada Al Doory (1980).
4.1Pemeriksaan mikroskopik
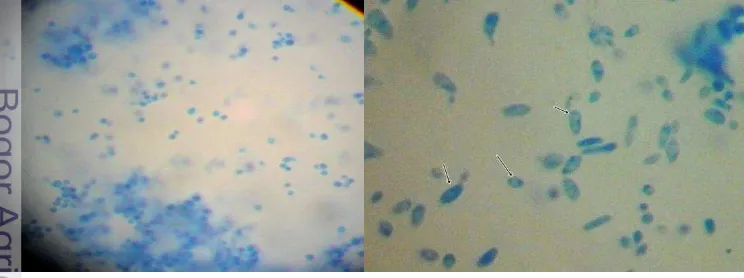
Koloni yang diduga sebagai C. albicans diinokulasi dengan ose pada gelas objek dan diwarnai dengan LPCB. Setelah itu diamati dengan mikroskop dan hasil yang positif menunjukkan adanya sel khamir (blastospora ) dengan atau tanpa hifa semu.
Gambar 1 Sel khamir (blastospora ) (Stafford 2002; Babic dan Hukic 2010) 4.2Uji tabung kecambah (germ tube test)
8
Gambar 2 Uji tabung kecambah (germ tube) (Babic dan Hukic 2010) 4.3Uji Asimilasi Gula-gula
Deretan tabung reaksi berisi media cair Sugar Assimilation Medium yang mengandung gula sukrosa, L-arabinosa, laktosa, glukosa, maltosa, dan manitol yang diperlukan dan satu tabung kontrol, yang berisi media yang sama tetapi tidak mengandung gula disiapkan untuk keperluan uji ini. Kemudian secara aseptik, sedikit koloni khamir (paling lama berumur tiga hari) dipindahkan ke tabung reaksi yang di dalamnya telah terdapat 2 mL air suling sucihama. Suspensi tersebut dihomogenkan dan kekeruhannya disamakan dengan larutan McFarland #1. Lalu, sebanyak 0,2 mL suspensi khamir yang telah homogen dipindahkan secara aseptik ke tabung-tabung gula-gula dan juga ke tabung kontrol. Seluruh tabung yang mendapatkan isolat diinkubasi pada suhu 30 0C selama tujuh hari atau setelah terjadi perubahan kekeruhan. Setelah masa inkubasi dicapai, seluruh tabung diamati terhadap adanya pertumbuhan dan kekeruhan pada media. Suspensi yang diamati pertama kali adalah pada tabung kontrol. Bila pada tabung kontrol terjadi kekeruhan yang menandakan adanya pertumbuhan, maka percobaan dibatalkan dan harus diulang. Bila tidak terjadi demikian, maka pengamatan akan diteruskan. Hasil positif ditandai dengan adanya pertumbuhan dan terlihat media di tabung yang keruh dibandingkan media di tabung kontrol.
5. Uji Aktifitas Anticendawan
Uji ini dilakukan hanya untuk koloni yang sudah dipastikan sebagai koloni C. albicans. Pengujian dilakukan melalui dua tahapan, yakni (i) uji antibiogram, dan (ii) penentuan kadar terendah yang masih dapat menghambat pertumbuhan (minimum inhibition concentration,MICs) seperti yang dilakukan oleh Reezal et al. (2002) dan Koselac et al. (2005).
5.1Uji antibiogram
Uji antibiogram dilakukan sebagai uji penapisan untuk melihat kemampuan obat anticendawan bekerja terhadap C. albicans. Bila C. albicans masih peka terhadap obat anticendawan yang diuji, maka akan terlihat adanya zona hambat di sekitar titik penempatan anticendawan yang digunakan. Pengujian ini menggunakan metode difusi agar. Anticendawan yang digunakan adalah ketokonazol dengan kadar pengenceran 1µg, 2 µg, 4 µg, 8 µg dan 16 µg ; griseofulvin dengan kadar pengenceran 4 µg, 8 µg, 16 µg, 32 µg dan 64 µg; itrakonazol dengan kadar pengenceran 1 µg, 2 µg, 4µg, 8 µg dan 16 µg.
9 disapu-ratakan menggunakan kapas bergagang (cotton swab) sucihama dengan harapan merata pada seluruh permukaan lempengan agar. Setelah didiamkan selama lima menit, agar dilubangi sebanyak lima lubang dengan jarak yang telah diatur sedemikian rupa sehingga tidak terjadi penumpukan zona hambat yang akan dihasilkan nantinya. Sebanyak 50 µ l dari masing-masing suspensi anticendawan yang digunakan dimasukkan ke dalam lubang-lubang yang telah dibuat. Cawan yang telah selesai diberi perlakuan diinkubasi pada suhu 27–29 ºC selama 24–48 jam. Adanya aktifitas anticendawan akan ditunjukkan dengan terbentuknya zona hambat di sekitar lubang.
5.2Penentuan Kadar Hambat Minimum
Penentuan kadar hambat minimum adalah konsentrasi terendah dari antimikroba yang menunjukkan pengurangan 100% mikroba setelah di inkubasi dibandingkan dengan kontrol untuk poliena dan pengurangan 80% mikroba untuk golongan azole (Lalitha et al. 2007). Uji ini diawali dengan menempatkan koloni C. albicans umur 24 jam ke tabung reaksi yang di dalamnya terdapat 9 mL air suling sucihama dan dihomogenkan untuk disamakan kepekatannya dengan larutan McFarland #1 (diperkirakan setara dengan jumlah 108 cfu/mL C. albicans). Suspensi diencerkan sampai kandungan khamir diperkirakan mencapai 106 cfu/mL.
Anticendawan yang digunakan dalam penelitian ini adalah ketokonazol dengan kadar 2 µg/mL, 4 µg/mL, 8 µg/mL, dan 16 µg/mL; itrakonazol dengan kadar 1 µg/mL, 2 µg/mL, 4 µg/mL, dan 16 µg/mL; griseofulvin dengan kadar 0,25 µg/mL, 8 µg/mL, 16 µg/mL, dan 64 µg/mL. Berpatokan dari kadar tertinggi setiap obat anticendawan maka ketokonazol ditimbang seberat 3,2 mg, itrakonazol seberat 3,2 mg dan griseofulvin seberat 12,8 mg untuk dilarutkan ke dalam 200 mL air suling sucihama. Setelah itu sebanyak 2 mL dari suspensi anticendawan yang telah dibuat, diambil dan dimasukkan ke dalam tabung reaksi berisi 2 mL pengencer sehingga diperoleh suspensi anticendawan dengan kadar setengah dari dosis sebelumnya. Demikian seterusnya hingga diperoleh suspensi anticendawan dengan kadar yang akan dipakai.
Suspensi C. albicans yang telah diimbuhi anticendawan dengan berbagai kadar yang akan diuji, diencerkan sampai ke tingkat pengenceran 10-7. Sebanyak 1 mL dari masing-masing tabung pengenceran 10-3 sampai 10-7 dituangkan ke dalam satu cawan petri kosong dan sucihama. Setelah itu, ke dalam semua cawan dituangi media PDA yang diimbuhi kloramfenikol (0,05 mg/mL medium). Cawan digerakkan membentuk angka delapan sehingga suspensi tercampur merata ketika memadat. Setelah didiamkan dan agar memadat, seluruh cawan diinkubasi pada suhu 37 oC selama 24 jam. Koloni yang tumbuh setelah masa inkubasi dicapai dihitung dengan aturan hanya cawan yang diperkirakan mengandung kisaran 25–250 koloni yang tumbuh saja yang akan dihitung.
Analisis Data
10
HASIL DAN PEMBAHASAN
Pengambilan Contoh
Pengambilan contoh dilakukan pada beberapa peternakan di sekitar wilayah Kabupaten Bogor yaitu Quansu Farm, Dian Layer Farm, Caringin Farm dan di daerah Depok yaitu Rudi Jaya Farm. Jenis ayam yang dipelihara adalah ayam pedaging dan ayam petelur. Peternakan ayam merupakan suatu usaha atau kegiatan pemeliharaan dan budidaya ayam dengan tujuan memperoleh keuntungan ekonomi dengan menyediakan kebutuhan protein hewani bagi masyarakat. Peternakan ayam akan menghasilkan produksi yang optimal jika memperhatikan aspek kenyamanan dan kesehatan ternak. Menurut Nuriyasa et al. (2010), Ibrahim dan Allaily (2012) rasa nyaman pada ternak dipengaruhi oleh kepadatan ternak, ketersediaan air dan jenis lantai kandang yang dipergunakan.
Litter yang dipakai sebagai alas lantai peternakan merupakan salah satu contoh yang digunakan untuk mengisolasi Candida sp. Lantai litter adalah salah satu jenis lantai yang umum dipakai pada peternakan ayam, karena keadaan kandang akan menjadi lebih hangat dan pengelolaannya relatif mudah. Namun litter dapat mengalami fermentasi sehingga menghasilkan gas metan dan amonia yang dapat meningkatkan suhu udara di dalam kandang (Puspani et al. 2008). Pengambilan contoh Litter dilakukan pada hampir semua peternakan, kecuali peternakan Dian Layer Farm karena peternakan ini tidak menggunakan Litter sebagai alas kandang. Sementara untuk pengambilan contoh air dilakukan pada seluruh peternakan. Menurut Noverita (2009), air minum maupun air sungai telah tercemar khamir dan kapang. Oleh sebab itu, penelitian ini menggunakan air yang dipakai di peternakan dan lingkunagan peternakan untuk mengisolasi Candida sp. Gambar suasana peternakan di salah satu lokasi peternakan yang dijadikan tempat penelitian terlihat pada Gambar 3.
11 Tabel 1 Lokasi dan jumlah pengambilan contoh
Lokasi pengambilan
contoh
Jumlah contoh ysng diambil berdasarkan jenis
Jumlah
Identifikasi dilakukan pada koloni yang diduga C .albicans pada contoh yang sebelumnya telah dibiakkan dengan menggunakan metode agar tuang. Media tersebut diinkubasi pada suhu 37 ⁰C selama 24 jam. SDA merupakan media biakan C. albicans karena merupakan media tumbuh standar yang banyak mengandung gula dan pepton yang mendukung pertumbuhan Candida sp. Setelah diinkubasi, isolat yang tumbuh diamati secara makroskopik ada tidaknya koloni berwarna putih dengan permukaan halus, licin serta memiliki bau yang khas seperti ragi, kemudian dilanjutkan dengan pemeriksaan mikroskopik dalam bentuk sediaan natif yang diwarnai dengan LPCB. Hasil identifikasi memperlihatkan adanya bentuk sel khamir (blastospora ) yang merupakan salah satu bentuk dari fase pertumbuhan dimorfik yang ada pada C. albicans serta akan membentuk tunas (budding cell). Sedangkan pada identifikasi berikutnya memperlihatkan adanya pseudohifa yang juga merupakan bentuk dari fase pertumbuhan dimorfik C. albicans. Menurut Heitman (2006) bentuk pseudohifa dan hifa menjadi penciri untuk mengidentifikasi Candida sp. dan juga berguna untuk diagnosis kandidiasis.
12
Uji tabung kecambah merupakan suatu uji paling sederhana untuk mengidentifikasi presumtif C. albicans. Khamir ini bila diinkubasi dalam putih telur pada suhu 37 oC dan pH netral dapat membentuk tabung kecambah. Pembentukan tabung kecambah merupakan tahap awal dari proses transisi fase khamir ke fase hifa. Tabung kecambah ini hanya dapat dibentuk oleh C. albicans dan C. stellatoidea. C.albicans membentuk tabung kecambah dalam jangka waktu inkubasi 1–3 jam pertama. Sedangkan spesies Candida sp. lainya akan membentuk tabung kecambah setelah tiga jam (Crissey et al. 1995). Bentuk tabung kecambah yang diamati dari uji tabung kecambah ini seperti terpapar pada Gambar 5.
Gambar 5 Tabung kecambah (tanda lingkaran) yang dibentuk oleh isolat khamir yang diduga C. albicans (Pembesaran: 40 ×)
Isolat yang membentuk tabung kecambah, diteruskan pengujiannya dengan uji asimilasi karbohidrat. C. albicans dan Candida sp. lainnya dapat dibedakan berdasarkan kemampuannya menggunakan karbohidrat spesifik (glukosa, maltosa, sukrosa, galaktosa, dan laktosa) sebagai sumber tunggal dari karbon dengan adanya oksigen, kemampuan menghasilkan karbon dioksida dan alkohol (uji fermentasi) (Crissey et al. 1995). Hasil uji terhadap pembentukan tabung kecambah dan proses asimilasi terhadap karbohidrat terpapar pada Tabel 2.
Tabel 2 Hasil uji tabung kecambah dan asimilasi gula-gula terhadap seluruh isolat yang diduga sebagai C. albicans
13
Tabel 2 diatas menunjukkan bahwa isolat-isolat yang diduga sebagai koloni Candida sp. sebagian besar dikenali sebagai C. albicans. Hanya satu isolat yang dikenali sebagai C. krusei, yaitu isolat yang berasal dari Dian Layer Farm. Menurut Ashbee dan Bignell (2009) C. krusei menyebabkan infeksi saluran kemih pada anjing dan kucing, mastitis dan aborsi pada ternak, serta infeksi saluran pencernaan pada unggas. Candida ini tersebar luas di alam dan tergolong patogen lemah jika dibandingkan dengan Candida sp. terutama Candida albicans (Samaranayake dan Samaranayake 1994).
Keberadaan isolat C. albicans yang diisolasi dari lingkungan peternakan terpapar pada Tabel 3. Berdasarkan dari Tabel tersebut, terlihat bahwa air pembuangan peternakan merupakan media yang paling rentan untuk dijadikan media hidup oleh C. albicans. Sedangkan litter dari Quansu Farm dan Rudi Jaya Farm juga ditemukan C. albicans. C. albicans tidak ditemukan dalam sumber air bersih, air dari kamar kecil (toilet) peternakan dan sumber air penduduk di sekitar peternakan.
Keberadaan C. albicans yang hanya ditemukan pada dua lokasi, yaitu air pembuangan dan litter, disebabkan kecenderungan C. albicans yang lebih menyukai lingkungan dengan sanitasi buruk dan lembab (Ayuningtyas dan Suryaatmadja 2011). Hal ini juga sesuai dengan hasil penelitian Noverita (2009) yang menyatakan bahwa 70% dari contoh air terdapat cemaran khamir. C. albicans dan C. krusei merupakan spesies khamir yang ditemukan di dalam perairan. Kondisi lembab pada litter akibat feses, tumpahan air minum atau keberadaan litter yang jarang diganti dapat memicu pertumbuhan Candida sp.tersebut. Pertumbuhan Candida sp. dipengaruhi oleh beberapa faktor yaitu suhu, pH, nutrisi (gula, asam amino dan peptida), bahan kimia misalnya serum, dan berbagai faktor lingkungan. Tabel 3 Jumlah contoh yang diperiksa dan jumlah contoh yang terdapat isolat C.
albicans Lokasi pengambilan contoh
Contoh yang diperiksa dan keberadaan C. albicans Litter Sumber
Ca: jumlah contoh yang mengandung isolat C. albicans
Penentuan Kadar Hambat Minimum
14
digunakan dan metode lubang (sumuran) merupakan metode yang dilakukan pada penelitian ini. Menurut Nurainy et al. (2008), metode sumur didasarkan pada kemampuan senyawa-senyawa antimikroba yang diuji untuk menghasilkan jari-jari zona penghambatan di sekeliling sumur uji terhadap mikroba yang digunakan sebagai penguji. Tampilan terbentuknya zona hambat yang dilakukan pada penelitian ini terpapar pada Gambar 4 di bawah ini.
Gambar 6 Zona Hambat yang dibentuk oleh anticendawan
Zona bening yang terdapat pada Gambar 6 adalah hasil dari proses penghambatan yang diakibat oleh adanya anticendawan yang ditambahkan ke dalam media. Namun besar atau kecilnya zona hambat yang terbentuk tidak dapat menentukan peka atau resistennya C. albicans yang diuji terhadap anticendawan yang dipakai karena hasil ini dipengaruhi oleh banyak faktor, seperti ketebalan media, waktu pradifusi, dan kerapatan inokulum. Jadi, metode ini hanya untuk menapis apakah C. albicans masih peka atau tidak terhadap anticendawan yang digunakan dan tidak dapat digunakan untuk menentukan kadar hambat minimum (Rostinawati 2009).
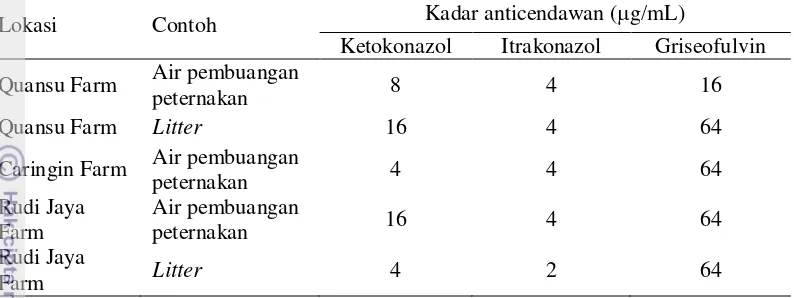
15 Tabel 4 Kadar tertinggi anticendawan yang digunakan untuk terbentuknya zona hambat terhadap beberapa isolat Candida albicans yang diperoleh dari contoh
Lokasi Contoh Kadar anticendawan (g/mL)
Ketokonazol Itrakonazol Griseofulvin
Menurut Koga et al. (2008), MIC suatu anticendawan ditentukan berdasarkan kadar terendah yang dapat menghambat pertumbuhan koloni cendawan sebanyak 80%. Dari hasil persentase jumlah kematian candida sp. yang diperoleh, dapat diketahui bahwa ketokonazol sudah dapat menghambat ≥80% pertumbuhan seluruh contoh dengan kadar 2 µg/mL. Sementara itu Itrakonazol dapat menghambat ≥80% pertumbuhan C. albicans dari contoh dengan kadar terkecil 2 µg/mL (Litter di Quansu farm dan Rudi Jaya farm, air pembuangan peternakan di Quansu farm) dan 1 µg/mL (air pembuangan peternakan di Caringin Farm dan Rudi Jaya farm). Griseofulvin dapat menghambat pertumbuhan cendawan ini dengan kadar 0,25 µg/mL (air pembuangan peternakan di Quansu farm), 8 µg/mL (Litter di Quansu farm dan air pembuangan peternakan di Caringin farm), dan 64 µg/mL (air pembuangan peternakan dan Litter di Rudi jaya farm). Nilai MIC yang diperoleh dapat dilihat pada Tabel 5.
Tabel 5 Nilai MIC ketokonazol, itrakonazol dan griseofulvin terhadap beberapa isolat C. albicans yang diperoleh dari contoh
Contoh Lokasi Contoh Anticendawan
KTK ITK GRIS
KTK: ketokonazol; ITK: itrakonazol; GRIS: griseofulvin.
16
Ketokonazol merupakan salah satu agen antifungi yang sering digunakan dalam pengobatan kandidiasis. Mekanisme kerja dari obat ini menghambat sintesis ergosterol.Karena penyerapannya yang cukup baik, umumnya ketokonazol dalam pengobatan kandidiasis digunakan dalam bentuk sediaan oral (Yulian 2007). Itrakonazol adalah antijamur berspektrum luas yang prinsip utama kerjanya sama seperti antijamur golongan azole lainnya yaitu menghambat enzim cytochrome P450 14a-demethylase (P45014DM) pada jalur biosintesis sterol, yang mengubah lanosterol menjadi ergosterol. Metabolit utama dari itrakonazol adalah hydroxy-itrakonazole, yang memiliki aktifitas antijamur. Itrakonazol peroral absorbsinya sangat bervariasi, yang mengakibatkan konsentrasi dalam plasma juga bervariasi (Muin 2009). Sementara itu, griseofulvin disebutkan sebagai obat yang sering digunakan sebagai fungistatis terhadap banyak dermatofita dengan mekanisme kerjanya melalui pengambatan sintesis RNA (Tjay dan Rahardja 2007).
Griseofulvin merupakan anticendawan yang bekerja dengan cara menghambat mitosis cendawan yang menyebabkan pemutusan berkas mitotik sebagai akibat dari interaksi obat dengan mikrotubulus yang terpolimerisasi.
Griseofulvin juga mengganggu sistem pengangkutan di dalam sel yang tergantung pada
adanya energi (energy-dependent transport system). Dengan demikian, keberadaan
griseofulvin akan menyebabkan tingkat metabolisme di dalam sel meninggi yang mengakibatkan sel kehabisan energi untuk melakukan pertumbuhan lebih lanjut. Spektrum kerja obat ini hanya efektif untuk cendawan-cendawan Dermatofita, seperti
Microsporum, Tricophyton, dan Epidermophyton. Sedangkan C. albicans memiliki sistem metabolisme yang singkat dan tidak membutuhkan energi sehingga cendawan ini digolongkan tidak peka terhadap griseofulvin (Bahry dan Setiabudy 1995; Bossche 1997). Berdasarkan hasil yang telah diperoleh dari penelitian ini, isolat C. albicans yang diperiksa masih tergolong peka terhadap griseofulvin. Hal ini karena griseofulvin dapat bersifat fungisidal pada sel khamir muda sehingga dapat mengurangi pertumbuhan C. albicans (Bahry dan Setiabudy 1995).
SIMPULAN
Isolat C. albicans diperoleh dari contoh air pembuangan peternakan dan Litter yang berasal dari peternakan Quansu Farm, Caringin Farm, Rudi Jaya Farm dan Dian Layer Farm. Seluruh isolate yang diperoleh masih tergolong peka terhadap anticendawan ketokonazol, itrakonazol dan griseofulvin.
SARAN
Dari hasil penelitian yang telah diperoleh, diperlukan penelitian lebih lanjut untuk mengetahui
1. apakah C. albicans mencemari bahan/alat lain di sekitar lingkungan peternakan; 2. apakah C. albicans dapat dibawa oleh mahluk hidup lain yang berada di sekitar kandang peternakan, misalnya tikus (Ratus ratus), kumbang Franki (Alphitobius diaperinus), kecoa (Blatella sp.) dan sebagainya;
17
DAFTAR PUSTAKA
Ali AS. 2008. Oral imune defens against chronic hyperplastic candidosis [disertation]. Finland (FI) : University of Helsinki
Al-Doory Yousef. 1980. Laboratory Medical Mycology. Philadelphia(US): Lea and Febiger.
Ariningsih RI. 2009. Isolasi Streptomyces dari Rizosfer Familia Poaceae yang berpotensi menghasilkan antijamur terhadap C. albicans [skripsi]. Surakarta (ID): Universitas Muhammadiyah Surakarta.
Ashbee HR, Bignell EM. 2009. The Yeast Handbook: Pathogenict Yeasts. Berlin Heidelberg (DE): Springer-Verlag
Ayuningtyas DN, Suryaatmadja L. 2011. Hubungan antara pengetahuan dan perilaku menjaga kebersihan genitalia eksterna dengan kejadian keputihan pada siswa SMA Negeri 4 Semarang [skripsi]. Semarang (ID): Universitas Diponegoro.
Babic M, Hukic M. 2010. Candida albicans and non-albicans species as etiological agent of vaginitis in pregnant and non-pregnant women. Bosn J Basic Med Sci. 10(1):89-97.
[Balitvet] Balai Penelitian Veteriner. 1991. Residu antibiotika pada daging ayam broiler dan pakannya di Jawa Barat [laporan penelitian]. Bogor (ID): Balai Penelitian Veteriner.
Bahry B, Setiabudy R. 1995. Obat Jamur. Di Dalam: Sulistia GG, Rianto S, Frans DS, Purwantyastuti, Nafrialdi, editor. Farmakologi dan Terapi. Edisi ke-4. Jakarta: Gaya Baru.
Bossche VD. 1997. Mechanism of antifungal resistance. Rev Iberoam Micol. 14:44-49
Crissey JT, Lang H, Parish LC. 1995. Manual of Medical Mycology. Massachusetts (US): Blackwell Science Inc.
[Ditjennakkeswan] Direktorat Jendral Peternakan dan Kesehatan Hewan. 2013. Pedoman Pelaksanaan Kawasan Agribisnis Unggas Lokal. Jakarta (ID): Kementerian Pertanian Republika Indonesia.
Diwyanto K, Priyanti A, Smeth I. 2005. Prospek dan arah pengembangan komoditas peternakan: unggas, sapi dan kambing-domba. WARTAZOA. 15(1): 11-25.
Ernawati. 2007. Penapisan dan fraksinasi senyawa antibakteri dari rumput laut bulu ayam [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Fadilah R, Polana A . 2004. Aneka Penyakit Pada Ayam dan Cara Mengatasinya. Jakarta (ID): Agromedia pustaka.
Forbes AB, Sahm DF, Weissfiels AS. 2000. Laboratory methods in basic mycology: Antifungal susceptibility testing. Bailey Scott, Editor. San Francisco (US): Pearson Educatin Inc.
Hastiono S. 1987. Pembubuhan oksitetrasiklin aditif pakan ke dalam pakan ayam pedaging dan pengaruhnya terhadap jumlah kamir tembolok. J. Penyakit Hewan. 19(34):65-69.
18
He M, Du M, Fan M, Bian Z. 2007. In vitro activity of eugenol against C. albicans biofilms. Mycopathologia. 163:137–143.
Ibrahim S, Allaily. 2012. Pengaruh berbagai bahan litter terhadap konsentrasi ammonia udara ambient kandang dan performan ayam broiler. Agripet. 1(12):47-51.
Jamin F. 2011. Kajian histopatologi bursa fabrisius, timus dan limpa pada ayam akibat infeksi C. albicans [tesis]. Bogor (ID): Institut Pertanian Bogor. [Kementan] Kementrian Pertanian. 2013. Dokumen Pendukung Konsep Strategi
Induk Pembangunan Pertanian 2013-2045 Pertanian-Bioindustri Berkelanjutan Solusi Pembangunan Indonesia Masa Depan. Jakarta (ID) : Biro Perencanaan Sekretariat Jendral Kementrian Pertanian.
Koga CY, Lyon JP, Resende MA. 2008. Comparison between E-test and CLSI broth microdilution method for antifungal susceptibility testing of Candida albicans oral isolates. Rev Inst Med Trop Sao Paulo. 50(1):7-10.
Koselac I, Pepeljnjak S, Kustrak D. 2005. Antifungal activity of fluid extract and essensial oil from anise fruit (Pimpinella anisum L., Apiaceae). Acta Pharm. 55:377-385
Lalitha P, Shapiro BL, Srinivasan M, Prajna NV, Acharya NR, Fothergill AW, Ruiz J, Chidambaram JD, Maxey KJ, Hong KC, McLeod SD, Lietman TM. 2007. Antimicrobial susceptibility of fusarium, aspergillus, and other filamentous fungi isolated from keratitis. JAMA Opthalmology. 125(6):789-793.
Lubis R. 2008. Pengobatan Deratomikosis. Medan (ID): Departemen Ilmu Kesehatan Kulit dan Kelamin FK USU.
Mariyah. 2010. Analisis finansial budidaya ayam petelur di Kalimantan Timur. JMA. 7(2):6-13.
Muin A. 2009. Analisis profilaksis itraconazole dan factor-faktor lainnya terhadap kejadian mukositis oral kandida akibat radioterapi pada penderita karsinoma nasofaring [tesis]. Semarang (ID): Universitas Diponegoro.
Niewerth M, Korting H. 2000. The use of system antimycotycs in dermatotheraphy. J Dermatol Europ. 10(2):155-160.
Noreva P. 2012. Kepekaan Candida albicans yang diisolasi dari beberapa tempat pemotongan unggas dan pasar tradisional terhadap obat anticendawan ketokonazol, itrakonazol, dan griseofulvin [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Noverita. 2009. Identifikasi kapang dan khamir penyebab penyakit pada sumber air minum penduduk pada sungai Ciliwung dan sekitarnya. Vis Vitalis. 2(2):12-22.
Nurainy F, Rizal S, Yudiantoro. 2008. Pengaruh konsentrasi kitosan terhadap aktivitas antibakteri dengan metode difusi agar (sumur). J. Teknologi Industri dan Hasil Pertanian. 13(2):117-125.
Nuriyasa IM, Puspani E, Sumatra IGN, Wibawa PP, Mudita IM. 2010. Peningkatan efisiensi produksi ayam petelur melalui peningkatn kenyamanan kandang di desa Bolangan. Media Petern. 9(2):55-58.
19 Prima H, Habib I. 2007. Perbandingan Daya Antifungi Ekstrak Bawang Putih
(Allium sativum) dan Ketokonazol terhadap C. albicans secara In Vitro [laporan penelitian]. Yogyakarta (ID): Muhammadiyah University.
Pfaller MA , Rex JH, Rinaldi MG. 1997. Antifungal susceptibility testing: technical advances and potential clinical applications. Clin Infect Dis. 24:776-784.
Puspani E, Nuriyasa IM, Wibawa Putra AAP, Candrawati. 2008. Pengaruh tipe lantai kandang dan kepadatan ternak terhadap tabiat makan ayam pedaging umur 2–6 minggu. Majalah Ilmiah Petern. 11(1):7-11.
Reezal I, Somchit MN, AbdulRahim M. 2002. In Vitro Antifungal Properties of Cassia Alata (Gelanggang Besar). Proceeding of the Symposium on Environment and Natural Resources Malaysia. 1:654-659.
Rostinawati T. 2009. Aktivitas Antibakteri Ekstrak Etanol Bunga Rosella (hibiscus sabdariffa l.) Terhadap escherichia coli, salmonella typhi dan staphylococcus aureus dengan Metode Difusi Agar. Bandung (ID): Universitas Padjadjaran.
Samaranayake Yuthika, Samaranayake LP. 1994. Candida krusei: Biology, epidemiology, pathogenicity and clinical manifestations of an emerging pathogen. J Med Microbiol. 4:295-310.
Sehgal R, Arya S, Kumar V L. 2005. Inhibitory effect of extracts of latex of Calotropis Procera againts C. albicans: a preliminary study. Indian J Pharmacol. 37(5):334-335.
Stafford P. 2002. Dimorphism in C. albicans Part I. American Society for Microbiology [Internet]. [ diunduh pada 21 September 2013]. Tersedia pada: http://lib.jiangnan.edu.cn/ASM/318-Introduce.html.
Sudbery PE. 2011. Growth of Candida albicans hyphae. Nat Rev Microbiol. 9(10):737-48.
Tabbu CR. 2000. Penyakit Ayam dan Penanggulangannya - Volume 1. Yogyakarta (ID): Kanisius.
Taboada J. 2012. Candidiasis. The Merck Vetrinary Manual [Internet]. [diunduh 20
September 2013]. Tersedia pada:
http://www.merckmanuals.com/vet/generalized_conditions/fungal_infection s_mycoses/candidiasis.html.
Tjay T H, Rahardja K. 2007. Obat-Obat Penting: Khasiat, Penggunaan, dan Efek-Efek Sampingnya– Edisi keenam. Jakarta (ID): PT Gramedia.
Treagan L. 2011. Candida And Its Role In Opportunistic Mycotes (Edisi Revisi). California (US): CAMLT.
Tyasrini E, Winata T, Susantina. 2006. Hubungan antara sifat dan metabolit candidasp. dengan patogenesis kandidiasis. J Mikrobial Indones. 6(1). Wahyuningsih R, Rozalyani A, Jannah S, Amir I, Prihartono J. 2008. Kandidemia
pada neonatus yang mengalami kegagalan terapi antibiotik. Artikel Penelitian Maj Kedokt Indon. 58(4):110-115.
20