KERAGAMAN KEPEKAAN Candida albicans YANG
DIISOLASI DARI LOKASI PETERNAKAN SAPI
PERAH TERHADAP BEBERAPA
ANTICENDAWAN
HAMDANAH
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2012
ABSTRACT
HAMDANAH. Variability of Dairy Farms-Isolated Candida albicans Sensitivity to Various Antifungals. Supervised by Eko Sugeng Pribadi.
Candida albicans is a yeast species which often able to infect an animal, including dairy cow. Candida infections frequently leads to mycotic abortion and mastitis in dairy cow. Mycotic mastitis in dairy farm will be triggerred by various predisposing factors, such as using antibiotics and immunosuppressants for long period. The resistance activity of C. albicans against antifungal will be rised a serious problem at dairy farms. This research aims were determined the habitat where C. albicans can be able to survive in the dairy farms location. The isolated C. albicans were evaluated to antifungals sensitivity. This study showed that C. albicans was isolated from all milk samples. The all isolated C. albicans still remain sensitive to ketoconazole and griseofulvin, except C. albicans, which isolated from milk sample of Cipanas farm, were resistant to fluconazole, and C. albicans, which isolated from milk sample of Cisarua farm and vaginal swab sample of Kebon Pedes farm, were resistant to itraconazole, respectively. The research showed that antifungal ketoconazole more effective to inhibit the C. albicans growth than itraconazole, fluconazole, and griseofulvin.
RINGKASAN
HAMDANAH. : Keragaman Kepekaan Candida albicans yang Diisolasi dari Lokasi Peternakan Sapi Perah terhadap Beberapa Anticendawan. Dibimbing oleh Eko Sugeng Pribadi.
Candida albicans merupakan spesies khamir yang memiliki kemampuan untuk menginfeksi hewan, termasuk sapi perah. Infeksi Candida sering menyebabkan terjadinya aborsi mikotik dan mastitis mikotik pada sapi perah. Terjadinya mastitis mikotik pada sapi perah tergantung oleh berbagai faktor predisposisi, seperti penggunaan antibiotika dan imunosupresan untuk jangka waktu yang lama. Resistensi C. albicans terhadap anticendawan akan menimbulkan masalah yang serius pada peternakan sapi perah. Penelitian ini bertujuan untuk mengetahui habitat dimana C. albicans mampu bertahan pada lokasi peternakan sapi perah dan mengetahui tampilan kepekaan C. albicans terhadap anticendawan. Penelitian ini menunjukkan bahwa secara keseluruhan C. albicans banyak ditemukan pada susu. Candida albicans yang diisolasi dari seluruh contoh yang diuji masih memiliki kepekaan terhadap anticendawan ketokonazol dan griseofulvin, kecuali contoh susu yang berasal dari peternakan Cipanas terhadap flukonazol, serta contoh susu yang berasal dari peternakan Cisarua dan contoh usapan vagina yang berasal dari peternakan Kebon Pedes terhadap itrakonazol. Penelitian ini menunjukkan bahwa ketokonazol lebih efektif untuk menghambat pertumbuhan C. albicans dibandingkan itrakonazol, flukonazol, dan griseofulvin.
KERAGAMAN KEPEKAAN Candida albicans YANG
DIISOLASI DARI LOKASI PETERNAKAN SAPI
PERAH TERHADAP BEBERAPA
ANTICENDAWAN
HAMDANAH
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2012
PERNYATAAN MENGENAI
SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul “Keragaman Kepekaan Candida albicans yang Diisolasi dari Lokasi Peternakan Sapi Perah terhadap Beberapa Anticendawan” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2012 Hamdanah
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB
Judul Skripsi : Keragaman Kepekaan Candida albicans yang Diisolasi dari Lokasi Peternakan Sapi Perah terhadap Beberapa Anticendawan
Nama Mahasiswa : Hamdanah
NIM : B04080149
Disetujui
Dr. drh. Eko Sugeng Pribadi, MS. Pembimbing
Diketahui
drh. H. Agus Setiyono, MS, Ph.D, APVet. Wakil Dekan FKH IPB
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga skripsi ini dapat diselesaikan. Tema yang dipilih dalam penelitian ini yaitu mengenai Keragaman Kepekaan Candida albicans yang Diisolasi dari Lokasi Peternakan Sapi Perah terhadap Beberapa Anticendawan.
Penelitian ini tidak akan berjalan lancar tanpa bantuan dari berbagai pihak. Penulis ingin menyampaikan rasa terima kasih yang sebesar-besarnya kepada Dr. drh. Eko Sugeng Pribadi, MS sebagai pembimbing skripsi dan seluruh staf di Laboratorium Mikrobologi Medik yang telah banyak membantu selama proses penelitian, serta drh. Dewi Ratih Agungpriyono P.hD, APVET sebagai dosen pembimbing akademik yang telah banyak memberi arahan serta nasehat selama penulis menjalani masa studi program sarjana ini. Ungkapan terima kasih juga disampaikan kepada kedua orang tua penulis, kakak, abang, saudara kembar, serta kakak-kakak ipar dan keponakan yang selalu memberikan doa, semangat, dan dukungan dalam proses menuntut ilmu di kampus IPB Dramaga. Terimakasih juga penulis ucapkan untuk Elvi Rahayu selaku sahabat satu daerah di kampus IPB yang telah banyak membantu dan memberi semangat, untuk Desi, Alvi, dan kak Patricia selaku rekan satu penelitian yang saling membantu dan memotivasi dalam proses penelitian. Saudara-saudara di DKM An-Nahl IPB (Afifah, Hastin, Dhia, Nurul Aini, Chanifah, dan semuanya), sahabat Wisma Raihana (kak Rani, kak Kasih, Vita, Nisa, Chae, Ratna), serta Ruri, Rika yang selalu memberikan motivasi dan membantu penulis dalam banyak hal. Tak lupa ungkapan terima kasih kepada seluruh sahabat Avenzoar selaku rekan angkatan 45 di Fakultas Kedokteran Hewan IPB.
Bogor, Agustus 2012 Hamdanah
RIWAYAT HIDUP
Penulis dilahirkan di Tembilahan, Riau pada tanggal 29 September 1990 dari ayah H. Nurani dan ibu Hj. Nurhamisah. Penulis merupakan putri ketiga yang terlahir kembar dari empat bersaudara.
Pendidikan formal penulis dimulai dari TK Nurul Iman Tembilahan, SDN 007 Tembilahan, MTsN 094 Tembilahan, dan kemudian melanjutkan ke SMAN 1 Tembilahan Hulu pada tahun 2005. Tahun 2008 penulis diterima sebagai mahasiswa program sarjana Institut Pertanian Bogor melalui jalur Beasiswa Utusan Daerah (BUD), setahun kemudian penulis masuk ke Fakultas Kedokteran Hewan IPB.
Selama mengikuti perkuliahan, penulis turut berpartisipasi dalam beberapa organisasi dalam dan luar kampus. Organisasi dalam kampus yang pernah diikuti oleh penulis yaitu LDK Al-Hurriyyah, Forum for Scientific Studies (FORCES) IPB, DKM An-Nahl, serta Rohis Avenzoar. Organisasi luar kampus yang pernah diikuti oleh penulis yaitu IKPMR (Ikatan Keluarga Pelajar Mahasiswa Riau) Bogor dan Himpunan Pemuda Pelajar Mahasiswa Indragiri Hilir (HIPPMIH) Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv BAB 1 PENDAHULUAN ... 1 Latar Belakang ... 1 Perumusan Masalah ... 2 Tujuan ... 2 Hipotesis ... 2
BAB 2 TINJAUAN PUSTAKA ... 3
Candida albicans... 3
Karakter Makroskopik dan Mikroskopik... 4
Habitat ... 5
Peranan dalam Kesehatan Hewan ... 5
Infeksi C. albicans pada Ternak Sapi Perah ... 7
Mastitis Mikotik ... 7 Aborsi Mikotik ... 7 Penggunaan Anticendawan ... 8 Golongan Azol ... 9 Ampoterisin B ... 11 Nistatin ... 12 Griseofulvin ... 12
Resistensi Spesies Candida terhadap Anticendawan ... 13
BAB 3 METODE PENELITIAN ... 16
Waktu dan Tempat Penelitian ... 16
Alat dan Bahan ... 16
Rancangan Penelitian ... 16
Pengambilan Contoh ... 16
Perlakuan Contoh ... 17
Pengamatan terhadap Koloni yang Tumbuh pada Media PDA ... 17
Identifikasi Isolat ... 18
Uji Aktivitas Anticendawan ... 19
Pencarian Kadar Hambat Terendah ... 19
BAB 4 HASIL DAN PEMBAHASAN ...21
Lokasi Pengambilan Contoh ... 21
Identifikasi C. albicans ... 24
Kadar Hambat Terendah ... 28
BAB 5 SIMPULAN DAN SARAN... 36
DAFTAR TABEL
Halaman
1. Karakter makrobiologi dan mikrobiologi C. albicans ... 5 2. Beberapa kelompok obat anticendawan dan sasaran kerja yang dilakukannya .. 9 3. Lokasi dan jumlah pengambilan contoh... 24 4. Hasil uji tabung kecambah dan asimilasi gula-gula terhadap beberapa isolat
yang diduga sebagai C. albicans ... 26 5. Isolat-isolat khamir dari contoh yang diperiksa... 27 6. Jumlah C. albicans pada contoh-contoh yang diperiksa ... 27 7. Kadar terbentuknya zona hambat pada ketokonazol, itrakonazol, flukonazol,
dan griseofulvin terhadap beberapa isolat C. albicans yang diperoleh dari contoh ... 29 8. Nilai MIC ketokonazol, itrakonazol, flukonazol, dan griseofulvin terhadap
DAFTAR GAMBAR
Halaman
1. Pertumbuhan dimorfik C. albicans ... 3
2. Sel C. albicans yang membentuk tabung kecambah ketika dibiakkan di dalam serum... 4
3. Khlamidospora dari C. albicans pada media Corn Meal Agar (CMA) ... 4
4. Struktur molekul golongan azol... 10
5. Struktur molekul amfoterisin B ... 11
6. Struktur molekul nistatin ... 12
7. Struktur molekul griseofulvin ... 13
8. Diagram skematik dari sel C. albicans sebagai target obat anticendawan... 14
9. Uji tabung kecambah ... 18
10. Peternakan Kebon Pedes (a) dan sumber air yang digunakan (b) ... 22
11. Beberapa contoh yang diambil. Usapan vagina (a), usapan tangan (b), susu (c), pelicin (d) ... 23
12. Hasil pemeriksaan sediaan natif (tanda panah) yang diwarnai dengan LPCB memperlihatkan adanya budding cell (a) dan hifa sejati (b) ... 25
13. Tabung kecambah (tanda panah) yang dibentuk oleh isolat khamir yang diduga C. albicans ... 26
BAB 1 PENDAHULUAN
Latar Belakang
Genus Candida terdiri dari 200 spesies lebih. Candida albicans merupakan spesies yang sering dihubungkan dengan penyakit pada hewan. Peningkatan prevalensi penyakit lokal dan sistemik yang disebabkan oleh spesies Candida telah mengakibatkan berbagai gejala klinis baru dan tampilannya tergantung pada status kekebalan dari inang. Candida sp. menghasilkan bentuk penyakit yang beragam, mulai dari penyakit mukokutan superfisial sampai penyakit invasif (Jose 2010). Infeksi Candida sp. ini merupakan infeksi oportunistik yang tidak menyebabkan penyakit pada individu imunokompeten tetapi hanya dapat terjadi pada individu yang mengalami gangguan pertahanan tubuh (De Repentigny et al. 1992). Selama sistem kekebalan tubuh berfungsi dengan baik, flora normal dan kesatuan jaringan dipertahankan dengan baik maka invasi jaringan oleh Candida tidak akan terjadi (Tregan 2011).
Candida banyak tersebar di lingkungan dan merupakan kelompok yang sangat heterogen (Tregan 2011). Dulu hanya C. albicans yang dianggap sebagai khamir patogen dari genus Candida. Namun sekarang diketahui lebih dari 100 spesies Candida dan tujuh diantaranya mendapat perhatian penting secara medis, yakni C. albicans, C. krusei, C. tropicalis, C. parapsilosis, C. glabrata, C. guilliermondii dan C. kefyr. Candida albicans, C. krusei, C. tropicalis, dan C. parapsilosis mewakili 71% dari Candida sp. yang terisolasi dari hewan domestik (Foley dan Schlafer 1987; Adininggar 1996). Salah satu hewan ternak yang sering terinfeksi agen penyakit ini adalah sapi perah. Menurut Foley dan Schlafer (1987), terjadi kecenderungan peningkatan kejadian infeksi Candida sp. yang diisolasi dari lendir serviks sapi yang dikaitkan dengan masalah kesuburan.
Pengobatan penyakit ini mencakup desinfeksi lokal dan penerapan antiinflamasi, anticendawan seperti nistatin dan mikonazol, dan vitamin B2, pellagra preventive (PP/ vitamin B3), B6, dan C. Pencegahan dapat dicapai dengan menghilangkan kondisi yang memungkinkan cendawan untuk tumbuh, mengisolasi hewan yang terinfeksi dan juga dengan desinfeksi (Ashkilleison 2010).
Gholib dan Kusumaningtyas (2008) menjelaskan bahwa umumnya peternak melakukan pengobatan kasus mastitis pada sapi dengan menggunakan antibiotika karena memang kebanyakan kasus mastitis disebabkan oleh infeksi bakteri. Tetapi, ternyata pengobatan dengan antibiotika pada beberapa kasus tidak efektif sehingga pada pemeriksaan contoh susu di laboratorium diarahkan terhadap pertumbuhan cendawan, khususnya jenis khamir. Beberapa jenis khamir penyebab infeksi pada kelenjar ambing sudah lama diteliti dan umumnya jenis khamir yang berperan pada infeksi ini adalah Candida, terutama C. albicans. Hal ini diperkuat dengan adanya hasil penelitian dari Natalia dan Hastiono (1985) dan Pribadi dan Pramono (1986) yang berhasil mengisolasi C. albicans dari susu sapi perah yang menderita mastitis.
Perumusan Masalah
Permasalahan yang akan diamati melalui penelitian ini dirangkum melalui pertanyaan-pertanyaan seperti di bawah ini, yakni:
a) Di habitat manakah di lokasi peternakan sapi perah yang menjadi habitat paling cocok bagi pertumbuhan C. albicans?
b) Bagaimanakah keragaman dari isolat C. albicans yang diperoleh?
c) Bagaimanakah tampilan kepekaan C. albicans yang diisolasi terhadap beberapa anticendawan yang diberikan?
Tujuan
Penelitian ini bertujuan untuk mengetahui habitat yang banyak ditemukan Candida albicans di lokasi peternakan sapi perah dan mengetahui tampilan kepekaan terhadap anticendawan.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah
H0 : Isolat C. albicans yang diisolasi dari lokasi peternakan sapi perah masih peka terhadap anticendawan.
H1 : Isolat C. albicans yang diisolasi dari lokasi peternakan sapi perah sudah tidak peka lagi terhadap anticendawan.
BAB 2
TINJAUAN PUSTAKA Candida albicans
Menurut Ali (2008), Candida albicans diklasifikasikan sebagai berikut : Kingdom : Fungi Filum : Ascomycota Subfilum : Ascomycotina Kelas : Ascomycetes Ordo : Saccharomycetales Famili : Saccharomycetaceae Genus : Candida
Spesies : Candida albicans
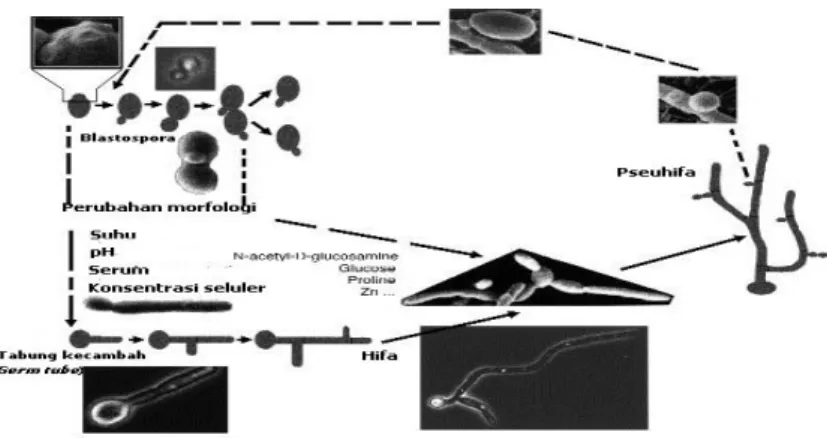
Cendawan patogen C. albicans dapat tumbuh setidaknya dengan tiga bentuk yang berbeda yaitu sel khamir, pseudohifa dan hifa (Sudbery et al. 2004). Khamir merupakan mikroorganisme bersel satu, berbentuk bulat, dan berdinding halus. Pseudohifa dan hifa merupakan satu kesatuan yang berbentuk filamen dari suatu cendawan. C. albicans membentuk koloni berwarna putih. Candida albicans merupakan cendawan dimorfik karena kemampuannya untuk tumbuh dalam dua bentuk yang berbeda, yaitu sebagai sel tunas yang akan berkembang menjadi blastospora (sel khamir) dan sebagai hifa yang akan membentuk pseudohifa (Ali 2008). Fase-fase pertumbuhan dimorfik tersebut diperlihatkan pada Gambar 1 di bawah ini.
Karakter Makroskopik dan Mikroskopik
C. albicans jika dibandingkan dari spesies Candida lainnya dapat dibedakan dengan menggunakan dua tes morfologik sederhana, yaitu pembentukan tabung kecambah (germ tube) dan khlamidospora. Sel-sel khamir C. albicans akan mulai membentuk tabung kecambah (germ tube) setelah dilakukan inkubasi dalam serum selama sekitar 90 menit pada suhu 37ºC (Magdalena 2009). Sedangkan khlamidospora akan terbentuk saat keadaan lingkungan yang rendah oksigen, cahaya, suhu dan nutrisi. Khlamidospora merupakan spora berbentuk besar, dan berdinding tebal, serta memiliki kadar lemak dan karbohidrat yang tinggi. Khlamidospora ini merupakan spora aseksual yang berperan sebagai tempat sel penyimpanan (storage cell) (Citiulo et al. 2009). Kedua bentuk morfologi ini dapat dilihat pada Gambar 2 dan 3 di bawah ini.
Gambar 2 Sel C. albicans yang membentuk tabung kecambah ketika dibiakkan di dalam serum (Sudbery 2001)
Gambar 3 Khlamidospora dari C. albicans pada media Corn Meal Agar (CMA) ( Sonneborn 1999)
C. albicans melakukan asimilasi karbohidrat untuk mendapatkan sumber karbon dan energi untuk melakukan pertumbuhan sel. Candida albicans menggunakan glukosa, maltosa, dan sukrosa melalui proses asimilasi ini. Selain proses asimilasi, C. albicans juga melakukan proses fermentasi pada glukosa,
5
maltosa dan sukrosa (Tjampakasari 2006). Beberapa tahapan khusus untuk pengidentifikasian terhadap C. albicans terpapar di Tabel 1 di bawah ini.
Tabel 1 Karakter makrobiologi dan mikrobiologi C. albicans Metode identifikasi Karakter makrobiologi
Candida albicans
Karakter mikrobiologi Candida albicans Potato dextros agar Berbentuk bulat, Permukaan
halus, Berwarna putih -
Uji natif - Blastospora, Hifa,
Pseudohifa Uji tabung kecambah - Tabung kecambah Sugar assimilation medium - Glukosa ( + ) - Sukrosa ( + ) - Maltosa ( + ) - Galaktosa ( + ) - Laktosa ( - ) -
Corn meal agar - Khlamidospora Sumber: CMPT (2006); Marinho et al. (2010)
Habitat
Spesies C. albicans merupakan flora normal di saluran pernapasan bagian atas, saluran pencernaan, saluran kelamin, kulit, kuku, ambing, serta membran mukosa (mulut, vagina atau dubur) (Hanafi et al. 2010). Spesies ini umumnya ditemukan sebagai organisme komensal yang dapat menginfeksi manusia dan hewan. Dalam kondisi normal, bakteri dan cendawan C. albicans akan hidup secara bersama. Akan tetapi, dalam kondisi yang tidak baik, seperti ketika kurangnya nutrisi, spesies ini akan berubah bentuk dari bentuk khamir menjadi filamen (hifa) yang akan membunuh bakteri (Hogan 2002).
Peranan dalam Kesehatan Hewan
Sejumlah khamir dapat menyebabkan berbagai penyakit, baik pada manusia maupun hewan, seperti sariawan, kandidiasis disseminata, kriptokokosis,
dan mastitis (Asfour et al. 2009). Candida albicans dan spesies Candida lainnya dapat menyebabkan kandidiasis saluran pencernaan pada hewan. Khamir ini paling sering menginfeksi unggas dan menyebabkan lesi pada mukosa mulut, esofagus, dan tembolok. Sedangkan pada babi dan anak kuda infeksi yang terjadi sering menyebabkan luka (ulcer) pada usus (MVM 2005).
Saluran reproduksi pada hewan dapat menjadi sumber dari berbagai khamir, seperti C. albicans dan Filobasidiella (Cryptococcus) neoformans. Infeksi oleh kedua spesies ini pernah dilaporkan terjadi pada sapi perah, kerbau, domba, dan kambing dalam bentuk pyometra, vaginitis, vulvovaginitis, servisitis, dan endometritis (Osman dan Gabal 1977). Dalam bidang kedokteran hewan telah tercatat bahwa C. albicans pernah diisolasi pada kasus aborsi pada sapi, mastitis pada sapi, endometritis pada kuda (Givens dan Marley 2008; Kaszak et al. 2012). Pada tahun 2002, C. albicans pertama kali dilaporkan menyebabkan terjadinya endometritis pada kerbau yang memiliki riwayat aborsi. Kerbau yang terinfeksi menunjukkan adanya tanda-tanda klinis berupa edema, hiperemi pada mukosa serviks dan eksudat purulenta berwarna putih pada alat kelamin (Pal 2002). Garoussi et al. (2007) melaporkan bahwa infeksi khamir dapat terjadi pada rongga servikovaginal dari sapi Frisian Holstein (FH) dengan atau tanpa penyakit reproduksi. Kejadian aborsi mikotik terjadi peningkatan sebanyak 21% dari semua jumlah kasus aborsi pada sapi dan telah tercatat di Veterinary Diagnostic Laboratory Surveys Amerika Serikat (Anderson 2007).
Genus Candida adalah patogen yang menyumbang sekitar 50 sampai 60% dari semua Candida isolat kultur darah yang dapat menyerang dan merusak berbagai macam jaringan inang (Wisplinghoff et al. 2004). Infeksi C. albicans ditandai dengan adanya lesi dan hifa pada organ yang terinfeksi (O'Grady dan Reade 1993). Infeksi Candida pernah terjadi pada kuda melalui servik maupun secara hematogen dan dinyatakan sebagai plasentitis mikotik. Lesi yang ditemukan berupa penebalan pada khorioalantois yang disertai dengan terbentuknya eksudat. Infeksi ini dapat mengakibatkan terjadinya aborsi pada usia kebuntingan 8-11 bulan dengan ditemukannya hifa pada plasenta, hati, paru-paru dan lambung (Givens dan Marley 2008; Critz 2012).
7
Infeksi C. albicans pada Ternak Sapi Perah Mastitis Mikotik
Mastitis adalah salah satu masalah paling serius dalam peternakan sapi perah. Sebagian besar kasus mastitis disebabkan oleh bakteri. Tetapi, belum lama ini telah terjadi peningkatan kasus mastitis mikotik yang umumnya disebabkan oleh C. albicans dan F. neoformans (Elmagd et al. 2011). Kasus mastitis mikotik yang disebabkan oleh C. albicans pada sapi di Tanzania mengalami peningkatan prevalensi dari 1% pada tahun 1971 menjadi 17% pada tahun 2002 (Kivaria dan Noordhuizen 2006). Lebih dari tiga perempat kasus dari mastitis mikotik disebabkan oleh spesies Candida, seperti C. albicans, C. glabrata, C. kefyr, C. tropicalis, C. krusei, dan C. parapsilosis (Lagneau et al. 1996; Tarfarosh dan Purohit 2008). Belum banyak data mengenai kasus mastitis mikotik yang terjadi di Indonesia. Hanya tercatat melalui penelitian yang dilakukan oleh Natalia dan Hastiono (1985) dan Pribadi dan Pramono (1986) bahwa kejadian mastitis mikotik pada sapi perah disebabkan oleh Candida.
Mastitis mikotik yang terjadi pada sapi perah tergantung pada faktor-faktor predisposisi penggunaan antibiotika dan imunosupresan untuk jangka waktu yang lama dan faktor sanitasi yang kurang diperhatikan. Galur khamir yang diisolasi dari sekresi susu sapi yang didiagnosa sebagai mastitis klinis dan subklinis memiliki aktivitas enzim leusin arylamilase dan asam fosfatase yang tinggi. Aktivitas dan karakter kedua enzim ini menjadi faktor virulensi bagi khamir ketika menginfeksi jaringan kelenjar mamae (Wawron et al. 2011).
Aborsi Mikotik
Aborsi mikotik pada sapi pertama kali dilaporkan pada tahun 1920 oleh Theobald Smith. Sejak itu, telah terjadi peningkatan yang stabil dari laporan tentang aborsi yang diakibatkan oleh cendawan Aspergillus fumigatus dengan tingkat prevalensi sebesar 75% dari kasus aborsi mikotik. Sedangkan 25% lainnya disebabkan oleh jenis cendawan dalam kelas Phycomycetes dan oleh spesies dalam genus Candida.
Kasus aborsi pada sapi yang disebabkan oleh Candida spp. saat ini masih bersifat sporadis. Infeksi ini biasanya terjadi selama musim dingin dan musim
semi. Hal ini dikarenakan ketika musim tersebut sapi sering ditempatkan di dalam kandang yang berisi jerami-jerami yang telah tercemar (Djonne 2007). Penyebab infeksi dapat masuk ke saluran pernafasan atau pencernaan, kemudian masuk ke sirkulasi darah dan akhirnya menyebar ke plasenta. Aborsi umumnya dapat terjadi saat usia kebuntingan antara 6 sampai 8 bulan. Tanda-tanda klinis yang terlihat berupa retensi plasenta dan plasentitis (Givens dan Marley 2008). Penyebaran kejadian ini telah dilaporkan terjadi di Inggris, Polandia, Hungaria, Jerman, Selandia Baru, Israel, India, dan Amerika Serikat. Terisolasinya C. tropicalis dari abomasum fetus menjadi laporan awal dari rangkaian empat kejadian aborsi mikotik pada sapi yang disebabkan oleh C. parapsilosis. Rangkaian kejadian ini telah tercatat pada dokumen New York State College of Veterinary Medicine (NYSCVM) selama periode 5 tahun (Foley dan Schlafer 1987).
Penggunaan Anticendawan
Infeksi cendawan dapat diobati dengan beberapa obat anticendawan, seperti ketokonazol, mikonazol, klotrimazol, parkonazol, enilkonazol, ekonazol, itrakonazol, flukonazol, griseofulvin, nistatin, ampoterisin B yang dapat diberikan dalam bentuk krim atau tablet dan diberikan secara topikal ataupun sistemik (Little et al. 1999). Obat-obat anticendawan tersebut memiliki cara kerja yang berbeda-beda terhadap sel cendawan seperti yang terpapar di dalam Tabel 2.
Menurut Veen dan Kremer (1992), tidak terdapat bukti yang jelas tentang efektivitas terapi antimikotik terhadap infeksi khamir pada sapi yang menderita mastitis. Berdasarkan penelitian yang dilakukan oleh McDonald et al. (1980) yang melakukan pemeriksaan in vitro terhadap sejumlah khamir yang diisolasi dari kelenjar susu sapi, diperoleh bahwa sebanyak 91 isolat dinyatakan paling peka terhadap klotrimazol yang diikuti dengan ketokonazol, nistatin, ampoterisin B, dan mikonazol. Khamir yang paling sensitif adalah C. lusitaniae (85,7%) dan C. rugosa (31,9%).
9
Tabel 2 Beberapa kelompok obat anticendawan dan sasaran kerja yang dilakukannya
Kelas Obat* Target
Griseofulvin (o) Menghambat microtubule sliding
Polyenes Ampoterisin B (iv, t, o) Natamicin (t)
Nistatin (t, o)
Fungsi membrane barrier
Azole Imidazol Klotrimazol (t) Ekonazol (t) Enilkonazol (t) Ketokonazol (t, o) Mikonazol (t) Parkonazol (o) Flukonazol (o, iv) Itrakonazole (o, iv)
Biosintesis ergosterol 14α-demethylase
Triazol
Pyrimidin Flusitosin (o, iv) Sintesis DNA dan RNA *o, oral; t, topical; iv, intravenous
Sumber: Bossche et al. (2003)
Sapi yang didiagnosa menderita mastitis yang disebabkan oleh Candida spp. pernah dilakukan pengobatan menggunakan thiabendazol dan mikonazol. Tingkat kesembuhan yang diperoleh mencapai 78-80% (Vandamme 1983). Beberapa kejadian mastitis yang disebabkan oleh Candida, Cryptococcus, Trichosporon, dan Torulopsis dapat diobati menggunakan nistatin dan klotrimazol secara intramamari (Yeo et al. 1989).
Golongan Azol
Anticendawan azol diklasifikasikan menjadi dua kelompok, yaitu imidazol (mikonazol dan ketokonazol) dan triazol (flukonazol dan itrakonazol). Kerja anticendawan ini menghambat biosintesis ergosterol dengan menghalangi kerja enzim 14-α-demithilase, suatu enzim yang bergantung pada sitokrom P-450 dan dibutuhkan untuk mengubah lanosterol menjadi ergosterol. Kekurangan ergosterol menyebabkan ketidakstabilan membran sehingga menurunkan aktivitas enzim yang berkaitan dengan membran dan mengakibatkan peningkatan permeabilitas serta hambatan pertumbuhan dan perbanyakan sel (Ford 2004).
Ketokonazol dan itrakonazol memiliki struktur kimia dan profil farmakologik yang sama. Sedangkan untuk flukonazol memiliki struktur kimia yang unik karena ukuran molekulnya yang kecil dan lipofilitasnya yang lebih rendah (Herman 1996). Struktur molekul masing-masing golongan azol tersebut terpapar pada Gambar 4 dibawah ini.
Gambar 4 Struktur molekul golongan azol (Bossche et al. 2003)
- Ketokonazol
Saat ini kejadian infeksi cendawan sistemik telah meningkat seiring dengan meningkatnya individu-individu immunocompromised (Nakayama et al. 2010). Menurut Fraser et al. (1992) dan Ozcan et al. (2006), spesies Candida terlibat dalam kasus kandidiasis superfisial dan sistemik yang menerima pemberian antibiotika spektrum luas, kortikosteroid dan obat imunosupresif. Ketokonazol merupakan obat antimikotik sintetik berspektrum luas. Obat ini membutuhkan lingkungan asam agar terjadi penyerapan yang optimal sehingga H2-blocker atau antasid tidak boleh diberikan secara bersamaan. Biasanya ketokonazol ini sering dikombinasikan dengan amfoterisin B untuk mengatasi kasus kandidiasis sistemik yang serius (MVM 2005).
- Flukonazol
Flukonazol telah menjadi terapi untuk mengobati infeksi cendawan yang disebabkan oleh spesies Candida, kecuali yang disebabkan oleh Candida krusei (Tollemar et al. 1999). Pemberian flukonazol telah terbukti efektif menurunkan
11
infeksi akibat C. albicans, C. tropicalis, dan C. parapsilosis pada pasien yang diikuti dengan jumlah neutrofil yang rendah (Tregan 2011).
- Itrakonazol
Itrakonazol adalah anticendawan triazol yang lebih baru dan memiliki spektrum kerja luas. Tidak seperti flukonazol, obat ini memiliki aktivitas in vitro terhadap berbagai macam spesies Candida, khususnya C. glabrata dan C. krusei (Fidel et al. 1999). Itrakonazol telah menggantikan ketokonazol dalam pengobatan mikosis karena memiliki spektrum yang lebih luas, potensi yang lebih besar, dan efek samping yang lebih sedikit (MVM 2005).
Amfoterisin B
Amfoterisin B merupakan antibiotika kelompok makrolida polien yang memiliki tujuh ikatan rangkap konjugasi pada posisi trans- dan 3-amino-3,6-dideoksimanosa yang berhubungan melalui ikatan glikosida (Herman 1996), sebagaimana terpapar pada Gambar 5 dibawah ini.
Gambar 5 Struktur molekul amfoterisin B (Bossche et al. 2003)
Amfoterisin B berikatan dengan ergosterol sehingga membran sel menjadi rentan dan mengakibatkan rusaknya fungsi pelindung membran, hilangnya unsur-unsur sel yang penting, mengganggu metabolisme dan juga kerusakan oksidatif terhadap sel cendawan (Dumasari 2008). Kandidiasis invasif biasanya memerlukan resep amfoterisin B yang diberikan secara intravena dan obat ini dapat diberikan dalam bentuk kombinasi dengan flusitosin melalui oral untuk menambah efek pengobatan. Sedangkan pemakaian secara topikal hanya bermanfaat pada kandidiasis kulit (Herman 1996; Magdalena 2009).
Nistatin
Nistatin merupakan anticendawan dari golongan polien yang aman terhadap sel mamalia. Nistatin bekerja mengikat sterol (terutama ergosterol) pada membran sel cendawan. Beberapa penelitian melaporkan bahwa ergosterol berkompetisi dengan kolesterol dan menjadi target kerja dari nistatin sehingga menghasilkan perubahan permeabilitas membran sel cendawan, diikuti dengan kebocoran dari komponen-komponen intraseluler dan mengakibatkan kematian cendawan (Anonim 2009; Ridawati et al. 2011). Struktur molekul nistatin mirip dengan amfoterisin B. Namun nistatin hanya memiliki enam ikatan rangkap konjugasi, hal ini terpapar pada Gambar 6 dibawah ini.
Gambar 6 Struktur molekul nistatin (Bossche et al. 2003)
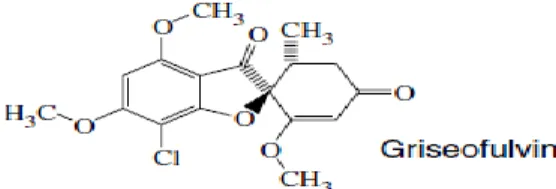
Griseofulvin
Griseofulvin merupakan golongan miscellaneous dari suatu anticendawan dan menjadi satu-satunya obat dari jenis golongan ini (Ali 2008). Obat ini mematikan sel cendawan muda yang bermetabolisme aktif dan hanya bersifat menghambat pertumbuhan sel cendawan yang lebih tua. Perubahan morfologik yang menonjol sebagai akibat kerja dari griseofulvin adalah produksi sel-sel inti ganda saat obat menghambat mitosis sel cendawan dengan pemutusan berkas mitotik melalui interaksi mikrotubulus terpolimerasi (Herman 1996).
Griseofulvin memiliki waktu paruh didalam plasma lebih kurang satu hari dan sekitar 50% dari dosis yang diberikan secara oral dapat ditemukan di dalam urin setelah lima hari dalam bentuk metabolitnya, yaitu 6-desmethyl-griseofulvin (Dumasari 2008). Struktur molekul kimia dari griseofulvin ini dapat dilihat pada Gambar 7 dibawah ini.
13
Gambar 7 Struktur molekul griseofulvin (Bossche et al. 2003)
Resistensi Spesies Candida terhadap Anticendawan
Beberapa tahun terakhir ini telah banyak laporan peningkatan resistensi spesies Candida terhadap obat anticendawan. Secara umum, isolat spesies Candida yang telah dianalisis menunjukkan resistensi terhadap flukonazol dan itrakonazol sebesar 2,5% dan 9%. C. glabrata dan C. krusei pernah dilaporkan tahan terhadap golongan azol secara in vitro dengan menunjukkan nilai MIC sebesar 164 µg/mL. Selain itu, pada beberapa galur C. tropicalis juga menunjukkan resistensi terhadap golongan azol yang diperlihatkan secara in vitro. Sedangkan resistensi C. albicans terhadap flukonazol dan itrakonazol dapat muncul jika telah terjadi pengobatan jangka panjang sebagai profilaksis. Berdasarkan data dari Antifungal Surveillance Study (ARTEMIS ), telah terjadi peningkatan resistensi C. glabrata terhadap flukonazol sebesar 9% pada rentang waktu 1992-2001 menjadi 14% pada rentang waktu 2001-2007 (Perea dan Patterson 2002; Michael dan Pfaller 2012).
Penelitian terbaru mengenai resistensi C. albicans dan C. glabrata terhadap beberapa anticendawan golongan azol menunjukkan setidaknya ada tiga mekanisme resistensi yang dikenal, yaitu perubahan pada enzim P-450 lanosterol demethylase, perubahan ∆5-6
-sterol desaturase, dan ketergantungan energy (energy dependent) yang ada pada mekanisme efflux pumps (Pinjon et al. 2003). Perubahan pada enzim P-450 lanosterol demethylase terjadi saat adanya mutasi pada gen ERG11 (kode untuk enzim 14-α-demethylase). Pengkodean gen pada enzim ini mencegah terjadinya pengikatan pada bagian enzimatik sehingga menyebabkan penurunan kadar obat pada sel sasaran. Ergosterol merupakan sterol utama membran sel cendawan dan seringkali menjadi sasaran kerja bagi obat-obat anticendawan. Resistensi terjadi karena komposisi sterol ini mengalami perubahan sehingga menyebabkan berkurangnya penyerapan agen anticendawan ke dalam
sel. Energi yang ada pada mekanisme efflux pumps merupakan karakteristik terjadinya resistensi pada bakteri, khamir, dan sel mamalia. Mekanisme ini memberikan kemampuan untuk memompa azol keluar dari sel target (Kanafani dan Perfect 2008; Pinjon et al. 2003).
Berbagai golongan obat anticendawan memiliki target kerja yang berbeda-beda terhadap sel Candida seperti yang terpapar pada Gambar 8. Mekanisme yang dapat mengembangkan resistensi tergantung pada cara kerja obat anticendawan, termasuk saat berkurangnya penyerapan obat, keluarnya obat melalui efflux pumps, dan berkurangnya afinitas pada target enzim (Shuter 1999).
Gambar 8 Diagram skematik dari sel C. albicans sebagai sasaran obat anticendawan (Ali 2008)
Spesies Candida yang terpapar anticendawan telah menunjukkan penurunan aktivitas fosfolipase secara signifikan. Penurunan aktivitas ini terjadi pada C. albicans dan C. tropicalis terhadap anticendawan nistatin dan amfoterisin B (Anil dan Samaranayake 2003). Cara yang terbaik untuk meningkatkan efek terapi obat anticendawan adalah dengan meningkatkan sistem kekebalan inang, Contohnya dengan melakukan kombinasi antara granulocyte macrophage colony-stimulating factor (sitokin) dan anticendawan flukonazol (Kothavade et al. 2010).
Resistensi anticendawan dapat dibagi menjadi dua kategori yaitu resistensi klinis dan resitensi in vitro. Resistensi klinis menandakan kurangnya tanggap klinis terhadap pemberian obat anticendawan yang digunakan. Kegagalan klinis terjadi karena rendahnya tingkat obat dalam serum. Sedangkan resistensi in vitro terjadi saat cendawan diuji secara in vitro yang dikelompokan lagi ke dalam
15
bentuk resistensi primer dan resistensi sekunder. Resistensi primer dikenal sebagai resistensi intrinsik atau bawaan yang terjadi ketika organisme tersebut secara alami resisten terhadap anticendawan. Bentuk ini diperlihatkan oleh C. krusei yang dikenal resisten terhadap flukonazol. Resistensi sekunder atau dapatan terjadi ketika isolat yang awalnya tidak resisten menjadi resisten terhadap obat anticendawan (Fidel et al. 1999).
Keadaan sistem imun yang kurang baik menjadi salah satu faktor khamir tahan atau relatif tahan terhadap obat anticendawan. Ada banyak laporan kasus yang menggambarkan adanya kolonisasi dan infeksi pada pasien immunocompromised yang menggunakan obat anticendawan jangka panjang, hal ini terjadi pada C. krusei dan C. glabrata yang telah resisten terhadap anticendawan secara in vitro (Wingard 1995). Bahkan baru-baru ini dilaporkan bahwa C. albicans, C. guilliermondi, dan F. neoformans resisten terhadap ampoterisin B (Fidel et al. 1999). Selama ini, dalam beberapa kasus telah dilaporkan resistensi primer secara in vitro terhadap flukonazol terjadi pada C. krusei dan resistensi sekundernya paling umum terjadi pada C. glabrata. Resistensi in vitro terhadap ketokonazol dan itrakonazol pada C. albicans dan C. glabrata masih jarang terjadi, yakni hanya sekitar <15%. Demikian pula halnya resistensi yang diperlihatkan oleh C. albicans terhadap flukonazol (Wingard 1994; Rex et al. 1995).
BAB 3
METODE PENELITIAN Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Juli 2011 sampai dengan bulan Maret 2012. Kegiatan ini dilakukan di laboratorium Bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah gelas objek, kaca penutup, mikroskop, cawan petri, tabung reaksi, rak tabung reaksi, ose, spiritus, ruang inokulasi, inkubator, lemari es, otoklaf, oven, termos es, pinset, dan pipet.
Bahan yang digunakan antara lain contoh susu, contoh air yang digunakan sebagai sumber air di peternakan, pelicin (vaselin, mentega) yang digunakan saat pemerahan, usapan tangan pemerah, usapan lendir vagina sapi, urin yang baru keluar, Potato Dextrose Broth (PDB) sebagai media transport, Lactophenol Cotton Blue (LPCB), Pottato Dextrose Agar (PDA), NaCl, air suling sucihama, putih telur bebek, Sugar Assimilation Medium, antibiotika (kloramfenikol) dan anticendawan (ketokonazol, flukonazol, itrakonazol, griseofulvin).
Rancangan Penelitian Pengambilan Contoh
Pengambilan contoh dilakukan di beberapa lokasi peternakan sapi perah yaitu Cipanas (Bapak Suroso), Cisarua (Bapak H. Karom), Kebon Pedes (Bapak Syarib Hidayat), dan Kawasan Usaha Peternakan (KUNAK), Cibungbulang (Bapak Cecep). Contoh yang diambil berupa susu yang baru diperah, sumber air yang digunakan di peternakan, pelicin yang digunakan saat pemerahan, usapan tangan pemerah, usapan vagina sapi, dan urin yang baru keluar.
17
Perlakuan Contoh
Contoh diproses di ruang inokulasi. Pembiakan masing-masing contoh dilakukan dengan metode agar tuang. Tahapan-tahapan dari proses pembiakan contoh ini adalah :
(a) Sebanyak satu mililiter contoh diambil kemudian dicampurkan ke dalam tabung yang telah berisi sembilan mililiter air suling sucihama sehingga diperoleh tingkat pengenceran 1/10. Suspensi ini dihomogenkan dan diambil sebanyak satu mililiter ke dalam cawan petri suci hama. Selanjutnya, untuk mendapatkan suspensi dengan tingkat pengenceran 1/100, dilakukan dengan mengambil suspensi pada tabung pertama sebanyak satu mililiter dan dicampurkan ke dalam tabung kedua yang telah berisi sembilan mililiter air suling sucihama. Suspensi kedua ini dihomogenkan kembali dan dimasukkan sebanyak satu mililiter ke dalam cawan petri suci hama.
(b) Media PDA yang siap membeku dituangkan ke dalam cawan yang berisi suspensi contoh. Cawan digoyang–goyangkan mengikuti angka delapan agar suspensi dan media tercampur sempurna. Media didiamkan untuk memadat dan diinkubasi pada suhu 37 oC selama 3 hari.
Pengamatan terhadap Koloni yang Tumbuh pada Media PDA
Pengamatan dilakukan terhadap koloni yang tumbuh pada pembiakan setelah masa inkubasi dicapai. Pengamatan yang dilakukan meliputi warna, bentuk, dan bau koloni. Pengamatan mikroskopik dilakukan dengan pewarnaan Lactophenol Cotton Blue atau lugol mengenai ukuran dan bentuk sel, ada tidaknya miselium, kapsul dan budding cell, dan ciri – ciri morfologi yang lain dilakukan terhadap koloni yang diduga sebagai koloni Candida berdasarkan pengamatan makroskopik. Koloni yang diduga adalah koloni Candida berdasarkan pengamatan makroskopik dan mikroskopik disubkultur ke media agar miring PDA dan diinkubasi pada suhu 25-27 oC selama 3 hari.
Identifikasi Isolat
Pemeriksaan dilanjutkan dengan melakukan serangkaian pemeriksaan untuk identifikasi spesies dari Candida. Identifikasi ini dilakukan dengan metode yang telah dilakukan oleh Marinho et al. (2010).
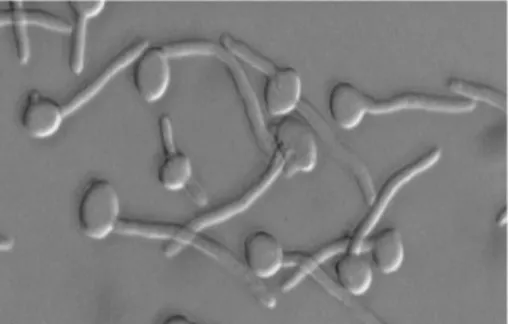
(a) Uji tabung kecambah (tabung kecambah test)
Media yang digunakan adalah bahan yang mengandung faktor protein, seperti putih telur, serum dan plasma. Pada penelitian ini media yang digunakan adalah putih telur bebek. Biakan murni berumur 24 jam dibiakkan ke dalam 0,5 mL putih telur bebek dan kemudian diinkubasikan pada suhu 37 oC selama 2 jam. Setelah 2 jam, biakan diperiksa di bawah mikroskop untuk mengetahui ada tidaknya tabung kecambah seperti yang terpapar pada Gambar 9 di bawah ini.
Gambar 9 Uji tabung kecambah (Saigal et al. 2011)
(b) Uji asimilasi gula-gula
- Deretan tabung reaksi berisi media cair Sugar assimilation medium yang mengandung gula-gula yang diperlukan yaitu glukosa, maltosa, sukrosa, laktosa, arabinosa, dan manitol. Satu tabung kontrol yang berisi media yang sama tetapi tidak mengandung gula disiapkan untuk keperluan uji ini. - Secara aseptik, sedikit koloni khamir (paling lama berumur 3 hari)
dipindahkan ke tabung reaksi yang di dalamnya telah terdapat dua mililiter air suling sucihama. Suspensi tersebut dihomogenkan dan kekeruhannya disamakan dengan larutan McFarland #1.
- Secara aseptik, sebanyak 0,2 mL suspensi khamir yang telah homogen dipindahkan ke tabung-tabung gula-gula dan juga ke tabung kontrol. Seluruh
19
tabung yang mendapatkan isolat diinkubasi pada suhu 30 oC selama tujuh hari atau setelah terjadi perubahan warna (keruh).
- Hasil positif ditandai dengan adanya pertumbuhan dan terlihat media di tabung menjadi keruh dibandingkan media di tabung kontrol.
Uji Aktivitas Anticendawan
Uji ini dilakukan hanya untuk koloni yang sudah dipastikan sebagai koloni C. albicans. Pengujian aktivitas anticendawan ini bertujuan untuk melihat apakah khamir masih peka terhadap anticendawan yang diberikan dengan melihat terbentuk tidaknya zona hambat. Pengujian ini menggunakan metode difusi agar dan metode ini dilakukan berdasarkan metode yang digunakan oleh Rostinawati et al. (2009). Anticendawan yang digunakan adalah ketokonazol, flukonazol, itrakonazol dan griseofulvin dengan berbagai kadar pengenceran (sampai terbentuk adanya zona hambat).
Suspensi C. albicans dibuat dengan mengambil biakan menggunakan ose lalu diencerkan dengan NaCl 0,9% suci hama dan disesuaikan kepekatannya dengan larutan McFarland #1. Sebanyak 0,1 mL suspensi diteteskan ke atas permukaan media PDA di cawan petri. Tetesan disapu-ratakan dengan menggunakan kapas bergagang (cotton swab) sucihama dengan harapan seluruh permukaan lempengan agar. Setelah didiamkan selama lima menit, agar dilubangi sebanyak lima lubang dengan jarak yang telah diatur sedemikian rupa sehingga tidak terjadi penumpukan zona hambat yang akan dihasilkan nantinya. Sebanyak 50 µL masing-masing suspensi anticendawan yang digunakan ke dalam lubang-lubang yang telah dibuat. Cawan yang telah selesai diberi perlakuan diinkubasi pada suhu 27-29 ºC selama 24-48 jam. Adanya aktivitas anticendawan akan ditunjukkan dengan terbentuknya zona hambat di sekitar lubang.
Pencarian Kadar Hambat Minimum (Minimum Inhibition Concentration-MIC)
Uji ini diawali dengan menempatkan koloni C. albicans umur 24 jam ke tabung reaksi yang di dalamnya terdapat sembilan mililiter air suling sucihama dan dihomogenkan untuk disamakan kepekatannya dengan larutan McFarland #1 (diperkirakan setara dengan jumLah 108 CFU/mL). Suspensi diencerkan sampai
kandungan khamir diperkirakan mencapai 106 CFU/mL. Sebanyak 11,25 µL anticendawan yang akan diuji ditambahkan ke dalam suspensi pengenceran terakhir (106 CFU/mL). Anticendawan yang digunakan dalam penelitian ini adalah ketokonazol dengan kadar 0,125 µg/mL, 0,5 µg/mL, 2 µg/mL, dan 8 µg/mL; itrakonazol dengan kadar 0.125 µg/mL, 0.5 µg/mL, 4 µg/mL, dan 16 µg/mL; flukonazol dengan kadar 0.25 µg/mL, 2 µg/mL, 8 µg/mL, dan 32 µg/mL; dan griseofulvin dengan kadar 0,25 µg/mL, 4 µg/mL, 8 µg/mL, dan 64 µg/mL.
Suspensi C. albicans yang telah ditambahi anticendawan diencerkan sampai ke tingkat pengenceran 10-7. Sebanyak satu mililiter dari masing-masing tabung pengenceran 10-3 sampai 10-7 dituangkan ke dalam satu cawan petri kosong dan sucihama. Proses ini dilakukan secara triplo. Setelah itu, ke dalam semua cawan dituangi media PDA yang diimbuhi kloramfenikol (0,05 mg/mL medium). Cawan digoyang membentuk angka 8 sehingga suspensi tercampur merata memadat. Setelah didiamkan dan agar memadat, seluruh cawan diinkubasi pada suhu 37 oC selama 24 jam. Koloni yang tumbuh setelah masa inkubasi dicapai dihitung dengan aturan hanya cawan yang diperkirakan mengandung kisaran 25-250 CFU koloni yang tumbuh saja yang akan dihitung.
Analisis Data
Data kepekaan anticendawan terhadap C. albicans yang dihasilkan pada penelitian ini dianalisis secara deskriptif.
BAB 4
HASIL DAN PEMBAHASAN Lokasi Pengambilan Contoh
Pengambilan contoh dilakukan pada beberapa peternakan sapi perah yang berada di wilayah kota Bogor. Peternakan sapi perah merupakan usaha atau kegiatan pemeliharaan sapi perah dengan tujuan utama untuk pemerahan susu (Sularto 2008). Susu yang bermutu baik dapat diperoleh dari ternak sapi perah yang sehat karena manajemen pemeliharaan yang baik dan benar. Salah satunya adalah pengendalian penyakit yang benar dan tepat dengan memperhatikan higiene dan sanitasi peternakan tersebut. Biasanya peternak sapi perah kurang memperhatikan kondisi ternaknya sehingga mereka mudah terserang penyakit (Rahman 2007).
Penelitian ini dilakukan dengan melakukan pengambilan contoh pada empat peternakan sapi perah yang berada di wilayah kota Bogor. Lokasi peternakan sapi perah tersebut adalah peternakan Kebon Pedes, Cisarua, Cipanas, dan Kunak. Bahan yang diambil untuk dijadikan contoh adalah susu, pelicin yang digunakan saat memerah (mentega atau vaselin), usapan vagina, usapan tangan pemerah, urin dan air yang digunakan pada masing-masing peternakan. Pemilihan tempat pengambilan contoh ditentukan berdasarkan suhu ditempat tersebut. Sedangkan jenis contoh yang diambil ditentukan berdasarkan asumsi bahwa contoh yang dipilih merupakan tempat yang disukai C. albicans.
Suhu merupakan faktor yang berpengaruh langsung terhadap hewan ternak terutama sapi perah, karena sapi perah memiliki sifat-sifat tertentu yang dipengaruhi oleh suhu yaitu dalam hal pertumbuhan, konsumsi pakan, dan produksi susu. Pada umumnya, sapi perah yang dipelihara di Indonesia adalah dari jenis Frisian Holstein (FH) dan peranakan FH. Sapi perah yang dipiara di Indonesia kebanyakan berasal dari daerah Eropa. Oleh karena itulah, hanya beberapa daerah saja di Indonesia yang bisa dijadikan lokasi untuk peternakan sapi perah (Kartiwa 2010). Selain itu, faktor lingkungan dan pengelolaan peternakan dapat menjadi faktor pendukung untuk munculnya penyakit pada sapi perah. Faktor-faktor tersebut dapat berupa pakan, perkandangan, jumlah ternak dalam satu kandang, sirkulasi udara, sanitasi kandang dan cara pemerahan susu
(Sharif dan Muhammad 2009). Berdasarkan pengamataan yang dilakukan pada saat pengambilan contoh ke beberapa peternakan sapi perah, peternakan Cisarua dan Cipanas merupakan peternakan yang memiliki suhu yang dingin karena lokasi peternakan ini berada di daerah pegunungan Gunung Pangrango. Sedangkan peternakan Kebon Pedes dan Kunak memiliki suhu yang lebih tinggi daripada peternakan Cisarua dan Cipanas.
Agen penyebab penyakit dapat diisolasi pada sapi perah dari berbagai tempat yang cocok sebagai tempat berkembangbiaknya. Menurut Supar dan Ariyanti (2008), beberapa cara masuknya agen penyakit pada sapi perah dapat terjadi melalui cara pemerahan susu tanpa menggunakan mesin, melalui tangan pemerah, air yang dipakai untuk mencuci ambing, kain lap atau peralatan lain yang dipakai pada saat pemerahan susu. Penyakit yang paling sering terjadi adalah mastitis, terutama mastitis subklinis yang kejadiannya di Indonesia mencapai 95-98% (Sudarwanto 1999). Berdasarkan penelitian Sudarwanto (1997) dan Winata (2011), kejadian mastitis subklinis di daerah Bogor dan Cipanas terdeteksi sebesar 49,3%, sedangkan di Kunak terdeteksi sebesar 69,76%.
Dilihat dari sumber air yang digunakan pada peternakan sapi perah ini, tiga dari empat peternakan telah menggunakan PDAM sebagai sumber air, sedangkan peternakan Kebon Pedes masih menggunakan air sumur sebagai sumber air di peternakannya. Hal ini menjadi salah satu faktor yang dapat menentukan tingkat higiene dan sanitasi untuk masing-masing peternakan. Gambaran suasana peternakan di lokasi Kebon Pedes terlihat pada Gambar 10 di bawah ini.
(a) (b)
23
Contoh-contoh yang telah diambil dalam penelitian ini adalah susu, air yang digunakan sebagai sumber air di peternakan, pelicin (vaselin, mentega) yang digunakan saat pemerahan, usapan tangan pemerah, usapan vagina, dan urin yang baru keluar. Usapan vagina dan tangan pemerah diambil dengan alat bantu kapas bergagang yang sucihama dan selanjutnya disimpan di dalam tabung yang sucihama juga. Sedangkan susu dan pelicin langsung diambil secara aseptik dan disimpan di dalam plastik. Bentuk contoh yang diambil tersebut terpapar pada Gambar 11 di bawah ini.
(a) (b)
(c) (d)
Gambar 11 Beberapa contoh yang diambil. Usapan vagina (a), usapan tangan (b), susu (c), dan pelicin (d)
Tabel 3 menunjukkan data jumlah contoh yang diambil pada setiap lokasi peternakan.
Tabel 3 Lokasi dan jumlah pengambilan contoh
Lokasi pengambilan contoh
Jumlah contoh yang diambil berdasarkan jenis Susu Usapan
vagina
Usapan tangan
Pelicin Air Urin Jumlah
Peternakan Cipanas 3 5 2 1 1 1 13
Peternakan Cisarua 3 5 2 1 1 1 13
Peternakan Kebon Pedes 3 5 2 2 1 1 14
Peternakan Kunak 3 5 2 1 1 1 13
Jumlah 12 20 8 5 4 4 53
Berdasarkan Tabel 3 diatas, penelitian ini menggunakan 53 contoh yang terdiri dari 12 contoh susu, 20 contoh usapan vagina, delapan contoh usapan tangan pemerah, lima contoh pelicin yang digunakan saat memerah, empat contoh air yang digunakan sebagai sumber air di peternakan dan empat contoh urin. Banyaknya contoh yang diambil untuk masing-masing lokasi memiliki jumlah yang sama, kecuali pada lokasi peternakan Kebon Pedes. Di lokasi ini dua contoh pelicin diambil karena pelicin yang digunakan pada peternakan Kebon Pedes ditempatkan pada dua tempat yang berbeda. Mentega digunakan di peternakan Cipanas, Cisarua, dan Kebon Pedes sebagai pelicin ketika melakukan pemerahan, kecuali di lokasi peternakan Kunak yang menggunakan vaselin.
Kandidiasis pada sapi perah biasanya dinyatakan sebagai mastitis, serta pernah juga dilaporkan pada kasus aborsi (Gholib dan Kusumaningtyas 2008; Foley dan Schlafer 1987), hal ini yang mendasari pengambilan contoh pada susu dan usapan vagina. Selain itu, pengambilan contoh pada usapan tangan pemerah, pelicin (vaselin,mentega) yang digunakan saat pemerahan, sumber air di peternakan, dan urin yang baru keluar merupakan contoh yang diduga menjadi tempat yang cocok untuk berkembangbiaknya agen penyebab penyakit pada sapi perah, terutama bakteri dan cendawan.
Identifikasi C. albicans
Identifikasi dilakukan terhadap koloni yang diduga C. albicans pada contoh yang sebelumnya telah dibiakkan dengan menggunakan metode agar
25
tuang. Media tersebut diinkubasi pada suhu 37 ºC selama 24 jam. Setelah masa inkubasi tercapai, isolat yang tumbuh diamati secara mikroskopik dalam bentuk sediaan natif yang diwarnai dengan LPCB.
Hasil identifikasi secara mikroskopik dapat dilihat pada Gambar 12 di bawah ini. Gambar 12a memperlihatkan adanya bentuk sel khamir (blastospora) yang merupakan salah satu bentuk dari fase dimorfik yang ada pada C. albicans dan akan membentuk tunas yang biasa disebut dengan budding cell. Sedangkan Gambar 12b memperlihatkan adanya hifa yang juga merupakan bentuk dari fase dimorfik C. albicans. Fase ini merupakan satu kesatuan yang berbentuk filamen dari suatu cendawan (Ali 2008).
(a) (b)
Gambar 12 Hasil pemeriksaan sediaan natif (tanda panah) yang diwarnai dengan LPCB memperlihatkan adanya budding cell (a), dan hifa yang akan membentuk pseudohifa (b).
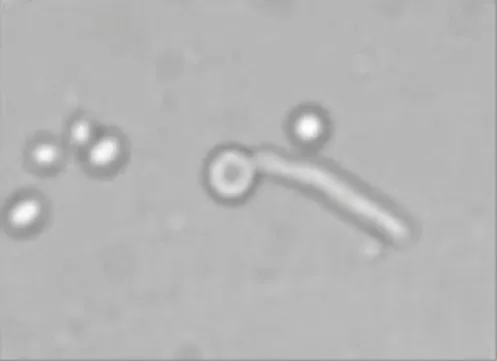
Untuk menetapkan arah identifikasi sebagai Candida albicans, isolat yang dicurigai diuji kemampuannya untuk membentuk tabung kecambah. Seluruh isolat yang memberikan hasil positif terhadap uji kecambah dibiakkan pada media asimilasi karbohidrat (Tjampakasari 2006). Hasil uji terhadap pembentukan tabung kecambah dan proses asimilasi terhadap karbohidrat terpapar di dalam Tabel 4 di bawah ini. Tabel tersebut memperlihatkan bahwa isolat yang diduga sebagai C. albicans dari uji kemampuannya membentuk tabung kecambah ternyata memang C. albicans (Gambar 13). Isolat yang diperiksa membutuhkan karbohidrat glukosa, sukrosa, maltosa, laktosa, manitol, dan arabinosa sebagai sumber karbon dan sumber energi untuk pertumbuhan dan proses
metabolismenya, kecuali isolat dari usapan vagina yang berasal dari peternakan Cipanas yang ternyata adalah C. pseudotropicalis.
Gambar 13 Tabung kecambah (tanda panah) yang dibentuk oleh isolat khamir yang diduga C. albicans
Tabel 4 Hasil uji tabung kecambah dan asimilasi gula-gula terhadap beberapa isolat yang diduga sebagai C. albicans
Kode
Koloni Asal koloni
Hasil uji kecambah
Hasil uji asimilasi gula-gula
Kesimpulan
G Mn S M L ARB
S3 P. Kebon Pedes + + + + + - - C. albicans UV2 P. Kebon Pedes + + + + + - - C. albicans P1 P. Kebon Pedes + + + + + - - C. albicans P2 P. Kebon Pedes + + + + + - - C. albicans S3 P. Cisarua + + + + + - - C. albicans P1 P. Cisarua + + + + + - - C. albicans S3 P. Cipanas + + + + + - - C. albicans UV1 P. Cipanas + + + + - + + C. pseudotropicalis Catatan: P= Peternakan. S3 berasal dari susu. UV1, UV2 berasal dari usapan vagina. P1, P2
berasal dari pelicin yang digunakan saat memerah. G= Glukosa, Mn= Manitol, S= Sukrosa, M= Maltosa, L= Laktosa, ARB= Arabinosa
Pembentukan tabung kecambah merupakan tahap awal dari proses transisi fase khamir ke fase hifa. Proses ini dipengaruhi oleh berbagai faktor lingkungan, yaitu suhu, pH, dan bahan kimia yang salah satunya berupa serum. Tabung kecambah ini hanya dapat dibentuk oleh C. albicans dan C. stellatoidea. Akan tetapi, berdasarkan data yang tertera di dalam Tabel 4 terlihat C. pseudotropicalis juga membentuk tabung kecambah dan ini diduga sebagai hasil positif palsu. Hasil ini terjadi diduga karena waktu inkubasi yang dilakukan terlalu lama (Molero et al.1998; Ali 2008; CMPT 2006). Waktu inkubasi yang terlalu lama ini terjadi karena banyaknya jumlah isolat yang harus diperiksa. Pemeriksaan tidak
27
mungkin bisa dilakukan dalam waktu yang bersamaan sehingga isolat yang terakhir diperiksa kemungkinan akan berpengaruh terhadap hasil yang diperoleh.
C. albicans yang diperoleh dari contoh-contoh yang diperiksa berasal dari beberapa lokasi seperti dipaparkan pada Tabel 5. Sedangkan jumlah contoh yang positif diperoleh C. albicans terpapar pada Tabel 6 di bawah ini.
Tabel 5 Isolat-isolat khamir dari contoh yang diperiksa
Lokasi pengambilan contoh
Dugaan koloni yang diisolasi dari contoh Susu Usapan vagina Usapan
tangan
Pelicin Air Urin
P. Kebon Pedes C. abicans C. albicans - C. albicans - - P. Cisarua C. albicans - - C. albicans - - P. Cipanas C. albicans C. Pseudotropicalis - - - -
P. Kunak - - - - - -
Catatan: P= Peternakan. Pelicin yang digunakan di Peternakan Kebon Pedes, Cisarua, dan Cipanas adalah mentega. Pelicin yang digunakan di Peternakan Kunak adalah vaselin
Tabel 6 Jumlah C. albicans pada contoh-contoh yang diperiksa
C. albicans pada contoh Lokasi pengambilan contoh S UV UT P A U Ca Ca Ca Ca Ca Ca P. Kebon Pedes 3 1 5 1 2 0 2 2 1 0 1 0 P. Cisarua 3 1 5 0 2 0 1 1 1 0 1 0 P. Cipanas 3 1 5 0 2 0 1 0 1 0 1 0 P. Kunak 3 0 5 0 2 0 1 0 1 0 1 0 Total 12 3 20 1 8 0 5 3 4 0 4 0
Catatan : P. Peternakan. S= Susu, UV= Usapan vagina, UT= Usapan tangan, P= Pelicin, A= Air, U= Urin, Ca= C. albicans
Berdasarkan Tabel 5 diatas, dapat dilihat bahwa dari keempat peternakan yang menjadi lokasi pengambilan contoh hanya peternakan Kunak yang tidak diperoleh C. albicans. Terdapat dua spesies Candida yaitu C. albicans dan C. pseudotropicalis yang berhasil diisolasi dari contoh-contoh yang diambil dari peternakan Kebon Pedes, Cisarua, dan Cipanas. Namun, C. albicans tetap sebagai khamir yang mendominasi. Spesies Candida merupakan flora normal saluran kelamin, kulit (termasuk kuku dan ambing), dan membran mukosa, seperti mulut, vagina atau dubur (Hanafi et al. 2010). Dari Tabel 5 dan 6 terlihat bahwa susu, mukosa vagina dan pelicin merupakan media yang paling rentan untuk dijadikan media hidup bagi C. albicans. Diisolasinya khamir C. albicans dari contoh susu, usapan vagina, dan pelicin diatas sejalan dengan laporan yang
disampaikan oleh Kivaria dan Noordhuizen (2006) yang menyebutkan bahwa telah terjadi peningkatan prevalensi C. albicans dari 1 % pada tahun 1971 menjadi 17 % pada tahun 2002 untuk kasus mastitis sapi di Tanzania.
Lebih dari tiga perempat kasus dari mastitis mikotik disebabkan oleh spesies Candida, seperti C. albicans, C. glabrata, C. kefyr, C. tropicalis, C. krusei, dan C. parapsilosis (Lagneau et al. 1996). Sedangkan kasus aborsi mikotik yang disebabkan oleh C. albicans telah dilaporkan terjadi pada sapi Holstein dengan atau tanpa penyakit reproduksi (Garoussi et al. 2007).
Susu sapi merupakan salah satu produk asal ternak yang paling sering dikonsumsi oleh manusia. Oleh karena itu, jika susu tersebut memiliki mutu yang kurang baik dan telah tercemar oleh berbagai mikroorganisme patogen seperti spesies Candida, khususnya C. albicans, maka akan berakibat terhadap kesehatan manusia. Spesies Candida yang tercerna oleh manusia dalam jumlah yang besar dari beberapa produk, termasuk susu, dapat mengakibatkan berbagai penyakit seperti kandidiasis vagina, kandidiasis usus, dan sariawan (Tafarosh dan Purohit 2008; Agboke et al. 2011).
Kadar Hambat Terendah
Penetapan MIC dapat dilakukan dengan menggunakan metode agar difusi maupun agar dilusi. Metode agar difusi hanya dapat mengetahui kemampuan daya hambat suatu anticendawan dengan melihat adanya zona hambat yang terbentuk. Sedangkan, metode agar dilusi dapat dilakukan dan mengetahui kadar terendah dari anticendawan yang efektif dalam menghambat pertumbuhan suatu cendawan (Kusumaningtyas et al. 2008). MIC suatu anticendawan ditentukan berdasarkan kadar terendah yang dapat menghambat pertumbuhan koloni cendawan sebanyak 80% (Koga et al. 2008).
Sebagai uji pendahuluan, dilakukan uji zona hambat untuk mengetahui kisaran kadar anticendawan yang mungkin efektif menghambat pertumbuhan isolat khamir C. albicans yang diperiksa. Efektifitas anticendawan diketahui dengan terbentuknya zona hambat seperti yang ditunjukkan pada Gambar 14. Namun uji ini tidak dapat menentukan peka atau resistennya anticendawan yang digunakan karena besar kecilnya diameter zona hambat yang terbentuk
29
dipengaruhi oleh banyak faktor, diantaranya ketebalan media, waktu pradifusi, dan kerapatan inokulum. Jadi, metode ini tidak dapat digunakan untuk menentukan MIC (Rostinawati 2009).
Gambar 14 Zona hambat yang dibentuk oleh anticendawan
Kadar anticendawan yang digunakan pada tahap awal uji zona hambat ini merupakan kadar anticendawan yang tergolong peka, yaitu ≤ 0,125 µg/mL untuk ketokonazol, 0,125 µg/mL untuk itrakonazol, 0,25 µg/mL untuk flukonazol, dan ≤ 0,25 µg/mL untuk griseofulvin (Graybill et al. 1998; Citak et al. 2005; Koga et al. 2008; Noreva 2012). Kemudian kadar dari masing-masing anticendawan ini dinaikkan sampai terbentuk zona hambat pada masing-masing isolat. Kadar terbentuknya zona hambat untuk masing-masing isolat C. albicans terpapar pada Tabel 7 dibawah ini.
Tabel 7 Kadar terbentuknya zona hambat pada ketokonazol, itrakonazol, flukonazol dan griseofulvin terhadap beberapa isolat C. albicans yang diperoleh dari contoh
Lokasi Contoh
Anticendawan
KTK ITK FLU GRIS (µg/mL)
Peternakan Kebon Pedes
Usapan vagina 8 16,0 4,0 64,0
Pelicin 0,5 0,125 4,0 64,0
Peternakan Cisarua Susu 2,0 0,125 0,25 4,0 Peternakan Cipanas Susu 0,125 0,25 32,0 8,0 Catatan: KTK= ketokonazol; ITK= itrakonazol; FLU= flukonazol; GRIS= griseofulvin
Uji selanjutnya adalah uji untuk menentukan MIC dengan menggunakan metode dilusi agar. Setiap anticendawan yang diuji terdiri dari empat kadar anticendawan, yaitu 0,125 µg/mL, 0,5 µg/mL, 2 µg/mL, dan 8 µg/mL untuk ketokonazol, 0,125 µg/mL, 0,5 µg/mL, 4 µg/mL, dan 16 µg/mL untuk itrakonazol, 0,25 µg/mL, 2 µg/mL, 8 µg/mL, dan 32 µg/mL untuk flukonazol, dan 0,25 µg/mL, 4 µg/mL, 8 µg/mL, dan 64 µg/mL untuk griseofulvin. Setiap anticendawan memiliki tingkat kepekaan yang berbeda terhadap C. albicans dan dari data yang diperoleh terbukti adanya perbedaan zona hambat yang terbentuk. Oleh karena itulah, terdapat perbedaan kadar yang digunakan untuk masing-masing anticendawan. MIC yang diperoleh ditentukan dari koloni cendawan yang hanya tumbuh sebanyak ≤ 20 % jika dibandingkan dengan kontrol yang tidak dipaparkan anticendawan (Koga et al. 2008). Nilai MIC anticendawan terhadap C. albicans yang diperoleh dari contoh tertera pada Tabel 8 dibawah ini.
Tabel 8 Nilai MIC ketokonazol, itrakonazol, flukonazol dan griseofulvin terhadap beberapa isolat C. albicans yang diperoleh dari contoh
Lokasi Contoh
Anticendawan
KTK ITK FLU GRIS (µg/mL)
Peternakan Kebon Pedes
Usapan vagina 2,0 16,0 8,0 8,0
Pelicin 2,0 0,5 8,0 64,0
Peternakan Cisarua Susu 0,125 16,0 8,0 64,0 Peternakan Cipanas Susu 0,125 4,0 32,0 64,0 C. albicans (Referensi) ≤ 0,125 – 4 (Citak et al. 2005) 0,125 – 4 (Koga et al. 2008) 0,25 – 8 (Graybill et al. 1998; Citak et al. 2005) 800 (Sehgal et al. 2005)
Catatan: KTK= ketokonazol; ITK= itrakonazol; FLU= flukonazol; GRIS= griseofulvin
Berdasarkan Tabel 8 diatas, nilai MIC yang didapatkan untuk ketokonazol masih tergolong peka terhadap semua isolat yang diuji dan nilai ini sesuai dengan hasil penelitian Citak et al. (2005) yang menyatakan bahwa nilai MIC ketokonazol yang tergolong peka terhadap C. albicans berada pada kisaran ≤ 0,125 - 4 µg/mL. Hal yang serupa juga terjadi pada griseofulvin. Semua isolat yang diuji tergolong peka karena nilai MIC yang didapatkan pada penelitian ini jauh berada dibawah nilai MIC yang didapatkan pada penelitian Sehgal et al.
31
(2005) yaitu sebesar 800 µg/mL. Sedangkan untuk itrakonazol terdapat isolat C. albicans yang tergolong resisten karena nilai MICnya untuk itrakonazol adalah ˃ 4 µg/mL. Hal serupa juga terdapat pada flukonazol karena ada salah satu isolat C. albicans yang tergolong resisten dengan nilai MIC ˃ 8 µg/mL. Nilai ini tergolong resisten karena berdasarkan Graybill et al. (1998) dan Citak et al. (2005) nilai MIC flukonazol yang dapat dikatakan peka terhadap C. albicans berada pada kisaran 0,25 - 8 µg/mL.
Ketokonazol, itrakonazol, dan flukonazol merupakan anticendawan yang berasal dari golongan azol. Ketokonazol termasuk dalam kelompok imidazol, sedangkan itrakonazol dan flukonazol termasuk dalam kelompok triazol. Kerja anticendawan ini menghambat biosintesis ergosterol dengan membatasi atau menghalangi kerja enzim 14-α-demithilase, yakni enzim yang bergantung pada sitokrom P-450 dan dibutuhkan untuk mengubah lanosterol menjadi ergosterol. Kekurangan ergosterol menyebabkan fluiditas membran sehingga menurunkan aktifitas enzim yang berkaitan dengan membran dan mengakibatkan peningkatan permeabilitas, menghambat pertumbuhan dan perbanyakan sel (Ford 2004). Ketokonazol dan itrakonazol memiliki struktur kimia dan profil farmakologik yang sama. Sedangkan untuk flukonazol memiliki struktur kimia yang unik karena ukuran molekulnya yang kecil dan lipofilitasnya yang lebih rendah. Secara umum, perbedaan penting antara kelompok imidazol dan triazol terletak pada afinitasnya. Triazol memiliki afinitas yang lebih besar terhadap enzim sitokrom P-450 dibandingkan dengan imidazol (Herman 1996).
Setidaknya ada tiga mekanisme resistensi yang dikenal terhadap golongan azol, yaitu perubahan pada enzim P-450 lanosterol demethylase, perubahan ∆5-6 -sterol desaturase, dan ketergantungan energy (energy dependent) yang ada pada mekanisme efflux pumps (Pinjon et al. 2003). Perubahan pada enzim P-450 lanosterol demethylase terjadi saat adanya mutasi pada gen ERG11 (kode untuk enzim 14-α-demethylase). Pengkodean gen pada enzim ini mencegah terjadinya pengikatan pada bagian enzimatik sehingga menyebabkan penurunan kadar obat pada sel sasaran. Ergosterol merupakan sterol utama membran sel cendawan dan seringkali menjadi sasaran kerja bagi obat-obat anticendawan. Resistensi terjadi karena komposisi sterol ini mengalami perubahan sehingga menyebabkan