SKOTIA FITRIASTRI PUTRI. Isolasi dan Purifikasi Inhibitor RNA Helikase
Virus Hepatitis C dari Bakteriosin Bakteri Asam Laktat S34. Dibimbing oleh
SURYANI dan A. ZAENAL MUSTOPA.
Terapi target molekular merupakan salah satu penanggulangan penyakit
virus hepatitis C yang sedang dikembangkan. Penghambatan NS3 helikase atau
RNA helikase virus hepatitis C dengan peptida inhibitor merupakan salah satu
terapi target molekuler. Bakteriosin merupakan salah satu peptida inhibitor yang
memiliki kemampuan untuk menghambat virus hepatitis C melalui mekanisme
penghambatan NS3 helikase. Bakteriosin adalah peptida yang dihasilkan bakteri
asam laktat. Tujuan penelitian ini untuk melakukan isolasi dan purifikasi
bakteriosin dari isolat S34 yang memiliki aktivitas yang tinggi dalam menghambat
kerja RNA helikase virus hepatitis C. Bakteri asam laktat S34 yang diidentifikasi
dengan metode amplifikasi 16S rRNA dan sekuensing DNA merupakan bakteri
Lactobacillus plantarum WCFS1. Pertumbuhan bakteri tersebut mencapai fase
logaritma pada jam ke:7 dan fase stasioner jam ke:10. Bakteriosin diisolasi dan
dipurifikasi melalui presipitasi amonium sulfat dengan kejenuhan 80% dan
kromatografi gel filtrasi serta dilakukan karakterisasinya meliputi analisis bobot
molekul dan pengukuran kadar protein. Bakteriosin dari bakteri asam laktat S34
memiliki persentase inhibisi terhadap RNA helikase virus hepatitis C sebesar
64.20%, diduga bakteriosin kelas 2, bersifat termostabil, memiliki bobot molekul
pada kisaran 1.7:4.6 kDa dengan aktivitas spesifik sebesar 2.84 x 10
6SKOTIA FITRIASTRI PUTRI. Isolation and Purification RNA Helicase Inhibitor
of Hepatitis C Virus From S34 Lactic Acid Bacteria Bacteriocin. Under the
direction of SURYANI and A. ZAENAL MUSTOPA.
Target molecular therapy is one of method to prevent hepatitis C virus
which was developed recently. NS3 Helicase/RNA helicase hepatitis C virus
inhibition using inhibitory peptide are target in molecular therapy. Bacteriocin are
inhibitory peptides which can inhibit hepatitis C virus through inhibition of NS3
helicase. Bacteriocin is a peptide which is produced by lactic acid bacteria. The
aim of this research were to isolate and to purify bacteriocin from S34 lactic acid
bacteria which has high activity to inhibit RNA helicase of hepatitis C virus. S34
lactic acid bacteria were identified using 16S RNA amplification and DNA
sequencing identification of S34 lactic acid bacteria was Lactobacillus plantarum
WCFS1. The bacterial growth reached logaritmic phase at 7
hours and stationary
phase at 10 hours. Bacteriocin were isolated and purified by ammonium sulphate
precipitation with 80% saturation, gel filtration chromatography, and
characterization of bacteriocin through molecular weight analysis and measured
protein concentration. Bacteriocin from S34 lactic acid bacteria were included in
2
ndclass bacteriocin, had 64.20 % of inhibition against RNA helicase hepatitis C
virus, had molecular weight about 1.7:4.2 kDa, and specific activity in the amount
of 2.84 x 10
6Virus hepatitis C merupakan penyakit penyebab kematian ke sepuluh di dunia. Sekitar 8.000 hingga 10.000 orang meninggal tiap tahunnya akibat virus hepatitis C menurut
US Centers for Disease Control And Prevention. Berdasarkan data World Health Organization, sekitar 170 juta orang yang menderita penyakit virus hepatitis C (Baginski
et al. 2000). Tahun 2006 sebanyak 7 juta masyarakat Indonesia terjangkit virus hepatitis C.
Virus ini dapat menyebar melalui penggunaan jarum suntik, transfusi darah, hubungan seksual, dan hemodialisis (Sy & Jamal 2006). Virus hepatitis C mengalami perkembangan secara klinis selama 7 hingga 8 minggu setelah paparan virus tersebut. Namun biasanya penderita tidak menunjukkan tanda: tanda adanya gejala atau hanya gejala ringan. Gejala tersebut timbul setelah menjadi kronis dan dalam waktu interval yang sangat lama. Infeksi virus hepatitis C sangat sulit untuk dideteksi. Interval antara infeksi hingga fase kronis yang menimbulkan fibrosis dan sirosis dapat meningkat setelah tiga puluh tahun.
Terapi pengobatan hepatitis C telah dilakukan sejak tahun 1989 dan sampai sekarang masih terdapat beberapa kendala dalam terapi tersebut. Terapi terhadap virus hepatitis C dapat melalui 2 strategi pendekatan, yaitu terapi obat:obatan dan terapi target molekular. Terapi virus hepatitis C berdasarkan obat:obatan dan bahan kimia merupakan terapi yang pertama kali digunakan. Terapi ini dimulai pada tahun 1989 (Lauer & Walker 2001). Beberapa obat: obatan dan senyawa kimia telah diujicobakan terhadap penderita penyakit hepatitis C. Obat: obatan tersebut adalah ribavirin, inhibitor inositol monofosfat dehidrogenase (IMPDH), histamin, thymosin alpha 1, dan amantadin. Meskipun terapi pengobatan menggunakan ribavirin dan interferon alfa menunjukkan kemajuan yang berarti dalam terapi virus hepatitis C, terapi menggunakan obat:obatan masih menimbulkan efek samping yang berbeda:beda dan diperlukan kombinasi yang cocok sehingga pengobatan dengan pendekatan obat:obatan dapat sesuai dengan genotipe virus hepatitis C yang berbeda:beda (Mc Hutchison & Patel 2002).
Terapi yang saat ini sedang berkembang adalah terapi berdasarkan target molekular. Salah satu yang sedang dikembangkan saat ini adalah terapi inhibitor NS3 helikase. NS3 helikase merupakan enzim yang berperan
penting dalam siklus hidup virus yang memiliki material genetik berupa RNA. Gen NS3 (non structural 3) helikase merupakan salah satu target dalam terapi berdasarkan target molekular selain NS2 dan NS3 protease, NS5B RNA dependent polymerase, ribozim, dan oligonukleotida antisense.
RNA helikase yang dihasilkan dari ekspresi gen NS3 helikase merupakan katalisator pemisahan nukleotida dupleks melalui mekanisme pelepasan untaian yang sangat penting dalam proses replikasi virus. Inhibitor yang dapat menghambat kerja dari RNA helikase dapat menghambat proses replikasi virus yang merupakan tahapan penting dalam terapi ini sehingga diperlukan adanya molekul yang dapat menghambat kerja dari RNA helikase virus hepatitis C. Peptida inhibitor merupakan kandidat sebagai agen antivirus. Beberapa penelitian ditemukan bahwa isolat peptida yang memiliki sekuen yang memberikan respon terhadap protein, memiliki kecenderungan yang kuat untuk mengikuti konformasi protein sehingga peptida dapat menjadi inhibitor selektif untuk menghambat perlekatan virus, masuknya virus, dan replikasi dari virus (Gozdek et al.
2007). Beberapa peptida dari bakteri memiliki kemampuan sebagai inhibitor virus. Strain bakteri asam laktat telah banyak dipublikasikan sebagai inhibitor pada berbagai virus seperti virus herpes simplex, HIV, dan virus avian influenza.
Bakteri asam laktat dapat memproduksi substansi berupa peptida yang disebut dengan bakteriosin. Bakteriosin telah terbukti memiliki efek antimikrobial dan dapat menghambat beberapa virus seperti virus influenza A dan virus herpes simplex (Serkedjieva et al. 2000, Wachsman et al.
hepatitis C yang berperan penting dalam siklus hidup virus hepatitis C. Penelitian ini juga diharapkan dapat memberikan solusi terhadap penanganan penyakit virus hepatitis C sehingga mengurangi penyebaran penyakit hepatitis C lebih lanjut.
!
"#$% &' ("("%
Virus hepatitis C adalah virus RNA yang berutas nonsitopatik positif menyebabkan hepatitis akut dan kronis serta karsinoma hepatoseluler (Zhong et al. 2005). Virus Hepatitis C termasuk anggota dalam genus hepacivirus dan famili flaviviridae yang merupakan penyebab penyakit hepatitis pada manusia di seluruh dunia (Baginski et al.
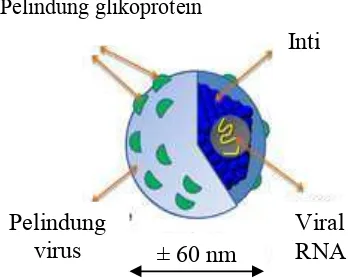
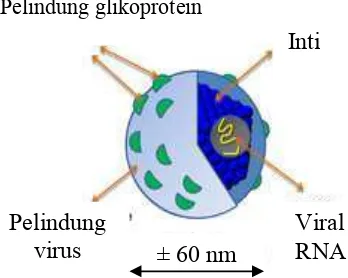
2000). Virus hepatitis C ini memiliki ukuran kecil yaitu 50 nm dan beramplop. Partikel virus hepatitis C terdiri atas inti berupa RNA yang merupakan material genetik, kulit yang mengelilingi material genetik yang terbentuk dari protein berbentuk ikosahedral, dan terbungkus dalam amplop asam lemak (Gambar 1). Dua glikoprotein amplop virus, E1 dan E2 tertanam di dalam amplop lipid (Op de Beeck & Dubuisson 2003). Target alami dari virus hepatitis C adalah hepatosit dan limfosit B (Lauer & Walker 2001). Virus hepatitis C memiliki 3 reseptor yang telah diidentifikasi yaitu CD81 (Cormier et al.
2004), human scavenger class B1 (SR:BI) (Mailard et al. 2006), dan claudin:1 (Evans et al. 2001).
Replikasi virus bersifat kuat dan dapat diperkirakan lebih dari sepuluh milyar partikel virion diproduksi perhari bahkan pada fase kronis dari infeksi. Virus hepatitis C mengkode poliprotein tunggal yang terdiri atas 3011 asam amino dan memproses menjadi 10 protein struktural dan regulator. Komponen struktural terdiri atas inti dan dua protein amplop. Selain inti dari virus terdapat juga dua daerah dari protein amplop E2 didesain sebagai dareah hipervariabel 1 dan 2 yang memiliki laju yang tinggi terhadap mutasi dan dipercaya sebagai hasil dari tekanan selektif oleh antibodi spesifik terhadap virus (Lauer & Walker 2001).
Virus hepatitis C juga mengkode gen helikase spesifik virus, protease, dan polimerase. Protein:protein ini memiliki fungsi penting dalam siklus hidup virus. Protein:protein ini dijadikan target yang menarik untuk terapi antivirus. Daerah yang tidak ditranslasikan pada kedua ujung RNA
virus memiliki potensi juga terhadap target terapetik.
Gambar 1 Virus hepatitis C (Moradpour et al.
2007).
& ") %&
Enzim helikase adalah enzim yang terlibat dalam hampir semua aspek metabolisme DNA dan RNA. meskipun terdapat kemajuan terhadap pengetahuan mekanisme aksi dari enzim:enzim ini, resolusi yang terbatas menyebabkan mekanisme rinci seperti penataan ulang struktur asam nukleat hingga pengikatan dan hidrolisis ATP yang dilakukan pasangan enzim helikase ini tidak dapat diketahui (Dumont et al. 2006). Fungsi dasar enzim helikase untuk membuka utas ganda DNA atau RNA melalui coupling hidrolisis NTP dengan translokasi sepanjang satu utas DNA atau RNA (Fan et al. 2008).
Helikase mengandung tiga domain yang ukurannya sama dan dipisahkan oleh celah yang agak dalam serta dihubungkan oleh asam amino fleksibel yang meregang disebut hinge
region (Borowsksi 2008). Domain 1 dan
domain 2 helikase virus hepatitis C memiliki topologi yang serupa. Domain 1 dari helikase virus hepatitis C mengandung untai β yang membentuk antiparalel seluruhnya. Domain 3 memiliki struktur α helik yang lebih dominan dan berasosiasi dengan domain 2 melalui untai β (Kim et al. 1998).
Seluruh helikase virus memiliki aktivitas NTP/ATPase. Aktivitas ini tergantung pada adanya NTP dan kation divalen berupa Mg2+. Produk dari hidrolisis NTP pada setiap pengkajian helikase adalah NDP/ADP dan Pi. Aktivitas NTP/ATP dari helikase secara umum distimulasikan oleh keberadaan asam nukleat untai tunggal. Hal ini memungkinkan enzim berikatan dengan untai RNA dengan energi yang didapat dari hidrolisis ATP untuk
Inti
Viral
RNA
Pelindung
virus
Pelindung glikoprotein
memisahkan ikatan hidrogen pasangan basa dari struktur dupleks (Kim et al. 1998).
Ikatan asam nukleat dapat menginduksi konformasi protein yang terkarakterisasi dengan pengembangan situs aktif dari domain NTP/ATPase. Aktivitas NTP/ATPase tidak dapat distimulasi pada kadar garam tinggi. Hal ini disebabkan kondisi kekuatan ionik kuat asam nukleat tidak dapat terikat dengan enzim dan enzim membentuk konformasi yang tidak cocok untuk pelepasan untaian (Kim et al.
1998).
Helikase adalah enzim yang mengikat dan menggunakan NTP/ATP. Interaksi antara nukleotida dimediasikan oleh pengikatan yang terkarakterisasi dan terdeteksi dengan keberadaaan motif A dan motif B Walker yang terkonservasi tinggi. Kedua motif tersebut adalah sekuen asam amino yang berpartisipasi dalam pengikatan dan hidrolisis grup fosfat β dan γ dari NTP (Borowsksi 2008).
Beberapa penelitian tentang mutasi dan penghambatan terhadap NS3 diperlukan untuk propagasi virus sehingga pengembangan inhibitor efektif dari enzim helikase virus hepatitis C adalah bagian penting dalam strategi antiviral.
)(&#" % )( (
Bakteri asam laktat merupakan bakteri Gram positif, tidak membentuk spora, memiliki bentuk kokus atau batang dengan komposisi DNA kurang dari 56% G+C. Bakteri asam laktat adalah kelompok bakteri yang mampu mengubah karbohidrat (glukosa) menjadi asam laktat. Efek bakterisidal dari asam laktat berkaitan dengan penurunan pH lingkungan menjadi 3 sampai 4,5 sehingga pertumbuhan bakteri lain termasuk bakteri pembusuk akan terhambat. Pada umunya mikroorganisme dapat tumbuh pada kisaran pH 6:8 (Buckle et al. 1987).
Bakteri asam laktat merupakan organisme yang tumbuh secara anaerob tetapi tidak seperti organisme anaerob lainnya. Hal ini disebabkan bakteri asam laktat dapat tumbuh dengan keberadaan oksigen atau disebut juga dengan organisme aerotoleran anaerob (Widodo 2003). Bakteri asam laktat terbagi atas beberapa genus yaitu Lactobacillus, Leuconostoc, Pediococcus, Lactococcus, Streptococcus, Enterococcus, Oenococcus,
Tetragenococcus, Vagococcus,
Carnobacterium, dan Weisella.
Jalur metabolisme bakteri asam laktat terbagi menjadi dua macam yaitu pengubahan
satu molekul glukosa menjadi dua molekul asam laktat untuk bakteri asam laktat homofermentatif dan pengubahan glukosa menjadi asam laktat, etanol, dan karbon dioksida (Caplice & Fitzgerald 1999, Jay 2000, Kuipers et al. 2000).
Gambar 2 Bakteri asam laktat (Claesson et al.
2006)
)(&#"*%"
Bakteriosin merupakan polipeptida yang termodifikasi atau tidak termodifikasi sintetik oleh ribosom. Bakteriosin memiliki kemampuan untuk menghambat spektrum antimikrobial yang sempit. Bakteriosin diproduksi untuk melawan bakteri Gram positif yang memiliki kekerabatan terhadap bakteri asam laktat yang merupakan penghasil bakteriosin. Selain memiliki kemampuan dalam menghambat bakteri, bakteriosin juga telah terbukti memiliki kemampuan dalam menghambat virus (Serkedjieva et al. 2000, Wachsman et al. 2003, Todorov et al. 2005).
Bakteriosin diklasifikasikan menjadi tiga grup yaitu bakteriosin kelas 1, bakteriosin kelas 2, serta bakteriosin kelas 3. Masing: masing kelas memiliki ciri:ciri yang berbeda. Bakteriosin kelas satu merupakan bakteriosin yang terdiri atas satu atau dua peptida kecil dan merupakan peptida yang termodifikasi pada post:translasi. Ukuran peptida ini sekitar 3 kDa. Bakteriosin ini juga disebut lantibiotik karena memiliki modifikasi struktur yang mengandung lanthionin, β:metillanthionin, dan asam amino terdehidrasi. Lantibiotik juga terbagi menjadi 2 subkelas yaitu tipe A dan tipe B. Lantibiotik tipe A yang telah banyak adalah nisin. Lantibiotik tipe A merupakan molekul yang fleksibel terelongasi dengan muatan postif serta memiliki aktivitas depolarisasi membran. Lantibiotik tipe B yang banyak dikenal adalah mersacidin. Merscasidin memiliki bentuk globular dan mengganggu sintesis dinding sel (Yoneyama
Bakteriosin kelas 2 memiliki ukuran yang kecil yaitu kurang dari 5 kDa dan terbagi menjadi 2 subkelas yaitu kelas IIa dan kelas IIb. Bakteriosin kelas IIa merupakan bakteriosin yang banyak ditemukan pada bermacam:macam bakteri asam laktat (Lactobacillus, Enterococcus, Pediococcus,
Carnobacterium, dan Leuconostoc).
Bakteriosin tersebut memiliki kesamaan 40%: 60% sekuen asam amino dengan karakteristik sekuen terkonservasi, serta residu sistein membentuk ikatan disulfida pada daerah N: terminal. Bakteriosin tipe ini dikenal sebagai pengawet makanan karena dapat menghambat aktivitas bakteri patogen yang menular lewat makanan. Bakteriosin kelas IIb mengandung 2 peptida yang terpisah. Bakteriosin kelas I dan II memiliki target membran sitoplasma bakteri Gram positif. Bakteriosin kelas I dan II bersifat stabil terhadap suhu panas (Yoneyama et al. 2004).
Bakteriosin tipe III yang telah dikenal adalah helveticin J. Bakteriosin ini merupakan bakteriosin yang terakhir dikarakterisasi. Bakteriosin tipe III bersifat tidak stabil terhadap suhu panas. Bakteriosin ini juga memiliki ukuran yang lebih besar dari 30 kDa (Yoneyama et al. 2004).
#* (*+# ," & " (# %"
Kromatografi filtrasi gel merupakan teknik pemisahan protein berdasarkan pada ukuran molekul. Matrik filtrasi gel merupakan gel yang berpori yang dikemas dalam kolom. Pori:pori matrik dapat menampung molekul yang berukuran kecil dan memisahkannya dari molekul yang mempunyai berat molekul tinggi, sehingga teknik ini dapat pula digunakan untuk estimasi berat molekul (Scopes 1987).
Keuntungan dari metode ini adalah dapat memisahkan dengan baik molekul besar dari molekul kecil serta dapat menggunakan berbagai pelarut tanpa harus mengganggu proses pemisahan. Penggunaan kromatografi gel filtrasi ini akan didapatkan pemisahan yang baik, sensitifitas yang baik, dan waktu yang diperlukan untuk pemisahan cepat. Selain itu tidak ada sampel yang tertinggal karena pelarut tidak berinteraksi dengan fase diam (Skoog 2006). Kehilangan molekul protein dapat terjadi selama proses pemurnian dengan menggunakan teknik kromatografi gel filtrasi karena autolisis (Scopes 1987).
Prinsip dasar kromatografi gel filtrasi adalah partikel dengan ukuran yang berbeda akan dielusi melalui fase stasioner pada
tingkat yang berbeda. Hal ini menyebabkan pemisahan partikel berdasarkan ukuran. Setiap kolom eksklusi ukuran memiliki jangkauan berat molekul yang dapat dipisahkan. Batas pengecualian digunakan untuk menentukan molekul berbobot besar yang dapat terjebak dalam fase diam. Jika bobot molekul melewati batas ini maka molekul akan terjebak dalam fase diam. Batas permeasi digunakan untuk menentukan molekul berbobot kecil yang dapat menembus pori:pori dalam fase diam (Skoog 2006).
Gambar 3 Kromatografi gel filtrasi
&)(#*,*#&%"% & * " )#"
"-Elektroforesis gel SDS poliakrilamid adalah suatu teknik yang banyak digunakan dalam biokimia, forensik, genetika dan biologi molekuler untuk memisahkan protein sesuai dengan mobilitas elektroforesis mereka (fungsi dari panjang rantai polipeptida atau bobot molekul). Sampel elektroforesis gel SDS memiliki muatan identik per satuan massa akibat pengikatan sampel dengan SDS dan difraksinasi berdasarkan ukuran (Deyl 1983).
dapat melacak migrasi protein melalui gel selama elektroforesis dijalankan. Pewarna berukuran lebih kecil dibandingkan ukuran protein (Laemmli 1970).
Medan listrik diterapkan di seluruh gel, menyebabkan protein bermuatan negatif bermigrasi di gel menuju anoda. Setiap protein akan bergerak berbeda melalui matriks gel. Protein pendek akan lebih mudah sesuai melalui pori:pori pada gel, sedangkan yang lebih besar akan memiliki lebih banyak kesulitan. Setelah waktu yang telah ditentukan protein akan bermigrasi berdasarkan ukuran; protein yang lebih kecil akan bermigrasi jauh di bawah gel, sedangkan yang lebih besar akan tetap lebih dekat ke titik asal. Oleh karena itu, protein dapat dipisahkan berdasarkan ukuran atau bobot molekul. glikoprotein tertentu berperilaku sebaliknya pada gel SDS.
Pewarna yang digunakan dalam teknik ini terdiri atas dua macam yaitu Coomassie Brilliant Blue atau pewarna perak. Pewarna
Coomassie Brilliant Blue biasanya dapat
mendeteksi pita protein dengan konsentrasi 50 ng protein, Pewarnaan perak meningkatkan sensitivitas pewarnaan biasanya 50 kali. Banyak variabel yang dapat mempengaruhi intensitas warna. Setiap protein memiliki karakteristik pewarnaan sendiri (Hempelmann 1984).
Polymerase chain reaction (PCR)
merupakan teknik yang sering digunakan dalam biologi molekular. Prinsip kerja teknik ini adalah amplifikasi beberapa cetakan DNA menjadi jutaan cetakan DNA. teknik ini menggunakan siklus termal yang terdiri atas beberapa tahapan siklus yaitu tahap denaturasi, tahapan annealing, dan tahapan elongasi (Sambrook dan Russel 2001).
Tahapan denaturasi merupakan tahapan awal dari teknik PCR. Tahapan ini membutuhkan suhu yang tinggi untuk melepaskan ikatan untaian ganda DNA. Tahapan annealing merupakan tahapan yang penting dalam PCR. Primer yang digunakan akan mengenali cetakan DNA dan menempel pada cetakan DNA secara spesifik. Penggunaan suhu yang tidak tepat pada tahapan ini akan menyebabkan penempelan primer yang tidak spesifik dengan cetakan DNA. Tahapan ketiga merupakan tahapan pemanjangan rantai. Tahapan ini dibantu dengan enzim polimerase dari Taq aquaticus
yang berperan sebagai katalis dalam tahapan
ini. Tahapan pemanjangan terbagi atas dua bagian, yaitu pemanjangan primer dan pemanjangan rantai DNA (Sambrook dan Russel 2001).
Komponen:komponen penting yang dibutuhkan dalam teknik PCR adalah dNTP (deoksiribonukleosida trifosfat) yang digunakan sebagai sumber basa nukleotida yang diperlukan untuk sintesis DNA, primer berupa oligonukleotida yang umumnya berukuran 18:30 basa yang berfungsi mengawali proses pembentukan utas DNA, DNA polimerase yang berfungsi mensintesis DNA baru melalui pemanjangan primer yang menempel pada cetakan DNA, kation divalen sebagai kofaktor enzim polimerase, buffer untuk menjaga pH saat terjadi amplifikasi, dan cetakan DNA sebagai sekuen target yang akan diamplifikasi (Sambrook dan Russel 2001).
. - (
Bahan:bahan yang digunakan adalah isolat bakteri asam laktat S34 yang diisolasi dari bekasam daging sapi, media MRS (de Man, Rogosa, Sharpe) (15 g pepton, 5 g ekstrak yeast, 10 g dekstrosa, 5 g jus tomat, 2 g monopotasium fosfat, dan 1 g polisorbat 80 per 1 liter larutan), media Luria Bertani (10 g tripton, 5 g ekstrak ragi, dan 10 g NaCl per 1 liter larutan), akuades steril, natrium azidaHCl 6 N, ampicilin, amonium sulfat, Tris:HCl 50 mM pH 7.4, NaCl 1 M, Tris:HCl 100 mM pH 8.5, buffer TE (10 mM Tris–HCl, 1 Mm EDTA, pH 7.6), gliserol, Sephadex G:50, metanol 100%, akuades dingin, MOPS (asam 4:morfolinopropanafosfat sulfonat), isopropanol, etanol 70%, MgCl2, ATP,
malachite green, polyvinil alkohol, amonium molibdat, natrium sitrat, aquabidest, metanol, sukrosa, TEMED, akrilamid, amonium
persulfat, isopropyl+β+D+
thiogalactopyranoside (IPTG), buffer B,
buffer elusi, buffer dialisis, loading dye, lisozim (60 mg/mL), SDS 10%, NaCl 5M, CTAB 10%, kloroform, isopropanol, RNAse, buffer PCR, dNTP, primer forward
(AGAGTTTGATCCTGGCTNNN), primer
reverse (AAGGAGGTGATCCANNN), dan Taq, bromophenol blue, coomassie brilliant
blue, bovine serum albumin (BSA),
dapat melacak migrasi protein melalui gel selama elektroforesis dijalankan. Pewarna berukuran lebih kecil dibandingkan ukuran protein (Laemmli 1970).
Medan listrik diterapkan di seluruh gel, menyebabkan protein bermuatan negatif bermigrasi di gel menuju anoda. Setiap protein akan bergerak berbeda melalui matriks gel. Protein pendek akan lebih mudah sesuai melalui pori:pori pada gel, sedangkan yang lebih besar akan memiliki lebih banyak kesulitan. Setelah waktu yang telah ditentukan protein akan bermigrasi berdasarkan ukuran; protein yang lebih kecil akan bermigrasi jauh di bawah gel, sedangkan yang lebih besar akan tetap lebih dekat ke titik asal. Oleh karena itu, protein dapat dipisahkan berdasarkan ukuran atau bobot molekul. glikoprotein tertentu berperilaku sebaliknya pada gel SDS.
Pewarna yang digunakan dalam teknik ini terdiri atas dua macam yaitu Coomassie Brilliant Blue atau pewarna perak. Pewarna
Coomassie Brilliant Blue biasanya dapat
mendeteksi pita protein dengan konsentrasi 50 ng protein, Pewarnaan perak meningkatkan sensitivitas pewarnaan biasanya 50 kali. Banyak variabel yang dapat mempengaruhi intensitas warna. Setiap protein memiliki karakteristik pewarnaan sendiri (Hempelmann 1984).
Polymerase chain reaction (PCR)
merupakan teknik yang sering digunakan dalam biologi molekular. Prinsip kerja teknik ini adalah amplifikasi beberapa cetakan DNA menjadi jutaan cetakan DNA. teknik ini menggunakan siklus termal yang terdiri atas beberapa tahapan siklus yaitu tahap denaturasi, tahapan annealing, dan tahapan elongasi (Sambrook dan Russel 2001).
Tahapan denaturasi merupakan tahapan awal dari teknik PCR. Tahapan ini membutuhkan suhu yang tinggi untuk melepaskan ikatan untaian ganda DNA. Tahapan annealing merupakan tahapan yang penting dalam PCR. Primer yang digunakan akan mengenali cetakan DNA dan menempel pada cetakan DNA secara spesifik. Penggunaan suhu yang tidak tepat pada tahapan ini akan menyebabkan penempelan primer yang tidak spesifik dengan cetakan DNA. Tahapan ketiga merupakan tahapan pemanjangan rantai. Tahapan ini dibantu dengan enzim polimerase dari Taq aquaticus
yang berperan sebagai katalis dalam tahapan
ini. Tahapan pemanjangan terbagi atas dua bagian, yaitu pemanjangan primer dan pemanjangan rantai DNA (Sambrook dan Russel 2001).
Komponen:komponen penting yang dibutuhkan dalam teknik PCR adalah dNTP (deoksiribonukleosida trifosfat) yang digunakan sebagai sumber basa nukleotida yang diperlukan untuk sintesis DNA, primer berupa oligonukleotida yang umumnya berukuran 18:30 basa yang berfungsi mengawali proses pembentukan utas DNA, DNA polimerase yang berfungsi mensintesis DNA baru melalui pemanjangan primer yang menempel pada cetakan DNA, kation divalen sebagai kofaktor enzim polimerase, buffer untuk menjaga pH saat terjadi amplifikasi, dan cetakan DNA sebagai sekuen target yang akan diamplifikasi (Sambrook dan Russel 2001).
. - (
Bahan:bahan yang digunakan adalah isolat bakteri asam laktat S34 yang diisolasi dari bekasam daging sapi, media MRS (de Man, Rogosa, Sharpe) (15 g pepton, 5 g ekstrak yeast, 10 g dekstrosa, 5 g jus tomat, 2 g monopotasium fosfat, dan 1 g polisorbat 80 per 1 liter larutan), media Luria Bertani (10 g tripton, 5 g ekstrak ragi, dan 10 g NaCl per 1 liter larutan), akuades steril, natrium azidaHCl 6 N, ampicilin, amonium sulfat, Tris:HCl 50 mM pH 7.4, NaCl 1 M, Tris:HCl 100 mM pH 8.5, buffer TE (10 mM Tris–HCl, 1 Mm EDTA, pH 7.6), gliserol, Sephadex G:50, metanol 100%, akuades dingin, MOPS (asam 4:morfolinopropanafosfat sulfonat), isopropanol, etanol 70%, MgCl2, ATP,
malachite green, polyvinil alkohol, amonium molibdat, natrium sitrat, aquabidest, metanol, sukrosa, TEMED, akrilamid, amonium
persulfat, isopropyl+β+D+
thiogalactopyranoside (IPTG), buffer B,
buffer elusi, buffer dialisis, loading dye, lisozim (60 mg/mL), SDS 10%, NaCl 5M, CTAB 10%, kloroform, isopropanol, RNAse, buffer PCR, dNTP, primer forward
(AGAGTTTGATCCTGGCTNNN), primer
reverse (AAGGAGGTGATCCANNN), dan Taq, bromophenol blue, coomassie brilliant
blue, bovine serum albumin (BSA),
Alat:alat yang digunakan adalah tabung reaksi, labu Erlenmeyer, hot plate stirrer,
sentrifus high speed, sonikator, rotator, penangas air, kromatografi afinitas TALON resin, mikropipet, mikrosentrifus, oven, kolom kromatografi, microplate reader,
microtiter plate, inkubator, pH meter, oven, PCR kit, elektroforesis kit, dan peralatan laboratorium lainnya.
&(*-& & & "("
Metode penelitian ini dilakukan dengan beberapa tahapan. Tahapan awal dari penelitian ini adalah ekspresi dan pemurnian enzim helikase virus hepatitis C. Tahapan berikutnya adalah identifikasi bakteri asam laktat dengan identifikasi 16S rRNA menggunakan PCR, optimasi pertumbuhan bakteri asam laktat isolat S34, kultivasi bakteri asam laktat S34 dengan menggunakan media MRS broth dengan pH 6.5 dan suhu 37 ºC. Tahapan ketiga adalah isolasi dan purifikasi bakteriosin bakteri asam laktat S34 dengan menggunakan metode Serkedjieva et al. (2000) termodifikasi yang terdiri atas beberapa tahapan yaitu pengendapan protein dengan menggunakan amonium sulfat, purifikasi protein bakteri asam laktat S34 dengan menggunakan kromatografi gel filtrasi, dan uji aktivitas RNA helikase virus hepatitis C. Tahapan terakhir dari penelitian ini adalah karakterisasi bakteriosin bakteri asam laktat S34 sebagai inhibitor virus hepatitis C yang terdiri atas beberapa bagian yaitu analisis protein inhibitor dengan elektroforesis gel SDS poliakrilamid dan pengukuran kadar protein (Lampiran 1).
)%'#&%" - $#",") %" .& ") %& "#$% &' ("("% / ( 0
Sebanyak 10 mL prekultur enzim ditumbuhkan ke dalam 400 mL media LB. Sebanyak 400 PL ampicilin dengan konsentrasi 100 mg/mL ditambahkan ke dalam campuran prekultur dan media. Campuran tersebut dikocok dengan kecepatan 200 rpm, suhu 37°C selama 30 menit hingga 1 jam serta OD 600 mencapai ± 0.3 . Kemudian campuran tersebut ditambahkan 0.3 mM IPTG dan dikocok dengan kecepatan 20 g, suhu 37°C serta selama 3 jam hingga OD 600 mencapai ±1.
Kultur enzim yang telah didapatkan dimasukkan ke dalam tabung sentrifus. Kultur tersebut disentrifugasi dengan kecepatan 7000 g pada suhu 4 ºC selama 10 menit. Pelet yang
didapatkan dicuci dengan media LB (Luria Bertani). Kemudian campuran pelet dan media tersebut disentrifugasi pada kecepatan 9000 g, suhu 4 ºC selama 10 menit. Pelet yang dihasilkan dari proses sentrifugasi disimpan pada suhu :20ºC.
Pelet yang dihasilkan pada proses koleksi pelet dikeringbekukan (freeze dry) selama 30 menit. Hasil proses pengeringbekuan tersebut diresuspensi menggunakan buffer B (10 mM Tris:HCl buffer (pH 8.5), 100 mM NaCl, 0.25% Tween 20). Kemudian campuran tersebut dipecah menggunakan proses sonikasi selama 15 detik dengan tiga kali ulangan dan interval 1 menit dalam es. Kemudian hasil sonikasi tersebut disentrifugasi dengan kecepatan 10000 rpm selama 20 menit. Supernatan yang diperoleh digunakan untuk tahap selanjutnya yaitu purifikasi menggunakan kromatografi afinitas resin TALON metal affinity (Novagen).
Resin didapatkan melalui proses ekuilibrasi yang dilakukan sebanyak 3 kali. Proses tersebut diawali dengan pencampuran 150 RL resin BD:Talon dengan 1 mL buffer B dalam tabung Eppendorf. Kemudian campuran tersebut disentrifugasi menggunakan mikrosentrifugasi. Larutan jenih berupa buffer B dari campuran tersebut dibuang. Resin yang telah mengalami ekuilibrasi dicampurkan dengan sampel menggunakan rotator dalam lemari pendingin (4 ºC) selama 3 jam.
Campuran yang telah dihomogenisasi disentrifugasi dengan kecepatan 5000 g selama 7 menit. Supernatan yang dihasilkan disimpan pada suhu 4 ºC untuk dianalisis dengan menggunakan elektroforesis gel SDS: poliakrilamid (SDS PAGE). Pelet yang didapat (Resin binding) diresuspensi dengan 15 mL larutan buffer B dan disentrifugasi dengan kecepatan 5000 g pada suhu 4 ºC. supernatan kemudian dikoleksi sebanyak 100 RL untuk dianalisis SDS PAGE. Kemudian sisa supernatan yang lain disentrifugasi dengan kecepatan 5000 g pada suhu 4ºC selama 5 menit. Tahapan ini dilakukan dua kali sehingga didapatkan 2 larutan supernatan (pencucian 1 dan pencucian 2). Keduanya disimpan dalam suhu 4 ºC dan digunakan untuk analisis SDS PAGE.
yang dihasilkan mengandung enzim dan dipindahkan ke dalam tabung Eppendorf yang baru dan steril dan disimpan pada lemari pendingin dengan suhu 4 ºC (Lampiran 2).
-& (",") %" )(&#" % )( (
Bakteri asam laktat S34 diinokulasikan ke dalam media MRS sebanyak 3 mL. Bakteri tersebut ditumbuhkan dalam media pada suhu 37 ºC selama 24 jam. Sebanyak 1 mL bakteri asam laktat S34 yang telah tumbuh diambil ddan dipindahkan ke dalam tabung Eppendorf. Bakteri tersebut disentrifugasi dengan kecepatan 23000 g dengan menggunakan mikrosentrifus selama 5 menit. Pelet yang diperoleh diresuspensi dengan 500 RL buffer TE (10 mM Tris–HCl, 1 Mm EDTA, pH 7.6). Sebanyak 40 Pl lisozim (60 mg/mL) ditambahkan ke dalam pelet. Campuran tersebut diikubasi dengan suhu 37°C selama 1 jam. Selanjutnya campuran tersebut ditambahkan 200 Pl SDS 10%, 100 Pl NaCl 5 M dan 80 Pl CTAB 10%. Campuran tersebut diinkubasi pada suhu 68 ºC selama 30 menit. Setiap 10 menit campuran tersebut dikocok perlahan. Kemudian campuran tersebut ditambahkan kloroform (1 kali volume).
Campuran tersebut disentrifugasi dengan kecepatan 23000 g selama 10 menit. Supernatan yang didapat dipindahkan ke tabung Eppendorf yang baru. Supernatan tersebut ditambahkan isopropanol sebanyak 0.6x dari volume supernatan. Campuran tersebut kemudian disentrifugasi dengan kecepatan 23000 g selama 5 menit. Kemudian campuran tersebut dicuci dengan 100 RL etanol 70%. Selanjutnya hasil pencucian tersebut dikeringkan dan dilarutkan dengan 30 Pl ddH2O yang mengandung 0.1 mg/mL
RNase. Selanjutnya campuran tersebut diidentifikasi lebih lanjut dengan metode PCR (polymerase chain reaction).
DNA yang telah diisolasi kemudian dijadikan sebagai cetakan DNA pada teknik PCR untuk mengidentifikasi bakteri asam laktat. Pembuatan PCR mix terdiri atas 3 Pl cetakan DNA, 5 Pl buffer 10x, 4 Pl 2.5 mM dNTP, 0.5 Pl primer forward, 0.5 Pl primer
reverse, 36.5 Pl ddH2O, 0.5 Pl Taq. Pre:
denaturasi cetakan DNA berlangsung pada suhu 96 ºC selama 5 menit. Denaturasi cetakan DNA berlangsung pada suhu yang sama selama 1 menit. Proses penempelan primer berlangsung pada suhu 55 ºC selama 1 menit. Proses pemanjangan primer berlangsung pada suhu 72 ºC selama 3 menit.
Proses pemanjangan rantai DNA berlangsung pada suhu 72 ºC selama 7 menit. Siklus amplifikasi yang dibutuhkan sebanyak 35 siklus. Hasil amplifikasi PCR kemudian dianalisis bobot molekulnya dengan menggunakan elektroforesis gel agarosa serta disekuening dengan ABI PRISM Sequencer.
'(" %" &#($ 1$. )(&#" % )( (
Bakteri asam laktat S34 ditumbuhkan dalam media MRS broth sebanyak 200 mL. Bakteri tersebut ditumbuhkan dengan suhu 37 ºC selama 24 jam. Sebanyak 1 mL bakteri yang telah dikulturkan dipindahkan ke tabung Eppendorf baru setiap satu jam. Kultur bakteri tersebut dibaca absorbannya pada serapan panjang gelombang 600 nm.
$ ("2 %" )(&#" % )( (
Bakteri asam laktat S34 dikultur dalam media MRS broth. Isolat bakteri asam laktat S34 tersebut ditumbuhkan dalam media pada suhu 37ºC selama 24 jam dengan pH 6.8.
$#",") %" )(&#" % )( ( / &#)&-3"&2 (&# *-",") %"04
Purifikasi bakteriosin dari bakteri asam laktat S34 dilakukan berdasarkan modifikasi metode bakteri asam laktat S34 yang telah tumbuh disentrifugasi dengan kecepatan 14000 g selama 30 menit dengan suhu 4 ºC. Supernatan yang dihasilkan dipanaskan dengan suhu 90°C selama 15 menit dan diendapkan dengan menggunakan amonium sulfat hingga kejenuhan 80% selama 2 jam dengan suhu 4 ºC. Hasil pengendapan disentrifugasi dengan kecepatan 14000 g selama 30 menit dengan suhu 4 ºC. Pelet yang diresuspensi menggunakan Tris HCl 10 mM pH 7,4. Kemudian ekstrak kasar tersebut diuji aktivitas inhibisinya menggunakan uji kolorimetri ATPase.
kromatografi kemudian diuji aktivitas inhibisinya dengan metode kolorimetri ATPase assay. Beberapa fraksi yang memiliki aktivitas inhibisi yang tinggi digunakan untuk tahapan selanjutnya (Lampiran 3).
& +$3" ."1"%" & ") %& "#$% &' ("("% / ( 0
Pengujian ini dapat mengukur jumlah fosfat yang dilepaskan dari hidrolisis senyawa ATP menjadi ADP. Metode ini diawali dengan pembuatan campuran utama yang terdiri dari 38.5 RL akuades steril, 5.0 PL 0.1 mM MOPS, 0.5 RL 0.1 M MgCl2, dan 1 RL
0.1 M ATP. Pengujian kolorimetri ATPase
assay dibagi atas tiga bagian, yaitu a. campuran reaksi sebanyak 50 PL sebanyak 3 kali ulangan; b. campuran reaksi dan enzim sebanyak 50 PL dengan 3 kali ulangan; dan c. campuran reaksi, enzim, dan sampel sebanyak 50 PL dengan 3 kali ulangan. Kemudian proses inkubasi dilakukan selama 45 menit pada suhu ruang. Saat 15 menit sebelum waktu inkubasi habis, pewarna dibuat. Pewarna terdiri dari akuades, 0.081%
malachite green, 2.3% polyvinil alkohol, dan 5.7% amonium molibdat dalam HCl 6 N dengan perbandingan 2:2:1:1. Sebanyak 100 PL pewarna dimasukkan ke dalam sumur (well). Larutan tersebut diinkubasi lagi selama 5 menit. Setelah waktu inkubasi habis, sebanyak 25 RL natrium sitrat ditambahkan ke dalam microtitter plate untuk menghentikan reaksi warna. Larutan tersebut diukur absorbansinya pada panjang gelombang 620 nm dan panjang gelombang 405 nm sebagai referensi. Satu unit aktivitas RNA helikase virus hepatitis C adalah jumlah mol fosfat bebas (Pi) yang terhidrolisis dari ATP per menit per mg protein.
# )(&#"% %" )(&#"*%" )(&#" % )( (
Tahapan karakterisasi Bakteriosin bakteri asam laktat S34 diawali dengan analisis bobot molekul bakteriosin menggunakan elektroforesis gel SDS poliakrilamid (SDS PAGE). Fraksi yang memiliki aktivitas inhibisi RNA helikase virus hepatitis C yang besar dianalisis bobot molekulnya menggunakan elektroforesis gel SDS poliakrilamid 20%. Gel poliakrilamid 20% dibuat dengan mencampurkan sukrosa, poliakrilamid, akuades, TEMED, dan amonium persulfat. Gel dibiarkan memadat. Sampel yang berupa fraksi hasil kromatografi
kolom dicampurkan dengan loading dye dan didenaturasi pada suhu 95ºC selama 10 menit. Perangkat gel elektroforesis dipasang dengan gel poliakrilamid yang telah memadat. Buffer running SDS PAGE dimasukkan kedalam perangkat SDS PAGE. Sampel dimasukkan sebanyak 20 RL ke dalam sumur agar elektroforesis dan marker sebagai pembanding. Setelah selesai elektroforesis SDS poliakrilamid, gel diwarnai dengan pewarnaan perak (silver stainning) hingga muncul pita:pita.
Setelah bakteriosin dianalisis dengan menggunakan SDS PAGE, Kadar protein diukur dengan BCA Protein Assay kit. Sebanyak 0.1 mL sampel ditambahkan 2 mL
working reagent. Kemudian campuran
tersebut diinkubasi pada suhu 37 ºC selama 30 menit. Absorbansi diukur pada panjang gelombang 562 nm.
%" )%'#&%" - $#",") %" & ") %& "#$% &' ("("% 4
Ekspresi RNA helikase virus hepatitis C dilakukan dengan bertujuan mendapatkan RNA helikase virus hepatitis C yang dihasilkan oleh bakteri Escherichia coli
BL21(DE3)pLysS sebagai inang dari hasil kloning gen NS3 HCV (Utama 2000).
Penambahan Isopropyl+β+D+
thiogalactopyranoside (IPTG) bertujuan
menginduksi ekspresi enzim pada fase logaritmik hingga fase stasioner ( Utama et al.
2000). Setelah penginduksian ekspresi enzim dilakukan pengumpulan pelet. Pengumpulan pelet tersebut berguna untuk mempertahankan stabilitas bakteri Escherichia coli yang telah diinduksi selama penyimpanan dan mengekspresikan RNA helikase untuk pengujian selanjutnya.
Pemurnian RNA helikase virus hepatitis C bertujuan mendapatkan RNA helikase virus hepatitis C yang murni dari hasil ekspresi gen NS3 helikase hepatitis C yang telah diklonkan
dalam bakteri Escherichia coli
BL21(DE3)pLysS sehingga dapat digunakan dalam penentuan aktivitas inhibisi dari bakteriosin. Proses purifikasi RNA helikase hepatitis C diawali dengan proses pemecahan sel yang terdiri atas dua metode yaitu pengering bekuan dan sonikasi. Proses pengeringbekuan dalam pemurnian RNA helikase hepatitis C dilakukan dengan bertujuan untuk memecahkan sel bakteri
kromatografi kemudian diuji aktivitas inhibisinya dengan metode kolorimetri ATPase assay. Beberapa fraksi yang memiliki aktivitas inhibisi yang tinggi digunakan untuk tahapan selanjutnya (Lampiran 3).
& +$3" ."1"%" & ") %& "#$% &' ("("% / ( 0
Pengujian ini dapat mengukur jumlah fosfat yang dilepaskan dari hidrolisis senyawa ATP menjadi ADP. Metode ini diawali dengan pembuatan campuran utama yang terdiri dari 38.5 RL akuades steril, 5.0 PL 0.1 mM MOPS, 0.5 RL 0.1 M MgCl2, dan 1 RL
0.1 M ATP. Pengujian kolorimetri ATPase
assay dibagi atas tiga bagian, yaitu a. campuran reaksi sebanyak 50 PL sebanyak 3 kali ulangan; b. campuran reaksi dan enzim sebanyak 50 PL dengan 3 kali ulangan; dan c. campuran reaksi, enzim, dan sampel sebanyak 50 PL dengan 3 kali ulangan. Kemudian proses inkubasi dilakukan selama 45 menit pada suhu ruang. Saat 15 menit sebelum waktu inkubasi habis, pewarna dibuat. Pewarna terdiri dari akuades, 0.081%
malachite green, 2.3% polyvinil alkohol, dan 5.7% amonium molibdat dalam HCl 6 N dengan perbandingan 2:2:1:1. Sebanyak 100 PL pewarna dimasukkan ke dalam sumur (well). Larutan tersebut diinkubasi lagi selama 5 menit. Setelah waktu inkubasi habis, sebanyak 25 RL natrium sitrat ditambahkan ke dalam microtitter plate untuk menghentikan reaksi warna. Larutan tersebut diukur absorbansinya pada panjang gelombang 620 nm dan panjang gelombang 405 nm sebagai referensi. Satu unit aktivitas RNA helikase virus hepatitis C adalah jumlah mol fosfat bebas (Pi) yang terhidrolisis dari ATP per menit per mg protein.
# )(&#"% %" )(&#"*%" )(&#" % )( (
Tahapan karakterisasi Bakteriosin bakteri asam laktat S34 diawali dengan analisis bobot molekul bakteriosin menggunakan elektroforesis gel SDS poliakrilamid (SDS PAGE). Fraksi yang memiliki aktivitas inhibisi RNA helikase virus hepatitis C yang besar dianalisis bobot molekulnya menggunakan elektroforesis gel SDS poliakrilamid 20%. Gel poliakrilamid 20% dibuat dengan mencampurkan sukrosa, poliakrilamid, akuades, TEMED, dan amonium persulfat. Gel dibiarkan memadat. Sampel yang berupa fraksi hasil kromatografi
kolom dicampurkan dengan loading dye dan didenaturasi pada suhu 95ºC selama 10 menit. Perangkat gel elektroforesis dipasang dengan gel poliakrilamid yang telah memadat. Buffer running SDS PAGE dimasukkan kedalam perangkat SDS PAGE. Sampel dimasukkan sebanyak 20 RL ke dalam sumur agar elektroforesis dan marker sebagai pembanding. Setelah selesai elektroforesis SDS poliakrilamid, gel diwarnai dengan pewarnaan perak (silver stainning) hingga muncul pita:pita.
Setelah bakteriosin dianalisis dengan menggunakan SDS PAGE, Kadar protein diukur dengan BCA Protein Assay kit. Sebanyak 0.1 mL sampel ditambahkan 2 mL
working reagent. Kemudian campuran
tersebut diinkubasi pada suhu 37 ºC selama 30 menit. Absorbansi diukur pada panjang gelombang 562 nm.
%" )%'#&%" - $#",") %" & ") %& "#$% &' ("("% 4
Ekspresi RNA helikase virus hepatitis C dilakukan dengan bertujuan mendapatkan RNA helikase virus hepatitis C yang dihasilkan oleh bakteri Escherichia coli
BL21(DE3)pLysS sebagai inang dari hasil kloning gen NS3 HCV (Utama 2000).
Penambahan Isopropyl+β+D+
thiogalactopyranoside (IPTG) bertujuan
menginduksi ekspresi enzim pada fase logaritmik hingga fase stasioner ( Utama et al.
2000). Setelah penginduksian ekspresi enzim dilakukan pengumpulan pelet. Pengumpulan pelet tersebut berguna untuk mempertahankan stabilitas bakteri Escherichia coli yang telah diinduksi selama penyimpanan dan mengekspresikan RNA helikase untuk pengujian selanjutnya.
Pemurnian RNA helikase virus hepatitis C bertujuan mendapatkan RNA helikase virus hepatitis C yang murni dari hasil ekspresi gen NS3 helikase hepatitis C yang telah diklonkan
dalam bakteri Escherichia coli
BL21(DE3)pLysS sehingga dapat digunakan dalam penentuan aktivitas inhibisi dari bakteriosin. Proses purifikasi RNA helikase hepatitis C diawali dengan proses pemecahan sel yang terdiri atas dua metode yaitu pengering bekuan dan sonikasi. Proses pengeringbekuan dalam pemurnian RNA helikase hepatitis C dilakukan dengan bertujuan untuk memecahkan sel bakteri
RNA helikase HCV bersifat intraseluler. Sonikasi merupakan tahapan selanjutnya dari proses pemecahan sel. Proses sentrifugasi yang dilakukan pada tahapan setelah pemecahan sel bertujuan memisahkan antara supernatan dan sel debris hasil pemecahan sel. Supernatan yang mengandung beberapa komponen intraseluler dikoleksi sebagian untuk proses identifikasi dengan menggunakan SDS PAGE sehingga dapat dilihat hasil proses pemurnian RNA helikase hepatitis C. Supernatan tersebut dimurnikan lebih lanjut dengan resin TALON metal affinity yang secara spesifik dapat menangkap enzim yang memiliki His+tag. RNA helikase yang telah terekspresi dalam bakteri
Escherichia coli BL21(DE3)pLysS ini
memiliki label 6 x His+tag yang sehingga dapat terikat secara spesifik oleh resin TALON metal affinity. Proses pengikatan resin terhadap RNA helikase hepatitis C menggunakan proses rotasi dan sentrifugasi sehingga pengikatan resin dengan enzim tersebut dapat diperoleh secara maksimal. Penambahan buffer B (10 mM Tris:HCl buffer (pH 8.5), 100 mM NaCl, 0.25% Tween 20) dilakukan untuk memisahkan enzim RNA helikase dengan komponen intraseluler lainnya. Sebagian kecil hasil pemisahan tersebut disimpan untuk identifikasi dengan SDS PAGE.
Pemurnian dengan TALON metal affinity dilakukan sebanyak 3 kali untuk mendapatkan RNA helikase hepatitis C dengan tingkat kemurnian yang tinggi. Penambahan buffer elusi (imidazola dalam buffer B) berfungsi sebagai eluen dalam proses elusi RNA helikase hepatitis C yang berikatan dengan resin. Imidazola yang merupakan komponen penyusun buffer tersebut dapat memutuskan ikatan antara RNA helikase hepatitis C dengan resin TALON metal affinity sehingga diperoleh enzim yang murni dapat diperoleh.
Hasil pemisahan antara debris sel dan komponen intraseluler (inner volume), hasil pemisahan antara elusi dan resin (washing 1 dan washing 2), dan RNA helikase hepatitis C hasil purifikasi (E1 dan E2) yang telah dikoleksi sebagian diidentifikasi dengan SDS PAGE. Hasil SDS PAGE menunjukkan pita tunggal pada elusi 1 dan elusi 2 yang membuktikan bahwa pemurnian RNA helikase virus hepatitis C dilakukan dengan baik. Bobot molekular dari RNA helikase virus hepatitis C adalah 54 kDa (Gambar 4). Hasil penelitian Utama et al. (2000) melaporkan bahwa bobot molekul RNA
helikase virus hepatitis C memiliki bobot molekul 54 kDa (Utama et al. 2000).
Gambar 4 Hasil SDS PAGE RNA helikase virus hepatitis C.
%" -& (",") %" )(&#" % )( (
Identifikasi bakteri asam laktat S34 dilakukan dengan metode identifikasi 16S rRNA. Metode identifikasi filogenetik 16S
rRNA banyak digunakan untuk
mengidentifikasi mikroorganisme yang berada di tanah, jalur pencernaan, dan sampel klinis (Klijn et al. 1991). Bakteri asam laktat merupakan mikroorganisme yang umumnya diisolasi dari olahan fermentasi (Gambar 5).
Identifikasi 16S rRNA terdiri atas isolasi DNA, amplifikasi DNA menggunakan teknik PCR, analisis bobot molekul, dan sekuening. Isolasi total genome dengan menggunakan metode Sambrook dan Russel (2001). Hasil isolasi DNA tersebut dianalisis bobot molekulnya dengan menggunakan metode elektroforesis agarosa. Modifikasi dilakukan dengan menggunakan lisozim yang berfungsi sebagai pendegradasi dinding sel bakteri Gram positif yang kaya akan polisakarida. Hasil analisis bobot molekul DNA bakteri hasil isolasi dan amplifikasi PCR menunjukkan bahwa DNA bakteri asam laktat S34 memiliki bobot molekul 1.5 kb (Gambar 6).
Hasil sekuening 16S rRNA bakteri asam laktat menghasilkan sekuen DNA bakteri asam laktat (Gambar 7). Hasil analisis sekuen DNA bakteri asam laktat S34 dengan menggunakan program BLAST menunjukkan bahwa bakteri asam laktat S34 memiliki kesamaan 99% dengan sekuen DNA bakteri
Lactobacillus plantarum WCFS1 (Lampiran
Gambar 5 Koloni bakteri asam laktat S34.
Gambar 6 Hasil elektroforesis DNA bakteri asam laktat S34.
Gambar 7 Hasil sekuening DNA bakteri asam laktat S34 dengan primer.
$#2 &#($ 1$. %* ( )(&#" % )( (
Bakteriosin merupakan metabolit sekunder yang dihasilkan bakteri asam laktat pada masa pertumbuhan bakteri asam laktat. Peningkatan jumlah biomassa bakteri asam laktat menyebabkan peningkatan bakteriosin yang dihasilkan kemudian menurun pada fase stasioner (Usmiati dan Marwati 2007). Peningkatan jumlah bakteri asam laktat pada waktu tertentu menyebabkan perubahan jumlah nutrisi yang tersedia untuk metabolisme bakteri asam laktat sehingga metabolisme bakteriosin bakteri asam laktat terganggu.
Hasil perhitungan kurva OD bakteri asam laktat yang dilakukan selama 28 jam menunjukkan isolat bakteri asam laktat S34 fase logaritma terjadi setelah tujuh jam inkubasi (Gambar 8). Hasil penelitian Usmiati dan Marwati (2007) melaporkan bahwa fase logaritma bakteri asam laktat Lactobacillus sp
terjadi pada jam ke 7. Fase stasioner tercapai pada jam ke:10 sampai jam ke:24 setelah inkubasi (Lampiran 5).
Gambar 8 Kurva pertumbuhan bakteri asam laktat S34.
%" $#",") %" - & +$)$# )("2"( % ."1"%" )(&#"*%" )(&#" % )( (
(&#. - ' & ") %&
Bakteriosin merupakan peptida intraseluler. Teknik sentrifugasi yang dilakukan pada tahapan awal purifikasi bakteriosin bertujuan memisahkan antara debris sel dan komponen intraseluler (supernatan). Supernatan yang dihasilkan masih mengandung banyak komponen intraseluler sehingga diperlukan purifikasi lanjutan.
Bakteriosin dipisahkan dari komponen intraseluler lainnya dengan menggunakan teknik presipitasi amonium sulfat. Teknik
10 Kb
5 Kb
2 Kb
1 Kb
1.5 Kb
presipitasi amonium sulfat berdasarkan prinsip salting out. Penambahan amonium sulfat sebagai garam dalam tingkat kejenuhan tertentu dapat mengendapkan protein tertentu. Beberapa bakteriosin dapat diendapkan dengan amonium sulfat pada tingkat kejenuhan yang rendah (Sambrook et al.
1989). Namun ada pula bakteriosin yang dapat diendapkan dengan amonium sulfat pada tingkat kejenuhan yang tinggi. Sehingga diperlukan presipitasi amonium sulfat dengan beberapa rentang tingkat kejenuhan yaitu presipitasi amonium sulfat 60%, 70%, 80%, dan 90% (Lampiran 8). Peptida yang terendapkan melalui proses salting out
tersebut dipresipitasi dengan menggunakan teknik sentrifugasi. Hasil presipitasi amonium sulfat dengan kejenuhan 80% diuji aktivitas inhibisinya menggunakan uji kolorimetri ATPase.
Kolorimetri ATPase assay adalah uji yang digunakan untuk beberapa enzim yang bergantung dengan keberadaan ATP/NTP sebagai donor energi untuk aktivitas enzim tersebut (Utama et al. 2000). Kolorimetri ATPase assay merupakan uji kualitatif dan kuantitatif.
Uji ini dapat dijadikan metode untuk mengukur inhibisi RNA helikase virus hepatitis C karena RNA helikase hepatitis C membutuhkan substrat berupa ATP (adenosine trifosfat) untuk membuka untaian ganda pada RNA yang merupakan material genetik dari virus hepatitis C. Larutan campuran utama berguna sebagai blanko dalam pengujian kolorimetri ATPase assay.
Keberadaan MOPS (Asam 4:
morfolinopropanafosfat sulfonat) adalah sebagai buffer dalam campuran utama. Keberadaan Mg2+ dan Mn2+ diperlukan sebagai kofaktor RNA helikase sehingga MgCl2 berfungsi sebagai donor kofaktor
dalam campuran utama (Utama et al. 2000). Reaksi RNA helikase dengan ATP akan menghasilkan ADP (Adenosin difosfat) dan fosfat bebas. Fosfat bebas akan membentuk kompleks warna dengan pereaksi warna dari kolorimetri ATPase assay yang memiliki komposisi pewarna hijau malachite, polyvinil alkohol, dan amonium molibdat. Warna yang dihasilkan berkorelasi dengan jumlah fosfat bebas yang dihasilkan dari reaksi RNA helikase dengan ATP. Semakin hijau warna campuran reaksi maka semakin besar aktivitas RNA helikase bekerja (Gambar 9). Bakteriosin yang berfungsi sebagai inhibitor akan menghambat reaksi tersebut.
Kolorimetri ATPase assay juga dapat mengukur konsentrasi dengan menghitung serapan panjang gelombang dari campuran reaksi dengan RNA helikase dan bakteriosin. Panjang gelombang yang digunakan ada dua macam yaitu 620 nm dan 450 nm. Kedua panjang gelombang digunakan agar perhitungan reaksi RNA helikase dengan substratnya akurat. Konsentrasi ATP yang berubah karena adanya inhibitor dapat dihitung dengan membandingkan serapan panjang gelombang RNA Helikase.
Gambar 9 Reaksi pembentukan warna pada kolorimetri ATPase assay.
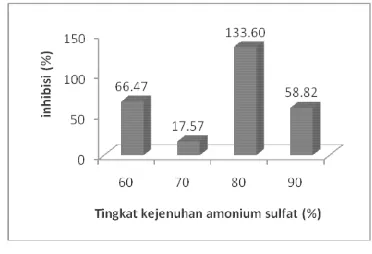
Berdasarkan hasil yang diperoleh melalui kolorimetri ATPase assay menunjukkan bahwa presipitasi amonium sulfat dengan kejenuhan 80% memiliki nilai inhibisi terhadap RNA helikase virus hepatitis C yang tertinggi yaitu 133.60% sedangkan presipitasi amonium sulfat dengan kejenuhan 60%, 70%, dan 90% memiliki nilai inhibisi 66.47 %, 17.57%, dan 58.82% terhadap RNA helikase virus hepatitis C (Gambar 10). Hal tersebut terjadi karena beberapa protein dapat diendapkan dengan konsentrasi tertentu sehingga banyaknya bakteriosin yang terendapkan tidak ekuivalen terhadap aktivitas inhibisi protein terhadap RNA helikase virus hepatitis C.
Pemurnian bakteriosin selanjutnya yaitu dengan menggunakan kromatografi gel filtrasi yang menggunakan Sephadex G:50. Matriks Sephadex G:50 dapat memisahkan protein dari ukuran 1.5 kDa:30 kDa. Peptida yang berukuran kecil akan terjerap pada pori matriks Sephadex G:50 sedangkan protein yang berukuran besar akan terelusi terlebih dahulu. Eluen yang digunakan merupakan pelarut polar. Beberapa bakteriosin memiliki kemampuan untuk larut dalam beberapa pelarut seperti akuades, buffer fosfat, metanol dan Tris:HCl (Gautam dan Sharma 2009). Pelarut akuades tidak dapat melarutkan bakteriosin yang dihasilkan bakteri asam laktat S34. Pelarut natrium fosfat buffer tidak dapat digunakan karena mempengaruhi uji ATPase assay yang secara prinsip mengukur jumlah fosfat yang bebas sehingga penggunaan pelarut sodium fosfat buffer dapat menyebabkan kesalahan positif terhadap uji ATPase assay. Metanol dapat mengikat bakteriosin namun dapat pula menghilangkan aktivitasnya sehingga eluen yang digunakan adalah metanol 30%. Metanol dalam konsentrasi rendah tersebut dapat mengelusi bakteriosin serta aktivitas inhibisi bakteriosin terhadap RNA helikase virus hepatitis C tidak menurun.
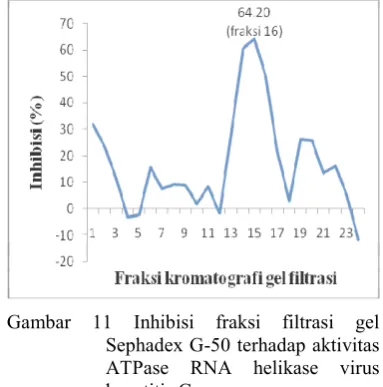
Sebanyak 25 fraksi didapatkan dari proses kromatografi gel filtrasi. Fraksi ke:16 memiliki persentase inhibisi yang lebih besar dari keseluruhan fraksi hasil gel filtrasi. Hasil uji kolorimetri ATPase menghasilkan fraksi ke:14 hingga fraksi ke:16 memiliki aktivitas inhibisi diatas 50% ketika diuji dengan menggunakan metode uji kolorimetri ATPase (Lampiran 9). Persentase inhibisi fraksi ke:14, fraksi ke:15, dan fraksi ke:16 adalah 58.89%, 60.61%, dan 64.20% (Gambar 11). Aktivitas inhibisi yang berada pada fraksi pertengahan mengimplikasikan bobot molekul protein yang memiliki aktivitas yang tinggi terhadap RNA helikase virus hepatitis C adalah protein yang berbobot molekul kecil sesuai dengan literatur yang menyebutkan bahwa semakin kecil molekul protein maka semakin lama terelusi dengan eluen (Scopes 1989).
Beberapa komposisi telah diujikan terhadap proses purifikasi bakteriosin dari bakteri asam laktat S34. Komposisi eluen yang dapat memisahkan bakteriosin bakteri asam laktat S34 yang dapat menginhibisi RNA helikase virus hepatitis C adalah komposisi eluen Metanol 30%. Konsentrasi metanol yang terlalu rendah menyebabkan banyak proein yang tidak terelusi sehingga masih berada pada matriks Sephadex G:50.
Konsentrasi metanol yang terlalu tinggi pada eluen dapat mengelusi protein dengan baik tetapi juga dapat menghilangkan aktivitas inhibisi bakteriosin secara cepat karena terjadi denaturasi (Gautam dan Sharma 2009)
Gambar 11 Inhibisi fraksi filtrasi gel Sephadex G:50 terhadap aktivitas ATPase RNA helikase virus hepatitis C.
Secara umum ringkasan purifikasi bakteriosin bakteri asam laktat S34 menunjukkan bakteriosin bakteri asam laktat S34 memiliki konsentrasi yang besar ekstrak kasar (Tabel 1). Aktivitas spesifik bakteriosin hasil presipitasi amonium sulfat dan kromatografi gel filtrasi sebesar
5.01 x 10
6 U/mg dan2.84 x 10
6 U/mg. Kemurnian bakteriosin yang didapat melalui tahapan presipitasi amonium sulfat 80% adalah 100% sedangkan kemurnian bakteriosin yang didapatkan dari hasil kromatografi gel filtrasi dengan eluen metanol 30% sebesar56.7%
(Tabel 1).Perhitungan konsentrasi protein menggunakan BCA kit assay. Metode ini mengkombinasikan reduksi Cu2+menjadi Cu+ oleh protein pada media alkalin (reaksi biuret). Kation cupro yang terbentuk akan bereaksi dengan asam bicinchoninat membentuk warna ungu yang dapat dideteksi pada panjang gelombang 562 nm.
Perhitungan konsentrasi protein menggunakan kurva standar Bovine Serum
Albumin (BSA) yang telah diukur sebelum
Tabel 1 Ringkasan purifikasi bakteriosin
Tahapan Volume
(mL) Kadar Protein (mg/mL) Total protein (mg) Total Aktivitas (U) Aktivitas Spesifik (U/mg) Kemurnian (%) Ekstrak
kasar 191 1.057 178.522 : : :
Amonium
Sulfat 80% 3 1.050 3.150 15.78 x 10
6
5.01 x 106 100
Sephadex
G:50 1 0.884 0.884 2.51 x 10
6
2.84 x 106 56.7
# )(&#"%(") )(&#"*%" )(&#" % )( (
*1*( * &)$ )(&#"*%" )(&#" % )( (
Analisis bobot molekul bakteriosin bakteri asam laktat S34 dilakukan dengan menggunakan metode elektroforesis gel poliakrilamida sodium dodesil sulfat (SDS PAGE). Teknik ini menganalisis bobot molekul bakteriosin lebih akurat daripada analisis bobot molekul menggunakan teknik kromatografi gel filtrasi sebab teknik ini menggunakan marker yang telah diketahui bobot molekulnya.
Denaturasi sampel diperlukan untuk SDS PAGE. Denaturasi sampel dengan suhu berfungsi untuk membuka struktur tersier dan kuartener dari peptida atau protein sampel. Peptida yang bersifat amfoter (memiliki dua muatan listrik) menjadi bermuatan negatif dengan adanya sodium dodesil sulfat sehingga saat elektroforesis bekerja peptida akan bergerak melalui arus dari muatan negatif (anoda) menuju muatan positif (katoda) berdasarkan dengan bobot molekul (Deyl 1983). Beberapa komponen penting selain SDS membantu proses pemisahan protein berdasarkan bobot molekulnya. Komponen tersebut adalah Tris berguna sebagai buffer dalam SDS PAGE, akrilamida sebagai komponen pembentuk gel, amonium persulfat
dan TEMED (N, N, N', N':
tetrametiletilenediamin) yang berperan dalam proses polimerisasi akrilamida menjadi poliakrilamid dalam pembentukan gel.
Hasil SDS PAGE dapat diberi warna dengan pewarna biru Coomasie atau pewarna perak. Pewarna perak lebih akurat menunjukkan pita:pita sampel karena memiliki sensitivitas yang lebih tinggi dibanding pewarna biru Coomasie. Hasil analisis bobot molekul bakteriosin bakteri asam laktat S34 menunjukkan pemisahan belum maksimal sebab masih banyak peptida yang muncul dengan berbagai ukuran.
Hasil elektroforesis gel sodium dodesil sulfat poliakrilamid fraksi ke:16 menunjukkan pita:pita yang sudah lebih sedikit dibandingkan dengan hasil elektroforesis gel sodium dodesil sulfat poliakrilamid fraksi amonium sulfat 80%. Terdapat 6 pita bakteriosin pada fraksi gel filtrasi ke:16 yang memiliki aktivitas yang tinggi dalam menginhibisi RNA helikase virus hepatitis C. Bakteriosin yang dapat menginhibisi virus hepatitis C berada pada kisaran 1.7:4.6 kDa (Gambar 12).
Bakteriosin tersebut termasuk kelas tipe 2. Ciri:ciri dari bakteriosin adalah berbobot molekul kecil dan stabil terhadap panas. Peptida yang stabil terhadap panas dapat dimanfaatkan pada industri makanan fermentasi karena peptida tersebut tidak akan rusak meski mengalami pemanasan sehingga makanan fermentasi olahan tidak perlu menggunakan pengawet karena memiliki kemampuan antibakteri dan antivirus.
%
Gambar 12 Hasil SDS PAGE: (1) fraksi pengendapan amonium sulfat 80%; (2) fraksi ke:10 kromatografi gel filtrasi dengan eluen MeOH 20%; (3) marker; (4) fraksi ke:16 kromatografi gel filtrasi dengan eluen MeOH 30%.
" '$
Bakteri asam laktat S34 penghasil bakteriosin merupakan bakteri Lactobacillus
plantarum WCFS1 yang memiliki fase
eksponensial pada jam ke:7 dan fase stasioner pada jam ke:10. Bakteriosin bakteri asam laktat S34 hasil pemurnian dengan menggunakan kromatografi kolom memiliki persentase inhibisi terhadap RNA helikase 64.20%. Kemurnian dari hasil purifikasi bakteriosin bakteri asam laktat S34 sebesar 56.7% dengan aktivitas spesifik
2.84 x 10
6U/mg serta memiliki bobot molekul diantara
1.7 – 4.6 kDa. Bakteriosin yang berperan sebagai inhibitor RNA helikase ini termasuk bakteriosin tipe 2 yang bersifat termostabil.#
Perlu dilakukan pemurnian lanjutan untuk memperoleh protein yang lebih murni dan memiliki persentase inhibisi yang lebih tinggi. Selain itu perlu dilakukan optimasi suhu dan pH untuk menentukan kondisi optimum dari aktivitas bakteriosin sebagai inhibitor RNA helikase.
Baginski SG et al. 2000. Mechanism of action of Pest virus antiviral compound.
PNAS 97:14.
Borowski P et al. 2008. Viral NS3 helicase activity is inhibited by peptides reproducing the Arg:rich conserved motif of the enzyme (motif VI). Biochemical
Pharmacology 76:28:38.
Buckle KA et al. 1987. Ilmu Pangan. Cetakan ke+2. Jakarta: Universitas Indonesia.
Deyl Z. 1983. Electrophoresis: A survey of techniques and applications. New York: Elsevier.
Dumont S et al. 2006. RNA translocation and unwinding mechanism of HCV NS3 helicase and its coordination by ATP.
Nature 439:105:108.
Caplice E, Fitzgerald GF. 1999. Food fermentation: role of microorganisms in food production and preservation. Int. J.
Food Microbiol 50:131:149.
Claesson MJ et al. 2006. Multireplicon genome architecture of Lactobacillus
salivarius. PNAS 103:6718:6723.
Cormier EG et al. 2004. CD81 is an entry coreceptor for hepatitis C virus. Proc.
Natl. Acad. Sci. USA 101:7270:7274.
Evans MJ et al. 2007. Claudin:1 is a hepatitis C virus co:receptor required for a late step in entry. Nature 446:801.
Fan L et al. 2008. XPD helicase structures and activities: insight into the cancer and aging phenotypes from XPD mutations. Cell
133:789:800.
Gautam N dan Sharma N. 2009. Purification and characterization of bacteriocin produced by strain of Lactobacillus brevis
MTCC 7539. Indian Journal Biochemistry & Biophysic 46: 337:341.
Gozdek A et al. 2007. NS3 peptide, a novel potent hepatitis C virus NS3 Helicase Inhibitor: its mechanism of action and antiviral activity in the replicon system.
Antimicrobial Agents and Chemotheraphy
52:393:401.
Hempelmann E, Schulze M, Götze O. 1984. Free SH:groups are important for the polychromatic staining of proteins with silver nitrat. Neuhof V (ed) Electrophoresis '84 Verlag Chemie Weinheim 1984:328– 330.
Jay, J.M. 2000. Modern Food Microbiology, 6th edition. Gaithersburg :Aspen.
Kim et al. 1988. Hepatitis C virus NS3 RNA helicase domain with a bound oligonucleotide: the crystal structure provides insights into the mode of unwinding. Structure 6:89:100.
Klijn N, Weerkamp AH, De Vos WM. 1991. Identification of mesophilic lactic acid bacteria by using polymerase chain reaction:amplified variable regions of 16S rRNA and specific DNA probes.Applied
and Environtmental Microbiology 57:
3390:3393.
Kuipers OP, Buist G, Kok J. 2000. Current strategies for improving food bacteria.
Res.Microbiol 151:815:822.
Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 5:680–685.
" '$
Bakteri asam laktat S34 penghasil bakteriosin merupakan bakteri Lactobacillus
plantarum WCFS1 yang memiliki fase
eksponensial pada jam ke:7 dan fase stasioner pada jam ke:10. Bakteriosin bakteri asam laktat S34 hasil pemurnian dengan menggunakan kromatografi kolom memiliki persentase inhibisi terhadap RNA helikase 64.20%. Kemurnian dari hasil purifikasi bakteriosin bakteri asam laktat S34 sebesar 56.7% dengan aktivitas spesifik
2.84 x 10
6U/mg serta memiliki bobot molekul diantara
1.7 – 4.6 kDa. Bakteriosin yang berperan sebagai inhibitor RNA helikase ini termasuk bakteriosin tipe 2 yang bersifat termostabil.#
Perlu dilakukan pemurnian lanjutan untuk memperoleh protein yang lebih murni dan memiliki persentase inhibisi yang lebih tinggi. Selain itu perlu dilakukan optimasi suhu dan pH untuk menentukan kondisi optimum dari aktivitas bakteriosin sebagai inhibitor RNA helikase.
Baginski SG et al. 2000. Mechanism of action of Pest virus antiviral compound.
PNAS 97:14.
Borowski P et al. 2008. Viral NS3 helicase activity is inhibited by peptides reproducing the Arg:rich conserved motif of the enzyme (motif VI). Biochemical
Pharmacology 76:28:38.
Buckle KA et al. 1987. Ilmu Pangan. Cetakan ke+2. Jakarta: Universitas Indonesia.
Deyl Z. 1983. Electrophoresis: A survey of techniques and applications. New York: Elsevier.
Dumont S et al. 2006. RNA translocation and unwinding mechanism of HCV NS3 helicase and its coordination by ATP.
Nature 439:105:108.
Caplice E, Fitzgerald GF. 1999. Food fermentation: role of microorganisms in food production and preservation. Int. J.
Food Microbiol 50:131:149.
Claesson MJ et al. 2006. Multireplicon genome architecture of Lactobacillus
salivarius. PNAS 103:6718:6723.
Cormier EG et al. 2004. CD81 is an entry coreceptor for hepatitis C virus. Proc.
Natl. Acad. Sci. USA 101:7270:7274.
Evans MJ et al. 2007. Claudin:1 is a hepatitis C virus co:receptor required for a late step in entry. Nature 446:801.
Fan L et al. 2008. XPD helicase structures and activities: insight into the cancer and aging phenotypes from XPD mutations. Cell
133:789:800.
Gautam N dan Sharma N. 2009. Purification and characterization of bacteriocin produced by strain of Lactobacillus brevis
MTCC 7539. Indian Journal Biochemistry & Biophysic 46: 337:341.
Gozdek A et al. 2007. NS3 peptide, a novel potent hepatitis C virus NS3 Helicase Inhibitor: its mechanism of action and antiviral activity in the replicon system.
Antimicrobial Agents and Chemotheraphy
52:393:401.
Hempelmann E, Schulze M, Götze O. 1984. Free SH:groups are important for the polychromatic staining of proteins with silver nitrat. Neuhof V (ed) Electrophoresis '84 Verlag Chemie Weinheim 1984:328– 330.
Jay, J.M. 2000. Modern Food Microbiology, 6th edition. Gaithersburg :Aspen.
Kim et al. 1988. Hepatitis C virus NS3 RNA helicase domain with a bound oligonucleotide: the crystal structure provides insights into the mode of unwinding. Structure 6:89:100.
Klijn N, Weerkamp AH, De Vos WM. 1991. Identification of mesophilic lactic acid bacteria by using polymerase chain reaction:amplified variable regions of 16S rRNA and specific DNA probes.Applied
and Environtmental Microbiology 57:
3390:3393.
Kuipers OP, Buist G, Kok J. 2000. Current strategies for improving food bacteria.
Res.Microbiol 151:815:822.
Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 5:680–685.
Maillard P et al. 2006. The interaction of natural hepatitis C virus with human scavenger receptor SR:BI/Cla1 is mediated by ApoB:containing lipoproteins. FASEB J. , 20:735:737.
McHutchison JG, Patel K. 2002. Future therapy of hepatitis C. Hepatology :245: 252.
Op De Beeck A, Dubuisson J. 2003. Topology of hepatitis C virus envelope glycoproteins. Rev. Med. Virol. 13:233–41.
Sambrook J, Fritsch EF, Maniatis T. 1989. 1989. Molecular cloning: a laboratory
manual. Cold Spring Harbour: Cold Spring
Laboratory Pr.
Sambrook J, Russel DW. 2001. Molecular cloning: a laboratory manual vol 2 third edition. Cold Spring Harbour: Cold Spring Laboratory Pr.
Scopes RK. 1987. Protein purification, principles, and practices 2nd ed. New York: Springer Verlag.
Serkedjieva J, Danova S, Ivanova I. 2000. Antiinfluenza virus activity of a bacteriocin produced b