PERAIRAN 1
C DAN 2
C
KORNEL ADHITIA WARMAN
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
RINGKASAN
KORNEL ADHITIA WARMAN. Adaptasi Fisiologi Anemon Pasir (Heteractis malu) Terhadap Peningkatan Suhu Lingkungan Perairan 1o C dan 2o C. Dibimbing oleh NEVIATY PUTRI ZAMANI dan BEGINER SUBHAN.
Fenomena bleaching pada hewan karang merupakan topik yang sangat menarik untuk diteliti. Hal tersebut terkait dengan pemanasan global yang menjadi penyebab terjadinya fenomena bleaching pada hewan karang. Anemon pasir merupakan salah satu pembentuk ekosistem terumbu karang yang memiliki simbiosis dengan zooxanthellae dan termasuk golongan hexacorallia seperti halnya hewan karang. Anemon diberikan perlakuan berupa peningkatan suhu lingkungan sebesar 1o C (29o C) dan 2o C (30o C) dalam rangka mengkaji respon terhadap peningkatan suhu global. Tujuan penelitian ini adalah untuk
mempelajari adaptasi anemon pasir (Heteractis malu) terhadap kenaikan suhu lingkungan sebesar 1o C dan 2o C pada skala laboratorium.
Pengamatan secara visual menunjukkan bahwa terjadi penurunan kondisi kesehatan anemon khususnya pada anemon yang diberi perlakuan berupa peningkatan suhu. Penurunan kondisi kesehatan tersebut diperlihatkan dengan adanya tanda-tanda stress, seperti keadaan tentakel yang tidak
mengembang/mekar, produksi mucus yang berlebihan, keadaan mesenterial filament yang abnormal, dan berubahnya warna anemon menjadi lebih pucat. Pengamatan terhadap kondisi internal anemon dikaji melalui kondisi
zooxanthellae dan rasio ketebalan lapisan endoderm terhadap ektoderm. Kondisi densitas zooxanthellae khususnya untuk pengamatan preparat segar pada
perlakuan dua (30o C) jam 48 menunjukkan pengurangan yang signifikan yaitu sebesar 2,89x104 ind/ml dari kondisi awal, dengan nilai P<0,05 terhadap kontrol (28o C). Kondisi mitotik indeks zooxanthellae khususnya untuk pengamatan preparat segar pada perlakuan dua jam 24 menunjukkan peningkatan yang signifikan yaitu sebesar 0,93% dari kondisi awal, dengan nilai P<0,05 terhadap kontrol. Hasil pengamatan terhadap parameter lain pada masa peningkatan I (jam 0, 24, 48), istirahat (jam 72, 96, 120, 144), dan penigkatan II (jam 168, 192) menunjukkan tidak adanya perubahan yang signifikan baik pengamatan pada preparat segar maupun histologis (P>0,05). Namun terdapat beberapa parameter amatan (histologis) yang mengalami kondisi yang lebih baik pada masa
peningkatan II daripada peningkatan I yaitu densitas zooxanthellae pada perlakuan satu dan luasan sel zooxanthellae pada perlakuan satu dan dua.
Pengamatan pada preparat segar memperlihatkan bahwa anemon mengalami penyesuaian (adaptasi) terhadap peningkatan suhu sebesar 2o C khususnya hanya pada parameter densitas dan mitotik indeks zooxanthellae. Pengamatan pada preparat histologi memperlihatkan bahwa anemon mengalami penyesuaian
terhadap peningkatan suhu sebesar 1o C khususnya hanya pada parameter densitas dan luasan sel zooxanthellae serta penyesuaian terhadap peningkatan 2o C
Ane mone (Heteractis malu) Towards Increasing Te mperature of The Water
Environment for 1o C and 2o C. Under Advisor NEVIATY PUTRI ZAMANI and BEGINER SUBHAN.
The phenomenon of coral bleaching is a very interesting topic to be studied. This is related to global warming, which is the cause of the phenomenon of coral bleaching in animals. Sand anemone is one of formers the coral reef ecosystem that has a symbiotic zooxanthellae and one of the hexacorallia like a coral. Anemones are given treatment of increased environmental temperature of 1o C (29o C) and 2o C (30o C) to assess the response to global temperature increases. The purpose of this research is to study the adaptation of sand anemone
(Heteractis malu) towards improved the environmental temperature for 1o C and
2o C and in laboratory scale.
Visual observation showed the decline of health conditions, especially in the anemones treated with increasing temperature. Decline in health conditions indicated by the signs of stress, such as expands its tentacles not / blooms,
excessive mucus production, abnormal state of mesenterial filaments, and change the color becomes more pale anemone.
Observations of the internal conditions of the anemone, studied by observed the zooxanthellae conditions and studied through the ratio of endoderm to ectoderm layer thickness. Zooxanthellae density conditions, especially for the preparation of fresh observations on the treatment of two (30o C) at 48 hours treatment showed a significant decrease in the amount of 2.89 x104 ind / ml initial conditions, with a value of P <0.05 against control (28o C). Mitotic index of zooxanthellae under certain conditions for the preparation of fresh observations on the treatment of two at 24 hours treatment showed a significant increase in the amount of 0.93% of the initial conditions, with a value of P <0.05 against control. Observations of other parameters on the increase time I (at 0, 24, 48 hours), breaks (72, 96, 120, 144 hours), and increasing time II (at 168, 192) showed no significant changes in both observations on fresh preparations and histological (P> 0.05). But there are some observational parameters (histologic) who experienced better conditions in the increase time II that are zooxanthellaes density (treatment one) and the area of zooxanthellae cells in treatment I and II.
Observations on fresh preparations showed that anemones experiencing adjustment (adaptation) with a 2o C rise in temperature in particular only on the density parameter and the mitotic index of zooxanthellae. Observations on histological preparations showed that anemones adapted 1o C increase in
PERAIRAN 1
C DAN 2
C
Oleh
KORNEL ADHITIA WARMAN
Sebagai salah satu syarat untuk me mperoleh gelar Sarjana Ilmu Kelautan pada Departemen Ilmu dan Teknologi Kelautan
Fakultas Pe rikanan dan Ilmu Kelautan
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Dengan ini saya menyatakan bahwa Skripsi yang berjudul:
ADAPTASI FISIOLOGI ANEMON PASIR (
Heteractis
malu
)
TERHADAP PENINGKATAN SUHU LINGKUNGAN
PERAIRAN 1
oC dan 2
oC
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan da lam Daftar Pustaka dibagian akhir Skripsi ini.
Bogor, Agustus 2011
© Hak cipta milik Kornel Adhitia Warman, tahun 2011
Hak cipta dilindungi
Judul Skripsi : ADAPTASI FISIOLOGI ANEMON PASIR (Heteractismalu) TERHADAP PENINGKATAN SUHU LINGKUNGAN PERAIRAN 1O C DAN 2O C
Nama Mahasiswa : Kornel Adhitia Warman Nomor Pokok : C54070011
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui, Dosen Pembimbing
Mengetahui,
Ketua Departemen Ilmu dan Teknologi Kelautan
Prof. Dr. Ir. Setyo Budi Susilo, M.Sc. NIP. 19580909 198303 1 003
Tanggal Ujian: 22 Agustus 2011 Utama
Dr. Ir. Neviaty Putri Zamani, M.Sc NIP. 19641014 198803 2 008
Anggota
iii
untuk ditelaah, terkait dengan isu pemanasan global yang terjadi saat ini.
Perubahan kondisi lingkungan tentunya akan mempengaruhi kondisi organisme
yang hidup dilingkungan tersebut. Oleh karena itu dalam penelitian ini diajukan
suatu topik mengenai salah satu parameter kondisi lingkungan yaitu perubahan
suhu. Topik yang diajukan adalah Adaptasi Fisiologi Anemon Pasir (Heteractis
Malu) Terhadap Peningkatan Suhu Lingkungan Perairan 1o C dan 2o C.
Penelitian ini merupakan tugas akhir yang dibuat sebagai salah satu
persyaratan akademik untuk memperoleh gelar kesarjanaan. Pada pelaksanaan
penelitian dan penyusunan skripsi, Penulis banyak mendapat bantuan dari
berbagai pihak. Oleh karena itu Penulis mengucapkan banyak terima kasih
terutama kepada Dosen Pembimbing Utama dan Anggota yang bersedia
membimbing dan memberi bantuan pada saat penelitian maupun penyusunan
skripsi. Penulis juga mengucapkan terima kasih kepada para Dosen yang bersedia
melayani penulis dalam diskusi dan pencarian literatur. Tidak lupa kepada
teman-teman, terima kasih atas sumbangan saran dan bantuan terhadap penelitian ini.
Bogor, Agustus 2011
Kornel Adhitia Warman
iv besarnya kepada:
1. Dr. Ir. Neviaty Putri Zamani, M.Sc sebagai ketua komisi pembimbing dan
pembimbing akademik yang telah memberikan arahan, motivasi, bantuan dana
penelitian serta kesabaran dalam membimbing sehingga penulis dapat
menyelesaikan penelitian dan skripsi dengan baik.
2. Bapak Beginer Subhan, S.Pi. M.Si sebagai anggota komisi pembimbing yang
telah bersabar dalam memberikan arahan serta masukan dan informasi kepada
penulis hingga penyelesaian penelitian dan skripsi.
3. Prof. Dr. Ir. Dedi Soedharma, DEA sebagai dosen penguji ujian skripsi
4. Dr. Ir. Henry M. Manik, M.T sebagai ketua komisi pendidikan Departemen
Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, IPB.
5. Staf dosen dan Tata Usaha Departemen Ilmu dan Teknologi Kelautan.
6. Dondi Arafat, S.Pi. M.Si atas arahan dan bimbingan pada saat penelitian
7. Irnita Yulianti sebagai rekan kerja ketika pelaksanaan penelitian
8. A. Aditiayuda, Didit A., Norihiko Z., La Ode Alifatri, Daniel Siahaan,
Agus M., Aulia Aldelanov, teman-teman ITK 44 serta teman-teman kontrakan
“Happy House” atas dukungan dan kerja sama selama masa perkuliahan hingga pelaksanaan penelitian dan penyusunan skipsi.
9. Risha Youstikasari dan keluarga atas doa dan motivasi yang diberikan selama
perkuliahan hingga penyelesaian skripsi
10.Keluarga tercinta, Bapak, Ibu, kakak, adik serta saudara-saudara, yang telah
v
Halaman
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... x
1. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 2
1.3. Tujuan ... 3
1.4. Luaran ... 3
2. TINJAUAN PUSTAKA ... 4
2.1. Anemon ... 4
2.1.1. Taksonomi Heteractis malu ... 5
2.1.2. Struktur tubuh anemon ... 5
2.1.3. Pengaruh suhu lingkungan terhadap kehidupan anemon laut dan hewan karang ... 6
2.2. Zooxanthellae ... 8
2.2.1. Pengaruh suhu lingkungan terhadap kehidupan zooxanthellae dan simbiosis dengan inangnya ... 8
3. METODOLOGI PENELITIAN ... 10
3.1. Waktu dan Lokasi Penelitian ... 10
3.2. Alat dan Bahan ... 10
3.2.1 Recirculation Water System (RWS) ... 10
3.2.2 Pemeliharaan anemon pada RWS ... 12
3.3. Metode Penelitian ... 12
3.4. Metode Pengambilan Data ... 13
3.4.1. Pengamatan secara visual terhadap hewan uji dan pengukuran kualitas air ... 13
3.4.2. Rasio ketebalan endoderm dan ektoderm H. malu ... 14
3.4.3. Densitas zooxanthellae ... 14
3.4.4. Mitotik Indeks (MI) zooxanthellae ... 15
3.4.5. Ukuran sel zooxanthellae ... 16
3.5. Metode Analisis Data ... 16
3.5.1. Rasio ketebalan endoderm dan ektoderm pada H. malu ... 16
3.5.2. Mitotik Indeks (MI) zooxanthellae ... 17
3.5.3. Densitas zooxanthellae ... 17
3.5.4. Uji statistik ... 18
4. HASIL DAN PEMBAHASAN ... 19
anemon ... 19
4.1.2. Pengamatan preparat segar ... 22
4.1.2.1. Densitas zooxanthellae ... 22
4.1.2.2. Mitotik indeks zooxanthellae ... 25
4.1.3. Pengamatan preparat histologi ... 27
4.1.3.1. Densitas zooxanthellae ... 27
4.1.3.2. Mitotik indeks zooxanthellae ... 31
4.1.3.3. Rasio ketebalan endoderm dan ektoderm ... 33
4.1.3.4. Luas sel zooxanthellae ... 34
4.2. Pembahasan ... 38
4.2.1. Adaptasi fisiologi ... 38
4.2.2. Pengaruh peningkatan suhu perairan terhadap H. malu ... 42
5. KESIMPULAN DAN SARAN ... 46
5.1. Kesimpulan ... 46
5.2. Saran ... 46
DAFTAR PUSTAKA ... 47
LAMPIRAN ... 49
DAFTAR TABEL
Halaman
1. Perlakuan Terhadap Unit Eksperimen ... 13
2. Nilai Perubahan Untuk Setiap Parameter Pengamatan Pada Preparat
DAFTAR GAMBAR
Halaman
1. Anemon Jenis Heteractis malu dari Papua New Guinea ... 4
2. Struktur Tubuh Anemon Secara Umum ... 5
3. Potongan Melintang Bunodeopsis antilliensis (a) dan Thelaceros
Rhizophorae (b) ... 6
4. Setting Akuarium Recirculation Water System (1 set) ... 11
5. Kondisi Anemon Pada Masa Perlakuan Pertama (Peningkatan I) Anemon Satu Kontrol (a), Anemon Tiga Perlakuan Satu (b), Anemon
Tiga Perlakuan Satu (c) ... 20
6. Kondisi Anemon Tiga Perlakuan Satu Pada Masa Istirahat. Penurunan Kondisi Kesehatan Anemon Pada Jam ke-72 (a), (b),
Dan (c), Kematian Pada Jam ke-96 (d) ... 21
7. Kondisi Anemon Setelah Masa Perlakuan Kedua (Peningkatan II). Anemon Satu Kontrol (a), Anemon Satu Perlakuan Dua (b), Anemon Dua Perlakuan Satu (c), Anemon Satu
Perlakuan Dua (d) ... 22
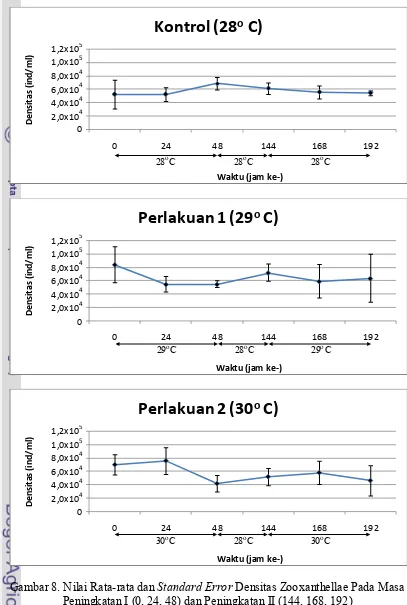
8. Nilai Rata-rata dan Standard Error Densitas Zooxanthellae Pada Masa Peningkatan I (0, 24, 48) dan Peningkatan II
(144, 168, 192) ... 23
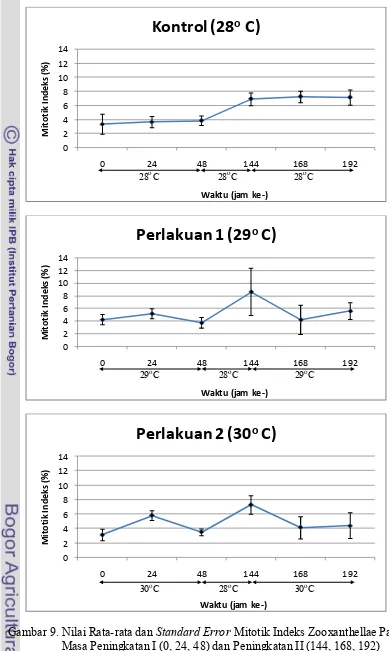
9. Nilai Rata-rata dan Standard Error Mitotik Indeks Zooxanthellae Pada Masa Peningkatan I (0, 24, 48) Dan Peningkatan II
(144, 168, 192) ... 26
10.Potongan Melintang Tentakel H. Malu (Anemon Tiga Kontrol) Pada
Preparat Histologis ... 28
11.Potongan Melintang Tentakel H. Malu (Anemon Dua Perlakuan
Dua) Pada Preparat Histologis ... 28
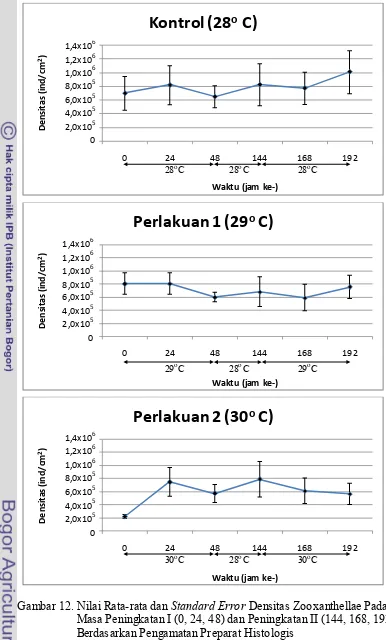
12.Nilai Rata-rata dan Standard Error Densitas Zooxanthellae Pada Masa Peningkatan I (0, 24, 48) dan Peningkatan II (144, 168, 192)
Berdasarkan Pengamatan Preparat Histologis ... 30
13.Sel Zooxanthellae Anemon Dua Perlakuan Dua Pada Kondisi Pembelahan Mitosis (Lingkaran Merah) Dan Kond isi Normal
(Lingkaran Biru) ... 31
14.Nilai Rata-rata dan Standard Error Mitotik Indeks Zooxanthellae Pada Masa Peningkatan I (0, 24, 48) dan Peningkatan II
(144, 168, 192) Berdasarkan Pengamatan Preparat Histologis ... 32
Pada Preparat Histologis ... 33
16.Nilai Rata-rata dan Standard Error Rasio Ketebalan Endoderm dan Ektoderm Zooxanthellae Pada Masa Peningkatan I (0, 24, 48) serta Peningkatan II (144, 168, 192) Berdasarkan Pengamatan
Preparat Histologis ... 35
17.Zooxanthellae Pada Lapisan Endoderm Tentakel H. Malu (Anemon
Dua Perlakuan Satu) Pada Preparat Histologis ... 36
18.Nilai Rata-rata dan Standard Error Luas Sel Zooxanthellae Pada Masa Peningkatan I (0, 24, 48) dan Peningkatan II (144, 168, 192)
DAFTAR LAMPIRAN
Halaman
1. Alat dan Bahan Penelitian ... 50
2. Diagram Alir Pembuatan Preparat Histologis ... 52
3. Data Pengamatan Visual Terhadap Hewan Uji Pada Jam 0, 24,
dan 48 ... 53
4. Data Pengamatan Visual Terhadap Hewan Uji Pada Jam 72, 96,
dan 120 ... 54
5. Data Pengamatan Visual Terhadap Hewan Uji Pada Jam 144, 168,
dan 192 ... 55
6. Rekapiltulasi F- hitung, Peluang, dan Koefisien Keragaman perlakuan
Suhu Terhadap Parameter Pengamatan Pada Preparat Segar ... 56
7. Rekapiltulasi F- hitung, Peluang, dan Koefisien Keragaman perlakuan
Suhu Terhadap Parameter Pengamatan Pada Preparat Histologi ... 57
1
1. PENDAHULUAN
1.1. Latar Belakang
Berdasarkan data suhu permukaan bumi selama 156 tahun (1850-2006),
selama duabelas tahun terakhir (1995-2006) memperlihatkan kenaikan suhu
permukaan bumi yang paling hangat (IPCC, 2007). Kenaikan suhu permukaan
bumi secara global terlihat pada kenaikan rata-rata suhu seratus tahunan yaitu
0,6o C pada tahun 1901-2000, menjadi 0,74o C pada tahun 1906-2005 (IPCC, 2007).
Pemanasan global tidak hanya mempengaruhi keadaan bumi secara fisik,
tetapi juga mempengaruhi faktor biologi kehidupan organisme di bumi. Banyak
organisme yang beradaptasi dari perubahan suhu lingkungan karena pemanasan
global dengan cara bermigrasi (moving) secara periodik untuk mempertahankan
toleransinya dan dapat bertahan dari stress juga menghindari kematian (Hawkes
et al., 2007). Penyesuaian ataupun perubahan fisiologi untuk menjadi lebih sesuai
dengan keadaan lingkungan merupakan salah satu bentuk adaptasi
(biology-online.org, 2011).
Terkait dengan pemanasan global yang sedang terjadi, fenomena bleaching
pada hewan karang menjadi topik yang sangat menarik untuk diteliti. Beberapa
penelitian yang telah dilaksanakan mengenai dampak peningkatan suhu
lingkungan terhadap biota perairan khususnya anemon laut dan hewan karang
diantaranya, terdapat perbedaan sintasan anemon laut terhadap suhu pemeliharaan
yang berbeda (Stan dan Hauter, 2010), kehilangan berat badan dan meningkatnya
tingkat respirasi (Chomsky, et al., 2004), kenaikan suhu dapat menyebabkan
berdasarkan hasil penelitian Goreau dan Hayes (2005), peningkatan suhu
1o C - 2o C diatas suhu rata-rata dalam satu bulan, dapat menyebabkan pemucatan (bleaching) pada hewan karang.
Anemon pasir merupakan salah satu pembentuk ekosistem terumbu karang
yang memiliki simbiosis dengan zooxanthellae dan termasuk golongan
hexacorallia seperti halnya hewan karang. Sebagai invertebrata, anemon
merupakan hewan berdarah dingin. Hewan berdarah dingin merupakan hewan
yang sangat sensitif terhadap perubahan suhu lingkungan sehingga akan
berpengaruh secara langsung terhadap kemampuan hidup dan reproduksi (Hawkes
et al., 2007).
Terjadinya pemutihan (bleaching) pada anemon terkait dengan kondisi
zooxanthellae dan rasio ketebalan lapisan endoderm dengan ektoderm pada tubuh
anemon. Berdasarkan hal tersebut, penelitian yang dilaksanakan selain
mengamati kondisi luar anemon secara visual juga melakukan pengamatan pada
bagian internal anemon dengan melakukan perhitungan densitas, luasan sel dan
mitotik indeks zooxanthellae serta rasio ketebalan lapisan endoderm dengan
ectoderm pada preparat histologi. Selanjutnya, informasi yang didapat akan
digunakan untuk mempelajari pola adaptasi anemon terhadap perubahan suhu
lingkungan perairan.
1.2. Rumusan Masalah
Rumusan masalah dari tulisan yang penulis susun adalah sebagai berikut :
1. Bagaimana kondisi hewan uji ketika menerima perlakuan berupa kenaikan
sel dan mitotik indeks) serta kondisi rasio ketebalan lapisan endoderm dan
ectoderm pada tentakel anemon?
2. Bagaimana adaptasi hewan uji terhadap kenaikan suhu lingkungan?
1.3. Tujuan
Tujuan penelitian ini adalah mempelajari adaptasi fisiologi anemon pasir
(Heteractis malu) terhadap kenaikan suhu lingkungan sebesar 1o C dan 2o C pada skala laboratorium.
1.4. Luaran
Hasil penelitian ini diharapkan dapat menunjukkan pengaruh perubahan suhu
lingkungan berupa kenaikan suhu, terhadap pola adaptasi biota laut khususnya
anemon pasir (Heteractis malu). Informasi mengenai pengaruh kenaikan suhu
lingkungan terhadap biota perairan tersebut sedikit banyak dapat dikaitkan dengan
kondisi perairan laut saat ini yang terus mengalami kenaikan suhu rata-rata pada
4
2. TINJAUAN PUSTAKA
2.1. Ane mon
Anemon merupakan salah satu anggota dari Filum Cnidaria. Anemon
mempunyai Nematocyst atau sel penyengat yang menjadi ciri khas dari golongan
cnidaria. Populasi anemon tersebar keseluruh lautan mulai dari wilayah trop is
sampai kutub. Anemon pasir (Heteractis malu) merupakan salah satu jenis
anemon yang hidup di wilayah perairan tropis. Tampilan fisik Heteractis malu
dapat dilihat pada Gambar 1 dibawah ini. Menurut Suwignyo et al. (2005),
karakteristik anemon laut secara umum diantaranya; polip soliter, biasanya
mempunyai pedal disk semacam kaki, Siphonoglyph biasanya berjumlah dua,
tidak mempunyai rangka, hidup menempel tetapi tidak melekat pada batu, pasir,
atau hewan avertebrata lain, dan dapat merayap menggunakan pedal disk
semacam kaki.
Sumber : Colin and Arneson (1995)
2.1.1. Taksonomi Heteractis malu
Taksonomi Heteractis malu menurut WoRMS (2010) adalah sebagai berikut :
Kingdom : Animalia
Filum : Cnidaria
Kelas : Anthozoa Subkelas : Hexacorallia
Ordo : Actiniaria (anemon laut)
Family : Stichodactylidae
Genus : Heteractis
Spesies : Heteractis malu (Haddon & Shackleton, 1893)
2.1.2. Struktur tubuh ane mon
Secara umum anemon laut mempunyai struktur tubuh berbentuk polip dan
hidup secara soliter. Bagian terbesar pada tubuh anemon laut adalah sebuah
batang tubuh seperti tabung (column), dibawah aboral terdapat telapak kaki yang
datar (pedal disc), dibagian oral agak melebar terdapat mulut yang dikelilingi
tentakel (Gambar 2). Mulut terhubung secara langsung dengan actinopharynx
(saluran seperti tenggorokan yang menghubungkan ke rongga perut/coelenteron).
Pada rongga perut tedapat mesenterial filaments yang berfungsi sebagai pencerna
makanan, sedangkan gonad dapat dilihat diantara mesentery dan mesenterial
filaments.
Sumber : McCloskey, 2011
Pada bagian tentakel terdapat tiga lapisan tubuh yaitu ektoderm, mesoglea,
dan endoderm (Gambar 3). Pada lapisan ektoderm terdapat sel nematocyst yang
menjadi ciri khas Filum Cnidaria. Sedangkan pada lapisan endoderm dapat
ditemukan alga symbion yaitu zooxanthellae.
(a) (b)
Sumber : McCloskey, 2011
Gambar 3. Potongan Melintang Bunodeopsis antilliensis (a) dan Thelaceros rhizophorae (b). Ektodermal epithelium (e.1), Nervous layer (n.1), Ektodermal muscular (m.1), mesoglea (mg/mes), endoderm
(en/end), rongga tentakel (R), rongga pada pertumbuhan tentakel (R1), nematocyst (nem), zooxanthellae (zoox)
2.1.3. Pengaruh suhu lingkungan te rhadap kehidupan ane mon laut dan
he wan karang
Suhu merupakan salah satu faktor fisik lingkungan yang dapat mempengar uhi
kehidupan biota yang hidup di perairan. Beberapa pengaruh suhu terhadap
kehidupan biota perairan khususnya anemon laut dan hewan karang adalah
sebagai berikut :
1. Stan dan Hauter D (2010) menyatakan bahwa pemeliharaan anemon pada
akuarium dengan suhu yang hampir sama di tempat asal anemon (80-900
F) tersebut memberikan jangka waktu bertahan hidup yang lebih lama
daripada suhu akuarium yang lebih rendah (71-750 F). Selain itu,
e.1 n.1 m.1 mg en
R1
R
ect
mes
end
pemeliharaan anemon pada akuarium dengan suhu air 760-780 F
memberikan jangka waktu bertahan hidup tiga kali lebih lama daripada
pemeliharaan dengan suhu air 710-750 F.
2. Peningkatan temperatur air laut dapat menyebabkan terganggunya proses
fotosistesis yang kemudian dapat meningkatkan konsentrasi ROS
(Reactive Oxygen Species) yaitu berupa H2O2. Meningkatnya konsentrasi
ROS akan menyebabkan kerusakan membran sel (host cell) yang pada
akhirnya akan berpengaruh kepada mekanisme pelepasan sel
zooxanthellae yaitu exocytosis, host cell detachment, dan host cell
apoptosis (Weis, 2008). Keluarnya zooxanthellae dari jaringan endoderm
hewan karang menyebabkan terjadinya pemutihan hewan karang
(bleaching).
3. Pada anemon pasir, jumlah pembelahan mitosis zooxanthellae berkurang
seiring dengan bertambahnya suhu lingkungan (Zamani, 1995).
4. Pada kondisi laboratorium, Anthopleura elegantissima yang hidup pada
suhu 20° C kehilangan berat badan secara signifikan dibandingkan dengan
anemon dengan jenis sama yang hidup pada suhu 13° C (terlepas dari jenis
anemon) (Saunders dan Parker, 1997). Hilangnya berat badan juga
dialami oleh salah satu jenis anemon yaitu Actinia equina yang dipelihara
pada suhu 25-30o C (Chomsky, et al., 2004).
5. Bertambahnya suhu perairan, akan menambah juga tingkat respirasi
2.2. Zooxanthellae
Zooxanthellae merupakan dinoflagellata dari genus Symbiodinium yang
berwarna kuning-cokelat dan pada umumnya bersimbiosis dengan hewan bentik
dari filum Cnidaria (Douglas, 2003). Adapun siklus hidup zooxanthellae menurut
Sorokin, 1993 in Purnomo, 2011 adalah sebagai berikut :
1. Bentuk yang tetap (immotil) berupa cyst (dalam sel inang) dengan kulit sel
yang keras (dalam media budidaya).
2. Bentuk gymnodinium flagella
3. Zoosporangia mengandung zoospora motil yang besar (dapat berenang
aktif sehingg dapat menempel pada inang)
4. Zoosporangia mengandung 2-3 zoospora nonmotil
Sebagai simbion, zooxanthellae mempunyai peran terhadap inangnya
misalnya hewan karang, sebagaimana yang disebutkan oleh Sebens (1997) in
Purnomo (2011) yaitu sebagai berikut :
1. Memberikan warna
2. Memberikan 95 % Energi hasil fotosintesis (Muscatine, 1990 in
Purnomo, 2011)
3. Memenuhi 90% kebutuhan karbon polyp
2.2.1. Pengaruh suhu lingkungan te rhadap kehidupan Zooxanthellae dan
simbiosis dengan inangnya.
Beberapa pengaruh suhu lingkungan terhadap kehidupan Zooxanthellae dan
simbiosis dengan inangnya adalah sebagai berikut :
1. Peningkatan suhu perairan sebesar 2o C -3o C dari temperatur normal
jika terjadi dalam beberapa bulan, dapat menyebabkan bleaching yang luas
dan bahkan kematian karang seperti observasi yang dilakukan di Indonesia
oleh Brown (1983) dan Suharsono (1998) (Brown, 1983 dan Suharsono,
1998 in Purnomo, 2011).
2. Peningkatan suhu secara ekstrim juga dapat menyebabkan kerusakan sel
zooxanthellae hingga menjadi mati (Zamani, 1995).
3. Zamani (1995) menyatakan bahwa peluluhan pigmen dan pelepasan
zooxanthellae dari polip karang akibat adanya tekanan suhu tidak hanya
terjadi dalam bentuk keluarnya zooxanthellae di dalam sel polip, tetapi
proses pelepasan tersebut diikuti oleh kerusakan seluler. Berdasarkan hal
tersebut maka proses degradasi dapat dilihat dengan cara mengamati
perubahan kandungan endosimbion dan perubahan struktur sel.
4. Suhu yang tinggi dapat menyebabkan penurunan kepadatan
zoochlorellae/zooxanthellae yang berasosiasi pada Anthopleura
elegantissima, secara signifikan dan penurunan indeks mitosis alga (dari
15% menjadi <5% pembelahan sel setelah 6 hari) untuk waktu
pemeliharaan (pemberian perlakuan) lebih dari 25 hari (Saunders dan
10
3. METODOLOGI PENELITIAN
3.1. Waktu dan Lokasi Penelitian
Penelitian dilaksanakan pada Bulan Februari-Juni 2011. Pelaksanaan
eksperimen yang terdiri dari pengambilan sampel dan pengamatan dilaksanakan
di Laboratorium Basah dan Laboratorium Kering, Bagian Hidrobiologi Laut,
Departemen Ilmu dan Teknologi Kelautan. Analisis kualitas air dilakukan di
Laboratorium Produktivitas Lingkungan, Departemen Manajemen Sumberdaya
Perairan. Pembuatan preparat histologis dilaksanakan di Laboratorium Kesehatan
Ikan, Departemen Budidaya Perairan. Keempat laboratorium yang digunakan
bertempat di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3.2. Alat dan Bahan
Alat dan bahan yang digunakan untuk penelitian ini utamanya yaitu, tiga set
akuarium Recirculation Water System, pemanas air untuk akuarium (Risheng RS308 150W), mikroskop cahaya (Olympus CX21LEDFS1), air laut, anemon
pasir (H. malu), dan sampel untuk pengamatan preparat segar maupun histologis berupa potongan tentakel anemon. Selain itu digunakan juga alat dan bahan untuk
pengamatan preparat segar dan histologis, pengukuran kualitas air, dan pembuatan
preparat histologis. Rincian alat dan bahan secara keseluruhan
dapat dilihat pada Lampiran 1.
3.2.1 Recirculation Water System (RWS)
Recirculation Water System yang digunakan pada penelitian ini terbagi menjadi dua bagian utama yaitu, akuarium pemeliharaan dan akuarium filter
dipelihara. Pada setiap akuarium pemeliharaan terdapat 3 anemon pasir yang
dipisahkan dengan jaring hapa agar anemon dapat dibedakan satu sama lain (tidak
bercampur). Akuarium filter digunakan sebagai tempat penyimpanan pompa air
dan filter akuarium yang terdiri atas filter fisika (pecahan karang/rubble), filter kimia (arang), dan filter biologi (bioball).
Gambar 4. Setting Akuarium Recirculation Water System (1 set)
Penggunaan RWSsangat baik untuk sistem pemeliharaan biota di akuarium
karena air laut akan terus mengalir sesuai sistem resirkulasi yang dibuat sehingga
air akan terjaga kualitasnya. Hal tersebut terkait dengan sistem filter yang
tentunya berfungsi untuk menyaring kotoran pada air laut. Filter fisik (rubble) berfungsi sebagai penyaring kotoran-kotoran yang berukuran cukup besar
terlarut, dan sejenisnya (Erian, 2010). Filter biologi (bioball) berfungsi untuk mengikat bakteri pengurai sehingga menjadi media bakteri untuk tumbuh (Erian,
2010). Lendir yang melekat pada bioball merupakan nitrobacter yang berguna untuk meningkatkan kualitas air.
3.2.2 Pemeliharaan ane mon pada RWS
Pemeliharaan anemon pada sistem resirkulasi terdiri atas dua masa
pemeliharaan yaitu masa aklimatisasi dan masa eksperimentasi. Masa
aklimatisasi merupakan masa pemeliharaan anemon selama kurang lebih satu
minggu mulai dari hari pertama dipeliharanya anemon pada RWS. Masa
aklimatisasi dilaksanakan untuk memberikan waktu kepada anemon sehingga
dapat menyesuaikan diri terhadap lingkungan yang baru (RWS). Masa
eksperimentasi merupakan masa diberikannya perlakuan (pada penelitian ini
berupa kenaikan suhu air). Masa eksperimentasi dilaksanakan setelah anemon
sudah dapat hidup dengan baik/nyaman pada sistem resirkulasi (setelah masa
aklimatisasi).
Selama masa pemeliharaan anemon diberi makan berupa potongan/cincangan
udang (udang mentah). Pemberian makan dilakukan satu kali dalam dua hari
pemeliharaan. Pemberian makan dilakukan dengan cara menyuapi anemon
menggunakan pinset langsung pada bagian mulut (oral disc).
3.3. Metode Penelitian
Penelitian ini dilaksanakan dengan menggunakan tiga set akuarium
Terdapat tiga perlakuan terhadap unit eksperimen (anemon), yaitu kontrol
(menggunakan suhu normal yaitu rata-rata 28oC), peningkatan 1oC dari suhu
normal (29 oC) dan peningkatan 2 oC dari suhu normal (30 oC) (Tabel 1). Secara
keseluruhan eksperimen dilaksanakan selama 192 jam, yaitu 48 jam peningkatan
I, 96 jam masa istirahat, dan 48 jam peningkatan II. Peningkatan I dan II
merupakan waktu ketika akuarium diberi perlakuan peningkatan suhu.
Tabel 1. Perlakuan Terhadap Unit Eksperimen
Akuarium Awal (jam)
Peningkatan I (jam)
Istirahat (jam)
Peningkatan II (jam) 0 24 48 72 96 120 144 168 192 Kontrol (oC) 28 28 28 28 28 28 Perlakuan 1 (oC) 28 29 29 28 29 29 Perlakuan 2 (oC) 28 30 30 28 30 30
3.4. Metode Pengambilan Data
3.4.1. Pengamatan secara vis ual te rhadap he wan uji dan pengukuran
kualitas air
Pengamatan secara visual dilaksanakan pada masa aklimatisasi da n saat
eksperimen dilaksanakan. Pengamatan dilaksanakan untuk mengetahui kondisi
kesehatan anemon yang dilihat berdasarkan empat parameter yaitu produksi
mucus/lendir, tentakel yang aktif, warna polip, dan keadaan mesenterial filaments. Pengamatan dilaksanakan satu kali dalam satu hari. Pengukuran kualitas air
dilakukan pada masa persiapan akuarium, aklimatisasi, dan saat eksperimen
(peningkatan I, istirahat, peningkatan II) dilaksa nakan. Parameter kualitas air
3.4.2. Rasio ketebalan endoderm dan ektode rm H. malu
Pengamatan rasio ketebalan endoderm dan ektoderm dilaksanakan untuk
melihat kondisi kesehatan anemon pasir k hususnya pada lapisan endoderm.
Semakin menurunnya nilai rasio ketebalan endoderm dan ektoderm menunjukkan
semakin tipisnya lapisan endoderm dibanding ektoderm. Hal tersebut
menunjukkan adanya kemungkinan terjadinya kerusakan lapisan endoderm akibat
mekanisme keluarnya zooxanthellae melalui proses necrosis dan Pinching off, ataupun rusaknya jaringan endoderm akibat lepasnya vakuola bersamaan dengan
lepasnya sel zooxanthellae (host cell detachment) (Gates, et al., 1992).
Pengamatan rasio ketebalan endoderm dan ektoderm dilakukan pada preparat
histologis dari potongan secara melintang pada bagian ujung tentakel anemon.
Satu potong tentakel diambil dari setiap individu setiap harinya pada saat
perlakuan dilasanakan (peningkatan I dan II). Potongan tentakel tersebut
kemudian difiksasi dan dibuat sediaan histologisnya. Langkah- langkah dalam
pembuatan preparat histologis dapat dilihat pada Lampiran 2. Setelah preparat
histologis tersedia, maka ketebalan endoderm dan ektoderm dapat diamati
menggunakan mikroskop cahaya dengan pembesaran 40x10 untuk diambil
gambarnya menggunakan kamera digital Optilab dan software Optilab Viewer.
Kemudian dari gambar yang diperoleh, ketebalan endoderm dan ektoderm dapat
diukur menggunakan software Image Raster dari Optilab.
3.4.3. Densitas zooxanthellae
Pengamatan densitas zooxanthellae dilaksanakan untuk melihat kondisi
akibat peningkatan suhu merupakan salah satu faktor yang menjadi penyebab
bleaching (Gates, et al., 1992).
Pengamatan densitas zooxanthellae dilakukan baik pada preparat histologi
maupun preparat segar dari potongan tentakel anemon menggunakan metode
lapang pandang (10 lapang pandang). Tiga potong tentakel diambil pada setiap
individu setiap harinya pada saat perlakuan dilaksanakan (peningkatan I dan II)
sebagai sampel preparat segar. Sampel yang didapat kemudian digerus dan
langsung dibuat preparat segar. Preparat segar tersebut diamati secara langsung
menggunakan mikroskop cahaya dengan pembesaran 40x10.
Pengamatan preparat histologi dilakukan dengan menggunakan mikroskop
cahaya pada pembesaran 40x10 untuk diambil gambarnya menggunakan camera
digital Optilab dan software Optilab Viewer. Setelah itu dari gambar yang
didapat, jumlah zooxanthellae dapat dihitung menggunakan Tools “manual count”
pada software Image Raster dari Optilab.
3.4.4. Mitotik Indeks (MI) zooxanthellae
Mitotik indeks dari zooxanthellae menjadi indikator yang lebih sensitif
terhadap stress dari pada respon bleaching (Zamani, 1995). Hal tersebut yang mendasari dilakukannya pengamatan mitotik indeks zooxanthellae pada
penelitian ini.
Pengamatan MI zooxanthellae dilakukan baik pada preparat histo logi maupun
preparat segar dari potongan tentakel anemon. Tiga potong tentakel diambil pada
setiap individu setiap harinya pada saat perlakuan dilaksanakan (peningkatan I
dan II) sebagai sampel preparat segar. Sampel yang didapat kemudian digerus
diamati secara langsung menggunakan mikroskop cahaya dengan pembesaran
40x10. Pengamatan preparat histology dilakukan secara langsung menggunakan
mikroskop cahaya pada pembesaran 40x10 menggunakan camera digital Optilab
dan software Optilab Viewer.
3.4.5. Ukuran sel zooxanthellae
Pengamatan ukuran sel zooxanthellae dilaksanakan untuk melihat respon
zooxanthellae pada tubuh anemon terhadap peningkatan suhu yang diberikan.
Anemon yang diberikan stress berupa peningkatan suhu akan menyebabkan berkurannya ukuran luasan sel zooxanthellae yang menjadi simbionnya (Zamani,
1995). Berdasarkan hal tersebut, pengamatan ukuran sel zooxanthellae
dilaksanakan khususnya untuk melihat respon stress yang terjadi.
Pengamatan ukuran luas sel zooxanthellae dilakukan hanya pada preparat
histologi menggunakan mikroskop cahaya pada pembesaran 40x10 untuk diambil
gambarnya. Pengambilan gambar dilakukan dengan menggunakan camera digital
Optilab dan software Optilab Viewer. Setelah itu, pengukuran ukuran sel
dilakukan menggunakan software imageJ pada gambar sel zooxanthellae.
3.5. Metode analisis data
3.5.1. Rasio ketebalan endoderm dan ektode rm pada H. malu
Rasio ketebalan endoderm dan ektoderm diperoleh dengan menggunakan
rumus berikut :
E G
K K
R
(1)
keterangan :
KG : ketebalan gastroderm/endoderm ( m )
KE : ketebalan ektoderm ( m )
3.5.2. Mitotik Indeks (MI) zooxanthellae
Rumus yang digunakan untuk menentukan mitotik indeks sel zooxanthellae
(Brown dan Zamani, 1992) adalah sebagai berikut:
100
n A MI
(2) keterangan :
MI : mitotik indeks zooxanthellae ( % )
A : jumlah sel yang melakukan pembelahan mitosis
n : jumlah sel yang dihitung sebagai dasar perbandingan (500 sel)
3.5.3. Densitas zooxanthellae
Densitas zooxantellae pada preparat histologi dihitung dengan
menggunakan rumus berikut :
m n
Z
D i
i i
1
(3)
a D
D i
(4)
Keterangan :
Di : densitas zooxanthellae per lapang pandang
D : densitas zooxanthellae
Z : jumlah zooxanthella dalam satu lapang pandang
m : jumlah lapang pandang
Perhitungan pada preparat segar menggunakan modifikasi rumus densitas
plankton dari Basmi (1999), yaitu sebagai berikut.
a cg
cg s i
A A
V V n
D
(5)
Keterangan :
Di : Densitas (individu/ml) Vcg: Volume cover glass (ml)
n : Jumlah sel yang ditemukan (individu) Acg : Luas cover glass (cm2)
Vs : Volume sampel (ml) Aa : Luas amatan (cm2)
3.5.4. Uji statistik
Data yang diperoleh diuji menggunakan Analisis of Varians (ANOVA) untuk melihat pengaruh pemberian perlakuan. Uji Beda Nyata Terkecil (BNT)
digunakan hanya untuk melihat perlakuan (suhu) yang dengan nyata atau sangat
nyata mempengaruhi kondisi zooxanthellae (mitotik indeks, densitas dan ukuran
luas sel) serta rasio ketebalan lapisan endoderm terhadap ektoderm pada tentakel
anemon. Proses perhitungan statistik ANOVA dan uji lanjut dilakukan dengan
menggunakan program SAS 9.1.3 portable. Hipotesis yang diuji adalah sebagai
berikut :
1. H0 : µ1 = µ2 = µ3
H1 : µ1≠ µ2≠ µ3
19
4.1. Hasil Penelitian
Terdapat tiga hasil utama yang didapat dari penelitian ini, yaitu hasil
pengamatan secara visual terhadap keadaan bagian luar tubuh anemon,
pengamatan preparat segar, dan pengamatan preparat histologis. Pengamatan
preparat segar meliputi dua parameter amatan yaitu densitas dan mitotik indeks
zooxanthellae. Pengamatan preparat histologis meliputi empat parameter amatan
yaitu densitas, mitotik indeks, dan luasan sel zooxanthellae serta rasio ketebalan
lapisan endoderm terhadap ektoderm pada tentakel anemon.
4.1.1. Pengamatan visual terhadap keadaan bagian luar tubuh ane mon
Kondisi anemon pada masa aklimatisasi menunjukan keada an kesehatan yang
cukup baik kecuali pada parameter warna pada anemon satu perlakuan satu.
Kondisi tersebut diperlihatkan dengan tidak adanya mucus yang terlihat, keadaan
tentakel yang mengembang, warna yang cerah, dan kondisi meseterial filaments
yang normal (tidak mengembung pada bagian mulut). Kondisi kurang sehat yang
diperlihatkan oleh anemon satu pada perlakuan satu yaitu menurunnya tingkat
kecerahan warna.
Pada masa pemberian perlakuan yang pertama (peningkatan I), terjadi
perubahan kondisi anemon terutama pada parameter warna dan keadaan
mesenterial filaments. Perubahan terjadi setelah 24 jam dari dimulainya
pemberian perlakuan, yaitu terjadinya perubahan warna menjadi agak pucat pada
anemon satu dan tiga pada kontrol serta anemon tiga pada perlakuan satu.
mesenterial filaments yang abnormal (kotak merah pada Gambar 5(c)). Data hasil
pengamatan visual dapat dilihat pada Lampiran 3. Kondisi anemon yang
mengalami perubahan kondisi dapat dilihat pada Gambar 5.
(a) (b)
[image:35.596.100.502.132.828.2](c)
Gambar 5. Kondisi Anemon Pada Masa Perlakuan Pertama (Peningkatan I) Anemon Satu Kontrol (a), Anemon Tiga Perlakuan Satu (b), Anemon Tiga Perlakuan Satu (c)
Pada masa istirahat (tidak ada perlakuan), selain terjadinya penurunan
kesehatan anemon juga terjadi kematian anemon dan pulihnya kesehatan anemon.
Penurunan kondisi kesehatan terjadi pada anemon tiga pada perlakuan satu yaitu
cukup banyaknya (sedang) keluarnya mucus, keadaan tentakel yang setengah
mengembang, warna agak pucat, dan abnormalnya mesenterial filaments (data
pada Lampiran 4 dan 5). Keadaan tersebut terus berlanjut hingga mengakibatkan
kematian anemon tersebut pada hari kedua masa istirahat (Gambar 6). Pulihnya
kesehatan anemon ditunjukan oleh anemon tiga pada kontrol yaitu kembalinya
keadaan warna menjadi cerah kembali.
(a) (b)
[image:36.596.111.494.136.534.2]
(c) (d)
Gambar 6. Kondisi Anemon Tiga Perlakuan Satu Pada Masa Istirahat. Penurunan Kondisi Kesehatan Anemon Pada Jam ke-72 (a),(b),dan (c), Kematian Pada Jam ke-96 (d)
Pada masa pemberian perlakuan yang kedua (Peningkatan II), terjadi kembali
penurunan kesehatan anemon. Penurunan kesehatan tersebut diperlihatkan oleh
perubahan keadaan warna menjadi agak pucat pada anemon satu pada kontrol dan
anemon dua pada perlakuan satu juga pucatnya anemon satu perlakuan satu
(Gambar 7. (a), (b), (c)). Pada anemon dua perlakuan dua, keadaan tentakel juga
kurang baik yaitu setengah mengembang. Keadaan tersebut terus berlanjut pada
hari kedua sehingga mengakibatnya semakin parahnya kondisi anemon dua pada
perlakuan dua yaitu tidak mengenbangnya tentakel (menyusut), keluarnya mucus,
warna yang agak pucat, dan abnormalnya keadaan mesenterial filaments (data
pada Lampiran 5). Setelah perlakuan kedua dihentikan, kondisi anemon dua
perlakuan dua tidak membaik dan mati pada hari berikutnya (Gambar 7.(d)).
(a) (b)
[image:37.596.110.483.147.529.2]
(c) (d)
Gambar 7. Kondisi Anemon Setelah Masa Perlakuan Kedua (Peningkatan II) Anemon Satu Kontrol (a), Anemon Satu Perlakuan Satu (b), Anemon Dua Perlakuan Satu (c), Anemon Dua Perlakuan Dua (d)
4.1.2. Pengamatan preparat segar
4.1.2.1. Densitas zooxanthellae
Kondisi densitas zooxanthellae pada masa perlakuan (Peningkatan I dan II)
dapat dilihat pada Gambar 8. Kondisi rata-rata densitas zooxanthellae pada
anemon kontrol tidak terlalu berfluktuasi. Pada masa peningkatan I, nilai rata-rata
densitas naik dari 5,23x104 ind/ml pada awal perlakuan (jam ke-0) menjadi 6,86
x104 ind/ml. Pada masa istirahat sampai masa peningkatan II berakhir (jam ke
192), nilai rata-rata densitas mengalami penurunan yaitu menjadi 5,43x104 ind/ml.
Tentakel tida k menge mbang
Ke matian ane mon setelah masa peningkatan II selesai
Gambar 8. Nilai Rata-rata dan Standard Error Densitas Zooxanthellae Pada Masa Peningkatan I (0, 24, 48) dan Peningkatan II (144, 168, 192)
catatan : pengambilan sampel dilakukan pada pukul 10.00 WIB 0.00E+00 2.00E+04 4.00E+04 6.00E+04 8.00E+04 1.00E+05 1.20E+05
0 24 48 144 168 192
D e ns it a s (i nd/ m l)
Waktu (jam ke-)
Kontrol (28
oC)
0.00E+00 2.00E+04 4.00E+04 6.00E+04 8.00E+04 1.00E+05 1.20E+05
0 24 48 144 168 192
D e ns it a s (i nd/ m l)
Waktu (jam ke-)
Perlakuan 1 (29
oC)
0.00E+00 2.00E+04 4.00E+04 6.00E+04 8.00E+04 1.00E+05 1.20E+05
0 24 48 144 168 192
D e ns it a s (i nd/ m l)
Waktu (jam ke-)
Perlakuan 2 (30
oC)
30oC 28oC 30oC 28oC 28oC 28oC
29oC 28oC 29oC
Anemon pada perlakuan satu memperlihatkan kondisi rata-rata densitas
zooxanthellae yang berfluktuasi dengan perubahan yang cukup besar. Pada masa
peningkatan I, nilai rata-rata densitas turun dari 8,35x104 ind/ml pada awal
perlakuan (jam ke-0) menjadi 5,46 x104 ind/ml. Pada masa istirahat, nilai
rata-rata densitas mengalami kenaikan menjadi 7,17 x104 ind/ml (jam ke-144). Namun
pada masa peningkatan II, nilai rata-rata densitas mengalami penurunan kembali
yaitu menjadi 6,33x104 ind/ml.
Kondisi rata-rata densitas zooxanthellae pada anemon dengan perlakuan dua
juga mengalami fluktuasi dan perubahan yang cukup besar. Pada masa
peningkatan I nilai rata-rata densitas turun dari 6,98x104 ind/ml pada awal
perlakuan (jam ke-0) menjadi 4,16x104 ind/ml, walaupun sempat mengalami
kenaikan pada jam ke-24. Pada masa istirahat nilai rata-rata densitas mengalami
kenaikan menjadi 5,17 x104 ind/ml (jam 144). Namun pada masa peningkatan II,
nilai rata-rata densitas mengalami penurunan kembali yaitu menjadi 4,61x104
ind/ml yang sebelumnya mengalami peningkatan terlebih dahulu
pada jam ke-168.
Analisis ragam (ANOVA) yang dilakukan terhadap data densitas
zooxanthellae saat jam ke-48, pada selang kepercayaan 95%, pemberian perlakuan
menunjukkan adanya perbedaan densitas yang nyata. Berdasarkan hal tersebut,
uji lanjut BNT dilakukan terhadap data pada jam ke-48 yang menunjukkan bahwa
perlakuan dengan suhu 30o C berbeda nyata dengan kontrol (suhu 28o C) dan
perlakuan dengan suhu 29o C tidak berbeda nyata baik dengan perlakuan suhu
Analisis yang dilakukan terhadap data densitas pada jam ke-24, 144, 162, dan
192, pemberian perlakuan menunjukan tidak adanya perbedaan densitas
yang nyata. Hasil perhitungan analisis ragam dapat dilihat pada Lampiran 6.
4.1.2.2. Mitotik indeks (MI) zooxanthellae
Kondisi mitotik indeks zooxanthellae pada masa perlakuan (Peningkatan I dan
II) dapat dilihat pada Gambar 9. Kondisi rata-rata MI zooxanthellae pada anemon
kontrol tidak terlalu berfluktuasi. Pada masa peningkatan I, nilai rata-rata MI
mengalami peningkatan dari 3,33% pada awal perlakuan (jam ke-0) menjadi
3,82%. Pada masa istirahat nilai rata-rata MI mengalami peningkatan yang besar
yaitu sebesar 3,02% menjadi 6,89% pada jam 144. Namun pada masa
peningkatan II, selain terjadi peningkatan nilai rata-rata juga terjadi penurunan
yaitu pada jam ke-192 yang bernilai 7,11%.
Perlakuan satu dan dua memperlihatkan pola nilai rata-rata MI pada masa
peningkatan I, istirahat, dan peningkatan II yang tidak jauh berbeda. Pada masa
peningkatan I, nilai rata-rata MI mengalami kenaikan pada jam ke-24 dan
penurunan pada jam ke-48. Namun sampai jam ke-48 secara keseluruhan
perlakuan satu mengalami penururan sebesar 0,51%, sedangkan perlakuan dua
mengalami kenaikan sebesar 0,36% . Pada masa istirahat, nilai rata-rata MI
mengalami kenaikan kembali (jam ke-144) yaitu sebesar 4,88% untuk perlakuan
satu dan 3,77% untuk perlakuan dua. Kemudian pada masa peningkatan II, terjadi
penurunan yang diikuti kenaikan nilai rata-rata MI sehingga pada jam ke-192 nilai
rata-rata MI berkurang sebanyak 3,04% untuk perlakuan satu dan 2,86% untuk
Gambar 9. Nilai Rata-rata dan Standard Error Mitotik Indeks Zooxanthellae Pada Masa Peningkatan I (0, 24, 48) dan Peningkatan II (144, 168, 192) catatan : pengambilan sampel dilakukan pada pukul 10.00 WIB
0 2 4 6 8 10 12 14
0 24 48 144 168 192
M it ot ik I nde k s (% )
Waktu (jam ke-)
Kontrol (28
oC)
0 2 4 6 8 10 12 14
0 24 48 144 168 192
M it ot ik I nde k s (% )
Waktu (jam ke-)
Perlakuan 1 (29
oC)
0 2 4 6 8 10 12 14
0 24 48 144 168 192
M it ot ik I nde k s (% )
Waktu (jam ke-)
Perlakuan 2 (30
oC)
28oC 28oC 28oC
29oC 28oC 29oC
Analisis ragam (ANOVA) yang dilakukan terhadap data mitotik indeks
zooxanthellae saat jam ke ke-24, pada selang kepercayaan 95% menunjukkan
bahwa terdapat perbedaan yang nyata antara ketiga perlakuan. Berdasarkan hal
tersebut, uji lanjut BNT dilakukan terhadap data pada jam ke ke-24 yang
menunjukkan bahwa perlakuan dengan suhu 300C berbeda nyata dengan kontrol
(suhu 280C) dan perlakuan dengan suhu 290C tidak berbeda nyata baik dengan
perlakuan suhu 300C maupun 280C. Analisis yang dilakukan terhadap data
densitas pada jam ke-48, 144, 162, dan 192 menunjukan tidak adanya perbedaan
yang nyata antara ketiga perlakuan. Hasil perhitungan analisis ragam dapat dilihat
pada Lampiran 6.
4.1.3. Pengamatan preparat histologi
Pengamatan pada preparat histologis dilakukan pada empat parameter yaitu
densitas, luasan sel dan mitotik indeks zooxanthellae dan rasio ketebalan lapisan
endoderm dan ektoderm. Secara umum bagian-bagian tubuh pada tentakel
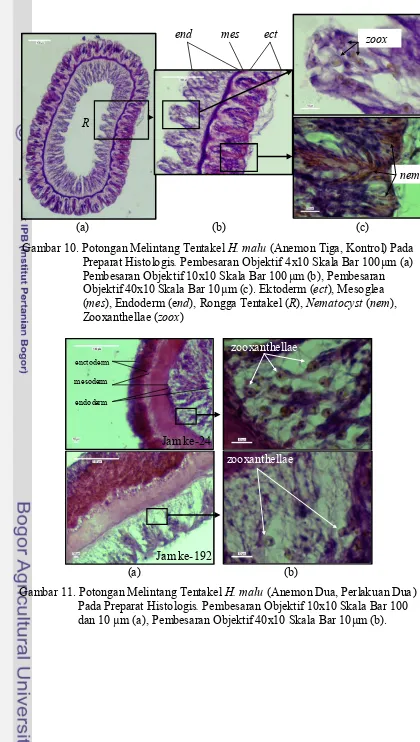
anemon hasil pengamatan pada preparat histologis dapat dilihat pada Gambar 10.
Bagian preparat histologis yang diamati adalah zooxanthellae pada bagian
endoderm (Gambar 10(c)) dan ketebalan lapisan endoderm dan ektoderm.
4.1.3.1. Densitas zooxanthellae
Gambar 11 memperlihatkan adanya perubahan kondisi kepadatan
zooxanthellae pada lapisan endoderm tentakel anemon pasir pada perlakuan dua
pada jam ke-24 dan 192. Terlihat semakin berkurangnya kepadatan sel
(a) (b) (c)
Gambar 10. Potongan Melintang Tentakel H. malu (Anemon Tiga, Kontrol) Pada Preparat Histologis. Pembesaran Objektif 4x10 Skala Bar 100µm (a) Pembesaran Objektif 10x10 Skala Bar 100 µm (b), Pembesaran Objektif 40x10 Skala Bar 10µm (c). Ektoderm (ect), Mesoglea (mes), Endoderm(end), Rongga Tentakel (R), Nematocyst (nem), Zooxanthellae (zoox)
(a) (b)
Gambar 11. Potongan Melintang Tentakel H. malu (Anemon Dua, Perlakuan Dua) Pada Preparat Histologis. Pembesaran Objektif 10x10 Skala Bar 100 dan 10 µm (a), Pembesaran Objektif 40x10 Skala Bar 10µm (b).
ect
end mes zoox
nem R
Jam ke-24
Jam ke-192
zooxanthellae zooxanthellae enctoderm
Pada Gambar 12, dapat terlihat kondisi rata-rata densitas zooxanthellae yang
mengalami perubahan pada setiap 24 jam pengamatan. Pada masa peningkatan I
anemon kontrol mengalami sedikit penurunan nilai rata-rata densitas dari
6,90x105 ind/cm2 pada jam 0 menjadi 6,49x105 ind/cm2 pada jam ke-48. Pada
masa istirahat dan peningkatan II, nilai rata-rata densitas cenderung naik sampai
pada densitas 1,01x106 ind/cm2 pada jam ke-192.
Anemon dengan perlakuan satu memperlihatkan hal yang berlawanan pada
masa peningkatan I dan II. Pada masa peningkatan I terjadi penurunan nilai
densitas dari 8,03x105 ind/cm2 pada jam ke 0 menjadi 5,97x105 ind/cm2 pada jam
ke-48. Pada masa peningkatan II terjadi kenaikan densitas zooxanthellae dari
6,78x105 ind/cm2 pada jam ke-144 (setelah terjadi kenaikan terlebih dahulu pada
masa istirahat) menjadi 7,51x105 ind/cm2 pada jam ke ke-192.
Kondisi rata-rata densitas zooxanthellae pada anemon dengan perlakuan dua
menunjukan fluktuasi yang besar, terutama pada masa peningkatan I terjadi
peningkatan yang besar pada jam ke-24 yaitu dari 2,22x105 ind/cm2 pada jam ke-0
menjadi 7,45x105 ind/cm2 pada jam ke-24. Namun terjadi penurunan pada jam
ke-48 menjadi 5,70x105 ind/cm2. Pada masa istirahat terjadi peningkatan nilai
rata-rata densitas, sebelum terjadinya penurunan kembali pada masa peningkatan
II sehingga nilai rata-rata pada jam ke-192 menjadi 5,65x105 ind/cm2 dari
7,87x105 ind/cm2 pada jam ke-144 setelah masa istirahat.
Analisis ragam (ANOVA) yang dilakukan terhadap data densitas
zooxanthellae saat jam ke-24, 48, 144, 168 dan 192, pada selang kepercayaan
95%, perlakuan tidak menunjukan adanya perbedaan nilai densitas yang nyata.
Gambar 12. Nilai Rata-rata dan Standard Error Densitas Zooxanthellae Pada Masa Peningkatan I (0, 24, 48) dan Peningkatan II (144, 168, 192) Berdasarkan Pengamatan Preparat Histologis
catatan : pengambilan sampel dilakukan pada pukul 10.00 WIB 0.00E+00 2.00E+05 4.00E+05 6.00E+05 8.00E+05 1.00E+06 1.20E+06 1.40E+06
0 24 48 144 168 192
D e ns it a s (i nd/ cm 2)
Waktu (jam ke-)
Kontrol (28
oC)
0.00E+00 2.00E+05 4.00E+05 6.00E+05 8.00E+05 1.00E+06 1.20E+06 1.40E+06
0 24 48 144 168 192
D e ns it a s (i nd/ cm 2)
Waktu (jam ke-)
Perlakuan 1 (29
oC)
0.00E+00 2.00E+05 4.00E+05 6.00E+05 8.00E+05 1.00E+06 1.20E+06 1.40E+06
0 24 48 144 168 192
D e ns it a s (i nd / cm 2)
Waktu (jam ke-)
Perlakuan 2 (30
oC)
28oC 28oC 28oC
30oC 28oC 30oC 29oC 28oC 29oC
4.1.3.2. Mitotik indeks zooxanthellae
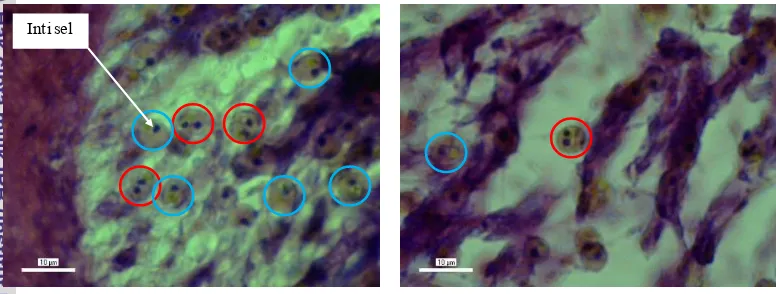
Gambar 13 memperlihatkan beberapa contoh sel yang sedang mengalami
pembelahan mitosis. Terlihat perbedaan antara sel pada kondisi normal dan sel
pada kondisi pembelahan mitosis. Sel pada kondisi pembelahan dicirikan dengan
terlihatnya dua inti sel dalam sel tersebut.
[image:46.596.118.506.221.368.2]
Gambar 13. Sel Zooxanthellae Anemon Dua Perlakuan Dua Pada Kondisi Pembelahan Mitosis (Lingkaran Merah) dan Pada Kondisi
Normal (Lingkaran Biru). Pembesaran Objektif 40x10. Skala Bar 100µm.
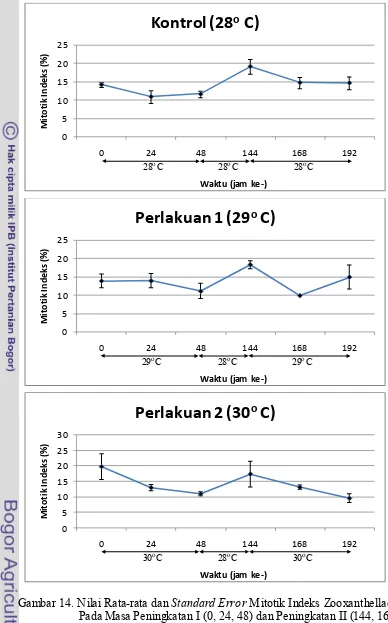
Kondisi rata-rata mitotik indeks (MI) pada anemon kontrol dan perlakuan
dapat dilihat pada Gambar 14. Secara keseluruhan perubahan kondisi rata-rata MI
pada kontrol dan perlakuan mempunyai pola yang sama, yaitu mengalami
penurunan pada masa peningkatan I, kenaikan pada masa istirahat, dan penurunan
kembali pada masa peningkatan II. Anemon kontrol mengalami penurunan yang
tidak besar pada masa peningkatan I dan II (2,55% dari jam ke 0 sampai jam ke 48
dan sebesar 4,5% dari jam ke-144 sampai jam ke-192). Kenaikan yang cukup
besar terjadi yaitu pada masa istirahat sebesar 7,5%. Anemon pada perlakuan
satu, memperlihatkan penurunan yang tidak besar juga pada masa peningkatan I
(2,73% dari jam ke-0 sampai jam ke-48). Kemudian terjadi kenaikan yang cukup
besar pada masa istirahat yaitu sebesar 7,07%. Setelah itu terjadi penurunan
Gambar 14. Nilai Rata-rata dan Standard Error Mitotik Indeks Zooxanthellae Pada Masa Peningkatan I (0, 24, 48) dan Peningkatan II (144, 168, 192) Berdasarkan Pengamatan Preparat Histologis
catatan : pengambilan sampel dilakukan pada pukul 10.00 WIB 0 5 10 15 20 25
0 24 48 144 168 192
M it ot ik I nde k s (% )
Waktu (jam ke-)
Kontrol (28
oC)
0 5 10 15 20 25
0 24 48 144 168 192
M it ot ik I nde k s (% )
Waktu (jam ke-)
Perlakuan 1 (29
oC)
0 5 10 15 20 25 30
0 24 48 144 168 192
M it ot ik I nd e k s (% )
Waktu (jam ke-)
Perlakuan 2 (30
oC)
30oC 28oC 30oC 28oC 28oC 28oC
yang besar pada jam ke-168 yaitu 8,20%, kemudian naik kembali sebesar 4,90%
pada jam ke-192.
Anemon pada perlakuan dua memperlihatkan penurunan yang cukup besar
pada masa peningkatan I dan II. Penurunan yang terjadi yaitu sebesar 8,67% dari
nilai awal pada jam ke-0, sedangkan pada peningkatan II terjadi penurunan
sebesar 7,68 % setelah terjadi peningkatan sebesar 6,28% pada masa istirahat.
Analisis ragam (ANOVA) yang dilakukan terhadap data mitotik indeks
zooxanthellae saat jam ke-24, 48, 144, 168 dan 192, pada selang kepercayaan
95%, perlakuan tidak menunjukkan adanya perbedaan nilai mitotik indeks yang
nyata. Hasil perhitungan analisis ragam dapat dilihat pada Lampiran 7.
4.1.3.3. Rasio ketebalan endoderm dan ektode rm
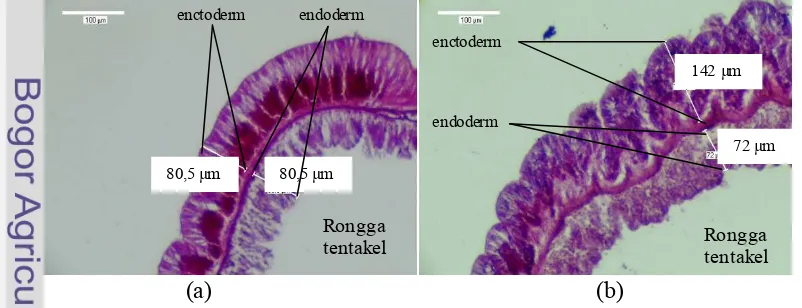
Hasil pengamatan rasio ketebalan lapisan endoderm dan ektoderm tentakel
zooxanthellae pada preparat histologis dapat dilihat pada Gambar 15 dan 16.
Gambar 15 memperlihatkan contoh terjadinya perubahan ketebalan lapisan
endoderm dan ektoderm pada tentakel anemon pasir (anemon dua pada
perlakuan satu).
[image:48.596.104.505.543.697.2](a) (b)
Gambar 15. Potongan Melintang Tentakel H. malu (Anemon Dua, Perlakuan Satu) Pada Preparat Histologis. Pembesaran Objektif 4x10 Skala Bar 100µm. Pada Jam ke-0 (a) dan Jam ke-192 (b)
enctoderm endoderm
enctoderm
endoderm
80,5 µm 80,5 µm
142 µm
72 µm
Rongga
Gambar 16 menunjukan nilai rata-rata rasio ketebalan endoderm dan ektoderm
(end/ect) pada masa peningkatan I, istirahat, dan peningkatan II. Secara
keseluruhan perubahan/fluktuasi nilai rasio cukup stabil walaupun cenderung
menurun untuk perlakuan satu (jam ke-0 sampai jam ke-192). Tidak banyak
perubahan yang terjadi, misalnya pada perlakuan satu dan dua pada masa
peningkatan I, nilai rata-rata rasio meningkat tipis dari 0,92 pada jam 0 menjadi
0,95 pada jam ke-48 untuk perlakuan satu dan 0,83 pada jam 0 menjadi 0,85 pada
jam ke-48 untuk perlakuan dua. Pada masa istirahat hanya perlakuan dua yang
mengalami peningkatan nilai rata-rata rasio yaitu menjadi 1,02 pada jam ke-144.
Pada masa peningkatan II, perlakuan satu cenderung mengalami peningkatan nilai
rasio dibanding dengan perlakuan dua yang cenderung mengalami penurunan nilai
rata-rata rasio.
Analisis ragam (ANOVA) yang dilakukan terhadap data rasio ketebalan
endoderm dan ektoderm saat jam ke-24, 48, 144, 168 dan 192, pada selang
kepercayaan 95%, perlakuan tidak menunjukkan adanya perbedaan nilai rasio
yang nyata. Hasil perhitungan analisis ragam dapat dilihat pada Lampiran 7.
4.1.3.4. Luas sel zooxanthellae
Gambar 17 memperlihatkan beberapa contoh ukuran sel pada anemon yang
diberikan perlakuan. Pada Gambar 17, terlihat adanya perubahan keberadaan sel
yang berukuran besar menjadi sel yang berukuran lebih kecil (Gambar 17(b))
Gambar 16. Nilai Rata-rata dan Standard Error Rasio Ketebalan Endoderm dan Ektoderm (end/ect) Pada Masa Peningkatan I (0, 24, 48) dan Peningkatan II (144, 168, 192) Berdasarkan Pengamatan Preparat Histologis
catatan : pengambilan sampel dilakukan pada pukul 10.00 WIB 0
0.5 1 1.5 2
0 24 48 144 168 192
R a si o e nd / e ct
Waktu (jam ke-)
Kontrol (28
oC)
0 0.5 1 1.5 2
0 24 48 144 168 192
R a si o e nd/ e ct
Waktu (jam ke-)
Perlakuan 1 (29
oC)
0 0.5 1 1.5 2
0 24 48 144 168 192
R a si o e nd/ e ct
Waktu (jam ke-)
Perlakuan 2 (30
oC)
28oC 28oC 28oC
29oC 28oC 29oC
(a) (b)
Gambar 17. Zooxanthellae Pada Lapisan Endoderm Tentakel H. malu (Anemon Dua, Perlakuan Satu) Pada Preparat Histologis. Pembesaran
Objektif 40x10 Skala Bar 10µm. Pada Jam ke-0 (a), Jam ke-192 (b)
Berdasarkan Gambar 18, secara keseluruhan rata-rata luas sel zooxanthellae
pada secara keseluruhan berada pada kisaran 20-25 µm2 untuk kontrol dan 15-25
µm2 untuk akuarium yang diberikan perlakuan. Pada anemon kontrol, nilai
rata-rata luas sel cenderung menurun (jam ke-0 sampai jam ke-192) yaitu 23,92 µm2
pada jam ke-0 menjadi 21,33 µm2 pada jam ke-192. Anemon pada perlakuan
satu, mengalami penurunan yang terus menerus dari jam ke-0 sampai jam ke-168,
kemudian nilai rata-rata naik pada akhir perlakuan menjadi 24,77 µm2 pada jam ke
192 dari 23,79 µm2 pada jam ke-0. Berbeda dengan perlakuan satu, perlakuan dua
mengalami kenaikan pada masa peningkatan II mulai dari jam ke-144, walapun
sebelumya mengalami penurunan pada masa istirahat maupun peningkatan I.
Analisis ragam (ANOVA) yang dilakukan terhadap data luas sel zooxanthellae
saat jam ke-24, 48, 144, 168 dan 192, pada selang kepercayaan 95%, perlakuan
tidak menunjukkan adanya perbedaan luasan sel yang nyata. Hasil perhitungan
analisis ragam dapat dilihat pada Lampiran 7.
zooxanthellae zooxanthellae
6,25 µm
6,62 µm
6,55 µm 6,5 µm
4,77 µm
4,2 µm
Gambar 18. Nilai Rata-rata dan Standard Error Luas Sel Zooxanthellae Pada Masa Peningkatan I (0, 24, 48) dan Peningkatan II (144, 168, 192) Berdasarkan Pengamatan Preparat Histologis
catatan : pengambilan sampel dilakukan pada pukul 10.00 WIB 0 5 10 15 20 25 30
0 24 48 144 168 192
L u a s (µ m 2)
Waktu (jam ke-)
Kontrol (28
oC)
0 5 10 15 20 25 30
0 24 48 144 168 192
L u a s (µ m 2)
Waktu (jam ke-)
Perlakuan 1 (29
oC)
0 5 10 15 20 25 30
0 24 48 144 168 192
L u a s (µ m 2)
Waktu (jam ke-)
Perlakuan 2 (30
oC)
28oC 28oC 28oC
29oC 28oC 29oC
4.2. Pembahasan
4.2.1. Adaptasi fisiologi
Adaptasi merupakan penyesuaian atau perubahan dari tingkah laku, fisiologi,
dan struktur untuk menjadi lebih sesuai dengan keadaan lingkungan
(biology-online.org, 2011). Pada penelitian ini, proses adaptasi fisiologis H. malu terhadap
kenaikan suhu perairan diamati pada beberapa parameter yaitu densitas, mitotik
indeks dan ukuran luas sel zooxanthellae juga morfologi anemon berupa rasio
ketebalan lapisan endoderm dan ektoderm. Pengamatan terutama dilakukan pada
masa pemberian perlakuan yaitu peningkatan I dan II, sedangkan pada masa
istirahat anemon di beri kesempatan untuk berada pada kondisi lingkungan yang
normal (seperti kontrol) sebelum diberikan perlakuan kembali (peningkatan II).
Masa peningkatan I (perlakuan) yang diberikan bertujuan sebagai masa
adaptasi anemon terhadap stress yang diberikan. Masa istirahat yang diberikan
bertujuan untuk memberikan waktu kepada anemon untuk kembali pulih
(diharapkan kondisi anemon kembali sehat) terutama untuk kondisi metabolisme
oksigen (O2). Berdasarkan hasil penelitian Guldberg dan Smith (1989), kondisi
metabolisme oksigen (O2) hewan karang yang telah mengalami stress akibat
kenaikan suhu, akan mengalami ketidaknormalan hingga 4 hari. Masa
peningkatan II, diberikan sebagai percobaan apakah anemon dapat
bertahan/beradaptasi terhadap perubahan suhu yang terjadi setelah menerima
stress terlebih dahulu pada masa peningkatan I.
Berdasarkan hasil yang diperoleh, dapat dilihat pola peningkatan dan
penurunan kondisi kesehatan anemon yang diamati dari parameter densitas,
tersebut dapat dilihat pada Tabel 2 berikut.
Tabel 2. Nilai Perubahan Untuk Setiap Parameter Pengamatan Pada Preparat Segar dan Histologis
No Para meter Perla kuan Peningkatan I Istirahat Peningkatan II 24 48 144 168 192
preparat segar
1
Densitas (ind/ml)
Suhu 28oC -5,56x10 1,63 x104 -7,33 x103 -5,67 x103 -1,28 x103
Suhu 29oC -2,91 x104 2,22 x102 1,70 x104 -1.28 x104 4.42 x103
Suhu 30oC 5,67 x103 -3,39 x104 1,02 x104 6,11 x103 -1,18 x104
2
Mitotik indeks (%)
Suhu 28oC 0,31 0,18 3,07 0,31 -0,09
Suhu 29oC 0,93 -1,44 4,88 -4,40 1,37
Suhu 30oC 2,67 -2,31 3,78 -3,16 0,29
preparat histologis
3 Densitas
(ind/cm2)
Suhu 28oC 1,18 x105 -1,69 x105 1,75 x105 -5,08 x104 2,35 x105
Suhu 29oC 5,99 x102 -2,06 x105 8,07 x104 -8,85 x104 1,62 x105
Suhu 30oC 5,23 x105 -1,75 x105 2,17 x105 -1,77 x105 -4,61 x104
4 Mitotik indeks
(%)
Suhu 28oC -3,29 0,73 7,50 -4,40 -0,08
Suhu 29oC 0,03 -2,77 7,10 -8,27 4,93
Suhu 30oC -6,69 -1,98 6,29 -4,18 -3,53
5 Rasio
Suhu 28oC -0,18 0,13 -0,04 0,36 0,02
Suhu 29oC -0,03 0,06 -0,08 -0,15 0,16
Suhu 30oC 0,08 -0,06 0,17 -0,23 0,06
6 luas sel
(µm2)
Suhu 28oC -0,89 -0,02 -2,55 1,68 -0,81
Suhu 29oC -1,39 -1,38 -0,34 -1,56 5,65
Suhu 30oC -2,59 0,69 -2,97 1,16 1,26
Hasil penelitian menunjukkan bahwa pengamatan densitas pada preparat segar
memperlihatkan pola yang sama pada masa peningkatan I dan peningkatan II,
namun dengan nilai perubahan yang berbeda. Nilai perubahan pada masa
peningkatan I cenderung lebih besar dari pada peningkatan II, kemudian pada
masa istirahat juga terjadi peningkatan nilai rata-rata densitas. Sehingga dapat
dikatakan untuk parameter densitas pada preparat segar untuk perlakuan dua,
anemon mengalami penyesuaian terhadap kenaikan suhu perairan. Hal tersebut
adanya perbedaan yang nyata pada selang kepercayaan 95% antara kontrol (suhu
28oC) dan perlakuan dua (suhu 30oC) pada jam ke-48 (peningkatn I) sedangkan
pada masa peningkatan II analisis ragam menyatakan tidak adanya perbedaan
yang nyata.
Pengamatan mitotik indeks pada preparat segar memperlihatkan perbedaan
pola perubahan nilai antara masa peningkatan I dan II. Pada masa peningkatan I
terjadi kenaikan nilai mitotik indeks pada jam ke-24 sebagai respon stress,
sedangkan pada peningkatan II tidak terlihat adanya respon stress berupa
kenaikan nilai mitotik indeks pada awal dimulainya peningkatan II. Berdasarkan
hasil analisis ragam dan uji BNT, pada masa peningkatan I (jam ke-24) terjadi
perbedaan nilai yang nyata pada selang kepercayaan 95% antara kontrol (suhu
28oC) dan perlakuan dua (suhu 30oC), sedangkan pada masa peningkatan II
analsis ragam menyatakan tidak adanya perbedaan yang nyata. Sehingga dapat
dikatakan untuk parameter mitotik indeks pada preparat segar untuk perlakuan
d