RESISTENSI BIBIT JABON PUTIH DAN MERAH (Anthocephalus spp.)
TERHADAP SERANGAN Botryodiplodia theobromae
PENYEBAB PENYAKIT MATI PUCUK
LOLA ADRES YANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
* Pelimpahan hak cipta atas karya tulis dari penelitian kerja sama dengan pihak luar IPB harus
didasarkan pada perjanjian kerja sama yang terkait.
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK
CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Resistensi Bibit Jabon Putih dan Merah (Anthocephalus spp.) terhadap Serangan Botryodiplodia theobromae Penyebab Penyakit Mati Pucuk adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2015
RINGKASAN
LOLA ADRES YANTI. Resistensi Bibit Jabon Putih dan Merah (Anthocephalus spp.) terhadap Serangan Botryodiplodia theobromae Penyebab Penyakit Mati Pucuk. Dibimbing oleh ACHMAD dan NURUL KHUMAIDA.
Bibit jabon putih dan merah sangat digemari para pembudidaya karena berbagai manfaat dan dapat meningkatkan kesejahteraan ekonomi. Permasalahan utama dalam pembibitan tanaman kehutanan adalah hama dan penyakit. Salah satu penyakit yang banyak menyerang bibit adalah penyakit mati pucuk. Penyakit mati pucuk disebabkan oleh B. theobromae, yang dapat menyebabkan kematian inang. Patogen dapat menyerang secara pasif dan aktif. Setiap tanaman memiliki mekanisme resistensi terhadap serangan patogen, baik struktural maupun biokimia, sebelum dan sesudah serangan patogen.
Penelitian ini bertujuan untuk: (1) menguji serangan B. theobromae dengan cara infeksi tanpa maupun dengan pelukaan batang bibit jabon; (2) mempelajari resistensi bibit jabon secara struktural dan biokimia terhadap serangan B. theobromae; (3) mempelajari interaksi antara spesies bibit jabon dan cara infeksi terhadap resistensi bibit jabon; (4) memperoleh spesies bibit jabon yang lebih resisten terhadap serangan B. theobromae.
Penelitian ini menggunakan rancangan acak lengkap faktorial (RALF) dengan mengkombinasikan spesies bibit jabon dan cara infeksi. Resistensi struktural diamati dengan mempelajari kondisi mikroskopis batang bibit jabon yang sehat dan terinfeksi patogen menggunakan scanning electron microscope. Resistensi biokimia dilakukan dengan melihat komponen senyawa kimia bibit jabon menggunakan analisis fitokimia.
Kejadian penyakit mati pucuk pada bibit jabon merah dengan cara infeksi tanpa pelukaan batang lebih luas, yaitu sebesar 80% dibandingkan dengan bibit jabon putih sebesar 30%. Keparahan penyakit mati pucuk pada bibit jabon merah dengan cara infeksi tanpa pelukaan batang lebih berat yaitu sebesar 16% dibandingkan dengan bibit jabon putih sebesar 12%. Respon spesies bibit jabon dan cara infeksi tanpa pelukaan batang terhadap keparahan penyakit mati pucuk menunjukkan berat yang sama besar.
Kejadian penyakit mati pucuk pada bibit jabon putih dan merah dengan cara infeksi pelukaan batang masing-masing sebesar 100%. Keparahan penyakit mati pucuk pada bibit jabon putih dengan cara infeksi pelukaan batang lebih berat, yaitu sebesar 62% dibandingkan dengan bibit jabon merah sebesar 38%. Respon spesies bibit jabon dan cara infeksi pelukaan batang terhadap kejadian penyakit mati pucuk menunjukkan luas yang sama tinggi, sedangkan keparahan penyakit terberat terjadi pada bibit jabon putih. Kejadian dan keparahan penyakit pada bibit jabon dengan cara infeksi pelukaan batang lebih luas dan berat dibandingkan dengan cara infeksi tanpa pelukaan batang.
triterpenoid dan steroid, sedangkan pada bibit jabon putih hanya terdapat senyawa steroid. Sesudah serangan patogen pada bibit jabon merah, resistensi biokimia ditunjukkan dengan terjadinya peningkatan akumulasi senyawa fenol hidrokuinon, tanin dan kadar yang tetap pada flavanoid, sedangkan bibit jabon putih mengalami peningkatan akumulasi senyawa flavanoid, tanin dan penurunan fenol hidrokuinon.
(Anthocephalus spp.) to Botryodiplodia theobromae Causing Dieback Disease. Supervised by ACHMAD and NURUL KHUMAIDA.
White and red jabon seedlings are very popular to nurserier, because of the benefits and can improve the economic. The main problem in nurseries are insects and diseases attack. One of the diseases is dieback disease. Dieback disease is caused by B. theobromae, that can make the seedlings death. These pathogens can attack passively and actively. Every plant has a mechanism of resistance to pathogen attack, either structural or biochemical, before and after attacked.
This research aimed: (1) to test B. theobromae attacked with non wounded and wounded stem infection methods in jabons; (2) to study the structural and biochemical resistance of jabons to B. theobromae attacked; (3) to study the interaction between the species of jabons and stem infection methods in jabons to the resistance of jabon seedlings; (4) to obtain the most resistance species of jabons to B. theobromae attacked.
This research used factorial completely randomized design that combined the species of jabons and stem infection methods in seedling. The structural resistance was done with studying the microscopy of infected and non infected jabon used scanning electron microscope. The biochemical resistance was done with studying the chemical compound of Jabons used phytochemistry analysis.
The disease incidency of red jabon seedlings with non wounded stem infection methods were 80%, that were wider than white jabon seedlings were 30%. The disease severity of red jabon seedlings with non wounded stem infection methods were 16%, that were worse than white jabon seedlings were 12%. The response of the species of jabons and non wounded stem infection method for the disease severity showed the same severity.
The disease incidency of red and white jabon seedlings with wounded stem infection methods were 100%. The disease severity of white jabon seedlings with wounded stem infection methods were 62%, that were worse than red jabon seedlings were 38%. The response of the species of jabons and wounded stem infection method for the disease incidency showed the same width high, but, the disease severity of white jabon seedlings were worse than red jabon seedlings. The incidency and the severity of disease in jabons with wounded stem infection methods were wider and worse than jabons with non wounded stem infection methods.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PENYEBAB PENYAKIT MATI PUCUK
LOLA ADRES YANTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Silvikultur Tropika
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang dilaksanakan sejak bulan April sampai Desember 2014 adalah Resistensi Bibit Jabon Putih dan Merah (Anthocephalus spp.) terhadap Serangan Botryodiplodia
theobromae Penyebab Penyakit Mati Pucuk. Satu naskah dengan judul Uji
Resistensi Bibit Jabon Putih dan Merah (Anthocephalus spp.) terhadap Serangan Botryodiplodia theobromae Penyebab Penyakit Mati Pucuk telah diterima pada Jurnal Silvikultur Tropika dan sedang menunggu proses penerbitan.
Terima kasih penulis ucapkan kepada Prof Dr Ir Achmad, MS dan Dr Ir Nurul Khumaida, MS selaku pembimbing yang telah membimbing penulis untuk menyelesaikan studi. Penulis menyampaikan terima kasih kepada Dr Ir Bonny PW Soekarno, MS selaku dosen penguji ujian tesis saya dan Prof Dr Ir Nurheni Wijayanto, MS selaku moderator ujian tesis, yang telah banyak memberikan masukan untuk kesempurnaan penulisan tesis. Terima kasih juga disampaikan kepada Bakrie Center Foundation yang telah memberikan beasiswa studi selama setahun dan membantu pembiayaan kegiatan penelitian hingga akhirnya tesis ini dapat disusun. Tak lupa penulis ucapkan terima kasih kepada Kepala Laboratorium Patologi Hutan, Laboratorium Kimia Kayu, dan Laboratorium Kimia Analitik IPB, serta Pusat Penelitian Zoologi LIPI Cibinong. Terima kasih kepada Kepala BPDAS Citarum-Ciliwung di Persemaian Permanen Kampus IPB Dramaga yang telah memberikan izin pada penulis untuk melaksanakan kegiatan penelitian di lingkungan kerjanya. Terima kasih pula penulis sampaikan kepada Ibu Ai Rosah Aisah, SHut MSi, Ibu Tutin BScF, Bapak Suprihatin, Bapak Ismail, Ibu Encah, Bapak Eter Cahyadi, SHut, Ibu Nunung, Ibu Yuni dan Ibu Endang LIPI Cibinong, Ibu Illa Anggraeni, Bapak Taufan, dan rekan-rekan mahasiswa Silvikultur Tropika angkatan 2012, serta rekan-rekan mahasiswa S1 dan S2 yang berada di lingkup Laboratorium Patologi Hutan, serta semua pihak yang telah membantu teknis pelaksanaan penelitian ini. Ungkapan terima kasih dan rasa hormat yang mendalam juga penulis sampaikan kepada Ayah, Ibu, dan Adik-adik tersayang, serta keluarga besar yang senantiasa mendukung dan memberikan dorongan moral.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2015
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
1 PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis Penelitian 4
Kerangka Pemikiran 4
2 TINJAUAN PUSTAKA
Jabon Putih (Anthocephalus cadamba (Roxb.) Miq.) 6 Jabon Merah (Anthocephalus macrophyllus (Roxb.) Havil.) 7
Perbedaan Jabon Merah dan Jabon Putih 8
Botryodiplodia theobromae 10
Mekanisme Infeksi Patogen terhadap Tanaman Inang 12
Resistensi Inang terhadap Serangan Patogen 14
3 BAHAN DAN METODE
Waktu dan Tempat 21
Bahan dan Alat 21
Metode 22
Analisis Data 28
4 HASIL DAN PEMBAHASAN Hasil
Karakteristik Makroskopis dan Mikroskopis Isolat B. theobromae 28 Resistensi Bibit Jabon terhadap Serangan Patogen 29 Resistensi Struktural Batang Bibit Jabon (Anthocephalus spp.) 35 Resistensi Biokimia Batang Bibit Jabon (Anthocephalus spp.) 37
Pembahasan Umum 38
5 SIMPULAN DAN SARAN
Simpulan 48
Saran 48
DAFTAR PUSTAKA
LAMPIRAN
DAFTAR TABEL
1 Karakteristik morfologi jabon merah dan putih 9 2 Kandungan senyawa primer pada daun jabon merah dan putih (%) 9 3 Kandungan senyawa metabolit sekunder pada daun jabon
merah dan putih (A. macrophyllus dan A. cadamba) berumur 7 bulan 10 4 Nilai numerik kategori serangan dan keparahan penyakit mati
pucuk pada bibit jabon 25
5 Respon spesies bibit jabon dan cara infeksi terhadap kejadian
penyakit mati pucuk 33
6 Respon spesies bibit jabon dan cara infeksi terhadap keparahan
penyakit mati pucuk 33
7 Masa inkubasi bibit jabon putih dan merah terhadap serangan
patogen B. theobromae 34
8 Temperatur dan kelembapan selama 14 hari pengamatan 35 9 Keragaan fitokimia senyawa metabolit sekunder bibit jabon
(Anthocephalus spp.) 38
DAFTAR GAMBAR
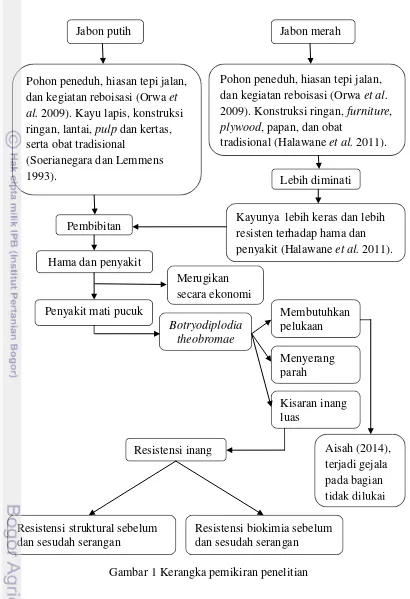
1 Kerangka pemikiran penelitian 5
2 Karakteristik mikroskopis Botryodiplodia theobromae 11 3 Struktur anatomi batang bibit Tilia americana 12 4 Mekanisme serangan M. graminicola selama 11 hari pengamatan 13 5 Kondisi mikroskopis penampang batang bibit jambu monyet
umur 2 bulan yang terserang L. theobromae 15
6 Tahapan penelitian resistensi bibit jabon putih dan
merah terhadap serangan patogen B. theobromae 22 7 Nilai numerik kategori serangan dan keparahan penyakit mati pucuk
pada bibit jabon 26
8 Miselium B. theobromae yang berumur 3 hari setelah tanam (HST) 28
9 Karakteristik mikroskopis B. theobromae 29
10 Kondisi bibit jabon putih dan merah perlakuan kontrol 30 11 Kondisi bibit jabon putih selama 14 hari pengamatan 31 12 Kondisi bibit jabon merah selama 14 hari pengamatan 32 13 Kondisi mikroskopis penampang melintang batang bibit jabon putih 36 14 Kondisi mikroskopis penampang melintang batang bibit jabon merah 37
DAFTAR LAMPIRAN
1 Rekapitulasi sidik ragam spesies bibit jabon dan cara infeksi
pada kejadian penyakit mati pucuk 57
2 Rekapitulasi sidik ragam spesies bibit jabon dan cara infeksi
pada keparahan penyakit mati pucuk 57
1 PENDAHULUAN
Latar Belakang
Jabon putih dan merah merupakan tanaman fast growing, yang banyak diminati saat ini. Kedua jenis jabon ini banyak digunakan sebagai pohon peneduh, hiasan tepi jalan, dan dalam kegiatan reboisasi (Orwa et al. 2009). Menurut Soerianegara dan Lemmens (1993), jabon putih dan merah dapat dimanfaatkan untuk kayu lapis, konstruksi ringan, lantai, pulp dan kertas, langit-langit, peti, mainan, ukiran, dan obat tradisional. Jabon merah lebih diminati karena memiliki kayu yang lebih keras dan lebih resisten terhadap hama dan penyakit (Halawane et al. 2011). Dikarenakan manfaat dan keunggulannya, kedua jenis ini banyak dibudidayakan pada level pembibitan.
Permasalahan utama yang sering terjadi di pembibitan tanaman kehutanan adalah serangan hama dan penyakit. Penyakit yang banyak menyerang adalah mati pucuk, bercak, dan hawar daun. Penyakit bercak daun pada bibit jabon putih telah diidentifikasi oleh Anggraeni dan Lelana (2011) disebabkan oleh Colletotrichum sp., sedangkan menurut Herliyana et al. (2012) oleh Rhizoctonia sp. Sementara itu, penyakit hawar daun dan mati pucuk pada jabon putih berturut-turut disebabkan oleh Fusarium sp. dan Botryodiplodia sp. (Herliyana et al. 2012).
Penyakit yang menjadi fokus pada penelitian ini adalah penyakit mati pucuk, yang disebabkan oleh Botryodiplodia sp. Identifikasi secara molekuler oleh Winara (2014), menginformasikan spesies patogen penyebab mati pucuk yaitu, Botryodiplodia theobromae. Menurut Anggraeni dan Lelana (2011), Botryodiplodia sp. dilaporkan menjadi patogen pada beberapa tanaman kehutanan di Indonesia antara lain, menyebabkan bercak daun pada pulai (Alstonia sp.), merbau (Intsia bijuga Kuntze.), bakau (Rhizophora mucronata Lamk.), dan skubung (Macaranga gigantea Muell.), busuk akar pada meranti (Shorea sp.), bledok pada nyamplung (Calophyllum inophyllum Linn.), dan penyakit batang pada gaharu (Aquilaria malaccensis Lamk.). Pernyataan ini juga didukung oleh Begoude et al. (2009) bahwa, Botryosphaeriaceae mempunyai distribusi inang yang sangat luas termasuk monokotiledon, dikotiledon, gymnospermae, dan angiospermae. Patogen ini merupakan patogen lemah yang membutuhkan luka untuk menginfeksi inang, namun dapat menyerang parah (Semangun 2007). Menurut Aisah (2014), bibit jabon putih umur 4 bulan yang tidak dilukai, terdapat gejala infeksi patogen Botryodiplodia spp. Penelitian Arshinta (2013) menunjukkan bahwa, bibit jabon putih dengan umur 3, 4, dan 5 bulan mengalami kejadian penyakit masing-masing sebesar 100% dengan keparahan penyakit berturut-turut adalah 61, 42, dan 54%. Penyakit mati pucuk pada bibit jabon berpotensi menimbulkan kerusakan dan kematian bibit. Menurut Achmad et al. (2012) bahwa, semakin bertambah umur semai pinus, resistensi terhadap patogen penyakit lodoh akan semakin meningkat. Berdasarkan uraian di atas, penelitian ini menggunakan bibit jabon putih dan merah umur 5 bulan.
(Anthocephalus cadamba (Roxb.) Miq) oleh Aisah (2014), dan bioaktivitas ekstrak mahoni dan identifikasi jenis isolat Botryodiplodia sp. pada bibit jabon putih oleh Winara (2014). Namun demikian, penelitian mengenai bibit jabon merah masih jarang, terutama penelitian yang membandingkan resistensi bibit jabon putih dan merah.
Setiap tanaman memiliki mekanisme resistensi terhadap penyakit. Menurut Agrios (1997), resistensi yang dimiliki oleh tanaman dibedakan menjadi dua yaitu, resistensi struktural dan biokimia, baik sebelum dan sesudah serangan patogen. Emery (1987) bahwa, resistensi tanaman dipengaruhi oleh dua faktor yaitu, faktor genetik dan non genetik. Resistensi tanaman yang dipengaruhi oleh faktor genetik dibedakan menjadi resistensi antar spesies, umur, resistensi dalam spesies (strain), dan kerusakan bawaan. Resistensi non genetik berupa faktor abiotik, seperti temperatur, kelembapan, dan virulensi patogen. Sehingga dipilih dua jenis tanaman dari genus yang sama yaitu Anthocephalus untuk dilihat resistensi antar spesiesnya. Penilaian bibit tanaman kehutanan secara operasional mengacu pada Peraturan Direktur Jenderal Rehabilitasi Lahan dan Perhutanan Sosial (Perdirjen RLPS) No. P.05/V-Set/2009 tentang Pedoman Sertifikasi Mutu Bibit Tanaman Hutan. Bibit jabon yang bermutu harus memiliki Ø> 7 mm, tinggi > 40 cm, kekompakan media utuh, jumlah daun > 4 pasang, umur 2-3 bulan, berbatang tunggal dan lurus, bibit sehat, dan batang bibit berkayu, diukur dari pangkal batang sampai dengan setinggi 50% dari tinggi bibit. Varietas resisten adalah varietas yang memiliki sifat untuk menghindar atau pulih kembali dari serangan hama dan penyakit, memiliki sifat yang dapat mengurangi kemungkinan hama menggunakan tanaman sebagai inang, atau menghasilkan produk yang lebih banyak dan lebih baik dibandingkan dengan varietas lain pada tingkat populasi hama dan penyakit yang sama.
Berdasarkan uraian tersebut, maka penelitian mengenai resistensi bibit jabon (Anthocephalus spp.) terhadap serangan Botryodiplodia theobromae penting dilakukan. Perlakuan cara infeksi penting diketahui untuk mempelajari mekanisme Botryodiplodia theobromae menginfeksi tanpa (bukan pada lentisel) maupun dengan pelukaan batang.
Perumusan Masalah
Penelitian mengenai jabon putih telah banyak, namun demikian, tidak ada penelitian yang membandingkan resistensi kedua jenis bibit jabon yang terserang B. theobromae, penyebab mati pucuk. Setiap tanaman memiliki mekanisme resistensi terhadap penyakit. Menurut Agrios (1997), resistensi yang dimiliki oleh tanaman dibedakan menjadi dua yaitu, resistensi struktural dan biokimia, baik sebelum dan sesudah serangan patogen. Resistensi struktural sebelum dan sesudah serangan patogen berturut-turut adalah struktur permukaan tanaman dan resistensi jaringan, sel, sitoplasma, serta nekrotik. Resistensi biokimia sebelum dan sesudah serangan patogen, salah satunya berturut-turut adalah terdapatnya zat inhibitor dalam sel tumbuhan berupa senyawa metabolit sekunder dan peningkatan akumulasi senyawa fenolik. Beberapa senyawa metabolit sekunder merupakan senyawa fenolik seperti, flavanoid, kuinon, dan tanin. Penelitian Wali (2014) menunjukkan bahwa, kandungan senyawa metabolit sekunder, berupa kuinon dan steroid pada daun bibit jabon merah lebih kuat dibandingkan dengan daun bibit jabon putih.
Penelitian ini diharapkan menjawab beberapa pertanyaan, antara lain : 1. Apakah patogen B. theobromae dapat menyerang bibit jabon tanpa (bukan
pada lentisel) maupun dengan pelukaan batang?
2. Bagaimana resistensi bibit jabon putih dan merah secara struktural dan biokimia terhadap serangan B. theobromae?
3. Bagaimana interaksi antara spesies bibit jabon dengan cara infeksi pada resistensi bibit jabon?
4. Apakah bibit jabon putih atau merah yang lebih resisten terhadap serangan B. theobromae?
Tujuan Penelitian
Tujuan penelitian ini adalah:
1. Menguji serangan B. theobromae dengan cara infeksi tanpa maupun dengan pelukaan batang bibit jabon.
2. Mempelajari resistensi bibit jabon secara struktural dan biokimia terhadap serangan B. theobromae.
3. Mempelajari interaksi antara spesies bibit jabon dan cara infeksi terhadap resistensi bibit jabon.
4. Memperoleh spesies bibit jabon yang lebih resisten terhadap serangan B. theobromae.
Manfaat Penelitian
Manfaat dari penelitian ini adalah:
1. Memberikan informasi bagi ilmu pengetahuan mengenai serangan B. theobromae tanpa maupun dengan pelukaan pada batang bibit jabon.
2. Memberikan informasi bagi ilmu pengetahuan mengenai spesies bibit jabon yang lebih resisten terhadap serangan B. theobromae.
Hipotesis Penelitian
Hipotesis dari penelitian ini adalah :
1. B. theobromae dapat menyerang bibit jabon putih dan merah dengan cara infeksi tanpa (bukan pada lentisel) maupun dengan pelukaan batang.
2. Bibit jabon putih dan merah memiliki perbedaan resistensi secara struktural dan biokimia terhadap serangan B. theobromae.
3. Spesies bibit jabon dan cara infeksi memiliki interaksi pada resistensi bibit jabon terhadap serangan B. theobromae.
4. Bibit jabon merah lebih resisten terhadap serangan patogen B. theobromae dibandingkan dengan bibit jabon putih.
Kerangka Pemikiran
Gambar 1 Kerangka pemikiran penelitian Botryodiplodia
theobromae
Membutuhkan pelukaan
Aisah (2014), terjadi gejala pada bagian tidak dilukai Kisaran inang
luas
Jabon putih Jabon merah
Resistensi biokimia sebelum dan sesudah serangan Resistensi struktural sebelum
dan sesudah serangan
Pohon peneduh, hiasan tepi jalan, dan kegiatan reboisasi (Orwa et al. 2009). Kayu lapis, konstruksi ringan, lantai, pulp dan kertas, serta obat tradisional
(Soerianegara dan Lemmens 1993).
Pohon peneduh, hiasan tepi jalan, dan kegiatan reboisasi (Orwa et al. 2009). Konstruksi ringan, furniture, plywood, papan, dan obat
tradisional (Halawane et al. 2011).
Lebih diminati
Kayunya lebih keras dan lebih resisten terhadap hama dan penyakit (Halawane et al. 2011). Pembibitan
Hama dan penyakit
Penyakit mati pucuk
Merugikan secara ekonomi
Resistensi inang
2 TINJAUAN PUSTAKA
Jabon Putih (Anthocephalus cadamba (Roxb.) Miq.)
Taksonomi dan Botani
Anthocephalus cadamba (Roxb.) Miq. dikenal dengan nama jabon putih. Menurut Martawijaya et al. (1989) bahwa, taksonomi jabon putih adalah sebagai berikut :
Spesies : Anthocephalus cadamba (Roxb.) Miq.
Jabon putih merupakan pohon berukuran besar dengan batang lurus, silindris, dan memiliki tajuk tinggi seperti payung dengan sistem percabangan khas mendatar. Tinggi pohon mencapai 45 m, dengan lingkar batang berkisar 100-160 cm, dan kadang-kadang berbanir hingga ketinggian 2 m. Daun menempel pada batang utama, berwarna hijau mengilap, berpasangan, dan berbentuk oval-lonjong berukuran 15-50 cm x 8-25 cm (Soerianegara dan Lemmens 1993). Kulit pohon muda berwarna abu-abu dan mulus, sedangkan kulit pohon tua kasar dan beralur. Bunga jabon putih berbentuk kepala terminal bulat tanpa brakteol, bertangkai, berwarna oranye atau kuning. Bunga bersifat biseksual, terdiri dari lima bagian dan kelopak bunga berbentuk corong. Mahkota bunga berbentuk seperti cawan. Benang sari ada lima dan melekat pada tabung mahkota. Buah jabon putih merupakan buah majemuk, berbentuk bulat, dan lunak. Buah jabon memiliki biji sangat kecil, berbentuk kapsul berdaging, dan berisi sekitar 8.000 biji. Biji berbentuk trigonal, tidak teratur, dan tidak bersayap (Soerianegara dan Lemmens 1993).
Penyebaran dan Karakteristik
Jabon putih tumbuh secara alami di Australia, Cina, India, Indonesia, Malaysia, Papua Nugini, Filipina, Singapura, dan Vietnam. Jabon putih telah disebar ke Kosta Rika, Puerto Riko, Afrika Selatan, Suriname, Taiwan, Venezuela, negara-negara subtropis dan tropis lainnya (Orwa et al. 2009).
Jabon putih merupakan tanaman pionir yang tumbuh pada tanah aluvial lembap. Pada habitat alami, suhu maksimum pertumbuhan jabon putih adalah 32-42 °C dan suhu minimum adalah 3-15.5 °C. Jabon putih dapat tumbuh pada daerah kering dengan curah hujan tahunan minimum 200 mm (Martawijaya et al. 1989).
Kegunaan
Jabon putih digunakan sebagai bahan baku kayu lapis, konstruksi ringan, lantai, pulp dan kertas, langit-langit, kotak, peti, mainan, ukiran, korek api, sumpit, dan pensil (Soerianegara dan Lemmens 1993). Pohon jabon berfungsi sebagai pohon peneduh, hiasan tepi jalan, pelindung tanaman lain pada wanatani, dalam kegiatan reboisasi dan penghijauan, serta memperbaiki sifat fisika dan kimia tanah (Orwa et al. 2009).
Kayu jabon putih juga digunakan sebagai bahan pembuatan sampan dan perkakas rumah sederhana, lapisan inti atau lapisan permukaan kayu lapis, serta bahan baku papan partikel, papan semen, dan papan blok. Ekstrak daun jabon putih digunakan sebagai obat kumur dan daun segarnya sebagai pakan ternak. Kulit kayu kering digunakan sebagai bahan tonik dan obat menurunkan demam. Pewarna kuning dari kulit akar berfungsi sebagai tanin (Soerianegara dan Lemmens 1993).
Hama dan Penyakit
Menurut Soerianegara dan Lemmens (1993) bahwa, Gloeosporium anthocephali menyebabkan defoliasi sebagian atau seluruh daun jabon putih. Beberapa jenis serangga menyerang daun jabon putih. Penelitian Ngatiman dan Tangketasik (1987) menunjukkan bahwa, beberapa jenis ulat menyerang jabon putih di Kalimantan Timur. Menurut Suratmo (1987) bahwa, Margaronia sp. (Lepidoptera, Pyralidae) merupakan defoliator jabon putih. Penelitian Arshinta (2013); Aisah (2014); Winara (2014) menunjukkan bahwa, Botryodiplodia spp. merupakan penyebab penyakit mati pucuk pada bibit jabon putih.
Jabon Merah (Anthocephalus macrophyllus (Roxb.) Havil.)
Taksonomi dan Botani
Jabon merah memiliki nama latin Anthocephalus macrophyllus (Roxb.) Havil. dan termasuk Rubiaceae. Menurut Halawane et al. (2011) bahwa, klasifikasi jabon merah adalah sebagai berikut :
Kindom : Plantae
Spesies : Anthocephalus macrophyllus (Roxb.) Havil.
Penyebaran dan Karakteristik
Jabon merah berasal dari daerah beriklim muson tropika seperti, Indonesia, Malaysia, Vietnam, dan Filipina. Jabon merah juga ditemukan tumbuh di Sri Lanka, Nepal, Laos, Myanmar, Thailand, China, dan Papua New Guinea. Jabon merah disebarkan ke Afrika Selatan, Puertorico, Suriname, Taiwan, dan Negara subtropis lain. Penyebaran alami jabon merah di Indonesia lebih sempit dibandingkan dengan jabon putih yaitu meliputi, Sulawesi, Maluku, dan Papua. Jabon merah memiliki beberapa nama lokal, seperti Karumama (Sulawesi Utara) dan Samama (Maluku Utara) (Heyne 1978).
Jabon merah merupakan tanaman fast growing. Jabon merah memiliki resistensi yang lebih tinggi terhadap serangan hama dan penyakit (Halawane et al. 2011). Jabon merah memiliki tekstur halus dengan arah serat lurus. Kayu jabon merah termasuk kelas kuat II-III, kelas awet IV, dan kelas sedang dalam menyerap bahan pengawet. Pohon jabon merah tumbuh pada ketinggian 10-1000 mdpl. Pemupukan pada bibit jabon merah sangat diperlukan untuk mempercepat pertumbuhan dan meningkatkan kualitas bibit jabon merah (Halawane et al. 2011).
Kegunaan
Pemanfaatan jabon merah sebagai bahan papan rumah (Heyne 1978). Kayu jabon merah digunakan sebagai bahan bangunan konstruksi ringan, furniture, plywood, papan, peti, korek api, dan lain-lain. Pemanfaatan non kayu pada jabon merah adalah sebagai obat tradisional (Halawane et al. 2011).
Hama dan Penyakit
Hama yang menyerang tanaman jabon merah pada persemaian dan di lapangan berturut-turut adalah semut, bekicot, ulat, rayap, dan penggerek akar, ulat grayak (Spodoptera sp.), pengisap daun (Helopeltis sp.), ulat pemakan daun, ulat api (Thosea asigna), Achaea sp., belalang (Valanga nigricornis), rayap (Captotermes sp.), serta tikus (Ratus tiomanicus).
Penyakit yang menyerang jabon merah pada persemaian dan di lapangan berturut-turut adalah penyakit dumping off dan bercak daun (leaf spot), keriting daun (leaf curl), embun jelaga (black mildew), embun tepung (powdery mildew), busuk akar (root rot), busuk hati (heart rot), serta cacar daun (Halawane et al. 2011).
Perbedaan Jabon Merah dan Jabon Putih
Beberapa karakteristik morfologi yang membedakan jabon merah dan jabon putih tersaji pada Tabel 1.
Tabel 1 Karakteristik morfologi jabon merah dan putih
Karakteristik morfologi Jabon merah Jabon putih
Tunas daun muda Berwarna merah Berwarna coklat muda
Pangkal daun Runcing Rata
Urat daun primer Berwarna merah Berwarna hijau kekuningan Batang muda Berwarna merah
kehitaman
Berwarna hijau kecoklatan
Batang pohon Berwarna kehitaman Berwarna coklat kelabu Warna buah Buah masak fisiologis
berwarna coklat kemerahan
Buah masak fisiologis berwarna coklat kuning
Sumber : Halawane et al. (2011).
Sifat kimia kayu jabon berperan terhadap mekanisme resistensi kayu terhadap serangan hama dan penyakit serta membantu menentukan cara pengerjaan dan pengolahan kayu untuk mendapatkan hasil yang maksimal. Penelitian Wali (2014) menunjukkan bahwa, daun jabon putih mengandung kadar air, serat kasar, ADF, dan lignin yang lebih banyak dibandingkan dengan daun jabon merah, sedangkan daun jabon merah mengandung lebih banyak lemak kasar dan selulosa. Kandungan senyawa primer daun jabon merah dan putih disajikan pada Tabel 2.
Tabel 2 Kandungan senyawa primer pada daun jabon merah dan putih (%)
Sumber : Wali (2014).
Jenis analisis Jabon merah (A. macropyllus)
Kandungan senyawa metabolit sekunder daun jabon merah dan putih umur 7 bulan tersaji pada Tabel 3.
Tabel 3 Kandungan senyawa metabolit sekunder pada daun jabon merah dan putih (A. macrophyllus dan A. cadamba) berumur 7 bulan
Senyawa aktif Jenis daun
Jabon merah Jabon putih Alkaloid
Penelitian Wali (2014) menunjukkan bahwa, daun jabon merah mengandung senyawa kuinon dan steroid yang lebih kuat dibandingkan dengan daun jabon putih. Senyawa antrakuinon dan kuinon berfungsi sebagai antibiotik, penghilang rasa sakit, dan merangsang pertumbuhan sel baru pada kulit manusia maupun hewan (Harborne 1987). Steroid merupakan senyawa metabolit sekunder yang dimanfaatkan sebagai obat. Senyawa steroid yang terdapat pada tumbuhan berfungsi sebagai pelindung dari serangan mikroba penyebab penyakit (Harborne 1987; Robinson 1995).
Menurut Emery (1987), resistensi tanaman dipengaruhi oleh dua faktor yaitu, faktor genetik dan non genetik. Resistensi tanaman yang dipengaruhi oleh faktor genetik dibedakan menjadi resistensi antar spesies, umur, resistensi dalam spesies (strain), dan kerusakan bawaan. Resistensi non genetik berupa faktor abiotik, seperti temperatur, kelembapan, dan virulensi patogen.
Botryodiplodiatheobromae
Taksonomi dan Morfologi
Menurut Alexopoulos et al. (1996) bahwa, taksonomi Botryodiplodia sp. adalah sebagai berikut :
Kingdom : Fungi
Phylum : Deuteromycota Kelas : Deuteromycetes Ordo : Sphaeropsidales Famili : Sphaeropsidaceae Genus : Botryodiplodia
miselium Botryodiplodia sp. berwarna putih, kemudian berubah menjadi hitam setelah 3-4 minggu (Kunz 2007).
Penenelitian Gandjar et al. (1999) menunjukkan bahwa, koloni B. theobromae pada media OA (Oatmeal Agar) dan PDA (Potatoes Dextrose Agar), membentuk miselia yang lebat dan berwarna coklat tua dengan piknidia berbentuk bulat, berleher panjang, dan berwarna hitam kehijauan. Konidia tua B. theobromae memiliki dua sel, berukuran 22-28 x 12-15 µm, berbentuk elips, berwarna coklat tua, dan memiliki garis longitudinal. Menurut Punithalingam (1976) bahwa, miselium B. theobromae berbentuk seperti benang halus atau kapas dengan miselium udara yang tebal. Piknidia B. theobromae berbentuk sederhana, bergerombol, beragregat, stromatik, dan ostiolate dengan lebar sampai 5 mm. Konidia muda bersifat uniseluler, hialin, granulosa, subovoid sampai ellipsoid, berdinding tebal, dan memotong seperti sekat, sedangkan konidia tua memiliki sekat dan berwarna coklat dengan ukuran 20-30 μm x 10-15 μm. Berikut adalah gambar karakteristik mikroskopis B. theobromae.
Gambar 2 Karakteristik mikroskopis Botryodiplodia theobromae: (a) konidia muda dan tua; (b) piknidium. Sumber : Sato et al. (2008).
Tanda panah menunjukkan konidia muda yang hialin dan tidak bersekat, konidia tua yang berwarna coklat tua dan bersekat, serta piknidium B. theobromae.
Karakteristik dan Inang
Patogen B. theobromae memiliki kisaran inang yang luas. Patogen ini merupakan parasit lemah yang menginfeksi melalui luka mekanis, seperti luka akibat pemangkasan atau serangga (Semangun 2007). Penelitian Aisah (2014) menunjukkan bahwa, Botryodiplodia spp. dapat menginfeksi bagian batang bibit jabon putih tanpa dan dengan pelukaan. Menurut Arshinta (2013), kejadian dan keparahan penyakit mati pucuk pada bibit jabon putih umur 3-5 bulan berturut-turut sebesar 100% dan 42-61%. Penyakit mati pucuk pada bibit jabon putih berpotensi menimbulkan kerusakan dan kematian bibit.
Menurut Begoude et al. (2009), Botryosphaeriaceae mempunyai distribusi inang yang sangat luas, yaitu monokotiledon, dikotiledon, gymnospermae, dan angiospermae. Penelitian Anggraeni dan Lelana (2011) menunjukkan bahwa,
Botryodiplodia sp. merupakan patogen yang menyerang beberapa tanaman
kehutanan di Indonesia, antara lain menyebabkan bercak daun pada pulai (Alstonia sp.), merbau (Intsia bijuga Kuntze.), bakau (Rhizophora mucronata
10 µm
40µm
Lamk.), dan skubung (Macaranga gigantea Muell.), busuk akar pada meranti (Shorea sp.), bledok pada nyamplung (Calophyllum inophyllum Linn.), dan penyakit batang pada gaharu (Aquilaria malaccensis Lamk.).
Mekanisme Infeksi Patogen terhadap Tanaman Inang
Jabon putih dan merah merupakan tanaman dikotil. Menurut Semangun (1996) bahwa, struktur anatomi tanaman dikotil, terdiri dari jaringan epidermis, korteks berupa parenkim dan kolenkim, dan stele yang terdiri dari endodermis, perisikel, xilem, kambium, floem, serta empulur. Penelitian Arifin (2009) menunjukkan bahwa, anatomi batang tanaman dikotil terdiri dari, epidermis, korteks, dan stele. Epidermis terdiri dari, selapis sel dan merupakan bagian terluar batang. Epidermis berperan mencegah transpirasi dan melindungi jaringan dalam dari kerusakan mekanis dan penyakit. Daerah di sebelah dalam epidermis adalah jaringan korteks. Korteks terbagi menjadi dua, yaitu kolenkim dan parenkim. Kolenkim menempati posisi di bawah epidermis dan parenkim di sebelah dalam kolenkim. Stele terdiri atas, endodermis, perisikel, berkas vaskuler, dan empulur. Berkas vaskuler tersusun atas, xilem, kambium, dan floem. Bagian tengah batang tanaman dikotil disebut empulur. Berikut adalah gambar struktur anatomi batang Tilia americana, tersaji pada Gambar 3.
Gambar 3 Struktur anatomi batang bibit Tilia americana. Sumber : Raven et al. (1986).
Menurut Semangun (1996) bahwa, fungi merupakan patogen yang menginfeksi tumbuhan melalui luka, lubang alami, atau menembus langsung ke permukaan jaringan tanaman yang utuh. Lubang alami tersebut berupa stomata dan lentisel. Mekanisme infeksi fungi pada lubang alami dan luka adalah sebagai berikut, spora jamur menempel pada permukaan epidermis, berkembang, dan
Endodermis
Epidermis
Kolenkim
Parenkim
Berkas vaskuler Empulur
membentuk buluh kecambah. Selanjutnya, buluh kecambah membesar dan membentuk apresorium berupa tabung penetrasi yang akan masuk ke dalam stomata atau luka. Apresorium membengkak, hifa berkembang, membentuk haustorium, dan mengisap makanan sel inang. Mekanisme infeksi fungi pada permukaan jaringan utuh adalah dengan membentuk apresorium dan hifa. Senyawa penyusun kutikula dihancurkan secara biokimia oleh patogen. Selanjutnya, hifa menghancurkan dinding sel epidermis. Selulosa yang merupakan penyusun dinding sel mengalami pembengkakan. Hifa infeksi membentuk saluran kecil dalam bengkakan dan masuk ke dalam sel.
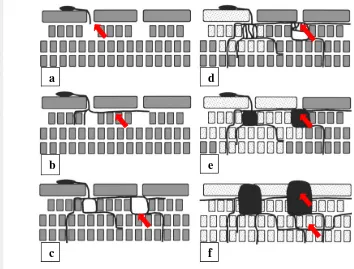
Patogen Mycosphaerella spp. juga menyerang inang menggunakan senjata fisik mekanik. Ilustrasi tahapan penyerangan Mycosphaerella spp. tersaji pada Gambar 4.
Gambar 4 Mekanisme serangan M. graminicola selama 11 hari pengamatan : (a) hari 1 : konidia berkecambah, berbentuk seperti pipa, dan masuk ke ruang substomata melalui lubang alami; (b) hari 3: hifa berkolonisasi, menginfeksi ruang substomata, dan menyebar ke samping; (c) hari 5: hifa tumbuh di interselular dan berkembang ke samping; (d) hari 7: hifa yang membentuk percabangan tegak lurus lama kelamaan menjadi percabangan keranjang anyaman di sekeliling ruang substomata. Gejala serangan yang tampak adalah klorosis dan nekrosis pada sel inang; (e) hari 9: hifa yang berbentuk keranjang di ruang substomata berisi piknidia; (f) hari 11: piknidia terlihat langsung dan hifa terus menyebar ke seluruh lamela daun. Sumber : Duncan dan Howard (2000).
Tanda panah menunjukkan penyebaran hifa fungi dalam jaringan inang.
Pembentukan apresorium diinduksi oleh sinyal kimiawi, seperti ion potassium dan kalsium, gula sederhana, gradien pH, dan perubahan temperatur. Fungi yang mempenetrasi menggunakan apresorium menunjukkan melanisasi
a
f c
e b
pada dinding apresorium, sehingga terbentuk tekanan turgor untuk mempenetrasi dinding sel inang. Selanjutnya, apresorium membentuk hifa penetrasi yang berdinding tipis dan kuat. Mekanisme kerja hifa penetrasi dibantu oleh enzim selulase untuk melunakkan dinding sel inang (Mendgen et al. 1996).
Penelitian Aisah (2014) menunjukkan bahwa, Botryodiplodia spp. dapat menimbulkan gejala mati pucuk pada bibit jabon putih, baik tanpa maupun dengan pelukaan batang. Gejala yang muncul pada bagian batang yang tidak dilukai, menunjukkan bahwa, Botryodiplodia spp. dapat melakukan penetrasi langsung pada jaringan inang. Sehingga dapat disimpulkan bahwa, Botryodiplodia spp. dapat melakukan penetrasi secara pasif dan aktif. Fungi ini mempenetrasi secara aktif menggunakan senjata biokimia seperti, enzim pektinase dan selulase. Botryodiplodia spp. memiliki aktivitas pektinase yang lebih tinggi dibandingkan dengan selulase, yang digunakan untuk mendegradasi pektin pada lamela tengah. Mekanisme penetrasi secara aktif dilakukan melalui kekuatan mekanik atau enzimatik. Menurut Mendgen et al. (1996), beberapa patogen tidak melakukan diferensiasi apresorium, sehingga memerlukan enzim pendegradasi dinding sel untuk mempenetrasi inang.
Resistensi Inang terhadap Serangan Patogen
Setiap tanaman memiliki mekanisme resistensi terhadap penyakit. Menurut Agrios (1997), resistensi yang dimiliki oleh tanaman dibedakan menjadi dua yaitu, resistensi struktural dan biokimia, baik sebelum dan sesudah serangan patogen.
Resistensi Struktural Sebelum Serangan Patogen : Struktur Trikoma
Resistensi struktural sebelum serangan patogen adalah struktur permukaan tanaman. Struktur tersebut meliputi, kualitas lilin dan kutikula yang menutupi sel epidermis, ketebalan dan kekuatan dinding sel epidermis, ukuran stomata dan lentisel, serta jaringan dinding sel yang tebal (Agrios 1997).
Trikoma merupakan rambut-rambut halus yang berada di permukaan epidermis. Menurut Nugroho et al. (2006); Issaacson et al. (2009), struktur trikoma berfungsi melindungi tanaman dari serangga pemangsa, spora jamur, dan air hujan. Penelitian Faizah (2010) menunjukkan bahwa, kerapatan trikoma merupakan mekanisme resistensi tanaman cabai terhadap begomovirus penyebab penyakit keriting daun. Menurut Qazniewska et al. (2012), mekanisme trikoma sebagai resistensi adalah dengan menangkap mikroorganisme, termasuk spora fungi dan mencegah spora mencapai permukaan epidermis. Trikoma juga berperan pada kelembapan di daerah epidermis, yang merupakan faktor penting bagi perkembangan fungi. Spora fungi dibawa oleh angin dan menempel pada ujung trikoma, ujung trikoma memiliki kelembapan yang sangat rendah, sedangkan spora fungi membutuhkan air untuk berkembang.
Resistensi Struktural Sesudah Serangan Patogen : Resistensi Nekrotik
dinding sel, dan terdepositnya kalosa palipa pada bagian dalam dinding sel), resistensi sitoplasma (sitoplasma menjadi granular dan keras), dan resistensi nekrotik (patogen menyerang dan inti sel pecah) (Agrios 1997).
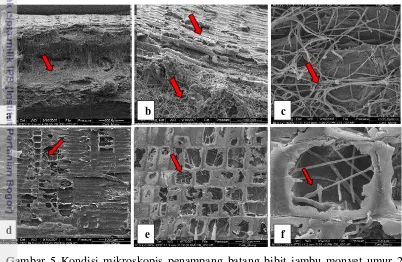
Menurut Agrios (1997), salah satu resistensi struktural sesudah serangan patogen adalah resistensi nekrotik melalui reaksi hipersensitifitas. Mekanisme resistensi nekrotik adalah sebagai berikut, patogen melakukan kontak dengan protoplasma sel inang. Selanjutnya inti sel bergerak ke arah serangan patogen, pecah, mengering, dan mengalami nekrosis. Berikut adalah kondisi mikroskopis penampang batang bibit jambu monyet umur 2 bulan yang terserang L. theobromae menggunakan scanning electron microscope, tersaji pada Gambar 5.
Gambar 5 Kondisi mikroskopis penampang batang bibit jambu monyet umur 2 bulan yang terserang L. theobromae : (a) kolonisasi hifa pada jaringan parenkim; (b) xilem yang dikolonisasi oleh fungi; (c) hifa mempenetrasi dinding sel; (d) sel parenkim penuh miselium; (e) jaringan parenkim yang rusak; (f) sel yang terinfeksi patogen. Sumber: Muniza et al. (2011).
Tanda panah menunjukkan jaringan yang terserang dan penyebaran hifa.
Resistensi Biokimia Sebelum Serangan Patogen : Senyawa Metabolit Sekunder
Menurut Agrios (1997) bahwa, resistensi biokimia sebelum serangan patogen adalah terdapatnya zat inhibitor yang dilepaskan tumbuhan ke lingkungannya, resistensi dengan tidak terdapatnya faktor-faktor esensial, kekurangan reseptor dan bagian yang sensitif inang terhadap toksin, tidak terdapatnya hara esensial bagi patogen, dan terdapatnya zat inhibitor dalam sel tumbuhan sebelum infeksi seperti senyawa metabolit sekunder.
Metabolit sekunder merupakan senyawa metabolit non-esensial yang berfungsi sebagai mekanisme resistensi diri terhadap kondisi lingkungan seperti, a
f e
d
resistensi dari serangan hama, penyakit, dan menarik polinator (Verpoorte dan Alfermann 2000). Beberapa jenis senyawa metabolit sekunder adalah senyawa alkaloid, fenol hidrokuinon, flavanoid, saponin, tanin, dan triterpenoid/steroid.
Alkaloid
Alkaloid merupakan senyawa nitrogen organik yang banyak ditemukan di alam dan tersebar luas pada berbagai jenis tumbuhan (Tobing dan Rangke 1989). Penelitian Harborne (1987) menunjukkan bahwa, alkaloid adalah substansi dasar yang memiliki satu atau lebih atom nitrogen, bersifat basa, membentuk sistem siklis berupa cincin heterosiklik, tidak berwarna, berbentuk kristal dengan titik lebur tertentu, dan berbentuk amorf atau cairan pada suhu ruang. Alkaloid dapat larut dalam air dan pelarut organik (Sirait 2007). Alkaloid bersifat racun pada manusia, tetapi ada pula yang memiliki aktivitas fisiologis sehingga digunakan dalam pengobatan (Harborne 1987).
Senyawa alkaloid dikelompokkan menjadi tiga, yaitu alkaloid, protoalkaloid, dan pseudoalkaloid. Protoalkaloid merupakan senyawa sederhana yang tidak memiliki cincin heterosiklik dan diperoleh dari biosintesis asam amino yang bersifat basa. Pseudoalkaloid bukan merupakan senyawa turunan asam amino dan senyawa ini bersifat basa (Sastrohamidjojo 1996).
Senyawa alkaloid berfungsi sebagai inhibitor enzim α-glukosidase (Samson 2010), dalam bidang kesehatan seperti pemicu sistem saraf, menaikkan tekanan darah, mengurangi rasa sakit, antimikroba, obat penenang, dan obat penyakit jantung (Aksara et al. 2013), serta sebagai antioksidan (Yuhernita dan Juniarti 2011; Porto et al. 2009). Senyawa alkaloid juga berfungsi sebagai antibakteri. Menurut Robinson (1991); Lamothe (2009) bahwa, mekanisme kerja alkaloid sebagai antibakteri, yaitu dengan mengganggu komponen peptidoglikan sel bakteri, sehingga lapisan dinding sel tidak terbentuk secara utuh dan menyebabkan kematian sel. Gugus basa nitrogen pada alkaloid bereaksi dengan senyawa asam amino penyusun dinding sel dan DNA bakteri, yang menyebabkan perubahan keseimbangan genetik pada rantai DNA. Selanjutnya, terjadi kerusakan dan lisis pada sel bakteri.
Flavanoid
Flavonoid merupakan senyawa polifenol terbanyak ditemukan di alam. Flavonoid berbentuk deretan senyawa C6-C3-C6, yang disambungkan dengan rantai alifatik tiga karbon (Robinson 1991). Susunan ini dapat mengahasilkan tiga jenis struktur, yaitu flavanoid, isoflavanoid, dan neoflavanoid (Kristanti et al. 2008). Flavonoid bersifat polar dan terikat sebagai glikosida dan aglikon flavonoid (Markham 1988 dalam Silaban 2010).
Flavanol juga merupakan senyawa yang tidak berwarna dan terdapat pada kayu tumbuhan tingkat tinggi. Isoflavanoid ditemukan terutama pada famili Leguminosae (Vickery dan Vickery 1981).
Menurut Mariska (2009) bahwa, senyawa flavanoid berfungsi sebagai proteksi terhadap radiasi UV-B, resistensi terhadap serangan patogen, penarik serangga, dan sebagai sinyal inisiasi hubungan simbiosis. Senyawa ini juga berfungsi sebagai antioksidan (Bayu 2009; Hartika 2009; Simamora 2011), antibakteri, dan inhibitor enzim α-glukosidase (Hartika 2009), antimikrobial (Naidu 2000), dan skrining cahaya (Simamora 2011). Penelitian Kumar et al. (2011) menunjukkan bahwa, flavonoid yang terdapat pada daun tumbuhan berperan mengatur fungsi fisiologis sebagai resistensi terhadap serangan hewan pemakan tumbuhan, infeksi bakteri, melindungi dari sinar UV, dan membantu dalam fotosintesis, transfer energi, serta respirasi. Menurut Kristanti et al. (2008), flavanoid juga memiliki fungsi sebagai zat pengatur tumbuh, pengatur fotosintesis, antimikroba, antivirus, antiinseksida, dan sebagai respon yang dihasilkan tanaman terhadap serangan fungi. Vickery dan Vickery (1981) bahwa, senyawa khalkon berkontribusi terhadap warna kuning terang pada pigmen bunga. Antosianin memberikan warna biru, ungu muda, dan merah pada bunga, buah, serta daun.
Penelitian Amic et al. (2003) menunjukkan bahwa, potensi antioksidan senyawa flavanoid tergantung pada karakteristik struktur senyawa, seperti jumlah dan pola substitusi gugus hidroksil, serta jumlah gugus hidroksil yang tersubstitusi oleh glikosida. Menurut Kahkonen et al. (2001) bahwa, kadar fenolik pada daun tanaman dipengaruhi oleh faktor umur daun, kondisi tanah, pemberian pupuk, dan stres lingkungan baik secara fisik, biologi, maupun kimiawi. Vickery dan Vickery (1981) bahwa, perbedaan konsentrasi atau tipe senyawa flavanoid bergantung pada umur jaringan, siklus hidup, dan waktu.
Menurut Dwidjoseputro (1994) bahwa, mekanisme kerja senyawa flavonoid sebagai antibakteri adalah melalui pembentukan senyawa kompleks protein extraseluler yang mengganggu keutuhan membran sel bakteri dengan mendenaturasi protein sel bakteri dan merusak membran sel. Flavonoid merupakan senyawa fenol dan senyawa fenol bersifat koagulator protein. Menurut Shaul et al. (2001), peningkatan flavonoid berperan dalam mensintesis enzim kitinase dan phenylalanine ammonium lyase.
Fenol Hidrokuinon
Menurut Harborne (1987) bahwa, fenol merupakan senyawa fenolat yang memiliki struktur aromatik yang berikatan dengan satu atau lebih gugus hidroksil, gugus metil atau glikosil. Senyawa fenol bersifat larut dalam air. Senyawa kuinon merupakan senyawa yang berwarna, mempunyai kromofor pada benzokuinon, dan dapat dibagi menjadi 4 kelompok, yaitu benzoquinon, naftaquinon, antraquinon, dan isoprenoid quinon. Benzoquinon, naftaquinon, dan antraquinon bersifat fenol, sedangkan isoprenoid quinon digunakan pada respirasi seluler (ubiquinon) dan fotosintesis (plastoquinon).
penghambatan mekanisme pertumbuhan bakteri. Menurut Peoloengan et al. (2006) bahwa, senyawa fenol merupakan senyawa antimikroba.
Mekanisme kerja senyawa fenol sebagai antimikroba adalah dengan merusak dinding sel fungi, sehingga mengakibatkan lisis, menghambat proses pembentukan dinding sel, mengubah permeabilitas membran sitoplasma yang menyebabkan kebocoran nutrien dalam sel, mendenaturasi protein sel, dan merusak sistem metabolisme dengan cara menghambat kerja enzim intraseluler (Dwidjoseputro 1994).
Tanin
Tanin merupakan senyawa dengan rumus struktur C72H52O46. Bentuk
kompleks dari senyawa tanin adalah protein, pati, selulosa, dan mineral. Senyawa tanin terkandung pada bagian kulit kayu, batang, daun, dan buah-buahan (Hagerman 2002). Tanin dapat dibedakan menjadi 2 yaitu, tanin terkondensasi dan tanin terhidrolisis. Tanin terkondensasi terdapat pada paku-pakuan, gymnospermae, dan angiospermae terutama pada tumbuhan berkayu. Tanin terhidrolisis hanya terdapat pada tumbuhan berkeping dua (Harborne 1987). Menurut Hagerman (2002) bahwa, beberapa tanaman yang menghasilkan senyawa tanin adalah tanaman pinang, akasia, gabus, bakau, pinus, dan gambir. Tanin disebut juga asam tanat, galotanin, dan asam galotanat.
Tanin merupakan senyawa fenolik yang berfungsi sebagai antioksidan biologis (Hagerman 2002). Tanin juga berfungsi sebagai pelindung tumbuhan pada masa pertumbuhan, anti hama (Harborne 1987; Hagerman 2002), antiseptik, dan obat keracunan alkaloid (Hagerman 2002), serta sebagai antioksidan (Zeuthen dan Sorensen 2003).
Menurut Vickery dan Vickery (1981) bahwa, senyawa tanin dapat berikatan dengan protein pada kulit tanaman, yang akan menyebabkan tanaman lebih resisten terhadap serangan fungi dan bakteri. Mekanisme kerja tanin sebagai antibakteri adalah dengan mengkerutkan membran sel, sehingga mengganggu permeabilitas sel dan menyebabkan kematian sel, mempresipitasi protein, menginaktivasi enzim, dan destruksi fungsi materi genetik (Masduki 1996; Ajizah 2004).
Saponin
Saponin merupakan kelompok senyawa triterpenoida glikosida. Hidrolisis senyawa triterpenoida glikosida, akan menghasilkan senyawa aglikon (saponin steroida) dan glikosida (gula) (Harborne 1987). Saponin bersifat seperti sabun dan dideteksi keberadaannya berdasarkan kemampuan membentuk busa. Saponin dapat larut dalam air, namun tidak larut dalam etanol dan metanol pekat yang dingin (Harborne 1984). Menurut Haralampidis et al. (2002) bahwa, kandungan senyawa saponin pada tanaman bergantung pada beberapa faktor, antara lain genetik tanaman, jenis jaringan, umur dan keadaan fisiologis tanaman, serta kondisi lingkungan.
senyawa saponin juga berfungsi sebagai antimikroba. Menurut Vickery dan Vickery (1981) bahwa, saponin berfungsi dalam proses perkecambahan biji dan menghambat pertumbuhan akar.
Penelitian Zablotowicz et al. (1996); Cowan (1999); Faure (2002); Hardiningtyas (2009) menunjukkan bahwa, mekanisme kerja saponin sebagai antifungi adalah melalui interaksi saponin dengan sterol membran, sehingga permeabilitas sel meningkat. Saponin bersifat racun bagi hewan berdarah dingin termasuk golongan serangga, namun aman bagi mamalia (Prihatman 2001).
Triterpenoid
Senyawa terpen merupakan kelas senyawa organik bahan alam terbesar yang meliputi mono, sesqui, di-, tri-, dan senyawa poli-terpen. Rumus molekul senyawa terpen adalah C10H16. Struktur mirip-terpen yang mengandung selain
unsur C dan H disebut terpenoid (Manitto 1992). Senyawa terpenoid berbentuk essential oil atau minyak atsiri (Pridham 1967).
Menurut Harborne (1984) bahwa, senyawa terpenoid berasal dari molekul isopren CH2=C(CH3)-CH=CH2 dengan kerangka karbon yang dibangun oleh
penyambungan dua atau lebih satuan C5. Terpenoid terdiri atas, monoterpenoid
(C10) dan seskuiterpenoid (C15) yang mudah menguap, diterpenoid (C20) yang
lebih sukar menguap, dan senyawa yang tidak menguap, yaitu triterpenoid dan sterol (C30), serta tetraterpen (C40). Penelitian Fessenden and Fessenden (1979)
menunjukkan bahwa, terpenoid dikategorikan berdasarkan banyak pasangan satuan isopren yang dikandungnya yaitu, monoterpenoid (dua satuan isopren), seskuiterpenoid (tiga satuan isopren), diterpenoid (empat satuan isopren), triterpenoid (enam satuan isopren), dan tetraterpenoid (delapan satuan isopren).
Triterpenoid merupakan kerangka karbon yang tersusun oleh 6 unit isoprene dan dibuat secara biosintesis dari skualen (C30 hidrokarbon asiklik).
Senyawa ini berbentuk siklik dan memiliki gugus alkohol, aldehida, atau asam karboksilat. Triterpenoid dibedakan menjadi, triterpenoid, steroid, saponin, dan glikosida. Senyawa triterpenoid yang terdapat pada tumbuhan tingkat tinggi adalah fitosterol, yang terdiri dari sitosterol, stigmasterol, dan kaempsterol (Harborne 1987). Triterpenoid tidak berwarna, berbentuk kristal, memiliki titik lebur yang tinggi, dan terasa pahit (Harborne 1984).
Mekanisme triterpenoid sebagai antibakteri adalah dengan merusak porin (protein transmembran) pada membran luar dinding sel bakteri, sehingga mengurangi permeabilitas membran sel bakteri, yang mengakibatkan sel bakteri mengalami kekurangan nutrisi (Cowan 1999). Menurut Banwart (1981) bahwa, kerusakan membran sel terjadi saat senyawa aktif antibakteri bereaksi dengan sisi aktif membran atau dengan melarutkan konstituen lipid dan meningkatkan permeabilitas yang menyebabkan senyawa antibakteri masuk ke dalam sel. Selanjutnya, senyawa triterpenoid menlisis membran sel atau mengkoagulasi sitoplasma sel bakteri. Penelitian Cowan (1999); Padmini et al. (2010); Panda (2010); Wink (2013) menunjukkan bahwa mekanisme triterpenoid sebagai antifungi adalah dengan berinteraksi dengan biomembran dan menlisis sel sehingga terjadi kebocoran ion sel fungi.
Steroid
Menurut Harborne (1987) bahwa, senyawa steroid merupakan turunan senyawa triterpenoid. Steroid berasal dari transformasi kimia triterpena yaitu, lanosterol dan saikloartenol. Senyawa steroid diklasifikasikan menjadi dua, yaitu steroid sederhana (steroid dengan atom karbon tidak lebih dari 21) dan steroid kompleks (steroid dengan atom karbon lebih dari 21) seperti, sterol, sapogenin, alkaloid steroid, dan vitamin D.
Penelitian Harborne (1987) menunjukkan bahwa, steroid digunakan sebagai bahan dasar pembuatan obat. Menurut Bayu (2009), steroid berfungsi sebagai antiradang, antiinflamasi, antikarsinogenik, dan pengontrol diabetes. Kristanti et al. (2008) bahwa, senyawa steroid digunakan sebagai racun.
Mekanisme steroid sebagai antibakteri adalah dengan mengganggu proses pembentukan membran sel, sehingga tidak terbentuk sempurna. Fenol berinteraksi dengan sel bakteri melalui proses adsorpsi yang melibatkan ikatan hidrogen. Fenol dengan kadar yang rendah, menyebabkan presipitasi dan denaturasi protein. Fenol dengan kadar yang tinggi, menyebabkan koagulasi protein dan lisis pada sel membran (Parwata dan Dewi 2008). Menurut Wink (2013), mekanisme steroid sebagai antifungi adalah melalui interaksi dengan biomembran.
Resistensi Biokimia Sesudah Serangan Patogen : Peningkatan Akumulasi Senyawa Fenolik
Menurut Agrios (1997) bahwa, sesudah serangan patogen pada tumbuhan, resistensi biokimia ditunjukkan dengan terdapatnya zat inhibitor yang dihasilkan tumbuhan sebagai respon terhadap serangan patogen, resistensi melalui reaksi hipersensitif, peningkatan akumulasi kadar senyawa fenolik berupa fenolik umum dan fitoaleksin, pelepasan fenolik fungitoksis dari fenolik non toksis, terdapatnya enzim polifenoloksidase, peran sintesis enzim terimbas, resistensi melalui pembentukan substrat yang menolak enzim patogen, resistensi melalui inaktivasi enzim patogen, pelepasan sianida fungitoksis dari non toksis, resistensi melalui detoksifikasi toksin patogen, dan resistensi melalui resistensi terimbas.
Resistensi sistemik terinduksi pada tanaman, menunjukkan terjadi peningkatan enzim glukanase, kitinase, glukosidase, sitonase, peroksidase, fenol, dan asam salisilat (Maurhofer et al. 1994). Penelitian Widnyana et al. (2009) menunjukkan bahwa, terjadi peningkatan total fenol pada tanaman tomat yang terinfeksi Fusarium sp. Menurut Achmad (1997); Achmad et al. (2012), semakin bertambah umur semai pinus, resistensi terhadap penyakit lodoh akan semakin meningkat, dikarenakan terjadinya peningkatan senyawa fenolik dan aktivitas enzim oksidatif, serta hilangnya sifat sukulen batang.
Menurut Agrios (1997) bahwa, faktor yang mendukung perkembangan penyakit yaitu, inang yang rentan, patogen yang virulen, dan lingkungan yang mendukung. Inang yang mengalami luka, patogen yang virulen dengan jumlah melimpah dan aktif, serta lingkungan yang mendukung seperti, suhu, kelembapan, dan angin. Kejadian pada satu siklus penyakit terdiri dari: inokulasi, penetrasi, infeksi, invasi, kolonisasi, pemencaran, dan daya bertahan hidup patogen tanpa inang.
3
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilakukan mulai bulan April sampai dengan Desember 2014. Tempat penelitian antara lain, Laboratorium Patologi Hutan Fakultas Kehutanan, Rumah Paranet Pembibitan Permanen BPDAS Citarum-Ciliwung, Laboratorium Kimia Analitik Fakultas Matematika dan Ilmu Pengetahuan Alam, Kampus IPB Dramaga, dan Pusat Penelitian Zoologi LIPI Cibinong.
Bahan dan Alat
Metode
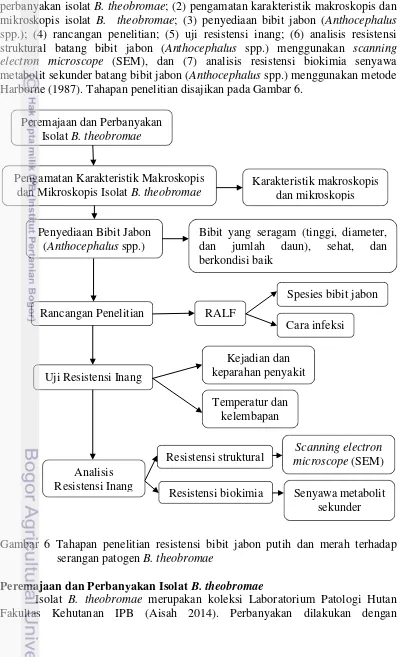
Penelitian ini terdiri atas 6 kegiatan yaitu : (1) peremajaan dan perbanyakan isolat B. theobromae; (2) pengamatan karakteristik makroskopis dan mikroskopis isolat B. theobromae; (3) penyediaan bibit jabon (Anthocephalus spp.); (4) rancangan penelitian; (5) uji resistensi inang; (6) analisis resistensi struktural batang bibit jabon (Anthocephalus spp.) menggunakan scanning electron microscope (SEM), dan (7) analisis resistensi biokimia senyawa metabolit sekunder batang bibit jabon (Anthocephalus spp.) menggunakan metode Harborne (1987). Tahapan penelitian disajikan pada Gambar 6.
Gambar 6 Tahapan penelitian resistensi bibit jabon putih dan merah terhadap serangan patogen B. theobromae
Peremajaan dan Perbanyakan Isolat B.theobromae
Isolat B. theobromae merupakan koleksi Laboratorium Patologi Hutan Fakultas Kehutanan IPB (Aisah 2014). Perbanyakan dilakukan dengan
Peremajaan dan Perbanyakan Isolat B. theobromae
Pengamatan Karakteristik Makroskopis dan Mikroskopis Isolat B. theobromae
Analisis Resistensi Inang Penyediaan Bibit Jabon
(Anthocephalus spp.)
Karakteristik makroskopis dan mikroskopis
Bibit yang seragam (tinggi, diameter, dan jumlah daun), sehat, dan berkondisi baik
Uji Resistensi Inang
Resistensi struktural Kejadian dan keparahan penyakit
Spesies bibit jabon
Senyawa metabolit sekunder Resistensi biokimia
Scanning electron microscope (SEM) Rancangan Penelitian RALF
Temperatur dan kelembapan
mempurifikasi isolat yang telah ada. Peremajaan dilakukan menurut Michailides (1991) dengan modifikasi. Miselium patogen ditanam pada media PDA menggunakan corebore berdiameter 5 mm, kemudian diinkubasi pada suhu 25 °C di dalam laminar air flow hingga miselium memenuhi cawan. Isolat yang diperoleh selanjutnya digunakan sebagai sumber inokulum.
Pengamatan Karakteristik Makroskopis dan Mikroskopis Isolat B.
theobromae
Pengamatan dilakukan berdasarkan karakteristik morfologi secara makroskopis dan mikroskopis meliputi, warna, tekstur, topografi koloni, dan diameter pertumbuhan, serta ukuran dan bentuk hifa. Identifikasi dilakukan menggunakan buku kunci identifikasi untuk genus imperfect fungi (Barnet dan Hunter 1998). Pengamatan dilakukan sebanyak 5 ulangan.
Penyediaan Bibit Jabon (Anthocephalus spp.)
Bibit jabon putih dan merah yang digunakan berumur 5 bulan. Bibit berasal dari pembibitan di Kota Bogor dengan asal provenans dari Kota Malang. Hal ini dikarenakan Kota Malang memiliki petani yang membudidayakan pohon jabon putih dan merah skala besar, sehingga memiliki banyak pohon induk. Bibit jabon putih dan merah yang digunakan pada penelitian diasumsikan seragam karena berasal dari pohon induk yang sama tempat tumbuhnya yaitu Kota Malang. Bibit berumur 2 bulan dari benih didistribusikan ke Persemaian kota Bogor. Sehingga bibit yang digunakan pada penelitian ini memiliki waktu aklimatisasi selama 3 bulan sebelum digunakan.
Bibit yang dipilih berukuran seragam baik tinggi, diameter dan jumlah daun bibit, sehat (tidak terserang hama dan penyakit), serta berkondisi baik. Penyiraman bibit dilakukan dua kali sehari dengan volume 300 cc per polibag selama penelitian berlangsung. Menurut Jafar et al. (2013), penyiraman terbaik pada bibit jabon merah adalah dua kali sehari dengan volume 300 cc.
Rancangan Penelitian
Model yang digunakan adalah sebagai berikut:
Yijkl = µ + αi + βj + αβij + εijk
Keterangan:
Yijk = respon dari faktor spesies bibit jabon ke-i, faktor cara infeksi pada
batang ke-j, serta ulangan ke-k µ = rataan umum
αi = pengaruh faktor spesies bibit jabon (petak utama) ke-i
βj = pengaruh faktor cara infeksi pada batang (anak petak) ke-j
αβij = pengaruh interaksi faktor spesies bibit jabon ke-i dan faktor cara infeksi
pada batang (anak petak) ke-j
εijk = galat dari faktor spesies bibit jabon ke-i, faktor cara infeksi pada batang
(anak petak) ke-j serta ulangan ke-l
Uji Resistensi Inang
Uji resistensi inang menggunakan metode penempelan blok agar berdasarkan Ismail et al. (2012) dengan modifikasi. Batang jabon sehat bagian atas disterilisasi menggunakan etanol 70%. Batang dilukai dengan jarum suntik steril, kemudian potongan agar yang mengandung B. theobromae (diambil menggunakan corebore Ø=5 mm) diinokulasikan pada batang yang telah dilukai dan dilapisi dengan kapas lembab. Potongan agar mengandung patogen yang digunakan adalah kultur berumur 7 hari. Kemudian batang ditutup menggunakan alumunium foil untuk menjamin potongan patogen tidak terlepas selama 14 hari pengamatan. Kelembapan kapas dijaga dengan memberikan beberapa tetes aquades steril setiap hari. Prosedur tersebut juga dilakukan pada batang tanaman dengan cara infeksi tanpa pelukaan. Inokulasi dilakukan pada batang yang tidak dilukai, bukan pada lentisel (dilihat menggunakan lup). Tanaman perlakuan kontrol diinokulasi dengan blok agar tanpa isolat menggunakan kombinasi faktor spesies bibit jabon dan cara infeksi serta prosedur yang sama. Parameter yang diamati adalah kejadian dan keparahan penyakit yang disebabkan oleh B. theobromae pada bibit jabon putih dan merah, serta temperatur dan kelembapan udara dalam rumah paranet.
Kejadian penyakit pada bibit jabon putih dan merah dihitung menggunakan rumus sebagai berikut (Achmad et al. 2012) :
��� = n
N x 100%
Keterangan :
Keparahan penyakit diukur menggunakan rumus sebagai berikut (Townsend dan Heurberger 1943 dalam Stević et al. 2010) :
KpP =∑ ��
�� � 100%
Keterangan:
KpP = Keparahan Penyakit
n = Jumlah tanaman dalam setiap kategori V = Nilai numerik dari kategori serangan
Z = Kategori serangan dengan nilai numerik tertinggi N = Jumlah seluruh tanaman yang diamati
Nilai numerik kategori serangan dan keparahan penyakit yang digunakan pada penelitian ini disajikan pada Tabel 4 dan Gambar 7. Kegiatan pengukuran temperatur dan kelembapan dilakukan pada pagi (06.00-07.00 WIB), siang (12.00-13.00 WIB), dan malam (19.00-20.00 WIB). Tabel 4 menyajikan nilai numerik kategori serangan dan keparahan penyakit yang digunakan:
Tabel 4 Nilai numerik kategori serangan dan keparahan penyakit mati pucuk pada bibit jabon
Nilai numerik kategori serangan
Keterangan keparahan penyakit
0 sehat (tidak ada gejala infeksi)
1 ≤ 25% bagian tanaman terinfeksi dan membusuk hanya pada jaringan epidermis
2 ≤ 25% bagian tanaman terinfeksi dan membusuk 3 26-50% bagian tanaman mengalami nekrosis 4 > 50% bagian tanaman mengalami nekrosis
5 Tanaman mati
Gambar 7 menyajikan nilai numerik kategori serangan dan keparahan penyakit mati pucuk pada bibit jabon yang digunakan dalam penelitian ini :
Gambar 7 Nilai numerik kategori serangan dan keparahan penyakit mati pucuk pada bibit jabon: (a) 0 = tanaman tidak bergejala; (b) 1 = ≤ 25% bagian tanaman mengalami nekrosis dan membusuk hanya pada jaringan epidermis; (c) 2 = ≤ 25% bagian tanaman mengalami nekrosis dan membusuk; (d) 3 = 26-50% bagian tanaman mengalami nekrosis; (e) 4 = > 50% bagian tanaman mengalami nekrosis; (f) 5 = tanaman mati
Tanda panah menunjukkan gejala pada bibit jabon.
Analisis Resistensi Struktural Batang Bibit Jabon (Anthocephalus spp.) Menggunakan Scanning Electron Microscope (SEM)
Sampel yang digunakan berupa batang bibit jabon putih dan merah yang sehat sebagai perlakuan kontrol, serta bibit jabon yang terinfeksi patogen baik dengan cara infeksi tanpa maupun dengan pelukaan batang. Analisis dilakukan sesuai buku panduan Pusat Penelitian Zoologi LIPI Cibinong. Tahapannya adalah:
Prefiksasi. Sampel direndam dalam larutan glutaraldehide 2.5% selama beberapa jam sampai dengan 2 hari pada suhu 4 0C.
Fiksasi. Sampel direndam dalam larutan tannic acid 2%, pada suhu 4 0C selama 6 jam sampai dengan beberapa hari. Selanjutnya, sampel dicuci menggunakan larutan cacodylate buffer sebanyak 4 kali, dengan masing-masing tahap berlangsung selama 5 menit pada suhu 4 0C.
Dehidrasi. Dehidrasi dilakukan menggunakan larutan seri alkohol 50% sebanyak 4 kali, masing-masing tahapan berlangsung 5 menit pada suhu 4 0C. Selanjutnya, sampel direndam dalam larutan alkohol 70%, dan direndam lagi dalam larutan alkohol 85% masing-masing selama 20 menit pada suhu 4 0C.
a b c
Sampel dimasukkan ke dalam larutan alkohol 95% selama 20 menit pada suhu kamar. Tahap terakhir adalah perendaman dalam larutan alkohol absolut sebanyak 2 kali, masing-masing tahapan berlangsung selama 10 menit pada suhu kamar.
Pengeringan. Sampel direndam dalam larutan tert-butanol sebanyak 2 kali, masing-masing selama 10 menit. Kemudian dibekukan dengan cara disimpan dalam freezer suhu - 20 0C. Setelah sampel membeku, dimasukkan dalam vacuum drier selama 20 menit.
Coating. Sampel dilekatkan pada specimen stub menggunakan perekat karbon, selanjutnya disepuh menggunakan logam emas selama 5 menit. Kemudian diamati menggunakan scanning electron microscope (SEM tipe JSM-5310LV).
Analisis Resistensi Biokimia Senyawa Metabolit Sekunder Batang Bibit Jabon (Anthocephalus spp.) Menggunakan Metode Harborne (1987)
Analisis dilakukan pada bibit jabon putih dan merah yang sehat, sebagai perlakuan kontrol dan bibit yang terinfeksi dengan cara infeksi pelukaan batang. Sampel yang digunakan berbentuk serbuk seberat 500 mg pada tiap pengujian. Tahapan kegiatan sebagai berikut :
Uji Alkaloid. Sampel dilarutkan dalam 5 ml kloroform dan dibasakan dengan 5 tetes NH4OH. Kemudian larutan dikocok dan disaring. Ekstrak
kloroform sebanyak 2 ml ditambahi dengan 10 tetes H2SO4 2 M, lalu dikocok
sampai terbentuk dua lapisan. Lapisan asam yang berada di atas diambil, kemudian diteteskan pada pelat tetes dan diuji berturut-turut dengan pereaksi Meyer, pereaksi Wagner, dan pereaksi Dragendrof. Uji positif bila terdapat endapan berturut-turut putih, cokelat, dan merah jingga.
Uji Flavonoid. Sampel ditambahkan 10 ml air panas, kemudian dididihkan selama 5 menit dan disaring. Filtrat sebanyak 5 ml ditambahkan 0.5 g serbuk Mg, 1 ml HCl pekat, dan 1 ml amil alkohol, kemudian dikocok dengan kuat. Uji positif ditandai dengan munculnya warna kuning hingga merah tua.
Uji Fenol Hidrokuinon. Sampel ditambahkan 10 ml metanol, kemudian dikocok. Selanjutnya dididihkan dalam air panas lalu disaring. Filtrat ditambahi 3 tetes NaOH 10%. Uji positif ditandai dengan munculnya warna kuning hingga merah.
Uji Tanin. Sampel ditambahkan 50 ml air panas dan dididihkan selama 15 menit lalu disaring. Filtrat ditambahi 10 ml FeCl3 1%. Uji positif ditandai dengan
munculnya warna hijau hingga kehitaman.
Uji Saponin. Sampel dididihkan dengan 10 ml air panas selama 5 menit kemudian disaring. Sebanyak 10 ml fitrat dikocok dalam tabung reaksi tertutup selama 10 detik, kemudian dibiarkan selama 10 menit. Uji positif ditunjukkan dengan terbentuknya buih yang stabil.
Analisis Data
Analisis sidik ragam dilakukan terhadap data kejadian dan keparahan penyakit pada uji resistensi inang. Apabila hasil yang diperoleh berbeda nyata, maka dilanjutkan dengan uji Tukey menggunakan software Minitab. Data resistensi struktural dan biokimia bersifat deskriptif serta disajikan dalam tabel dan gambar.
4 HASIL DAN PEMBAHASAN
Hasil
Karakteristik Makroskopis dan Mikroskopis Isolat B. theobromae
Koloni B. theobromae memiliki warna putih pada permukaan atas (Gambar 8a), yang selanjutnya berubah menjadi abu-abu (Gambar 8b), atau hijau kehitaman (Gambar 8c). Warna koloni pada bagian bawah media terlihat abu-abu (Gambar 8d), hijau kehitaman (Gambar 8e), atau hitam. Miselium B. theobromae memiliki tekstur seperti benang halus (fluffy) dengan miselium udara yang tebal dan koloni yang menyebar dari bagian tengah dengan topografi tidak beraturan (rugose) (Gambar 8). Isolat memiliki pertumbuhan radial yang cepat, yaitu dapat memenuhi cawan petri (Ø = 9 cm) setelah 3-4 hari masa inkubasi. Rataan pertumbuhan diameter B. theobromae tergolong cepat, yaitu 1.38 mm/jam. Berikut adalah gambar karakteristik makroskopis B. theobromae.
Gambar 8 Miselium B. theobromae berumur 3 hari setelah tanam (HST) :(a) ulangan 1;(b) ulangan 2;(c) ulangan 3;(d) ulangan 4;(e) ulangan 5 Tanda panah menunjukkan warna, tekstur, dan topografi miselium.
a b c
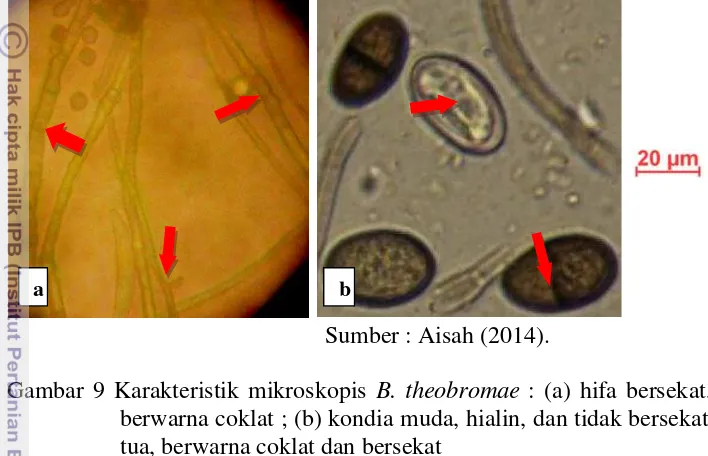
B. theobromae memiliki hifa bersekat, bercabang, hialin saat muda, dan berwarna coklat saat tua, serta berukuran 53-57 x 2-3 µm (Gambar 9a). Penelitian Aisah (2014) menunjukkan bahwa, B. theobromae memiliki konidia hialin dan tidak bersekat, yang kemudian menjadi kecoklatan dan bersekat satu saat tua. Konidia berbentuk ellipsoid atau ovoid berukuran 26-32 x 13-17 μm (Gambar 9b). Berikut adalah gambar hifa tua dan konidia B. theobromae.
Sumber : Aisah (2014).
Gambar 9 Karakteristik mikroskopis B. theobromae : (a) hifa bersekat, tua, dan berwarna coklat ; (b) kondia muda, hialin, dan tidak bersekat ; konidia tua, berwarna coklat dan bersekat
Tanda panah menunjukkan sekat pada hifa tua, tidak bersekat pada konidia muda, dan bersekat pada konidia tua.
Resistensi Bibit Jabon terhadap Serangan Patogen
Kejadian penyakit pada bibit jabon putih dan merah perlakuan kontrol, baik dengan cara infeksi tanpa (Gambar 10a dan b) maupun dengan pelukaan (Gambar 10c dan d) adalah sebesar 0%. Keparahan penyakit pada bibit jabon putih dan merah perlakuan kontrol juga sebesar 0%. Bibit jabon putih dan merah yang tidak diinokulasi patogen (kontrol), tidak menunjukkan adanya gejala mati pucuk. Berikut adalah gambar yang menyajikan tentang kondisi bibit jabon perlakuan kontrol pada hari pengamatan ke-14.