KARAKTERISASI PERTUMBUHAN MIKROB
PENDEGRADASI ASAM-ASAM ORGANIK
TANAH GAMBUT
DIANA NURANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Karakterisasi Pertumbuhan Mikrob Pendegradasi Asam-asam Organik Tanah Gambut adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2010
ABSTRACT
DIANA NURANI. Characterization of Microbes Degrading Organic Acids of Peatsoils. Under direction of DWI ANDREAS SANTOSA and KOESNANDAR.
The aim of the study was to isolate and characterize the growth of low pH tolerant-microbes being able to degrade and utilize organic acid extracted from peatsoil. Among 39 strains of fungi, bacteria and yeast isolated from various sources that grown at pH 3.8, strain FS2 was found to be the best isolate to degrade organic acid including p-hydroxybenzoic acid and increase pH-medium up to 5.9 within 36 hour. The optimum degradation of organic acid and pH increment were achieved when FS2 was grown on the medium containing 33.1 mN-NaOH organic acid, 2 g/l (NH4)2SO4, 0.5 g yeast extract, 1 g/liter KH2PO4,
and 0.5 g/l MgSO47H2O at initial pH of 3.8. The maximum growth rate as
observed by rate of organic acid comsumption and its pH increment were achieved at 6 to 12 hour of fermentation. The results revealed that an acid-tolerant strain FS2 was a prominent strain that is able to degrade organic acid and subsequently increase pH at high rate.
RINGKASAN
DIANA NURANI. Karakterisasi Pertumbuhan Mikrob Pendegradasi Asam-asam Organik Tanah Gambut. Dibimbing oleh DWI ANDREAS SANTOSA sebagai ketua komisi pembimbing dan KOESNANDAR sebagai anggota komisi pembimbing.
Indonesia memiliki lahan gambut terluas diantara negara tropis, sekitar 21 juta ha yang tersebar terutama di Sumatra, Kalimantan dan Papua (BB Litbang SDLP, 2008). Variabilitas lahan gambut sangat tinggi, baik dari segi ketebalan gambut, kematangan maupun kesuburannya sehingga tidak semua lahan gambut layak untuk dijadikan areal pertanian. Dari lahan gambut yang tersebar di pulau-pulau utama Indonesia, hanya sekitar 6 juta ha yang layak dimanfaatkan untuk pertanian (Agus & Subiksa, 2008).
Pemanfaatan lahan gambut untuk pertanian banyak mengalami kendala terutama pada lahan gambut yang belum mengalami pelapukan lanjut. Kendala utama adalah tingginya kemasaman tanah, yang mengakibatkan unsur hara menjadi tidak tersedia untuk tanaman. Kemasaman tanah gambut bisa disebabkan karena adanya asam-asam organik atau pengaruh sulfat hasil akumulasi dari FeS2
Berbagai penelitian untuk perbaikan produktivitas tanah gambut telah dilakukan diantaranya dengan penambahan abu vulkan, kapur serta dengan pembakaran, tetapi usaha perbaikan produktivitas tersebut banyak mengalami berbagai kendala. Untuk itu perlu adanya alternatif usaha dalam meningkatkan produktivitas tanah gambut khususnya untuk mengurangi kemasaman tanah yaitu melalui pendekatan bioteknologi. Beberapa mikrob tanah mampu secara cepat mendekomposisi beberapa asam organik yang menjadi salah satu penyebab kemasaman tanah gambut. Beberapa genus dari bakteri dan fungi dapat mendegradasi asam fenolat dan menggunakannya sebagai sumber karbon, salah satunya adalah Azotobacter (Juarez et al. 2005).
, hal ini tergantung pada proses pembentukan tanah gambut serta kondisi lingkungannya.
Tujuan penelitian ini adalah mendapatkan mikrob unggul pendegradasi asam organik tanah gambut. Lingkup penelitian adalah (i) ekstraksi asam-asam organik dari beberapa tanah gambut, (ii) isolasi mikrob dari tanah dengan pH rendah dari beberapa wilayah dan dari limbah cair industri pengolahan kelapa sawit, (iii) seleksi mikrob yang mampu mendegradasi asam-asam organik tanah gambut, (iv) karakterisasi pertumbuhan mikrob, (v) optimalisasi medium pertumbuhan khususnya sumber karbon dan nitrogen.
© Hak Cipta Milik IPB, Tahun 2010
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
KARAKTERISASI PERTUMBUHAN MIKROB
PENDEGRADASI ASAM-ASAM ORGANIK
TANAH GAMBUT
DIANA NURANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Tanah
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Karakterisasi Pertumbuhan Mikrob Pendegradasi Asam-asam Organik Tanah Gambut
Nama : Diana Nurani NRP : A 151080081
Disetujui
Komisi Pembimbing
Dr. Ir. Dwi Andreas Santosa, M.S.
Ketua Anggota
Dr. Ir. Koesnandar, M.Eng
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Tanah
Dr. Ir. Atang Sutandi, M.Si Prof. Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah S.W.T, karena hanya berkat rahmat dan hidayahNya sehingga penulis dapat menyelesaikan penulisan tesis ini tepat pada waktunya sesuai dengan harapan dan keinginan penulis.
Tesis yang berjudul “Karakterisasi Pertumbuhan Mikrob Pendegradasi Asam-asam Organik Tanah Gambut” ini disusun dalam rangka memenuhi tugas akhir dalam mencapai gelar Magister Sains pada Program Studi Ilmu Tanah Institut Pertanian Bogor.
Penulisan tesis ini tidak terlepas dari bimbingan, perhatian dan dukungan dari berbagai pihak. Pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih dan rasa hormat yang sedalam-dalamnya kepada:
1. Dr. Ir. Dwi Andreas Santosa, M.S. sebagai Ketua Komisi Pembimbing yang senantiasa memberikan bimbingan dan petunjuk kepada penulis.
2. Dr. Ir. Koesnandar, M.Eng sebagai Anggota Komisi Pembimbing yang selalu memberikan arahan, bimbingan dan dorongan kepada penulis.
3. Dr. Ir. Syaiful Anwar, M.Sc sebagai Ketua Departemen Ilmu Tanah dan Sumberdaya Lahan Fakultas Pertanian Institut Pertanian Bogor yang telah memberikan arahan kepada penulis.
4. Dr. Ir. Atang Sutandi, M.Si sebagai Ketua Program Studi Ilmu Tanah Fakultas Pertanian Institut Pertanian Bogor yang telah memberikan arahan kepada penulis. 5. Dr. Ir. Basuki Sumawinata sebagai penguji luar komisi pada ujian tesis.
6. Rekan-rekan Tim Mikrob Gambut Pusat Teknologi Bioindustri BPPT : Dr. Ir. Agus Masduki, M.Eng; Dra. Sih Parmiyatni; Ir. Gatyo Angkoso, M.Si; Ir. Heru Purwanta; Farah, STP; Ahmad Fauzi; Reni Giarni, S.Si; Jamhuri, SP yang telah membantu dan memberikan dukungan kepada penulis.
7. Rekan-rekan S2 angkatan 2008 Program Studi Ilmu Tanah Institut Pertanian Bogor yang senantiasa memberikan semangat dan kebersamaan kepada penulis selama menempuh program S2.
8. Ayahanda Ir. Haryoto Dhanutirto (Alm) dan Ibunda Siti Nurhayati yang telah mendidik, mendoakan dan memberikan dorongan semangat yang tiada henti. 9. Suamiku Ir. Budi Winarno serta ananda Safira Putri Widiani dan Ardelia Putri
Widyadhari yang dengan penuh pengertian telah membantu dan memberi semangat sehingga penulis bisa menyelesaikan studi dengan lancar dan tepat waktu.
10.Pusat Pembinaan Pendidikan dan Pelatihan BPPT yang telah memberikan beasiswa kepada penulis selama menempuh program pasca sarjana di IPB.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan tesis ini. Untuk itu segala keterbukaan kritik dan saran dari pembaca sangat diharapkan demi kesempurnaan tesis ini. Semoga tesis ini dapat bermanfaat bagi semua pihak yang memerlukannya.
RIWAYAT HIDUP
Penulis dilahirkan di Salatiga pada tanggal 23 Mei 1970 dari ayah Ir. Haryoto Dhanutirto (Alm) dan ibu Siti Nurhayati. Penulis merupakan putri kedua dari dua bersaudara.
Tahun 1988 penulis lulus dari SMA Negeri 1 Salatiga dan pada tahun 1992 penulis lulus dari Fakultas Biologi Universitas Kristen Satya Wacana Salatiga (UKSW), kemudian pada tahun yang sama penulis bekerja pada Badan Pengkajian dan Penerapan Teknologi (BPPT) Jakarta sampai sekarang. Pada saat ini penulis adalah Perekayasa Muda pada Pusat Teknologi Bioindustri BPPT.
Pada tahun 2008 penulis mendapatkan kesempatan untuk melanjutkan studi (S2) pada program studi Ilmu Tanah Departemen Ilmu Tanah dan Sumberdaya Lahan
DAFTAR ISI
2.1. Karakteristik Tanah Gambut ……….. 5
2.2 Asam-asam Organik tanah Gambut ……… 7
2.3. Mikrob Pendegradasi Asam Organik …………... 9
BAB 3 BAHAN DAN METODE ………... 11
3.1. Tempat dan Waktu Penelitian ………. 11
3.2. Bahan dan Alat ……… 11
3.3. Metode ……… 11
3.3.1. Tahapan Penelitian ……… 11
3.3.2. Ekstraksi Asam-asam Organik dari Tanah Gambut ……….. 12
3.3.3. Analisa Total Asam ……….. 12
3.3.4. Analisa Fenolat ………... 13
3.3.5. Isolasi Mikrob ………... 13
3.3.6. Seleksi Mikrob Pendegradasi Asam Organik 14 3.3.7. Karakterisasi Pertumbuhan ………... 15
3.3.8. Rancangan Penelitian ……… 15
BAB 4 HASIL DAN PEMBAHASAN ………. 17
4.1. Ekstraksi Asam-asam Organik dari Tanah Gambut … 17 4.2. Isolasi Mikrob ………. 18
4.3. Seleksi Mikrob Pendegradasi Asam Organik …... 18
4.3.1. Seleksi Fungi Pendegradasi Asam Organik .. 18
4.4. Karakterisasi Pertumbuhan Mikrob Terpilih ……….. 28
4.4.1. Optimalisasi Sumber Karbon dan Nitrogen .. 29
4.4.2. Optimalisasi Ekstrak Khamir ……… 32
4.4.3. Optimalisasi pH ……… 33
4.5. Pertumbuhan Strain FS2 pada Medium C & N Optimum ………... 34
BAB 5 SIMPULAN ……….. 37
DAFTAR PUSTAKA ………. 38
DAFTAR TABEL
Halaman
1 Daftar asam-asam organik pada tanah gambut ……… 8 2 Variasi sumber karbon dan sumber nitrogen dalam medium
pertumbuhan ………. 15 3 Kemasaman tanah dan kandungan total asam organik ekstrak
tanah gambut ………... 17 4 Isolat yang diperoleh dari beberapa wilayah ………... 19 5 Nilai pH akhir strain FS2 dengan variasi sumber C dan N setelah
DAFTAR GAMBAR
Halaman
1 Alur tahapan penelitian ………... 12 2 Nilai pH berbagai isolat fungi setelah inkubasi 96 jam ……….. 20 3 Penurunan total asam berbagai isolat fungi setelah inku basi 96 jam
………. 20 4 Pertumbuhan berbagai isolat fungi setelah inkubasi 96 jam ……….. 21 5 Nilai pH, total asam dan berat kering sel berbagai isolat fungi
setelah inkubasi 96 jam ……….. 21 6 Pengaruh waktu inkubasi terhadap kenaikan pH berbagai isolat
fungi terpilih ………... 22 7 Pengaruh waktu inkubasi terhadap kecepatan penurunan total asam
organik berbagai isolat fungi terpilih ………... 23 8 Pengaruh waktu inkubasi terhadap pertumbuhan sel berbagai isolat
fungi terpilih ……….. 23 9 Peningkatan pH medium berbagai isolat bakteri dan khamir setelah
inkubasi 24 jam ………. 25 10 Pertumbuhan sel berbagai isolat bakteri dan khamir setelah inkubasi
24 jam ………. 25 11 Kenaikan pH, pertumbuhan sel dan konsumsi asam organik isolat
bakteri dan khamir terpilih setelah inkubasi 24 jam ……….. 26 12 Pengaruh waktu inkubasi terhadap kecepatan kenaikan pH isolat
BL6 dan YL7 selama inkubasi 48 jam ……….. 27 13 Pertumbuhan isolat BL6 dan YL7 selama inkubasi 48 jam……... 27 14 Nilai total asam isolat BL6 dan YL7 selama inkubasi 48 jam …….. 28 15 Nilai pH strain FS2 pada medium pertumbuhan dengan variasi
sumber karbon dan nitrogen ……… 29 16 Penurunan total asam yang dikonsumsi strain FS2 pada medium
pertumbuhan dengan variasi sumber karbon dan nitrogen …………. 30 17 Pertumbuhan sel strain FS2 pada medium pertumbuhan dengan
variasi sumber karbon dan nitrogen ……… 30 18 Pengaruh ekstrak khamir terhadap pertumbuhan strain FS2 …... 32 19 Pengaruh pH terhadap pertumbuhan strain FS2 ………. 33 20 Nilai pH dan total asam pada pertumbuhan strain FS2 dalam
medium C & N optimum selama inkubasi 48 jam ……….. 34 21 Konsumsi asam fenolat oleh strain FS2 pada medium C & N
optimum selama inkubasi 48 jam …………... 35 22 Pertumbuhan sel strain FS2 pada medium C & N optimum selama
DAFTAR LAMPIRAN
Halaman
1 Sampel tanah Siantan II ………. 43
2 Analisa tanah Siantan II ………. 43
3 Populasi mikrob tanah gambut Siantan II pada pH medium 3,8 ... 43
4 Medium untuk pertumbuhan mikrob ………. 44
5 Data pH akhir, pertumbuhan sel dan penurunan total asam pada seleksi isolat fungi (inkubasi 96 jam)……….. 45
6 Data pH, total asam dan pertumbuhan sel isolat fungi terpilih selama inkubasi 96 jam ……….. 46
7 Data pH akhir dan pertumbuhan sel pada seleksi isolat bakteri dan khamir (inkubasi 24 jam)………. 47
8 Data pH, total asam dan pertumbuhan sel isolat bakteri dan khamir terpilih selama inkubasi 48 jam ……….. 48
9 Data pH akhir, penurunan total asam dan pertumbuhan sel strain FS2 dengan variasi sumber C & N (inkubasi 48 jam) ……….. 49
10 Analisis ragam (Anova) faktorial RAL - interaksi C & N terhadap pH ………... 50
11 Analisis ragam (Anova) RAL 1 faktor kombinasi perlakuan C & N terhadap pH ………... 51
12 Uji Duncan – kombinasi perlakuan C & N terhadap pH ………... 52
13 Analisis ragam (Anova) faktorial RAL - interaksi C & N terhadap pertumbuhan sel ……… 53
14 Uji Duncan faktor C terhadap pertumbuhan sel ……… 54
15 Analisis ragam (Anova) faktorial RAL - interaksi C & N terhadap penurunan total asam ………. 55
16 17 18 19 Uji Duncan faktor C terhadap penurunan total asam ………. Uji Duncan faktor N terhadap penurunan total asam ………. Data pH pertumbuhan strain FS2 selama inkubasi 72 jam dengan perlakuan ekstrak khamir dan tanpa ekstrak khamir ………. Data pH akhir pertumbuhan strain FS2 pada medium C & N optimum dengan pH awal yang berbeda-beda (inkubasi 48 jam)….. 56 57 58 59 20 Data pH, total asam, asam fenolat dan pertumbuhan sel strain FS2 pada medium C dan N optimum selama inkubasi 48 jam ………… 60
21 Kromatogram standar asam fenolat ……….. 61
22 Kromatogram analisis asam fenolat dalam medium pertumbuhan strain FS2 pada inkubasi jam ke-0 ………. 62
23 Kromatogram analisis asam fenolat dalam medium pertumbuhan strain FS2 pada inkubasi jam ke-12 ……… 63
25 Kromatogram analisis asam fenolat dalam medium pertumbuhan strain FS2 pada inkubasi jam ke-36 ……… 65 26 Kromatogram analisis asam fenolat dalam medium pertumbuhan
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Ekstensifikasi pertanian dalam rangka mendukung program ketahanan
pangan dapat dilakukan pada lahan-lahan marginal diluar Jawa seperti lahan
gambut, sebagai akibat terjadinya alih fungsi penggunaan lahan-lahan subur di
Jawa ke sektor non pertanian. Lahan marginal untuk budidaya tanaman
merupakan lahan yang mempunyai sifat-sifat fisika, kimia dan biologi yang tidak
optimum untuk kebutuhan pertumbuhan tanaman. Lahan gambut sangat
berpotensi untuk dikembangkan sebagai lahan pertanian, tetapi disisi lain lahan
gambut mempunyai masalah yang komplek, sehingga perlu input teknologi agar
karakteristik tanahnya dapat diperbaiki untuk mendukung pertumbuhan tanaman.
Indonesia memiliki lahan gambut terluas diantara negara tropis, sekitar 21
juta ha yang tersebar terutama di Sumatra, Kalimantan dan Papua (BB Litbang
SDLP, 2008). Variabilitas lahan gambut sangat tinggi, baik dari segi ketebalan
gambut, kematangan maupun kesuburannya sehingga tidak semua lahan gambut
layak untuk dijadikan areal pertanian. Dari lahan gambut yang tersebar di
pulau-pulau utama Indonesia, hanya sekitar 6 juta ha yang layak dimanfaatkan untuk
pertanian (Agus & Subiksa, 2008).
Pemanfaatan lahan gambut untuk pertanian banyak mengalami kendala
terutama pada lahan gambut yang belum mengalami pelapukan lanjut.
Ketersediaan hara didalam tanah gambut berhubungan erat dengan tingkat
dekomposisi tanah gambut. Beberapa hal yang harus diperhatikan pada
pengelolaan lahan gambut untuk usaha pertanian adalah (1) dinamika sifat
kemasaman tanah yang dikaitkan dengan pengendalian asam-asam organik
meracun, (2) dinamika kesuburan tanah sehubungan dengan ketersediaan unsur
hara makro dan mikro yang dibutuhkan tanaman, (3) pembakaran lahan
gambut dalam rangka pemanfaatan lahan dan (4) pengaturan tata air pada lahan
gambut yang sesuai dengan sifat fisika dan kebutuhan tanaman.
Tanah gambut di daerah tropika basah seperti Indonesia berkembang dari
merupakan bahan material organik berserat yang berasal dari sisa-sisa tanaman
yang terdekomposisi belum sempurna, sehingga menghasilkan tanah gambut yang
variasi dan sebarannya heterogen. Komponen utama tanah gambut terdiri atas
lignin, selulosa, hemiselulosa dan protein.
Tanah gambut di Indonesia mempunyai kandungan lignin yang lebih
tinggi dibandingkan dengan gambut yang berada di daerah beriklim sedang,
karena terbentuk dari pohon-pohonan (Driessen & Suhardjo, 1976). Lignin akan
mengalami proses degradasi dan menghasilkan asam fenolat (Stevenson, 1994).
Beberapa jenis asam fenolat yang umum dijumpai dalam tanah gambut
diantaranya asam ferulat, vanilat, p-kumarat dan p-hidroksibenzoat (Tadano et al.
1992). Asam-asam fenolat tersebut berpengaruh langsung terhadap fisiologi
tanaman, serta penyediaan hara di dalam tanah. Beberapa hasil penelitian
menunjukkan bahwa asam-asam fenolat bersifat fitotoksik bagi tanaman dan
menyebabkan pertumbuhan tanaman terhambat (Stevenson, 1994). Disamping itu,
kandungan asam fenolat berperan dalam penyebab kemasaman tanah gambut
(Barchia, 2006).
Tanah gambut umumnya memiliki kesuburan yang rendah dengan pH
sekitar 3,3 (pH<4). Permasalahan utama dalam pemanfaatan tanah gambut untuk
pertanian adalah tingginya kemasaman tanah, yang mengakibatkan unsur hara
menjadi tidak tersedia untuk tanaman. Kemasaman tanah gambut bisa disebabkan
karena adanya sulfat hasil akumulasi FeS2
Penggunaan konsorsia mikrob dengan substrat selulosa dapat
memperbaiki karakteristik tanah gambut (Komariah et al. 1993), meningkatkan
pH dan produktivitas tanah gambut (Nurani et al. 2007), serta meningkatkan
produksi jagung (Koesnandar et al. 2008). Beberapa genus dari bakteri dan fungi
dapat mendegradasi asam fenolat dan menggunakannya sebagai sumber karbon,
salah satunya adalah Azotobacter (Juarez et al. 2005). Penerapan mikrob yang tepat diharapkan tidak hanya dapat mengurangi kemasaman lahan gambut tetapi
juga mengurangi penggunaan pupuk serta tidak menyebabkan polusi lingkungan. , atau asam-asam organik hasil
degradasi lignin, tergantung pada proses pembentukan tanah gambut serta kondisi
1.2. Perumusan Masalah
Berbagai penelitian untuk perbaikan produktivitas tanah gambut telah
dilakukan diantaranya dengan penambahan abu vulkan, kapur serta dengan
pembakaran, tetapi usaha perbaikan produktivitas tersebut banyak mengalami
berbagai kendala. Untuk itu perlu adanya alternatif usaha dalam meningkatkan
produktivitas tanah gambut khususnya untuk mengurangi kemasaman tanah yaitu
melalui pendekatan bioteknologi. Beberapa mikrob tanah mampu secara cepat
mendekomposisi beberapa asam organik yang menjadi salah satu penyebab
kemasaman tanah gambut.
Beberapa mikrob yang diisolasi dari berbagai sumber diperkirakan dapat
mendegradasi asam organik yang ada di dalam tanah gambut. Aplikasi mikrob
tersebut diharapkan dapat mengurangi kemasaman tanah sekaligus memperbaiki
produktivitas tanah gambut, sehingga pada akhirnya akan meningkatkan
produktivitas tanaman.
1.3. Tujuan
Mendapatkan mikrob unggul pendegradasi asam-asam organik tanah
gambut.
1.4. Hipotesa
• Akan diperoleh mikrob unggul pendegradasi asam-asam organik tanah
gambut.
• Medium yang optimum dapat meningkatkan kemampuan mikrob
dalam mendegradasi asam-asam organik.
• Meningkatnya kemampuan mikrob dalam mendegradasi asam organik
diikuti dengan meningkatnya pH.
1.5. Ruang Lingkup Penelitian
Lingkup penelitian meliputi (i) ekstraksi asam-asam organik dari beberapa
tanah gambut, (ii) isolasi mikrob dari tanah dengan pH rendah dari beberapa
wilayah dan dari limbah cair industri pengolahan kelapa sawit, (iii) seleksi mikrob
pertumbuhan mikrob, (v) optimalisasi medium pertumbuhan khususnya sumber
BAB 2
TINJAUAN PUSTAKA
Lahan gambut merupakan salah satu ekosistem yang mempunyai potensi
cukup besar untuk dikembangkan sebagai lahan pertanian karena arealnya cukup
luas. Berdasarkan tingkat kesuburannya, gambut di Indonesia umumnya tergolong
kedalam gambut oligotropik (miskin hara) sampai mesotropik (sedang) dan hanya
sedikit yang tergolong kedalam golongan eutropik (subur)dan umumnya tersebar
di daerah pantai dan di sepanjang jalur aliran sungai (Agus & Subiksa, 2008).
Sedangkan berdasarkan lingkungan pembentukannya, sebagian besar lahan
gambut di Indonesia merupakan lahan gambut ombrogen (Radjagukguk, 1997).
Ketebalan gambut suatu kawasan bervariasi akibat adanya akumulasi gambut,
semakin dekat dengan sungai ketebalan gambut menipis, sebaliknya semakin ke
kawasan pedalaman gambut makin menebal dan membentuk kubah gambut
(dome). Tanah gambut ombrogen dengan kubah gambut tebal (> 3 m) umumnya
memiliki kesuburan yang rendah dengan pH sekitar 3,3 tetapi pada gambut tipis di
kawasan dekat tepi sungai gambut semakin subur dan pH berkisar 4,3 (Andriesse,
1988).
Pemanfaatan potensi lahan gambut untuk pertanian belum dapat
dilaksanakan, karena tanah gambut memiliki karakteristik yang khas yang berbeda
dengan tanah-tanah mineral. Untuk itu perlu dilakukan perbaikan dan pengelolaan
yang khusus terhadap kualitas tanah gambut dengan tujuan untuk memperbaiki
sifat tanah yang kurang produktif serta tidak mendukung pertumbuhan tanaman.
Masalah penting dan utama dalam pemanfaatan gambut adalah usaha
meningkatkan kesuburan lahan gambut yang ditentukan oleh (i) ketebalan gambut
dan tingkat kematangan lapisan-lapisannya, (ii) keadaan tanah mineral di bawah
gambut, (iii) kualitas air sungai atau air pasang yang mempengaruhi proses
pembentukan maupun proses penanganannya (BB Litbang SDLP, 2008).
2.1. Karakteristik Tanah Gambut
Tanah gambut adalah tanah yang didefinisikan memiliki lapisan bahan
organik penyusun tanah gambut terbentuk dari sisa-sisa tanaman yang belum
lapuk secara sempurna karena kondisi lingkungan jenuh air dan miskin hara (Agus
& Subiksa, 2008).
Karakteristik kimia tanah gambut di Indonesia sangat ditentukan oleh
kandungan mineral, ketebalan, jenis mineral pada substratum (di dasar gambut)
dan tingkat dekomposisi gambut. Kandungan kadar abu gambut di Indonesia
umumnya kurang dari 5% dan sisanya adalah bahan organik. Tanah gambut
umumnya mempunyai tingkat kemasaman yang relatif tinggi dengan kisaran pH
3-5, Kapasitas Tukar Kation (KTK) tergolong tinggi sehingga Kejenuhan Basa
(KB) menjadi sangat rendah (Agus & Subiksa, 2008).
Tanah gambut dengan ciri kapasitas tukar kation sangat tinggi, tetapi
persentase kejenuhan basa sangat rendah, akan menyulitkan penyerapan hara,
terutama basa-basa yang diperlukan oleh tanaman. KTK yang tinggi disebabkan
oleh banyaknya kandungan asam-asam organik pada tanah tersebut. Asam-asam
organik dengan gugus karboksil (-COOH) dan gugus fenol (-OH) memberikan
kontribusi yang besar bagi tingginya nilai KTK tanah gambut (Tim Fakultas
Pertanian IPB,1986).
Tingkat kesuburan tanah gambut ditentukan oleh kandungan mineral dan
basa-basa, bahan substratum/dasar gambut dan ketebalan lapisan gambut. Lapisan
bawah gambut dapat berupa lapisan lempung marin atau pasir. Gambut diatas
pasir kuarsa memiliki kesuburan yang relatif rendah, jika lapisan gambut terkikis,
menyusut dan hilang maka akan muncul tanah pasir yang sangat miskin. Tanah
lapisan lempung marin umumnya mengandung pirit (FeS2
Kemasaman tanah gambut disebabkan oleh kandungan asam-asam organik
yang terdapat pada koloid gambut. Dekomposisi bahan organik pada kondisi
anaerob menyebabkan terbentuknya senyawa fenolat dan karboksilat yang
menyebabkan tingginya kemasaman gambut. Selain itu terbentuknya senyawa
fenolat dan karboksilat juga dapat meracuni tanaman pertanian (Sabiham et al,
1997).
). Pada kondisi
tergenang (anaerob) pirit tidak akan berbahaya namun jika didrainase secara
berlebihan dan pirit teroksidasi maka akan terbentuk asam sulfat dan senyawa besi
2.2. Asam-asam Organik Tanah Gambut
Gambut tropika tersusun dari lignin, hemiselulosa, selulosa dan protein.
Biodegradasi gambut yang berasal dari kayu banyak mengandung lignin
(Andriesse, 1997) menghasilkan asam-asam fenolat sedangkan biodegradasi
selulosa dan hemiselulosa menghasilkan asam-asam karboksilat ((Andriesse,
1988; Katase, 1993). Biodegradasi lignin menghasilkan dua tipe asam fenolat,
yaitu asam benzoat tersubstitusi dan asam sinamat tersubstitusi, dan biodegradasi
lignin ini menghasilkan terlebih dahulu tipe asam sinamat tersubstitusi, kemudian
menyusul membentuk tipe asam benzoat tersubstitusi (Katase, et al. 1992). Asam
sinamat tersubstitusi (ΣCA) merupakan total asam kumarat, ferulat dan sinapat,
sedangkan asam benzoat tersubstitusi (ΣBA) meliputi asam p-hidroksibenzoat,
vanilat dan siringat (Riwandi, 2000). Rasio (ΣCA)/(ΣBA) mencerminkan tingkat
degradasi lignin (Katase, et al. 1992) dimana semakin rendah nilai rasio
(ΣCA)/(ΣBA) semakin stabil bahan gambut (Riwandi, 2000).
Biodegradasi lignin pada tanah gambut menghasilkan beberapa asam
organik (Tan, 1986) (Tabel 1). Asam-asam organik hasil biodegradasi lignin bisa
berasal dari golongan alifatik dan aromatik. Golongan alifatik yang sering
dijumpai pada tanah gambut berasal dari derivat asam-asam karboksilat seperti
asetat, format, propionat dan butirat, sedangkan yang berasal dari golongan
aromatik terutama derivat asam-asam fenolat seperti asam vanilat,
p-hidroksibenzoat, p-kumarat, ferulat, siringat (Alexander, 1977; Stevenson, 1994; Hartley & Whitehead, 1984).
Senyawa dari golongan aromatik yang ditemukan pada gambut pantai,
peralihan dan pedalaman Kalimantan Tengah adalah asam sinamat, ferulat,
p-kumarat, p-hidroksibenzoat, siringat dan vanilat (Salampak, 1999). Gambut pantai
mempunyai kandungan asam fenolat yang lebih kecil dibandingkan dengan
gambut transisi dan pedalaman (Saragih, 1996; Salampak, 1999). Rendahnya
kandungan asam-asam fenolat pada gambut pantai disebabkan pengaruh marin
yang lebih intensif, sehingga memungkinkan kation-kation yang terkandung
dalam air pasang surut bereaksi dengan asam-asam organik membentuk senyawa
asam-asam fenolat tanah gambut pantai disebabkan adanya ikatan antara
kation-kation polivalen yang berasal dari air laut (Salampak, 1999).
Tabel 1 Daftar asam-asam organik pada tanah gambut
Asam organik Formula
Asam asetat CH3COOH
Asam suksinat HOOCCH2CH2
Asam aspartat
Asam fumarat HOOCCH : CHCOOH
Asam benzoat (C6H5
Asam fenolat umumnya berpengaruh buruk terhadap serapan hara oleh
tanaman (Tadano et al. 1992) dan pertumbuhan tanaman (Prasetyo, 1996).
Asam-asam fenolat pada konsentrasi 4-30 mM sudah menunjukkan pengaruh meracun
terhadap beberapa jenis tanaman (Guenzi & McCalla, 1966). Secara umum
asam-asam fenolat terutama asam-asam ferulat, asam-asam p-kumarat dan asam-asam p-hidroksibenzoat
lebih berbahaya dibanding asam-asam karboksilat, karena kandungan dan tingkat
meracun dari asam-asam fenolat yang lebih besar daripada asam-asam
berkisar 18,77 – 79,65 ppm, diikuti asam p-kumarat (53,93 – 69,03 ppm) dan
asam p-hidroksibenzoat (32,45 – 45,85 ppm), sedangkan andungan asam-asam karboksilat seperti asam asetat (5,6 - 8,45 ppm), asam propionat (2 – 4,52 ppm),
asam suksinat (7,19 – 18,27 ppm) dan asam butirat (29,5 – 38,95 ppm) jauh lebih
kecil (Prasetyo, 1996).
Gambut yang berasal dari kayu banyak mengandung lignin cenderung
mempunyai nilai pH yang rendah (Salampak, 1999). Tingginya kemasaman tanah
gambut disebabkan oleh tingginya kandungan asam-asam organik terutama
derivat asam-asam fenolat yang dihasilkan dari dekomposisi bahan organik yang
banyak mengandung lignin (Barchia, 2006). Kemasaman tanah gambut sangat
dipengaruhi oleh keberadaan asam-asam organik. Ion H+ dalam tanah gambut
berada dalam bentuk gugus fungsional asam-asam organik terutama dalam bentuk
gugus karboksilat (-COOH) dan gugus hidroksil dari fenolat (-OH). Gugus
tersebut merupakan asam lemah yang dapat terdissosiasi menghasilkan ion H+
(Riwandi, 2001).
2.3. Mikrob Pendegradasi Asam Organik
Perombakan bahan organik saat pembentukan gambut melibatkan
komunitas mikrob yang komplek. Mikrob perombak bahan organik ini terdiri atas
fungi dan bakteri. Pada kondisi aerob, mikrob perombak bahan organik terdiri atas
fungi, sedangkan pada kondisi anaerob sebagian besar perombak bahan organik
adalah bakteri. Fungi berperan penting dalam proses dekomposisi bahan organik
untuk semua jenis tanah. Fungi toleran pada kondisi tanah yang masam, yang
membuatnya penting pada tanah-tanah dengan pH rendah seperti tanah gambut.
Sisa-sisa pohon di tanah merupakan sumber bahan makanan yang berlimpah bagi
fungi tertentu yang mempunyai peran dalam perombakan lignin (Foth, 1991).
Tanah gambut yang telah didrainase untuk tujuan pertanian pada bagian
permukaan tanahnya menjadi aerob, sehingga memungkinkan fungi dan bakteri
berkembang untuk merombak senyawa lignin, selulosa, hemiselulosa, dan protein.
Gambut tropika umumnya tersusun dari bahan kayu sehingga banyak
mengandung lignin, bakteri yang banyak ditemukan pada gambut tropika adalah
Pseudomonas merupakan bakteri yang mampu merombak lignin (Alexander, 1977). Penelitian tentang dekomposisi gambut di Palangkaraya menunjukkan
bahwa dekomposisi permukaan gambut terutama disebabkan oleh dekomposisi
aerob yang dilakukan oleh fungi (Moore and Shearer, 1997).
Proses perombakan lignin akan menghasilkan beberapa asam organik.
Beberapa mikrob tanah mampu secara cepat mendekomposisi beberapa senyawa
asam organik. Banyak studi dilakukan untuk mengembangkan pemanfaatan asam
organik sebagai sumber karbon bagi mikrob (McCarty & Bremner, 1986).
Pemilihan asam organik yaitu asam fenolat yang dapat dimanfaatkan oleh bakteri
dalam tanah dan rizosfer telah diteliti melalui pemberian satu jenis asam fenolat
pada konsentrasi ≥ 0,25 µmol/g tanah. Penambahan asam p-hidroksibenzoat pada
tanah menunjukkan bahwa bakteri mampu memanfaatkan asam tersebut sebagai
sumber karbon tunggal (Mohamed et al. 2009).
Beberapa genus dari bakteri dapat mendegradasi asam fenolat dan
menggunakannya sebagai sumber karbon, salah satunya adalah Azotobacter
(Juarez et al. 2005), sedangkan dari kelompok actinomycetes diantaranya Streptomyces sannanensis mampu tumbuh optimal dengan menggunakan asam ferulat pada konsentrasi 5 mM sebagai sumber karbon (Ghosh et al. 2007). Selain
dari kelompok bakteri dan actinomycetes, terdapat beberapa fungi yang juga
mampu menggunakan asam fenolat, yaitu fungi akar putih (white rot fungus)
Schyzophyllum commune, Pycnoporus cinnabarinus, Trametes sp. menggunakan asam kumarat dan asam ferulat sebagai sumber karbon tunggal (Sachan et al.
2010), menurut Ghosh et al. (2006) fungi Paecilomyces variotii tumbuh optimal dengan menggunakan asam ferulat sebagai sumber karbon pada konsentrasi 10
BAB 3
BAHAN DAN METODE
3.1. Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratoria Pengembangan Teknologi Industri
Agro dan Biomedika (LAPTIAB), Badan Pengkajian dan Penerapan Teknologi,
Serpong. Penelitian dilaksanakan pada bulan Januari 2010 sampai dengan bulan
Mei 2010.
3.2. Bahan dan Alat
Mikrob yang digunakan diisolasi dari limbah cair industri pengolahan
kelapa sawit PT. Bumi Pratama Khatulistiwa, Pontianak, dan beberapa lokasi
tanah gambut yang mempunyai pH rendah di perkebunan Nanas dan Kelapa PT.
Pulau Sambu, Riau, wilayah Terminal Agrobisnis dan kawasan Aloevera Center,
di Siantan Kalimantan Barat serta tanah mineral dengan pH rendah di perkebunan
lidah buaya Tabanan, Denpasar.
Bahan kimia yang digunakan adalah ekstrak khamir (Scharlau),
(NH4)2SO4 (Merck), MgSO4.7H2O (Univar), KH2PO4 (Univar), NaOH (Merck),
H2SO4
Peralatan yang digunakan adalah laminar, sentrifuse, mikroskop, autoklaf,
pH meter, biuret, spektrofotometer, High Performance Liquid Chromatography
(HPLC) Varian 940 LC, desikator, oven, shaker, cawan petri, tabung reaksi, pipet,
gelas ukur, bunsen, erlenmeyer, timbangan, magnetic stirer, vortex, stirer, kertas
saring.
(Merck), metanol, asam p-kumarat (Sigma), asam sinamat (Sigma
Aldrich), asam ferulat (Sigma Aldrich), asam vanilat (Sigma Aldrich), asam
siringat (Sigma), asam p-hidroksibenzoat (Sigma), indikator phenol phtalin,
alkohol. Bahan mikrobiologi yang digunakan adalah Nutrien Agar (NA), Potatoes
Dextrose Agar (PDA), de Mann Rogosa Sharpe (MRS).
3.3. Metode
3.3.1. Tahapan Penelitian
1. Ekstraksi asam-asam organik dari tanah gambut beberapa wilayah.
3. Seleksi mikrob pendegradasi asam-asam organik.
4. Karakterisasi pertumbuhan mikrob pendegradasi asam organik.
3.3.2. Ekstraksi Asam-asam Organik dari Tanah Gambut
Ekstraksi asam-asam organik dari tanah gambut menggunakan cara yang
dilakukan oleh Maciak dan Harms (1986) dengan modifikasi. Terhadap sepuluh
gram tanah ditambahkan 100 ml NaOH 2 M dan dikocok dengan shaker selama 3
jam. Larutan dipisahkan dari sisa fraksi padat dengan sentrifugasi selama 20 menit
8000 rpm (8770 xg). Larutan H2SO4 ditambahkan secara bertahap dalam fraksi
larutan sambil di aduk, sampai terjadi pengendapan sempurna. Fraksi larutan
dipisahkan dengan sentrifugasi 8770 xg selama 20 menit dan digunakan sebagai
sumber karbon dalam penelitian.
3.3.3. Analisa Total Asam, Metode Titrasi (AOAC, 1990)
Sampel sebanyak 2 ml dipipet, dimasukkan kedalam erlenmeyer 250 ml.
Cairan selanjutnya diencerkan dengan akuades sampai volume 20 ml (FP : 10
kali) dan diberi beberapa tetes indikator phenol phtalin. Cairan dititrasi dengan
larutan NaOH 0,1 N hingga terbentuk warna merah muda. Seleksi mikrob pendegradasi asam-asam organik
tanah gambut
Karakterisasi pertumbuhan mikrob Isolasi mikrob dari tanah & limbah cair
industri pengolahan kelapa sawit
Ekstraksi asam-asam organik dari
tanah gambut
Pre kultur 1 Pre kultur 2
Rumus perhitungan total asam :
3.3.4. Analisa Asam Fenolat
Kadar turunan asam fenolat dideteksi dengan HPLC, sebanyak 10 ml
sampel atau medium diasamkan hingga pH 2,5 dengan 1 M HCl, kemudian
diencerkan dengan menambahkan 10 ml campuran larutan metanol (MeOH) : air
(H2O) : asam asetat (HOAc), selanjutnya diambil 2,5 ml untuk dilakukan
penetapan asam fenolat dengan HPLC. Penetapan jenis asam-asam fenolat
berdasarkan sistem mekanisme pemisahan partisi menggunakan kolom fase
terbalik yakni kolom C18 merek BondapakTM ukuran 3.9 x 300 mm dan detektor
UV dengan lampu D2 pada panjang gelombang 240 nm.
3.3.5. Isolasi mikrob
Setengah mililiter limbah cair industri pengolahan kelapa sawit
diinokulasikan kedalam medium Nutrien Agar (NA), Potatoes Dextrose Agar
(PDA), de Mann Rogosa Sharpe (MRS) dan diinkubasi pada suhu kamar selama
1-3 hari. Pemurnian isolat dilakukan dengan menumbuhkan koloni kedalam
medium agar miring.
Isolasi mikrob dari limbah cair industri pengolahan kelapa sawit :
Satu gram contoh tanah gambut atau tanah mineral dilarutkan dalam 9 ml
air steril kemudian divortex. Sebanyak 0,5 ml larutan diinokulasi dalam medium
Nutrien Agar (NA), Potatoes Dextrose Agar (PDA), de Mann Rogosa Sharpe
(MRS) dan diinkubasi pada suhu kamar selama 1-3 hari. Pemurnian isolat
dilakukan dengan menumbuhkan koloni kedalam medium agar miring. Isolasi mikrob dari tanah
3.3.6. Seleksi Mikrob Pendegradasi Asam Organik
Sebanyak 1 ose masing-masing isolat diinokulasikan kedalam 10 ml
medium cair Czapek’s dengan modifikasi (Labeda, 1990), dengan komposisi
(g/liter) : MgSO Pre kultur 1 :
4.7H2O 0,5 g; (NH4)2SO4 3 g; KH2PO4 1 g; ekstrak khamir 0,5 g
dan asam organik 33,1 mN-NaOH, pH medium 3,8. Sebelum inokulasi medium
disterilisasi selama 20 menit (1 atm, 121 oC). Inkubasi dilakukan pada suhu kamar
dengan pengocokan 120 rpm selama 24 jam (untuk bakteri dan khamir) dan 48
jam (untuk fungi).
Kultur hasil pre kultur 1 sebanyak 10 ml diinokulasikan kedalam 100 ml
medium Czapek’s dengan modofikasi (Labeda, 1990), dengan komposisi (g/liter)
: MgSO Pre kultur 2 :
4.7H2O 0,5 g; (NH4)2SO4 3 g; KH2PO4 1 g; ekstrak khamir 0,5 g dan
asam organik 33,1 mN-NaOH, pH medium 3,8. Sebelum inokulasi medium
disterilisasi selama 20 menit (1 atm, 121 oC). Inkubasi dilakukan pada suhu kamar
dengan pengocokan 120 rpm selama 24 jam (untuk bakteri dan khamir) dan 48
jam (untuk fungi).
Kultur hasil pre kultur 2 sebanyak 10 ml diinokulasikan pada 100 ml medium Czapek’s dengan modifikasi (Labeda, 1990), dengan komposisi (g/liter)
: MgSO
Tahap Seleksi :
4.7H2O 0,5 g; (NH4)2SO4 3 g; KH2PO4 1 g; ekstrak khamir 0,5 g dan
asam organik 33,1 mN-NaOH, pH medium 3,8. Medium disterilkan selama 20
menit (1 atm, 121 oC). Kultur diinkubasi pada suhu kamar dengan pengocokan
120 rpm selama 48 jam (untuk bakteri dan khamir) dan 96 jam (untuk fungi).
Masing-masing dilakukan dengan ulangan 2 kali. Parameter yang diamati selama
fermentasi adalah pH medium, OD620
Seleksi mikrob yang paling optimal dalam mendegradasi asam organik
dilakukan berdasarkan kemampuan mikrob dalam mengkonsumsi asam organik
sebagai sumber karbon tunggal yaitu melalui parameter penurunan kandungan
total asam dan kenaikan nilai pH. Mikrob dengan kenaikan pH paling tinggi
yang akan digunakan untuk percobaan selanjutnya (optimalisasi medium
pertumbuhan).
3.3.7. Karakterisasi Pertumbuhan
Karakterisasi pertumbuhan dilakukan melalui optimalisasi sumber karbon
dan nitrogen. Konsentrasi asam organik sebagai sumber karbon (C1, C2, C3, C4)
masing-masing adalah 33,1; 66,2; 99,3; 132,4 mN-NaOH/liter medium,
sedangkan konsentrasi (NH4)2SO4 sebagai sumber nitrogen (N1, N2, N3, N4)
masing-masing adalah 1, 2, 3, 4 gr/liter medium. 10 ml kultur isolat unggul
diinokulasikan pada 100 ml medium (komposisi seperti pada Tabel 1.) dan
diinkubasikan pada suhu kamar dengan pengocokan 120 rpm selama 48 jam
sampai 96 jam tergantung jenis isolat yang diperoleh. Pengamatan yang dilakukan
adalah total asam, pH, pertumbuhan sel (OD620 atau bobot kering sel). Percobaan
dilakukan dengan jumlah ulangan 2.
Tabel 2 Variasi sumber karbon dan sumber nitrogen dalam medium pertumbuhan *)
Data hasil penelitian dianalisis menggunakan percobaan faktorial dengan
rancangan dasar Rancangan Acak Lengkap (2 faktor).
Model yang digunakan :
Y = µ + Ni + Cj + NiCj + ε
dimana :
Y = Respon percobaan
µ = Rataan perlakuan
Ni
C
= Faktor N ke-i, i = 1, 2, 3, 4
j
N
= Faktor C ke-j, j = 1, 2, 3, 4
iCj
ε
= Pengaruh interaksi N ke i dan C ke j
BAB 4
HASIL DAN PEMBAHASAN
Tanah gambut terbentuk dari sisa-sisa tanaman yang dalam lingkungan
anaerob tidak terdekomposisi sempurna. Rendahnya kandungan kation-kation
dalam bahan organik, serta tingginya kandungan asam organik sebagai senyawa
yang relatif stabil dalam tanah gambut menjadi salah satu sebab rendahnya pH
tanah gambut.
4.1. Ekstraksi Asam Organik dari Tanah Gambut
Tanah gambut untuk ekstraksi asam organik diambil dari 3 wilayah.
Ekstraksi tanah gambut dilakukan untuk memperoleh ekstrak asam organik
dengan menggunakan metoda sebagaimana dilakukan oleh Maciak & Harms
(1986) dengan modifikasi sebagimana tercantum dalam metode. Asam organik
dari tanah gambut terpilih akan dijadikan medium untuk menyeleksi mikrob yang
dapat mendegradasi asam organik. Kandungan total asam organik masing-masing
tanah gambut bervariasi tergantung pada lokasi dan kematangan gambutnya.
Tabel 3 Kemasaman tanah dan kandungan total asam organik ekstrak tanah gambut.
No Asal tanah gambut pH Total Asam organik (mN-NaOH/10 gr tanah)
1 Siantan I, AVC-Kalimantan Barat (perkebunan Lidah buaya)
4 72,4
2 Siantan II, Terminal Agribisnis-Kalimantan Barat (tanaman
Tanah gambut dari wilayah Siantan II mempunyai pH rendah 3,8 dan
mempunyai kandungan total asam organik paling tinggi (Tabel 3). Ekstraksi asam
organik dari tanah gambut wilayah Siantan II dipilih untuk digunakan sebagai
4.2. Isolasi Mikrob
Mikrob yang dapat mendegradasi asam organik pada pH rendah
diperkirakan akan diperoleh dari lokasi yang mempunyai kemasaman tinggi,
walaupun rendahnya pH tanah tidak hanya disebabkan oleh asam-asam organik
tetapi juga karena kandungan ion-ion sulfat. Mikrob diisolasi dari 6 lokasi
sampling dan diperoleh 39 isolat (Tabel 4). Sebagian besar mikrob tersebut
diperkirakan adalah fungi. Fungi merupakan kelompok mikrob yang dominan
pada tanah masam karena lingkungan masam tidak baik untuk bakteri ataupun
actinomycetes sehingga fungi dapat memonopoli pemanfaatan substrat alami
dalam tanah (Rao, 1986). Bakteri dan khamir hanya sedikit dijumpai pada
tanah-tanah masam yang menjadi wilayah sampling, hal tersebut memperlihatkan bahwa
kedua jenis mikrob kurang toleran pada pH rendah dibanding fungi.
4.3. Seleksi Mikrob Pendegradasi Asam Organik
Seleksi mikrob dilakukan dengan menumbuhkan seluruh isolat yang
diperoleh pada tahap isolasi pada media yang mengandung asam organik sebagai
sumber karbon tunggal. Asam organik yang digunakan adalah asam organik yang
diekstrak dari tanah gambut Siantan II. Kultur mikrob ditumbuhkan pada kondisi
aerob dan pada temperatur kamar selama 48-96 jam.
4.3.1. Seleksi Fungi Pendegradasi Asam Organik
Semua isolat fungi dapat tumbuh dengan menggunakan asam organik
sebagai sumber karbon, dimana kenaikan pH dan konsumsi asam organik
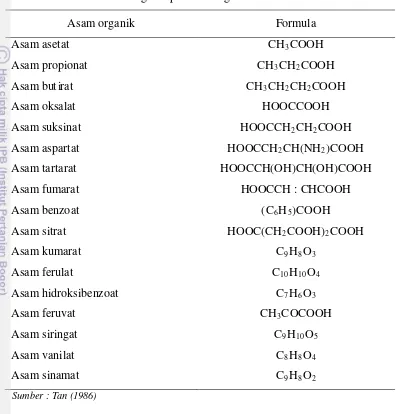
bervariasi diantara isolat-isolat yang diuji (Gambar 2 dan Gambar 3). Nilai pH
pada akhir fermentasi (96 jam) berkisar antara 5.6 sampai 5.9 (Gambar 2).Secara
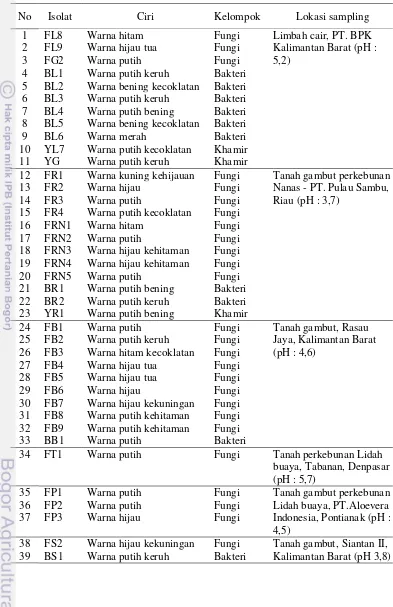
umum jumlah asam organik yang dikonsumsi oleh isolat mengikuti pola kenaikan
pH (Gambar 3). Jumlah asam organik yang dikonsumsi setara dengan kenaikan
pH pada setiap isolat. Hasil ini sesuai dengan hipotesa yang menyatakan bahwa
meningkatnya kemampuan mikrob dalam mendegradasi asam organik diikuti
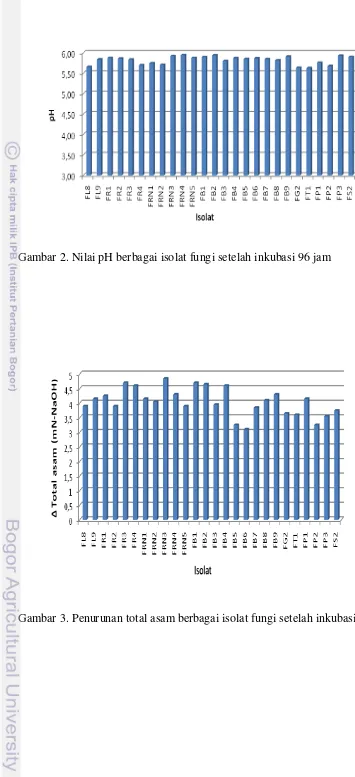
dengan meningkatnya pH. Pertumbuhan sel berbagai isolat tidak berkorelasi
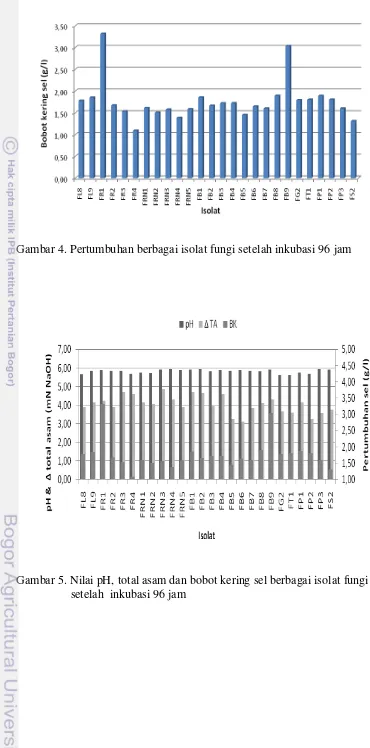
dengan kenaikan nilai pH (Gambar 4). Perbandingan kenaikan pH dengan
konsumsi asam organik dan bobot kering sel pada seluruh isolat ditampilkan pada
Tabel 4 Isolat yang diperoleh dari beberapa wilayah.
No Isolat Ciri Kelompok Lokasi sampling
1 FL8 Warna hitam Fungi Limbah cair, PT. BPK
Kalimantan Barat (pH : 5,2)
2 FL9 Warna hijau tua Fungi
3 FG2 Warna putih Fungi
4 BL1 Warna putih keruh Bakteri
5 BL2 Warna bening kecoklatan Bakteri
6 BL3 Warna putih keruh Bakteri
7 BL4 Warna putih bening Bakteri
8 BL5 Warna bening kecoklatan Bakteri
9 BL6 Warna merah Bakteri
10 YL7 Warna putih kecoklatan Khamir
11 YG Warna putih keruh Khamir
12 FR1 Warna kuning kehijauan Fungi Tanah gambut perkebunan
Nanas - PT. Pulau Sambu, Riau (pH : 3,7)
13 FR2 Warna hijau Fungi
14 FR3 Warna putih Fungi
15 FR4 Warna putih kecoklatan Fungi
16 FRN1 Warna hitam Fungi
17 FRN2 Warna putih Fungi
18 FRN3 Warna hijau kehitaman Fungi
19 FRN4 Warna hijau kehitaman Fungi
20 FRN5 Warna putih Fungi
26 FB3 Warna hitam kecoklatan Fungi
27 FB4 Warna hijau tua Fungi
28 FB5 Warna hijau tua Fungi
29 FB6 Warna hijau Fungi
30 FB7 Warna hijau kekuningan Fungi
31 FB8 Warna putih kehitaman Fungi
32 FB9 Warna putih kehitaman Fungi
33 BB1 Warna putih Bakteri
34 FT1 Warna putih Fungi Tanah perkebunan Lidah
buaya, Tabanan, Denpasar (pH : 5,7)
35 FP1 Warna putih Fungi Tanah gambut perkebunan
Lidah buaya, PT.Aloevera Indonesia, Pontianak (pH : 4,5)
36 FP2 Warna putih Fungi
37 FP3 Warna hijau Fungi
38 FS2 Warna hijau kekuningan Fungi Tanah gambut, Siantan II,
Kalimantan Barat (pH 3,8)
Gambar 2. Nilai pH berbagai isolat fungi setelah inkubasi 96 jam
Gambar 4. Pertumbuhan berbagai isolat fungi setelah inkubasi 96 jam
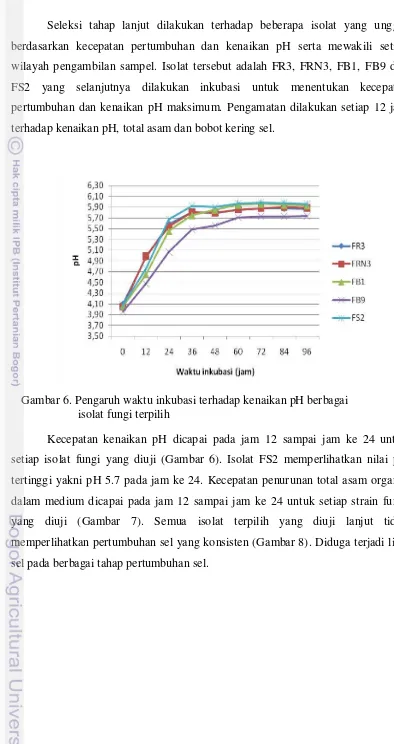
Seleksi tahap lanjut dilakukan terhadap beberapa isolat yang unggul
berdasarkan kecepatan pertumbuhan dan kenaikan pH serta mewakili setiap
wilayah pengambilan sampel. Isolat tersebut adalah FR3, FRN3, FB1, FB9 dan
FS2 yang selanjutnya dilakukan inkubasi untuk menentukan kecepatan
pertumbuhan dan kenaikan pH maksimum. Pengamatan dilakukan setiap 12 jam
terhadap kenaikan pH, total asam dan bobot kering sel.
Kecepatan kenaikan pH dicapai pada jam 12 sampai jam ke 24 untuk
setiap isolat fungi yang diuji (Gambar 6). Isolat FS2 memperlihatkan nilai pH
tertinggi yakni pH 5.7 pada jam ke 24. Kecepatan penurunan total asam organik
dalam medium dicapai pada jam 12 sampai jam ke 24 untuk setiap strain fungi
yang diuji (Gambar 7). Semua isolat terpilih yang diuji lanjut tidak
memperlihatkan pertumbuhan sel yang konsisten (Gambar 8). Diduga terjadi lisis
sel pada berbagai tahap pertumbuhan sel.
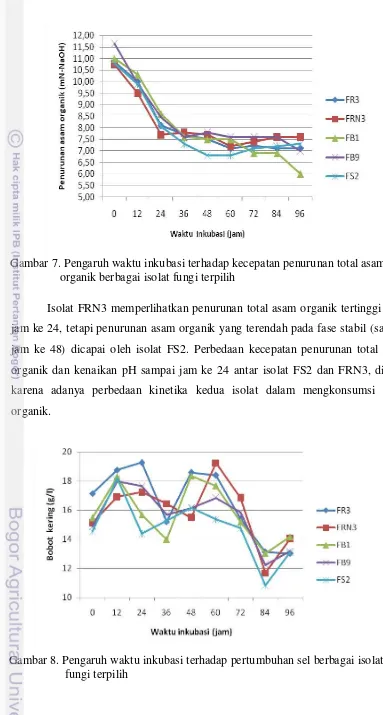
Isolat FRN3 memperlihatkan penurunan total asam organik tertinggi pada
jam ke 24, tetapi penurunan asam organik yang terendah pada fase stabil (sampai
jam ke 48) dicapai oleh isolat FS2. Perbedaan kecepatan penurunan total asam
organik dan kenaikan pH sampai jam ke 24 antar isolat FS2 dan FRN3, diduga
karena adanya perbedaan kinetika kedua isolat dalam mengkonsumsi asam
organik.
Gambar 7. Pengaruh waktu inkubasi terhadap kecepatan penurunan total asam organik berbagai isolat fungi terpilih
Berdasarkan seleksi terhadap 26 isolat fungi dalam mendegradasi asam
organik tanah gambut, diperoleh hasil bahwa isolat FS2 merupakan isolat unggul
dari kelompok fungi. Hal ini didukung oleh penelitian yang dilakukan oleh
Sachan et al. (2010) bahwa beberapa fungi mampu menggunakan asam organik (asam kumarat dan asam ferulat) sebagai sumber karbon tunggal, diantaranya
fungi akar putih (white rot fungus) Schyzophyllum commune, Pycnoporus cinnabarinus, Trametes sp. Strain Penicillium Bi 7/2 juga dilaporkan dapat menggunakan berbagai senyawa fenol termasuk asam protokatekuat dan asam
galat sebagai sumber karbon dan energi (Hofrichter dan Schiebner, 1993).
4.3.2. Seleksi Bakteri & Khamir Pendegradasi Asam Organik
Seleksi juga dilakukan untuk memperoleh isolat bakteri dan khamir yang
mampu tumbuh pada media yang mengandung asam organik sebagai sumber
karbon tunggal. Parameter yang digunakan untuk menentukan mikrob unggul
adalah nilai pH akhir dan total asam pada medium fermentasi serta berat sel
berdasarkan optical density (OD) pada panjang gelombang 620 nm.
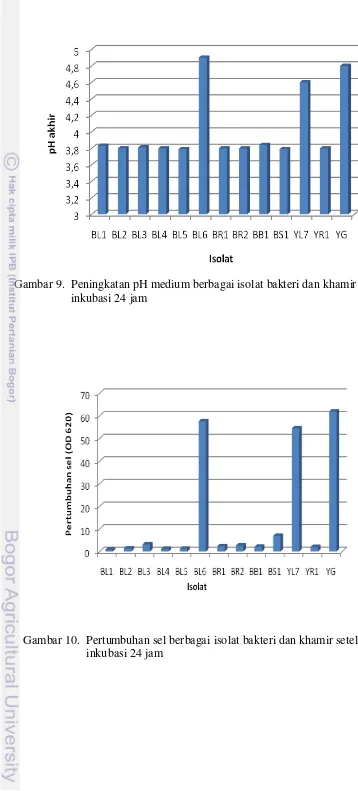
Isolat BL6, YL7 dan YG mampu tumbuh pada medium asam organik dan
menaikkan pH medium antara 4.6 sampai 4.8 pada akhir fermentasi (24 jam)
(Gambar 9), tidak terlalu tinggi dibandingkan oleh isolat-isolat fungi pada waktu
yang sama. Hal ini memperlihatkan bahwa bakteri dan khamir kurang toleran
untuk tumbuh pada lingkungan pH rendah.
Kenaikan pH yang dicapai isolat BL6, YL7 dan YG tersebut sebagai
akibat dari pertumbuhan sel dalam memanfaatkan asam organik dalam medium
(Gambar 10). Kenaikan pH dan pertumbuhan sel isolat BL6, YL7 dan YG
tersebut sebanding dengan konsumsi asam organik selama berlangsungnya
fermentasi (Gambar 11).
Kemampuan bakteri untuk menggunakan asam fenolat juga telah
dilaporkan sebelumnya, dimana Leuconostoc oenos dan Lactobacillus hilgardii dapat memetabolisme asam galat (Alberto et al., 2001) dan campuran beberapa
Gambar 9. Peningkatan pH medium berbagai isolat bakteri dan khamir setelah inkubasi 24 jam
Seleksi lanjut terhadap bakteri dan khamir yang dapat menggunakan asam
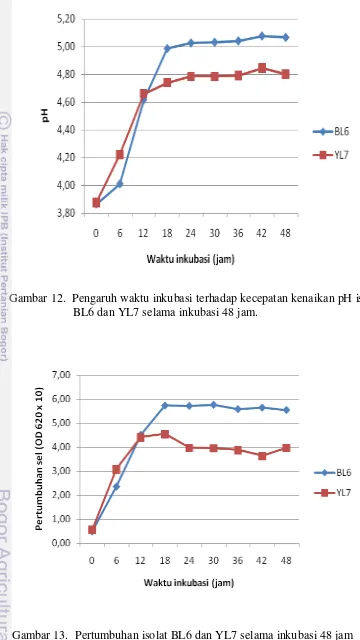
organik sebagai sumber karbon dilakukan terhadap isolat BL6 dan YL7 untuk
menentukan fase kecepatan pertumbuhan dan kenaikan pH maksimum.
Pengamatan dilakukan setiap 6 jam terhadap kenaikan pH, total asam dan berat
kering sel.
Pertumbuhan sel kedua isolat YL7 dan BL6 berakhir setelah jam ke-18.
Kenaikan pH yang dicapai oleh isolat YL7 lebih cepat dibandingkan dengan isolat
BL6 sampai dengan jam ke-12, tetapi kenaikan pH lebih tinggi dicapai oleh isolat
BL6 sejak jam ke 18 sampai berakhirnya fermentasi (Gambar 12). Kenaikan pH
tersebut diikuti dengan kenaikan pertumbuhan sel (Gambar 13), serta diikuti
dengan penurunan total asam yang cepat untuk kedua isolat (Gambar 14). Gambar 11. Kenaikan pH, pertumbuhan sel dan konsumsi asam organik
Gambar 13. Pertumbuhan isolat BL6 dan YL7 selama inkubasi 48 jam Gambar 12. Pengaruh waktu inkubasi terhadap kecepatan kenaikan pH isolat
Berdasarkan hasil seleksi 39 isolat baik fungi, bakteri maupun khamir,
diperoleh hasil bahwa isolat FS2 adalah isolat unggul yang akan digunakan untuk
penelitian selanjutnya, karena isolat FS2 mampu menaikkan pH menjadi 5,90
dengan penurunan total asam sebesar 3,5 mN-NaOH pada jam ke 36.
4.4. Karakterisasi Pertumbuhan Mikrob Terpilih Strain FS2
Susunan dan kadar nutrisi suatu medium untuk pertumbuhan mikrob harus
seimbang agar mikrob dapat tumbuh optimal. Hal ini perlu dikemukakan
mengingat banyak senyawa yang menjadi zat penghambat atau racun bagi mikrob
jika kadarnya terlalu tinggi. Disamping itu dalam medium yang terlalu pekat
aktivitas metabolisme dan pertumbuhan mikrob dapat berubah. Perubahan faktor
lingkungan menyebabkan aktivitas fisiologi mikrob dapat terganggu, bahkan
mikrob dapat mengalami kematian. Medium memerlukan kemasaman (pH)
tertentu tergantung pada jenis mikrob yang ditumbuhkan. Aktivitas metabolisme
mikrob dapat mengubah pH, sehingga untuk mempertahankan pH medium
ditambahkan bahan buffer.
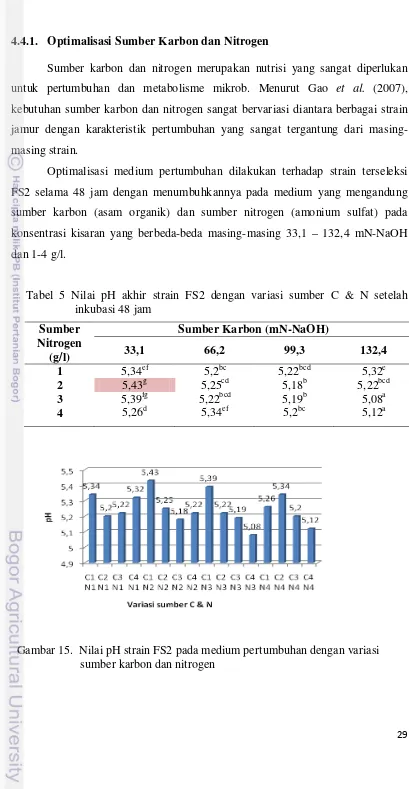
4.4.1. Optimalisasi Sumber Karbon dan Nitrogen
Sumber karbon dan nitrogen merupakan nutrisi yang sangat diperlukan
untuk pertumbuhan dan metabolisme mikrob. Menurut Gao et al. (2007),
kebutuhan sumber karbon dan nitrogen sangat bervariasi diantara berbagai strain
jamur dengan karakteristik pertumbuhan yang sangat tergantung dari
masing-masing strain.
Optimalisasi medium pertumbuhan dilakukan terhadap strain terseleksi
FS2 selama 48 jam dengan menumbuhkannya pada medium yang mengandung
sumber karbon (asam organik) dan sumber nitrogen (amonium sulfat) pada
konsentrasi kisaran yang berbeda-beda masing-masing 33,1 – 132,4 mN-NaOH
dan 1-4 g/l.
Hasil optimalisasi sumber C dan N menunjukkan bahwa kombinasi asam
organik dan nitrogen optimum untuk pertumbuhan strain FS2 adalah medium
dengan sumber karbon 33,1 mN-NaOH dan sumber nitrogen 2 g/l. Pada medium
optimum tersebut, kenaikan pH mencapai 5,43 (Tabel 5, Gambar 15) diikuti
dengan penurunan asam organik sebesar 4,8 mN-NaOH selama 48 jam fermentasi Gambar 16. Penurunan total asam yang dikonsumsi strain FS2 pada medium
pertumbuhan dengan variasi sumber karbon dan nitrogen
(Gambar 16). Hasil ini didukung oleh penelitian yang dilakukan oleh Perveen
(2010) bahwa dengan pemberian amonium sulfat sebesar 2 g/l medium dapat
meningkatkan pertumbuhan fungi Phythophthora casici.
Berdasarkan hasil analisis ragam terhadap pH (Lampiran 10),
memperlihatkan bahwa interaksi C dan N berbeda nyata (memberikan pengaruh
yang berbeda) terhadap pH pada taraf nyata α 5% (p < 0,05→ 0,00 < 0,05). Hasil
ini memperlihatkan bahwa sumber C dan N sangat diperlukan oleh strain FS2
dalam mendegradasi asam organik. Selanjutnya dari hasil uji Duncan
memperlihatkan bahwa terdapat 7 kelompok perlakuan yang memberikan
pengaruh yang berbeda terhadap pH (Lampiran 12). Hasil uji Duncan tersebut
mengindikasikan bahwa kombinasi faktor C1N2 (sumber karbon 33,1 mN-NaOH
dan sumber nitrogen 2 g/l) memberikan pengaruh yang berbeda nyata terhadap pH
diantara kombinasi perlakuan yang lain.
Hasil analisis ragam terhadap pertumbuhan sel (Lampiran 13),
memperlihatkan bahwa interaksi C dan N tidak memberikan pengaruh yang
berbeda terhadap pertumbuhan sel pada taraf nyata α 5% (p > 0,05 → 0,511 >
0,05). Hasil analisis pengaruh faktor tunggal menunjukkan bahwa faktor C
berpengaruh nyata terhadap pertumbuhan sel pada taraf nyata α 5% (p < 0,05 →
0,00 < 0,05), namun sebaliknya faktor N tidak berpengaruh terhadap pertumbuhan
sel pada taraf nyata α 5% (p > 0,05 → 0,122 > 0,05). Selanjutnya dari hasil uji
Duncan terhadap faktor C menunjukkan bahwa terdapat 2 kelompok perlakuan
yang memberikan pengaruh yang berbeda terhadap pertumbuhan sel (Lampiran
14). Hasil uji Duncan tersebut memperlihatkan bahwa sumber karbon sangat
diperlukan oleh strain FS2 untuk pertumbuhannya.
Hasil analisis ragam terhadap penurunan total asam (Lampiran 15),
memperlihatkan bahwa interaksi C dan N tidak memberikan pengaruh yang
berbeda terhadap penurunan total asam pada taraf nyata α 5% (p > 0,05 → 0,402
> 0,05). Hasil analisis faktor tunggal menunjukkan bahwa faktor C berpengaruh
nyata terhadap penurunan total asam pada taraf nyata α 5% (p < 0,05 → 0,001 <
0,05), demikian juga dengan faktor N berpengaruh nyata terhadap penurunan total
asam pada taraf nyata α 5% (p < 0,05 → 0,023 < 0,05). Hasil uji lanjut Duncan
memberikan pengaruh berbeda terhadap penurunan total asam (Lampiran 16).
Hasil uji Duncan terhadap faktor N menunjukkan bahwa terdapat 2 kelompok
perlakuan yang memberikan pengaruh yang berbeda terhadap penurunan total
asam (Lampiran 17). Berdasarkan hasil analisis ragam dan uji Duncan tersebut
memperlihatkan bahwa masing-masing sumber karbon dan sumber nitrogen
sangat diperlukan oleh strain FS2 dalam mendegradasi asam organik.
4.4.2. Optimalisasi Ekstrak Khamir
Pengaruh penambahan ekstrak khamir terhadap pertumbuhan strain FS2
dengan asam organik sebagai sumber karbon tunggal dilakukan dengan
menumbuhkan strain FS2 pada medium yang tidak mengandung ekstrak khamir.
Parameter yang diukur adalah pH setiap 12 jam dengan selama 72 jam.
Hasil optimalisasi ekstrak khamir (Gambar 18) memperlihatkan bahwa
strain FS2 tidak mampu tumbuh pada medium yang tidak mengandung ekstrak
khamir. Pada medium tersebut kenaikan pH hanya mencapai 4,39 pada jam ke-36.
Pada medium yang tidak mengandung amonium sulfat, FS2 masih mampu
tumbuh dengan baik, kenaikan pH pada jam ke-36 mencapai 5,79 hampir setara
menunjukkan bahwa ekstrak khamir dapat berperan baik sebagai sumber nitrogen
maupun faktor lain yang mutlak diperlukan untuk pertumbuhan strain FS2.
Diduga dalam ekstrak khamir terkandung vitamin atau asam amino tertentu yang
sangat dibutuhkan dalam pertumbuhan strain FS2. Pada penelitian lain
menggunakan bakteri Clostridium thermoaceticum yang ditumbuhkan pada medium mineral, menunjukkan bahwa hanya asam nikotinat dari ekstrak khamir
yang mutlak diperlukan untuk pembentukan NAD+
4.4.3. Optimalisasi pH
dalam metabolisme
pertumbuhannya (Koesnandar et al. 1990).
Pengaruh pH awal terhadap pertumbuhan strain FS2 dilakukan pada
kisaran pH antara 3,8-6,5 dengan menggunakan medium C dan N optimum.
Parameter yang diukur adalah pH akhir fermentasi yaitu pada jam ke-48. Hasil
percobaan menunjukkan bahwa semakin tinggi pH awal, kecepatan dalam
mendegradasi asam organik semakin rendah (Gambar 19). Dari hasil tersebut bisa
disimpulkan bahwa strain FS2 toleran terhadap pH rendah dan mendegradasi
asam organik tertinggi sebagai sumber karbon tunggal pada pH 3,8.
4.5. Pertumbuhan Strain FS2 pada Medium C dan N Optimum
Strain terpilih FS2 ditumbuhkan pada medium optimum selama 48 jam
untuk diamati perubahan nilai pH, total asam, asam fenolat dan pertumbuhan sel
setiap 6 jam. Kecepatan kenaikan pH, konsumsi asam organik dan pertumbuhan
sel tertinggi dicapai pada jam ke-6 sampai ke-12 (Gambar 20, 21,22).
Peningkatan pH oleh strain FS2 sampai jam ke-12 menunjukkan bahwa
selain mengkonsumsi asam fenolat (asam p-hidroksibenzoat), strain FS2 diduga
juga mengkonsumsi asam-asam organik non fenolat yang mungkin terdapat dalam
ekstrak asam organik tanah gambut Siantan II. Konsumsi asam organik non
fenolat diduga terjadi sejak awal pertumbuhan dan pada fase pertumbuhan
maksimum jam ke-6 sampai jam ke-12. Kenaikan pH tersebut diikuti dengan
menurunnya total asam yang dimulai pada jam ke-6 sampai jam ke-12 (Gambar
20). Pada jam yang sama pertumbuhan sel juga mengalami kenaikan, selanjutnya
mulai menurun setelah jam ke-12 (Gambar 22), hal ini disebabkan karena
kandungan asam organik sebagai sumber karbon tunggal sudah mulai berkurang Gambar 20. Nilai pH dan total asam pada pertumbuhan strain FS2
sehingga diduga sel mengalami lisis, bahkan asam p-hidroksibenzoat sudah
dikonsumsi pada awal pertumbuhan.
Gambar 21. Konsumsi asam fenolat oleh strain FS2 pada medium C & N optimum selama inkubasi 48 jam
Asam fenolat (asam p-hidroksibenzoat) sebesar 15,58 ppm yang
terkandung dalam medium pertumbuhan diduga didegradasi pada awal
pertumbuhan (jam ke-6 sampai jam ke-12), karena ternyata asam
hidroksibenzoat sudah tidak terdeteksi lagi pada jam ke-12 (Gambar 21). Asam
p-hidroksibenzoat juga diketahui merupakan senyawa intermediate yang paling
penting dalam degradasi berbagai senyawa aromatik (Karegoudar dan Kim,
2000).Mendonca et al. (2004) melaporkan bahwa Fusarium flocciferum terbukti dapat mendegradasi asam fenolat dan menaikkan pH, sedangkan menurut Sachan
et al. (2010) bahwa strain Schizophyllum commune dapat mengkonversi asam kumarat menjadi asam p-hidroksibenzoat. Streptomyces sannanensis juga dilaporkan mampu mendegradasi asam ferulat (Ghosh et al. 2007). Dari
kelompok bakteri, menurut Juarez et al. (2005) bahwa Azotobacter chroococcum
mampu mendegradasi asam p-hidroksibenzoat pada inkubasi 24 jam. Bacillus sp.
dan Pseudomonas sp. menghasilkan enzim hidroksibenzoat hidroksilase yang digunakan untuk mendegradasi asam p-hidroksibenzoat menjadi asam
BAB 5
SIMPULAN
1. Eksplorasi mikrob yang diisolasi dari beberapa wilayah menghasilkan 26
isolat fungi, 10 isolat bakteri dan 3 isolat khamir.
2. Strain fungi FS2 merupakan strain unggul hasil isolasi dari tanah gambut
Siantan II yang mampu mendegradasi asam organik dalam ekstrak tanah
gambut sebagai sumber karbon tunggal.
3. Pertumbuhan strain FS2, kemampuan degradasi asam organik dan
kenaikan pH maksimum dicapai pada medium yang mengandung asam
organik dan (NH4)2SO4
4. Pertumbuhan strain FS2 sangat dipengaruhi oleh peran asam organik
sebagai sumber karbon tunggal, ekstrak khamir sangat diperlukan untuk
pertumbuhan dan degradasi asam organik.
masing-masing 33,1 mN-NaOH dan 2 g/l dengan
pH awal 3.8, kecepatan degradasi asam organik maksimum oleh FS2
dicapai pada jam ke-6 sampai 12.
5. Degradasi asam organik oleh strain FS2 diikuti oleh kenaikan pH medium
DAFTAR PUSTAKA
Agus, F., I.G.M. Subiksa. 2008. Lahan Gambut: Potensi untuk Pertanian dan Aspek Lingkungan. Balai Penelitian Tanah, Bogor.
Alberto, M.R., Farias, M.E. and Manca De Nadra, M.C. 2001. Effect of gallic acid and catechin on Lactobacillus hilgardii on the growth and metabolism of organic compounds. J Agric Food Chem, 49 (9): 4359-4363.
Alexander, M. 1977. Introduction to Soil Microbiology. John Willey & Sons New York
Andriesse, J.P. 1988. Nature and management of tropical peat soils. Soil resources management and Conservation service FAO land and water development division. FAO Soils Bulletine. 59. Rome.
Association Official Agriculture Chemists. 1990. Official Methods of Analysis of AOAC International. Volume 2. Erlington, Virginia, USA.
Barchia, M.F. 2006. Gambut: Agroekosistem dan Transformasi Karbon. Gadjah Mada University Press. Yogyakarta.
BB Litbang SDLP. 2008. Konsorsium penelitian dan pengembangan perubahan iklim pada sektor pertanian. Laporan Tahunan 2008. Balai Besar Penelitian dan Pengembangan Sumberdaya Lahan Pertanian, Bogor.
Dohong, S., S. Sabiham. 2001. Kandungan beberapa derivat asam fenolat dalam tanah gambut Kalimantan Tengah berdasarkan lingkungan pembentukannya. J GDLNODE, 5 (3).
Driessen, P.M., H. Suhardjo. 1976. On the defective grain formation of sawah rice on peat. Soil Res. Inst. Bull, 3: 20-44.
Fakultas Pertanian IPB. 1986. Gambut pedalaman untuk lahan pertanian. Kerjasama Dinas Pertanian Tanaman Pangan Propinsi Dati I, Kalimantan Tengah dengan Fakultas Pertanian IPB, Bogor.
Foth, H.D. 1991. Fundamentals of Soil Science. John Wiley & Sons Inc.
Gao Li, Man H Sun, Xing Z liu, Yong C.S. 2007. Effects of carbon concentration and carbon to nitrogen ratio on the growth and sporulation of several biocontrol fungi. Myco Res, 111(1): 87-92.
Ghosh, S., A. Sachan, A. Mitra. 2006. Formation of vanillic acid from ferulic acid by Paecilomyces variotii MTCC 6581. Current Science. 90 (6).
Ghosh, S., A. Sachan, S.K. Sen, A. Mitra. 2007. Microbial transformation of ferulic acid to vanillic acid by Streptomyces sannanensis MTCC 6637. J Ind Microbiol Biotechnol. 34: 131-138.
Guenzi, W.D. dan T.M. McCalla. 1966. Phenolic acids in oats, wheat, sorghum, and corn residues and their phytotoxicity. J Agron. 58:303-304.
dan R.E. Malcolm. Soil Organic Matter and Biological Activity. Martinus Nijhoff/DR. W. Junk Publisher. Lancaster.
Hofrichter, Martin and Scheibner, Katrin. 1993. Utilization of aromatic compounds by the Penicillium strain Bi 7/2. J Basic Microbiol, 33 (4): 227-232.
Juarez, B, Martinez-Toledo, M.V., Gonzalez-Lopez, J. 2005. Growth of Azotobacter chroococcum in chemically defined media containing p-hydroxybenzoic hcid and protocatechuic acid. Chemosphere, 59: 1361-1365.
Karegoudar, T.B. dan C.K. Kim. 2000. Microbial degradation of monohydroxybenzoic acids. J Microbiol. p: 53-61.
Katase, T. 1993. Phenolic acids in tropical peats from Peninsular Malaysia : Occurrence and possible diagenetic behavior, Soil Sci. 155: 155-165.
Katase, S. Hirota, M. Naoi, K. Yamamato, H. Sumida, E. Wada, Y.M. Khanif and P. Vijarnsorn. 1992. A comparison of phenolic constituents in peat soils between subfrigid areas, Japan and tropical areas of Penninsula, Malaysia and Thailand. Dalam Aminuddin, B.Y., S.L. Tan, B. Aziz, J. Samy, Z. Salmah, H.S. Petimah, dan S.T. Choo (Eds), Tropical Peat, Proceedings of the International Symposium on Tropical Peatland. 6-10 May 1992, Kuching, Sarawak.
Koesnandar, N. Nishio, S. Nagai. 1990. Stimulation by cysteine on growth of Clostridium thermoaceticum in minimal medium. Appl Microb Biotechnol, 32: 711-714.
Koesnandar, A. Masduki, D. Nurani, G. Angkoso, S. Parmiyatni, H. Purwanta, P. Wahyudi. 2008. Microbiological treatment of peat land for agriculture use. ASEAN-China Workshop on Development of effective microbial consortium potent in peat modification. Jakarta 10-15 November 2008.
Komariah, S., T. Prihartini, M.E. Suryadi. 1993. Aktivitas mikroorganisme dalam reklamasi tanah gambut, Prosiding Pertemuan Teknis Penelitian Tanah dan Agroklimat : Bidang kesuburan dan produktivitas tanah, Puslit Tanah dan Agroklimat. Bogor. Hlm. 105-113.
Labeda, D.P. 1990. Isolation of Biotechnological Organisms from Nature. McGraw-Hill Publishing Company. New York.
Maciak, F. and H. Harms. 1986. The Effect of agricultural utilization on the composition and yield of phenolic acids in low peat soils. Plant and Soil, 94: 171-178.
McCarty, G.W. and J.M. Bremner, 1986. Effects of phenolic compounds on nitrification in soil. Soil Sci Soc Am J, 50: 920-922.
Mendonca, E., A. Martins, A.M. Anselmo. 2004. Biodegradation of natural phenolic compounds as single and mixed substrates by Fusarium flocciferum. J Biotechnol, 7: 30-37.