PERANCANGAN LABEL INDIKATOR BAKTERI PATOGEN
UNTUK PEMANTAUAN KUALITAS PEMPEK
MELATI PRATAMA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Perancangan Label Indikator Bakteri Patogen Untuk Pemantauan Kualitas Pempek adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Melati Pratama NIM F351130391
RINGKASAN
MELATI PRATAMA. Perancangan Label Indikator Bakteri Patogen untuk Pemantauan Kualitas Pempek. Dibimbing oleh ENDANG WARSIKI dan LIESBETINI HADITJAROKO.
Pempek adalah salah satu makanan khas Sumatera Selatan berbahan dasar daging ikan giling dan tapioka. Pempek mengandung nutrisi yang cukup tinggi, sehingga sangat baik bagi pertumbuhan terutama bakteri. Pertumbuhan bakteri pada pempek dapat menurunkan kualitas pempek. Penurunan kualitas pempek akibat aktivitas mikroba selama penyimpanan dapat dipantau dengan penggunaan label cerdas indikator warna. Penelitian perancangan label indikator dilakukan dengan tujuan untuk (i) mengidentifikasi mikroba dominan perusak pempek; (ii) mendapatkan formula label terbaik berdasarkan karakteristik mikroba dominan; (iii) menganalisis pengaruh kondisi kemasan dan suhu penyimpanan pempek terhadap label dan pempek pada aplikasi formula terbaik; (iv) menganalisis respon perubahan warna label terhadap kualitas pempek pada berbagai perlakuan selama penyimpanan; (v) memprediksi umur simpan pempek melalui perubahan warna label; (vi) mendapatkan dan memvalidasi model persamaan matematika perubahan warna label untuk memprediksi warna label dan kualitas pempek.
Identifikasi mikroba dominan dilakukan agar label lebih sensitif. Identifikasi dilakukan dengan mengisolasi mikroba pempek pada masing-masing media selektif. Jumlah bakteri terbanyak dijadikan sebagai bakteri dominan dan karakteristiknya digunakan sebagai dasar dalam penentuan formula label. Formula dibuat dengan menambahkan kombinasi konsentrasi phenol red dan NaCl. Formula terbaik ditentukan dari formula yang memberikan perubahan warna tercepat. Perbedaan warna ditentukan menggunakan uji Ducan taraf 5%. Formula label terbaik diaplikasikan untuk mendeteksi pertumbuhan mikroba pada pempek. Pada penelitian ini, pempek dikemas dengan plastik dan disimpan dalam dua suhu yaitu tidak vakum dan vakum dengan penyimpanan suhu ruang (30-32 oC) dan dingin (5-10 oC). Pengamatan terhadap parameter dilakukan pada jam ke-0, 8, 16, 24, 48 jam dengan tiga kali ulangan. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap Faktorial in time. Faktor yang berpengaruh nyata dianalisis lebih lanjut menggunakan uji lanjut Duncan taraf 5%.
Identifikasi menunjukkan bakteri dominan yang mengkontaminasi pempek adalah Staphylococcus aureus, sehingga komposisi media mengacu pada manitol salt agar (MSA) dengan dengan formula label terbaik adalah 3 mL phenol red konsentrasi 0.0028% (b/v) dan 7.5 gram NaCl. Hasil analisis ragam menunjukkan suhu penyimpanan, lama penyimpanan, interaksi antara suhu dan kondisi kemasan, interaksi antara suhu dan lama penyimpanan, interaksi antara kondisi kemasan dan lama penyimpanan, interaksi antara ketiga perlakuan berpengaruh sangat nyata terhadap pH label, nilai hue label, jumlah S. aureus pada label dan pempek. Serta berpengaruh nyata terhadap gas H2S, SO2, NO, aroma dan warna
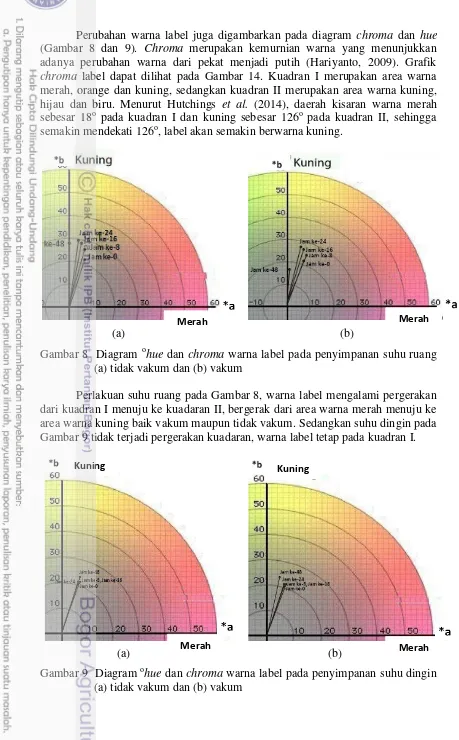
mengalami perubahan dari merah menjadi kuning yang direpresentasikan dalam
o
hue. Nilai hue label (o) meningkat dari 68.93 menjadi 88.89 dan 84.37 untuk suhu ruang, sedangkan untuk suhu dingin menjadi 71.29 dan 76.16. Jumlah S. aureus label (cfu/g) meningkat dari 0 menjadi 1×103 dan 1.22×103 untuk suhu ruang, sedangkan untuk suhu dingin menjadi 61 dan 0.12×103. Jumlah S. aureus pada pempek (cfu/g) meningkat dari 30 menjadi 354×103 dan 273×103 untuk suhu ruang, sedangkan untuk suhu dingin menjadi 1.42×103 dan 0.89×103. Total volatil nitrogen (mg/100g) meningkat dari 0 menjadi 0.37 dan 0.28 untuk suhu ruang, menjadi 0.19 dan 0.10 untuk suhu dingin.
Pada masing-masing kemasan tidak vakum dan vakum, untuk suhu ruang konsentrasi H2S (ppm) meningkat dari 0 menjadi 0.57 dan 0.37, sedangkan untuk
suhu dingin peningkatan hanya terjadi pada kemasan tidak vakum yaitu menjadi 0.07. Konsentrasi SO2 (ppm) meningkat dari 0 menjadi 0.43 dan 0.48, menjadi
0.23 dan 0.29 untuk suhu dingin. Peningkatan konsentrasi NO (ppm) hanya terjadi pada penyimpanan suhu ruang yaitu dari 0 menjadi 0.10 dan 0.07 pada masing-masing kemasan tidak vakum dan vakum. Nilai pH pempek menurun dari 7.67 menjadi 6.20 dan 6.8 untuk suhu ruang, sedangkan untuk penyimpanan suhu dingin penurunan pH terjadi pada kedua kondisi kemasan yaitu menjadi 7.2.
Penerimaan konsumen pada masing-masing kemasan tidak vakum dan vakum dengan rentang angka 3 (sangat suka) – 1 (tidak suka) terhadap aroma menurun dari 2.4 menjadi 1.1 dan 1.4 untuk suhu ruang, menjadi 2.4 dan 2.3 untuk suhu dingin. Penerimaan konsumen terhadap tekstur pempek menurun dari 2.4 menjadi 1 dan 1.7, sedangkan pada suhu dingin menjadi 1.9 pada kedua kondisi kemasan. Penerimaan konsumen terhadap warna menurun dari 2.8 menjadi 1.1 dan 1.9 pada suhu ruang, sedangkan pada suhu dingin menjadi 2.5 pada kedua kondisi kemasan.
Label hasil penelitian ini terbukti mampu memberikan informasi kualitas pempek lebih awal dengan perubahan warna dari merah menjadi orange sebelum jumlah S. aureus pempek mencapai 1×103 cfu/g, pH pempek 7 atau 7, penerimaan konsumen 2 atau 2 (suka). Kinerja label dalam memprediksi umur simpan pempek melalui perbedaan warna label. Warna merah menandakan umur simpan masih panjang, warna orange menandakan umur simpan segera berakhir (warning), warna kuning menandakan umur simpan telah berakhir (expired).
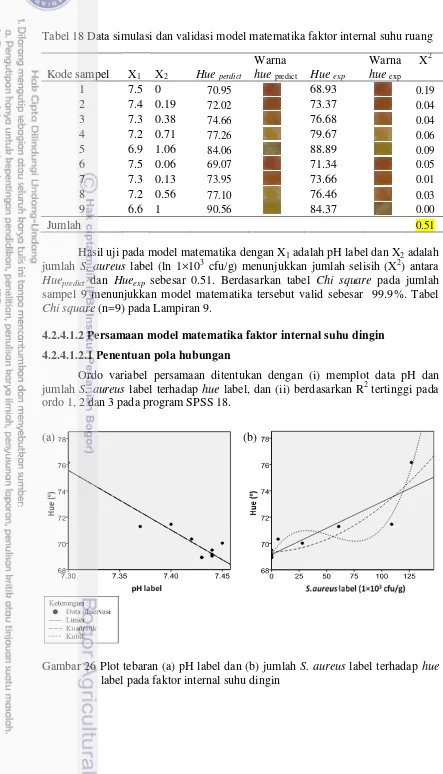
Perubahan warna label yang diakibatkan oleh asam dari fermentasi manitol pada label disebut faktor internal, dan penetrasi gas asam hasil degradasi protein pempek disebut faktor eksternal. Model persamaan untuk menduga ohue label pada penyimpanan suhu ruang, berdasarkan faktor internal adalah ohueSR = 234.41
– 21.79X1 + 0.66X2, untuk faktor eksternal adalah ohueSR = 126.62 – 6.71X3 +
0.92X4 + 1.96X6 dengan nilai validasi masing-masing adalah 97% dan 99.8%. Jika
disimpan pada suhu dingin, persamaan model matematika faktor internalnya adalah ohueSD = 178.29 – 13.86X1 + 0.95X2, sedangkan untuk faktor eksternal
adalah ohueSD = 73.76 + 1.22X4 + 39.25X5 - 26.04X6 dimana nilai validasi
masing-masing adalah 97.6% dan 92%. X1 adalah pH label, X2 adalah jumlah S.aureus label (ln 1×103 cfu/g), X3 adalah pH pempek, X4 adalah jumlah S.aureus
pempek (ln 1×103 cfu/g), X5 adalah TVN pempek (mg/100g), X6SR adalah gas
asam dalam kemasan (ln ppm) dan X6SD adalah gas asam dalam kemasan (ppm).
SUMMARY
MELATI PRATAMA. Designing Indikator Label of Pathogen Bacteria to Monitoring Pempek Quality. Supervised by ENDANG WARSIKI and LIESBETINI HADITJAROKO.
Pempek is one of the popular food from South Sumatra. It is made from minced fish meat and tapioca. Pempek contains high nutrition, therefore it is easily spolied by microorganism. Such microbe, especially pathogenic bacteria are dangerous for health. The growth of pathogenic bacteria should be monitored along the storage of the product thus the freshness and the safety of pempek could be guaranteed. A small label with color indicator was assigned for this taks.
The objective of the research was to (i) identification dominant microbe growing on the pempek; (ii) obtain the best formula of indicator color label based on characteristics of dominant bacteria; (iii) analyzing the effect of packaging condition and temperature storage to label and pempek quality at the best formula aplication during storage; (iv) analyzing color change respon of label to pempek quality at various treatments during storage; (v) predicting shelf life of pempek quality by color change of label; (vi) obtain and validation mathematica model of color to predict color label and pempek quality.
The identification of the dominant microbe is important to get more sensitive label to detect the microbe. This identification was conducted by isolated pempek bacteria into each selective media. The highest number bacteria found in the media would be pointed as dominant bacteria and this media was selected as base media to formulate the indicator label. The formula was produced by adding the base media with phenol red and NaCl in different combination of concentration. The best formula was determined from the media which gave the fastest detection indicating by the color changing of the label. The result and further was analyzed using Duncant test with confidence level of 5%. The best formula was applied to detect the bacteria growth on the pempek. In this experiment, the pempek was packaged with plastic and then store in two different packaging condition i.e. not vacuum and vacuum with temperature storage of cold temperature (5-10oC) and room temperature (30-32oC). The observation of some parameter was done at time of 0, 8, 16, 24, 48 hours with three replications. The experimental design used was factorial completely randomized design in time.
The result showed that dominant bacteria contaminate pempek was Staphylococcus aureus. The composition of label based on manitol salt agar (MSA) by the best formula was 3 mL phenol red 0.0028% (w/v) and 7.5 g NaCl. The variance analysis showed that storage temperature, storage time, interaction between temperature and packaging condition, interaction between temperature and time storage, interaction between packaging condition and storage time, interaction of the three treatments had significant effect on pH label, hue label, S. aureus number of label, S. aureus number of pempek, H2S, SO2 and NO. Further
more packaging condition had not significant effect on that all parameters.
which represented into ohue. The value hue of label (o) was increase from 68.93 to 88.89 and 84.37 at room temperature, at cold temperature to 71.29 dan 76.16 for each not vacuum and vacuum packed. The number of S. aureus label (cfu/g) was increase from 0 to 1×103 and 1.22×103 at room temperature, to 61 and 0.12×103 at cold temperature for each not vacuum and vacuum packed. The number of S. aureus pempek (cfu/g) increase from 30 to 354×103 and 273×103 at room temperature, to 1.42×103 and 0.89×103 at cold temperature for each not vacuum and vacuum. The volatile nitrogen (mg/100g) increase from 0 to 0.37 and 0.28 at room temperature, to 0.19 and 0.10 at cold temperature for each not vacuum and vacuum packed. The concentrations of H2S (ppm) increase from 0 to 0.57 and
0.37 at room temperature for each not vacuum and vacuum packed, while at cold temperature the increasing only for not vacuum such as 0.07. The concentrations of SO2 (ppm) increase from 0 to 0.43 and 0.48 at room temperature, to 0.23 and
0.29 at cold temperature for each not vacuum and vacuum packed. The increasing concentrations of NO (ppm) only at room temperature such as from 0 to 0.1 and 0.07 for each not vacuum and vacuum packed.
The value pH of pempek decrease from 7.67 to 6.2 and 7.13 at room temperature for each not vacuum and vacuum packed, while 7.2 for both not vacuum and vacuum at cold temperature. The consumer acceptance at range value from 3 (very like) to 1 (not like) to aroma decrease from 2.4 to 1.1 and 1.4 at room temperature, to 2.4 and 2.3 at cold temperature for each not vacuum and vacuum packed. The consumer acceptance to texture of pempek decrease from 2.4 to 1 and 1.7 at room temperature for each not vacuum and vacuum packed, while 1.9 for both not vacuum and vacuum at cold temperature. The consumer acceptance to color of pempek decrease from 2.8 to 1.1 and 1.9 at room temperature for each not vacuum and vacuum packed, while 2.5 for both not vacuum and vacuum at cold temperature.
The label resulted from this research was proved that it could monitor the pempek quality before number of S. aureus pempek 1×103 cfu/g, pH pempek 7 or 7, consumer acceptance was exceeded 2 or 2 (like). The performance of label to shelf life prediction by color difference on color guidelines of sticker label. The red color shows that the pempek has a long shelf life, the orange color shows that shelf life coming to the end (warning), the yellow shows that expired.
The color change of label due to acid from mannitol fermentation in label was called internal factor, and the penetration of acid gas from protein pempek degradation was called external factor. The mathematica model to predict hue label at room temperature based on internal factor was ohueSR = 234.41 – 21.79X1
+ 0.66X2, for external factor was ohueSR = 126.62 – 6.71X3 + 0.92X4 + 1.96X6 by
value of validation for each equations were 97% and 99.8%. If it were stored at cold temperature, the equation of mathematica model to predict hue value based on internal factors was ohueSD = 178.29 – 13.86X1 + 0.95X2, for external factor
was ohueSD = 73.76 + 1.22X4 + 39.25X5 - 26.04X6 which the value of validation
for each equation were 97.6% and 92%. X1 was pH label, X2 was number of S.aureus on label (ln 1×103 cfu/g), X3was pH pempek, X4 was number of S.aureus
on pempek (ln 1×103 cfu/g), X5 was TVN pempek (mg/100g), X6SR was acid gas
inner packaging (ln ppm), and X6SD was acid gas inner packaging (ppm)
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PERANCANGAN LABEL INDIKATOR BAKTERI PATOGEN
UNTUK PEMANTAUAN KUALITAS PEMPEK
MELATI PRATAMA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Industri Pertanian
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2014 sampai Agustus 2015 ini adalah Perancangan Label Indikator Bakteri Patogen untuk Pemantauan Kualitas Pempek.
Terima kasih penulis ucapkan kepada Ibu Dr Endang Warsiki, STP MSi dan Ibu Dr Ir Liesbetini Haditjaroko, MS selaku pembimbing serta Ibu Dr Ir Emmy Darmawati, MSc selaku penguji. Disamping itu, penulis ucapkan terimakasih kepada papa tercinta Agustinus, mama tercinta Siti Rohana, saudara-saudari Melati Ireng Sari ST, Febriyandi Putra, M Wais Alkurni ST atas doa, perhatian dan suportnya dalam proses meraih Master ini. Untuk sahabat-sahabat khususnya yang berasal dari Sumatera Selatan yang telah membantu dalam penelitian ini (Rapeka Reli, Zakiah, Oktaviana MSi, Dela H MSi, Mega, Putri Iren MSi, Irfan), sahabat-sahabat Maryam (Mawar, Fiya, Siti, Laila, Ratih MSi, kak Nelinda) dan teman-teman pasca TIP 2013. Penulis ucapkan terimakasih kepada Direktorat Jendral Pendidikan Tinggi (DIKTI) dalam program BPPDN Dikti 2013 dan LPPM 2014 yang telah menjadi sponsor. Ungkapan terimakasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga atas doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2016
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiv
1 PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Perumusan Masalah 1
1.3 Tujuan Penelitian 2
1.3 Ruang Lingkup 2
1.4 Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
2.1 Kemasan Cerdas 3
2.2 Bakteri Patogen 4
2.3 Indikator Warna 4
2.4 Pempek 5
2.5 Prediksi Umur Simpan 6
3 METODOLOGI PENELITIAN 7
3.1 Bahan 7
3.2 Alat 7
3.3 Waktu dan Tempat 7
3.4 Metode Penelitian 7
3.5 Rancangan Percobaan 16
4 HASIL DAN PEMBAHASAN 17
4.1 Penelitian Pendahuluan 17
4.2 Penelitian Utama 20
5 KESIMPULAN DAN SARAN 56
5.1 Kesimpulan 56
5.2 Saran 56
DAFTAR PUSTAKA 57
DAFTAR TABEL
1 Variasi Formula Label 9
2 Identifikasi mikroba kontaminan dominan pada pempek 17
3 Uji lanjut identifikasi S. aureus 17
4 Perubahan warna label MSA terhadap pertumbuhan S. aureus pada
label tidak dikemas 18
5 Perubahan warna label MSA terhadap pertumbuhan S. aureus pada
label kemas 19
6 Nilai hue dan waktu perubahan warna pada masing-masing formula 20 7 Perubahan warna label pada berbagai kondisi kemasan dan suhu
penyimpanan 22
8 Waktu perubahan warna label dalam memantau kualitas pempek
selama penyimpanan 36
9 Prediksi umur simpan pempek berdasarkan metode ESS 37 10 Kategori warna label untuk memprediksi umur simpan 37 11 Kesesuaian perubahan warna label dalam memprediksi umur simpan
Pempek 38
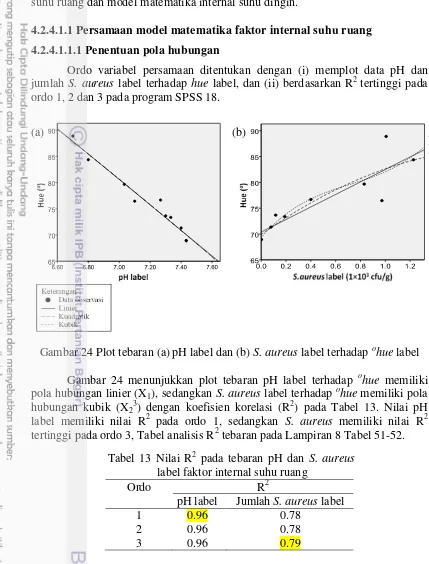
12 Warna label pada masing-masing nilai ohue (pedoman warna) 39 13 Nilai R2 pada tebaran pH dan S. aureus label faktor internal suhu ruang 40 14 ANOVAb pH dan jumlah S. aureus label terhadap ohue label faktor
internal suhu ruang 41
15 Koefisiena model dan pengaruh variabel terhadap perubahan ohue label
faktor internal suhu ruang 42
16 Nilai R2 (adj) model persamaan matematika faktor internal suhu ruang 42 17 Uji asumsi kelayakan model matematika faktor intenal suhu ruang 42 18 Data simulasi dan validasi model matematika faktor internal suhu ruang 43 19 Nilai R2 pada tebaran pH dan S.aureus label faktor internal suhu dingin 44 20 Koefisiena model dan pengaruh variabel terhadap perubahan ohue label
faktor internal suhu dingin 45
21 Nilai R2 (adj) model persamaan matematika faktor internal suhu dingin 45 22 Uji asumsi kelayakan model matematika faktor internal suhu dingin 45 23 Data simulasi dan validasi model matematika faktor internal suhu dingin 46 24 Nilai R2 pada tebaran pH, jumlah S. aureus, total volatil nitrogen pempek dan gas asam dalam kemasan faktor eksternal suhu ruang 47 25 Koefisiena model dan pengaruh variabel terhadap perubahan ohue label
faktor eksternal suhu ruang (variabel TVN) 49 26 ANOVAb pH, jumlah S. aureus dan gas asam pempek terhadap ohue label
faktor eksternal suhu ruang 49
33 ANOVAb jumlah S. aureus, TVN dan gas asam terhadap ohue label faktor
eksternal suhu dingin 54
34 Koefisiena model dan pengaruh variabel terhadap perubahan ohue label faktor eksternal suhu dingin (tanpa vaiabel pH pempek) 54 35 Nilai R2 (adj) model persamaan faktor eksternal suhu dingin 54 36 Uji asumsi kelayakan model matematika faktor eksternal suhu dingin 55 37 Data simulasi dan validasi model matematika faktor eksternal suhu dingin 55
38 Hasil analisis ragam pH label 71
39 Hasil analisis ragam ohue label 71
40 Hasil analisis ragam chroma label 72
41 Hasil analisis ragam jumlah S. aureus label 72 42 Hasil analisis ragam jumlah S. aureus pempek 73 43 Hasil analisis ragam total volatil nitrogen 73
44 Hasil analisis ragam H2S 74
45 Hasil analisis ragam SO2 74
46 Hasil analisis ragam NO 75
47 Hasil analisis ragam pH pempek 75
48 Hasil analisis ragam aroma pempek 76
49 Hasil analisis ragam tekstur pempek 76
50 Hasil analisis ragam warna pempek 77
51 Ringkasan model dan estimasi pH label faktor internal suhu ruang 79 52 Ringkasan model dan estimasi S. aureus label faktor internal suhu ruang 79 53 Uji kenormalan (Kolmogorov-Smirnov), kehomogenan (Glejser),
Multikolinieritas, Autokolinieritas) faktor internal suhu ruang 79 54 Ringkasan model dan estimasi pH label faktor internal suhu dingin 79 55 Ringkasan model dan estimasi S. aureus label faktor internal suhu dingin 80 56 Uji kenormalan (Kolmogorov-Smirnov), kehomogenan (Glejser),
Multikolinieritas, Autokolinieritas) faktor internal suhu dingin 80 57 Ringkasan model dan estimasi pH pempek faktor ekstenal suhu ruang 80 58 Ringkasan model dan estimasi S. aureus pempek faktor eksternal
suhu ruang 80
59 Ringkasan model dan estimasi TVN faktor eksternal suhu ruang 81 60 Ringkasan model dan estimasi gas asam faktor eksternal suhu ruang 81 61 Uji kenormalan (Kolmogorov-Smirnov), kehomogenan (Glejser),
Multikolinieritas, Autokolinieritas) faktor eksternal suhu ruang 81 62 Ringkasan model dan estimasi pH pempek faktor eksternal suhu dingin 81 63 Ringkasan model dan estimasi S. aureus pempek faktor eksternal
suhu dingin 82
64 Ringkasan model dan estimasi TVN faktor eksternal suhu dingin 82 65 Ringkasan model dan estimasi gas asam faktor eksternal suhu dingin 82 66 Uji kenormalan (Kolmogorov-Smirnov), kehomogenan (Glejser),
DAFTAR GAMBAR
1 Struktur kimia phenol red (A) kondisi basa, (B) kondisi asam 5 2 Diagram alir penelitian identifikasi mikroba dominan pada pempek 8
3 Diagram alir penelitian formulasi label 9
4 Kerangka kerja penelitian utama 10
11 Alur pemecahan manitol menjadi asam di dalam sel S. aureus
(Kenny et al. 2013, Ferreira et al. 2013) 24 12 Mekanisme perubahan warna label akibat fermentasi manitol 25 13 Mekanisme perubahan warna label akibat penetrasi gas hasil degradasi 25
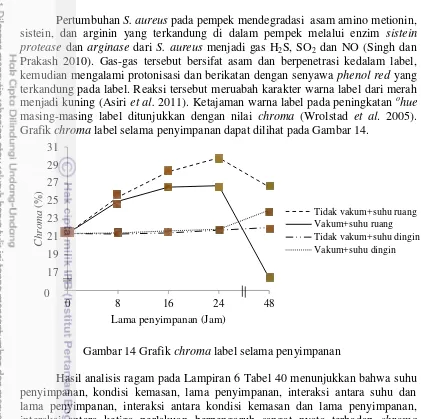
14 Grafik chroma label selama penyimpanan 26
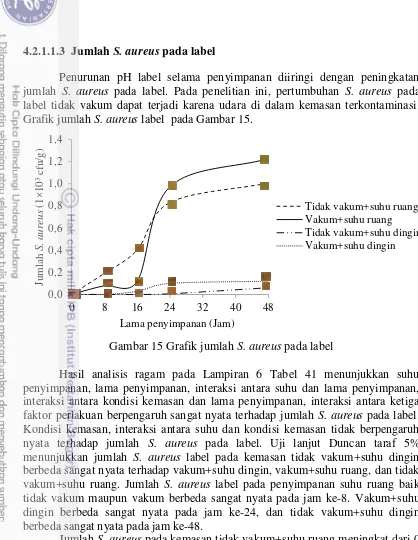
15 Grafik jumlah S. aureus pada label 27
16 Grafik pertumbuhan S. aureus pada pempek 28
17 Grafik konsentrasi TVN pempek selama penyimpanan 30 18 Konsentrasi gas (a) H2S, (b) SO2, (c) NO di dalam hasil degradasi
pempek di dalam kemasan 31
19 Grafik perubahan pH pempek selama penyimpanan 32 20 Grafik kesukaan konsumen terhadap aroma pempek selama penyimpanan 33 21 Grafik kesukaan konsumen terhadap tekstur pempek selama
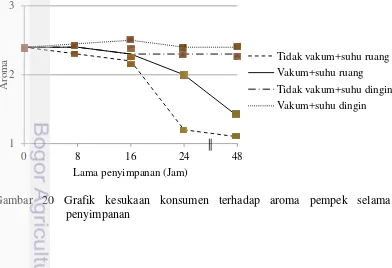
penyimpanan 34
22 Grafik kesukaan konsumen terhadap warna pempek selama
penyimpanan 35
23 Desain label pada (a) kemasan vakum dan (b) kemasan tidak vakum 38 24 Plot tebaran (a) pH label dan (b) jumlah S. aureus label terhadap hue label (d) gas asam terhadap hue label faktor eksternal suhu ruang 47 29 Plot tebaran (a) S. aureus pempek (ln 1×103 cfu/g), (b) TVN (ln mg/100g), (c) gas asam (ln ppm) terhadap hue label faktor eksternal suhu ruang 48 30 Plot tebaran (a) pH pempek dan (b) S.aureus pempek (b) terhadap hue
label faktor eksternal suhu dingin 51
31 Plot tebaran (c) TVN pempek dan (d) gas asam terhadap hue label faktor
32 Plot tebaran S. aureus pempek (ln 1×103 cfu/g)terhadap hue label faktor
eksternal suhu dingin 53
33 Mekanisme kerja Lancom IV 67
DAFTAR LAMPIRAN
1 Diagram alir pembuatan pempek lenjer 62
2 Prosedur analisa 63
3 Diagram alir pembuatan label indikator warna 68
4 Formulir uji kesukaan 69
5 Hasil uji identifikasi bakteri dominan pada masing-masing bakteri 70
6 Hasil analisis ragam penelitian utama 71
7 Penentuan rentang ohue pada masing-masing warna label 78 8 Analisis ordo dan uji kelayakan model persamaan matematika 79
1 PENDAHULUAN
1.1 Latar Belakang
Pempek adalah salah satu makanan tradisional khas Sumatera Selatan yang berbahan dasar daging ikan giling dan tapioka. Pempek mengandung kadar air berkisar 58.59%, protein berkisar 15.84%, karbohidrat berkisar 20.17%, lemak berkisar 1.41% dan kadar abu 1.57% (Rosdiana 2002). Komponen-komponen tersebut menyebabkan pempek mudah mengalami kerusakan. Hasil penelitian Karneta et al. (2013) menunjukkan pempek dengan komposisi ikan 39.7% yang disimpan pada suhu ruang hanya mampu bertahan selama satu hari. Kerusakan atau kemunduran mutu pempek ditandai dengan perubahan pada tekstur pempek, terbentuk lendir pada permukaan, warna pempek berubah menjadi kuning atau kecoklatan, timbul bau busuk dan penurunan pH.
Hal itu disebabkan adanya aktivitas mikroba yang mendegradasi senyawa terutama protein menjadi senyawa yang lebih sederhana seperti asam amino dan terdegradasi lebih lanjut menjadi amonia, trimetilamin, hidrogen sulfida (Karneta et al. 2013). Rosdiana (2002) menyatakan bahwa kandungan protein pada pempek yang disimpan dalam suhu ruang selama dua hari mengalami penurunan dari 15.84% menjadi 13.42%. Keberadaan mikroba pada pempek terutama bakteri patogen dibatasi oleh BPOM (Badan Pengawas Obat dan Makanan) melalui penetapan batas maksimum cemaran mikroba dalam makanan No. HK 00061524011 tahun 2009 untuk produk perikanan yang dikukus atau direbus memiliki batas cemaran maksimum yaitu Escherichia coli sebesar <3 cfu/g, Salmonella adalah negatif/25g dan Staphylococcus aureus sebesar 1×103 cfu/g.
Peraturan ini menjadi dasar dalam pemantauan kualitas pempek. Pemantauan kualitas pempek dapat dilakukan dengan penggunaan kemasan cerdas. Kemasan cerdas adalah sistem yang melekat sebagai label, yang dimasukkan ke dalam kemasan atau dicetak ke bahan kemasan untuk memantau kualitas produk (Kerry dan butler 2008). Beberapa kemasan cerdas yang telah diteliti yaitu kemasan cerdas menggunakan indikator daun erpa (Nofrida et al. 2013), kemasan cerdas pewarna natural dan sintetik (Warsiki dan Putri 2012), kemasan cerdas pemantau kebusukan ikan (Pacquit et al. 2007) dan kemasan cerdas pemantau umur simpan daging ayam beku (Brizio dan Prentice 2014). Kemasan cerdas yang dirancang pada penelitian ini adalah label indikator bakteri patogen. Penelitian ini menggunakan label sebagai media pemberi informasi.
Label direkatkan pada permukaan bagian dalam kemasan. Label dibuat dengan menambahkan bahan pewarna yang dapat bereaksi dengan hasil metabolisme akibat pertumbuhan mikroba pada bahan. Bahan pewarna yang digunakan adalah indikator warna yang memiliki rentang pH 6 hingga 8, karena pempek memiliki pH sekitar 7.5. Penelitian terhadap identifikasi mikroba dominan pada pempek dan formulasi label perlu dilakukan untuk mendapatkan formula yang lebih sensitif terhadap pertumbuhan mikroba pada pempek.
1.2 Perumusan Masalah
mikroba. Adanya aktivitas mikroba pada pempek dibatasi jumlahnya oleh Badan POM dalam penetapan batasan maksimum cemaran mikroba. Peraturan tersebut dijadikan sebagai dasar dalam pemantauan kualitas pempek selama penyimpanan. Pemantauan kualitas pempek selama penyimpanan dapat dilakukan dengan penggunaan kemasan cerdas. Kemasan cerdas akan memantau kualitas pempek melalui perubahan warna label. Label merupakan perangkat informasi yang diletakkan dan direkatkan bagian dalam kemasan. Perancangan terhadap label diperlukan untuk mendapatkan label yang akurat dalam memantau kualitas pempek.
1.3 Tujuan Penelitian
Tujuan umum penelitian ini adalah merancang label indikator warna pendeteksi kerusakan pempek akibat pertumbuhan mikroba dominan yang dapat merusak pempek dan membahayakan kesehatan. Tujuan khusus penelitian ini adalah untuk (i) Mengidentifikasi mikroba dominan perusak pempek; (ii) Mendapatkan formula label terbaik berdasarkan karakteristik mikroba dominan; (iii) Menganalisis pengaruh kondisi kemasan dan suhu penyimpanan pempek terhadap label dan pempek pada aplikasi formula terbaik selama penyimpanan; (iv) Menganalisis respon perubahan warna label terhadap kualitas pempek pada berbagai perlakuan (kondisi kemasan dan suhu penyimpanan) selama penyimpanan; (v) Memprediksi umur simpan pempek melalui perubahan warna label; (vi) Mendapatkan dan memvalidasi model persamaan matematika perubahan warna label untuk memprediksi warna label dan kualitas pempek.
1.4 Ruang Lingkup
Ruang lingkup penelitian ini dibatasi pada (i) Label yang dibuat adalah label indikator khusus pemantau pertumbuhan mikroba dominan pada pempek yang dikemas dengan LDPE (low density polyethylene); (ii) Formula yang digunakan berdasarkan karakeristik bakteri dominan; (iii) Kemasan dikondisikan pada vakum dan tidak vakum, penyimpanan pada suhu dingin (5 hingga 10 oC) dan suhu ruang (30 hingga 32 oC); (iv) Respon perubahan warna label dianalisis berdasarkan jumlah maksimum cemaran mikroba dominan berdasarkan BPOM No. HK 00061524011 2009, pH pempek minimum 7 dan penerimaan konsumen minimum 2 (skala 3-1); (v) Penentuan umur simpan menggunakan metode Extended Shelf Studies (ESS); (vi) Model persamaan matematika ditentukan menggunakan analisis regresi berganda pada program SPSS 18.
1.5 Manfaat Penelitian
2 TINJAUAN PUSTAKA
2.1 Kemasan Cerdas
Kemasan modern dibagi menjadi dua jenis yaitu kemasan aktif dan kemasan cerdas. Kemasan cerdas (smart packaging) atau intelligent packaging adalah sistem kemasan yang mampu mendeteksi, merekam dan memberikan informasi produk selama penyimpanan untuk pengambilan keputusan dalam meningkatkan keamanan dan mempertahankan kualitas produk (Yam et al. 2005). Kemasan cerdas menggunakan label yang dimasukkan ke dalam kemasan atau dicetak pada kemasan makanan untuk memantau kualitas produk, melacak titik kritis dan memberikan informasi lebih rinci dalam rantai pasok. Label akan memberikan informasi mengenai sejarah produk (kondisi penyimpanan dan pertumbuhan mikroba) (Han et al. 2005).
Fungsi kemasan cerdas dapat diperoleh dari indikator, sensor atau perangkat yang mampu menginformasikan tentang kondisi produk. Indikator adalah perangkat yang menunjukkan ada atau tidaknya zat atau reaksi antar zat ditunjukkan dengan perubahan karakteristik, umumnya pada warna (Lee dan Rahman 2014). Indikator menginformasikan tentang perubahan yang terjadi pada produk atau lingkungannya (suhu, pH) secara visual. Indikator yang disimpan secara internal biasanya ditempatkan pada headspace kemasan atau direkatkan pada penutup kemasan. Contoh indikator internal adalah indikator oksigen, karbon dioksida, pertumbuhan mikroba dan mikroba patogen. Indikator eksternal yaitu indikator waktu dan suhu (Ahvenainen 2003).
Teknologi ini mengintegrasikan berbagai keahlian seperti kimia, biokimia, fisika, elektronik dan teknologi pangan. Kemasan cerdas memiliki potensi besar dalam pengembangan sistem baru penginderaan terintegrasi dalam kemasan makanan yang berada diluar teknologi konvensional (Kuswandi et al. 2012). Penggunaan label indikator warna sebagai kemasan cerdas dilakukan dengan melihat perubahan warna pada label. Label yang terintegrasi dengan kemasan pangan dapat mendeteksi bahan kimia, patogen dan racun yang terdapat dalam makanan. Label dibuat dengan menambahkan bahan pewarna yang dapat bereaksi dengan hasil metabolisme akibat pertumbuhan mikroba.
Pengembangan indikator kesegaran pangan berdasarkan pendeteksian perubahan kimia yang berhubungan dengan pertumbuhan mikroba pada produk makanan, dan memberikan alternatif analisis sensori-mikrobiologi dengan murah dan cepat. Sistem indikator menggunakan hasil metabolisme sebagai informasi dalam memantau kebusukan ikan berdasarkan total volatil nitrogen (TVN). Sensor mengandung pH pewarna sensitif yaitu bromocresol green yang diperangkapkan ke dalam bahan polimer (Kuswandi et al. 2012).
indikator dengan senyawa volatil (H2S, CO2) yang dihasilkan oleh mikroba pada
label. Perubahan warna label terjadi dari hijau menjadi orange (Napwinyuwong et al. 2010). Label pemantau kebusukan ikan menggunakan bromocresol green sebagai pewarna indikator. Perubahan warna label dari kuning menjadi biru akibat reaksi antara bromocresol green dengan volatil nitrogen (Pacquit et al. 2007).
2.2 Bakteri Patogen
Keracunan makanan dapat disebabkan oleh pertumbuhan mikroba berbahaya pada makanan yang dikonsumsi. Sebanyak 66% penyebab keracunan makanan berasal dari bakteri. Dua tipe keracunan makanan yaitu intoksikasi dan infeksi. Intoksikasi terjadi ketika toksin yang dihasilkan oleh bakteri patogen dikonsumsi, sedangkan infeksi terjadi ketika pengkonsumsian makanan yang mengandung bakteri patogen (Addis dan Sisay 2015). Beberapa kasus keracunan makanan dilaporkan telah terjadi. Sebanyak 1210 kasus di Perancis tahun 2010, 2600 kasus di Inggris tahun 2010, 25000 kasus di Australia dan Amerika pada tahun 2010 (Teisl dan Roe 2010), 1000 kasus di Surabaya tahun 2013 (Ariani dan Haryono 2013), 609 kasus di Tangerang tahun 2010 (DKT 2010).
Kontaminasi mikroba akibat penanganan yang salah dapat terjadi pada saat proses pengolahan maupun pengemasan (Addis dan Sisay 2015). Menurut BPOM (2009), bakteri patogen yang dapat mengkontaminasi pempek adalah E. coli, Salmonella sp. dan S. aureus. Keberadaan bakteri-bakteri tersebut pada makanan yang dikonsumsi dapat menyebabkan mual, muntah, diare bahkan kematian.
E. coli adalah bakteri Gram negatif berukuran 3m, non spora, non motil, anaerobik fakultatif dan dapat memfermentasikan gula menjadi asam laktat, asetat dan format, dapat hidup pada selang pH 4 hingga 9 dan suhu 10 hingga 45 oC (Gupta dan Sharma 2015). Salmonella sp. adalah Gram negatif berukuran 1 hingga 2.5m, non spora, anaerobik fakultatif, dapat tumbuh pada selang pH 4 hingga 9 dan suhu 5 hingga 46.2 oC (Addis dan Sisay 2015, Wisner et al. 2001).
S. aureus merupakan bakteri Gram positif berdiameter 0.5 hingga 1 m, non motil, non spora, aerobik atau anaerobik fakultatif yang memfermentasi gula (termasuk manitol) kecuali rafinosa dan salisin, memproduksi asam laktat selama fermentasi, katalase dan koagulase positif, resisten terhadap garam tinggi hingga 20%, dapat hidup pada selang pH 4 hingga 10, suhu 6 hingga 48.5 oC (Magdevis et al. 2012), tumbuh optimum pada pH 7.4 hingga 7.6 (Singh dan Prakash 2010).
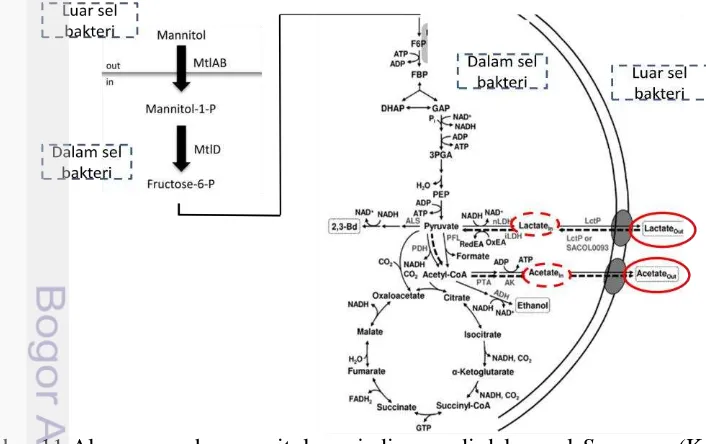
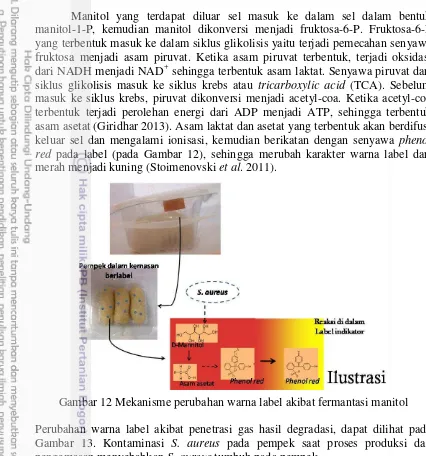
S. aureus menggunakan gula dan protein sebagai sumber karbon dan energi, mengkatabolisme glukosa pada kondisi anaerobik dengan hasil akhir asam laktat, mengkatabolisme manitol menjadi fruktosa-6 fosfat lebih lanjut menjadi asam asetat dan laktat pada kondisi aerobik (Kenny et al. 2013, Ferreira et al. 2013). Racun enterotoxin S. aureus diproduksi pada fase pertumbuhan eksponensial atau stasioner. S. aureus menghasilkan enzim sistein protease (Kolar et al. 2013). Sistein protease mendegradasi peptida dan protein membentuk senyawa sulfur volatil (Young et al. 2001).
2.3 Indikator Warna
(2013) menyatakan beberapa indikator asam basa antara lain bromocresol green, bromocresol purple, bromophenol blue, bromothymol blue, methyl orange, methyl red, phenolphthalein, phenol red dan sebagainya. Bromocresol green memiliki rentang pH 3.8-5.4 dengan perubahan warna dari kuning menjadi biru. Bromocresol purple memiliki rentang pH 5.2-6.8 dengan perubahan warna dari kuning menjadi ungu. Bromophenol blue memiliki rentang pH 3.0-4.6 dengan perubahan warna dari kuning menjadi biru. Bromothymol blue memiliki rentang pH dari 6.0-7.6 dengan perubahan warna dari kuning menjadi biru. Methyl orange memiliki rentang pH 3.2-4.4 dengan perubahan warna dari merah menjadi kuning. Methyl red memiliki rentang pH dari 4.8-6.0 dengan perubahan warna dari merah menjadi kuning. Phenolphthalein memiliki rentang pH 8.2-10 dengan perubahan warna dari putih menjadi pink.
Phenol red atau phenolsulfonphthalein (PS) digunakan sebagai indikator asam basa dalam analisis kuantitatif (Wu et al. 2013). Phenol red akan berwarna kuning pada pH 6.5 (asam) dan menjadi merah pada pH 8.1 (basa) (Gundogdu et al. 2008). Phenol red larut dalam air dan membentuk ikatan hidrogen. Molekul phenol red adalah tetrahedron teratur yang berdimensi besar. Indikator phenol red sensitif terhadap pH. Ionisasi hidrogen dari asam akan mempengaruhi pH (Lee at al. 2004). Reaksi perubahan struktur kimia phenol red dari basa menjadi asam dapat dilihat pada Gambar 1.
Gambar 1 Struktur kimia phenol red kondisi (A) basa, (B) asam (Wu et al. 2006)
2.4 Pempek
Pempek dibuat melalui pencampuran bahan, pembentukan dan pemasakan (diagram alir pada Lampiran 1). Masalah yang dihadapi oleh industri pempek adalah umur simpan yang pendek. Parameter penurunan mutu pempek meliputi tekstur (kekenyalan), total volatil nitrogen dan total mikroba (Karneta et al. 2013). Tanda-tanda kerusakan pempek yaitu perubahan tekstur, terbentuknya lendir pada permukaan dan terjadinya perubahan warna. Hal itu disebabkan oleh adanya aktivitas mikroba yang mendegradasi protein pempek menjadi senyawa asam amino, terimetilamin dan amonia.
Berdasarkan penelitian Karneta et al. (2013), tekstur pempek yang disimpan pada suhu ruang mengalami penurunan seiring dengan lamanya penyimpanan yaitu dari 350 gf menjadi 250 gf pada komposisi 39.7% daging ikan gabus dan suhu perebusan 95 oC. Total volatil nitrogen juga akan mengalami peningkatan seiring dengan lamanya penyimpanan. Total volatil nitrogen mengalami peningkatan dari 8 hingga 28 mg/100 g. Total volatil nitrogen
+ H+
merupakan parameter untuk menentukan kemunduran mutu ikan dan produk olahan ikan yang mengandung protein. Penurunan mutu pempek selama penyimpanan disebabkan adanya aktivitas mikroba. Keberadaan mikroba pada makanan merupakan parameter kualitas pempek selama penyimpanan. Kontaminasi bakteri tersebut dapat terjadi pada pempek karena proses produksi pempek yang menggunakan tenaga manusia dan kontak pempek dengan udara yang tidak dapat dihindari (Kusumaningrum et al. 2002).
Pada penelitian Rosdiana (2002), pempek ikan tenggiri mengandung kadar air yaitu 58.59% dan protein 15.84% dengan kandungan asam amino arginin (g/100 g) 0.557, histidin 0.268, lisin 0.843, leusin 0.747, isoleusin 0.424, methionin 0.271, fenilalanin 0.363, threonin 0.404, triptofan 0.106, valin 0.478. Asam amino-asam amino tersebut didegradasi oleh enzim protease yang dihasilkan S. aureus menjadi gas asam seperti hidrogen sulfida, amonia (Filipiak et al. 2012) yang menyebabkan timbulnya bau tidak sedap. Degradasi asam amino pada pempek ikan tenggiri ditunjukkan dengan penurunan kadar arginin (g/100g) menjadi 0.556, histidin 0.266, lisin 0.834, leusin 0.739, methionin 0.268, fenilalanin 0.360, triptofan 0.105, dan valin 0.475 (Rosdiana 2002).
2.5 Prediksi Umur Simpan
Umur simpan makanan didefinisikan sebagai waktu atau periode tingkat penerimaan kualitas makanan baik dari nilai keamanan atau organoleptik. Umur simpan bergantung pada empat faktor yaitu formula, proses produksi, pengemasan dan kondisi penyimpanan (Labuza dan Shimoni 2000). Umur simpan produk merupakan salah satu informasi yang sangat penting bagi konsumen karena terkait keamanan produk pangan dan untuk jaminan mutu pada saat produk sampai ke tangan konsumen.
Secara garis besar pendugaan umur simpan produk dapat ditetapkan dengan dua metode yaitu Extended Shelf Studies (ESS) dan Accelerated Shelf Life Testing (ALST). ESS adalah penentuan tanggal kadaluarsa dengan menyimpan produk pada kondisi penyimpanan sebenarnya. Cara ini menghasilkan hasil yang paling tepat, namun memerlukan waktu yang lama. Sedangkan metode pendugaan umur simpan ASLT yaitu dengan cara menyimpan produk pangan pada lingkungan yang dapat menyebabkan produk cepat rusak, baik pada kondisi suhu atau kelembapan ruang penyimpanan yang tinggi (Harris dan Fadli 2014, Budijanto et al. 2010). Menurut Rosdiana (2002) dan Karneta et al. (2013) pempek memiliki umur simpan yang relatif singkat yaitu 24 hingga 48 jam sehingga pada penelitian ini metode ESS dipilih. Pengembangan prediksi umur simpan pada penelitian ini dilakukan melalui perubahan warna label.
Warna label dapat diprediksi menggunakan analisis regresi berganda. Regresi berganda merupakan regresi yang memiliki dua atau lebih variabel independen (bebas), dimana variabel independen mempengaruhi varibel dependen (terikat) (Nurlifa et al. 2014). Pengujian asumsi klasik perlu dilakukan untuk memperoleh hasil yang akurat. Pengujian asumsi klasik meliputi uji normalitas, heteroskesdasitas, multikolinieritas dan autokorelasi. Model regresi yang baik adalah yang memiliki distribusi normal, memiliki hasil yang homogen, kesalahan koefisien regresi yang kecil, dan memiliki koefisien yang stabil (Bramasto 2014).
3 METODOLOGI PENELITIAN
3.1 Bahan
Bahan yang digunakan pada penelitian ini meliputi bahan identifikasi mikroba dominan dan optimasi formula meliputi brilliant green lactose bile, EC broth, eosin methylene blue, tryptone, MR-VP broth, pereaksi pewarnaan gram, simmon citrate agar, plate count agar, bismuth sulfite agar, brain heart infusion, HE agar, lysine iron agar, salmosis salt agar, tryptone soya agar, triple sugar iron agar, baird parker agar and egg yolk, garam fisiologis dan kultur S. aureus. Selanjutnya, bahan untuk aplikasi label meliputi pempek lenjer berukuran 3×8 cm berdiameter 1.5 cm (pempek digunakan dalam penelitian terbuat dari daging ikan tenggiri 50% (b/b) dan tapioka 33.3% (b/b)), plastik Low Density Polyethylene (LDPE), plastik mika (PVC), plastik polyamide. Bahan pembuatan label meliputi manitol, agar bubuk, susu cair, tapioka, NaCl dan phenol red. Bahan uji meliputi indikator fenolftalein, asam borat, asam perklorat dan asam klorida.
3.2 Alat
Alat yang digunakan pada penelitian ini meliputi alat gelas yaitu cawan petri, tabung reaksi, piring, labu Erlenmeyer, seperangkat alat ekstraksi, destilasi dan titrasi. Alat digital yaitu Chromameter CR-400, pH meter merek ATC PH-009(I)A, gas analyzer Lancom IV. Alat pendukung lainnya yaitu inkubator, lemari pendingin, sealer, dan vacuum packer.
3.3 Waktu dan Tempat
Penelitian pendahuluan yang meliputi identifikasi mikroba dominan dan optimasi formula dilakukan pada bulan Oktober 2014 hingga April 2015. Penelitian utama dilakukan pada bulan Juni hingga Agustus 2015. Identifikasi mikroba dominan, optimasi formula, pembuatan label dan pengukuran mikroba pempek dilakukan di Laboratorium Mikrobiologi Fakultas Kedokteran Hewan Institut Pertanian Bogor. Pengukuran komponen kimia dan organoleptik dilakukan di Laboratorium Dasar Ilmu Terapan TIN Fakultas Teknologi Pertanian Institut Pertanian Bogor. Pengukuran gas asam di dalam kemasan dilakukan di Laboratorium Kualitas Udara dan Kebisingan Fakultas Teknik Sipil dan Lingkungan Institut Pertanian Bogor.
3.4 Metode Penelitian
Penelitian ini dibagi menjadi dua tahap yaitu penelitian pendahuluan dan penelitian utama.
3.4.1 Penelitian Pendahuluan
meliputi identifikasi bakteri patogen yang dominan pada pempek dan penentuan formulasi label indikator mikroba dominan.
3.4.1.1 Identifikasi bakteri patogen yang dominan pada pempek
Identifikasi mikroba bertujuan untuk menentukan bakteri patogen yang akan dideteksi secara spesifik oleh label indikator. Sampel pempek dikemas menggunakan plastik polyamide berukuran 13×13×3.5 cm sebanyak 3 pcs dan dikondisikan menjadi dua yaitu vakum dan tidak vakum. Pempek yang telah dikemas, disimpan pada suhu ruang dan diamati setiap 12 jam. Pempek pada jam ke-0 sebagai kontrol. Tujuan perlakuan kondisi kemasan adalah untuk mengetahui kemungkinan bakteri dominan. Jenis mikroba yang diidentifikasi berdasarkan mikroba yang telah ditentukan oleh Badan Pengawas Obat dan Makanan (BPOM) pada peraturan Kepala BPOM RI Nomor HK.00061524011 Tahun 2009. Bakteri yang diuji yaitu E. coli, Salmonella sp, dan S. aureus. Pengujian bakteri pada pempek mengacu pada SNI 01-2331.1-2006, SNI 01-2332.2-2006, dan SNI 2332.9-2011 (prosedur analisa disajikan pada Lampiran 2). Berikut Gambar 2 adalah kerangka kerja penelitian identifikasi mikroba patogen.
Gambar 2 Diagram alir penelitian identifikasi mikroba dominan pada pempek
3.4.1.2 Penentuan formula label indikator mikroba dominan
Formula label ditentukan berdasarkan karakteristik bakteri kontaminan yang dominan tumbuh pada pempek. Bakteri dominan mampu memanfaatkan manitol dan resisten terhadap garam sehingga komposisi label didasarkan pada komposisi Manitol Salt Agar (MSA) yang merupakan media selektif. Manitol Salt Agar (MSA) mengandung NaCl 7.5% (b/v), agar 1.5% (b/v), D-manitol 1% (b/v), kasein pankreas 0.5% (b/v), protein dari jaringan hewan 0.5% (b/v), ekstrak daging sapi 0.1% (b/v), phenol red 0.0025% (b/v) (Ronald 2010). Kemampuan media MSA sebagai label dalam mendeteksi pertumbuhan bakteri dominan diuji pada isolat bakteri dominan yang diinokulasikan pada media umum Tryptone Soya Agar (TSA), dengan berbagai konsentrasi yaitu dari 3.105- 3.108 cfu/g.
Label MSA dibuat dengan melarutkan 27.75 g MSA ke dalam 250 mL aquades, kemudian dilakukan pemanasan dan sterilisasi pada suhu 121 oC selama 15 menit. Label dibentuk berukuran 2×2 cm, kemudian diberi perlakuan pengemasan dan tanpa pengemasan. Jenis plastik yang digunakan sebagai
Pempek
Pengemasan vakum Pengemasan tidak vakum
Penyimpanan suhu ruang
Penentuan bakteri patogen dominan berdasarkan BPOM
kemasan label adalah low density polyethylene (LDPE). LDPE dipilih karena memiliki sifat transparan, fleksibel, tahan terhadap asam dan basa (Zhang dan Carter 2012). Penggunaan LDPE pada label bertujuan untuk menguji pengaruh kemasan terhadap perubahan warna label. Label yang telah dikemas disterilisasi kembali dengan sinar ultraviolet (UV). Label MSA steril diuji dengan merekatkan label pada tutup cawan yang berisi beragam konsentrasi bakteri dominan pada media TSA di wadah cawan. Pertumbuhan bakteri dominan pada label dan perubahan warna label diamati. Komposisi media MSA dioptimasi dengan membuat berbagai formula label, yaitu dengan mengganti komponen protein dengan susu, pati media dengan tapioka, garam dengan NaCl, gula dengan manitol, dan phenol red cair. Kemudian, konsentrasi phenol red dan garam (NaCl) divariasi dan dikombinasi untuk mendapatkan formula yang memiliki respon pendeteksian paling baik. Variasi formula label dapat dilihat pada Tabel 1.
Tabel 1 Variasi Formula Label
Respon label diperoleh dengan menguji masing-masing formula pada biakan bakteri dominan. Sebanyak satu Ose biakan digoreskan pada masing-masing formula yang berbentuk media padat pada cawan. Perubahan warna masing-masing media diamati. Media terbaik adalah formula yang memiliki perubahan warna tercepat dan perubahannya dapat dilihat dengan mata. Pemilihan hasil terbaik digunakan uji Duncan taraf 5% sebagai uji pembeda formulasi. Formula label terbaik digunakan dalam aplikasi pada penelitian utama. Pembuatan label pada 3.4.2.1.1. Kerangka kerja penelitian formulasi label pada Gambar 3.
Gambar 3 Diagram alir penelitian formulasi label
3.4.2 Penelitian Utama
Penelitian utama didasarkan pada formula terbaik yang terpilih dari penelitian pendahuluan. Kerangka kerja penelitian utama pada Gambar 4.
Gambar 4 Kerangka kerja penelitian utama
Penelitian utama dimulai dengan membuat label indikator dengan formula terbaik. Label kemudian diaplikasikan pada pempek dengan merekatkan label
Pembuatan label
Pempek
Perlakuan kemasan pempek (tidak vakum, vakum)
Pengamatan
Label Kualitas pempek
- Perubahan warna label - Jumlah mikroba dominan pada pempek - Nilai pH label - Total volatil nitrogen pempek
-Jumlah mikroba dominan label - Konsentrasi gas asam dalam kemasan - Nilai pH pempek
- Penerimaan konsumen (uji organoleptik) - Umur simpan pempek
Analisis pengaruh kondisi kemasan dan suhu penyimpanan pempek terhadap label dan pempek pada aplikasi formula label terbaik dengan rancangan acak
lengkap faktorial in time dan uji lanjut Duncan taraf 5% Bahan label (aquades, agar bubuk, tapioka,
susu, manitol, NaCl, indikator phenol red)
Label
Pengemasan pempek (polyamide) dan pemberian label
Suhu penyimpanan (suhu ruang 30-32 oC dan suhu dingin 5-10 oC)
Analisis respon perubahan warna label terhadap kualitas pempek berdasarkan waktu perubahan warna label; waktu jumlah bakteri dominan
pempek, pH pempek dan penerimaan konsumen mencapai ambang batas
Penentuan dan validasi model persamaan matematika perubahan warna label menggunakan analisis regresi berganda pada program SPSS 18 dengan prediktor pH label dan pempek, jumlah bakteri dominan label dan pempek,
total volatil nitrogen, gas asam dalam kemasan
pada kemasan pempek. Analisis hasil pengamatan yang dilakukan meliputi pengaruh perlakuan (kondisi kemasan dan suhu penyimpanan) terhadap label dan kualitas pempek, respon perubahan warna label terhadap kualitas pempek, prediksi umur simpan pempek melalui perubahan warna label, penentuan model matematika perubahan warna label untuk memprediksi warna label dan kualitas pempek.
3.4.2.1 Persiapan sampel
Label formula terpilih dibuat untuk diaplikasikan ke pempek. Prosedur pembuatan label disajikan pada 3.4.2.1.1. Aplikasi label pada pempek dilakukan dengan merekatkan label pada permukaan bagian dalam kemasan plastik, prosedur kerja disajikan pada 3.4.2.1.2. Kemasan kemudian diberi perlakuan tidak vakum dan vakum, prosedur kerja pada 3.4.2.1.3. Perlakuan selanjutnya adalah penyimpanan pempek yang dikemas pada suhu dingin dan suhu ruang, prosedur kerja pada 3.4.2.1.4.
3.4.2.1.1 Pembuatan label
Label dibuat dengan mencampurkan bahan label meliputi agar bubuk dan tapioka sebagai matriks, NaCl 7.5% dan phenol red cair 0.0028% (v/v) sebagai penekan pertumbuhan bakteri lainnya ke dalam aquades. Kemudian, homogenisasi pada suhu 85 oC dilakukan hingga diperoleh larutan film. Susu cair (v/v) dan manitol (b/v) sebagai nutrisi mikroba ditambahkan pada larutan film sebelum dilakukan sterilisasi. Sterilisasi dilakukan pada suhu 121oC menggunakan autoclave hingga diperoleh larutan film yang steril. Larutan film steril diletakkan ke dalam cawan petri steril hingga memadat. Larutan film yang padat berbentuk lembaran, dipotong berukuran 2×2 cm dengan spatula steril. Label yang telah berukuran 2×2 cm dikemas dengan plastik LDPE (low density polyethylene), kemudian disterilisasi kembali menggunakan sinar UV. Label kemas yang telah disterilisasi siap digunakan. Diagram alir pembuatan label pada Lampiran 3.
3.4.2.1.2 Prosedur pengemasan pempek
Pengemasan pempek dilakukan bersamaan dengan perekatan label pada kemasan pempek. Mekanisme pereketan label pada Gambar 5.
Gambar 5 Penempatan label pada kemasan pempek
mika
Pempek
Kemasan
polyamide
Label PR Plastik mika (PVC)
Label PR Kemasan nilon
Langkah 3
Pempek
Langkah 1
Pempek sebanyak 3 pcs berukuran 3×8 cm berdiameter 1.5 cm dikemas menggunakan plastik polyamide. Polyamide adalah bahan kemasan ideal yang digunakan untuk kemasan vakum karena memiliki kuat tarik yang tinggi, ketahanan terhadap tusukan dan memiliki sifat penghalang yang baik terhadap oksigen dan gas lainnya (Ahn dan Min 2006). Aplikasi label indikator dilakukan dengan meletakkan label indikator ke dalam kemasan. Label direkatkan pada permukaan bagian dalam kemasan dengan posisi ditengah dan berjarak 2 cm dari pempek untuk menghindari kontak label dengan pempek. Kemasan pempek yang digunakan berukuran 13×13×3.5 cm.
3.4.2.1.3 Perlakuan kemasan tidak vakum dan vakum
Pempek yang telah dikemas diberi perlakuan kondisi kemasan yaitu tidak vakum dan vakum. Pengkondisian bertujuan untuk mengetahui respon label terhadap kondisi kemasan yang berbeda. Pengemasan pempek secara vakum, dilakukan dengan cara ujung kemasan direkatkan menggunakan vacuum packer dengan tekanan 1 kpa, sedangkan pempek yang dikemas tidak vakum ujung kemasan direkatkan dengan sealer biasa.
3.4.2.1.4 Perlakuan suhu penyimpanan pempek
Pempek disimpan pada suhu dingin dan suhu ruang. Tujuannya adalah untuk mengetahui respon label terhadap pola penurunan kualitas pempek pada suhu yang berbeda. Suhu dingin yang digunakan adalah suhu kulkas berkisar 5-10
o
C, sedangkan suhu ruang adalah berkisar 30-32 oC.
3.4.2.2 Analisis pengaruh perlakuan terhadap label dan kualitas pempek Sampel yang telah diberi perlakuan diamati pengaruhnya terhadap label dan kualitas pempek, parameter pengamatan seperti pada 3.4.2.2.1 dan 3.4.2.2.2. Pengamatan dilakukan pada lama penyimpanan ke-8, 16, 24, dan 48 jam dengan 0 jam sebagai kontrol. Selama penyimpanan, pengaruh kondisi kemasan dan suhu penyimpanan terhadap respon label dan kualitas pempek diamati.
3.4.2.2.1 Respon label phenol red
Pengaruh perlakuan terhadap label diamati dengan mengukur perubahan pH label (SNI 06-6989 11-2004), perubahan warna label (Bengston 2006), dan jumlah bakteri dominan pada label (SNI 2332.9:2011). Prosedur analisa pada Lampiran 2.
3.4.2.2.2 Kualitas pempek
3.4.2.3 Analisis respon perubahan warna label terhadap kualitas pempek Warna label selama penyimpanan baik kemasan tidak vakum dan vakum, suhu dingin dan suhu ruang pada pempek dianalisis perubahannya terhadap kualitas pempek. Analisis respon perubahan warna label terhadap kualitas pempek menggambarkan perubahan warna label terhadap jumlah bakteri dominan, nilai pH dan penerimaan konsumen pada pempek. Kemampuan label dalam memantau kualitas pempek ditunjukkan pada ketepatan waktu label dalam berubah warna. Label yang mampu memantau kualitas pempek adalah label yang memiliki waktu perubahan warna lebih awal dibanding waktu ambang batas jumlah bakteri dominan, pH dan penerimaan konsumen pempek. Waktu perubahan warna label adalah jam ketika warna label berubah, waktu ambang batas jumlah bakteri adalah jam ketika jumlah bakteri mencapai ambang batas (pada BPOM ambang maksimum S. aureus adalah 1×103 cfu/g), waktu ambang batas pH pempek adalah jam ketika pH pempek sudah mencapai 7 atau 7, waktu ambang batas penerimaan konsumen adalah jam ketika kesukaan konsumen mencapai 2 atau 2 (suka) pada skala 3 (sangat suka) – 1 (tidak suka). Formulir uji organoleptik disajikan pada Lampiran 4.
3.4.2.4Prediksi umur simpan pempek melalui perubahan warna label
Kemampuan label dalam memantau kualitas pempek dapat digunakan untuk memprediksi umur simpan pempek. Secara matematika, umur simpan pempek ditentukan berdasarkan jumlah maksimum mikroba dominan yang diperbolehkan BPOM pada pempek. Umumnya umur simpan pempek diprediksi menggunakan metode Extended Shelf Studies (ESS) pada persamaan orde satu sebagai berikut (Karneta et al. 2013):
.. (1)
Laju peningkatan mikroba ditentukan dengan rumus sebagai berikut (Labuzadan Shimoni 2000) :
……….(2)
Prediksi umur simpan pempek melalui perubahan warna label tidak hanya didasarkan pada jumlah bakteri dominan saja, namun juga didasarkan pada tingkat kesukaan konsumen. Prediksi umur simpan pempek melalui perubahan warna label dapat dilakukan dengan melihat kategori warna label. Kategori warna label akan menunjukkan warna yang berbeda pada masing-masing tingkat kerusakan pempek. Kesesuaian perubahan warna label pada kategori warna sebagai pedoman umur simpan pempek diuji dengan membandingkan prediksi umur simpan pempek pada metode ESS dengan perubahan warna label. Pedoman warna yang dinyatakan sesuai adalah yang memiliki ketepatan perubahan warna label terhadap prediksi umur simpan pempek pada metode ESS.
3.4.2.5 Penentuan model persamaan matematika perubahan warna label untuk memprediksi warna label dan kualitas pempek
Warna label dapat diprediksi melalui model persamaan matematika, jika data sekunder atau sebagian data yang dibutuhkan dimiliki. Prediksi warna label dilakukan dengan mengkonversi nilai hue yang diperoleh dari perhitungan model matemaika dengan warna pada skala hue. Perbedaan warna pada hue ditentukan menggunakan uji Duncan taraf 5%.
Model persamaan matematika perubahan warna label terhadap kualitas pempek dirumuskan dengan menggunakan analisis regresi berganda. Penelitian yang sama dilakukan oleh Paras dan Mathur (2012) memprediksi cuaca, dan Kuzhda (2012) memprediksi penjualan. Analisis regresi berganda adalah metode untuk memprediksikan variabel dependen (hue) jika variabel independen (pH, jumlah S. aureus, total volatil nitrogen dan gas asam) sebagai faktor prediktor dimanipulasi. Variabel dependen merupakan variabel tak bebas (respon) dan variabel independen merupakan variabel bebas (predictor) (Sugiyono 2010).
Penentuan model persamaan matematika dimulai dengan menentukan ordo, koefisien model persamaan dan kelayakan model. Ordo, koefisien dan kelayakan model persamaan regresi ditentukan menggukanan program SPSS 18. Nilai ohue dijadikan variabel dependen, kemudian ordo variabel ditentukan dengan memplot data variabel independen terhadap hue yang akan menghasilkan plot tebaran dan garis. Hasil tebaran akan menunjukkan ordo variabel yang akan digunakan (Ismail et al. 2009), selain itu ordo variabel ditentukan berdasarkan R square atau R2 (Nathan et al. 2012) yang tertinggi. Jika R square tertinggi pada ordo 1 atau linier, maka variabel dinyatakan linier. Jika R square tertinggi pada ordo 2 atau kuadratik, maka variabel dinyatakan kuadratik, dan sebagainya. Tahap selanjutnya, data variabel dependen (ohue) dan data variabel independen (pH label, jumlah S.aureus pada label, jumlah bakteri dominan pada pempek, total volatil nitrogen, konsentrasi gas asam dan pH pempek) dimasukkan ke dalam sel data sheet pada program SPPS 18 dan dianalisis regresinya. Hasil analisis menampilkan ANOVA, coefficients, dan model summary. ANOVA menunjukkan sig (P-value), coefficients menunjukkan koefisien persamaan model matematika yang akan ditentukan, dan model summary menunjukkan R square, adjust R square dan standar galat.
o
Hueeks = f (X3, X4, X5, X6 ) ………….. (4)
dengan,
X3 = pH pempek
X4 = jumlah bakteri dominan label (1×103 cfu/g)
X5 = konsentrasi total volatil nitrogen pempek (mg/ 100g)
X6 = konsentrasi gas asam di dalam kemasan (ppm)
Persamaan yang diperoleh kemudian diuji kelayakannya menggunakan uji asumsi. Model regresi yang layak harus memenuhi asumsi pada uji Kolmogorov smirnov, uji Glejser, uji multikolinieritas dan autokorelasi (Draper dan Smith 2014). Kolmogorov smirnov merupakan uji normalitas untuk menguji nilai residual terstandarisasi pada model regresi sudah menyebar atau belum. Jika sig 0.05 () maka data telah menyebar normal. Glejser merupakan uji heteroskedastisitas untuk menguji ketidaksamaan data dari residual satu pengamatan ke pengamatan yang lain. Model regresi yang baik adalah homoskesdasitias atau tidak terjadi heteroskedastisitas. Jika sig ANOVA 0.05 () maka data telah homogen.
Uji multikolinieritas sangat penting dilakukan pada variabel bebas lebih dari satu, untuk menguji adanya korelasi antara variabel bebas. Model yang baik adalah tidak memiliki korelasi antar variabel bebas. Multikolinieritas dapat dilihat dari nilai variance inflation factor (VIF). Nilai cutoff yang umum dipakai untuk menunjukkan multikolinieritas adalah nilai VIF 10 dengan nilai tolerance = 0.1 sama dengan tingkat koliniertitasnya 0.95. Variabel yang memiliki VIF>10 tidak dapat digunakan dalam penentuan persamaan model, sehingga variabel dikeluarkan. Jika VIF 10, maka tidak ada multikolinieritas (Ghozali 2001).
Uji autokorelasi bertujuan untuk menguji masalah pada model. Model regresi yang baik adalah yang bebas dari autokorelasi. Uji autokolerasi menggunakan ketentuan Durbin-Watson (DW). Jika 1.65 DW 2.35, maka tidak terdapat autokorelasi atau hubungan antar variabel. Jika 1.21 DW 1.65 atau 2.35 DW 2.79 maka tidak dapat disimpulkan. Jika DW 1.21 atau DW 2.79 maka terjadi autokorelasi (Ghozali 2001).
P(X2 Xo2 ) = 1 - ……… (5)
Keterangan :
X2 = total dari selisih ohuepredict dan ohueexp
Xo2 = kriteria validitas (tingkat kepercayaan, jumlah sampel)
3.5 Rancangan Percobaan
Rancangan percobaan digunakan pada penelitian utama untuk menentukan pengaruh faktor perlakuan terhadap respon label (Nilai hue, chroma, pH label dan jumlah bakteri dominan label) dan kualitas pempek (jumlah bakteri dominan pempek, total volatil nitrogen, gas asam dalam kemasan, pH pempek dan penerimaan konsumen pada pempek) selama penyimpanan serta menguji perbedaan masing-masing faktor. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap Faktorial in time. RAL in time merupakan rancangan dengan satuan percobaan yang relatif homogen dan pengamatan dilakukan berulang dalam waktu yang berbeda selama periode percobaan. Waktu pengamatan dipandang sebagai faktor tambahan yang dialokasikan ke dalam anak petak, sehingga RAL in time seolah-olah dipandang sebagai rancangan split plot. Faktor yang dialokasikan sebagai petak utama meliputi dua faktor yaitu kondisi kemasan (K) dan suhu penyimpanan (S), sedangkan waktu pengamatan dialokasikan sebagai anak petak (Widiharih 2001). Percobaan diulang sebanyak tiga kali. Hasil percobaan atau pengukuran ditabulasikan dan dihitung rata-ratanya, kemudian dianalisis keragamannya. Perlakuan yang berpengaruh nyata diuji lanjut menggunakan uji lanjut Duncan taraf 5%. Model matematika rancangan percobaan yang digunakan yaitu :
Y = + Ki + Sj + (KS)Ij + Gij + Lk + (KL)ik + (SL)ij + (KSL) ijk + Gijk ……….. (6)
dengan,
Y = nilai pengamatan = nilai rata-rata
Ki = pengaruh perlakuan kondisi kemasan taraf ke-i (i = tidak vakum,
vakum)
Sj = pengaruh perlakuan suhu penyimpanan taraf ke-j (j = suhu ruang,
suhu dingin)
(KS)ij = interaksi antara perlakuan kondisi kemasan taraf ke-i dan suhu
penyimpanan taraf ke-j
Gij = galat percobaan untuk pengamatan ke-i dan j
Lk = pengaruh perlakuan lama simpan taraf ke-k (k = jam ke- 8, 16,
24, 48)
(KL)ik = interaksi antara perlakuan kondisi kemasan taraf ke-i dan lama
simpan taraf ke-k
(SL)ij = interaksi antara perlakuan suhu penyimpanan taraf ke-j dan lama
simpan taraf ke-k
(KSL)ijk = interaksi antara perlakuan kondisi kemasan taraf ke-i, suhu
4
HASIL DAN PEMBAHASAN
4.1 Penelitian Pendahuluan
Hasil penelitian pendahuluan meliputi identifikasi mikroba patogen yang dominan pada pempek dan penentuan formulasi label indikator mikroba dominan.
4.1.1 Identifikasi mikroba dominan pada pempek
Identifikasi yang dilakukan pada masing-masing media selektif menunjukkan mikroba dominan yang mengkontaminasi pempek adalah S. aureus. Hasil identifikasi mikroba dominan dapat dilihat pada Tabel 2.
Tabel 2 Identifikasi mikroba kontaminan dominan pada pempek
Penyimpanan
Penegasan lebih lanjut dengan uji koagulase, katalase dan fermentasi anaerob menunjukkan hasil positif bahwa bakteri dominan yang tumbuh pada pempek adalah S. aureus, pada Tabel 3. Hasil penegasan E. coli dan Salmonella pada Lampiran 5. Hasil pengamatan pada uji lanjut menunjukkan semua sampel pada uji katalase dan koagulase adalah positif. Uji katalase digunakan untuk membedakan S. aureus dari Streptococcus, sedangkan uji koagulase untuk membedakan S. aureus dari Staphylococcus lainnya. Fey et al. (2013) menyatakan S. aureus mampu memfermentasikan manitol menjadi asam.
Tabel 3 Uji lanjut identifikasi S. aureus
Jam ke- Kondisi kemasan Katalase Koagulase Fermentasi manitol
Dominasi kontaminan S. aureus pada pempek menunjukkan hasil yang sama dengan penelitian Tavakoli et al. (2012) dan Yam et al. (2015) pada olahan daging ikan. Hal itu disebabkan S. aureus memiliki sifat fisiologi yang lebih sesuai dibanding E.coli dan Salmonella. Penelitian Rosdiana (2002) menunjukkan pempek ikan tenggiri mengandung asam amino (g/100 g) yaitu arginin 0.557, histidin 0.268, lisin 0.843, leusin 0.747, isoleusin 0.424, metionin 0.271, sistein 0.112, fenilalanin 0.363, treonin 0.404, triptopan 0.106, dan valin 0.478. Asam amino-asam amino tersebut merupakan jenis asam amino yang dibutuhkan S. aureus dalam pertumbuhannya (Medvedova dan Valik 2012). Sedangkan E. coli dan Salmonella membutuhkan asam amino sistein, metionin, alanin, asam gulatamat, prolin, sistein (Yang et al. 2015) untuk dapat tumbuh.
Hasil penelitian juga menunjukkan S. aureus tumbuh pada pempek yang dikemas vakum (Tabel 2). Pada penelitian ini, tekanan vakum yang digunakan dalam pengemasan sebesar 0.95-0.98 kpa. Hal itu memungkinkan masih terdapatnya oksigen di dalam kemasan vakum. Keberadaan oksigen rendah dalam kemasan adalah penyebab S. aureus tumbuh pada kemasan vakum karena S. aureus memiliki sifat anaerobik fakultatif (Missiakas dan Schneewind 2013). Pertumbuhan S. aureus pada oksigen rendah terjadi melalui respirasi nitrat, yaitu menggunakan nitrat atau nitrit sebagai alternatif penerima elektron. Namun, konsentrasi oksigen yang rendah di dalam kemasan juga menyebabkan pertumbuhan bakteri menjadi lambat dan konsumsi nutrisi lebih rendah, sedangkan pada kondisi aerobik jumlah S. aureus meningkat hingga fase stasioner (Fuchs et al. 2007), hasil yang sama ditunjukkan Sun et al. (2012).
4.1.2 Penentuan formulasi label indikator S. aureus
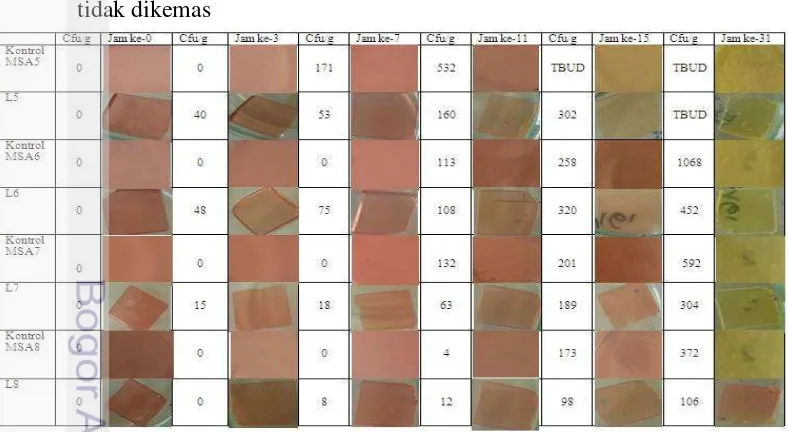
Formula label ditentukan berdasarkan karakteristik bakteri kontaminan yang dominan tumbuh pada pempek. Komposisi label didasarkan pada komposisi Manitol Salt Agar (MSA) yang merupakan media selektif bagi pertumbuhan S. aureus. Kemampuan media MSA sebagai label ditunjukkan pada Tabel 4 dan 5. Tabel 4 Perubahan warna label MSA terhadap pertumbuhan S. aureus pada label
tidak dikemas
Hasil pengamatan menunjukkan terjadi perubahan warna dari merah menjadi kuning. Hasil yang sama juga terjadi pada perlakuan kemasan pada label MSA. Hasil pengamatan dapat dilihat pada Tabel 5.
Tabel 5 Perubahan warna label MSA terhadap pertumbuhan S. aureus pada label kemas
Keterangan : MSA = media selektif, L = label dari MSA. Angka notasi yang mengikuti MSA dan L menunjukkan pengenceran inokulan
Perubahan warna dari merah menjadi kuning diduga akibat adanya reaksi antara senyawa phenol red yang dikandung oleh label MSA dengan gas asam yang dihasilkan dari degradasi TSA dan asam hasil fermentasi manitol oleh S. aureus (Fey et al. 2013). TSA adalah media umum yang mengandung pepton kasein dan kedelai yang merupakan sumber karbon, nitrogen, vitamin dan mineral bagi pertumbuhan S. aureus. Pepton kasein mengandung triptopan, sedangkan pepton kedelai mengandung polipeptida, dipeptida dan asam amino lainnya (Al-Bahry et al. 2014). Kasein dan asam amino didegradasi oleh S. aureus menjadi volatil asam asetat, dimetil sulfida dan metantiol (Carbonero et al. 2012, Filipiak et al. 2012). Fermentasi manitol menjadi asam terjadi ketika S. aureus mengkontaminasi label dan tumbuh pada label. S. aureus memanfaatkan manitol untuk pertumbuhannya sehingga menghasilkan asam. Asam dan gas hasil degradasi yang terbentuk akan mengubah pH label dan merubah warna label.