ISOLASI DAN SELEKSI BAKTERI ENDOFIT YANG
BERPOTENSI MENINGKATKAN VIGOR
TANAMAN NILAM (
Pogostemon cablin
B.)
RESTU SATRIO BAWONO
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Isolasi dan Seleksi Bakteri Endofit yang Berpotensi Meningkatkan Vigor Tanaman Nilam (Pogostemon cablin Benth) adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Restu Satrio Bawono
ABSTRAK
RESTU SATRIO BAWONO. Isolasi dan Seleksi Bakteri Endofit yang Berpotensi Meningkatkan Vigor Tanaman Nilam (Pogostemon cablin Benth). Dibimbing oleh MARIA BINTANG dan ALINA AKHDIYA.
Bakteri endofit dapat berperan sebagai PGPB (plant growth-promoting bacteria) dengan cara menghasilkan zat pengatur tumbuh dan meningkatkan ketersediaan nutrisi bagi tanaman. Penelitian ini bertujuan mengisolasi bakteri endofit dari tanaman Nilam dan menyeleksi bakteri endofit yang berpotensi meningkatkan vigor tanaman Nilam serta melakukan karakterisasi reaksi biokimia terhadap isolat bakteri terpilih. Sebanyak 43 isolat endofit berhasil diisolasi dari tiga jenis tanaman Nilam, yaitu klon B6, varietas Sidikalang, dan Varietas Patchoulina. Sebanyak 6 isolat patogen terhadap daun tembakau dieliminasi. Dua puluh sembilan isolat yang bersifat non-hemolitik dilakukan pengujian lebih lanjut Terdapat 14 isolat yang masuk ke dalam jaringan planlet Nilam dan dilakukan karakterisasi biokimia. Isolat B63.8, B63.10, NSD 20, dan P 35 memiliki aktivitas fiksasi Nitrogen dan pelarutan Fosfat. Isolat P 40 dapat memproduksi auksin dan komponen yang serupa dengan konsentrasi paling tinggi, yaitu 58,7773 ppm. Isolat NSD 20 dapat menghambat pertumbuhan R. solanacearum melalui uji antagonis dan uji pengaruh Volatile Organic Compounds (VOCs).
Kata kunci: bakteri endofit, bakteri penambat nitrogen, bakteri pelarut fosfat, produksi IAA-like compounds, aktivitas selulolitik.
ABSTRACT
RESTU SATRIO BAWONO. Endophytic Bacteria Isolation and Selection that Potentially Improve the Vigor of Patchouli Plant (Pogostemon cablin Benth). Supervised by MARIA BINTANG and ALINA AKHDIYA.
Endophytic bacteria can act as PGPB (plant growth-promoting bacteria) by generating growth regulators and increase the availability of nutrients for plants. Objective of this research was to isolate endophytic bacteria from Patchouli plants, select the effective endophytic bacteria that potentially increase vigor of Patchouli plant and characterize of biochemical reactions. A total of 43 endophytic bacteria were isolated from three types of patchouli plants such as B6 clone, Sidikalang variety, and Patchoulina variety. A total of 6 isolates were eliminated due to its pathogenicity towards tobacco leaves. There were 29 non-hemolytic isolates and further screening step were done towards that isolates. A total of 14 isolates could enter the planlet tissues and have been characterized. B63.8, B63.10, NSD 20, and P 35 have nitrogen fixation and phosphate solubilization activity. P 40 isolate produced the highest concentration of IAA like compound about 58.7773 ppm. NSD 20 isolate could inhibit the growth of R. solanacearum by doing antagonis assay and VOC influence assay.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
ISOLASI DAN SELEKSI BAKTERI ENDOFIT YANG
BERPOTENSI MENINGKATKAN VIGOR
TANAMAN NILAM (
Pogostemon cablin
B.)
RESTU SATRIO BAWONO
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis haturkan ke hadirat Tuhan Yang Maha Kuasa yang telah melimpahkan berkat, karunia, serta kasih setia sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul Isolasi dan Karakterisasi Bakteri Endofit yang Berpotensi Meningkatkan Vigor Tanaman Nilam (Pogostemon cablin Benth). Ucapan terima kasih serta penghargaan penulis persembahkan kepada Ibu Prof. Dr. drh. Maria Bintang, MS selaku dosen pembimbing I serta Ibu Dr. Alina Akhdiya, MSi selaku pembimbing II yang senantiasa memberikan pengetahuan dan arahan selama penelitian hingga penyusunan karya ilmiah ini. Terima kasih penulis ucapkan juga kepada Ibu Dr. Ragapadmi, M.Si, Andri Ferbianto, S.Si, Sherly Anggraini, SP, dan seluruh staf di Laboratorium Biokimia, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Badan Litbang Pertanian, Jalan Tentara Pelajar 3A, Kota Bogor atas segala dukungan dan bantuan selama penelitian ini. Ucapan salam juga penulis sampaikan kepada Mahasiswa Biokimia IPB angkatan 48 yang senantiasa mendukung, terutama Lu’lu, Dezika, Budi, dan Dwi.
Karya tulis ini penulis persembahkan untuk kedua orang tua, yaitu Teguh Sutanto dan Yenny Pramusinta serta adik Rahma Larasati yang senantiasa mendukung dan memberi doa. Semoga karya ilmiah ini bermanfaat. Saran dan kritik senantiasa diharapkan untuk karya yang lebih baik.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
BAHAN DAN METODE 2
Bahan dan Alat 2
Prosedur Penelitian 2
HASIL 5
Sterilisasi Permukaan Tanaman dan Isolasi Bakteri Endofit 5 Respon Hipersensitivitas dan Aktivitas Hemolitik Isolat Endofit 6 Sifat Patogen Isolat Endofit terhadap Planlet Nilam 7
Karakterisasi Biokimia Isolat Endofit Terpilih 8
Kemampuan Isolat Endofit Terpilih dalam Menghambat R. solanacearum 10
PEMBAHASAN 11
Sterilisasi Permukaan dan Isolasi Bakteri Endofit dari Tanaman Nilam 12 Respon Hipersensitivitas dan Aktivitas Hemolitik Isolat Endofit 12 Sifat Patogen Isolat Endofit terhadap Planlet Nilam 13
Karakterisasi Biokimia Isolat Endofit Terpilih 14
Kemampuan Isolat Endofit Terpilih dalam Menghambat R. solanacearum 18
SIMPULAN DAN SARAN 19
Simpulan 19
Saran 20
DAFTAR PUSTAKA 20
LAMPIRAN 25
DAFTAR TABEL
1 Produksi Asam Indolasetat, kemampuan fiksasi Nitrogen, dan pelarutan Fosfat isolat bakteri endofit
2 Kemampuan isolat bakteri endofit menghambat pertumbuhan patogen R. solanacearum
DAFTAR GAMBAR
1 Media TSA 100% yang telah diinokulasi air bilasan terakhir pada proses sterilisasi permukaan tanaman Nilam
2 Jumlah bakteri endofit hasil isolasi dari tanaman Nilam B6, Nilam Sidikalang, dan Nilam Patchoulina
3 Daun tembakau setelah diinfiltrasi oleh isolat endofit.
4 Isolat bakteri endofit yang ditumbuhkan pada agar darah. Anak panah menunjukkan zona hemolitik disekitar koloni isolat endofit 5 Planlet Nilam yang diinokulasikan isolat endofit, dan patogen R.
solanacearum
6 Konsentrasi IAA-like compounds beberapa isolat bakteri endofit 7 Tumbuhnya isolat bakteri endofit penambat nitrogen pada agar LGI
dan isolat bakteri endofit pelarut fosfat pada media Pikovskaya. 8 Potensi bakteri endofit dalam menghambat pertumbuhan patogen R.
solanacearum. Anak panah menunjukkan zona hambatan pertumbuhan R. solanacearum
9 Terhambatnya pertumbuhan R. solanacearum oleh VOCs yang dihasilkan isolat terpilih dan pertumbuhan R. solanacearum yang tidak dipengaruhi VOCs
10 Struktur kimia Indole Acetic Acid
11 Mekanisme reaksi IAA membentuk kompleks berwarna
12 Lintasan biosintesis IAA yang menggunakan triptofan sebagai prekursor dan yang tidak bergantung terhadap triptofan
DAFTAR LAMPIRAN
1 Hasil isolasi bakteri endofit dari tanaman Nilam2 Hasil uji HR isolat pada tanaman tembakau dan uji aktivitas hemolitik
3 Hasil pengukuran absorbansi IAA-like compounds yang dihasilkan bakteri endofit
4 Keadaan planlet Nilam yang telah diinokulasikan isolat bakteri endofit
5 Kurva standar pengukuran IAA
PENDAHULUAN
Tanaman Nilam (Pogostemon cablin, B.) merupakan salah satu jenis tanaman penghasil minyak atsiri. Tanaman ini dibudidayakan oleh para petani untuk diambil minyak atsirinya. Namun demikian, sebagian besar minyak atsiri dihasilkan oleh petani dengan menggunakan peralatan penyulingan yang masih sederhana. Minyak atsiri dari tanaman Nilam tersebut merupakan bahan baku atau penunjang dalam industri parfum, kosmetika, farmasi, sabun, makanan, dan minuman. Hingga kini minyak atsiri yang berasal dari tanaman nilam memiliki pangsa pasar ekspor paling besar dalam perdagangan Indonesia, yaitu mencapai 60 persen (Halimah 2010). Menurut Rusli (2010), pemakaian minyak Nilam di dunia mencapai 1500 ton/tahun. Masalah penyakit pada tumbuhan akan selalu muncul selama manusia masih mengusahakan tanaman atau tumbuhan tersebut sebagai tanaman budidaya, seperti pada bidang budidaya nilam. Penyakit merupakan suatu proses bagian tertentu dari organisme tidak dapat menjalankan fungsinya secara normal karena adanya suatu gangguan. Salah satu penyakit tumbuhan yang dialami Nilam adalah penyakit layu bakteri. Penyakit ini ditandai dengan berbagai gejala, seperti beberapa daun muda layu dan daun tua sebelah bawah menguning, bagian tanaman yang terinfeksi (batang, cabang, dan tangkai daun) yang dibelah akan tampak pembuluh berwarna coklat, demikian juga empulur sering berwarna kecoklatan, batang mengeluarkan lendir putih (Adinugroho 2008). Salah satu penyebab penyakit ini adalah bakteri
Ralstonia solanacearum. Patogen ini merupakan bakteri penyebab penyakit yang cukup penting di daerah tropis, subtropis, dan daerah bersuhu hangat (Jeung et al. 2007).
Berbagai pengendalian yang telah dilakukan antara lain pengendalian kimiawi seperti penggunaan bakterisida, penggunaan varietas yang resisten dan prosedur sanitasi lahan), pengapuran pada lahan terinfestasi, rotasi tanaman dengan tanaman non-Solanaceae (Khoirunnisya 2009), menanam tanaman dari varietas yang resisten terhadap penyakit layu bakteri dan mencabut tanaman terserang (Khoirunnisya 2009) serta pengendalian hayati menggunakan Bacillus subtilis
(Nawangsih 2006), Pseudomonas fluorescens (Nawangsih 2006; Ratdiana 2007). Selain pengendalian di atas, pada dasawarsa terakhir diketahui bahwa bakteri endofit yang biasa bersimbiosis dengan tanaman juga dapat menjadi sumber strain yang menjanjikan dibandingkan dengan bakteri rizosfer karena kurangnya kompetisi dengan bakteri lain dalam apoplas. Hubungan simbiosis antara bakteri endofit dengan tanaman dapat bersifat netral, mutualisme atau komensalisme (Bacon dan Hinton 2006). Bakteri endofit mendapatkan nutrisi dari hasil metabolisme tanaman dan memproteksi tanaman dalam melawan patogen, sedangkan tanaman mendapatkan derivat nutrisi dan senyawa aktif yang diperlukan selama hidupnya (Simarmata et al. 2007).
Bakteri endofit adalah bakteri yang mengkolonisasi jaringan tanaman sehat tanpa menyebabkan gejala atau luka pada inangnya dan dapat hidup pada bagian tanaman seperti akar, batang, dan daun. Bakteri endofit dapat berperan sebagai
2
Beberapa bakteri endofit mampu menambat nitrogen bebas dari udara dengan cara mengubah nitrogen (N2) menjadi ammonia (NH3) agar dapat dimanfaatkan. Nitrogen pada tanaman berfungsi dalam pembentukan asam amino, protein, asam nukleat, enzim, hormon, klorofil, dan biomolekul lainnya (Fatma 2014). Isolasi bakteri endofit, seleksi, serta karakterisasi isolat bakteri terpilih perlu dikaji dengan baik untuk mendapatkan agen hayati yang unggul, aman, dan berpotensi meningkatkan vigor tanaman Nilam.
Penelitian ini bertujuan mengisolasi bakteri endofit dari tanaman Nilam dan menyeleksi mikrob endofit yang efektif berpotensi meningkatkan pertumbuhan tanaman Nilam serta melakukan karakterisasi reaksi biokimia terhadap isolat bakteri terpilih. Penelitian ini diharapkan dapat menggantikan peran pestisida pada budidaya Nilam dengan penggunaan bakteri endofit dan memberikan informasi pemenfaatan bakteri endofit yang berpotensi meningkatkan vigor tanaman nilam.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah tanaman Nilam koleksi BB Biogen klon B6 yang merupakan hasil mutasi somaklonal dari tetua Tapak Tuan, tanaman Nilam varietas Sidikalang, tanaman Nilam varietas Patchoulina, isolat bakteri Ralstonia solanacearum, larutan bleaching komersial (konsentrasi bahan aktif NaOCl 5,25%), aquades, etanol 75%, media TSA (Trypticase Soy Agar), bakteri patogen R. solanacearum, media Sucrose Peptone Agar, garam fisiologis, media agar darah, planlet Nilam, kertas saring Whatmann no. 1, asam pikrat, larutan Na2CO3, media Murashige-Skoog, larutan standar IAA. Alat-alat yang digunakan adalah mortar, kabinet laminar air flow, inkubator, kompor, neraca analitik, penangas, erlenmeyer, gelas piala, pipet pisau, cawan petri, autoklaf, oven, nampan, pisau, gelas ukur, baskom, alat PCR, gunting, batang pengaduk, sentrifugasi, spektrofotometer.
Prosedur Penelitian
Sterilisasi Permukaan Batang Tanaman Nilam (Schulz 2014)
Tanaman dibersihkan dari tanah yang menempel, dicuci di bawah air yang mengalir, kemudian ditiriskan di atas kertas tissue. Bagian batang dipisahkan dari bagian akar dan daun menggunakan gunting steril, kemudian dipotong-potong dengan ukuran ± 4 cm sebelum dilakukan sterilisasi permukaan. Sterilisasi permukaan batang tanaman dilakukan dengan cara perendaman selama 1 menit dalam 2.5 % larutan bleaching komersial, dibilas dengan akuades steril, direndam selama 5 menit dalam etanol 75 %, dan terkahir dibilas dengan 2 kali dengan akuades steril.
3 Isolasi Bakteri Endofit dari Tanaman Nilam (Costa et al. 2012)
Batang yang telah disterilisasi masing-masing dipotong kecil kemudian digerus sampai hancur dengan menggunakan mortar steril. Hasil gerusan masing-masing diencerkan secara serial dengan akuades steril, kemudian disebarkan pada media TSA 20 %. Inkubasi dilakukan pada suhu ruang dan kondisi gelap selama 2 hari sampai 6 minggu. Koloni yang tumbuh pada media isolasi dan menunjukkan morfologi koloni yang berbeda dipilih, dan dimurnikan dengan teknik penggoresan kuadran pada media TSA 100 %.
Penyimpanan Isolat (Feltham et al. 2008)
Isolat murni yang diperoleh dari hasil isolasi diremajakan dan diperbanyak pada media TSA. Kultur padat bakteri endofit yang telah diremajakan (umur 48-72 jam) diambil menggunkan lup inokulasi kemudian dimasukkan ke dalam tabung eppendorf yang telah berisi 750 µL gliserol 40 % steril. Tabung tersebut ditutup rapat, diberi label, dan selanjutnya diberi perlakuan dengan alat vortex agar terbentuk suspensi sel yang merata, kemudian disimpan pada lemari pendingin -20oC.
Bioesei Respon Hipersensitivitas (HR) (Wahyudi et al. 2011)
Isolat bakteri endofit ditumbuhkan pada media TSA selama 2-7 hari, dan
Ralstonia solanacearum ditumbuhkan pada media SPA selama 7 hari. Koloni bakteri yang tumbuh diambil dengan lup inokulasi kemudian disuspensikan dengan akuades steril sampai diperoleh kepadatan sel ± 107 sel/mL. Sebanyak 0.5-1.0 mL masing-masing suspensi bakteri diinfiltrasikan ke permukaan bawah daun tembakau (Nicotiana tabaccum) umur 2 bulan. Pengamatan terhadap reaksi HR yang timbul di bagian yang diinfeksi dilakukan setiap hari selama 7 hari berturut-turut. Sebagai kontrol, digunakan akuades untuk menginfeksi daun tembakau. Bioesei HR untuk masing-masing isolat dilakukan dalam 2 ulangan.
Uji Kemampuan Hemolitik (Aziz et al. 2014)
Isolat bakteri yang tidak bersifat patogen pada tanaman tembakau selanjutnya diuji aktivitas hemolitiknya. Uji aktivitas hemolitik dilakukan dengan cara menginokulasikan isolat bakteri ke permukaan media agar darah yang komposisinya terdiri dari: Blood Agar Base (BBL) 40 g/L, dan darah domba steril yang telah di-defibrinasi sebanyak 50 ml/L (Snavely dan Brahier 1960). Setelah diinkubasi selama 1-5 hari pada suhu ruang (29 oC - 30 oC), dilakukan pengamatan aktivitas hemolitik di sekitar koloni bakteri. Isolat-isolat yang tidak menunjukkan aktivitas hemolitik merupakan isolat terpilih yang digunakan sebagai bahan percobaan berikutnya.
Uji Patogenisitas Isolat terhadap Planlet Tanaman Nilam (Daub 1986)
4
gejala penyakit yang ditimbulkan oleh bakteri yang diinokulasikan diamati selama 10 hari. Penumbuhan planlet dilakukan pada kondisi berikut: media Murashige-Skoog, suhu 23 oC, 8 jam gelap, dan 16 jam terang. Planlet yang sehat diinkubasi lebih lanjut sampai berumur 4 minggu untuk digunakan sebagai bahan percobaan berikutnya. Satu botol planlet berisi tiga tanaman nilam sebagai ulangan perlakuan. Karakter Isolat Bakteri Endofit yang Berpotensi Menghambat Pertumbuhan Patogen Ralstonia solanacearum (Krausse et al. 2005)
Uji antagonis dilakukan dengan pengujian dual culture, yaitu antara bakteri endofit hasil isolasi dengan patogen Ralstonia solanacearum di dalam cawan berisi media TSA. Satu lup massa bakteri endofit hasil isolasi digoreskan pada media TSA, diinkubasi 3 hari pada ruang gelap. Setelah bakteri endofit tumbuh, patogen
Ralstonia solanacearum digores menyilang dengan bakteri endofit dan diinkubasi kembali hingga 3 hari. Bakteri endofit yang berpotensi menghambat patogen membuat pertumbuhan Ralstonia solanacearum terhambat atau bahkan tidak terjadi.
Bioesei Potensi Produksi Volatile Organic Compounds (VOCs) dan Aktivitas Penghambatanya terhadap Kultur R. solanacearum (Fernando et al. 2005)
Potensi kemampuan produksi VOCs isolat bakteri endofit hasil isolasi diuji menggunakan teknik cawan terbagi (divided petri plate) sebagaimana dipublikasi oleh Fernando et al. (2005). TSA dituang ke dalam ruang pertama yang terdapat pada two compartment petri plate sedangkan SPA (Sucrose Peptone Agar) dituang pada ruang kedua. Setelah media agar tersebut memadat, isolat bakteri endofit digoreskan pada permukaan TSA dan diinkubasi pada suhu ruang dalam keadaan gelap. Tiga hari setelah inkubasi, ketika bakteri endofit telah tumbuh pada permukaan media, bakteri patogen R. solanacearum digoreskan pada media SPA dan cawan ditutup kembali. Inkubasi dilakukan selama 7 hari. Sebagai kontrol, bakteri patogen R.solanacearum digoreskan pada media SPA dalam two compartment petri plate, namun bakteri endofit tidak digoreskan pada media TSA dalam cawan tersebut. Cawan kontrol diinkubasi dengan cara yang sama dengan cawan perlakuan.
Uji Kemampuan Fiksasi Nitrogen (Franche et al. 2009)
Kultur bakteri endofit hasil isolasi diinokulasikan ke permukaan media LGI agar dengan cara digores. LGI agar merupakan media bebas nitrogen dengan komposisi sebagai berikut: 5 g L-1 sukrosa, 0.2 g L-1 K2HPO4, 0.6 g L-1 KH2PO4, 0.2 g L-1 MgSO4.7H2O, 0.02 g L-1 CaCl2, 0.002 g L-1 Na2MoO4.2H2O, 0.01 g L-1 FeCl3, dan 19 g L-1 agar bacto. Bakteri diinkubasi pada suhu ruang selama 12 hari.
Uji Potensi Isolat Pelarut Fosfat (Ruangsanka 2014)
5 Penentuan Kadar Asam Indolasetat dan Komponen Sejenisnya (Suriaman 2010).
Pengukuran IAA-like compound dilakukan dengan metode kolorimetri menggunakan reagen Salkowski yang dimodifikasi oleh Suriaman et al. (2010). Kurva standar IAA diperoleh dari pengukuran IAA standar (Merck, Darmstadt, Germany) pada konsentrasi 0-100 ppm (Lampiran 2) dan digunakan untuk mengetahui konsentrasi IAA setiap kultur bakteri. Satu lup massa bakteri endofit hasil isolasi diambil dan dikulturkan kembali pada media TSB (Trypticase Soy Broth) dan diinkubasi pada suhu ruang sambil digoyang 75 rpm) selama 7-10 hari. Kultur disentrifugasi pada kecepatan 10000 rpm, suhu 4 oC, selama 10 menit. Sebanyak 1 mL supernatan kultur direaksikan dengan 2 mL reagen Salkowski (12 g L-1 Fe Cl3 dalam 7.9 M H2SO4), kemudian didiamkan dalam kondisi gelap selama 30 menit pada suhu ruang. Keberadaan IAA-like compound di dalam sampel yang dianalisis ditunjukkan dengan adanya perubahan warna menjadi merah muda hingga merah anggur. Campuran reaksi diukur rapat optis atau absorbansinya menggunakan spektrofotometer pada panjang gelombang 530 nm. Media tanpa inokulasi bakteri digunakan sebagai kontrol.
HASIL
Sterilisasi Permukaan dan Isolasi Bakteri Endofit dari Tanaman Nilam (Patchoulina plant)
Sterilisasi permukaan adalah tahapan awal yang perlu dilakukan sebelum melakukan isolasi bakteri endofit. Sterilisasi permukaan tanaman dilakukan dengan menggunakan 2.5% larutan bleaching komersial, 75% larutan etanol, dan air distilasi. Air distilasi tersebut bermanfaat sebagai air bilasan yang selanjutnnya disebar pada dua buah cawan petri berisi media TSA 100% yang disebut dengan kontrol. Pengamatan terhadap kontrol tersebut dilakukan pada hari ketiga dan menunjukkan tidak adanya bakteri yang tumbuh. Hal ini ditunjukkan media agar tetap jernih (Gambar 1).
6
Gambar 1 Media TSA 100% yang telah diinokulasi air bilasan terakhir pada proses sterilisasi permukaan tanaman Nilam tidak ditumbuhi oleh bakteri setelah diinkubasi 24 jam.
Gambar 2 Jumlah bakteri endofit hasil isolasi dari tanaman Nilam B6, Nilam Sidikalang, dan Nilam Patchoulina
Respon Hipersensitivitas Daun Tembakau yang Diinfiltrasikan Isolat Endofit dan Aktivitas Hemolitik Isolat Endofit
Seleksi mikrob endofit yang dapat meningkatkan vigor tanaman Nilam dapat dilakukan melalui beberapa uji in vitro. Pengujian awal yang sangat penting adalah uji respon hipersensitivitas (HR). Uji HR dilakukan untuk menyingkirkan isolat yang berpotensi patogen terhadap tanaman. Uji HR dilakukan terhadap 43 isolat bakteri endofit. Hasil pengujian menunjukkan 6 jenis bakteri yang menimbulkan respon positif patogen terhadap daun tembakau. Respon positif pada uji HR ditandai dengan matinya jaringan daun tembakau yang telah diinfiltrasikan bakteri endofit sehingga berwarna kuning dan kering (Gambar 3).
Uji hemolitik merupakan tahapan penting selanjutnya. Uji ini dilakukan untuk mengeliminasi isolat yang berpotensi melisis sel darah merah mamalia dan manusia. Hasil pengujian menunjukkan 8 jenis bakteri memiliki sifat hemolitik. Bakteri yang bersifat hemolitik ditandai dengan timbulnya zona bening di sekitar atau di bawah isolat pada media agar darah (Blood Agar) (Gambar 4). Diperoleh 29 isolat bakteri yang bersifat non-hemolitik dan tidak berpengaruh negatif terhadap tanaman.
Nilam B6 17 koloni
Nilam Sidikalang 11 koloni Nilam
7
Gambar 3 Daun tembakau setelah diinfiltrasi oleh isolat endofit. Matinya jaringan daun tembakau setelah 24 jam diinfiltrasi bakteri R. solanacearum (a) dan respon hipersensitif daun tembakau setelah 3 hari diinnfiltrasi bakteri endofit (b)
Gambar 4 Isolat bakteri endofit yang ditumbuhkan pada agar darah. Anak panah menunjukkan zona hemolitik disekitar koloni isolat endofit
Sifat Patogen Isolat Endofit terhadap Planlet Nilam
Seleksi bakteri endofit selanjutnya dilakukan pada inang sesungguhnya (planlet Nilam). Penggunaan hasil kultur jaringan tanaman Nilam untuk seleksi bakteri endofit ini karena planlet bersifat sangat rentan terhadap cekaman sehingga segera memberikan kondisi sebenarnya terhadap perlakuan yang diberikan (Akhdiya 2014). Sebanyak 29 isolat bakteri endofit non-patogen dan non-hemolitik diinokulasikan pada media planlet.
Planlet yang telah diinokulasikan bakteri endofit menghasilkan tampilan yang berbeda pada bagian media, akar, dan daunnya. Planlet yang diperkaya dengan isolat endofit memiliki daun yang lebar dan warna hijau yang cerah. Planlet yang diperkaya isolat endofit juga tumbuh lebih tinggi dibandingkan dengan planlet yang tidak diinokulasikan bakteri endofit. Sebaliknya, planlet yang diinokulasikan dengan R. solanacearum menjadi layu (Gambar 5). Uji patogenisitas terhadap planlet menunjukkan 3 isolat menyebabkan kematian planlet dan 15 isolat tidak dapat masuk ke dalam jaringan. Diperoleh 14 isolat bakteri yang dapat masuk ke dalam jaringan dan tidak menimbulkan kematian.
8
Gambar 5 Kondisi planlet Nilam kontrol yang tidak diberi perlakuan (a), planlet yang telah diperkaya bakteri endofit yang menghasilkan media berwarna kecoklatan dan pertumbuhan akar normal (b), planlet yang diperkaya bakteri endofit tetapi pertumbuhan akar terhambat (c), planlet yang mati dan sakit setelah diinokulasi patogen Ralstonia solanacearum
Karakterisasi Biokimia Bakteri Endofit Terpilih
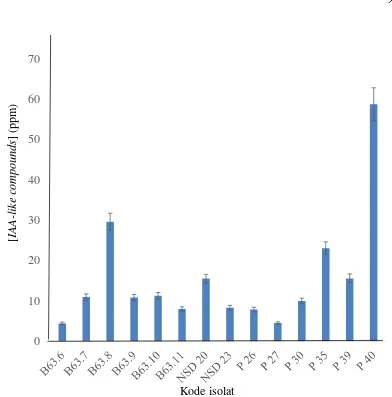
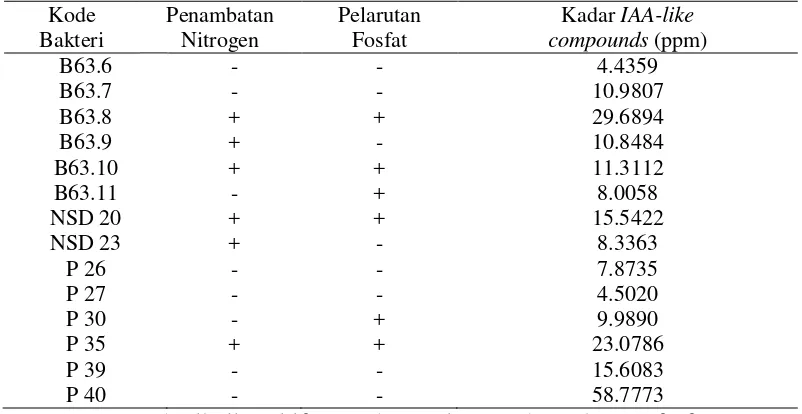
Pengujian kandungan Asam Indolasetat dilakukan pada supernatan bakteri endofit yang telah ditumbuhkan pada media TSB 100% selama 10 hari. Metode yang digunakan adalah metode kolorimetri, yaitu berdasarkan perubahan warna sampel setelah penambahan reagen Salkowski. Hasil pengujian menunjukkan adanya konsentrasi yang berbeda-beda pada setiap isolat bakteri endofit (Tabel 1), yaitu dari 4 ppm hingga 58 ppm. Isolat P 40 menghasilkan Asam Indolasetat dengan konsentrasi tertinggi, yaitu 58.7773 ppm (Gambar 6).
Peningkatan ketersediaan nutrisi pada tanaman oleh bakteri endofit, yaitu melalui penambatan nitrogen dan pelarutan fosfat. Pengujian potensi bakteri endofit menambatkan Nitrogen bebas dari udara dilakukan dengan cara menumbuhkan bakteri tersebut pada media agar LGI. Bakteri yang tumbuh pada media LGI memiliki kemampuan menambat Nitrogen (Gambar 7a). Bakteri yang tumbuh pada media agar LGI memiliki tampilan berair dan jernih. Terdapat 6 isolat yang dapat tumbuh pada agar LGI, antara lain B63.8, B63.9, B63.10, NSD 20, NSD 23, dan P 35. Sementara itu, uji potensi pelarut fosfat dilakukan dengan cara menumbuhkan bakteri endofit pada media agar Pikovskaya (Gambar 7b). Zona jernih disekitar media Pikovskaya mengindikasi adanya aktivitas pelarutan fosfat oleh isolat endofit
(a) (b)
9
Gambar 6 Konsentrasi auksin dan komponen sejenisnya (IAA like-compounds) yang diproduksi oleh isolat bakteri endofit terpilih
(a) (b)
0 10 20 30 40 50 60 70
Kode isolat
[
IA
A
-li
ke
c
ompounds
] (p
pm)
10
Tabel 1 Produksi Asam Indolasetat, kemampuan menambat nitrogen, dan melarutan fosfat isolat bakteri endofit
Keterangan: (+) hasil uji positif penambatan nitrogen dan pelarutan fosfat (-) hasil uji negatif penambatan nitrogen dan pelarutan fosfat
Kemampuan Isolat Terpilih dalam Menghambat Bakteri Patogen Ralstonia solanacearum
Beberapa bakteri endofit dapat menghambat pertumbuhan patogen R. solanacearum bahkan mematikan patogen tersebut (Tabel 2). Penghambatan terhadap patogen ini diuji dengan cara menggoreskan silang bakteri endofit dengan bakteri patogen. Terdapat 4 isolat endofit yang mampu menghambat pertumbuhan
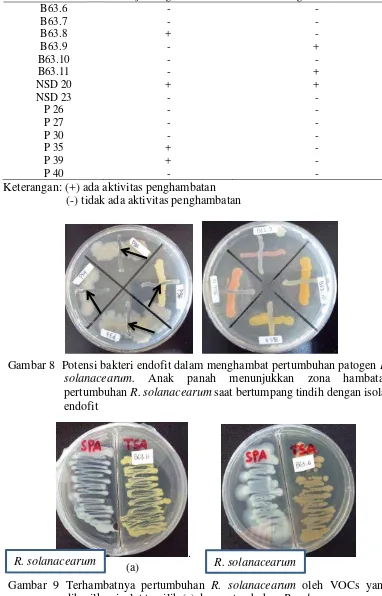
R. solanacearum pada uji Antagonis, antara lain B63.8, NSD 20, P 35, dan P 39. Terhambatnya pertumbuhan R. solanacearum ditandai dengan tidak tumbuhnya bakteri R. solanacearum yang bertumpang tindih dengan isolat endofit (Gambar 8).
Bakteri endofit juga dapat menghambat pertumbuhan bakteri patogen melalui produksi Volatile Organic Compounds (VOC). Penghambatan terhadap patogen karena pengaruh VOCs dilakukan dengan menumbuhkan isolat endofit dengan R. solanacearum pada cawan terbagi dua. R. solanacarum ditumbuhkan pada satu sisi yang berisi media SPA sedangkan isolat endofit ditumbuhkan pada sisi lainnya yang berisi media TSA. Adanya penghambatan pertumbuhan R.
11 Tabel 2 Kemampuan bakteri endofit menghambat pertumbuhan patogen R.
solanacearum
Kode Bakteri Uji Antagonis Pengaruh VOCs
B63.6 - -
B63.7 - -
B63.8 + -
B63.9 - +
B63.10 - -
B63.11 - +
NSD 20 + +
NSD 23 - -
P 26 - -
P 27 - -
P 30 - -
P 35 + -
P 39 + -
P 40 - -
Keterangan: (+) ada aktivitas penghambatan (-) tidak ada aktivitas penghambatan
.
(a) (b)
R. solanacearum R. solanacearum
Gambar 8 Potensi bakteri endofit dalam menghambat pertumbuhan patogen R. solanacearum. Anak panah menunjukkan zona hambatan pertumbuhan R. solanacearum saat bertumpang tindih dengan isolat endofit
12
PEMBAHASAN
Sterilisasi Permukaan dan Isolasi Bakteri Endofit dari Tanaman Nilam (Patchoulina plant)
Proses isolasi bakteri endofit seringkali memberikan hasil membingungkan antara bakteri endofit yang diperoleh atau mikrob lain yang berada di permukaan tanaman. Sterilisasi permukaan adalah tahap penting awal yang perlu dilakukan sebelum melakukan isolasi mikrob endofit. Proses ini penting dilakukan agar mendapat bakteri endofit yang sebenarnya (Akhdiya 2014). Air bilasan terakhir dari proses sterilisasi permukaan yang disebar pada media TSA 100% sebagai kontrol tidak ditumbuhi oleh mikrob. Hal ini menunjukkan permukaan tanaman bersih dari mikrob permukaan dan bakteri yang diperoleh merupakan true endophyte microbes.
Sterilisasi permukaan batang tanaman dilakukan dengan merendam batang ke dalam larutan bleaching komersial (NaOCl) 5,25% selama 1 menit dan etanol 70% selama 5 menit. Kedua larutan ini berfungsi sebagai desinfektan untuk membunuh bakteri permukaan pada batang tanaman (Cao et al. 2004). Batang steril tersebut kemudian dibilas dengan akuades. Pembilasan ini dilakukan untuk membersihkan larutan etanol dan NaOCl dari permukaan tanaman. Media TSA 100% yang disebar dengan air bilasan terakhir tidak ditumbuhi oleh bakteri mengindikasi permukaan batang tanaman tersebut sudah bersih dari bakteri permukaan.
Isolasi dilakukan dari tiga jenis varietas tanaman Nilam, yaitu Nilam klon B6, varietas sidikalang, dan varietas Patchoulina. Batang tanaman yang permukaannya sudah bersih digerus hingga halus dan cairan hasil gerusan diinokulasi pada media TSA 20%. Penggunaan media TSA 20% bertujuan mengurangi kemungkinan kontaminasi bakteri selain bakteri endofit yang diharapkan. Hasil isolasi menunjukkan adanya perbedaan jumlah bakteri endofit dari ketiga tanaman Nilam. Terdapat 15 koloni pada nilam Patchoulina, 17 koloni dari klon B6, dan 11 koloni dari varietas sidikalang. Keanekaragaman bakteri endofit dipengaruhi oleh kandungan senyawa di dalam jaringan tanaman dan ruang antar sel pada jaringan tanaman. Semakin banyak senyawa yang dihasilkan suatu tumbuhan, bakteri endofit yang tumbuh di dalam jaringan tanaman tersebut juga semakin beragam (Yuliar et al. 2013).
Respon Hipersensitivitas Daun Tembakau yang Diinfiltrasikan Isolat Endofit dan Aktivitas Hemolitik Isolat Endofit
13 tersebut. Reson hipersensitif terjadi pada tanaman sebagai reaksi atas infeksi cendawan, bakteri, dan virus patogen tanaman. Respon ini merupakan kompleks pertahanan tanaman dan juga sebagai tanggapan awal dalam bentuk nekrosis dan terjadinya kematian sel untuk membatasi pergerakan patogen (Leiwakabessy 2011). Leiwakabessy juga menjelaskan bahwa gen yang dapat menimbulkan sifat patogen adalah gen Avr (Avirulen). Menurut Wahyudi et al. (2011), induksi reaksi hipersensitif dan patogenisitas suatu bakteri dipengaruhi oleh gen hrp yang umum ditemukan pada bakteri Gram negatif patogen tanaman, seperti kelompok
Xanthomonas sp. Hasil positif uji HR menunjukkan perubahan warna dari hijau menjadi kuning pada bagian daun yang diinfiltrasikan mikroba.
Bakteri endofit yang tidak mematikan jaringan daun tembakau dilakukan pengujian aktifitas hemolitik. Zona jernih yang terbentuk di sekitar isolat menunjukkan adanya aktivitas hemolitik dari isolat tersebut.
Aktivitas hemolitik merupakan peristiwa luruhnya membran eritrosit yang mengakibatkan keluarnya isi sel diikuti dengan lepasnya molekul hemoglobin yang terkandung di dalamnya. Peristiwa lisis membran eritrosit ini tetap dalam keadaan tidak terurai tetapi pada bagian membran tertentu terjadi kebocoran yang menyebabkan keluarnya isi sel karena mekanisme komplemen pada gabungan antigen-antibodi. Hemolisin adalah senyawa penyebab peristiwa hemolisis ini, ditemukan pada beberapa mikroba dan cendawan. Mekanisme hemolisin melisis sel darah merah dari beberapa bakteri, yaitu dengan membentuk pori-pori pada membran sel. (Mangindaan dan Losung 2013).
Sifat Patogen Isolat Bakteri Endofit terhadap Planlet Nilam
Dua puluh sembilan isolat bakteri yang tidak memiliki aktivitas hemolitik diuji patogenisitasnya terhadap tanaman inang. Uji patogenisitas mikrob endofit tetap harus dilakukan pada tanaman inangnya karena mikroba endofit yang lolos uji HR belum tentu bersifat non-fitopatogenik terhadap semua jenis tanaman termasuk tanaman inangnya. Oleh karena itu, seleksi dilanjutkan dengan melakukan uji pada tanaman inang sesungguhnya, yaitu planlet Nilam.
Seleksi mikrob endofit pada planlet dilakukan dengan memilih mikrob yang tidak mengakibatkan kematian tanaman planlet dan mikroba yang dapat masuk ke dalam jaringan. Sebanyak 3 isolat bakteri endofit menyebabkan kematian pada planlet Nilam. Terdapat 14 isolat bakteri endofit yang dapat meresap ke dalam media dan masuk ke jaringan planlet. Bakteri tersebut dapat masuk ke dalam jaringan tanaman melalui akar dan menkolonisasi di berbagai kompartemen yang berbeda, seperti di apoplast dan ruang intrasel antara dinding sel dan jaringan xilem (Malfanova 2013).
14
zat pengatur tumbuh. Zat pengatur tumbuh (ZPT) merupakan senyawa yang mampu menimbulkan respon fisiologi tanaman dengan cara meningkatkan ketersediaan nutrisi. Beberapa zat pengatur tumbuh, di antaranya auksin, giberelin, asam absisat (ABA), sitokinin, etilen asam jasmonat (JA), dan asam salisilat (Munif et al. 2012).
Adanya isolat bakteri endofit yang mampu menghasilkan IAA-like compounds juga memengaruhi pertumbuhan akar planlet. Menurut Fuchs (1986) dalam Arimarsetiowati dan Ardiyani (2012), adanya tambahan IAA-like compounds
dengan konsentrasi tertentu tidak selalu meningkatkan pertumbuhan akar tetapi dapat menurunkan pertumbuhan akar. Hal ini berhubungan dengan kadar nitrogen yang terkandung pada media kultur jaringan sudah disesuaikan dengan IAA sintetis yang diberikan. Nitrogen yang melimpah pada media dibandingkan dengan IAA kurang baik bagi pertumbuhan akar karena asam amino yang terbentuk dapat menghambat pertumbuhan akar. Hal inilah yang menyebabkan perbedaan panjang akar pada planlet.
Karakterisasi Biokimia Bakteri Endofit Terpilih
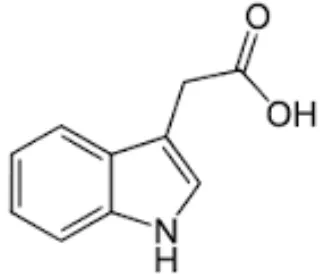
Auksin merupakan salah satu hormon penting bagi tanaman. Auksin dapat memengaruhi pertumbuhan batang, diferensiasi dan percabangan akar, perkembangan buah, dominansi apikal, fototropisme, dan geotropisme (Dewi 2008). IAA termasuk dalam golongan auksin alami (Gambar 10). IAA ditemukan pada ujung batang dan akar berfungsi sebagai pengatur pembesaran sel dan memicu pemanjangan sel di daerah belakang meristem ujung. Senyawa ini juga diperlukan pada proses pembentukan bunga (Santoso dan Nursaidi 2001).
Gambar 10 Struktur kimia Indole Acetic Acid (Andanawarih 2008)
Gambar 11 Mekanisme reaksi IAA membentuk kompleks berwarna (Shahab et al.2009).
15 terjadinya perubahan warna pada campuran supernatan bakteri dengan reagen Salkowski. Reagen Salkowski yang digunakan sesuai metode yang dipublikasi oleh Gordon dan Weber (1951) dalam Suriaman et al. (2010). Hasil positif uji ini ditandai dengan perubahan warna supernatan bakteri menjadi merah muda hingga merah anggur. Warna merah ini terjadi karena produk kondensasi berupa gugus aldehid dengan derivatif pyrrole dan kombinasi Fe pada kondisi asam membentuk komponen koinoidal berwarna merah keunguan (Gambar 11). Seluruh isolat terpilih dapat menghasilkan IAA-like compounds dengan konsentrasi yang berbeda-beda. Isolat P 40 memproduksi IAA-like compounds dengan konsentrasi paling tinggi, yaitu 58,7773 ppm.
Media kultur yang digunakan pada pengujian IAA-like compounds tidak ditambahkan dengan triptofan. Media pertumbuhan ini menggunakan TSB yang mengandung pepton kasein dan pepton kedelai. Kandungan pepton kasein dan pepton kedelai adalah asam amino dan substansi nitrogen lainnya. Becton, Dickinson, dan Company (2006) mengatakan bahwa pepton kasein dan pepton kedelai mengandung triptofan secara berturut-turut sebesar 0,8% dan 0,2%. Hasil uji kolorimetri terhadap kultur supernatan tiap isolat bakteri menunjukkan nilai absorbansi yang berbeda. Hal ini mengindikasi adanya perbedaan kandungan IAA-like compounds tiap isolat bakteri.
16
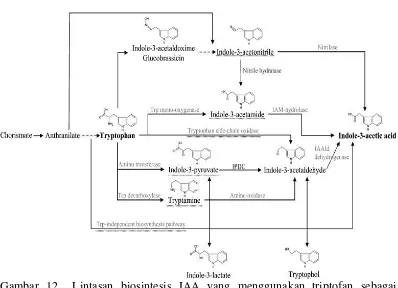
Gambar 12 Lintasan biosintesis IAA yang menggunakan triptofan sebagai prekursor dan yang tidak bergantung terhadap triptofan (Spaepen et al. 2007).
indole-3-piruvate (IpyA), tryptamine (TAM), tryptophan side-chain oxidase (TSO), dan indole-3-acetonitrile (IAN)
Spaepen et al. (2007) menjelaskan lebih lanjut mengenai lima jalur biosintesis IAA dengan prekursor triptofan. Lintasan indole-3-acetamide (IAM) merupakan lintasan dengan karakter terbaik bagi bakteri. Lintasan ini terdiri dari dua langkah, yaitu triptofan dioksidasi oleh enzim tryptophan-2-monooxigenase
(IaaM) menjadi IAM, selanjutnya IAM akan dihidrolisis oleh enzim IAM hidrolase untuk menghasilkan IAA. Beberapa bakteri yang menggunakan lintasan IAM di antaranya Agrobacterium tumefaciens, Pseudomonas syringae, Pantoea agglomerans, Rhizobium, dan Bradyrhizobium (Theunis et al. 2004). Alternatif lintasan kedua adalah melalui lintasan triptamin (TAM). Proses ini terjadi pengubahan triptofan menjadi triptamin oleh enzim triptofan dekarboksilase, selanjutnya triptamin akan diubah menjadi IAA oleh enzim indole-acetaldehide
dehidrogenase. Perley dan Stowe (1966) memaparkan aktivitas triptofan dekarboksilase terjadi pada bakteri Bacillus cereus. Alternatif lintasan ketiga adalah
indole-3-pyruvate (IpyA). Proses ini terjadi pengubahan triptofan menjadi asam indol piruvat oleh enzim triptofan transaminase dan kemudian diubah menjadi IAA oleh enzim indole-acetaldehide dehidrogenase. Blaha et al. (2005) menjelaskan bakteri Pa. Agglomerans, Bradyrhizobium,Azospirillum, Rhizobium,Cyanobacter,
17 (IAN). Namun lintasan ini hanya terjadi pada tanaman. Beberapa ilmuwan masih mendebatkan proses lintasan ini (Bartling et al 1992).
Lintasan biosintesis IAA yang tidak menggunakan triptofan sebagai prekursor terjadi pada bakteri Alcaligenes faecalis, (Nagasawa et al. 1990 dan Kobayashi et al. 1993). Prinsen et al. (1993) mendemonstrasikan penelitiannya untuk membuktikan lintasan biosintesis IAA tanpa prekursor triptofan. Penelitiannya dilakukan terhadap bakteri Az.brasilense menggunakan media yang tidak mengandung triptofan. Lintasan ini tidak menggunakan enzim spesifik dan masih dikaji lebih mendalam.
Kemampuan isolat B63.8, B63.9, B63.10, NSD 20, dan NSD 23 untuk tumbuh pada media yang tidak mengandung nitrogen (agar LGI) mengindikasi isolat tersebut mampu menambat nitrogen bebas di udara. Hanya terdapat sedikit bakteri yang menambat N2 bebas untuk diubah menjadi amonia dan nitrat sebagai sumber nitrogennya karena pemecahan ikatan rangkap tiga pada N2 membutuhkan energi yang cukup besar (Sumarsih 2003). Proses reduksi N2 menjadi NH4+ dinamakan proses penambatan atau fiksasi gas nitrogen. Salisbury dan Ross (1995) memaparkan bahwa penambatan ini hanya dapat dilakukan oleh mikroorganisme prokariot. Hasil reaksi kimia penambatan nitrogen menghasilkan dua molekul amonia dari satu molekul gas nitrogen. Reaksi kimia proses penambatan nitrogen sebagai berikut:
N2 + 8H+ + 8e- + 16 ATP = 2 NH3 + H2 + 16 ADP + 16 Pi
Kecepatan pertumbuhan isolat bakteri endofit terpilih di meda agar LGI sangat lambat. Proses ini memerlukan 16 molekul ATP dan pasokan elektron serta proton. Terpakainya energi pada proses penambatan nitrogen membuat pertumbuhan sel bakteri menjadi lambat (White 2007). Bakteri endofit yang tumbuh pada media agar LGI memiliki tampilan basah dan cembung.
Proses fiksasi nitrogen bebas melibatkan penggunaan ATP dan proses reduksi ekuivalen berasal dari metabolisme primer. Reaksi penambatan yang terjadi dikatalisis oleh nitrogenase dan hidrogenase. Davet (2004) menyatakan bahwa kemampuan fiksasi nitrogen suatu bakteri dipengaruhi oleh karakter enzim nitrogenasenya dan juga ekspresi gen Niff. Terdapat dua protein kompleks pada enzim ini, yaitu nitrogen reduktase (NR) dan protein besi molibdenum (MoFe). Kirchoff et al. (2007) menjelaskan proses fiksasi nitrogen terdiri dari beberapa tahapan. Pertama, elektron dari molekul nitrogen bebas diikat dan H2 dilepaskan oleh nitrogenase pada waktu yang sama. Kemudian elektron dan proton dari NR diterima oleh nitrogenase dan selanjutnya ditambahkan ke dalam molekul N2. Kerja enzim hidrogenase pada proses reduksi nitrogen adalah menyimpan beberapa energi metabolik yang hilang. Energi tersebut diperoleh dari elektron molekul hidrogen dan selanjutnya ditransfer kembali ke dalam bentuk feredoksin (Simanungkalit et al. 2006).
18
P35. Zona bening yang terbentuk di sekitar atau di bawah isolat bakteri pada agar pikovskaya mengindikasi adanya kemampuan bakteri melarutkan fosfat.
Unsur fosfat (P) merupakan unsur esensial kedua setelah N yang berperan penting dalam fotosintesis dan perkembangan akar tanaman. Ketersediaan fosfat dalam jarang melebihi 0,01% total P. Sebagian besar bentuk fosfat terikat oleh koloid tanah sehingga tidak tersedia bagi tanaman. Fosfat terikat tersebut bersenyawa dengan berbagai unsur lain dan membentuk kompleks yang sulit larut, seperti Al-P, Fe-P, dan Ca-P. Salah satu alternatif mengatasi masalah rendahnya fosfat tersedia dalam tanah adalah penggunaan bakteri pelarut fosfat (Isgitani et al. 2005).
Bakteri pelarut fosfat dalam aktivitasnya menghasilkan metabolit berupa asam-asam organik dan enzim Phosphomonoesterase (PME), dan antibiotika. Asam organik yang dihasilkan oleh mikroba ini, antara lain asam sitrat, glutamat, suksinat, fumarat, tartrat, laktat, dan α-ketobutirat (Premono 1994; Kim et al. 2002; Hu Hongqing et al. 2002). Berbagai asam organik tersebut dapat melarutkan fosfat terikat melalui beberapa mekanisme, antara lain kompetisi anion-orthophosphate, perubahan nilai pH medium, dan pengikatan logam membentuk logam-organik dan pengkelatan. Asam sitrat mampu memineralisasi bentuk organik menjadi P-anorganik. Ponmurugan dan Gopi (2006) dalam penelitiannya menemukan bahwa spesies Aspergillus niger dan Penicillum simplicissimum berkemampuan melarutkan P-anorganik karena menghasilkan asam sitrat dengan konsentrasi tinggi. Asam asetat juga merupakan asam organik yang sering dihasilkan bakteri pelarut fosfat. Asam ini dibentuk saat bakteri dalam kondisi kurang oksigen. Hal ini membuat NADH2 yang terbentuk dari glikolisis ataupun lintasan metabolisme lainnya akan digunakan untuk mereduksi asetil Ko-A menjadi asam asetat. Ligan organik seperti asam tartrat, oksalat, malat, sitrat yang memiliki gugus karboksilat, alifatik-OH, dan fenolik-hidroksil dapat melarutkan fosfat akibat pengkelatan dengan unsur Al, Fe, dan Ca (Setiawati dan Mihardja 2008). Salah satu mekanisme pelepasan P yang terikat pada besi-P terkait dengan hidrogen sulfida yang diproduksi oleh bakteri pelarut fosfat. Pengkelatan Fe3+ dari Fe-P oleh siderofor yang diproduksi oleh beberapa bakteri pelarut P juga diyakini sebagai salah satu mekanisme kerja bakteri pelarut P.
Asam-asam organik dihasilkan oleh bakteri pelarut P melalui proses katabolisme glukosa dalam siklus asam trikarboksilat (TCA), yang merupakan lanjutan proses glikolisis. Bakteri pelarut P memproduksi asam organik dalam jumlah banyak dan sebagian berdifusi keluar sel karena reaksi keseimbangan osmosis. Asam organik tersebut juga digunakan sebagai substrat proses anabolisme sintesis asam amino dan makromolekul lain (Setiawati dan Mihardja 2008).
Kemampuan Isolat Bakteri Endofit Terpilih dalam Menghambat Pertumbuhan Patogen R. solanacearum
Tanaman Nilam mengandung komponen utama patchouli alcohol (PA), termasuk dalam senyawa metabolit sekunder dan berpotensi menghambat pertumbuhan patogen (Corrin dan Bure 2004). Terdapat 4 isolat endofit yang dapat menghambat pertumbuhan R. solanacearum, yaitu B63.8, NSD 20, P 35, dan P39.
19 sekunder merupakan senyawa kimia yang umumnya memiliki kemampuan bioaktif dan berfungsi sebagai pelindung organisme inang dari gangguan hama penyakit. Senyawa ini tidak dibutuhkan untuk pertumbuhan tanaman tetapi sangat dibutuhkan untuk kelangsungan hidup suatu tanaman. Senyawa ini dapat menangkal serangan bakteri patogen, seperti R. solanacearum.
R. solanacearum sebelumnya dikenal sebagai Pseudomonas solanacearum
merupakan bakteri tular tanah yang mampu hidup dalam tanah dalam periode waktu lama. Bakteri ini merupakan salah satu penyebab penyakit layu pada tanaman di wilayah tropis, subtropis, dawrah beriklim hangat (Jeung et al. 2007). Bakteri ini menginfeksi pada bagian akar, bergerak secara sistematik melalui xylem, bersifat nonmotil pada tanaman.
Akhdiya (2014) memaparkan adanya bukti peran senyawa organik yang mudah menguap (VOCs) yang dihasilkan bakteri dalam menghambat patogen. Salah satu bukti sederhananya adalah aroma dari kultur khamir dan bakteri asam sitrat atau laktat. Namun demikian hanya sedikit bakteri yang dapat menghasilkan VOCs. Hasil uji menunjukkan hanya terdapat 3 isolat endofit yang dapat menghasilkan VOCs dan dapat menghambat pertumbuhan R. Solanacearum.
Beberapa isolat tersebut antara lain, B63.9, B63.11, dan NSD 20. Senyawa VOCs tersebut merupakan produk metabolisme mikroba. Senyawa tersebut berasal dari kelompok asam organik (sitrat, asam laktat, asam propionat, dll), alkohol, ester, merkaptan, pentilfuran dan sebagainya (Akhdiya 2014).
Riset Akhdiya (2014) juga menunjukkan bahwa VOC memiliki kemampuan dalam menginduksi ketahanan tanaman. Terdapat senyawa VOC yang memiliki aktivitas antimikroba, antara lain sikloheksanol, benzothiazole, n-decanol, hexanol. Fernando et al. 2005 memaparkan bahwa sifat antimikroba dari senyawa-senyawa tersebut dapat dimanfaatkan untuk melawan fitopatogen. Hasil pengujian terhadap isolat endofit terpilih yang ditumbuhkan pada cawan terpisah dengan
R.solanacearum mengindikasi adanya penghambatan terhadap R.solanacearum
oleh VOCs yang dihasilkan isolat terpilih. Namun demikian pengujian lebih lanjut perlu dilakukan untuk mengidentifikasi senyawa VOCs tersebut.
SIMPULAN DAN SARAN
Simpulan
Bakteri endofit yang berada di dalam jaringan tanaman dapat berpotensi meningkatkan vigor tanaman inangnya. Hasil isolasi bakteri tanaman endofit diperoleh isolat B63.8, B63.10, NSD 20, dan P 35 memiliki aktivitas fiksasi Nitrogen dan pelarutan Fosfat. Berdasarkan pengujian antagonis dan pengaruh VOCs, isolat terpilih NSD 20 dapat menghambat pertumbuhan R. solanacearum.
20
Saran
Pengujian lebih lanjut perlu dilakukan untuk mendapat bakteri endofit yang efektif meningkatkan vigor tanaman Nilam di lapangan melalui aklimatisasi planlet. Identifikasi molekuler juga perlu dilakukan untuk mengetahui jenis bakteri endofit terpilih tersebut.
DAFTAR PUSTAKA
Adinugroho WC. 2008. Konsep Timbulnya Penyakit Tanaman. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor.
Akhdiya A. 2014. Karakterisasi bakteri endofit penghasil Volatile Organic Compound (VOC’s) untuk meningkatkan ketahanan tanaman kentang
terhadap penyakit layu bakteri. [Disertasi]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor.
Andanawarih S. 2008. Optimasi produksi asam indolasetat oleh Rhizobium sp. dalam medium serum lateks Hevea brasiliensis dengan suplementasi triptofan. [Skripsi]. Bogor: Institut Pertanian Bogor.
Bacon CW, Hinton DM. 2006. Bacterial andophytes : the endophytic niche, its occupants, and its utility. Di dalam : Gnanamanickam SS, editor. Plant Associated Bacteria. Netherland : Springer.
Bartling D, Seedorf M, Mithofer A, Weiler EW. 1992. Cloning and expression of an Arabidopsis nitrilase which can convert indole-3-acetonitrile to the plant hormone, indole-3-acetic acid. Eur J Biochem 205: 417–424.
Blaha D, Sanguin H, Robe P, Nalin R, Bally R, Moenne Y. 2005. Physical organization of phytobeneficial genes nifH and ipdC in the plant growth-promoting rhizobacterium Azospirillum lipoferum 4V(I). FEMS Microbiol Lett 244: 157–163.
Cao L, Qiu ZQ, You J, Tan H, Zhou S. 2004. Isolation and characterization of endophytic Streptomyces strains from surface-sterilized tomato (Lycopersicon esculentum) roots. Lett Appl Microbiol. 39:425-430.
Corrin, Bure. 2004. Analysis of essential oil of Indonesian patchouli (Pogostemon cablin Benth) using GC/MS (EI/CI). Essential Oils. 15(3): 98-106.
Costa L, Queiroz, Borges AC, Moraes CA, Araujo. 2012. Isolation and characterization of endophytic bacteria isolated from the leaves of the common bean (Phaseolus vulgaris). Braz J Microbiol. 43(4): 1562-1575. Daub ME. 1986. Tissue culture and the selection of resistance to pathogens. Annu
Rev Phytophatol. 24: 159-165.
Davet P. 2004. Microbial Ecology of the Soil and Plant Growth. Hoboken: Scienci Publishing Inc.
21 Dewi IR. 2008. Peranan dan fungsi fitohormon bagi pertumbuhan tanaman.
[Skripsi]. Bandung: Fakultas Pertanian Universitas Padjadjaran.
Fatma YS. 2014. Kemampuan bakteri endofit Micrococcus endophyticus G053 dalam memproduksi IAA-like compound dan meningkatkan pertumbuhan tanaman [Skripsi]. Bogor: Fakultas Matematika dan IPA Institut Pertanian Bogor.
Feltham R, Power A, Pell, Sneath. 2008. A simple method storage of bacteria. J Appl Microbiol. 44: 313-316.
Fernando E, Ramarathnam M, Krishnamoorthy AS, Savchuk SV. 2005. Identification and use of potential bacteria organic antifungal volatiles in biocontrol. Soil Biol Biochem. 37: 955-964.
Franche C, Lindstrom K, Elmerich C. 2009. Nitrogen-fixing bacteria associated with leguminous and non-leguminous plants. Plant Soil.321: 35-59.
Glickmann E, Dessaux Y. 1995. A critical examination of the specificity of the Salkowski reagent for indolic compounds produced by phytopathogenic bacteria. Appl Environ Microbiol. 61:793-796.
Halimah D. 2010. Minyak atsiri dari tanaman nilam (Pogostemon cablin Benth.) melalui metode fermentasi dan hidrodistilasi serta uji bioaktivitasnya.
Prosiding Tugas Akhir Semester Genap 2010/2011. Surabaya: FMIPA Institut Teknologi Sepuluh November.
Hongqing H, Xueyuan L, dan Jizheng H. 2002. Effects of organic acids on desorption of phosphat from the surfaces of aluminium hydroxide and complexes. World Congress Soil Sci. Thailand. Symposium 47. 170. Isgitani N, Kabirun S, Siradz SA. 2005. Pengaruh inokulasi bakteri pelarut fosfat
terhadap pertumbuhan sorghum pada kandungan P tanah. J Tanah Lingk.
5(1): 48-54.
Jeung Y, Kim J, Kang Y. 2007. Genetic diversity and diversity of Korean isolates of Ralstonia solanacearum. Plant Disease 91 (10): 1277-1287.
Jimptha JC, Smitha PV, Anisha C, Deepthi P, Meekha G, Radhakrishnan EK, Gayatri GP, Remakanthan A. 2014. Isolation of endophytic bacteria from embryogenic suspension culture of banana and assessment of their plant growth promoting properties. Plant Cell Tiss Org. 10:1-10.
Khoirunnisya. 2009. Potensi bakterisida senyawa metabolit Penicillium spp. terhadap Ralstonia solanacearum penyebab penyakit layu bakteri pada cabai [Skripsi]. Bogor: Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Kim KY, Hwangbo H, Park RD, Seong KY, Kim YW, Park BK, Krishnan HB. 2002. The 2-ketogluconic acid production and phosphat solubilization by
Enterobacter intermedium. World Congress Soil Sci. Thailand. Symposium 06. 919.
indole-3-22
acetonitrile in plant-associated bacteria, Agrobacterium and Rhizobium.
Proc Natl Acad Sci USA 92: 714–718.
Krausse, Pienning, Ullmann. 2005. Inhibitory effects of various micro-organism on growth of Helicobacter pylori.Lett Appl Microbiol. 40: 81-86.
Kuswinanti, Baharuddin, Sukmawati S. 2013. Efektivitas isolat bakteri yang berasal daru berbagai rizosfer dan bahan organik terhadap patogen penyakit layu secara in vitro. Makalah. Makasar: Fakultas Pertanian Universitas Hasanudin.
Lamos MA, Teixeira JA, Domingues N, Mota M, Gama FM. 2003. The enhancement of the cellulolytic activity of cellobiohidrolase and endoglucanase by the addition of cellulose binding domains derived from
Trichoderma reesei.Enzym Microb Technol. 32: 35-40.
Leiwakabessy. 2011. Respons Hipersensitif. Bogor: Fakultas Pertanian Departemen Proteksi Tanaman Institut Pertanian Bogor.
Malfanova NV. 2013. Endophytic Bacteria with Plant Growth Promoting and Biocontrol Abilities. Leiden: University of Leiden Pr.
Mangindaan, Losung. 2013. Aktivitas hemolitik teripang (Bohadschia graeffei) dari pantai malalayang, Sulawesi Utara pada beberapa suhu dan pH. J. Ilmiah Sains. 13(1): 27-33.Marlina N dan D Rusnandi. 2007. Teknik aklimatisasi planlet anthurium pada beberapa media tanam. Bul Teknik Pertanian. 12(1):38-40.
Meryandini A, Widosari W, Maranatha D, Sunarti TC, Rachmania N, Satria H. 2009. Isolasi bakteri selulolitik dan karakterisasi enzimnya. Makaira Sains.
13(1): 33-38.
Munif A, Wiyono S. 2012. Pemanfaatan bakteri endofit untuk meningkatkan pertumbuhan dan kesehatan tanaman padi gogo. Di dalam: Suwarno, editor.
Prosiding Seminar Hasil-Hasil Penelitian IPB 2012. hlm 349-417.
Nagasawa T, Mauger J, Yamada H. 1990. A novel nitrilase, arylacetonitrilase, of Alcaligenes faecalis JM3 purification and characterization. Eur J Biochem.
194: 765–772.
Nawangsih AA. 2006. Seleksi dan karakterisasi bakteri biokontrol untuk mengendalikan penyakit layu bakteri (R. solanacearum) pada tomat [Disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Oberhansli E, Defago G, Haas D. 1991. Indole-3-acetic-acid (IAA) synthesis in the biocontrol strain CHA0 of Pseudomonas fluorescens – role of tryptophan side-chain oxidase. J Gen Microbiol. 137: 2273–2279.
Perley JW, Stowe BB. 1966. On the ability of Taphrina deformans to produce indoleacetic acid from tryptophan by way of tryptamine. Plant Physiol. 41: 234–237.
23 Premono ME. 1994. Jasad renik pelarut fosfa: pengaruhnya terhadap P tanah dan efisiensi pemupukan P tanaman tebu. [Disertasi]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor.
Prinsen E, Chauvaux N, Schmidt J, John M,Wieneke U, Degreef J, Schell J, Vanonckelen H. 1991. Stimulation of indole-3-acetic acid production in Rhizobium by flavonoids. FEBS Lett. 282: 53–55.
Ratdiana. 2007. Kajian pemanfaatan air kelapa dan limbah cair peternakan sebagai media alternatif perbanyakan Pseudomonas fluorescens serta uji potensi antagonismenya terhadap Ralstonia solanacearum [Skripsi]. Bogor : Fakultas Pertanian, Institut Pertanian Bogor.
Ruangsanka S. 2014. Identification of phosphate-solubilizing bacteria from the bamboo rhizosphere. Sci Asia. 40: 204-211.
Rusli MS. 2010. Sukses Memproduksi Minyak Atsiri. Jakarta: Penerbit Agromedia Pustaka.
Salisbury F, Ross C. 1995. Fisiologi Tumbuhan jilid 2. Bandung: Institut Teknologi Bandung.
Santoso U, Nursaidi F. 2001. Kultur Jaringan Tanaman. Malang: Universitas Muhammadiyah Malang Pr.
Schulz B. 2014. Endophytes from herbaceous plants and shrubs: effectiveness of surface sterilization methods. Mycol Res. 97(12): 1447-1450.
Setiawati T, Mihardja P. 2008. Identifikasi dan kuantifikasi metabolit bakteri pelarut fosfat dan pengaruhnya terhadap aktivitas Rhizoctonia solani pada tanaman kedelai. J Trop Soils. 13(3): 233-240.
Shahab S, Ahmed M, Khan NS. 2009. Indole acetic acid production and enhanced plant growth promotion by indigenous PSBs. Afr J Agric Res. 4(11): 1312-1316.
Simanungkalit R, Saraswati, Rasti, Hastuti, Husen R. 2006. Bakteri Penambat Nitrogen dalam Pupuk Organik dan Pupuk Hayati. Bogor: Balai Besar Penelitian dan Pengembangan Sumberdaya Lahan Pertanian.
Simarmata, Lekatompessy, Sukiman. 2007. Isolasi mikroba endofitik dari tanaman obat sambung nyawa (Gynura procumbens) dan analisis potensinya sebagai antimikroba. Berk Penel Hayati 13 : 85-90.
Snavely J, Brahier J. 1960. The viability of streptococci under field screening conditions. Amer J Clin Pathol. 33:511-515.
Spaepen S, Vanderleyden J, Remans R. 2007. Indole-3-acetic acid in microbial and microorganism-plant signaling. FEMS Lett. Hal 1-24.
Suriaman E. 2010. Potensi bakteri endofit dari akar tanaman kentang (Solanum tuberosum) dalam memfiksasi N2 di udara dan menghasilkan hormon IAA (Indole Acetic Acid) secara in vitro. [Skripsi]. Malang: Fakultas Sains dan Teknologi Departemen Biologi Universitas Islam Negeri Malang.
24
endophytic bacteria exhibiting a beneficial effect on growth and development of poplar trees. Appl Environ Microbiol J. 75(3):748-757. Theunis M, Kobayashi H, Broughton W, Prinsen E. 2004. Flavonoids, NodD1,
NodD2, and nod-box NB15 modulate expression of the y4wEFG locus that is required for indole-3-acetic acid synthesis in Rhizobium sp. strain NGR234. Mol Plant–Microb Interact 17: 1153–1161.
Wahyudi, Meliah S, dan Nawangsih AA. 2011. Xanthomonasi oryzae pv. oryzae bakteri penyebab hawar daun pada padi: isolasi, karakterisasi, dan telaah muragenensis dengantransposon. Makaira Sains. 15:89-96.
Young, Mulkey. 1997. Effect of ethylene antagonists on auxin-induced inhibition of intact primary root elongation in maize (Zea mays L.). J Plant Biol.
40(4)256-260.
25 Lampiran 1 Hasil isolasi bakteri endofit dari tanaman Nilam
Kode Bakteri Warna Bentuk Elevasi
B61.1 Putih Tidak menyebar
Kasar
Datar
B61.2 Putih Tidak menyebar
Halus
Datar
B61.3 Putih Tidak menyebar
Kasar
B63.1 Merah-jingga Tidak menyebar
Halus
Cembung
B63.2 Merah-jingga Tidak menyebar Cembung
B63.3 Kuning Tidak menyebar
Kasar Berserabut
Datar
B63.4 Putih-kuning Tidak menyebar
Kasar
Datar
B63.5 Putih-kuning Tidak menyebar
Kasar
Datar
B63.6 Putih-merah Tidak menyebar
Halus
Cembung
B63.7 Kuning Tidak menyebar
Kasar
Cembung
B63.8 Merah muda Tidak menyebar
Halus
Cembung
B63.9 Merah muda Tidak menyebar
Halus
Cembung
B63.10 Kuning Tidak menyebar
Halus
Cembung
B63.11 Hijau muda Tidak menyebar
Halus
Datar
B63.12 Merah muda Tidak menyebar
Halus
26
NSD 24 Putih Menyebar
Kasar
Datar
NSD 25 Putih-kuning Tidak menyebar
Halus
P 28 Putih-merah muda Tidak menyebar
Halus
Cembung
P 29 Putih-merah muda Tidak menyebar
27
B61.3 B61.2 B61.3 B62.1 B62.2 B63.1 B63.2
B63.3 B63.4 B63.5 B63.6 B63.7 B63.8 B63.9
B63.10 B63.11 B63.12 NSD 14 NSD 15 NSD 16 NSD 17
NSD 18 NSD 20 NSD 21 NSD 22 NSD 23 NSD 24 NSD 25
P 26 P 27 P 28 P 29 P 30 P 31 P 32
P 33 P34 P35 P 36 P 37 P 38 P 39
P 40
28
Lampiran 2 Seleksi awal isolat endofit dengan cara uji HR pada daun tembakau dan uji aktivitas hemolitik
Kode Bakteri Uji HR Uji Hemolitik
B61.1 - -
Keterangan: Isolat bakteri endofit yang memiliki sifat patogen pada daun tembakau dieliminasi sehingga tidak diuji aktivitas hemolitiknya.
29
Tumbuh normal Pendek tidak
bercabang
Tumbuh normal Pendek tidak
bercabang
Tumbuh normal Tinggi tidak
30
Tumbuh normal Tinggi tidak
31 Lampiran 4 Hasil pengukuran absorbansi Asam Indol Asetat dan komponen
sejenisnya yang dihasilkan oleh isolat bakteri endofit Kode
Isolat
Absorbansi
Rerata Kadar IAA-like compounds Standar
Deviasi
Standar Error
I II III
B63.6 0.110 0.111 0.090 0.1036 4.43607 0.0118 0.0068
B63.7 0.137 0.135 0.138 0.1366 10.9811 0.0015 0.0008
B63.8 0.230 0.230 0.233 0.2310 29.6906 0.0017 0.0010
B63.9 0.137 0.135 0.136 0.1360 10.8489 0.0010 0.0005
B63.10 0.139 0.138 0.138 0.1383 11.3116 0.0005 0.0003
B63.11 0.122 0.120 0.123 0.1216 8.0060 0.0015 0.0008
NSD 20 0.159 0.162 0.158 0.1596 15.5428 0.0020 0.0012
NSD 23 0.123 0.123 0.124 0.1233 8.33664 0.0005 0.0003
P 26 0.123 0.121 0.119 0.1210 7.87386 0.0020 0.0011
P 27 0.105 0.100 0107 0.1040 4.50218 0.0036 0.0020
P 30 0.132 0.133 0.130 0.1316 9.98942 0.0015 0.0008
P 35 0.198 0.195 0.200 0.1976 23.0795 0.0025 0.0014
P 39 0.160 0.158 0.162 0.1600 15.6089 0.0020 0.0011
32
Lampiran 5 Kurva standar pengukuran Asam Indol Asetat (Merck, Darmstadt, Germany)
0 0.1 0.2 0.3 0.4 0.5 0.6
0 20 40 60 80 100 120
A
bs
or
ban
s
i
33
RIWAYAT HIDUP
Penulis dilahirkan di Bekasi pada tanggal 19 Juni 1993 dari ayah Teguh Sutanto dan Ibu Yenny Pramusinta. Penulis merupakan anak pertama dari dua bersaudara. Penulis memiliki seorang adik perempuan bernama Rahma Larasati. Penulis lulus dari SMA Negeri 1 Tambun Selatan, Bekasi pada tahun 2011 dan diterima sebagai mahasiswa Program Sarjana Biokimia Institut Pertanian Bogor melalui Seleksi Nasional Masuk Perguruan Tinggi Negeri jalur Undangan tahun 2011.
Selama menjalani kuliah di IPB, penulis aktif pada berbagai kegiatan Departemen Biokimia IPB dan Unit Kegiatan Mahasiswa (UKM) lainnya. Penulis merupakan anggota English Club Asrama TPB-IPB tahun 2011, dan pernah bekerja sebagai asisten praktikum mata kuliah Kimia Dasar II TPB-IPB tahun 2012 hingga 2015. Penulis juga merupakan anggota Community Research and Development in Biochemistry (himpunan profesi mahasiswa Biokimia IPB) dan pernah melakukan Praktik Lapang di Balai Penelitian Bioteknologi Perkebunan Indonesia, Bogor tahun 2014. Penulis mengembangkan bakatnya di bidang seni dengan berpartisipasi dalam Paduan Suara UKM Keluarga Mahasiswa Katolik IPB (KeMaKIPB) Puella Domini Choir sebagai penyanyi tenor dan organis pada tahun 2011 hingga 2015 serta berpartisipasi sebagai paduan suara Natal Nasional 2011 bersama Presiden ke-6 Republik Indonesia Susilo Bambang Yudhoyono. Selain itu, penulis memiliki ketertarikan pada bidang jurnalistik dan ilmu komunikasi sehingga menyelesaikan minor Komunikasi dari departemen Sains Komunikasi dan Pengembangan Masyarakat IPB serta menjabat sebagai kepala divisi Informasi dan Komunikasi UKM KeMaKIPB tahun 2012-2014 sekaligus pemimpin redaksi Buletin Bulanan UKM KeMaKIPB tahun 2013.