KUALITAS SEMEN DI DALAM PENGENCER TRIS
DAN NATRIUM SITRAT DENGAN BERBAGAI SUMBER
KARBOHIDRAT DAN LEVEL GLISEROL PADA PROSES
KRIOPRESERVASI SEMEN RUSA TIMOR (Cervus timorensis)
SISWANTO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul “Kualitas Semen di dalam Pengencer Tris dan Natrium Sitrat dengan Berbagai Sumber
Karbohidrat dan Level Gliserol pada Proses Kriopreservasi Semen Rusa Timor
(Cervus timorensis)” adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantukan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, April 2006
Siswanto
ABSTRAK
SISWANTO. Kualitas Semen di dalam Pengencer Tris dan Natrium Sitrat dengan Berbagai Sumber Karbohidrat dan Level Gliserol pada Proses Kriopreservasi Semen Rusa Timor (Cervus timorensis). Dibimbing oleh MOZES R TOELIHERE dan TUTY L YUSUF.
Permasalahan utama dalam kriopreservasi semen rusa, adalah motilitas yang rendah pasca pembekuan. Faktor ini sangat berpengaruh terhadap keberhasilan Inseminasi buatan (IB) pada rusa. Saat ini sangat sulit untuk mendapatkan semen beku yang memenuhi standar minimal untuk IB pada rusa. Penyebab utamanya adalah belum ditemukannya bahan pengencer semen rusa yang dapat menjamin kebutuhan fisik dan kimia bagi spermatozoa, sehingga spermatozoa dapat mempertahankan kelangsungan hidupnya selama proses kriopreservasi.
Pene litian ini dilakukan pada bulan Oktober 2003 sampai dengan bulan Juli 2004 di penangkaran rusa Pondok Gede, Bekasi dan Laboratorium Unit Rehabilitasi Reproduksi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Hewan percobaan yang digunakan adalah 4 ekor rusa jantan dewasa dengan kisaran umur 3 - 4 tahun, mempunyai tubuh yang sehat, serta dalam kondisi berangga keras. Peralatan yang dipakai adalah elektroejakulator, mikroskop, perlengkapan pengenceran, pemeriksaan dan penyimpanan semen. Bahan pengencer yang dipakai dalam penelitian ini adalah tris glukosa (TG), tris fruktosa (TF), natrium sitrat glukosa (NsG), dan natrium sitrat fruktosa (NsF), streptomisin, penisilin, akuadestilata, pewarna eosin- negrosin, KY jelly, nitrogen cair, alkohol, gliserol, serta obat anastesi Ilium Xylazine dan Ketamil Injection (Prod. Troy Laboratories Pty Limited, Austria). Penampungan dan evaluasi semen dilakukan tiga minggu sekali dengan menggunakan elektroejakulator. Semen yang telah diperoleh dievaluasi secara makroskopis dan mikroskopis. Pemeriksaan makroskopis dilakukan segera setelah semen diperoleh meliputi volume, pH, konsistensi dan warna, sedangkan pemeriksaan mikroskopis meliputi: gerakan massa, konsentrasi spermatozoa, persentase motilitas, hidup, dan MPU.
Hasil penelitian tentang penggunaan pengencer dengan sumber karbohidrat menunjukkan tidak terjadi interaksi antar perlakuan, tetapi masing- masing perlakuan memberikan pengaruh yang nyata (P<0.05) terhadap beberapa parameter kualitas semen cair pada beberapa tahap evaluasi. Penurunan persentase motilitas, hidup, dan MPU pada semen cair yang disimpan selama 96 jam di dalam pengencer TG (masing-masing 41.43%, 16.74%, dan 15.13%), pengencer TF ((masing-masing- (masing-masing 50.00%, 37.84%, dan 38.57%), pengencer NsG (masing- masing 32.86%, 24.51%, dan 22.50%), dan pengencer NsF (masing- masing 39.57%, 28.51%, dan 25.19%).
Hasil penelitian tentang penggunaan pengencer dengan level gliserol yang berbeda pada proses kriopreservasi menunjukkan tidak terjadi interaksi antar perlakuan, tetapi masing- masing perlakuan memberikan pengaruh yang nyata (P<0.05) pada tahap ekulibrasi dan pasca thawing, dimana penambahan gliserol 10% ke dalam pengencer tris glukosa menghasilkan persentase motilitas, hidup dan MPU spermatozoa yang relatif lebih tinggi dibandingkan dengan kombinasi jenis pengencer dan level gliserol yang lain (tris glukosa G15%, natrium sitrat glukosa G10%,dan natrium sitrat glukosa G15%).
KUALITAS SEMEN DI DALAM PENGENCER TRIS
DAN NATRIUM SITRAT DENGAN BERBAGAI SUMBER
KARBOHIDRAT DAN LEVEL GLISEROL PADA PROSES
KRIOPRESERVASI SEMEN RUSA TIMOR (
Cervus timorensis
)
SISWANTO
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Jurusan Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Kualitas Semen di dalam Pengencer Tris dan Natrium Sitrat dengan Berbagai Sumber Karbohidrat dan Level Gliserol pada Proses Kriopreservasi Semen Rusa Timor (Cervus timorensis)
Nama : Siswanto Nrp : B651024021
Disetujui Komisi Pembimbing,
Prof . Dr. drh. Mozes R Toelihere, M.Sc. Dr. drh. Tuty L Yusuf, M.S. Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana Biologi Reproduksi
Dr. drh. Tuty L Yusuf, M.S. Prof. Dr. Ir. Syafrida Manuwoto, M.Sc.
Penulis di lahirkan di Desa bumi Kencana, Kecamatan Seputih Agung,
Kabupaten Lampung Tengah pada tanggal 23 April 1977 yang merupakan anak
ketujuh dari pasangan Bapak Mastur (alm) dan Ibu Asiyati.
Tahun 2002 penulis lulus strata satu pada Program Studi Produksi ternak,
Jurusan Produksi Ternak, Fakultas Pertanian,Universitas Lampung dan pada tahun
yang sama diterima di Program Studi Biologi Reproduksi, Program Sekolah
Pascasarjana, Institut Pertanian Bogor.
Tahun 2000 penulis mengikuti pelatihan manajemen pakan ternak sapi di PT
Great Giant Peneaple Coy Lampung. Tahun 2001 tergabung dalam tim peneliti Semi
Que III Lembaga Pengabdian Masyarakat, Universitas Lampung. Selama mengikuti
S2, penulis aktif di Wacana Biologi Reproduksi dan mengik uti seminar bulanan yang
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa, karena atas rahmat dan hidayah-Nya sehingga penulisan tesis yang berjudul “Kualitas Semen di dalam Pengencer Tris dan Natrium Sitrat dengan Berbagai Sumber
Karbohidrat dan Level Gliserol pada Proses Kriopreservasi Semen Rusa Timor
(Cervus timorensis)” ini dapat diselesaikan dengan baik. Tesis ini disusun
sebagai salah satu syarat untuk menyelesaikan Program Magister Sains pada Program Studi Biologi Reproduksi, Sekolah Pascasarjana, Institut Pertanian Bogor.
Penelitian ini dilaksanakan pada bulan Oktober 2003 sampai dengan bulan Juli 2004 di penangkaran rusa Pondok Gede, Bekasi dan Laboratorium Unit Rehabilitasi Reproduksi, Departemen Klinik, Reproduksi, dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor atas bantuan dana dari Hibah Pasca, Direktorat Penelitian dan Pengabdian pada Masyarakat, Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional.
Terima kasih penulis ucapkan kepada Bapak Prof. Dr. drh. Mozes R Toelihere, M.Sc. dan Ibu Dr. drh. Tuty L Yusuf, M.S. selaku pembimbing atas nasehat, kritik dan saran yang diberikan demi meningkatkan bobot ilmiah dari tesis ini. Disamping itu, penghargaan penulis sampaikan kepada Ibu Dr. Ir. WM Nalley, M.Si., Ibu Dr. Ir. Ristika Handarini, M.Si., Ibu Dra. Iis Arifiantini, M.Si., Mas Bondan, Vira, dan Nadja yang telah membantu selama pengump ulan data. Ungkapan terima kasih juga disampaikan kepada istriku yang tercinta Irma Dwi Levi dan anakku Nadya Rihhadatul Aisya, Ibu, kakak, serta seluruh keluarga yang senantiasa mendoakan, memberikan bantuan, pengertian dan dorongan moril sehingga penulis dapat menyelesaikan studi ini dengan baik.
Akhirnya penulis menyadari bahwa isi tesis ini masih jauh dari kesempurnaan. Oleh karenanya penulis mengharapkan saran dan kritikan demi untuk pengembangan ilmu pengetahuan. Semoga tesis ini dapat bermanfaat.
Bogor, April 2006
Halaman
DAFTAR TABEL... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN Latar Belakang... 1
Kerangka Pemikiran ... 2
Tujuan Penelitian... 4
Kegunaan Penelitian... 4
Hipotesis ... 4
TINJAUAN PUSTAKA Biologi Reproduksi Rusa Timor ... 5
Klasifikasi Rusa Timor ... 5
Biologi Umum Rusa Timor ... 5
Karakteristik Reproduksi Rusa Timor ... 6
Fisiologi Semen Rusa ... 6
Plasma Semen... 7
Spermatozoa... 8
Metabolisme Spermatozoa ... 8
Pengencer, Komponen Pengencer, dan Pengenceran Semen... 12
Pengencer Tris ... 13
Pengencer Natrium Sitrat... 14
Kuning Telur ... 15
Karbohidrat ... 15
Krioprotektan... 16
Prinsip-Prinsip Pembekuan Semen... 18
Faktor-Faktor Penyebab Kerusakan Sel Spermatozoa selama Kriopreservasi... 18
Pembentukan Kristal-Kristal Es... 19
Cekaman Osmotik... 21
MATERI DAN METODE
Waktu dan Tempat Penelitian... 22
Materi Penelitian... 22
Hewan Percobaan... 22
Alat dan Bahan... 22
Metode Penelitian... 23
Penampungan dan Evaluasi Semen ... 23
Pengenceran Semen ... 24
Kegiatan I ... 24
Kegiatan II ... 25
Parameter yang Diamati ... 27
Rancangan Penelitian... 27
HASIL DAN PEMBAHASAN Karakteristik Semen Segar ... 28
Pengaruh Jenis Pengencer terhadap Kualitas Semen Cair... 30
Pengaruh Jenis Pengencer terhadap Persentase Motilitas ... 30
Pengaruh Jenis Pengencer terhadap Persentase Hidup Spermatozoa ... 33
Pengaruh Jenis Pengencer terhadap Persentase MPU... 35
Pengaruh Jenis Pengencer dan Dosis Gliserol terhadap Kualitas Semen Beku... 38
Pengaruh Gliserol terhadap Kualitas Semen ... 38
Persentase Motilitas ... 38
Persentase Hidup ... 40
Persentase Membran Plasma Utuh... 42
SIMPULAN DAN SARAN Simpulan... 46
Saran ... 46
DAFTAR PUSTAKA ... 47
Halaman 1 Sifat semen rusa Timor yang ditampung dengan elektroejakulator ... 7 2 Komposisi pengencer yang akan digunakan... 23 3 Rataan nilai karakteristik semen segar rusa Timor ... 28 4 Rataan persentase motilitas spermatozoa yang disimpan dalam
lemari es (3 – 5oC)pada berbagai jenis pengencer ... 31 5 Rataan persentase hidup spermatozoa yang disimpan dalam
lemari es (3 – 5oC) pada berbagai jenis pengencer ... 33 6 Rataan persentase MPU spermatozoa yang disimpan dalam
lemari es (3 – 5oC) pada berbagai jenis pengencer ... 36 7 Rataan persentase motilitas spermatozoa dalam berbagai kombinasi
jenis pengencer dan dosis gliserol ... 39 8 Rataan persentase hidup spermatozoa dalam berbagai kombinasi
PENDAHULUAN
Latar Belakang
Rusa adalah salah satu jenis satwa liar yang potensial dikembangkan sebagai jenis ternak harapan karena mempunyai banyak kelebihan dibandingkan dengan ternak lain, diantaranya mempunyai velvet yang dapat digunakan dalam bidang pengobatan, memiliki persentase karkas yang tinggi, dan memiliki kandungan kolesterol di dalam daging yang lebih rendah dibandingkan dengan sapi, domba maupun babi.
Usaha pengembangbiakkan rusa sebagai salah satu komoditas penyediaan stok daging dalam negeri belum banyak dilakukan masyarakat seperti halnya di negara Australia, Selandia Baru, Cina, maupun Amerika Serikat. Agar usaha pengembangbiakkan dapat dilaksanakan secara efektif dan efisien dalam rangka memperoleh keuntungan semaksimal mungkin, maka dibutuhkan suatu sistem pengelolaan yang tepat guna.
Inseminasi buatan (IB) merupakan salah satu metode pendekatan teknologi bidang reproduksi yang dapat membantu dalam mengembangbiakkan rusa secara cepat. IB merupakan metode yang efektif dan efisien dala m membantu meningkatkan produksi daging dan mempercepat kemajuan genetik. Permasalahan utama yang dapat mempengaruhi keberhasilan IB adalah kualitas semen beku yang rendah dan teknik IB yang belum tepat. Kedua faktor ini dapat berpengaruh secara simultan terhadap pemberdayaan teknologi IB pada rusa.
Salah satu upaya yang dapat dilakukan untuk mempertahankan kualitas semen rusa pasca pembekuan adalah penyediaan pengencer semen yang dapat menjamin kebutuhan fisik dan kimia bagi spermatozoa, sehingga spermatozoa dapat mempertahankan kelangsungan hidupnya selama proses kriopreservasi. Prinsip dasar pengencer semen adalah harus mengandung unsur-unsur yang hampir sama sifat fisik dan kimia plasma semen, tidak mengandung zat-zat toksik yang dapat meracuni spermatozoa, dan tidak membatasi kemampuan fertilisasi spermatozoa.
pengencer dasar tris-asam sitrat fruktosa-kuning telur dan natrium sitrat-glukosa-kuning telur seperti yang biasa digunakan pada proses kriopreservasi ternak mamalia umumnya. Kedua alternatif bahan pengencer ini direkomendasikan, karena kemungkinan memiliki kelebihan, yaitu tris dan sitrat dapat mempertahankan osmolaritas dan sebagai penyangga yang dapat digunakan secara efektif untuk mempertahankan pH secara fisiologik, glukosa/fruktosa sebagai sumber energi, bagi spermatozoa selama inkubasi dan dapat mempertahankan tekanan osmotik pengencer, dan kuning telur dapat melindungi spermatozoa dari kerusakan akibat cekaman dingin (cold shock). Penambahan gliserol yang optimal ke dalam pengencer semen beku diharapkan dapat melindungi membran plasma dan mencegah kerusakan fisik serta fungsional sel spermatozoa selama proses kriopreservasi semen akibat terbentuknya kristal-kristal es.
Berdasarkan uraian tersebut di atas, maka dilakukan penelitian untuk membandingkan jenis pengencer tris dan natrium sitrat yang dikombinasikan dengan sumber karbohidrat glukosa dan fruktosa serta krioprotektan gliserol 10 dan 15%.
Kerangka Pemikiran
Sampai saat ini bahan pengencer untuk pembekuan semen rusa, baik untuk semen cair, apalagi semen beku belum ada standar bakunya. Walaupun telah banyak dikenal berbagai jenis pengencer dasar semen, seperti tris dan sitrat yang biasanya dipakai pada ternak mamalia umumnya, namun peranannya dalam pembekuan semen rusa belum optimal. Hal ini ditandai dengan masih rendahnya kualitas semen yang diperoleh pasca thawing. Untuk itu perlu dilakukan perbaikan-perbaikan yang dapat meningkatkan kualitas spermatozoa setelah dibekukan. Salah satu strategi yang dapat dilakukan untuk perbaikan itu adalah melalui penambahan berbagai jenis karbohidrat dan dosis krioprotektan yang optimal.
3
fruktosa termasuk kelompok ketosa yang memiliki berat molekul 180.16 g/mol dan secara fisiologis ditemukan pada sebagian besar plasma semen mamalia yang berguna untuk menghasilkan energi dan daya hidup bagi spermatozoa. Karbohidrat selain sebagai sumber energi untuk mempertahankan kelangsungan hidup spermatozoa selama proses pembekuan, ternyata juga berperan sebagai krioprotektan ekstraseluler yang dapat membantu mempertahankan kestabilan membran sel.
Penambahan krioprotektan seperti gliserol dengan dosis yang tepat ke dalam pengencer semen diharapkan dapat mengatasi masalah rendahnya kualitas semen beku rusa. Gliserol diharapkan dapat melindungi membran plasma dan mencegah kerusakan fisik dan fungsional sel spermatozoa selama proses pembekuan semen akibat terbentuknya kristal-kristal es. Walaupun gliserol dapat memberikan perlindungan terhadap sel spermatozoa, namun pada rusa belum diketahui konsentrasi yang optimal untuk mempertahankan membran sel selama proses pembekuan. Penambahan gliserol sebanyak 10% ke dalam pengencer susu skim dan sitrat kuning telur pernah dicobakan pada rusa Waipiti dengan diperoleh motilitas pasca thawing yang cukup memuaskan. Hal yang sama juga pernah dilakukan dengan penambahan gliserol sebanyak 14% ke dalam pengencer natrium sitrat (2.9%) dan kuning telur 20% pada rusa Sambar dengan diperoleh motilitas pasca thawing yang bervariasi antara 10 – 70%. Sebagai perbandingan, penambahan gliserol sebanyak 10% ke dalam pengencer susu-glukosa-kuning telur dan susu- glisin-kuning telur pernah dicobakan pada spermatozoa sapi yang disimpan pada suhu 5oC dengan hasil yang tidak berbeda nyata terhadap lama hidup sperma. Menurut Evan dan Maxwel (1987) untuk melakukan pembekuan semen kambing standar penggunaan gliserol yang dianjurkan adalah 6-8%, jika kurang dari itu maka gliserol tidak akan memberikan efek yang berarti, sedangkan jika lebih tinggi maka akan menimbulkan efek toksik pada spermatozoa.
karbohidrat dan dosis gliserol yang optimal untuk meningkatkan kualitas semen beku rusa Timor.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
1 Penambahan glukosa dan fruktosa, sama-sama dapat meningkatkan kualitas semen rusa Timor.
2 Terdapat interaksi antara jenis pengencer dengan sumber karbohidrat (glukosa dan fruktosa) ataupun dosis gliserol dalam mempertahankan kualitas semen rusa Timor
3 Dosis gliserol yang optimum dalam pengencer mempunyai kemampuan dalam mempertahankan kualitas semen beku rusa Timor.
Tujuan Penelitian
Penelitian ini dilaksanakan dengan tujuan:
1 Menentukan jenis pengencer dan sumber karbohidrat terbaik yang dapat mempertahankan kualitas semen rusa Timor.
2 Mengetahui ada tidaknya interaksi antara jenis pengencer dengan sumber karbohidrat yang berbeda dalam mempertahankan kualitas semen rusa Timor.
3 Menentukan dosis gliserol yang tepat dalam mempertahankan kualitas semen beku rusa Timor.
Kegunaan Penelitian
TINJAUAN PUSTAKA
Biologi Reproduksi Rusa Timor
Klasifikasi Rusa Timor
Rusa Timor (Cervus Timorensis) merupakan salah satu dari empat rusa yang ada di Indonesia. Dalam klasifikasi hewan, rusa Timor termasuk ordo Artiodatyla, sub-ordo Ruminansia, famili Cervidae yang terdiri atas enam sub famili yaitu Rangiferinae, Alcinae, Hydropotinae, Muntiacinae, Odocoilinae, dan Cervinae. Rusa Timor termasuk pada sub famili Cervinae, genus Cervus, spesies
Cervus Timorensis.
Rusa Timor terbagi dalam delapan sub-spesies yang tersebar di Jawa, Sulawesi, Maluku, Sumbawa, Sumba, dan Timor. Kedelapan sub-spesies tersebut adalah Cervus timorensis (rusa Jawa), Cervus timorensis timorensis (Pulau Timor, Rote, Alor), Cervus timorensis floresiensis (Flores), Cervus timorensis maccasaricus (Sulawesi), Cervus timorensis djonga (Pulau Buton), Cervus timorensis moluccensis (Maluku), Cervus timorensis renschi (Sumbawa), dan
Cervus timorensis loronesiotes (Pulau Peucang).
Biologi Umum Rusa Timor
Rusa Timor umumnya berwarna coklat keabu-abuan sampai coklat gelap. Berat badan dewasa mencapai 60 kg bahkan dapat mencapai 100 kg, panjang badan berkisar 1.95 – 2.10 m, tinggi badan 1.00 – 1.10 m dan tinggi tumitnya 0.29 – 0.35 m. Panjang tengkorak jantan 0.320 – 0.350 m dan betina 0.290 – 0.320 m. Rusa jantan memiliki rangga dengan panjang maksimum
mencapai 0.870 m, rangga bercabang sesuai pertambahan umur.
Karakteristik Reproduksi Rusa Timor
Pubertas pertama pada rusa Timor jantan mulai terjadi saat pedicle mulai tumbuh. Rusa Timor jantan biasanya me ncapai dewasa kelamin pada umur 12 sampai 18 bulan atau jika telah mencapai bobot badan sekitar 45 sampai 50 kg. (Semiadi 1998b).
Status fisiologis reproduksi rusa jantan meliputi status rangga, lingkar leher dan lingkar tetis. Siklus reproduksi rusa dikenal dengan istilah siklus rangga (antler cycle). Siklus rangga ini teramati dari pertumbuhan rangga yang masih terbungkus kulit atau disebut dengan tahap velvet, selanjutnya kulit rangga mengelupas dinamakan dengan tahap shedding, berikutnya ialah rangga rusa dalam tahap keras dan akhirnya rangga rusa lepas. Siklus ini berkaitan dengan kemampuan berkembangbiak. Pada saat rangga rusa berada pada tahap keras, maka lingkar testis maksimum dengan produksi spermatozoa juga maksimum, kadar testosteron darah tinggi dan rusa sangat agresif. Sebaliknya jika rangga rusa lepas maka lingkar testis akan minimum, produksi spermatozoa menurun, kadar testosteron darah rendah, dan lingkar leher juga mengecil. Pada saat itu semen yang dihasilkan mengandung jumlah spermatozoa sedikit, dengan persentase abnormalitas yang tinggi.
Pada beberapa jenis rusa, di saat pejantan dalam keadaan berangga keras akan mengeluarkan aroma badan yang khas dan kuat. Biasanya prilaku berkubang juga timbul, dimana apabila sumber air tidak dijumpai maka air kencingnya sendiri dipakai sebagai sumber kubangan. Semangat untuk bertarung di saat rangga keras juga tinggi dan ini berhubungan dengan sifat untuk mempertahankan daerah kekuasaan dan mempertahankan betina yang diinginkannya sebanyak mungkin.
Fisiologi Semen Rusa
7
Masyud dan Taurin (2000) melaporkan bahwa semen rusa Timor yang berumur lebih dari lima tahun yang ditampung dengan elektroejakulator pada musim kawin (Desember- Februari) mempunyai volume 1.2 sampai 1.7 ml, berwarna putih sampai putih kekuningan, motilitas 66.7% sampai 76.7%, dan konsentrasi antara 840 x 106 sampai 1140 x 106 sel/ml (Tabel 1).
Tabel 1 Sifat semen rusa Timor yang ditampung dengan elektroejakulator
Ejakulat Sumber: Masyud dan Taurin (2000).
Plasma Semen
Plasma semen merupakan cairan yang sebagian besar disekresikan oleh kelenjar vesikularis, prostat, dan bulbourethralis dan dalam jumlah kecil disekresikan oleh testis. Menurut Bearden dan Fuquay (1997) komponen plasma semen terdiri atas glycosaminoglycan (GAG), yang merupakan suatu protein, natrium, dan klorin sebagai bahan anorganik, penyangga dan sebagai sumber energi bagi spermatozoa baik yang dapat digunakan secara langsung seperti fruktosa dan surbitol maupun yang secara tidak langsung digunakan yaitu glyceryl phosphoryl choline (GPC). Sedangkan menurut Garner dan Hafez (2000) di dalam plasma semen terdapat asam sitrat dalam konsentrasi tinggi, ergotionin, fruktosa, GPC, dan sorbitol yang berfungsi sebagai energi cadangan apabila subtrat yang lain telah habis. Selain itu terdapat pula asam amino, asam askorbat, protein, lipid, asam lemak dan beberapa enzim.
membran plasma spermatozoa, (2) vitamin C berperan melindungi membran plasma spermatozoa dari kerusakan selama proses pembekuan semen, dengan jalan me ngikat radikal oksigen sehingga mencegah terbentuknya peroksidasi lipid yang dapat menghambat glikolisis maupun motilitas, (3) kalium, natrium, dan klorida sangat diperlukan untuk menjaga integritas fungsional membran plasma spermatozoa dan berperan pula mempertahankan tekanan osmotik di dalam dan di luar sel spermatozoa, (4) kalsium berperan dalam menginduksi motilitas dan hiperaktivasi spermatozoa, (5) bikarbonat berperan sebagai agen penyangga untuk mencega h penurunan pH semen selama proses penyimpanan, (6) fruktosa dimanfaatkan spermatozoa sebagai sumber energi baik dalam kondisi anaerob (penyimpanan) dan aerob (saluran reproduksi betina).
Spermatozoa
Struktur spermatozoa terdiri atas tiga bagian yaitu kepala, bagian tengah, dan ekor, dimana kepala sebagai pembawa materi genetik (DNA) dan ekor sebagai alat penggeraknya. Berdasarkan evaluasi yang dilakukan pada semen rusa
Rangifer tarandus ukuran panjang kepala spermatozoa adalah 7.636 ± 0.130 mikron, lebar kepala 5.027 ± 0.071 mikron dan panjang ekor 48.86 ± 0.01 mikron (Dot & Utsi 1971 yang dikutip dalam Pramono 1988).
Menurut Athur et al. (1996) pada bagian kepala spermatozoa terdapat akrosom yang mengandung enzim akrosomal (acrosin dan hyaluronidase) yang berfungsi untuk melisiskan ikatan kumulus oophorus dan melisiskan zona pelusida pada sel telur saat terjadinya proses pembuahan. Ekor spermatozoa terdiri atas tiga bagian yaitu bagian tengah, bagian utama, dan bagian ujung. Pada bagian tengah terdapat heliks mitokondria sebagai tempat untuk berlangsungnya proses-proses metabolik, sebagai sumber energi endogen untuk aktivitas pergerakan sperma. Pada bagian utama dan bagian ujung terdiri dari fibril- fibril yang berfungsi untuk mekanisasi pergerakan spermatozoa.
Metabolisme Spermatozoa
9
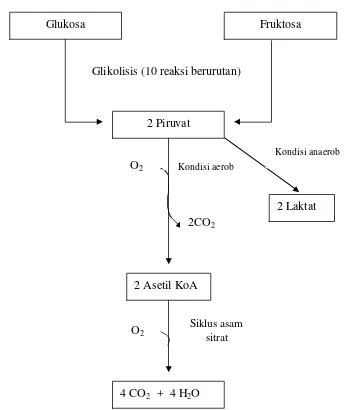
dalamnya. Untuk merubah fruktosa menjadi energi, enzim-enzim tersebut sebelumya harus melalui jalur Embden-Meyerhof dimana tidak memerlukan oksigen untuk terjadinya proses metabolisme. Sedangkan bila terdapat oksigen maka spermatozoa akan melakukan metabolisme melalui jalur Siklus Krebs (Gambar1) (Mann 1967).
Gambar 1 Jalur metabolisme glukosa dan fruktosa di dalam sel spermatozoa
Menurut Garner dan Hafez (2000) energi untuk motilitas spermatozoa berasal dari perombakan adenosin trifosfat (ATP) di dalam selubung mitokondria melalui reaksi-reaksi penguraiannya menjadi adenosin difosfat (ADP) dan
adenosin monofosfat (AMP). ATP akan dikonversi menjadi ADP dengan Fruktosa
Glukosa
2 Piruvat
2 Laktat
2 Asetil KoA
Kondisi aerob O2
2CO2
4 CO2 + 4 H2O
Kondisi anaerob
Siklus asam sitrat
O2
dihasilkan energi sebesar 7.000 kal/mol energi. Reaksinya dapat digambarkan sebagai berikut:
Fosfatase
ATP ADP + HPO3= + Energi (7000 kal/mol)
Fosfatase
ADP AMP + HPO3= + Energi (7000 kal/mol)
Dalam keadaan normal energi yang dilepaskan dapat dipakai sebagai energi mekanik atau energi kimia, jika tidak digunakan maka akan menghilang sebagai panas. Apabila pemberian energi berupa senyawa phosphor (P~P) di dalam ATP dan ADP habis, maka kontraksi fibril- fibril spermatozoa akan terhent i dan sperma tidak bergerak. Agar supaya spermatozoa dapat bergerak kembali maka ATP dan ADP harus dibagun lagi. Reaksi tersebut dapat berlangsung bolak-balik sehingga pergerakan spermatozoa dapat berlangsung. Untuk membangun kembali ATP dari ADP atau ADP dari AMP dengan penambahan gugus phosphoryl, diperlukan sumber energi dari luar. Sebagaian besar aktivitas fisiologis sumber energi tersebut didapat dari karbohidrat dan lemak.
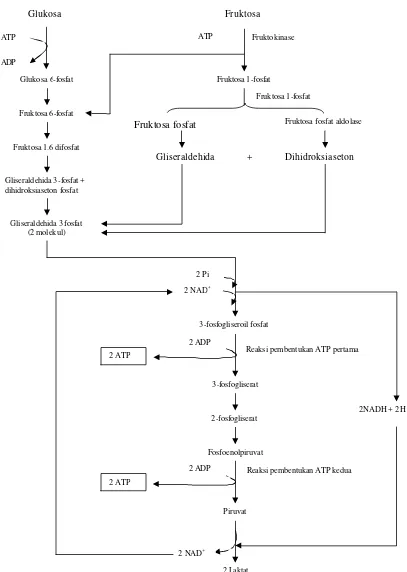
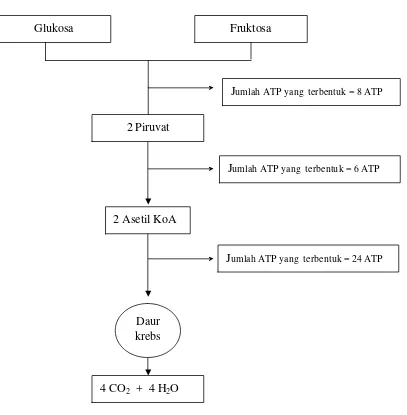
Metabolisme karbohidrat sederhana (glukosa dan fruktosa) pada keadaan anaerob menghasilkan 2 ATP atau setara dengan 14000 kalori (Gambar 2). Reaksi ini memperlihatkan kemampuan spermatozoa untuk menjaga daya tahannya pada waktu penyimpanan. Selain menghasilkan ATP, hasil akhir metabolisme karbohidrat tersebut juga dihasilkan asam laktat. Asam laktat ini dapat menyebabkan penurunan pH semen yang nantinya akan berpengaruh terhadap motilitas dan viabilitas spermatozoa. Pada keadaan aerob (ada oksigen) alur reaksi metabolisme glukosa dan fruktosa menjadi 19 kali lebih tinggi dalam menghasilkan energi yaitu 38 ATP atau sama dengan 266000 kalori dan hasil sampingan berupa karbon dioksida serta air (Gambar 3). Selain karohidrat sebagai sumber energi bagi spermatozoa di dalam plasma semen juga terdapat
glyceryl phosphoryl choline yang dapat dimetabolisir melalui jalur yang sama seperti pada fruktosa ataupun glukosa.
11
Gambar 2 Jalur glikolisis anaerob glukosa dan fruktosa di dalam sel spermatozoa
Glukosa Fruktosa
Fruktokinase ATP
Fruktosa 1-fosfat
Fruktosa fosfat Fruktosa fosfat aldolase
Gliseraldehida + Dihidroksiaseton ATP
Fruktosa 6-fosfat Glukosa 6-fosfat
Gliseraldehida 3-fosfat + dihidroksiaseton fosfat
Gliseraldehida 3 fosfat (2 molekul) ADP
Fruktosa 1.6 difosfat
Fruktosa 1-fosfat
2 Pi
2 NAD+
2NADH + 2 H+
3-fosfogliseroil fosfat
2 ADP
Reaksi pembentukan ATP pertama Dihidroksiaseton
2 ATP
3-fosfogliserat
2-fosfogliserat
Fosfoenolpiruvat
2 ADP 2 ATP
Reaksi pembentukan ATP kedua
Piruvat
Gambar 3 Jalur glikolisis aerob glukosa dan fruktosa di dalam sel spermatozoa
Pengencer, Komponen Pengencer dan Pengenceran Semen
Secara garis besar pengencer memiliki fungsi mekanis, fisik dan biokimia (Supriatna & Pasaribu 1991). Yang perlu diperhatikan dalam pembuatan pengencer semen adalah penggunaan peralatan yang bersih dan steril serta bahan-bahan yang dipergunakan tidak bersifat toksik baik untuk spermatozoa itu sendiri maupun untuk alat kelamin betinanya.
Bahan pengencer yang baik harus ma mpu mempertahankan kualitas semen sampai saat akan digunakan. Bahan pengencer umumnya dapat disimpan paling lama hanya satu minggu. Menurut Hafez (2000) yang dikutip dalam Hafez dan Hafez (2000) media pengencer yang baik harus memiliki fungsi sebagai berikut:
Fruktosa Glukosa
2 Piruvat
2 Asetil KoA
4 CO2 + 4 H2O
Jumlah ATP yang terbentuk = 8 ATP
Jumlah ATP yang terbentuk = 6 ATP
Daur krebs
13
1) Menyediakan nutrisi yang digunakan sebagai energi sperma, 2) Melindungi spermatozoa dari kerusakan akibat pendinginan, 3) Menyediakan media yang bersifat penyangga untuk melindungi sperma dari kerusakan akibat perubahan pH, 4) Mengatur keseimbangan osmotik dan keseimbangan elektrolit yang tepat bagi spermatozoa, 5) Menghambat pertumbuhan kuman, meningkatkan volume semen sehingga betina dapat di IB lebih banyak.
Bahan pengencer semen telah banyak dikembangkan untuk mendukung program IB diantaranya adalah tris, susu skim, maupun pengencer laktosa. Komponen dasar dari pengencer sintetis umumnya merupakan kombinasi dari penyangga, karbohidrat, dan kuning telur.
Pengencer Tris
Tris aminomethane umumnya digunakan sebagai pengencer pada pembekuan semen, karena memiliki toksisitas rendah dan sistem penyangga yang baik. Telah banyak peneliti yang menggunakan tris untuk pengenceran semen kambing baik dalam bentuk semen cair maupun semen beku.
Trisaminomethane bersama asam sitrat berperan sebagai penyangga untuk mempertahankan perubahan pH akibat terbentuknya asam laktat hasil metabolisme spermatozoa juga berperan untuk mempertahankan tekanan osmolaritas dan keseimbangan elektrolit karena mengandung garam dan asam amino. Selain itu Mathew et al. (1984) mengemukakan bahwa tris sebagai penyangga amine telah digunakan secara efektif untuk mempertahankan pH secara fisiologik.
Drajad (1994) melaporkan bahwa bahan pengencer tris sitrat kuning telur yang digunakan untuk pengenceran sperma sapi, kemudian dikemas dalam bentuk pelet maupun straw dan dibekukan menggunakan kriogen CO2 kering, maupun nitrogen cair diperoleh hasil yang cukup memuaskan. Motilitas sperma pasca thawing berkisar 54.40% ± 7.20 sampai dengan 57.00% ± 3.35.
Penggunaan tris dalam pengencer rusa telah banyak dilakukan oleh beberapa peneliti di luar negeri sejak tahun 1987. Mulley et al. (1987) dalam
tris-glukosa-asam sitrat- gliserol 6% diperoleh angka motililitas pasca thawing berkisar antara 10 sampai 70%. Sedangkan menurut Jacobson et al. (1989)
dalam Asher et al. (2000), rusa Ekor putih (O. virginianus) yang dibekukan dalam kemasan straw maupun pelet menggunakan pengencer tris-fruktosa-kuning telur-gliserol diperoleh angka motilitas pasca thawing lebih dari 50%. Menurut Veldhuizen (1994) yang dikutip dalam Asher et al. (2000), semen beku rusa Merah yang diencerkan dengan tris sitrat-kuning- telur-gliserol 5% menghasilkan angka pasca thawing sebesar 56.7 ± 8.4% dan angka kebuntingan berkisar antara 40 – 50% setelah IB dengan metode laparoskopi intrauterin.
Pengencer Natrium Sitrat
Pengencer natrium sitrat telah banyak digunakan untuk penge nceran semen ruminansia kecil. Natrium sitrat merupakan penyangga yang mampu mempertahankan kesetabilan pH pengencer, sehingga menguntungkan untuk memelihara kelangsungan hidup spermatozoa. Pengencer natrium sitrat telah banyak digunakan secara ekstensif oleh peneliti-peneliti terdahulu untuk pengenceran semen rusa. Asher et al. (2000) mengemukakan bahwa ada dua bahan pengencer yang biasa digunakan untuk pembekuan semen rusa, yakni natrium sitrat-kuning telur-gliserol dan tris-glukosa-kuning telur-gliserol. Menurut Haight et al. (1986) yang dikutip dalam Asher et al. (2000) pengencer sitrat-kuning telur yang digunakan untuk preservasi semen rusa dapat mempertahankan motilitas dan integritas sperma terutama sekali setelah ditambahkan 0.2% EDTA.
15
(40 – 45%) (Asher et al. 1988; Argo et al. 1994 , yang dikutip dalamAsher et al.
2000).
Kuning Telur
Kuning telur umumnya ditambahkan ke dalam pengencer semen sebagai sumber energi, agen protektif dan dapat memberikan efek sebagai penyangga terhadap sperma. Bagian yang berperan sebagai agen protektif adalah lipoprotein berkepekatan rendah (low density lipoprotein), yang mengandung lipid sebesar 89% dan sisanya adalah protein yang secara bersama-sama aktif dalam pembekuan semen (Walson & Martin 1975).
Kuning telur dan komponen fraksinya banyak digunakan karena memberikan perlindungan terhadap sperma pada saat semen diencerkan dan selama proses pendinginan dan pembekuan sampai mencapai temperatur 0oC. Kuning telur dapat mempertahankan motilitas dan integritas akrosom serta membran mitokondria spermatozoa. Penambahan kuning telur sebesar 20% ke dalam pengencer tris-sitrat memberikan presentase motilitas 68.35% ± 0.97 dan kerusakan akrosom 11.70% ± 2.26, sedangkan penambahan kuning telur sebesar 10% menghasilkan motilitas 67.35% ± 1.03 dan persentase kerusakan akrosom 10.80% ± 3.07 (Deka & Rao 1986). Trejo et al. (1996) merekomendasikan penggunaan kuning telur sebesar 15% hingga 20% dalam pengencer semen kambing untuk proses pembekuan semen.
Karbohidrat
semen cair domba. Gracia dan Graham (1989) yang diacu dalam Yildiz et al.
(2000) menunjukkan bahwa trisakarida tidak efektif dibandingkan dengan monosakarida dan disakarida dalam mempertahankan motilitas semen cair maupun motilitas pasca thawing spermatozoa sapi. Meskipun disakarida khususnya trehalosa, sukrosa dan maltosa dapat menurunkan kematian sperma dan atau menurunkan kerusakan rata-rata akrosom akan tetapi monosakarida (galaktosa dan glukosa) lebih tinggi dalam mempertahankan motilitas sperma, viabilitas dan intak akrosom rata-rata dalam waktu yang lebih lama.
Glukosa dan Fruktosa adalah monosakarida atau gula sederhana dengan rumus molekul (C6H12O6) yang tidak dapat dihidrolisis menjadi bentuk yang lebih sederhana lagi. Glukosa merupakan molekul karbohidrat utama dalam kelompok aldosa yang memiliki berat molekul 180 g/mol dan berfungsi sebagai bahan bakar utama penghasil energi pada semua sistem biologi atau semua tipe sel organisme. Sedangkan fruktosa termasuk kelompok ketosa yang memiliki berat molekul 180.16 g/mol dan secara fisiologis ditemukan dalam plasma semen yang berguna dalam proses metabolisme spermatozoa untuk menghasilkan energi dan daya hidup bagi spermatozoa.
Ponglowhapan et al. (2004) melaporkan bahwa penggunaan glukosa 70 mM yang ditambahkan ke dalam pengencer tris-kuning telur pada proses preservasi semen kucing mampu mempertahankan motilitas 59.10%, sedangkan jika menggunaan fruktosa 70 mM mampu mempertahankan motilitas 60.90% setelah disimpan selama 10 hari pada suhu 5oC. Penggunaan fruktosa 1g ke dalam pengencer sitrat kuning telur pada proses preservasi semen sapi Fries Holand terbukti mampu mempertahankan motilitas 53.30% setelah disimpan 24 jam dalam lemari es.
Krioprotektan
17
dengan sifat biologis membran sel yang semipermiabel maka dapat dibagi menjadi dua bagian yaitu krioprotektan ekstraseluler dan krioprotektan intraseluler. Yang termasuk krioprotektan intraseluler adalah gliserol, dimethyl sufoxide, 1,2 prepanediol dan etilen glikol. Sedangkan yang termasuk krioprotektan ekstraseluler adalah PVP, sukrosa, rafinosa, laktosa, protein, kuning telur dan susu.
Krioprotektan yang umum ditambahkan pada proses pembekuan semen mamalia adalah gliserol. Gliserol mempunyai efek pengikatan membran plasma yang secara langsung mengikat fosfolipid pada kelompok kepala yang menurunkan fluiditas membran berinteraksi dengan protein dan glikoprotein membran yang menyebabkan penumpukan partikel intra membran. Penambahan gliserol menurunkan kapasitas elektrikal membran yang mengindikasikan skala restrukturisasi yang besar dari struktur membran. Gliserol mempunyai aktivitas osmotik, merembes secara perlahan melalui membran, sehingga volume sel dapat hilang selama proses beku-cair sebagai konsekuensi penambahan gliserol dan air.
Gliserol sebagai kreoprotektan internal yang berperan dalam mekanisme kreopreservasi dengan tiga gugus hidroksil yang dimilikinya mempunyai kemampuan mengikat air yang kuat, sehingga mencegah akumulasi H2O dan mencegah kristalisasi pada daerah titik beku larutan sehingga melindungi spermatozoa terhadap pembentukan kristal es. Gliserol merupakan substansi yang langsung berdifusi ke dalam sel sperma dan membentuk fruktosa, sehingga secara anaerob memiliki persediaan fruktosa yang aktif, sedikit asam laktat yang dihasilkan namun memiliki aktifitas optimal (Salisbury & Vandenmark 1985).
ditambahkan pada semen setelah didinginkan pada temperatur 5oC, tetapi penambahan gliserol sebagai krioprotektan akan lebih baik jika ditambahkan bervaria si. Pada pengencer yang mengandung kuning telur ditambahkan kurang dari 5% sedangkan bahan pengencer yang mengandung air susu biasanya ditambahkan 10%. Pada pengencer natrium sitrat (2.9%) dan kuning telur (20%) ditambahkan 14% gliserol (Asher et al. 1993 yang diacu dalam Semiadi et al.
1998a).
Fiser and Fairful (1989) mengemukakan bahwa penambahan gliserol ke dalam pengencer sebelum pembekuan (pada suhu 5oC) lebih efektif dan lebih baik dari pada penambahan secara berangsur-angsur dalam bagian terpisah. Menurut Tuli et al. (1992) gliserolisasi semen kambing dapat dilakukan satu tahap pada suhu 37oC (dalam penangas air) dengan empat kali pemberian yang diselesaikan dalam 20 menit dengan tingkat pengenceran akhir sebesar 1:12 dari semen dengan konsentrasi spermatozoa rata-rata 3.04 ± 0.144 x 109/ml dengan rata-rata spermatozoa hidup sekitar 69.0 ± 2.3% dan motilitas rata-rata 64.0 ± 1.5%.
Prinsip-Prinsip Pembekuan Semen
Prinsip yang terpenting dari pembekuan semen adalah pengeluaran air dari dalam sel spermatozoa (dehidrasi) sebelum membeku secara intraseluler. Bila tidak terjadi dehidrasi akan terbentuk kristal-kristal es yang besar di dalam sel yang dapat merusak sel dengan hebat, dan bila terjadi dehidrasi yang berlebihan maka sel akan mengalami kekeringan sehingga akan merusak pula sel dan bersifat letal. Oleh karena itu yang harus diperhatikan dalam pembekuan semen adalah perpindahan air keluar masuk membran, baik dehidrasi sebelum deep freezing
maupun rehidrasi pasca thawing (Supriatna & Pasaribu 1992). Dengan demikian adanya proses pembekuan pada semen diharapkan daya hidup sel dapat dipertahankan yang ditandai dengan tetap berfungsinya sel tersebut baik imunologis, biologis dan fisiologis.
Faktor-Faktor Penyebab Kerusakan Sel Spermatozoa Selama Kriopreservasi
19
tekanan osmotik dari hipotonis ke hipertonis. Kerusakan umum yang terjadi pada sel spermatozoa selama proses pembekuan akibat adanya fenomena tersebut adalah (1) kerusakan mekanik, yang ditandai dengan kerusakan organel sitoplasma atau pecah karena ekspansi es, (2) konsentrasi larutan menjadi toksik dan letal akibat adanya dehidrasi dari suspensi media baik intra maupun ekstraseluler , dan (3) perubahan fisik-kimiawi diantaranya presipitasi, denaturasi, koagulasi dari protein, disosiasi ion dan kehilangan sifat absorpsi atau sifat-sifat pengikatan air (Supriatna & Pasaribu 1992).
Pembentukan Kristal-Kristal Es
Pembentukan kristal-kristal es selama proses pembekuan semen menyebabkan terjadinya penumpukan elektrolit di dalam sel spermatozoa. Akibatnya terjadi kerusakan sel secara mekanik, dimana elektrolit yang menumpuk ini akan merusak dinding sel sehingga pada waktu thawing permiabilitas membran plasma akan berubah dan sel akan mati. Pembentukan kristal-kristal es kemungkinan berkaitan dengan perubahan tekanan osmotik dalam fraksi tidak beku (Watson 2000).
Berdasarkan adanya pembentukan kristal es di dalam sel, maka kecepatan pembekuan dibedakan atas pembekuan lambat dan pembekuan cepat. Pada pembekuan lambat, kristal-kristal es hanya terbentuk di luar sel dan akan mengakibatkan peningkatan tekanan osmotik sehingga air akan keluar dari sel dan menambah pertumbuhan kristal-kristal es di dalam sel yang telah terbentuk. Pada pembekuan cepat, kristal-kristal es terbentuk tidak hanya di luar sel tetapi juga di dalam sel. Pembentukan kristal di dalam sel mengakibatkan peningkatan konsentrasi cairan sel di antara kristal es, akibatnya kristal es yang terbentuk makin banyak dan berukuran kecil. Kerusakan sel spermatozoa pada pembekuan cepat diakibatkan adanya tekanan mekanik dari kristal-kristal es yang terbentuk di dalam sel dan denaturasi.
Tingkat pendinginan (cooling rate) mempengaruhi kerusakan pada membran sel spermatozoa selama proses kriopreservasi semen. Prinsip utama
yang terbentuk (Supriatna & Pasaribu 1992). Jika cooling rate lambat, air akan banyak keluar dari sel untuk mencapai keseimbangan potensial kimiawi air intra dan ekstraseluler serta terjadi dehidrasi untuk menghindari pembekuan intraseluler. Apabila medium pengencer didinginkan di bawah titik beku, maka kristal-kristal es bernukleasi dan air akan berkristalisasi keluar sebagai es (Watson 2000). Jika cooling rate cepat, keseimbangan potensial air akan terganggu dan sel intraseluler membeku , dan cooling rate yang sangat cepat akan menyebabkan pembentukan kristal es intraseluler dimana mempunyai energi permukaan yang besar dan tidak stabil serta cenderung membentuk kristal-kristal es yang besar. Akibatnya akan bersifat letal terhadap sel (Gambar 4).
Gambar 4 Skema kejadian di dalam sel secara fisik selama proses pembekuan
Efek yang ditimbulkan pada spermatozoa akibat pembentukan kristal-kristal es adalah penurunan motilitas, viabilitas spermatozoa, peningkatan pengeluaran enzim-enzim intraseluler ke dalam ekstraseluler, dan kerusakan pada organel-organel sel, seperti lisosom, dan mitokondria. Jika lisosom pecah akan mengeluarkam asam hidrolase sehingga akan mencerna bagian sel yang lain, sedangkan mitokondria rusak menyebabkan rantai oksida terputus. Organel mitokondria mempunyai peranan sebagai sumber energi yang akan menggertak
Pendinginan lambat
Pendinginan cepat
Pendinginan sangat cepat
- 2oC - 5oC to -10oC
21
mikrotubuli sehingga terjadi pergesekan diantara mikrotubuli dan akibatnya spermatozoa dapat bergerak secara motil progresif.
Cekaman Osmotik
Tekanan osmotik harus dipertahankan selama proses pembekuan semen karena bila tidak dipertahankan akan mengakibatkan tekanan osmotik di dalam dan di luar sel berbeda sehingga air akan mengalir ke daerah yang bertekanan osmotik tinggi. Bila hal ini terjadi akan timbul gejala cekaman osmotik pada spermatozoa. Gejala cekaman osmotik memainkan peranan yang sangat penting terhadap kerusakan membran sel spermatozoa selama proses pembekuan semen. Tanda-tanda adanya cekaman osmotik adalah peningkatan kejadian spermatozoa dengan ekor melingkar, menurunkan viabilitas dan integritas membran plasma spermatozoa.
Cekaman Dingin
Cold shock atau cekaman dingin dapat terjadi karena adanya penurunan temperatur secara mendadak dari temperatur tubuh ke temperatur rendah (di bawah 0oC) sehingga akan menurunkan viabilitas sel dan perubahan dalam susunan struktur membran. Fenomena cekaman dingin pada sel belum diketahui secara pasti, tetapi kemungkinan berkaitan dengan fase transisi dari membran lipid yang menyebabkan terjadinya fase pemisahan dan penurunan sifat-sifat permiabilitas secara selektif dari membran biologik sel hidup (Watson 1995). Tingkat sensitivitas sel terhadap kejutan dingin dipengaruhi oleh tingkat pendinginan (Watson 2000).
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Oktober 2003 sampai dengan bulan Juli 2004 di penangkaran rusa Pondok Gede, Bekasi dan Laboratorium Unit Rehabilitasi Reproduksi, Departemen Klinik, Reproduksi, dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Materi Penelitian
Hewan Percobaan
Hewan percobaan yang digunakan adalah empat ekor rusa jantan dewasa dengan kisaran umur tiga sampai empat tahun, mempunyai tubuh yang sehat, serta dalam kondisi berangga keras. Rusa ditempatkan pada kandang berukuran (5 x 8)m dan diberi pakan berupa rumput lapangan (10% bobot tubuh/ekor) dan konsentrat dengan kadar protein kasar 16% sebanyak 750 g/ekor/hari serta diberi air minum secara ad libitum.
Alat dan Bahan
Peralatan yang dipakai adalah elektroejakulator, mikroskop, inkubator, perlengkapan pengenceran, pemeriksaan, dan penyimpanan semen.
23
Tabel 2 Komposisi pengencer yang akan digunakan
Jenis Pengencer Keterangan: Tris (Evans & Maxwell 1987); Natrium sitrat (Paulenz et al. 2002) yang
dimodifikasi.
NsG : Natrium sitrat glukosa TG : Tris glukosa NsF : Natrium sitrat fruktosa TF : Tris fruktosa
Metode Penelitian
Penelitian ini terdiri atas dua kegiatan, yaitu (I) menguji pengaruh bahan pengencer tris-sitrat, dan natrium sitrat dengan jenis karbohidrat yang berbeda (glukosa dan fruktosa) dan (II) menguji pengaruh level gliserol pada dosis yang berbeda terhadap kualitas sperma dalam proses kriopreservasi.
Penampungan dan Evaluasi Semen
Penampungan dan evaluasi semen dilakukan tiga minggu sekali dengan menggunakan elektroejakulator. Penampungan semen dilakukan pada pagi hari dengan terlebih dahulu dilakukan anastesi menggunakan kombinasi 1 mg Xylazine/kg bb dan 2 mg Ketamin/kg bb secara i.m. sesuai yang dilakukan Drajad (2000).
cairan NaCl 3%). (3) motilitas spermatozoa menggunakan obyek gelas yang ditutup dengan gelas penutup dan diamati menggunakan mikroskop cahaya dengan pembesaran 10 x 40. Persentase motilitas dinilai secara subyektif dengan membandingkan spermatozoa hidup bergerak ke depan (progresif) dengan yang tidak progresif. Penilaian yang diberikan dari angka 0% (mati semua) dan 100% (motil semua). (4) persentase hidup spermatozoa dilakukan dengan menggunakan pewarna eosin 2%, kemudian dilakukan ulasan secara cepat dan difiksasi pada api bunsen. Pemeriksaan dilakukan di bawah mikroskop cahaya dengan pembesaran 10 x 40, terhadap sepuluh lapang pandang atau dua ratus spermatozoa. (5) penilaian terhadap keutuhan membran plasma (MPU) dilakukan memakai uji
hypoosmotic swelling test (HOS test) dan menggunakan mikroskop cahaya pembesaran 10 x 40, terhadap sepuluh lapang pandang atau dua ratus spermatozoa.
Semen yang telah memenuhi syarat kemudian dilakukan proses selanjutnya. Syarat-syarat itu adalah volume 1-2 ml, motilitas lebih dari 60%, konsentrasi lebih dari 500 x 106 sel/ml, gerakan massa ++/+++, persentase hidup minimal 65%, dan persentase abnormal tidak lebih dari 15%.
Pengenceran Semen
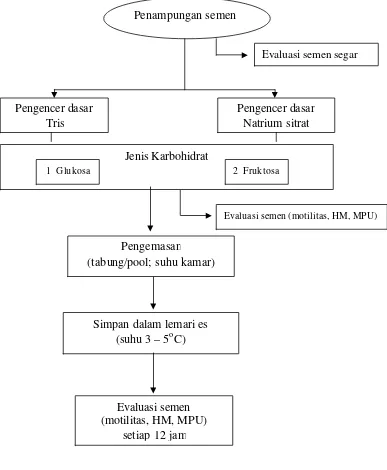
Kegiatan I
Semen yang telah memenuhi syarat langsung dibagi menjadi dua bagian, dicampur dengan bahan pengencer tris dan natrium sitrat sesuai dengan komposisi baku (Tabel 3), selanjutnya dikemas di dala m tabung reaksi dan disimpan pada lemari es suhu 3-5oC (Gambar 5). Pengamatan terhadap motilitas, hidup/mati, dan MPU dilakukan dua kali (setiap 12 jam) dalam sehari selama beberapa hari secara berturut-turut hingga motilitas tinggal 40% sejak dicampur dengan bahan pengencer. Dosis IB yang digunakan sesuai dengan dosis IB pada domba yaitu 50 juta sel sperma/0,2 ml. Cara menentukan jumlah pengencer dilakukan dengan persamaan sebagai berikut:
(
50)
0.2 ( )% )
( x volumeejakulat VE
25
Evaluasi semen cair dilakukan terhadap semen sebelum pengenceran, sesudah pengenceran, dan sesudah disimpan dalam lemari es.
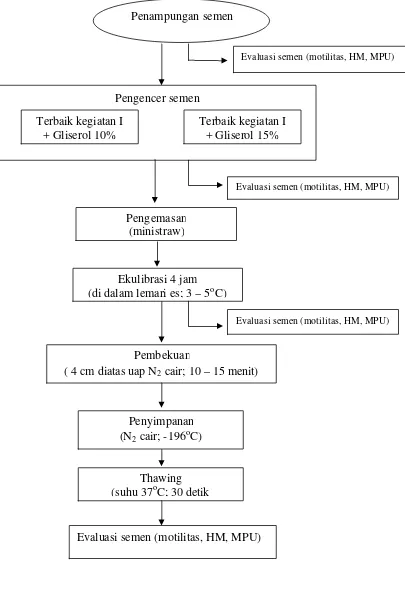
Gambar 5 Alur kegiatan penelitian tahap I.
Kegiatan II
Semen yang telah memenuhi syarat langsung dicampur dengan bahan pengencer dasar tris dan natrium sitrat terbaik pada kombinasi jenis karbohidrat kegiatan I. Kemudian semen yang telah diencerkan dikemas dalam straw mini
Evaluasi semen (motilitas, HM, MPU) Penampungan semen
Pengencer dasar Tris
Evaluasi semen segar
Pengemasan
(tabung/pool; suhu kamar)
Simpan dalam lemari es (suhu 3 – 5oC)
Evaluasi semen (motilitas, HM, MPU)
setiap 12 jam
Pengencer dasar Natrium sitrat
Jenis Karbohidrat
dan diekulibrasi pada suhu 3oC sampai dengan 5oC dalam lemari es selama empat jam, selanjutnya dilakukan proses pembekuan (Gambar 6).
Gambar 6 Alur kegiatan penelitian tahap II. Penampungan semen
Pengencer semen Terbaik kegiatan I
+ Gliserol 10%
Evaluasi semen (motilitas, HM, MPU)
Pengemasan (ministraw)
Ekulibrasi 4 jam (di dalam lemari es; 3 – 5oC)
Pembekuan
( 4 cm diatas uap N2 cair; 10 – 15 menit)
Penyimpanan (N2 cair; -196oC)
Thawing (suhu 37oC; 30 detik
Terbaik kegiatan I + Gliserol 15%
Evaluasi semen (motilitas, HM, MPU)
Evaluasi semen (motilitas, HM, MPU)
27
Proses pembekuan diawali dengan menempatkan straw mini pada rak 2 – 3 cm di atas permukaan N2 cair selama 10 – 15 menit, kemudian straw mini disimpan di dalam kontainer yang berisi Nitrogen (N2) cair (suhu –196oC). Evaluasi terhadap semen yang dibekukan dilakukan pada tahap sebelum diencerkan, sesudah pengenceran, sesudah ekulibrasi dan sesudah pencairan kembali. Thawing atau pencairan kembali semen beku dilakukan 24 jam setelah penyimpanan dalam kontainer yang berisi N2 cair dengan cara dimasukan ke dalam air suhu 37oC selama kurang lebih 30 detik.
Parameter yang Diamati
Parameter yang diamati dalam penelitian ini antara lain:
1 Kuantitas dan kualitas semen segar meliputi volume, densitas, pH, gerakan massa, konsentrasi, persentase motilitas, persentase hidup, persentase MPU dan morfologi sperma.
2 Kuantitas dan kualitas semen cair dan beku pada tahap setelah pengenceran, setelah ekulibrasi, dan setelah pencairan kembali mencakup persentase motilitas, persentase hidup, dan persentase membran plasma utuh.
Rancangan Penelitian
Rancangan penelitian yang digunakan adalah rancangan acak lengkap (RAL) pola faktorial 2 x 2 dengan dua faktor, yaitu faktor pertama adalah jenis pengencer semen (tris/T, dan natrium sitrat/Ns) dan faktor kedua jenis karbohidrat (glukosa/G dan fruktosa/F). Dengan demikian terdapat empat kombinasi perlakuan, yakni TG, TF, NsG, dan NsF. Pengerjaan semen sebanyak empat kali digunakan sebagai ulangan. Data dianalisis dengan menggunakan
Karakteristik Semen Segar
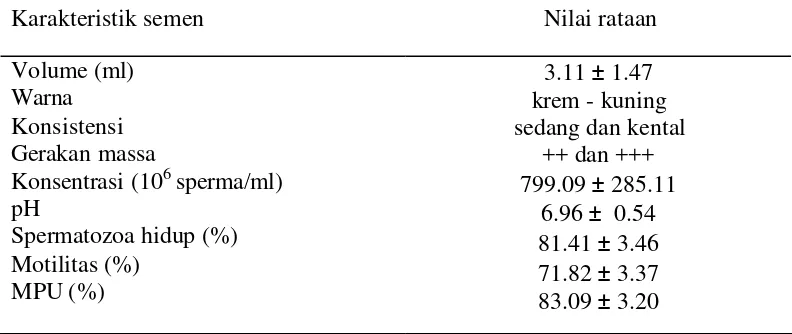
Dari hasil penampungan semen yang berlangsung pada bulan Oktober 2003 sampai dengan Juli 2004 dan rusa dalam kondisi rangga keras memperlihatkan bahwa rataan nilai sifat-sifat semen segar rusa Timor yang diperoleh selama penelitian cukup baik (Tabel 3)
Tabel 3 Rataan nilai karakteristik semen segar rusa Timor
Karakteristik semen Nilai rataan
Volume (ml) Warna Konsistensi Gerakan massa
Konsentrasi (106 sperma/ml) pH
Spermatozoa hidup (%) Motilitas (%)
MPU (%)
3.11 ± 1.47 krem - kuning sedang dan kental
++ dan +++ 799.09 ± 285.11
6.96 ± 0.54 81.41 ± 3.46 71.82 ± 3.37 83.09 ± 3.20
Rataan volume semen yang diperoleh selama penelitian adalah 3.11± 1.47 ml (kisaran antara 1.4 sampai 5.3 ml). Hasil penelitian ini sedikit lebih
tinggi dari yang dilaporkan Drajad (2000) yakni 0.68 ml, Masyud dan Taurin (2000) yakni berkisar 1.2 – 1.7 ml dan Semiadi et al. (1998a) yakni berkisar antara 0.4 sampai 1.9 ml. Menurut Semiadi et al. (1998a) rendahnya volume semen yang terkumpul disebabkan oleh variasi umur, tingkat rangsangan elektroejakulator, ukuran probe dan lama pejantan berada dalam kondisi rangga keras.
29
antara sedang dan kental (rata-rata sedang). Hal ini sama dengan yang dilaporkan Masyud dan Taurin (2000).
Konsistensi semen segar yang diperoleh selama penelitian termasuk baik dengan kisaran sedang dan kental, dengan gerakan massa berkisar antara ++ dan +++, persentase hidup rata-rata 81.41 ± 3.46, persentase motilitas rata-rata 71.82 ± 3.37 serta persentase MPU rata-rata 83.09 ± 3.20. Nilai motilitas ini lebih tinggi dibandingkan dengan hasil penelitian Semiadi et al. (1998a). yaitu 38% pada rusa Sambar. Perbedaan hasil ini kemungkinan disebabkan oleh perbedaan bangsa ternak, individu ternak dan umur ternak yang digunakan. Menurut Everett dan Bean (1992); Shukla et al. (1992) persentase motilitas sangat nyata dipengaruhi oleh jumlah ejakulat, umur pejantan, perubahan temperatur, dan jenis pejantan.
Nilai fisiologis derajat keasaman (pH) semen segar yang diperoleh selama penelitian berkisar antara 6.5 sampai 7.7 (rata-rata 6.96 ± 0.54), dimana hasil ini relatif lebih rendah dibandingkan dengan yang dilaporkan Masyud dan Taurin (2000), yakni berkisar 7.67 sampai 7.79. Pada rusa, pH semen ini tidak berbeda jauh dengan hewan- hewan lain seperti kambing (7.71 – 7.07) dan domba (7.12). Hal tersebut menjadi dasar untuk larutan pengencer karena pH larutan dapat mempengaruhi viabilitas spermatozoa. Perbedaan nilai fisiologis pH kemungkinan disebabkan oleh perbedaan ras, lingkungan dan perbedaan complex buffer system (Evans & Maxwel 1987). Derajat keasaman ini akan memp engaruhi daya tahan spermatozoa. Semakin rendah atau semakin tinggi dari pH normal, akan membuat spermatozoa lebih cepat mati. Penurunan pH dapat terjadi karena semen dibiarkan pada suhu kamar tanpa diencerkan. Ini akibat dari penimbunan asam laktat ya ng merupakan hasil akhir proses metabolisme, yakni pemecahan fruktosa (fruktolisis). Asam laktat ini dalam jangka waktu lama dapat menurunkan pH semen. Penurunan pH ekstraseluler secara efektif dapat menurunkan pH intraseluler.
termasuk golongan konsentrasi sedang yaitu rata-rata 799.09 ± 285.11 juta spermatozoa/ml. Hasil penelitian ini relatif sama dengan hasil penelitian Masyud dan Taurin (2000) yakni berkisar antara 840 sampai 1140 juta sel/ml. Bila dibandingkan dengan rusa Sambar, konsentrasi rusa Timor ini lebih tinggi, yakni pada rusa Sambar konsentrasi rataannya adalah 547.75 sel spermatozoa/ml (Semiadi et al. 1998a). Variasi nilai konsentrasi spermatozoa ini kemungkinan disebabkan oleh perbedaan individu ternak yang digunakan dan kondisi ternak. Menurut Everett dan Beans (1982) konsentrasi spermatozoa sangat nyata dipengaruhi oleh jumlah ejakulat, interval penampungan, kondisi pejantan, dan lingkungan. Perbedaan konsentrasi spermatozoa dapat juga dipengaruhi oleh kondisi individu, genetik, dan pakan. Apabila individu cukup sehat dan dalam kondisi yang optimal serta diberi pakan dengan kualitas baik, maka konsentrasi spermatozoa akan memiliki nilai yang lebih baik. Dibandingkan dengan hewan lain, konsentrasi spermatozoa rusa ini lebih mendekati sapi yaitu 700 – 1000 x 106 spermatozoa/ml semen (Hafez 2000).
Pengaruh Jenis Pengencer terhadap Kualitas Semen Cair
Hasil pengenceran semen menggunakan pengencer tris maupun natrium sitrat dengan sumber karbohidrat glukosa dan fruktosa didapatkan adanya perbedaan, tetapi secara statistik menunjukkan tidak terjadi interaksi antara jenis pengencer dengan sumber karbohidrat yang berpengaruh terhadap kualitas semen cair rusa Timor selama disimpan dalam lemari es (P>0.05), namun jenis pengencer maupun karbohidrat masing- masing memberikan pengaruh nyata (P<0.05) terhadap beberapa parameter kualitas semen cair pada beberapa tahap evaluasi. Hal ini menunjukkan bahwa pengaruh jenis karbohidrat terhadap kualitas semen rusa Timor tidak tergantung atau dipengaruhi oleh jenis pengencer yang digunakan, baik pengencer tris maupun natrium sitrat.
Pengaruh Jenis Pengencer terhadap Persentase Motilitas
31
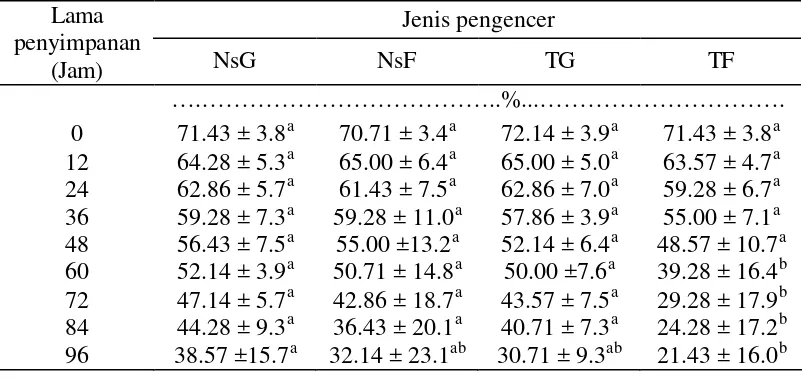
terjadi penurunan persentase motilitas sebesar 2.14% pada pengencer tris glukosa, nilai penurunan ini nyata lebih rendah jika dibandingkan dengan pengencer natrium sitrat glukosa (4.29%), natrium sitrat fruktosa (2.29 %), dan tris-fruktosa (9.29%). Dari hasil penelitian motilitas spermatozoa menunjukkan bahwa spermatozoa dalam pengencer natrium sitrat glukosa, natrium sitrat fruktosa, dan tris glukosa secara teknis layak dipakai untuk IB pada rusa Timor dengan menggunakan semen cair sampai penyimpanan 60 jam, karena memiliki persentase motilitas progresif di atas 50%, sedangkan spermatozoa dalam pengencer tris fruktosa layak digunakan sampai dengan penyimpanan 36 jam.
Tabel 4 Rataan persentase motilitas spermatozoa yang disimpan dalam lemari es (3 – 5oC) pada berbagai jenis pengencer Keterangan: Angka yang diikuti oleh huruf superskrip yang berbeda pada baris yang sama
menunjukkan perbedaan yang nyata (P<0.05)
NsG : Natrium sitrat glukosa TG : Tris glukosa
NsF : Natrium sitrat fruktosa TF : Tris fruktosa
dibandingkan dengan fruktosa. Hal ini sependapat dengan yang dikemukakan oleh Hawab (2001) yang menyatakan bahwa walaupun sel hidup dapat memetabolisme semua karbohidrat heksosa melalui glikolisis, namun glukosa merupakan molekul karbohidrat utama yang berfungsi sebagai penghasil energi utama untuk semua tipe sel.
Semen rusa yang telah diencerkan menggunakan pengencer tris maupun natrium sitrat dengan sumber karbohidrat glukosa dan fruktosa setelah disimpan dalam lemari es (suhu 3 – 5oC) akan mengalami penurunan (Gambar 7).
Keterangan:
NsG : Natrium sitrat glukosa TG : Tris glukosa NsF : Natrium sitrat fruktosa TF : Tris fruktosa
Gambar 7 Grafik penurunan persentase motilitas spermatozoa yang disimpan dalam lemari es (3 – 5oC) pada berbagai kombinasi jenis pengencer dan karbohidrat.
Penurunan motilitas spermatozoa mulai tampak setelah penyimpanan 12 jam dan terus turun secara gradual. Pada penyimpanan 84 jam pengencer natrium sitrat glukosa ternyata mampu mempertahankan motilitas (40%) lebih tinggi 44.28% dengan penurunan 27.15%, disusul dengan tris glukosa 40.71% dengan penurunan 31.43%, natrium sitrat fruktosa 36.43% dengen penurunan 34.28%, dan tris glukosa 24.28% dengan penurunan sebesar 47.15%. Terjadinya penurunan motilitas ini diduga akibat pengaruh metabolisme spermatozoa (Hafez 1987). Metabolisme spermatozoa akan menghasilkan asam laktat yang bila ada dalam jumlah yang banyak akan dapat merubah suasana semen menjadi asam
33
yang berakibat mempercepat proses kematian spermatozoa. Menurut Setiadi dan Julizar (2001), fenomena penurunan motilitas spermatozoa setela h penyimpanan yang lama lebih diakibatkan oleh menurunnya zat makanan spermatozoa dan pengaruh zat toksik hasil sampingan dari proses metabolisme spermatozoa. Rizal
et al. (2002) menambahkan bahwa motilitas spermatozoa sangat bergantung pada suplai energi berupa adenosin triphosphate (ATP) hasil dari proses metabolisme sel.
Pengaruh Jenis Pengencer terhadap Persentase Hidup Spermatozoa
Semen rusa yang telah diencerkan menggunakan pengencer tris maupun natrium sitrat dengan sumber karbohidrat glukosa dan fruktosa setelah disimpan dalam lemari es (suhu 3- 5oC) akan mengalami penurunan kualitas. Hasil analisis statistik menunjukkan bahwa pengencer tris dan natrium sitrat memiliki pengaruh yang nyata (P<0.05) dalam mempertahankan persentase hidup spermatozoa selama penyimpanan dalam lemari es (suhu 3 – 5oC). Rataan persentase hidup spermatozoa rusa Timor yang disimpan selama 96 jam dalam lemari es sekali lagi menunjukkan bahwa glukosa merupakan sumber karbohidrat terbaik untuk preservasi semen rusa diband ingkan dengan fruktosa (Tabel 5).
Tabel 5 Rataan persentase hidup spermatozoa yang disimpan dalam lemari es (3 – 5oC) pada berbagai jenis pengencer
Keterangan: Angka yang diikuti oleh huruf superskrip yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata (P<0.05)
NsG : Natriu m sitrat glukosa TG : Tris glukosa
Selama penyimpanan persentase spermatozoa hidup rusa Timor cenderung menurun secara gradual. Laju penurunan persentase hidup spermatozoa selama penyimpanan dalam lemari es sangat mencolok pada pengencer tris fruktosa (Gambar 8). Dari keempat jenis pengencer yang digunakan ternyata pengencer tris- glukosa dapat mempertahankan persentase spermatozoa hidup rata-rata lebih tinggi dibandingkan dengan pengencer natrium glukosa, natrium sitrat-fruktosa dan tris- sitrat-fruktosa. Secara umum rataan penurunan persentase hidup spermatozoa pada jenis pengencer yang ditambahkan glukosa cenderung lebih rendah dibandingkan dengan fruktosa, terutama yang dikombinasikan dengan tris. Hal ini diduga karena tris memiliki kapasitas sebagai penyangga yang paling optimal dalam mempertahankan kesetabilan pH semen rusa Timor, sehingga menguntungkan untuk memelihara kelangsungan hidup spermatozoa. Lapwood et al. (1966) menyatakan bahwa kemampuan karbohidrat dalam melindungi sel spermatozoa tergantung pada berat molekul karbohidrat dan tipe penyangga yang ditambahkan dalam pengencer.
Keterangan:
NsG : Natrium sitrat glukosa TG : Tris glukosa NsF : Natrium sitrat fruktosa TF : Tris fruktosa
Gambar 8 Grafik penurunan persentase hidup spermatozoa yang disimpan di dalam lemari es (3 – 5oC) pada berbagai kombinasi jenis pengencer dan karbohidrat.
Meskipun secara statistik tidak menunjukkan interaksi yang nyata antara jenis pengencer dan sumber karbohidrat, namun secara umum menunjukkan
35
bahwa glukosa cenderung lebih tinggi dalam mempertahankan persentase hidup spermatozoa dibandingkan dengan fruktosa. Hal ini kemungkinan disebabkan glukosa yang ditambahkan dalam pengencer tris dan natrium sitrat mampu memelihara kestabilan pH, melindungi spermatozoa terhadap terjadinya cekaman dingin, dan mempertahankan tekanan osmotik. Menurut Lapwood et al. (1966), karbohidrat yang ditambahkan dalam pengencer dapat memelihara tekanan osmotik, memfasilitasi metabolisme fruktosa, mengurangi kerusakan akibat pengencer dan melindungi spermatozoa terhadap terjadinya cekaman dingin. Woelder et al. (1997) menambahkan bahwa sumber karbohidrat yang ditambahkan dalam pengencer dapat mengurangi kerusakan sel spermatozoa selama dilakukan penurunan suhu secara cepat.
Hasil pengamatan semen cair menunjukkan bahwa tingkat penurunan persentase hidup spermatozoa selama penyimpanan lebih rendah jika dibandingkan dengan tingkat penurunan persentase motilitas spermatozoa pada keempat jenis pengencer. Tingkat penurunan persentase hidup dan persentase motilitas spermatozoa pada awal hingga 96 jam penyimpanan masing- masing adalah 16.74% dan 41.43% pada pengencer tris glukosa, 24.51% dan 32.86% pada pengencer natrium sitrat glukosa, 28.51% dan 39.57% pada pengencer natrium sitrat fruktosa, serta 37.84% dan 50.00% pada pengencer tris fruktosa. Hal ini menunjukkan bahwa penurunan persentase motilitas spermatozoa yang dratis tidak diikuti dengan penurunan persentase hidup yang dratis pula, karena persentase spermatozoa yang tergolong hidup dihitung tidak saja yang motil progresif tetapi juga yang bergerak di tempat atau melingkar.
Pengaruh Jenis Pengencer terhadap Persentase MPU
Membran plasma utuh mutlak harus dimiliki oleh spermatozoa supaya terjamin kelangsungan hidupnya dan tercapai keberhasilan saat proses fertilisasi. Selain berfungsi untuk melindungi organel-organel yang berada di dalam sel, membran plasma berfungsi juga untuk mengatur keluar masuknya zat- zat makanan serta keseimbangan elektrolit intra maupun ekstraseluler.
(Tabel 6). Perbedaan yang nyata (P<0.01) mulai terjadi pada saat penyimpanan lebih dari 84 jam, dimana terjadi penurunan persentase MPU sebesar 0,39% pada pengencer tris glukosa, nilai ini nyata lebih tinggi jika dibandingkan dengan pengencer natrium sitrat glukosa (2.76%), natrium sitrat fruktosa (3.30%), dan tris fruktosa (12.16%). Kenyataan ini memberikan indikasi bahwa pengencer tris glukosa lebih mampu berinteraksi dengan membran plasma spermatozoa dengan jalan melenturkannya sehingga dapat melindungi membran plasma spermatozoa dari kerusakan.
Tabel 6 Rataan persentase MPU spermatozoa yang disimpan dalam lemari es (3 – 5oC) pada berbagai jenis pengencer Keterangan: Angka yang diikuti oleh huruf superskrip yang berbeda pada baris yang sama
menunjukkan perbedaan yang nyata (P<0.05)
NsG : Natriu m sitrat glukosa TG : Tris glukosa
NsF : Natriu m sitrat fruktosa TF : Tris fruktosa
Glukosa dapat melindungi membran plasma spermatozoa selama proses penurunan suhu karena glukosa dapat bersifat sebagai krioprotektan ekstraseluler. Sebagai krioprotektan ekstraseluler glukosa dapat melindungi membran plasma dengan cara melenturkannya. Menurut Garcia dan Graham (1989) yang dikutip
37
20oC menuju 5oC yang menyebabkan kerusakan sel akibat cekaman dingin. Cekaman dingin ini menyebabkan perubahan pada lipid membran plasma dan menyebabkan membran plasma kehilangan daya selektivitasnya.
Rusaknya membran plasma dapat juga disebabkan adanya peroksidasi lipid pada bagian membran sel. Membran plasma terdiri dari 60% protein dan 40% lipid dimana lipid yang membentuk membran plasma terdiri atas 65% fosfolipid, 25% kolesterol dan 10% lipid lainnya. Lipid pada bagian membran plasma sangat rentan terhadap adanya reaksi peroksidasi.
Gambar 9 memperlihatkan grafik MPU spermatozoa pada setiap 12 jam pengamatan dari masing- masing perlakuan. Grafik ini memperlihatkan dengan jelas terjadi penurunan MPU spermatozoa dengan semakin lamanya waktu penyimpanan. Penurunan persentase MPU yang sangat dratis terlihat setelah semen disimpan selama 84 jam.
Keterangan:
NsG : Natrium sitrat glukosa TG : Tris glukosa NsF : Natrium sitrat fruktosa TF : Tris fruktosa
Gambar 9 Grafik penurunan MPU spermatozoa yang disimpan di dalam lemari es (3 – 5oC) pada berbagai kombinasi jenis pengencer dan karbohidrat.
Tingkat penurunan persentase MPU selama penyimpanan lebih rendah jika dibandingkan dengan tingkat penurunan persentase motilitas spermatozoa pada keempat jenis pengencer. Tingkat penurunan persentase MPU dan motilitas spermatozoa pada awal hingga 96 jam penyimpanan masing- masing adalah
15.13% dan 41.43% pada pengencer tris glukosa, 22.50% dan 32.86% pada pengencer natrium sitrat glukosa, 25.19 dan 39.57 pada pengencer natrium sitrat fruktosa, serta 38.57% dan 50.00% pada pengencer tris fruktosa. Hal ini menunjukkan bahwa penurunan persentase motilitas spermatozoa yang dratis tidak diikuti dengan penurunan persentase MPU yang dratis pula, dimana spermatozoa yang tidak motil dalam pengencer masih memiliki membran plasma yang baik.
Pengaruh Jenis Pengencer dan Dosis Gliserol terhadap Kualitas Semen Beku
Hasil pengenceran semen menggunakan pengencer tris maupun natrium sitrat dengan sumber karbohidrat glukosa dan fruktosa dan level gliserol 10% dan 15% didapatkan adanya perbedaan, tetapi secara statistik menunjukkan tidak terjadi interaksi antara jenis pengencer dengan dosis gliserol yang berpengaruh terhadap kualitas semen rusa Timor pada berbagai tahap pembekuan (P>0.05), akan tetapi jenis pengencer maupun dosis gliserol masing- masing memberikan pengaruh nyata (P<0.05) terhadap beberapa parameter kualitas semen beku pada beberapa tahap evaluasi. Hal ini menunjukkan bahwa pengaruh dosis gliserol terhadap kualitas spermatozoa semen beku rusa Timor tidak tergantung atau dipengaruhi oleh jenis pengencer ya ng digunakan, baik pengencer tris ataupun natrium sitrat.
Pengaruh Gliserol terhadap Kualitas Semen
Persentase Motilitas
Motilitas merupakan salah satu kriteria yang penting untuk menilai kualitas spermatozoa yang akan digunakan untuk inseminasi buatan. Motilitas diperlukan bagi spermatozoa untuk mencapai tempat fertilisasi dan menembus dinding ovum.
39
pasca thawing, penambahan gliserol sudah memperlihatkan pengaruh yang nyata (P<0.05), dimana penambahan gliserol 10% ke dalam pengencer tris menghasilkan persentase motilitas spermatozoa yang relatif lebih tinggi dibandingkan dengan kombinasi jenis pengencer dan level gliserol yang lain (tris gliserol 15%, natrium sitrat gliserol 10%, dan natrium sitrat gliserol 15%).
Tabel 7 Rataan persentase motilitas spermatozoa dalam berbagai kombinasi jenis pengencer dan dosis gliserol
Tris Natrium sitrat
Tahapan pengamatan
Keterangan: Angka yang diikuti oleh huruf superskrip yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata (P<0.05)
G : dosis gliserol (%)
Penambahan gliserol 10% ke dalam pengencer tris mampu memberikan perlindungan terhadap semen rusa Timor dari pengaruh yang merugikan. Pengaruh perlindungannya yaitu memodifisier kristal-kristal es yang terbentuk selama proses pembekuan, sehingga kerusakan organel-organel sel spermatozoa dapat dihindarkan. Bila organel-organel sel spermatozoa rusak, seperti mitokondria maka rantai oksidasi akan terputus sehingga proses metabolisme tidak dapat berlangsung dan akhirnya sel mati.
Peranan lain dari gliserol adalah mencegah terjadinya dehidrasi, karena memiliki daya pengikat air yang kuat. Sifat demikian mempengaruhi tekanan uap sehingga titik beku medium menurun, akibatnya sel spermatozoa akan memperoleh kesempatan lebih lama untuk mengeluarkan air. Mazur (1980), mengatakan bahwa gliserol dapat mencegah pengumpulan molekul- molekul H2O dan kristalisasi es pada daerah titik beku larutan.