DETEKSI DAN KERAGAMAN MOLEKULER VIRUS
NEWCASTLE DISEASE YANG BERSIRKULASI DI
BEBERAPA WILAYAH ACEH
MUHAMMAD DAUD AIYUB KADIR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Deteksi dan keragaman molekuler virus Newcastle Disease yang bersirkulasi di beberapa wilayah Aceh adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
MUHAMMAD DAUD AIYUB KADIR. Deteksi dan keragaman molekuler virus Newcastle Disease yang bersirkulasi di beberapa wilayah Aceh. Dibimbing oleh SURACHMI SETIYANINGSIH dan IDWAN SUDIRMAN.
Newcastle Disease (ND) adalah penyakit menular yang sangat merugikan bagi industri peternakan unggas. Penyakit ND masih endemik di Indonesia termasuk Aceh. Diagnosis ND di Aceh umumnya masih berdasarkan gejala klinik, patologik maupun secara serologik. Kajian virologik yang dilakukan pada penelitian terdahulu membuktikan tingginya prevalensi infeksi virus ND pada ayam kampung di Aceh sedangkan kajian infeksi ND pada unggas lain masih belum dilakukan.
Tujuan penelitian ini adalah 1) melihat keragaman isolat virus, 2) mendeteksi dan mengisolasi virus pada ayam buras dan unggas air, 3) mengidentifikasi dan mengkarakterisasi virus secara serologi dan molekuler.
Pengambilan sampel dilakukan di penampungan maupun pasar unggas yang tersebar di 12 kecamatan dalam wilayah Kabupaten Aceh Besar dan Kota Banda Aceh. Sampel usap orofaring dan kloaka dikoleksi dari 35 ekor bebek dan 106 ekor ayam peternakan (broiler, layer dan ayam Arab). Real-time Reverse Transcriptase Polymerase Chain Reaction (rRT-PCR) dengan target gen matrix dari virus ND digunakan untuk uji skrining terhadap sampel pool yang terdiri dari 5-6 sampel. Sampel-sampel individu yang terpilih berdasarkan jenis unggas, sampel dan lokasi di inokulasi pada telur ayam embrio (SPF) untuk isolasi virus. Keanekaragaman genetik isolat-isolat virus ND di uji dengan menggunakan real-time dan konvensional gel-elektroforesis RT-PCR terhadap gen fusion; 69 isolat VND asal ayam kampung yang diperoleh dari hasil penelitian terdahulu dalam waktu dan area studi yang sama juga dikutsertakan dalam analisis ini.
Infeksi virus ND dideteksi pada 15 (54%) pool sampel usap orofaring dan 21 usap kloaka sebanyak 15 pool (54%) dan swab kloaka sebanyak 21 pool (75%). Hasil inokulasi masing-masing sampel individu dari pool positif menghasilkan 15 isolat VND. Sebelas dari 15 isolat tersebut digolongkan sebagai virus virulen dan empat virus avirulent berdasarkan identifikasi dengan rRT-PCR gen fusion. Seekor bebek yang nampak sehat mampu mekskresikan virus ND virulen melalui orofaring dan kloaka, sementara sebagian besar ayam umumnya mengeluarkan virus virulen melalui orofaring. RT-PCR konvensional dengan target gen fusion berhasil mengamplifikasi ke 15 isolat tersebut. Penentuan patotipe menggunakan rRT-PCR terhadap 69 isolat VND ayam kampung menggolongkan 57 isolat sebagai VND virulen dan 12 isolat avirulent. VND. Enam isolat dari masing-masing patotipe VND tersebut tidak bisa dideteksi oleh RT-PCR konvensional. Hal ini menunjukkan adanya keragaman genetik dari VND yang bersirkulasi pada ayam kampung.
diagnostik berbasis PCR yang lain. Virus ND yang bersirkulasi pada ayam kampung pada umumnya lebih beragam secara genetik dari pada virus ND yang diisolasi dari jenis unggas lain. Penelitian lebih lanjut diperlukan untuk membuktikan keanekaragaman VND yang bersirkulasi di Aceh.
SUMMARY
MUHAMMAD DAUD AIYUB KADIR. Molecular Detection and Characterization of Newcastle Disease Virus Isolates Circulating in Areas of Banda Aceh and Aceh Besar. Under the direction of SURACHMI SETIYANINGSIH and IDWAN SUDIRMAN.
Newcastle Disease is one of the most contagious and economically devastating diseases to poultry industries. The disease is endemic in Indonesia, including Aceh where diagnosis is mainly based on clinical symptoms, pathological and serological findings. A recent virological study confirms the high prevalence of NDV infection among kampong chicken in Aceh whereas ND investigation in other types of birds is lacking.
The objectives of this study were: 1) to detect the presence of NDV in chickens (broiler, layer, and arab breeds). A real-time reverse transcription polymerase chain reaction (rRT-PCR) targeting the matrix gene of NDV was used to screen pools of 5–-6 samples. Selected individual samples representing type of birds, sample, and location were propagated in embryonated SPF chicken eggs for virus isolation. The genetic diversity of NDV isolates was examined using real-time and gel-based RT-PCRs of fusion gene; 69 NDV isolates from kampong chicken obtained in the earlier study at the same time and location were included in this analysis.
NDV infection were detected in 15 (54%) pools of oropharingeal and 21 (75%) pools of cloacal swabs. Egg inoculation of individual samples from positives pools yielded 15 NDV isolates. Of the 15 isolates, 11 were virulent viruses and 4 were avirulent viruses identified by rRT-PCR fusion. An apparantly healthy duck shed virulent virus from oropharinx and cloaca, while majority of chickens shed virulent NDV from oropharinx.
The fusion gene fragment targeted by the conventional RT-PCR were successfully amplified from all of the 15 isolates. On the other hand, the rRT-PCR based pathotyping of 69 kampong chicken isolates identified 57 virulent and 12 avirulent NDVs. Six isolates from each of the two pathotypes were not recognized by the conventional RT-PCR. This finding indicated genetic diversity existed among NDVs circulating in kampong chicken.
In conclusion this study confirms the NDV infection in ducks and some non-native chickens in Aceh areas and that the infection can be subclinical. The conventional and real-time RT-PCR methods described could be used to detect and identify NDVs; however, the diverse nature of NDV genome may lead to the development of PCR based diagnostic test. In general, the NDVs circulating among kampong chicken were more genetically diverse than the viruses isolated from other type of birds. Further study is needed to elucidate the diversity of the circulating NDV in Aceh.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi Medik
DETEKSI DAN KERAGAMAN MOLEKULER VIRUS
NEWCASTLE DISEASE YANG BERSIRKULASI DI
BEBERAPA WILAYAH ACEH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
HALAMAN PENGESAHAN
Judul Penelitian : Deteksi dan Keragaman Molekuler Virus Newcastle Disease yang Bersirkulasi di Beberapa Wilayah Aceh
Nama : Muhammad Daud Aiyub Kadir
NRP : B 253124011
Program studi : Mikrobiologi Medik
Disetujui oleh Komisi Pembimbing
Drh. Surachmi Setiyaningsih, P.hD Ketua
Dr. Drh. H. Idwan Sudirman Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi Medik
Prof. Dr. Drh. Fachriyan H. Pasaribu
Dekan Sekolah Pascasarjana IPB Sekretaris Program Magister
Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wata’ala atas segala karunia dan hidayah-Nya penulis dapat menyelesaikan penyusunan tesis penelitian yang berjudul “Deteksi dan Keragaman Molekuler Virus Newcastle Disease yang Bersirkulasi di Beberapa Wilayah Aceh”, di susun sebagai salah satu syarat untuk memperoleh gelan Magister Sains pada Program Studi Mikrobiologi Medik (MKM), Sekolah Pascasarjana Institut Pertanian Bogor.
Ucapan terima kasih sebesar-besarnya atas doa, bimbingan, dukungan dan bantuan dalam penyelesaian tesis ini penulis sampaikan kepada:
1. Drh. Surachmi Setiyaningsih, P. hD. Ketua komisi pembimbing dan Dr. drh. Idwan Sudirman. Anggota komisi pembimbing.
2. Prof. Dr. Drh. Fachriyan Hasmi Pasaribu. Ketua program studi pascasarjana Mikrobiologi Medik dan Dr. drh. Agustin Indrawati, M. Biomed. Sekretaris program studi pascasarjana Mikrobiologi Medik.
3. Prof. Dr. Drh. I Wayan Teguh Wibawan, MS. Penguji luar komisi pembimbing.
4. Prof. Dr. Drh. Retno D. Soejoedono, MS. Ketua laboratorium terpadu program studi Mikrobiologi Medik FKH IPB. Dr. Drh. Sri Murtini, M. Si, Drh. Ni Luh P. Ika M. P. hD, Dr. Drh. Okti Nadia Poetri, M. Si. M. Sc, drh. Titiek Sunartatie, MS, Mba Adeh Isnawati, SE, Mba Roselyn Syaferina, Amd, Mas Wahyu, Pak Nur dan Pak Ujang. Staff laboratorium terpadu Mikrobiologi FKH IPB.
5. Drh. Darniati, M.Si, Drh. Aprizal Panus, M. Si, Pupimadita Tizar Audora, S.Si, M.Si, Drh. Maya Shofa, teman-teman MKM 2012, 2013, 2014, dan Ikatan Mahasiswa Pascasarjana Aceh (IKAMAPA) Bogor.
6. Ibunda tercinta Rosdiana, Ayahanda Aiyub AK, Kakanda M. Ya’kub, Zulkifli, Adinda Munadhillah dan M. Rifqi.
Semoga tulisan ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL v
DAFTAR GAMBAR v
PENDAHULUAN 7
Latar Belakang 7
Perumusan Masalah 2
TINJAUAN PUSTAKA 4
Newcastle Disease (ND) 4
Perubahan Patologis Infeksi Newcastle Disease 4
Epidemiologi dan Transmisi Virus 5
Etiologi dan Sifat Virus 6
Patogenisitas dan Virulensi 8
Keragaman Antigenik virus ND 9
Keragaman Genetik virus ND 9
Teknik Diagnostik 10
Real time Reverse Transcriptase Polymerase Chain Reaction (rRT-PCR) 11
METODE 12
Waktu dan Tempat Penelitian 12
Bahan dan alat 12
Metode Penelitian 13
ANALISIS DATA 15
HASIL DAN PEMBAHASAN 16
Deteksi dan Isolasi Virus ND dengan real time RT-PCR 16
Deteksi virus ND dengan RT-PCR konvensional 18
SIMPULAN DAN SARAN 24
DAFTAR PUSTAKA 25
DAFTAR TABEL
Table 1 Sampel virus ND pada usap kloaka dan orofaring ... 3
Table 2 Hasil deteksi dan isolasi dengan realtime RT-PCR ... 16
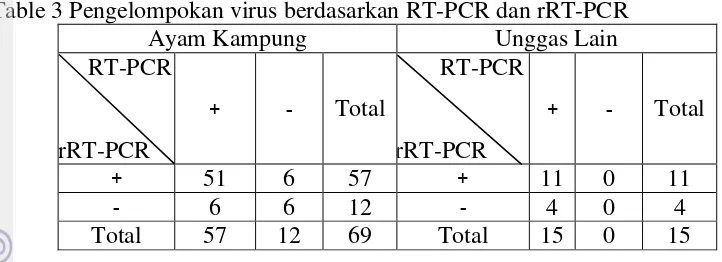
Table 3 Pengelompokan virus berdasarkan RT-PCR dan rRT-PCR ... 21
DAFTAR GAMBAR
Perubahan PA yang terinfeksi virus ND. ... 5Susunan Genom NDV ... 8
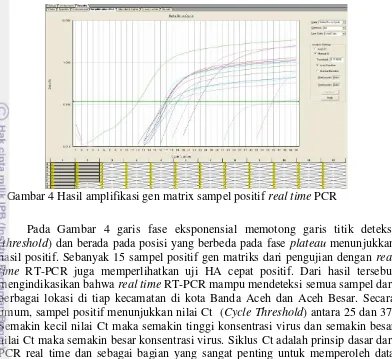
Hasil amplifikasi gen matrix sampel positif real time PCR ... 17
Hasil amplifikasi RT-PCR produk 991 bp (marker 100 bp) ... 19
Uji HI menggunakan serum B1 dan Komarov menunjukkan variasi afinitas titer antibodi antara dua serum 4 Log2 dan 5 Log2 ... 22
PENDAHULUAN
Latar Belakang
Newcastle disease (ND) atau di Indonesia dikenal sebagai penyakit tetelo merupakan penyakit yang bersifat menular dan sangat penting di industri peternakan. Secara ekonomi, penyakit ini sangat merugikan karena dapat menyebabkan kematian mencapai 100% pada semua jenis unggas terutama ayam, baik ayam ras maupun buras (Tabbu 2003) sehingga Organisasi Kesehatan Hewan Dunia (OIE) memasukkan penyakit ini dalam kategori notifiable diseases (Epidemiological Major Disease) (Alexander 2000).
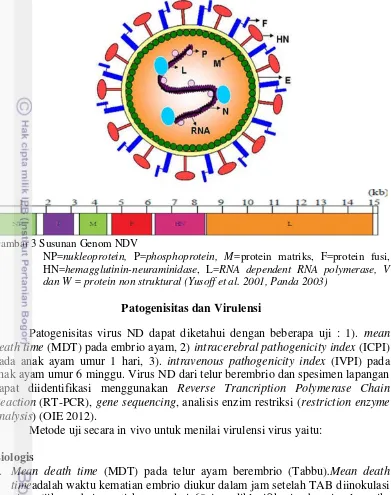
Virus merupakan virus RNA beramplop yang dengan asam inti berutas tunggal, berpolaritas negatif dan tidak bersegmen. Panjang genomnya berkisar 15.186-15.192 nukleotida yang menyandi enam polipeptida yakni Nukleokapsid Protein (Fazel et al.), Phospoprotein (P), Matrix (M), Fusion (F), Hemaglutinin-Neuraminidase (HN) dan RNA polymerase (L) dengan susunan 3'-NP-P-M-F-HN-L-5' (De Leeuw et al. 1999). Amplop virus ND terdiri atas dua glikoprotein, yakni HN dan F yang berperan amat penting dalam proses infeksi. Protein HN memediasi terjadinya perlekatan virus dengan sel inang, sedangkan protein F berfungsi untuk penetrasi virus ke dalam sel inang dan berperan dalam pembentukan sinsitia pada sel yang terinfeksi (Wakamatsu et al. 2006).
Secara genetik maupun antigenitas, virus ND masih sangat beragam. Analisis secara filogenetik (kekerabatan), virus ND diklasifikasikan menjadi 2 divisi; yaitu kelas 1 (yang menyerang unggas air dan terdiri dari golongan virus bervirulensi rendah) terdiri dari 9 genotipe, dan Kelas 2 (yang menyerang unggas darat dan terdiri dari virus bervirulensi tinggi/ganas) yang terdiri 10 genotipe (Xie et al. 2012). Sedangkan klasifikasi berdasar serotipe mengacu pada protein HN dengan melakukan HA/HI test, di mana ND hanya punya 1 serotipe. Sementara berdasar patotipe mengacu pada virulensi atau tingkat keganasan (Tabbu 2003). Dari 10 genotipe virus ND kelas 2 (1-10), genotipe yang paling awal ditemukan adalah genotipe 1, 2, 3, 4 dan 9 pada tahun 1930-1960. Setelah tahun 1960, genotipe 5, 6, 7, 8, dan 10 ditemukan. Dan pada tahun 2011 ditemukankanlah isolat baru NDV dari Madagaskar, yaitu genotipe 11 (Maminiaina et al. 2010). Genotipe 2 termasuk virus ND virulensi rendah yang digunakan sebagai galur vaksin, yaitu virus LaSota, B1 dan VG/GA. Kemudian, muncul pendapat bahwa vaksin yang banyak beredar di Indonesia umumnya dibuat dengan isolat virus La Sota dan Hitchner B1 asal Amerika yang tergolong ke dalam genotipe 2 tersebut. Sementara itu, isu yang berkembang menyebutkan bahwa dari kasus ND sepanjang tahun 2009-2011 yang dominan terjadi di Indonesia saat ini, disebabkan oleh virus ND genotipe 7 (Lomniczi et al. 1998).
2
seperti Chronic Respiratory Disease Infectious bursal disease (IBD), Pullorum, Kolera, dan beberapa kasus Avian influenza (AI). Dan pada beberapa lokasi peternakan rakyat di Kecamatan dalam wilayah Aceh Besar, dilaporkan terjadi kasus very virulent ND (vvND) sekitar 100 kasus di tiap kecamatannya (DISNAK 2012).
Sikuen dari gen penyandi genome virus dari berbagai negara sudah banyak dilaporkan, namun sangat terbatas informasi tentang sikuen gen isolat asal Indonesia (Adi et al. 2011). Laporan terakhir mengenai isolasi virus ND di Indonesia adalah tahun 2009, yang di kenal sebagai isolat NDV/Bali-1/07 dan tergolong strain velogenik. Sedangkan yang terbaru adalah strain Banjarmasin/010/10 dan Sukorejo/019/10 dan merupakan isolat Indonesia asal ayam mempunyai sekuen genom yang lengkap (Xiou et al. 2012).
Seringnya terjadi kasus tersebut disebabkan oleh sistem pemasaran melalui pengepul dan sistem pemeliharaan yang masih tradisional, dimana unggas yang diumbar mempermudah terjadinya penularan penyakit karena tingginya kontak langsung atau tidak langsung antar unggas. Meskipun upaya vaksinasi dan pengawasan lalu lintas unggas telah dilakukan, namun kasus ND masih dilaporkan terjadi akibat antigenitas vaksin yang digunakan tidak protektif pada unggas (Sa'idu et al. 2008). Untuk itu diperlukan pemilihan galur vaksin dan metode vaksinasi yang tepat untuk menanggulangi infeksi ND dengan mengetahui tingkat virulensi antigenitas dan genesitas virus lapangan.
Belakangan ini, metode diagnosis yang berbasis pendekatan biologi molekuler telah menjadi alternatif yang dapat diandalkan. Salah satu metode diagnosis berbasis molekuler yang dapat dikembangkan untuk melacak infeksi virus ND pada unggas terinfeksi adalah teknik reverse transcriptase-polymerase chain reaction (rRT-PCR) dan sequencing (Sinkovics et al. 2000). Penggunaan teknologi sequencing ini berhasil menunjukkan variasi genetik virus ND dilapangan sehingga dapat dibuat phylogenetic tree untuk melihat kekerabatan isolat virus tersebut (Alexander et al. 2008).
Perumusan Masalah
3
Tujuan Penelitian
Secara umum penelitian ini bertujuan untuk mengkaji keragaman VND yang bersirkulasi di Aceh pada unggas hidup. Secara khusus meliputi: deteksi dan isolasi VND (ayam buras dan unggas air), identifikasi dan karakterisasi virus berdasarkan sifat fisik, serologik, dan molekuler.
Manfaat Penelitian
1. Memberikan informasi tentang karakter dan keragaman virus ND yang bersirkulasi di wilayah Aceh.
2. Masukan untuk pengendalian ND di Aceh.
Ruang Lingkup Penelitian
Dalam penelitian ini dilakukan serangkaian kegiatan berupa koleksi sampel usapan orofaring dan kloaka dari ayam kampung, ayam ras (ayam Arab, broiler, layer), dan unggas air (itik, entok) di kabupaten Aceh Besar dan kota Banda Aceh, menggabungkan (pooling) sampel, mengekstraksi RNA virus, mendeteksi dengan rRT-PCR matriks, mengisolasi virus pada telur ayam berembrio specific pathogen free (SPF), mengidentifikasi pertumbuhan VND dengan uji haemaglutinasi (HA) dan rRT-PCR, serta mengkarakterisasi virus dengan uji haemaglutination inhibition (HI), rRT-PCR Fusion, dan RT-PCR.
Table 1 Sampel virus ND pada usap kloaka dan orofaring
Kabupaten Kecamatan Lokasi Jenis Jumlah
Aceh Besar Ingin Jaya Pengepul Bebek 5 Indrapuri Peternakan Layer 21 Montasik Peternakan Layer 15
Blang Bintang Peternakan Broiler 20
4
Hipotesis Penelitian
Virus ND yang di beredar wilayah Aceh beragam, baik secara antigenik dan genetik.
TINJAUAN PUSTAKA
Newcastle Disease (ND)
Berdasarkan keparahan penyakit secara klinis strain NDV diklasifikasikan menjadi 5 tipe (OIE 2012): Viscerotropic velogenic; sebuah bentuk yang sangat patogen dimana lesi perdarahan usus sering terlihat, Neurotropic velogenic; memperlihatkan kematian tinggi, biasanya diikuti gejala pernapasan dan saraf Mesogenic: bentuk yang memperlihatkan gejala pernafasan, kadang-kadang gejala saraf tetapi tingkat kematian yang rendah. Lentogenic; bentuk yang memperlihatkan infeksi ringan dan subklinis. Asymptomatic; bentuk yang biasanya terdiri dari infeksi enterik subklinis. Gejala klinis yang muncul pada penyakit ND bervariasi tergantung dari strain virus dan spesies unggas yang diinfeksi. Virus ND galur lentogenik memiliki gejala klinis yang bersifat ringan, tidak menimbulkan kematian pada unggas dewasa dan biasanya banyak digunakan sebagai vaksin (Alexander 2000).
Perubahan Patologis Infeksi Newcastle Disease
Lesi yang signifikan sering ditemukan pada unggas yang terinfeksi oleh strain velogenik. kepala atau daerah periorbital membengkak, dan jaringan interstisial pada leher mengalami edematous, terutama didekat toraks. Kongesti/ hemoragi terlihat pada faring bagian bawah dan mukosa trakeal, dan dipteritis membran pada oroparing, trakea dan esophagus. Pada mukosa proventrikulus dapat ditemukan Ptechie dan echimosa kecil. Hemoragi, ulcer, edema dan/atau nekrosis sering terjadi di seka tonsil dan jaringan limfoid di usus (termasuk peyer’s patches). Perubahan patologi anatomi ditandai dengan adanya ptechie pada proventrikulus, ventrikulus, usus, seka tonsil, trakea, dan paru-paru merupakan perubahan patognomonis pada penyakit ND (Kencana et al. 2012).
5
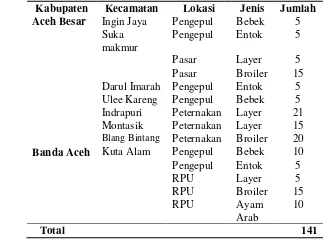
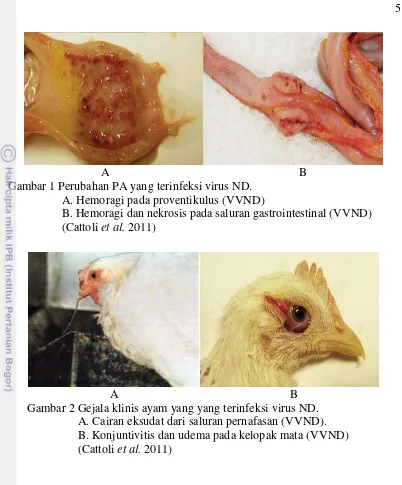
A B
Gambar 2 Gejala klinis ayam yang yang terinfeksi virus ND. A. Cairan eksudat dari saluran pernafasan (VVND). B. Konjuntivitis dan udema pada kelopak mata (VVND) (Cattoli et al. 2011)
A B
Gambar 1 Perubahan PA yang terinfeksi virus ND. A. Hemoragi pada proventikulus (VVND)
B. Hemoragi dan nekrosis pada saluran gastrointestinal (VVND) (Cattoli et al. 2011)
Nama lain untuk New Castle Disease (ND) adalah tetelo, pseudovogolpest, sampar ayam, Rhaniket, Pneumoencephalitis dan Tontaor furrens. Newcastle Disease dipandang sebagai salah satu penyakit penting di bidang perunggasan. Kejadian wabah penyakit ND seringkali terjadi pada kelompok ayam yang tidak memiliki kekebalan atau kekebalan rendah akibat terlambat divaksin atau karena kegagalan program vaksinasi.
Epidemiologi dan Transmisi Virus
6
yang bermigrasi di Amerika Serikat digunakan komersial vaksin strain B1 dan La Sota (EFSA 2007).
Transmisi virus ND dapat terjadi melalui inhalasi dan ingesti. Virus dapat disebarkan oleh hewan atau media yang berkontak langsung dengan unggas yang sensitif. Penularan virus ND dapat terjadi secara langsung antar ayam dalam satu kelompok ternak. Sumber virus berasal dari ekskreta ayam terinfeksi baik melalui pakan, air minum, lendir, feses, maupun udara yang tercemar virus, peralatan dan pekerja kandang. Virus ND dapat ditularkan melalui pernafasan atau pencernaan. Unggas Gallinaceous mengeluarkan virus 1-2 minggu setelah terinfeksi. Pada suhu diatas 1-2o C virus masih bertahan pada kulit ayam selama 60 hari dan dalam sum-sum tulang dapat bertahan hingga 200 hari .
Penularan virus dari ayam terinfeksi tergantung pada tempat replikasi dari virus. Ayam yang menunjukkan gejala pernafasan mengeluarkan udara yang mengandung virus dan menginfeksi ayam lain melalui inhalasi. Virus ND yang bereplikasi dalan saluran pencernaan mengeluarkan virus melalui feses. Penularan virus dapat terjadi melalui oral akibat ingesti dari feses yang mengandung virus, makanan dan minuman yang tercemar atau melalui inhalasi karena terhirup virus dari feses yang telah kering (Tabbu 2003).
Etiologi dan Sifat Virus
Newcastle Disease (ND) adalah penyakit viral yang disebabkan oleh Paramyxovirus tipe A, genus Avulavirus, ordo Mononegaverales dan tergolong virus ssRNA, total genom mengandung 16.000 nukleotida dan replikasinya di dalam sitoplasma sel hospes.Virus ini dapat diinaktifkan dengan pemanasan 56 oC
selama 3 jam dan 60 oC selama 30 menit, pada pH asam, sensitif terhadap eter, formalin dan fenol, namun virus ND dapat bertahan hidup pada temperatur lembab terutama di dalam feses ayam (Aldous dan Alexander 2001). ND adalah penyakit viral bersifat menular dan fatal menyerang semua spesies unggas. Gejala klinis sangat bervariasi tergantung pada strain virus, spesies, umur burung, penyakit sekunder dan imunitas tubuh. Berdasarkan gejala klinik ND terbagi dalam 5 golongan utama yaitu Velogenik Viserotropik, Velogenik Neurotropik, Mesogenik, Lentogenik, dan Asimtomatik (OIE 2012).
Di Indonesia ND menyebar ke berbagai daerah baik di Jawa maupun diluar Jawa. Saat ini hampir seluruh wilayah Indonesia merupakan daerah tertular dan belum ada satu daerah yang bebas dari penyakit ND (Tarmudji 2005). Serangan penyakit ND umumnya mulai meningkat pada awal musim hujan dan mencapai puncaknya pada pertengahan musim atau pada saat peralihan dari musim hujan ke musim kemarau.
Virus ND mampu menggumpalkan eritrosit, mudah mati di bawah sinar ultraviolet dan dalam keadaan sekitar yang tidak stabil, rentan terhadap zat-zat kimia, seperti kaporit, besi, klor dan lain-lain. Desinfektan yang peka untuk ND, antara lain NaOH 2%, Formalin (1- 2%), Phenol-lisol 3%, alkohol 95 dan 70%, fumigasi dengan Kalium permanganat (PK) 1 : 5000. Aktivitas ND hilang pada suhu 100 oC selama satu menit dan mati pada suhu 56 oC selama lima menit
7 antara 1 sampai dengan 2 hari setelah infeksi. Infeksi oleh virus ND alami yang tidak menyebabkan kematian menimbulkan kekebalan selama 6-12 bulan, demikian juga halnya kekebalan yang diperoleh dari vaksinasi (Jestin dan Jestin 1991).
8
Gambar 3 Susunan Genom NDV
NP=nukleoprotein, P=phosphoprotein, M=protein matriks, F=protein fusi, HN=hemagglutinin-neuraminidase, L=RNA dependent RNA polymerase, V dan W = protein non struktural (Yusoff et al. 2001, Panda 2003)
Patogenisitas dan Virulensi
Patogenisitas virus ND dapat diketahui dengan beberapa uji : 1). mean death time (MDT) pada embrio ayam, 2) intracerebral pathogenicity index (ICPI) pada anak ayam umur 1 hari, 3). intravenous pathogenicity index (IVPI) pada anak ayam umur 6 minggu. Virus ND dari telur berembrio dan spesimen lapangan dapat diidentifikasi menggunakan Reverse Trancription Polymerase Chain Reaction (RT-PCR), gene sequencing, analisis enzim restriksi (restriction enzyme analysis) (OIE 2012).
Metode uji secara in vivo untuk menilai virulensi virus yaitu:
Biologis
1. Mean death time (MDT) pada telur ayam berembrio (Tabbu).Mean death timeadalah waktu kematian embrio diukur dalam jam setelah TAB diinokulasi virus (jika embrio mati kurang dari 60 jam diklasifikasi sebagai velogenik; jika embrio hidup lebih dari 90 jam diklasifikasi sebagai lentogenik dan jika embrio mati diantara 60<MDT<90 jam diklasifikasi sebagai mesogenik (Cattoli et al. 2011).
9 dalam observasi. Virus virulen mempunyai skor mendekati 3.0, lentogenik dan mesogenik mempunyai nilai 0.0 ND (Dortmans et al. 2010).
3. Intracerebral pathogenicityindex (ICPI) pada ayam umur sehari. Pada uji ini digunakan 10 ekor ayam SPF yang diinokulasi dengan NDV melalui otak. Intracerebral pathogenicityindexadalah skor rata-rata ayam per observasi lebih dari 8 hari. Penilaian skor pada metode ini adalah jika ayam normal tidak menunjukkan gejala klinis nilainya 0, nilai skor 1 jika ayam menunjukkan gejala sakit sedangkan skor 2 jika ayam mati selama dalam observasi. Nilai ICPI lebih dari 0.4 adalah lentogenik, nilai 1.4 mesogenik sedangkan nilai lebih dari 1.7 velogenik ND (Dortman 2010).
Molekuler (PCR Fusion)
Penentuan virulensi juga bisa dilakukan secara molekuler (molecular pathotyping) dengan melihat urutan asam amino pada cleavage site protein F. Virus-virus lentogenik mempunyai motif asam amino monobasic 112G/E-K/R-Q-G/E-R116 dan L (leucine) pada residu 117, sedangkan strain mesogenik dan velogenik mempunyai motif asam amino multibasic 112R/K-R-Q/K/R-K/R-R116 dan F (phenylalanine) pada residu 117. Protein F bermotif monobasic terpecah secara ekstraselular oleh enzim protease seperti tripsin yang ditemukan pada saluran pernafasan dan pencernaan, sementara yang polybasic dapat dibelah secara intraseluler oleh enzim protease seperti furin yang terdapat di berbagai jaringan sel inang, sehingga mengakibatkan infeksi sistemik yang fatal (OIE 2012).
Keragaman Antigenik virus ND
Berdasarkan perbedaan antigenik, genus Avulavirus dikelompokkan kedalam 11 serotipe (APMV 1-APMV 11), dimana VND termasuk kedalam serotype 1 (APMV 1) yang menginfeksi unggas dan burung-burung liar (Kang et al, 2014). Sejak tahun 1926, Infeksi APMV 1 bersifat panzootik dan zoonosis. Di Pakistan infeksi APMV 1 pada burung merak menyebabkan tingkat mortalitas mencapai 100 % (Ashraf et al. 2014). Pada manusia APMV 1 menyebabkan konjungtivitis, sinusitis dan pneumonia (Scott J. Goebel et al. 2007). APMV 2 pertama sekali di isolasi di Yucaipa, California pada tahun 1956. Infeksi sering terjadi pada ayam, kalkun dan beberapa jenis burung. APMV 3 di isolasi pada tahun 1967 pada kalkun di Ontario dan Wisconsin yang selanjutnya juga di laporkan di beberapa negara Eropa. Virus-virus serotipe APMV 4, 8, dan 9 sering menginfeksi bebek dan angsa, sedangakn APMV 5 bersifat epizootik pada burun g Betet seperti yang pernah dilaporkan di Jepang pada tahun 1974. APMV 7 sering terlihat pada burung Merpati dan golongan burung ordo Colombiformes. APMV 11 pertama sekali di laporkan di Perancis pada burung Berkik isolat snipe/France/100212/2010 (Briand et al. 2012).
Keragaman Genetik virus ND
10
dan unggas air dan bersifat kurang virulen. Virus class II terbagi menjadi 16 genotipe , sering ditemukan pada ayam, burung peliharaan dan unggas air. Genotipe I, II, III, IV dan IX memiliki genom yang pendek yaitu 15,186 nukleotida, genotipe tersebut merupakan virus awal (early) yang ditemukan (tahun 1930-1960). Genotipe V, VI, VII, VIII dan X mempunyai panjang genom 15.192 nukleotida yang dikelompokkan sebagai virus “late” (setelah tahun1960). Semua virus class II merupakan virus yang bersifat virulen kecuali isolat genotipe I yang menyebabkan outbreak di Australia pada tahun 1998 sampai 2000, sehingga dijadikan sebagai vaksin aktif. Genotipe II dari class II juga tidak virulen sehingga digunakan sebagai vaksin secara meluas di dunia seperti La sota, B1dan VG/GA (Hines dan Miller 2012; Miller et al. 2013).
Ada dua komponen glikoprotein yang sangat penting dalam penentuan genotipe virus ND yaitu gen Fusion (F) dan Haemaglutinin (HN). Gen HN bersifat multifungsi dan berperan dalam mengenali reseptor yang mengandung asam sialik pada permukaan sel dan mendorong aktifitas fusi protein F terhadap reseptor sel sehingga membolehkan virus untuk penetrasi ke permukaan sel dan bertindak sebagai neuraminidase dengan melepaskan asam sialik dari partikel calon virus untuk mencegah self-agglutination (Huang et al. 2004). Sekuen nukleotida gen HN mengandung satu open reading frame yang panjang, dimulai dari kodon (ATG) pada 306-308 nt dan 2037-209 nt pada terminal kodon (Millar et al. 1986).
Teknik Diagnostik
Untuk mendiagnosa Newcastle disease dapat dilakukan dengan cara konvensional dan molekuler. Deteksi virus secara konvensional dilakukan dengan mengisolasi virus pada telur ayam berembrio (Tabbu) dan kultur sel. Isolasi virus merupakan standar referensi untuk mendiagnosa NDV. Isolasi virus penting untuk mengkonfirmasi keberadaan virus dan untuk karakterisasi virus selanjutnya (Terregino et al. 2009).Telur ayam berembrio spesific pathogen free (SPF) umur 9-11 hari yang sering digunakan untuk isolasi karena merupakan inang yang paling sensitif untuk isolasi virus dan dapat digunakan pada semua tipe sampel seperti organ, usap kloaka, usap trakhea, usap oropharingeal (OIE 2012).
Virus-virus ND virulen dapat bereplikasi pada berbagai kultur sel unggas dan non unggas. Kultur yang banyak digunakan antara lain chicken embryo fibroblast (CEF), chicken embryo liver (Maminiaina et al.), chicken embryo kidney (CEK), African green monkey kidney (Maminiaina et al.), chicken-embryo-related (CER), baby hamster kidney (BHK-21), HeLa cells, KB cells dan vero cell(Ahamed et al. 2004). Pertumbuhan virus pada sel monolayer dapat mengakibatkan perubahan atau cytopathic effect (CPE) dan syncytia. Virus ND membentuk plak tergantung pada tingkat cytopathic effect yang umumnya memiliki diameter dari 0.5 mm sampai 4.0 mm. Mayoritas strain velogenik dan mesogenik membentuk formasi plak yang jelas, sedangkan strain lentogenik untuk efektifitas pembentukan plak pada sel embrio ayam membutuhkan ion Mg2+ dan diethylaminoethyl dextranatau trypsin (0.01 mg/ml) dalam kultur medium (Reeve et al. 1971, Cattoli et al. 2011).
11 inhibition (HI),virus neutralization dan enzym linked immunosorbent assay (ELISA). Isolat virus dari lapang dapat mengandung virus virulen dan nonvirulen yang berasal dari vaksin aktif atau infeksi alami.Uji HA dilakukan untuk melihat kemampuan virus mengaglutinasi sel eritrosit akibat dari aktivitas haemaglutinin yang terdapat pada amplop virus.Aktifitas HA virus harus dikonfirmasi dengan uji Haemagglutination inhibition (HI) dengan menggunakan antisera poliklonal spesifik terhadap virus ND. Uji HI berdasarkan pada kemampuam antibodi spesifik untuk menghambat aktifitas hemagglutinin virus (Miller et al. 2013).
Real time Reverse Transcriptase Polymerase Chain Reaction (rRT-PCR)
Teknik molekuler untuk mendiagnosa Virus Newcastle Disease dengan Polymerase Chain Reaction (PCR) telah dikembangkan oleh Kary B. Mullis tahun 1985 dan menjadi teknik yang revolusioner. Pada awal perkembangannya metode PCR hanya digunakan untuk melipatgandakan molekul DNA, namun kemudian dikembangkan lebih lanjut sehingga dapat digunakan pula untuk melakukan kuantitasi molekul mRNA. Saat ini metode PCR telah banyak digunakan untuk berbagai macam manipulasi dan analisis genetik. Metode ini juga sering digunakan untuk memisahkan gen-gen berkopi tunggal dari sekelompok sekuen genom. Dengan menggunakan metode PCR, dapat diperoleh pelipatgandaan suatu fragmen DNA (110 bp, 5×109 mol) sebesar 200.000 kali setelah dilakukan 20 siklus reaksi selama 220 menit. Hal ini menunjukkan bahwa pelipatgandaan suatu fragmen DNA dapat dilakukan secara cepat. Kelebihan lain reaksi ini adalah dapat dilakukan menggunakan komponen dalam jumlah sangat sedikit, hanya sekitar 5 µg DNA template, oligonukleotida yang diperlukan hanya sekitar 1 µM dan reaksi ini bisa dilakukan dalam volume 50-100 µl (Kary et al. 1987).
Pelaksanaan metode PCR memerlukan empat komponen utama, yakni DNA cetakan, oligonukleotida primer, deosiribonukleotida trifosfat (dNTP) yang terdiri dari dATP, dCTP, dGTP, dTTP, dan) enzim polimerase yang digunakan untuk mengkatalis reaksi sintesis rantai DNA. Proses PCR terdiri dari tiga tahap, yakni denaturasi, penempelan (annealing), dan amplifikasi. Pada tahap denaturasi, suatu fragmen DNA (double strand) dipanaskan pada suhu 95 0C selama 1-2 menit sehingga terpisah menjadi rantai tunggal (single strand). Kemudian dilakukan penempelan (annealing) pada suhu 55 0C selama1-2 menit, yakni oligonukleotida
primer menempel pada DNA cetakan yang komplementer dengan sekuen primer. Setelah dilakukan penempelan, suhu dinaikkan menjadi 72 0C selama 1,5 menit. Pada suhu ini, enzim DNA polymerase melakukan poses polimerasi, yakni rantai DNA yang baru akan membentuk jembatan hidrogen dengan DNA cetakan. Proses ini disebut amplifikasi (Yuwono 2006).
12
Teknik real-time reverse transcriptation polymerase chain reaction (rRT-PCR) merupakan hasil pengembangan RT-PCR konvensional yang memungkinkan untuk dilakukan pemonitoran amplifikasi DNA pada saat proses amplifikasi berlangsung (real time). Dalam reaksi ini, RNA tidak dapat digunakan sebagai cetakan, oleh karena itu perlu dilakukan proses transkripsi balik (reverse transcription) terhadap molekul mRNA sehingga diperoleh molekul cDNA (complementary DNA). Molekul cDNA tersebut kemudian digunakan sebagai cetakan dalam proses PCR. Teknik rRT-PCR sangat sensitif yang memungkinkan amplifikasi dan kuantifikasi urutan asam nukleotida spesifik (Hoffmann et al. 2009). Teknik RT-PCR memerlukan enzim transcriptase balik (DNA polymerase) antara lain mesophilic viral reverse transcriptase (RTase) yang dikode oleh virus avian myoblastosis (AMV) maupun oleh virus moloney murine leukemia (MuLV), dan Tth DNA polymerase. RTase yang dikode oleh AMV maupun M-MuLV bersifat sangat prosesif dan mampu menyintesis cDNA sampai sepanjang 10 kb, sedangkan Tth DNA polymerase mampu menyintesis cDNA sampai sepanjang 1-2 kb (Yuwono 2006).
Deteksi hasil amplifikasi dilakukan dengan memonitor flourescens yang dihasilkan oleh intercalating dyes, primer yang dilabel fluorophor atau probe spesifik. Penggunaan probe spesifik meningkatkan spesifisitas dibandingkan konvensional PCR yang dilakukan pada agarose. Target kuantifikasi dicapai dengan menentukan jumlah siklus amplifikasi yang dibutuhkan untuk menghasilkan produk PCR pada awal fase eksponensial kemudian memotong garis fluorescens threshold (threshold cycle (Ct) (Hoffmann et al. 2009). Real-time reverse transcriptase polymerase chain reaction (rRT-PCR) sudah dikembangkan untuk mendeteksi RNA Avian paramyxovirus serotype 1 (APMV-1) dari sampel klinis berasal dari burung. Pengujian ini menggunakan protokol
Pengambilan sampel dilakukan di Tempat Pemotongan dan Penampungan Unggas (TPU), peternakan, dan pasar unggas dalam wilayah Aceh pada bulan Agustus 2013. Penelitian dilaksanakan di bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesmavet Fakultas Kedokteran Hewan IPB dari bulan Juli 2014 sampai Maret 2015.
Bahan dan alat
13 Phosphat Buffer Saline (PBS) pH 7.2, red blood cell (RBC) ayam. Untuk virus kontrol ND digunakan virus strain Lasota dan serum kontrol positif digunakan serum Kumarov dan B1 (koleksi BBPMSOH), Roche High Pure Viral Nucleic Acid kit, Primer Matrix forward (M+4100): (5’-AGT GAT GTG CTC GGA CCT TC-3’) dan matrix reverse (M-4220) (5’-CCT GAG GAG AGG CAT TTG CTA-3’). Probe yang digunakan adalah M+4169 (5’FAM TTC TCT AGC AGT GGG ACA GCC TGC) dan Sampel usap kloaka dan orofaring dari bebek, entok, broiler, layer dan ayam Arab.
Sedangkan alat berupa cotton swab steril, Ag-Path IDTM one-step RT-PCR kit dari Ambion dengan plat optik 96 sumuran, mesin Applied Biosystems 7500 Real Time PCR System, mikropipet, mikrotips, plat mikrotitrasi 96 sumuran V,spuit 1 cc, spuit 10 cc, sentrifus, vortex, biosafety cabinet (BCC) (Esco), refrigerator, freezer dan incubator.
Metode Penelitian laboratorium sampel digabungkan berdasarkan berdasarkan jenis usapan, jenis unggas, lokasi, dan tanggal pengambilan. Pooling dilakukan untuk 5-7 individu dengan volume 100 µl per individu.
Isolasi RNA (Roche)
Isolasi RNA dilakukan menggunakan High Pure Viral Nucleic Acid Kit dari Roche. Sebanyak 200 µl working solution (campuran poly A dan binding buffer) dimasukkan ke mikrocentrifuge 1.5 µl. Proteinase K ditambahkan sebanyak 50 µl dan sampel 200 µl kemudian dihomogenkan dan diinkubasi pada suhu 72 °C selama 10 menit. Selanjutnya ditambahkan 100 µl binding buffer, dihomogenkan dan ditransfer seluruh suspensi ke dalam High pure filter tube dan disentrifus selama 1 menit pada 8000 g. Tabung HP filter dipindahkan pada collection tube baru, ditambahkan 500 µl inhibitor removal buffer dan disentrifugasi pada 8000 g selama 1 menit. Collection tube diganti kembali dan dicuci dua kali dengan 450 ml wash buffer selanjutnya disentrifus 8000 g, 1 menit dan dilakukan pengeringan dengan sentrifugasi pada kecepatan 13.000 g selama 10 detik. Berikutnya ditambahkan 50 µl elution buffer ke dalam Hp filter tube dan disentrifugasi pada 8000 g selama 1 menit. Hasil elusi RNA disimpan dalam microcentrifuge pada suhu -80 oC.
Uji Real Time Reverse Transcriptation Polymerase Chain Reaction (rRT-PCR)
14
reverse (20ulM) 0,50, enzim mix 25X 1,00 ul, probe (10 uM) 0.60 ul, dan detection enhancer 1.67 ul. RNA yang berasal dari pooling beberapa sampel diamplifikasi dengan rRT-PCR untuk penafisan keberadaan virus ND (CVL 2007). Prosedur PCR yang dilakukan secara ringkas sebagai berikut : ke dalam masing-masing sumuran plat optik 96 sumuran dimasukkan 17 µl campuran PCR kemudian ditambahkan 8 µl RNA template hasil isolasi. Plat ditutup dengan seal optik kemudian di tempatkan pada mesin Applied Biosystems 7500 Real-time PCR System dengan kondisi sebagai berikut : tahap 1 (1×) : reverse transkripsi 45 oC 10 menit; denaturasi 95 oC 10 menit ; tahap 2 (40x): denaturasi 94 oC 10 detik; annealing 56 oC 30 detik; ekstensi 72 oC 10 detik. Protokol yang digunakan untuk uji rRT-PCR sesuai dengan protokol. Hasil PCR dianalisis menggunakan Applied Biosystems 7500 Real-Time PCR System software.
Isolasi Virus pada Telur Ayam Berembrio
Isolasi virus dilakukan terhadap sampel individual kloaka dan orofaring yang menunjukkan positif terdapat gen matriks dengan rRT-PCR. Sampel Swab Kloaka dan orofaring sebagai inokulum disuspensi dengan Penicillin-streptomycin (200.000 IU) (9:1) dan sebanyak 0,2 ml diinokulasikan pada telur ayam berembrio spesific pathogen free (SPF) berumur 9-11 hari melalui ruang alantois (allantoic cavity). Telur yang telah diinokulasi kemudian diinkubasikan dan diobservasi selama 4-7 hari pada suhu 37 °C dengan kelembaban 60-65 % (OIE 2012). Cairan alantoik dipanen dan diuji keberadaan aktivitas virus dengan uji HA. Jika pada pasase pertama tidak terdeteksi aktivitas virus, cairan alantoik diinokulasikan kembali pada telur berembrio (pasase kedua). Jika aktifitas virus tetap tidak diperoleh pada pasase kedua ini, sample dianggap negatif. Sampel yang telah menunjukkan adanya aktivitas virus pada uji HA dan dikonfirmasi dengan uji HI. Selanjutnya dilakukan ekstraksi RNA virus dan pengujian dengan rRT-PCR terhadap gen matriks (M) untuk meneguhkan jika virus yang terisolasi adalah virus ND dan terhadap gen fusion (F) untuk dapat melihat patogenitas dari virus.
Uji Haemaglutination (HA) metode mikro (OIE, 2012)
(20-15 24 oC). Hasil dapat dibaca setelah 30 menit (temperatur ruang) atau 40 menit pada
suhu 4 oC, hasil positif ditunjukkan dengan adanya aglutinasi dari sel darah merah pada dasar sumuran dari plat.
Uji Haemaglutination Inhibition (HI) metode mikro (OIE 2012)
Uji HI dilakukan untuk menguji virus yang terisolasi dengan menggunakan serum standar Komarov dan B1. Uji HI yang digunakan adalah cara beta yang menggunakan virus dalam jumlah tetap sedangkan serum diencerkan. Phosphat Buffer Saline (PBS) dimasukkan 25 µl ke dalam tiap sumuran plat mikrotiter (V-bottomed wells atau U-bottomed wells). Kemudian 25 µl serum standar dimasukkan pada kolom sumuran pertama.Pipetmulti-channel digunakan untuk melakukan pengenceran dua kali dari sumuran pertama sampai sumuran ke-12. Selanjutnya ditambahkan cairan alantois yang mengandung virus 4 HAU ke setiap sumuran. Secara pelan digoyang dan plat ditempatkan pada suhu 4 oC selama 60 menit atau suhu ruang selama 30 menit. Suspensi sel darah merah 1 % ditambahkan sebanyak 25 µl ke semua sumuran dan digoyang secara perlahan dan ditempatkan pada suhu 4 oC atau suhu ruang. Plat dibaca setelah 30-60 menit, hasil positif dutunjukkan dengan terbentuknya tear drop pada saat plat dimiringkan.
Penentuan Patogenisitas dengan rRT-PCR
Ekstraksi RNA dilakukan terhadap sampel cairan alantois yang positif pada uji HA dan dilanjutkan dengan uij rRT-PCR untuk meyakinkan keberadaan virus ND dari gen Matrix dan deteksi virulensi dari virus dengan melihat keberadaan gen fusion. Pengujian pada gen fusion menggunakan primer forward 4829 ‘5-GTGAGTCTATCCGGARGATACAAG-3’ dan reverse 4894 ‘ 5-AGCTGTTGCAACCCAAG-3’. Probe yang digunakan adalah M 4939 5’ FAM AAGCGTTTCTGTCTCCTTCCTCCA [BHQ-3]’ (CVL 2007).
ANALISIS DATA
16
HASIL DAN PEMBAHASAN
Deteksi dan Isolasi Virus ND dengan real time RT-PCR
Sampel berhasil diisolasi sebanyak 141 ekor unggas dari penampungan maupun pasar unggas yang berasal dari tiga lokasi yaitu Rumah Potong Unggas (RPU), Tempat Penampungan Ayam (TPA) dan Farm di 12 kecamatan (Ule Kareng, Peunayong, Kuta Alam, Lambaro, Blang Bintang, Barona Jaya, Kuta Baro, Ingin Jaya, Darul Imarah, Indrapuri, Mesjid Raya dan Darul Kamal) dalam wilayah Kabupaten Aceh Besar dan Kota Banda Aceh. Sampel usap orofaring dan kloaka dikoleksi dari 35 ekor bebek yang terdiri dari 20 ekor itik dan 15 ekor entok dan 106 ekor ayam peternakan (broiler 50 ekor, layer 46 ekor dan ayam Arab 10 ekor). Hasil empat sampel pool itik menunjukkan dua pool positif orofaring, empat pool positif kloaka dan dua pool positif orofaring/kloaka, sedangkan tiga sampel pool entok menunjukkan dua pool positif orofaring, satu pool positif kloaka dan satu pool positif orofaring/kloaka. Itik memiliki kecenderungan mengekskresikan Virus ND melalui kloaka seperti yang pernah dilaporkan oleh (Saepulloh et al. 2005, Panus 2014). Pada ayam peternakan, sepuluh pool sampel broiler menunjukkan dua pool positif orofaring, sembilan pool positif kloaka dan dua pool positif orofaring/kloaka, sedangkan pada layer dari sembilan sampel pool; tujuh pool positif orofaring, tujuh pool positif kloaka, dan tujuh pool positif orofaring/kloaka. Pada ayam Arab, hanya dua pool terdeteksi pada orofaring dari dua sampel pool dan tidak terdeteksi pada kloaka.
Hasil deteksi dan isolasi terhadap 15 pool (54%) positif VND dari swab orofaring dan 21 pool (75%) swab kloaka yang diinokulasi dan diamplifikasi menggunakan primer matriks menunjukkan bahwa 15 isolat terdeteksi positif yang tersebar di tiga lokasi dari empat kecamatan. Sampel swab diambil dari unggas yang menunjukkan gejala klinis dan subkilinis. Data sampel dan amplifikasi realtime RT-PCR dapat dilihat pada Tabel 2 dan Gambar 4.
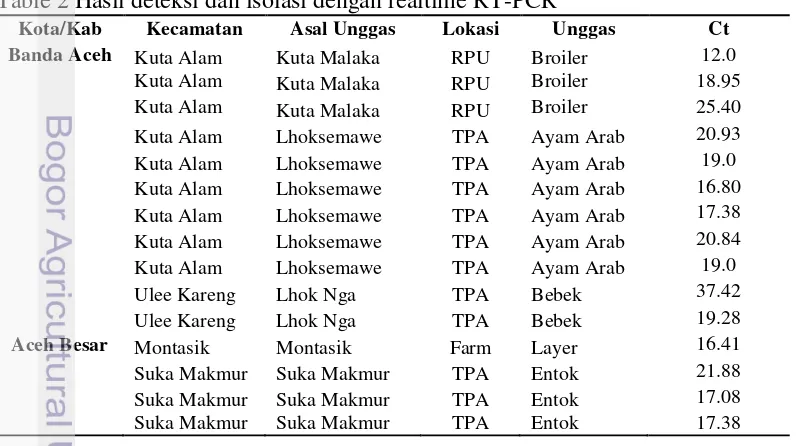
Table 2 Hasil deteksi dan isolasi dengan realtime RT-PCR
Kota/Kab Kecamatan Asal Unggas Lokasi Unggas Ct
17
Pada Gambar 4 garis fase eksponensial memotong garis titik deteksi (threshold) dan berada pada posisi yang berbeda pada fase plateau menunjukkan hasil positif. Sebanyak 15 sampel positif gen matriks dari pengujian dengan real time RT-PCR juga memperlihatkan uji HA cepat positif. Dari hasil tersebut mengindikasikan bahwa real time RT-PCR mampu mendeteksi semua sampel dari berbagai lokasi di tiap kecamatan di kota Banda Aceh dan Aceh Besar. Secara umum, sampel positif menunjukkan nilai Ct (Cycle Threshold) antara 25 dan 37. Semakin kecil nilai Ct maka semakin tinggi konsentrasi virus dan semakin besar nilai Ct maka semakin besar konsentrasi virus. Siklus Ct adalah prinsip dasar dari PCR real time dan sebagai bagian yang sangat penting untuk memperoleh data yang akurat. Nilai Ct PCR real time sangat berkorelasi dengan kuantitas urutan DNA target (Hewajuli et al. 2014)
Pada unggas air dengan gejala subklinis, konsentrasi virus tetap tinggi karena mengekresikan virus meskipun tidak menunjukkan gejala klinis (Kapczynski et al. 2013). Saepulloh, Darminto (2005) melaporkan bahwa unggas air yang terinfeksi VND baik dari galur mesogenik dan velogenik sering bersifat subklinis dan mampu menyebarkan ke unggas lain (carrier). Hasil inokulasi pada TAB juga menunjukkan bahwa hampir semua isolat sampel tidak menyebabkan kematian pada embrio dalam waktu <90 jam, tetapi memiliki titer HA yang tinggi mencapai 27, positif RT-PCR gen Fusion dan mengarah kepada VND virulen.
Sensitivitas dan spesifisitas metode RT-PCR sangat bergantung pada kondisi dan susunan primer, ketepatan dalam penentuan suhu dan waktu untuk denaturasi, penempelan primer (annealing) dan perpanjangan rantai DNA (extension), konsentrasi MgSO4 serta jumlah siklus pada mesin thermocycler. Diperlukan uji coba berkali-kali untuk mendapatkan hasil yang optimum. Salah satu masalah yang sering dihadapi dalam pengembangan metode RT-PCR adalah adanya sikuens nukleotida pada bagian gen tertentu yang sulit diamplifikasi dengan metode PCR standar (first-round PCR). Masalah tersebut umumnya dapat diatasi dengan metode nested PCR, yakni melakukan PCR ronde kedua (second-round) dengan menggunakan primer yang berbeda. Nested PCR dapat
18
meningkatkan sensitivitas PCR sampai 100 kali jika dibandingkan dengan PCR standar (Adi et al. 2011).
Pada real-time PCR analisis hasil amplifikasi fragmen DNA dapat dideteksi dan diukur di setiap siklus, Sedangkan PCR konvensional dilakukan dengan visualisasi di agar elektroforesis. Penandaan fragmen DNA dengan fluorescent dye dan intensitas pita DNA dapat diukur dengan menggunakan mesin digital densitometri. Hal ini berbeda pada PCR real time, jumlah DNA diukur di setiap siklus proses amplifikasi PCR terutama pada fase eksponensial. Deteksi akumulasi amplifikasi DNA pada PCR real time menggunakan probe DNA fluoresen. Walaupun demikian, analisis data hasil kedua prosedur tersebut baik PCR konvensional maupun real time memerlukan normalisasi data terhadap acuan yang diketahui untuk menentukan kualitas awal ekspresi target gen (Hewajuli, NLPI 2014).
Meskipun rRT-PCR merupakan suatu pengujian diagnostik yang sensitif dan spesifik serta banyak digunakan untuk deteksi penyakit secara cepat, tetapi adanya kemungkinan reaksi negatif palsu dapat terjadi. Reaksi ini kemungkinan disebabkan oleh adanya penghambat, ekstraksi virus RNA yang sedikit atau sudah terdegradasi, kesalahan personel laboratorium dalam melakukan pengujian rRT-PCR dan kualitas dari salah satu reagen yang sudah kadaluarsa. Sampel yang diperiksa dapat mengandung substansi penghambat PCR yang memungkinkan menghasilkan hasil negatif palsu. Penghambat amplifikasi PCR dapat dideteksi dengan kontrol internal. Kontrol internal merupakan faktor yang sangat penting sebagai kontrol dari kualitas pengujian sehingga pengujian dilakukan secara benar (Gilbert et al. 2012)
Menurut Hewajuli, NLPI (2014), kontrol positif harus mengandung organisme atau asam nukleat yang dapat dideteksi. Konsentrasi kontrol positif yang digunakan harus mampu memberikan hasil positif yang konsisten. Air atau buffer sering digunakan sebagai kontrol negatif. Namun demikian, kontrol negatif yang bagus adalah sampel yang mengandung asam nukleat selain target untuk mengetahui tidak adanya amplifikasi PCR non-spesifik atau amplifikasi produk. Selain itu, kontrol negatif digunakan untuk menunjukkan bahwa reagen yang digunakan tidak terkontaminasi dengan asam nukleat target.
Deteksi virus ND dengan RT-PCR konvensional
Semua sampel ayam Ras, unggas air, dan beberapa sampel ayam kampung di lakukan amplifikasi pada gen F menggunakan primer 4331F (5-GAGGTT agarose gel 1 % dan TAE yang mengandung ethidium bromide.
19 konsentrasi RNA yang rendah. Ketepatan rancangan primer sangat menentukan sensitivitas dan spesifisitas metode one-step RT-PCR (Gambar 5.). Umumnya, primer yang digunakan adalah berdasarkan sekuen gen virus ND galur Lasota dan B1 yang dapat diakses dari GenBank. Namun demikian, upaya untuk mencari primer spesifik dan mengevaluasinya masih terus dilakukan dikarenakan virus ND adalah virus RNA yang mudah mengalami mutasi (Zou et al. 2005).
Reaksi PCR konvensional biasanya menggunakan satu pasang primer oligonukleotida untuk mengamplifikasi bagian tertentu dari genom agen infeksi serta dilakukan pada suatu tabung. Primer PCR adalah oligodeoksiribonukleotida pendek, atau oligomer yang dirancang untuk melengkapi urutan akhir sekuen dari amplikon target PCR dan digunakan untuk mengawali sintesis rantai DNA. Panjang basa DNA primer umumnya 15-25 nukleotida dan mempunyai 50-60% kandungan guanine ditambah cytocine. Primer yang digunakan dalam PCR ada dua yaitu oligonukleotida yang mempunyai sekuen yang identik dengan salah satu rantai DNA cetakan pada ujung 5’ fosfat dan oligonukleotida yang kedua identik dengan sekuen pada ujung 3’-OH rantai DNA cetakan yang lain. Masing-masing dari dua primer PCR melengkapi untaian tunggal yang berbeda dari target untaian ganda. Namun demikian, primer PCR juga dapat homopolimer misalnya oligo (dT) yang sering digunakan untuk mengawali proses PCR (Hewajuli, NLPI 2014).
Keberhasilan proses PCR juga ditentukan oleh jenis enzim DNA polimerase yang digunakan. Enzim DNA polimerase yaitu enzim yang melakukan katalisis reaksi sintesis rantai DNA. Enzim DNA polimerase idealnya harus tahan panas, mempunyai laju polimerisasi dan prosesivitas yang tinggi. Prosesivitas adalah kemampuan suatu enzim polimerase untuk menggabungkan nukleotida dengan suatu primer secara terus menerus tanpa terdisosiasi dari kompleks primerDNA cetakan. Pada awalnya, PCR menggunakan DNA polimerasi yang berasal dari Eschericia coli. Namun demikian, DNA polimerase ini mempunyai kelemahan harus didenaturasi pada suhu yang sesuai untuk DNA cetakan dan harus ditambahkan di setiap siklus PCR. Beberapa kelemahan lain yang dimiliki DNA polimerase ini adalah tidak tahan panas serta mempunyai laju polimerisasi dan prosesivitas rendah (Yuwono 2006).
20
dilakukan secara otomatis karena penambahan enzim tidak diperlukan di setiap siklus PCR. Walaupun demikian, Taq DNA polimerase dari T. aquaticus tidak dapat memanfaatkan RNA sebagai cetakan dan memiliki aktivitas transkripsi balik yang rendah. Oleh karena itu, digunakan DNA polimerase yang lain, yaitu Taq DNA polimerase dari Thermus thermophilus (Tth DNA polymerase) yang mempunyai aktivitas DNA polimerase yang lebih tinggi untuk proses transkripsi balik RNA. Enzim ini dapat digunakan untuk melakukan RT-PCR molekul RNA sampai ukuran 1000 bp. Beberapa enzim DNA polimerase yang diisolasi dari mikroba extremophilic yaitu Pwo Polymerase, Amylase, Pullanase, Glutamin Synthetase I, Galactosidase dan Ferredoxin diperoleh dari Pyrococcus woesei (Kim et al. 2006). Enzim lain adalah Pfu DNA polimerase yang berfungsi sebagai proof reading DNA polimerase yang diisolasi dari Pyrococcus furiosus. Pfu DNA polimerase merupakan suatu pilihan yang ideal untuk berbagai teknik PCR yang membutuhkan sintesis, tingkat ketepatan yang tinggi dibandingkan dengan enzim lain (Biles et al. 2004).
Faktor lain dalam keberhasilan PCR adalah sampel. Sampel lapang organ dan feses kurang sensitif untuk deteksi virus ND karena mengandung bahan penghambat PCR. Tetapi, sampel yang berasal dari hewan coba sering menunjukkan hasil positif, sehingga swab trakea dan orofaring sering digunakan karena proses pengambilan mudah, lebih sensitif dan mengandung sedikit material organik yang dapat mengganggu stabilitas RNA dan amplifikasi PCR (Gohm et al. 2000, OIE 2012). Untuk itu, nested RT-PCR perlu dilakukan untuk sampel swab kloaka karena mampu menghasilkan produk 216 bp sampel sedangkan swab orofaring dapat dengan pengujian RT-PCR standar dengan hasil produk 365 bp (Mohran et al. 2011).
Deteksi Fragmen Gen F virus ND dengan rRT-PCR
21 Table 3 Pengelompokan virus berdasarkan RT-PCR dan rRT-PCR
Ayam Kampung Unggas Lain
Berdasarkan hasil investigasi menggunakan RT-PCR gen Fusion pada unggas lain menunjukkan semua isolat terdeteksi positif (100 %), akan tetapi dengan rRT-PCR hanya 11 isolat tergolong virulent dan 4 isolat avirulent. Sedangkan pada ayam kampung menggunakan rRT-PCR, 57 isolat masuk dalam kelompok virulent dan 12 isolat avirulent. Enam isolat dari masing-masing dua patotipe tersebut (virulent dan avirulent) tidak dapat di amplifikasi menggunakan RT-PCR konvensional. Ini membuktikan bahwa ayam kampung memiliki keragaman lebih tinggi dibandingkan dengan unggas lain dan rRT-PCR lebih mampu mendeteksi keragaman dibandingkan dengan RT-PCR konvensional. Selain itu, rRT-PCR bersifat lebih akurat, sensitif, dan lebih cepat dibandingkan dengan RT-PCR konvensional karena tidak memerlukan post PCR analisis (gel elektroforesis) sehingga mengurangi terjadinya kontaminasi silang. RT-PCR membutuhkan waktu lama dan keahlian yang lebih intensif (Hairul Aini et al. 2008, Ibrahim et al. 2014).
Deteksi virus ND lebih sensitif menggunakan metode real-time RT-PCR dibandingkan dengan RT-PCR konvensional karena primer-probe gen F yang digunakan dalam rRT-PCR mampu mendeteksi 102-104 kopi RNA dan sedikitnya 10 partikel virus ND. Konsentrasi minimum RNA virus ND yang dibutuhkan untuk RT-PCR dengan primer F adalah 105 (lebih sedikit jika dibandingkan
dengan RT-PCR konvensional) (Wise et al. 2004). Target gen F ini dirancang tidak hanya untuk mendeteksi strain virulen APMV-1 tetapi juga PPMV dan untuk membedakan antara virus dari unggas yang divaksin dan virus lapang virulen, sedangkan target gen M difokuskan untuk mendeteksi VND dari unggas yang tidak divaksin (unggas liar) (Kim et al. 2006).
22
Identifikasi Keragaman Antigenik Dengan Uji Haemaglutinasi Inhibisi (HI)
Titer antibodi terbentuk optimal apabila terjadi penghambatan reaksi aglutinasi dengan menggunakan serum spesifik poliklonal virus ND yang homolog (Miller et al. 2013). Pada gambar 4 dapat dilihat perbedaan afinitas serum B1 dan Komarov terhadap isolat virus dengan variasi titer antibodi, dimana serum B1 menunjukkan titer antibodi yang lebih rendah (4 Log2 - 6 Log2) dibandingkan dengan serum Komarov yang mencapai 5 Log2 sampai 9 Log2. Dikatakan Isolat virus yang positif ND apabila telah mencapai 4 Log2 - 5 Log2 atau dengan nilai 16-32 (OIE 2012). Menurut Sa'idu et al. (2008), kegagalan vaksinasi sering diakibatkan oleh penggunaan galur vaksin yang berbeda dengan virus lapang sehingga tidak mampu melindungi ayam dari infeksi VND. Semakin tinggi titer antibodi pada seekor ayam maka semakin protektif terhadap infeksi VND (Gambar 6).
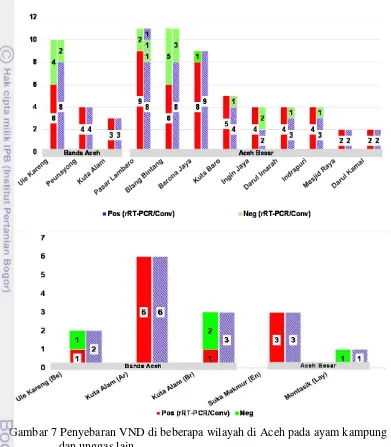
Deteksi Distribusi Virus ND di Wilayah Aceh
Virus ND menyebar hampir di semua wilayah di Aceh pada semua jenis unggas dan tergolong kedalam galur velogenik baik secara antegenesitas maupun genesitas (Gambar 7). Penyebaran VND yang tinggi ini disebabkan tidak adanya penerapan sistem biosekuriti yang baik dan tepat dalam pemeliharaan, pemasaran, transportasi, dan penanganan terhadap unggas mati. Unggas air sering di umbar dan dipelihara dalam satu kandang dengan ayam kampung, pemasaran dan transportasi tidak memadai. Penanganan yang salah dan aseptis terhadap unggas mati merupakan faktor resiko terjadinya penularan baik kontak secara langsung maupun tidak langsung sehingga memicu timbulnya keragaman virus akibat penggunaan vaksin yang tidak tepat dengan galur lapang (Miller et al. 2013).
Serum yang homolog memiliki daya afinitasnya yang tinggi terhadap VND sehingga akan lebih optimal dalam menghambat reaksi aglutinasi oleh VND yang ditunjukkan dengan titer uji HI yang lebih tinggi. Antibodi yang homolog akan mampu mengenali semua determinan antigen dari VND, sedangkan antibodi yang heterolog sebaliknya, hanya dapat mengenali beberapa determinan antigen VND. Meskipun vaksinasi menggunakan galur heterolog dengan virus lapangan
0
23 dapat menggertak produksi antibodi dalam jumlah besar tetapi tidak mampu menahan kecepatan replikasi dari VND karena rendahnya afinitas serum terhadap virus, sehingga ayam tetap akan terinfeksi dan mengeluarkan virus ke lingkungan (Miller et al. 2013, Panus 2014).
24
SIMPULAN DAN SARAN
Simpulan
Penyakit ND masih endemik di Aceh dan menyebar di 12 kecamatan. Pada bebek infeksi sering bersifat subklinis dan mampu mengekskresikan virus virulen dari orofaring dan kloaka sedangkan ayam hanya mampu melalui orofaring. Virus ND yang bersirkulasi di Aceh masih sangat beragam baik secara fisik, antigenik dan genetik. Karakteristik 15 Isolat yang berasal dari bebek dan ayam peternakan lebih homogen atau tidak beragam dibandingkan dengan ayam kampung yang lebih beragam dan mayoritas virulen. Metode RT-PCR konvensional maupun realtime secara umum bisa digunakan untuk identifikasi VND, tetapi keanekaragaman genetik VND juga dapat dilakukan dengan pengembangan teknik diagnostik lain menggunakan PCR. Semua isolat memiliki afinitas lebih tinggi terhadap serum Komarov (93.33%) dibandingkan dengan serum B1 sehingga vaksinasi ND pada ayam peternakan kurang optimal akibat perbedaan penggunaan galur vaksin dengan virus lapang.
Saran
25
DAFTAR PUSTAKA
Adi, AAAM, Kardena IM, Astawa NM, Putra KSA, Hayashi Y dan Matsumoto Y. 2011. "Kloning, Sikuensing dan Analisis Filogenetik Gen Nukleokapsid Protein Virus Tetelo Isolat Bali-1/07." Jurnal Veteriner. Vol. 12 No. 3: 173-179.
Ahamed, T, Hossain KM, Billah MM, Islam KMD, Ahasan MM dan Islam ME. 2004. "Adaptation of Newcastle disease virus (NDV) on vero cell line." International Journal of Poultry Science. 3(2): 153-156.
Alexander, DJ. 2000. "Newcastle disease and other avian paramyxovirus." Rev. sci. tech. Off. int. Epiz. 19(2): 443-462.
Alexander, DJ dan Senne DA. 2008. Newcastle disease. other Avian paramyxovirus and pneumovirus infections: Newcaste disease. Di dalam: Y Saif, editor. Book title. Ed ke- 12. Iowa (US), Iowa State University. hlm 75-115.
Ashraf, A dan Shah MS. 2014. "Newcastle Disease: Present status and future challenges for developing countries." African Journal of Microbiology Research. 8(5): 411-416.
Biles, BD dan Connolly BA. 2004. "Low-fidelity Pyrococcus furiosus DNA polymerase mutants useful in error-prone PCR." Nucleic Acids Research. 32(22): e176-e176.
Briand, FX, Henry A, Massin P dan Jestin V. 2012. "Complete genome sequence of a novel avian paramyxovirus." J Virol. 86(14): 7710.
Cattoli, G, Susta L, Terregino C dan Brown C. 2011. "Newcastle disease: a review of field recognition and current methods of laboratory detection." J Vet Diagn Invest. 23(4): 637-656.
CVL. 2007. Standard operating procedure for real time polymerase chain reaction detection of virulent Newcastle disease virus in clinical specimens. Tanzania, Central Veterinary Laboratory: 1-12.
De Leeuw, O dan Peeters B. 1999. "Complete nucleotide sequence of Newcastle disease virus: evidence for the existence of a new genus within the subfamily Paramyxovirinae." J Gen Virol. 80 ( Pt 1): 131-136.
DISNAK. 2012. Laporan Tahunan Dinas Peternakan Tahun 2011 DISNAK. Aceh Besar (ID), Dinas Peternakan Kabupaten Aceh Besar.
Dortmans, JC, Rottier PJ, Koch G dan Peeters BP. 2010. "The viral replication complex is associated with the virulence of Newcastle disease virus." J Virol. 84(19): 10113-10120.
EFSA. 2007. Regarding a request from the European commission to review Newcastle disease focusing on vaccination wordwide in order to determine its optimal use for disease control purpose. The EFSA Journal, European Food Safety Authority. 477: 1-24.
Fazel, PD, Khoobyar S, Mehrabanpour MJ dan Rahimian A. 2012. "Isolation and differentiation of virulent and non virulent strain of Newcastle disease virus by polimerase chain reaction from commercial broiler chicken flocks in Shiraz-Iran." Int. J. Anim. Veter. Adv. 4(6): 389-393.
26
Bolortuya P, Cardona CJ, Leung CYH, Peiris JSM, Spackman E, Swayne DE dan Joly DO. 2012. "Highly Pathogenic Avian Influenza Virus among Wild Birds in Mongolia." PLoS ONE. 7(9): e44097.
Gohm, DS, Thur B dan Hofmann MA. 2000. "Detection of Newcastle disease virus in organs and faeces of experimentally infected chickens using RT-PCR." Avian Pathol. 29(2): 143-152.
Hairul Aini, H, Omar AR, Hair-Bejo M dan Aini I. 2008. "Comparison of Sybr Green I, ELISA and conventional agarose gel-based PCR in the detection of infectious bursal disease virus." Microbiol Res. 163(5): 556-563.
Hewajuli, DA dan NLPI D. 2014. "Perkembangan Teknologi Reverse Transcriptase-Polymerase Chain Reaction dalam Mengidentifikasi Genom Avian Influenza dan Newcastle Diseases." WARTAZOA. Vol. 24(No. 1). Hoffmann, B, Beer M, Reid SM, Mertens P, Oura CA, van Rijn PA, Slomka MJ,
Banks J, Brown IH, Alexander DJ dan King DP. 2009. "A review of RT-PCR technologies used in veterinary virology and disease control: sensitive and specific diagnosis of five livestock diseases notifiable to the World Organisation for Animal Health." Vet Microbiol. 139(1-2): 1-23. Huang, Z, Panda A, Elankumaran S, Govindarajan D, Rockemann DD dan Samal
SK. 2004. "The Hemagglutinin-Neuraminidase Protein of Newcastle Disease Virus Determines Tropism and Virulence." Journal of Virology. 78(8): 4176-4184.
Ibrahim, WA, Abd El-Ghany WA, Nasef SA dan Hatem ME. 2014. "A comparative study on the use of real time polymerase chain reaction (RT-PCR) and standard isolation techniques for the detection of Salmonellae in broiler chicks." International Journal of Veterinary Science and Medicine. 2(1): 67-71.
Kapczynski, DR, Afonso CL dan Miller PJ. 2013. "Immune responses of poultry to Newcastle disease virus." Dev Comp Immunol. 41(3): 447-453.
Kary, M dan Fred F. 1987. [21] Specific synthesis of DNA in vitro via a polymerase-catalyzed chain reaction. Di dalam: W Ray, editor. Book title. Ed ke-, Academic Press. hlm 335-350.
Kencana, GAY, Kardena IM dan Mahardika IGNK. 2012. "Peneguhan diagnosis penyakit Newcastle disease lapang pada ayam buras di Bali menggunakan teknik PCR." Jurnal Kedokteran Hewan. 6(1): 28-31.
Kencana, GAY, Kardena IM dan Mahardika IGNK. 2012. "Peneguhan Diagnosis Penyakit Newcastle Disease Lapang Pada Ayam Buras Di Bali Menggunakan Teknik RT-PCR." Jurnal Kedokteran Hewan. Vol. 6. Kim, LM, Afonso CL dan Suarez DL. 2006. "Effect of Probe-Site Mismatches on
Detection of Virulent Newcastle Disease Viruses Using a Fusion-Gene Real-Time Reverse Transcription Polymerase Chain Reaction Test." Journal of Veterinary Diagnostic Investigation. 18(6): 519-528.
Kim, LM, King DJ, Suarez DL, Wong CW dan Afonso CL. 2007. "Characterization of class I Newcastle disease virus isolates from Hong Kong live bird markets and detection using real-time reverse transcription-PCR." J Clin Microbiol. 45(4): 1310-1314.