PERBANYAKAN DAN
PELESTARIAN
PLASMA
NUTFAH
TALAS
(Cohcasria
esc&n&
(L.)
Schott)
SECAIU
IN
WTRO
OLEH :
NURWITA
D E W
PROGRAM PASCA SARJANA
INSTITUT
PERTANIAN
BOGOR
NRWITA DEWI. Perbanyakan dan Pel& Plasma Nutfah Talas (Colocasia
esculenta (L.) Schott)
Seaam
In Vitro. Dibrmb'i olehBAMBANG
S-PURWOKO,AGUS PURWITO clan IDA W A N D A SOMANTRI.
Penggunaan metode kuitur jaringan
untuk perbanyakan
dan penyimpanan plasma nuthh sangat k g m a h i tanamm-mmmm yang diperbanyak secara vegetatif termasuk &las. TelrnoIogi konservasi in vitro penerapannya belurn banyak diIakukandan mash memiukan penelitian d~hndingkan teknik pelestarian pIasma nutfah konvensional. Penelitian dilakukan dalam dua tahap kegiatan, yaitu kegiatan perbanyakan in vifro dan kegiatan konservasi in vifro dengan tujuan untuk memperoleh metode perbanyak*
dan
penyimpanan talas dengan rnanitol sehingga dapat digunakan untuk pelestarian plasma nutfah talas Indonesia. Dalam kedua kegiatan digunakan ran&ngan acak lengkap dua faktor, yaitu perlakuan media sebagai hktor pertama dan asesi trtlas sehagai hktor kedua. Perlakum jenis mediauntuk percohaan perbanyakan adalah rraedia MS,
MS
+ 2.9
pM
I A A + 4.4M
pBA danMS
+
2.9pM
IAA+ 22.2
pM BA, sedanpkan jenis media untuk percobam konservasi adalahMS,
MS+
manitot 30 g/I, MS+
manitol 40 g/ldan
MS+
rnanitol 50 gn. Perlakuan asesi untuk kedua kegiatan adaiah talas No. 2 1,No.
586,No.
503, T a b Jahe dan Lumbu Banten. Hasil percobam perbanyakan rnenunjukkan bahwa penambahan Asam Idol-3-asetat (IAA) dan 6-Bemiladenin (BA) pada media MS meningkatkan jumhh anakan talas. Pada konsentrasi IAA yang sama (2.9 pM) penambahan konsentrasi BA sampai taraf 22.2pM
meningkatkan jurnlah anakan talasNo.
2 1,No.
586, sedangkan pada taraf 4.4 p M dapaf meningkatkan jumlah anakm No. 503, Talas Jahe dan Lumbu Banten. H a i l percotman konservasi rnenunjukkan tanaman yang diimpan &lam media kontrol (MS) tumbuh Iebi cepatdibanding tanaman pada media yang ditambah manitol. Semakin t inggi konsentrasi
d o 1 tanaman semakin pendek, &or jumhh akar menurun, jumlah
anakan
clan persentax dam hidup m e m a t , serta ukuran daun semaki kecil. Terdapat perbedaan respon pertumbuhan antar asesi yang dicoba dalam media konservasi Media dengan konsentrasi manit01 40 g/l merupakan media yang sesuai untuk konservasi plasma nutfahtalas.
Kelima asesi talas yang diuji dapat dishpan selamaSURAT
PERNYATAAN
Dengan ini saya menyatakm Wwa tesis yang hjladul
PERBANYAKAN
DAN
PELESTARIAN PLASMA NUTFAH TALAS(Colocasio mulenda
(L)
Schott) SECARAIN
FITROa d a h benar mrupkan hasid karya saya sendiri dan belum p e d dipublhsdcan
Semua s u n k data dan informasi yang digunakan telah dinyatakan
secara
jelasdan
&pat diperiksa
ke
benammya.Nurwita Dewi
PERBANYAKAN
DAN
PELESTARIAN
PLASMA NUTFAH TALAS
(Colocasia
esculentn
(L.) Schott)
SECARA
IN
WTRO
NURWITA DEW1
Tesis
salah satu syarat untuk memperoleh gelar Magister S hpada
Program Studi Bioteknologi
PROGRAM
PASCA SARJANA
Judul Tesis : Perbanyakan dan Pelestarian Plasma Nutfah Talas (Colocosia esculenta (L.) Schott) Secara In Vitro
Nama Mahasiswa : Nurwita Dewi
NRP : 98.414
Program Studi : Bioteknologi
Menyetujui,
1. Komisi Pembimbing
Dr. Ir. Barnhang Sapta Purwoko. MSc Ketua
b&
Dr. Ir. &us Purwito, MSc Dr. Ir. Ida H m i d a Somantri MS Anggota
2. Ketua Program Studi Bioteknologi 3. Direktur Program Pasca Sarjana
da Manuwoto, MSc
RIWAYAT HlDUP
Penulis CIlhMm
. .
di Bogor dagai tmak pextam dari b q d Terteog Swarmandm ibu W d Pendidikan sarjam ditempuh di Jurusan Agronomi,
F a k W
Pertanian, Institut Pertanian Bogor p m h tahm 1983 dan l hpada
tahun 1987. Atasb e a s i dari PAATP Badan Litbang Pertaaian, Departemen Pertanian, maka polda tahun 1998 penulis melanjutb jenjang pendidikan pada Program Studi Bioteknologi, Program Pasca Sajanxr, Institut Pertanian Bogor.
Permlis pernah kkerja sarm deogan para petani untuk mnhgkatkan produksi kedelai di pedesaan di W t a n Eromoko, Woaogki, Jawa Tengah, krsama dengan tim Soy- Yield Gap Andy&, Project, ESCAP-CGPRT Center, pada tahun
1988-1WO. Sejak tahun 1990 penulis bekerja di
El&
Penelitian Tamman Pangan Bogor (sekamng Balai Penelithn Bicteknohgidm
Sumkdaya Genetika Pertanian)sehagai pemulia kedelai
sampai
tahun 1995. Sejak 1995 sampai sekarang menangani karaktmhsi, evsluasi dan konservasi plasma nutfah kedelai di Kelompok Peneliti Sumberdaya GenetikaAhanddillah, =gala puji d m syulnrr pnuh pmjdian
ke
khradiarlt AUahS W T ~ r a b m a t d a n k a r u n b N y a s e h i n g g a p e n u l i s d a p t ~ ~ ~ yang bejudd "Perbanyakan dan Pektariau Plasma Nut% TaIas (CoIocmia
esculenta (L.) Scbtt) Secara In Vitro7',
Ucapan terirna kasih yang sebesar-hamya penulis
&
k
Dr.
Ir.
Bambang
S.
Purwoko, MSc,Dr.
Ir. Agus Purwito, MScd m
Dr. Ir. Ida Hanarida Somnmii,MS,
atas segalab
i
dan p g m h m dalam perencanaan clan pelaksanaan penelitian serta penulisan tesis. Ungkapan terimkasih
juga penulissampaikaa kepda Ketua Kelti Sumberdaya Genetik, Kepeda Balitbio, k p d a
WLmgtan, K q d a Badan Litbang Pertank atas kesemptan yang
~~
sehubungm dengan. .
masa belajars a q 4
akhir penelitian penulis di Insthit Pertaniarl Bogor. Dertliiuan pula atas dukungan dana penelit'i dari PAATP Badan Litbang Pertanian dmdana
penelitian ARMP dari Ir. Ketty Suketi,MS.
Ucapan terima kasih yang tak terhingga penulis
~~
kepada kedua orang tua permlis (Bapk Tateng dan Ibu Wiarsih),Bapk
Guaawm clan Ibu Murtrhah, dik Wini,dik
Ihsan, mas Budi M o j o , Fiko dm Iska atas segaladukungan d m do'a yrlng tak putus-putusnya selama penulis melanjutkan studi.
Penulis pun m y a m p a d m terima kasih kepada:
1. Bapak Dr. Sutrisno, Ketua Kelti Biologi Molekuler, beserta s@ yang telah memberi kesempatan kepada penulis untuk ukmelaksanakan penelitian
di
Lab
Kultur Jaringan
2. Rekan-rekan
di
Kelti Sumberdaya Genetika atas dukungannya s e h pen& melanjutkan studi. Ibu Minantyorini, ibu Hadiatmi, pak Ngatimin ataspenyediaan e k s p h
3. Dr.
Ika
Mariska dan seluruh staf Kelti Reproduksi clan Pertumbuhan atasdiikusinya yang hangat
4. Ibu Novianti, mbak Iswari, ibu Yusnita, pak Dwi Hapsoro, mbak Dedeh, mbak Rostika, mbak Mitri, mbak Nanas, mbak Vivi, pak Priatm, mas Heri dan mas Deden atas segala bantuannya
5. Rekan-rekan di Program Studi Bioteknobgi atas perdabatan dan dukunganny a
6. Semua pihak yang telab memhikan bantuan dan dorongan kepada penulis selama penulis mengikuti peradidhn, melaksanakan penelitian dan rnenyelesaikan tesis.
Penulis berhamp semoga tesis ini bermanfaat bagi yang membutuhkamya
Bogor, Juni 2002
Ringkasan
a d s i s ragam pengaruh asesi talasdan
media perbanyakanterhadap
jumlah
makan... ... . ..
..
. .. .
.
..
..
. . . . ... . ... .. . .. ... . . . .. ..
. . ..
..
.
. .
....
23Pmgaruh asesi tdas dm media perbanyakan terhadap jumlah anakan
. .
.
.
.
.
23Ringkasan mahiis ragam pengaruh mesi
dan
komntmi rnanitol terhadap 26 peuhah-peubolh yang d-ti.... . .
.
. .
. . .
.
.
. . .
. . .
. .
.
...
Pengaruh konsentrasi manitol terhadap tinggi tanaman (4 MST)
. . . .
.
. . .
..
27Pengaruh aseesi talas terhadap tinggi tanatl.lan (4 MST)
.. . .
.
.
.. . .
.
27Pengaruh
as&
talas dan konsentrasi manit01 terhadap tinggi tanaman(8-24
MST)
... ...
...
....
....
... . .. ... ... .. .
...
..
,.. . ... ... .. . .. . . .. ..
. . .. .. ..
.. .
28Pengaruh asesi talas dan konsentrasi manitol terhadap skor jumlah akar
. . .
3 1Pengaruh asesi
talas
dm konsentmi manitol terhadap persentase daun 33hidup
.
. . .
. .
.
. . . .
. . .
.
. . . ... . .
.
. . .
.
.
.
.
Pengaruh asesi talas
dan
konsentrasi Manitol terhadap jumlah anakan. . .
.
36Umbi anakan talas
...
22T a b pada media perbanyakan MS(A), MS+2.9
NM
IAA+ 4.4 pM BA 25...
(B),
d m
MS+-2.9 pM IAA+ 22.2 pM BA (C).
.
....
Penampiian tanaman talas dalam krbagai k o d manit01
pada
umur 6 bulan. (A)MS,
(B)
MS+mmitol 30 gll, (C) MS+manitol 40 gll,(D)
27 MS+manitol50 g/lHistogram pxqanh asesi tdas dan k o d manitol terhadap
persentase dam hidup pada berbagai umur simpan
...
29Sebaran perakaran talas di dalam media @a hbagai konsentrasi
manitol
...
32Histogram pengaruh asesi talas dan konsentrasi manit01 terhadap
persentase
daun
hidup pada berbagaiurnur
simpan...
34PenampiIan tanamm tabs pada media
MS
+
manit0140 d ( 2 4 MST)...
35Histogram pengaruh asesi talas dan konsentrasi rnaritol terhadap jumlafr anakan pada berbolgai umur simpan
...
371. Komposisi bahan kimia dari d i a
MS
(Murashlge dan Skoog 1 962). . . .
. . .
5 12. Analisis ragm jumlah anakan dalam media perbanyakan urnur 4- 16 MST 52
( ~ fVxM.5). o
. . .
~. . .
. . .
. . .
. . .
. . .
. . .
3. Analjsis ragam tinggi tanaman yang diionserva~i umur 4-24 MST
. .
. .
,. .
.
.
.
. .
534. Analisis ragam skor jumlah akar tanaman yang dikonservasi umur 4
-
24MST
...
.,...
545. Analisis ragam p n edam hidup tamman yang dikonservasi umur 5 5
4-24 MST
.. . .
.
. .
,.
. .
.
.
. . . .
.
. . . ....
.
.
. .. . .
.
.
. . .
. .
.
. . . ...
6 . Analisis ragm jumlah anakan tartamrln yang dikonservasi umur 4-24 MST 56
PENDAHULUAN
Latar Behkasg
Tahs (Colocasia escdenta)
~~
tan- umbi-umbian yang dapatdijumpai hampir di seluruh kepulauan
di
M o d
Urnbinya W u n g 1.9%protein (Horton 1988), lebih
tinggi
h idengan ubikayu
(0.8%)dan
ubi
jalar (1 -8%) ( Wargiono 1 980), meskipunkandungan
karlmhdmhy (23 -7%) (Sutari1999) lebih sedikit dibmdmgkafi dengan ubi kayu (37.8%) clan ubi jaler (27.9 %)
(Wargiom, 1980). Seluruh bagiian tanman dapat dikonsumsi T a b telah lam
d i k e d dan sudah biasa dikonsumsi oleh m a q m h t sehingga umbi
talas
dapatdijadikan sumber hubohidrat
ahematif
yang p o t d untuk divenXkasirrrakanan
pkok Sampai saat ini produksi talas di Indonesia mash sangat rendah bila
d i W i dengan ubi jalar dan ubi kayu karena budidaya
talas
masih merupakanusaha sampingan bagi petani Sehh itu talas juga hanya ~ ~ ~ e r u p k a n makanan
tambaban kecuali di Kepulauan Mentawai (Yusuf et
at.
1996) dan di irian Jaya(Sahari et al. 1997).
Talas umumnya diperhanyak secara vegetatif dengan menggunakan umbi utuh
(cormus), potongan umbi, umbi makan (cormel), a d a m atau stolon Perbanyakan
tanarnan secara generatif d t dilakukan ka-ena pembungaan jarang tejadi,
b d ~ h
bebrapa kultivar tidak krbunga (Sarono 1 978). Cara perbanyakan vegetatif tidak
dapat mengatasi serangan penyakit
virus
sepertidasheen
rnozaic
virus ( D m ) ( V o hmeristem tahs sqxrti yang &porkan
OM
Kartha (1986) dan W ' ' 4er et al.(1993).
Keberhash kukur in vitro tergantung pada genotipa, eksplan yang
digunakan,
jenis rm&,
zat
pengaturtumbuh,
dm
lingkungan tumbuh kuttur. Faktor-Wr hidapat d u g k i n t e n h i sehingga perlu dilakukan penehtian untuk meadapatkan
m o d e yang t e p t untuk memperoleh pertumbuhan dan perkembangan tammn
kultur yang optimal.
Indonesia menipakan negara yang mediki keanekaragaman genetik yang bras,
terinasuk keanekaragaman plasma nutfah talas & e b t dan Aradhya 1991; Irwin et al.
1997; Suketi et al. 2000). Plasma nutfah sangat berguna di
dalam
programpemuliaan tanaman, terutarna s e w flunber gen untuk mmperhaiki sifat-sifat
penting pada tanaman. Sampai saat ini umumnya p& nutfah talas mash disimpan
secara ex-situ di kebun koleksi. Cara ini memiliki risiko terjadiiya kehilangan
genotipe tanaman karena cekaman lingkungan, baik biotik
(hama
dan penyakit)maupun abiotik (kekeringan, kehanjiran) serta memerlukan lahan yang luas
dan
tenaga kt:rja yang banyak.
Penggunaan metode kultur jaringan untuk perbanyakan dan penyimpamn plasma
nutfah sangat krmanfaat bagi tanaman-tanamstn yang diperbanyak secara vegetatif
seperti ubi kayu, ubi jalar, Dioscorea sp. dan
talas,
karena daiarn mempertahankankoleksiiya tanaman-tanaman tersebut harm setiap
sun
ditanarn di kebun Berthaud(1977) menyarankan penggunaan metode penyimpanan in vitro untuk jellis tanaman
hum
clan
&pat d @ b &seam
c e p t bib sewah-waktu diprhkau (Nitche1988).
Meskipun konservttsi in vilro -@ b y a k keunggulan dilbandingkan
tekmlogi konvensional, m u n sampai saat
iai
penerapannya belum baayakdihkuhm Hal ini disebdhn teknologi konservasi in v i m
ks&
khusus atauspesmuntuk spesks
tmaman,
babkan
untuk bebrapa jenis tamman kekhususan itusampai pada tingkat varietas (Mariska et al. 1996). Selain itu metade penyimpanm
secara in v i m mas& memerlukan peaelitian d i h d h g h n dengan teknik pelestarian
plasrna nutfah biji (ortodoks) di ruang dingin yang
urmunnya
sudah mapan( Wattimena
dan
Mattjik 1 992)..
*Strategi yang diterapkan dalam p e n y h p n m in vitro iahh mermnunalkan
pemmbuhan jaringan k u k , -em viabilitas kultur dm stattilitas
genetiknya. Berbagai metode dapat digunakan untuk menghambat pertumbuhan
kultur =lama penyimpanan seperti perlakuan
suhu
rendah (Hu dan Wang 1983;Withers 1985),
penambolhan
senyawa-senyawa retardan sepati cycocel ancymidoldm p a c l o b u ~ l (Withers 1985), -an garam-garam mimral atau sukrosa
(Schnapp
dan
Preece 1986), dan penggunaan stabilisator osmotik seperti manitol dansorbitol (Wdhers 1985).
P e n a r n b manitol pada media mempengaruhi tekanan osmotik media
se-a mempengaruhi pertambahan tunas dan perpanjangan batang. Beberap
jenis ubi jalar dan ubi h y u teiah berhasil dikonservasi dengan menggunrtkan manitol
(Sunarlim et al. 1999), demikian pula talas (Staritsky er al. 1987; Bessembinder et al.
Tnjuan
Penelitian ini bertujuan uniuk mendapatkan rnetode perhanyakan dan
perryimpanan hias secara in vih-o dengan d o 1 sehingga dapat dig-
untuk
pelestarian plasma nut&
talas.
Hipot-is
(1) Penambahan &Bensiladenin (BA) pada media dapat mnhgkatkan jumlah
anakan talas
(2) Plasma nutfah t a k dapat d i s i
dalam
jangka waktu 6 1 2 bulan secara inv i m dengan menggumkan konsentrsi d o 1 tertentu
TWJAUAN
PUSTAKA
Botani dan Kegu naao Tallrs (Col~~asia escuknta
(L.)
Schott)Talas (Colocasia esculenta (L.) Schott) r n e r u p h tanaman semusim yang
term&
famili
Amceae, subfamili
Colocasioideae, dengan jurnlah set kromosom x= 14. Tabs diperkirakan berasal dari Asia Tenggara atau Asia Tengah bagian
Selatan Ada dua tipe taIas yaitu tipe eddoe yang dikenal sebqai C. esculenta var.
antiquorum (Schott) Hubb.
dan
Rehder clan tipe dashen (C. esculenta var. esculenta)(Flach dan Rurnawzls 1996). Di Indonesia talas dapat dijumpai hampir di seluruh
kepulauan dm tersebar dari p t a i sampai
ke
pegunungan sampai dengan 1 000 m diatas pennukaan hut, baik liar maupun
dibudidayakan
(Direktorat Bina Produksi1982). Keragaman genetik antar kultivar talas belum banyak diketahui ( L e b t dan
Aradhya 1 99 1 )
.
Talas merupakan tanaman herbaceous yang tingginya dapat mencapai lebih dari
1 meter. Sistem perakarannya adventif, berserabut dan berada di dekat permukaan
tanah (dangkal). Batang di bawah tangkai daun y q terietak di dalam tanah
berfimgsi sebagai cadangan makanm (corm) dan memiliki kuncup lateral yang akan
tumbuh menjadi c o m l , sucker atau stolon. Daun talas merniliki tangkai dam yang
panjang dan besar, berbentuk hati dengan panjang 20-50 crn. Bunga talas terdiri atas
tangkai, seludang (spathe) dan tongkol (spadix). Bunga jantan dan betinanya
berukuran kecil dan letaknya saling terpisah, yaitu bunga ktina yang IXI+WWI hijau
terletak di bagian pangkal dan bunga jantan di bagian ujung. Bunga jantan dm
akan tetapi
adanya
lalat Drosophihk amattejadinya
pen*sendiri yang merata Buah
talas
dapatdipanen
30-40hari
setelahdm
um~rmrya
dihasillran
200-500
butir pert~ogkol
buah
(lhddi 1978).Pada urn- talas -banyak
seami
vege#ifdmgm menggunakan potorganumbii umbi utuh, corael,
anakan
atau stobn. Manshuri el al. (1997) melaprkan, pertmyakanh
l
b
i
t
tdas dengan potongan rhizomdan
c o r d danirisan
mta umbi induk dapat m n i q k d m jumlah
W
i
yang diperokh tanpa~ ~ ~ b b o t u m b i ~ j a n g u m b i ~ ~ ~ y s l n g
dbsiilltan dibandingkan d-an bibit yang
berasal
dari rhizom dan c o r n 1utuh
Talas m w u p h tmamm A m g u m Sehlnlh bagiau mlmmn dapat
dikonmmsi Umbinya dapat direbus atau digoreng, daun dan t a q h
daun
dapat
dikonsumsi sebagai sayuran. Umbi
talas
mengandung 17-28 % amilosa Pati dariumbi talas sangat mudah dicema sehingga baik digunakan untd tepung IHakanan
bayi. Umbi
talas
&pat d i i cIaIam campuran inakammternak
dan sebagaiaditif
dalam
pembuatan plastik biodegradable. Dam talas rneru- makanan yangkaya g E , diddanqa terkandung 23 % protein, k a l s i i fosfor, ksi, vitamin C ,
provitamin A, tiamin, riboflavin
dan
niasin (Food and Agricdture Organization ofThe United Nations 1987). Beriawanan dengan kegmamya, sampai sad ini
di
lndonesia ptensi talas belum d h d a a t k a n dengan baik.
Di bebadpa negara di Kepulauan Pasif& terms& Hawaii drln Papua New
Guinea, tab m p a k a n makman
pkok
Di Idoaesia talas menipdm makananpokok di Kepulauan Mentawai (Yusuf
er
al. 1996) dandi
lrian Jaya (Sahari er al.Perbmyilmn dan Konsewasi Phsma Natfah S w r r
In
V i iKdtur jarhgan atau kuhur in vitro a d a l d ~ t e k d mengisolasi dan menumbuhkan
k g i i b a g i tanaman baik organ, jaringan, sel, ataupun protoplasma
secara
aseptikdalam d i a buatan yang kaya nutrisi dan zat pengatur tumbuh, dalam wadah yang
tembus cahaya serta lingkungan tisi y m g terkendali. Metode perbanyakan in vitro
dapat d i u k a n melalui (1) rnultiplikasi tunas dari mata tunas aksikr dan (2) melalui
pembentukan tunas adventif secara @sung atau tidak langsung. Metode
mdtiplikasi tunas banyak digunakan karena cepat clan d t mengalami
penyimpangan genetik (Annini el al. 1992).
Menurut Gunawan ( I 988) tahap-tahap pelaksanaan kultur jaringan meliput i:
p i a p a n media, isolasi hahan tanarrmn, sterilisasi eksplan, induksi eksplan,
mengkulturkan, aklimatisasi dan usaha pemhdahan tanaman hasil kuttur jaringan ke
lapang. Keberhasilan pertumbuhan dan morfogenesis tanaman dalam kultur jaringan
ditentukan oleh genotipe eksplan, komposisi media, lrngkungan fisik kultur dan
fisiologi jaringan eksplan (Armini el a/. 1992). Perbanyakan tammm secara ir! v i m
memiliki brbagai keunggulan yaitu tanaman dapat diperbanyak setiap saat tanpa
tergantung musim karena d i u k a n di ruang tertutup, kecepatan p e r b a n y h y a
tinggi, tanaman yang dihasilkan seragam, bahan tanaman yang digunakan sedikit, dm
dapat rnenghasilkan tanaman yang kbas penyakit (Armini et a!. 1992).
Plasma nutfah mrupakan sumber k e r a g m genetik bagi perbailtan kualitas dart
koleksi q a r
t d d a r dari kepunahaa, serh dijaga agar tetap hjdup baik dahmPelestarian (konservasi) plasma nut& dapat dU&m secara in-situ di
habitatnya atau ex-situ di lw habitatnya Silitonga (2001) juga mmyatdm perlunya
dilakukan
pelestarirrn plasma n&secara
on-farm yaitu peles&rian denganmengemhmgkm w u jenis p d a areal pertamm K o d in-situ dapat
dhkukm
di
s u h alam (cagar alam). Konservasi ex-situ clapatdilakukzn
secara
konvensional di kebun raya, kebun kokksi, meMui penyimpanan benih mupun
secara in vipo melalui kultur jaringan. B e h p
cara
dapal d g u d a mpada
penyimpanan meuui kdtur in vilro antara lain (1) penyimpm rnehhIi
pertumbuhan minimal atau pertumbuhan lambat
dan
(2) penyimpanan denganpembekuan (kriopreservasi). Bdaarkan jangka waktu penyimpmq konservasi in
vitro dibagi menjadi dua bagian, yaitu ( I ) penyimpanan jangka pendeklmenengah
dengan tujuan m e n e b pertumbuhm untuk sementara waktu, dhlmkan dengan cara
pertumbuhan h h t
dan
(2) penyimpamn jangka panjang dengan cara krbpreservasi dimma aktivitas metabolism sel diherrtikan tapi 4-sel tidak mati.Teknik kultur jaringan dalam konsemasi plasma nutfah bemanhat untuk (1)
tanaman yang berbiji rekalsitran seperti kelapa, kakao, rambutan, mangga dan
avokad,
dan
(2) tamman yang ti& berbiji (memiliki biji berviabilitas rendah), dan(3) tanaman yang dipbanyak seam vegetaiif (Imelda dan Soetisna 19!X2), seperti
ubi kayu, ubi jalar, pisang, Dioscorea dan talas. Teknik ini clapat mengatasi nwd&
Tanaman basil kuttur jaringm yang bebas patogen
~~
pertukozranp h nutfah htmmsional (Staritsky er al. 1986; MiUer-Jams dan Howell 1986),
khususnya untuk tanaman-tanamrmn yang
diperbanyak
dengan stek atau padatamumn-tammm yang me& biji yang &pat menyebarkan
virus,
m y akentang (Pltlcktt et a/. 1987).
Usaha peIestarian in vitro akan berhasil apabila memperhatikan kestabh
genetik dari 'koleksi yang d i s i Jenis kultur tertentu mklnya kuftu sel
dan
kultur
kalus kurang stabil
dibandingkan kultur laimp terhadap variasi somaklonal.Untuk menghindari ketidakstabh genetik, peles&rian in v i m b i y a
menggunakan kultur embrio, tunas dan planlet (Withers 1 99 1).
Kom posisi Media Perban yalrao
Untuk memperoleh pertumbuhan optimal
dari
jaringan yang ditanarn secara invitro diperlukan media tanam dengan komposisi nutrisi yang tepat. Umumnya media
kuhu jaringan dibedakan menjadi media dasar dan media p r h k ~ ~ n . Media dasar
terdiri dari umur hara makro @I,
P,
K, Ca,Mg
dan
S), unsur hara mikro (Fe, Mn,Zn,
Cu dan Mo), vitamin (thtamin,
asam
nikotinat dan piridoksii, myo-inositol, asamamino dm suplemen nitrogen lain (misal casein hydrolisate, L-glutamin, L-aspamgin,
adenin) dm gula. Gula yang digunalcan dalam media dirnaksudkan untuk sumber
karbon yang b i i y a diperoleh melalui proses fotosintesis (Gunawan 1 988).
Vitamin diperlukan
dalam
sistem enzim (George dan S-on 1984). Thiaminyang
suing d @ d m adahh nkh, pydoxin(B6),
d m g b biotin, asamMedia hmhh dapat k h t d c
cair
atau padat. P-jenis media tergantungmempaoleh
I@
p e ~ t m b u h yang cqmt. Mediapadat
d g u d m untukm e n u m b h h
tmas
dan
akar. P q g p m m media padat memiliki b e k q akeuntmgan d i m media cair yaitu eksplan mudah terlihat, eksplan b e d
di
penrmkaan media sehingga tidak mmmlukan alat bmtu untuk aerasi, tunas
dan
akar tumbuh temtur (George dm Sherrington 1984).
Berbagai jenis media telah hqak
digunakan,
tetapi media yangumum
digunakan adahh media Murashige clan
Skoog
(1962) tenitam untuk d o g e n e s i skukur &em dan regenerasi tanmum
Media
ini
mengandung garam-garam mineral dahtn konsentrasi tinggi (Garnborg dan Shyluk 198 1). SelainMS
jugat e r m media lain seperti White, Vacin & Went, Nitsch & Nitsch, Schenk &
Hildebndt,
WPM
dmN6.
White mengerndung nitrat tctapi tidak mengmdungamonium,
dan
5 5 mengandung garam-gmm mineraldalam
komtrasi rendah(Gunawan 1 988).
Jenis media y m g digunakan tergzlntung jenis tanaman. Sunariim et al. (1 999)
menggunakan media MS + 0.5 mgll BA
+
0.01 mgl NAA untuk perbanyakan ubikayu. Tambong et al. (1998) menggunakan media
BS
(Gamborg) @a Wur in vitrobelitung (Xanthsoma sagittfolium). Kodiswaran dan Ghani (1988) menggunakan
WIS & &
MS
-t 5 mg/l BA+
0.5-1.5 @ IBA & 0-gmiS darimeristetn apikal tahq m h g Chand ef
al.
(1999)6
MS
+
0-3.13mgn
-
.
n
untuk o r g a n o g d dari meristem apikaltdas.
Gomez et al.(1991) mnggudm media
MS
+
2.5 mg/i IAAd
perkembangan taaaman dand i a
MS
+
0.05 mgfl IAA + 1 mgll BA lmtuk~~i
talas.Zmrt Pengatur Tumbuh
Zat pengatur tumbuh a&hh q w a
organik
bukan hara (bmiMalamiah
mupun sintetik), yang
dalam
jumlah sedikit dapat mmpengaruhi proses-proseshiologis dari pertumbuhan ban per-= tanama~ (Nickell 1982). Diked
enam golongan nat pengatur tumbuh yaitu auksin, g ~ k t i n , sitokinin, asarn absisat,
etilen dm retardan. Juga terdapat senyawa-senyawa lain
yang
ikut aktiidalam
prosespertumbuhan
d m
perkembangan tarmmn, seperti polifenolik, poliamin, siklitol danberbagai senyawa
lain.
Di
dalam
perbanyakan in v i m , peranan auksin adalah merangsang pmkntukank, pemanjangan sel, pembesaran jmhgan dan pemhtukm akar (Pierik 1987).
Beberap eksplan
secara
alamiah m%mprod?lksi cukup auksin. Jenis auksin endogen(yang diproduksi oleh tanaman) &I& IAA, sedangkan yang termasuk auksin buatan
adahh 2.443, NAA, IBA, pCPA (PCMoropenoxy acetic acid).
Pengaruh sitokinin dalam perbm&m in vitro adahh merangsang pembelahan
sel pada jarhgan eksplan
dan
merangsang rmhiplikasi tunas.Zat
pngaturtumbuh
Kinetin, Zmth dan 2ip. P e n g a d sibkinin m l u k a n a k 4 k h zat ptxkptw
trrmbuhIrrin,terutamaauksin(Bbjwanidanhah
1983).Morfogenesis eksplan tergat.ltung pada k e h b n g m a u k dan sitokirrin di
dalam
media clan interaksi antara zat pengatur tumbuh endogen p d a tammn dm zatpengatur tumbuh eksogen yang diserap dari media tumbuh (Wattimam 1988b).
Terdspat siht antagonis dari sitokinin terhadap auksm nRlam
inisiasi
tunas d mperbanyakan
akar.
Tunas terbentuk apbih media mengaradung konsentrasi sitokininyang tinggi clan auksin yang rendah, sedangh a h terbentuk biIa perbaodingrm zat-
zat tersebut
dalam
media addah s e b d h p (Mumshige 1984). K o m t r a s i darisitokinin
dan
auksin yang diperlukan tergantung darijenis eksph, gem* kondisik
h
jenis
sitokinin dan auksin yang dipergidamGiberelin dapat mefangszrng pertumbuhan
dan
rneqmgaruhi pembentukantunas atau akar, akan tetapi p q g d m y a k k l a untuk setiap spesies dan koradisi
k b .
Penambahm gibrelin tidak esensialdalam
perbanyakan in vitro.h a m absisat berinteraksi dengan zat pengatur tumbuh lain di dab proses
pertumbuhan
dan
perkemhangan tanamn. Bhsanya imteraksinya bersihtnerghmh.
Pada
keadaan stres hgkmgan, kandungmasam &is
dahmtanaman meningkat. Asam absisat dapat digumkan untuk konservasi in vifro ubi kayu (Sunarlim et al. 1999) dan EucuIyp~us grandis (Watt et al. 2000).
Retardan dan Orrmoregulator
P e m e b a a n tanaman
dalam kultur
in vitro mmrlukm sub kultur yang ternsn m e r i d t a m m m k a r e m k o ~ M e l a l u i l r e g i a t a n k o d k e g h t a n s u b
-
dapat E-
. .
,, (Bhojwani dmRazdan
1983). Kegbhn inimemiliki
be-
k e k b
antaralain
(1) tidak memerlukan tempat yangh
(2)dam
menghernat temga dan biiya, (3) tidak m@adapi risiko kebilangom genotipa
&'bat g q g u a n penyakit clan c e h m m hngkungan lain, (4) mmhhkau
pert- atau p g k h n b&an tamman kepda penggm ( 5 ) memdaWm
d a b mengambil tidakaa pddcan apabiia terjadi kemunduran pada koleksi, dan
(6) memudahkan perbanyakan (Markka et al. 19%). Untuk memapi tujuan tefsebut
&pat
digunakan
metode p e pada suhu rendah ~ (Hu ~ dan Wang 1983;senyawa retardm seperti cywcel, awyrmdol
dan
plobutrazol (Withers 19851,pengurangan garamgaram mineral atau sukrosa (Schnapp
dm
Preece 1986),penggunaan osmoregulator seperti manitol
d m
sorbitol (Withers 1985; Withers danW i 1985). Menurut Wattimena (1988a), untuk tanaman tropis penyimpanan in
vitro lebjh baik dilakukan dengan cara pertumbuhan minimal. Tanaman ini dapat
dishpan
dalam
media kuit-m y m g ditambah ancymidoldan
paclobutraml( W a t t k 1988b), atau manitol (Withers 1991).
Retardan merupakan senyawa organik sintetik yang bila diberikan pada
tanaman dapat menghambat pepmjmgan batang, meningkatkan warna hijau daun
dan secara tidak langsung mempengaruhi pembungaan tanpa menyebabkan
perturnbuhan yang a b n o d . Retadan &pat dgumkan untuk konserwtsi in vim,
pengakaran tan- atau pembentukoln urnbi m k o . Beberapa jenis retardan yang
oltsidasi dari enf k e n e uenejadi asam ent kawemat
dalam
pernbentukan asarnPaclobutrazol dapat menghambat pertumbuhan tanaman dengan cara menekan
pertamhahan tinggi tanaman, pernanjangan ruas dan luas dam Pengaruh
paclobutrazol terhadap perpanjangm masa do& umbi mikro kentang dapat
dhanfaatkan
untuk
pengirimanumbi
antar daerah (Armini et ai. 1992). Dalam kulturjaringan, semakin tinggi konsentrasi paclobutrazol ruas tanaman yang dihasilkan
semakin pendek namun pemendekan ruas mengalami penurunan seiring dengan
bertambahya umur sinpan kultur sehgga menghasilkan panjang ruas yang normal
pada bagian atas tanaman
dalam
kdtur. Dibadngkan dengan retardan b y a ,p a c l o ~ ~ l mempunyai sifat tmmlokasi yang kbih b& sehhgga kbih efkktif
dalarn m e w pertumbuhan (Wattimena dan Mattjik 1992). Penyimpanan
dengan paclobutrazol pernah dhkukm antara
lain
pa& tanaman pulasari (Gati et a!.1994) clan jahe (Mattjik et al. 1994).
Osmoregulator rnerupabn suatu zat yang dapat me-
.
.
pertumbuhantanaman dengan cam tekanan osmotik dalam media kultur. Manitol
dan sorbit01 rnerupda jmis osmoregulator yang dianjurkan (Grout 1995). W t o l
dari nmmsa atau fruktosa dan berperan pating dab tmnslokasi
asidat
di d a bterhadap stres bgkungan dengan cara mehdungi proses-proses
dalam
sitosoLDalam konsenlasi yang tinggi, manitol d i i untuk pengujian kekeringan
Garnbar 1
.
Rumus bangun manitol (C6H 1 406)P e n a m b manitol ke dahm media kultur menghambat perturnbuhan dan
perkembangan tanaman kdtur (Staritsky et al. 1987) tanpa mempengaruhi sifat
genetikr~ya ( G h r g dm Shyluk 198 I), sehhgga manitol dapat digunakan untuk
kollsewasi in vitro. Penam- manitol 5 -70 gA mengurangi pertumbuhan kultur ubi jalar, akan tetapi konsentrasi optimal untuk konservasi ubi jalar s e h m lebih dari
12 bulan adalah 20 gA manitol (Mandal dan Chandel 1996). Suketi et al. (1997)
thelaporkan konsentrasi manitol optimal untuk penyimpanan ubi jalar adalah 40 gll.
Hal ini didukung oleh laporan Sunarlim et al. (1999). - Staritsky et al. (1987) dapat
Pada
ko-
t a x h i t (45 gli) Bessembiada ef al. (1993) &pat tabsselama 42 Indm dm pada koIlsentt.asi 30 g/l dapat d i h h h n kommasi s e b 102
b
h
denganjumlah
tananwn y m g tumW (nmhw) W ? .Hasil
penelitian Acedo(1994)
menunjukkan bahw
p m m b a hnmibl2%
rlalam media tumbuh ubiImp
kbih d~dmdhgbm komenhsi yang lebih tinggi (4
-
6%). S e uSunarlimet al. (1W) dan Engelmann (1991) m q a t a h bahwa penggunaan d o 1 tidak
tepat untuk penyimpanan ubi kayu sew petlu digunakan zat penghamhat
turnbuh
lain
sepertiasam absisat
(ABA) 1 mgll (Sunariim et al. 1999). Konse-imanitol yang opts untuk konservasi pisang srlabtr 2
-
4 % (Bhat dan Chandel1993). Pada konsentrasi yang lebih tinggi dari 4%, d o 1 dapat menyebabkan
kematian pada kuhm tanaman pisang (Bhat dm Chaadel 1993) dan ubi jalerr (Suketi
BAHAN
DAN
METODE
Tempat dam Wakta Penelitinn
Penelitian
dilaksanakan
di LaboratoriumKuhur
Jar* Kebmpok PenelitiBiologi Molekuler, Balai Penelitian Biotebbgi Tanaman
P
-
Bogor.Peneiitian
dilaksanakan
pada bulan Mei 2000-
Juni 2001.Bahaa dan Alat
Bahan yang digunakan dalam p e r c o b ini lullllah tunas umbi anakan dari 5
nomor asesi talas, agar bakto, media
MS,
zat pmgatw hunbuh Asam Indol-3-mt(IAA) dan 6-Bensiladenin (BA), Manitol, etanol
7 W ,
etanol 90%, Baych 50 %,Bayclin 15 %
dan
akuades steril. Peralataa yang digumh adahh peralatan untukrnembuat media, peralatan tanam dan rak kdtw.
Metode Percobaan
Penelitian ini terdiri atas
dua
kegiatan, yaitu kegiatanperbanyakan
dan
kegiatankonservasi in v i m . Pada kegiatan perbanyakan, penelitian dilakukan dengan
menggunakan Rancangan Acak Lengkap dengan dua faktor yaitu jenis
media sebagai
faktor pertama dan asesi talas sebagai faktor kedua. Model mncangan p e m h
yang diiunakan adalah:
Yijk=p+Ti+Mj
+(TM)
ij + ~ i j kdimana:
Yijk = respon asesi talas ke-i terhdap media ke-j pa& ulangm ke-k;
Cr = nilai rataan;
Mj
= M n d aIre-j;(TM)ij = pengaruh interaksi antma
asesi
talas ke-i dengan media ke-j;r
ijk
= pengaruh galat percobam p d a asesi talas ke-idan
media ke-j pada ulanganke-k
Asesi talas yang digunakan
aclPllah No.
21, No. 586,No.
503,Tabs
Jahe danLurnh Banten, Media perlakuan terdiri atas
MS,
MS+
2.9 pM IAA '+ 4.4 p M BA,dan
MS
+
2.9 @I IAA+
22.2pM
R
A. Jumlafi ulangan setiap perkdam 14.Pada kegiatan konservasi in vitro, penehian dilakukan dmgan menggunakan
Rancangan Acak Lengkap dengan dua faktor, yaitu asesi talas gbagai faktor pertama
dan
jenis media konservasi sebgai faktor kedua. Model rancangan percobam yangdigunakan addah
Yijk = p
+
Ti +Kj i- (TK) ij+
~ i j kdimana:
Yijk = respon asesi talas ke-i terhadap d i a konservasi ke-j pada wanke-k;
P
= nilai rat-;Ti = pengaruh asesi talas ke-i;
Kj
= pengaruh media konservasi ke-j;(TK)ij = pengaruh interaksi antara asesi tabs ke-i dengan media k o w a s i ke-j;
E ijk = pengaruh galat percobaan pada asesi tala ke-i dm media konservasi ke-j pada ulangan ke-k
Asesi tahs yang digunakan adatah
No.
2 1, No. 586,No.
503, Talas Jahedan
gll dan
MS+
marritol50 g/l. K o ddilakukan
=lama 6bulaa
Jumlah
setiap perlakuan 10.
Pehksanaan Penelitian
Persiapan Ekspho
Bahan tanaman yang digunakan ad& umbi analcan yang belum tunhuh (masih
di kwah permukaan tanah). Untuk setiap perlakuan diilukan minimal 20 umbi
anakan. Bahan tamman diambi dari tanaman irmduk y m g memiliki banyak umbi
anakan dari Kebun Percobam Cikeumeh dan Pacet,
kemudian
ditanam h
i
dipelihara di ember di rumah kaca. Setelah tunas tumbuh
h - k i r a
1 cm, umbianakan tersebut diambil sebagai eksplan untuk perbanyakan. Untuk rnencegah
kontaminasi, bahan tanaman yang akan digunakan d i s k h i dengan cara
mencucinya dengan r h o , kemudian dibilas di hawah
air
mengalir denganmenggunakan sikat sarnpai potongan tunas tersebut bersih dari kototanltawh Di
dalam laminar air j7mv umbi eksplan dipotong dengan ukuran L/z x '/z crn dan h g g i
tunas % cm, kemdian dicuci dengan BaycIin
5
W
( b a l m&if
NaOCl 5.25%)selama 10 menit kemudian dibilas dengan akuades s t e d sebanyak 3 kali, selanjutnya
eksplan dicuci kembali dengan Baych 15% s e b 10 menit, k e m u d i d i b i
dengan a k d e s steril sampai Bayclin hilang.
Pem buatan Media
M d i yang diguuakan adahh media MS (Lampika 1). Untulc penyiapan media
MS
semua h t a n komponen rnedia ( h a makro dan mikro, besi serta vitamin)sbauyak 900 ml sunbid diuk dengm magnetic stirrer. Setelah larut dilakukan
pengukuran pH. pH larutan diatur agar mncapai 5.8 dengan me- 0.1
N
HCl atau 0.1
N
KOH. Setelah diperolehpH
yang diginkan,ke
dalam
Ianitantersebut ditambdcan agar k t 0 8
gll.
Volume akhir larutan diterasampai
I literdengan rnenambahkan a k d . ' Media dipmaskan dengan hot plate clan d i u k
dengan magnetic stirrer sarnpai agarnya W. Larutan media dhasukkan ke dalam
botol-botol kultur dan ditutup dengan plastik. Media dalam botol disterilisasi dengan
autoklaf pada suhu 1 20°C, te- 18-20 psi, selama 20 menit. Setelah diautoklaf,
botol kultur dishpan di rak.
Persiapm medii perbanyakan dilakukan sanra dengan pembuatan media
MS
tetapi pada setiap liter media MS
ini
d i t a m w 2.9 pM IAA+
4.4 pM BA, atau2.9
pM
IAA -t 22.2pM
BA. Untuk media ko~l~ervasi pada setiap liter mediaMS
d i t a m b d m 30 gram manitol, 40 gram manitol atau 50 gram rnanitol.
Penanaman Eksplan
E k s p h ymg sudah s t 4 ditanam di media
MS
dalam btol kultur yangditutup plastik dan diinlcubasikan di ruang terang pada suhu 25e0c. Setelah dam
tumbuh clan eksplan telah bebas dari kontaminan Cjarnur dm Wteri), setiap tanaman
dipindahkan
ke
media multiplikasi sesuai dengan perlakuan yang tehh dirancangsebelurnnya. Setiap 4 minggu tanaman disubkultur dalam media multiplikasi yang
sejenis untuk rnemperoleh mother plant stock talas.
Anakan talas dari setiap asesi yang akan dikowmasi dipkahkan dari
.
*dpdakm
Le
mediaMS
sampai
mencapai tinggi kira-kira 1 cm, kermadian dbmmdi
media k o M Botol kultur yangberisi
eksplanditutup
dengau plastikdm
diletaLLm d a b rak loltnn yang
dhhq*n
daLm
~ a n g temng bersuhu 25 Sl OC.Kdtur
dipelibara s e h 6 huh untuk d d h t pmmhhammkemudian
sebagiand i p ' i
ke
nnlrrm mediaMS
untuk dilihat dayatumbuhnya
(regmwth).Pengamatan
Set* empat minggu Jekali
dahun
mEdia pabenyaLrmdihh*an
-tanterhadap peubah jumlah adcan,
sedaaglran
dalam media kommasi dilakukanpengamtan terhadap pubah:
1. tinggi tamman
(diukur
dari permukaan media sampai dam tertinggi)2. persentase
daun
hidup (jumlah dam h i d u p T ' dam total)3. jumlah
aaakan
(ada tidaknya anakan pada eksplan)4. jumlah a h (dihitung dengan skor, yaitu: (1)
jurritah
akar 1-5, ( 2 ) jumlahakar 6- 10, (3) jumlah
akar
1 1-
1 5, (4)jumlah
ak.ar 1 6-20, dan ( 5 ) jumlah akarpnpm&m p i t u umur 16
MST
(rninggu setehhm).
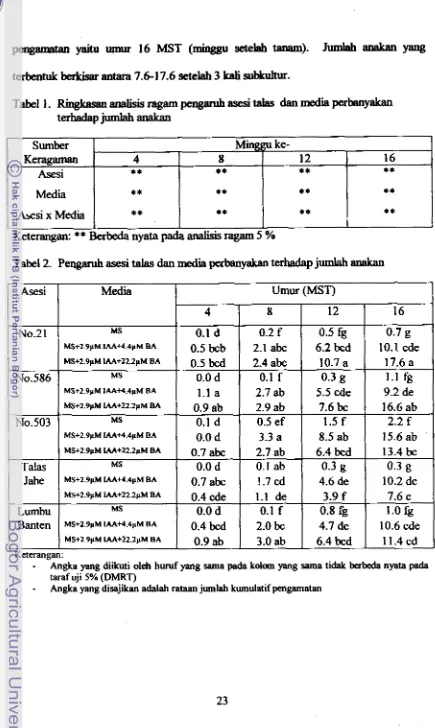
Jumkah amhn yangTabel 2. Pengaruh asesi tdas dan media p e r m terimdap jumlah
anakan
Sumber K e r a g m
Asesi
Media
Asesi x Media
1
M A
Umur (MST)I
MS 0.1 d 0.2 f 0.5 fg
0.7
gMS+29pM I M M . 4 p M BA 0.5 bcb 2.1 a h 6.2 lxd 10.1 cde
Keterangan:
**
Berbeda nyata pada analisis ragam 5 %Minggu ke-
MS+2.9pM IAA+4dpM BA 1.1 a 2.7 ab 5.5 cde 9.2 de M S + ~ . ~ P M M A + ~ ~ J ~ M BA 0.9 ab 2.9 ab
7.6
bc 16.6 abMS 0.1 d 0.5 ef 1.5 f 2.2 f
MS+Z.PpM IAA+4.4pM BA 0.0 d 3.3 a 8.5 ab 15.6 ab
MS+2.9pM LM+22.2pM BA 0.7 abc 2.7 ab 6.4 b ~ d 13.4
k
MS 0.0 d 0.1 ab 0.3 g 0.3 g MS+2.9pM IAA+4.4pM BA 0.7 abc !.7
Cd
4.6 de 10.2 deMS+2.9pM lAA+22.2pM BA 0.4 cde 1.1 de 3.9 f
7.6
eMS 0.0 d 0.1 f 0.8 fg
r
.o
fgMS+2.9pM M + 4 . 4 p M BA 0.4 lxd 2.0
bc
4.7 de 10.6 cde1 MS+2 9yM IAA+22.2pM BA 0.9
ab
3.0 ab 6.4 lxd 11.4 cdn :
mgka ymg diikuti oleh huruf yang sama pa& kdom yang sama ti& babeda nyata p d a
uaf uji 5% (DMRT)
mgka yang disajikan adalsrh m njumlah kumulstif pmgarnatm
[image:111.576.66.501.34.762.2]G a m k 3. Histogram pengar& asesi
talas
dan media p e r b m y h terhadap jumlrthG a m b 4. T a k pada media p e r b a p b n MS (A), MS2.9 pM
ISLA+
4.4BNB),
dm W 2 . 9pM
IAA+ 22-2 @I BA (C).B
-
h a d p- tedhat -. No. 503, TaIas Jahed m
~
~
~
~
-
~
p
~
~
~
d i b m h g No. 21
h N o .
$86.
P a & ~ k ~ i A A ~ s a t z i a ( 2 . 9j ~ ~ @ ~ ~ d i ~ B A 4 . 4 N m d e q m j u m l e l h a n r a k a n
daIam
media $eagm BA22.2
pM
pPtda
Nu.
503, T& JZ?E LmntnX 33mt.q~ @ ~ i ~ ~ J E m d e t h ~ y ~ t e r ~ ~ ~ ~ ~
~
~
a
k
o
~
i
B
A
y
J.umlahambnN0.21 p&m
g
&
~
ngxk BA 22.2 pM
lebih
'lhggi74.3%
&@h&t~ i--w
~~~sIIIJ& BA 4.4
pM
sdangkm jm&di mahu No. 586 p.& 22.2 pM BAklih
ihggi 80.4% d i ipads-zllPdia
p@
4.4 pM RA.Pada
rdrhir
p g m a t m p& media MS rah-mtajumlah
makm terkyakjumtah makm t e h u p k d i l e h dari
No.
503 (15.6) dan @a nmihMS
+
2.9 pMIAA
+
22.2 pM BA mta-rata jumW anakan k r h y a k dipetoleh dariNo.
21 (1 7.6).Ebplan yang d i g u d m pada p r c o b
ini
adaIahanalran
talas
hasilp d a q a k m
daiam
mediaMS
yang ditamhh ntt pengaturtumbuh
Pada saat anakandalam media tersebut mencapai tinggi !5
cm
dipdabkmke
mediaMS
untukmmstirnulir pertumbuhan akar dan dam
Pada
saat tinggi tatwnwn h - k i r a Icm
B d a s a r h
a d k i s
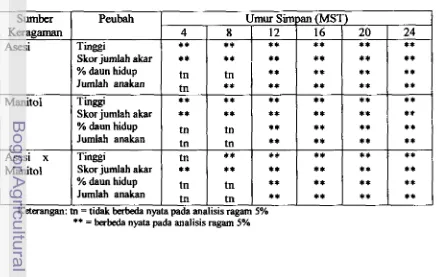
ragam dapat dilihat bahwa mulai umur simpan 12 MST, a*Tabel 3. Rmgkasan a d s i s ragam pengaruh asesi
dan
konsentrasi manitol terhadap peubah-peubah yang diamati.. -
** = babe& nyata pada analisis ragam
5%
S u n k Keragaman h i
Manit01
Asesi x
Manitol
Ketaangan: tn = tidak berbeda nyata pada analisis ragam 5% Peubah
Tinggi
Skor jumlah akar
9% &un hidup Jw&h anakan
Tinggi
Skor jumlah akar
% daun hidup Jumlah anakan Tinggi
Skor jumlah akar
% daun hidup
Jumlah anakan
Umur Simpan (MST)
4
**
**
tn tn**
**
tn tn tn**
tn tn 12*
*
**
**
*
**
**
**
**
* *
**
**
*
8**
* *
tn*
*
* *
**
tn tn* *
**
tn tn 16* *
**
*
rp [image:114.578.62.499.433.710.2]N0.586 NO,
~m
T h
lahe LumbuBmtm2.37
b
i
.80 r;ib1.67
a 1.86ab
K
K
*
dagm cqat d m setelah
umur
8 MST truuurran menyentuh permukaan atas btoLPada akbir pqpmtau tanamaa tertinggi
arlnlah NO.
21,d9n
tanaman terpendekadahh
Lumbu
Banten Pada media yang d b m W m r h l pertumbuhan tamman(Garnbar 5 dan 6). Hsmbstan terkecil
diaLrmi
okb
tamman p d a mediadcqgan
No. 21
1
Po
++
No.
586Umur Simpan (MST)
8
1
121
161
201
24...
Tinggi (m)
...
k s i
No. 503
t;o"
Manitol(dl)
1.06f 11.08h
1
1.13 f ) 1 . 1 9 h I1.19j1
iikuti oleh huruf yang m a p d a kolom yang sarna tidak h k d a nyata
pada hmf uji 5% (DMRT)
14.33 a
7.38 f 2.29 hij
13.50 a 7.66 de 1.73 gh
12.45 a 7.62 e 2.06 f
8.30 a
3.93 de
1.54 f
12.2 a
&l 30 g/l. Pada
umur
simpan
24MST
tinggi tatwrrwn pada mrlllitol 30fl
tertinggi Rrlalah
No.
586, diikuti oleh Llrmbu Baaten,No.
21,No.
503dan
TalasJahe. Pada konsentrasi d t o l 40 g/l tananmu tertinggi a&hh
No.
586, diikutioleh Lumbu Banten,
No.
503,No.
21dan
Tahs Jahe, sdangkm p d a koasentrasimanitol 50 g/l,
No.
586adahh
tammantertinggi,
d W i okehNo.
503,No.
21,Lurnbu Banten
clan
Tahs
Jahe. Dalam k & a i media yangditambah
d o 1 padako-i 30 - 50 g/l
No.
586 slrlaLlh tanaman tertinggi dan TalasJahe
t e p d e k .Dengan
umur
simpan, p d a manitol 40 dan 50 gll terlihatprhmbdm tinggi
tamman
No.
586, sedangkao pada asesi lainnya tidak terlihat.Skor Jumlah Akar
Berdadcm analisis ragam
terlihat
bahwa asesi, manitol dm interaksmyab e r p g a d nyata terhadap skor jumlah akar selama masa simpan (Tabel 6 clan
Lampiran 4). Dslam media MS pertumbuhan akar- tidak terhamhat d a n g k m dengan
pemmbbn mad01 pertumbuhan akar t e r h h t . Skor jumlah akar t e h y a k
terdapat pada media
MS,
skor jumlah akar paling sedikit terdapat padamedia
MS
+
manit01 50 gll. Hasil pengamatan secara visual menunjukkan bahwa akar pada media
MS
lebih panjang d i W i akar pada media yang ditambah rnanitol (Gambar 7).Pada umur 4 MST belum terlihat adanya perkban skor
jumlah
akar Talas Jahedm Lumh Baaten pada k b g a i media p e r k h a n Jumlah akar
No.
2 1d m
No.
503T h l 7 . Pengaruh asesi talas d m konsentrasi manitol terhadap skor jumlah
alcar
No.
21 030
40
k s i
50 1.0 f 1.2 f
No.
586