BAB I
PENDAHULUAN
1.1. Latar Belakang
Listrik digunakan luas hampir di seluruh aspek kehidupan oleh karenanya
memegang peran penting didunia teknik. Kelemahan energi listrik yang sangat prinsip
terletak pada fakta bahwa proses pembentukan dan penggunaan (
generate
&
consume
)
energi listrik biasanya berbanding lurus, pada saat yang bersamaan. Kita tidak bisa
memproduksi lalu menyimpan energi listrik begitu saja dengan alat yang sederhana. Sudah
menjadi hukumnya bahwa energi listrik yang kita gunakan harus berasal langsung dari
sumbernya. Dalam volume yang sedikit, energi listrik bisa disimpan dalam sebuah kapasitor
dan hanya dapat digunakan terbatas untuk menyuplai daya pada peralatan yang
membutuhkan energi listrik yang kecil pula.
Untuk disimpan dalam skala yang lebih besar, energi listrik pertama-tama harus
diubah terlebih dahulu kedalam bentuk energi yang lain. Pengetahuan tentang elektrokimia
menjawab tantangan masalah ini yaitu tugas "menyimpan" listrik agar bisa digunakan setiap
waktu yang berbeda-beda sesuai kebutuhan, serta dapat dipindah-pindahkan. Dalam
elektrokimia terdapat reaksi redoks yang dapat menimbulkan arus listrik. Alat penyimpan
energi listrik itulah yang kemudian kita kenal dengan nama akumulator/accu (aki) yang
sering digunakan pada kendaran seperti mobil dan motor. Maka dalam hal ini penulis akan
mengulas lebih dalam mengenai reaksi redoks pada aki.
1.2. Rumusan Masalah
1. apakah itu aki/ accu (accumulator) ?
1.3. Tujuan Makalah
Makalah ini bertujuan untuk mengulas lebih dalam mengenai
Accumulator/Accu (Aki) dan menunjukkan bagaimana proses pembuatan aki
samapai menghasilkan tegangan(V).
1.
Menambah wawasan penulis dalam menyusun makalah
BAB II
PEMBAHASAN
2.1.Pengertian Aki ( accumulator)
Aki(accumulator/baterai) merupakan suatu komponen elektrokimia yang menghasilkan tegangan dan menyalurkannya ke rangkaian listrik. Dewasa ini baterai merupakan sumber utama energi listrik yang digunakan pada kendaraan. Sebagai catatan bahwa baterai tidak menyimpan listrik, tetapi menampung zat kimia yang dapat menghasilkan energi listrik. Dua bahan timah yang berbeda berada di dalam asam yang bereaksi untuk menghasilkan tekanan listrik yang disebut tegangan. Reaksi elektrokimia ini mengubah energi kimia menjadi energi listrik.
Gambar 5.1. Baterai
Hal-hal yang disyaratkan untuk baterai adalah ukurannya harus kecil, ringan dan tahan lama, tahan terhadap gunjangan dan mudah dikontrol, mempunyai kapasitas yang besar dan harganya cukup murah. baterai harus bisa mensuplai arus listrik ke seluruh peralatan listrik yang ada pada kendaraan. Apabila alternator mengalamai kerusakan, baterai harus bisa dipakai sebagai sumber listrik pada saat kendaraan melaju. Baterai harus dapat mengatur kesimbangan antara output dari alternator dan beban pemakaian. Namun begitu, baterai bukanlah merupakan sumber utama untuk peralatan listrik yang ada pada kendaraan.
2.2.Fungsi, Tipe, dan Konstruksi Baterai (Accu)
A).Fungsi Baterai
Pada kendaraan, baterai berfungsi sebagai sumber arus untuk semua sistem kelistrikan pada kendaraan. Pada saat mesin belum hidup, baterai memberikan energi listrik untuk sistem
penerangan atau sistem lampu-lampu dan aksesoris. Pada saat start, baterai berfungsi
memberikan energi listrik untuk memutarkan motor starter dan sistem pengapian selama start.
Pada kondisi mesin hidup, hampir semua kebutuhan energi listrik pada sistem kelistrikan kendaraan dipenuhi oleh sistem pengisian.
B).Tipe Baterai
Beberapa tipe baterai yang ada yaitu baterai tipe timah-asam (lead acid), baterai
perawanan ringan atau baterai bebas perawatan, baterai berventilasi, dan baterai rapat (sealed
baterai). Penjelasan mengenai baterai tersebut adalah sebagai berikut.
1. Baterai tipe timah-asam (lead acid). Pada baterai tipe ini suatu logam (timah) direndam
dalam suatu larutan elektrolit. Tegangan atau energi listrik dihasilkan dari reaksi kimia antara logam dan larutan elektrolitnya.
2. Baterai berventilasi. Pada baterai ini, terdapat tutup ventilasi yang dapat dibuka untuk
mengecek elektrolit atau untuk menambahkan air suling jika diperlukan untuk mengembalikan kondisinya. Tutup ini juga berfungsi untuk mengeluarkan gas hidrogen yang dihasilkan selama proses pengisian.
3. Baterai rapat (sealed baterai). Baterai ini menggunakan juga timah-asam tetapi tidak
mempunyai tutup yang dapat dilepas untuk mengecek elektrolit atau menambah elektrolit. Pada beberapa tipe baterai ini, mempunyai mata kecil untuk menunjukkan tingkat isi dari baterai.
4. Baterai bebas perawatan. Pada baterai jenis ini larutan elektrolit tidak dapat ditambahkan
sehingga tidak diperlukan perawatan baterai secara khusus.
C).Konstruksi Baterai
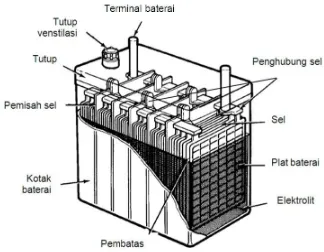
Konstruksi baterai digambarkan dengan iliustrasi pada gambar 5.2. Berikut adalah penjelasan dari tiap-tiap bagian baterai.
1. Kotak baterai. Bagian ini berfungsi sebagai penampung dan pelindung bagi semua komponen baterai yang ada di dalamnya, dan memberikan ruang untuk endapan-endapan baterai pada bagian bawah. Bahan kotak baterai ini biasanya transparan untuk mempermudah pengecekan ketinggian larutan elektrolit pada baterai.
Gambar 5.3. Kotak dan tutup baterai
2. Tutup baterai. Bagian ini secara permanen menutup bagian atas baterai (gambar 5.3), tempat dudukan terminal-terminal baterai, lubang ventilasi, dan untuk perawatan baterai seperti pengecekan larutan elektrolit atau penambahan air.
3. Plat baterai. Plat positif dan plat negatif mempunyai grid yang terbuat dari
antimoni dan paduan timah. Plat positif terbuat dari bahan antimoni yang dilapisi dengan
lapisan aktif oksida timah (lead dioxide, PbO2) yang berwarna coklat dan plat negatif
terbuat dari sponge lead (Pb) yang berwarna abu-abu. Jumlah dan ukuran plat
mempengaruhi kemampuan baterai mengalirkan arus. Baterai yang mempunyai plat yang besar atau banyak dapat menghasilkan arus yang lebih besar dibanding baterai dengan ukuran plat yang kecil atau jumlahnya lebih sedikit.
Beberapa macam bahan yang banyak digunakan untuk plat baterai di antaranya
adalah antimoni timah (lead antimony), kalsium timah (lead calcium), rekombinasi (gel
cell). Macam-macam bahan plat baterai dan elektrolit yang digunakan akan menghasilkan
karakteristik baterai yang berbeda. Bahan plat antimoni timah banyak digunakan pada
baterai asam timah (lead acid) pada umumnya. Keuntungan baterai ini adalah 1) umur
servis yang lebih panjang dibanding baterai kalsium, 2) lebih mudah di-charge atau diisi
ulang pada saat baterai benar-benar sudah kosong, dan 3) harganya lebih murah.
Baterai yang menggunakan plat berbahan kalsium timah adalah baterai asam timah
bebas perawatan (maintanance free lead acid battery). Keuntungan baterai tipe ini adalah
1) tempat cadangan elektrolit di atas plat baterai lebih besar, 2) kemampuan
menghasilkan arus untuk starter dingin (cold cranking amper rating) lebih tinggi, dan 3)
hanya sedikit atau bebas perawatan. Baterai dengan gel cell merupakan baterai asam timah
yang rapat yang bahan elektrolitnya berupa gel yang lebih padat dibanding cairan baterai
lainnya. Keuntungan tipe ini adalah 1) tidak ada cairan elektrolit yang dapat menyebabkan
kebocoran, 2) dapat bertahan beberapa lama dalam keadaan baterai kosong (habis sama
sekali = discharged) tanpa mengalami kerusakan (deep cycled), 3) bebas karat dan
perawatan, 4) umur pakai tiga kali atau empat kali lebih panjang dibanding baterai biasa,
dan 5) jumlah plat yang lebih banyak dengan jarak yang rapat (berdekatan) sehingga
ukuran baterai lebih kecil atau kompak.
Gambar 5.5. Baterai gel cell
4. Separator atau penyekat. Penyekat yang berpori ini ditempatkan di antara plat positif dan
Gambar 5.6. Penyekat atau sparator di antara plat baterai
Separator disisipkan diantara pelat positif dan negatif untuk mencegah agar tidak terjadi hubungan singkat antara kedua plat tersebut. Apabila pelat mengalami hubung singkat karena kerusakan separator, maka energi yang dihasilkan akan bocor. Bahan yang dipakai untuk separator adalah resin fiber yang diperkuat, karet atau plastik. Permukaan separator yang berpori menghadap ke plat positif untuk melindungi karat dari plat positif agar tidak berhamburan. Persyaratan yang harus dipenuhi oleh separator adalah bukan konduktor, harus cukup kuat, tidak mudah berkarat oleh elektrolit, dan tidak menimbulkan bahaya terhadap elektroda.
5. Sel. Satu unit plat positif dan plat negatif yang dibatasi oleh penyekat di antara kedua plat
posotif dan negatif disebut dengan sel atau elemen. Sel-sel baterai dihubungkan secara seri satu dengan lainnya, sehingga jumlah sel baterai akan menentukan besarnya tegangan baterai yang dihasilkan. Satu buah sel di dalam baterai menghasilkan tegangan kira-kira sebesar 2,1 volt, sehingga untuk baterai 12 V akan mempunyai 6 sel.
6. Penghubung sel (cell connector) merupakan plat logam yang dihubungkan dengan plat-plat baterai. Plat penghubung ini untuk setiap sel ada dua buah (lihat gambar 5.7), yaitu untuk plat positif dan plat negatif. Penghubung sel pada plat positif dan negatif disambungkan secara seri untuk semua sel.
7. Pemisah sel (cell partition). Ini merupakan bagian dari kotak baterai yang memisahkan tiap
sel (lihat gambar 5.3).
8. Terminal baterai. Ada dua terminal pada baterai, yaitu terminal positif dan terminal negatif
yang terdapat pada bagian atas baterai. Saat terpasang pada kendaraan, terminal-terminal ini dihubungkan dengan kabel besar positif (ke terminal positif baterai) dan kabel massa (ke terminal negatif baterai).
Gambar 5.8. Terminal baterai
9. Tutup ventilasi. Komponen ini terdapat pada baterai basah untuk menambah atau
memeriksa air baterai. Lubang ventilasi berfungsi untuk membuang gas hidrogen yang dihasilkan saat terjadi proses pengisian.
10. Larutan elektrolit, yaitu cairan pada baterai merupakan campuran antara asam sulfat
(H2SO4) dan air (H2O). Secara kimia, campuran tersebut bereaksi dengan bahan aktif pada
plat baterai untuk menghasilkan listrik. Baterai yang terisi penuh mempunyai kadar 36%
asam sulfat dan 64% air. Larutan elektrolit mempunyai berat jenis (specific gravity) 1,270
pada 200C (680F) saat baterai terisi penuh. Berat jenis merupakan perbandingan antara
massa cairan pada volume tertentu dengan massa air pada volume yang sama. Makin tinggi berat jenis, makin kental zat cair tersebut. Berat jenis air adalah 1 dan berat jenis asam sulfat adalah 1,835. Dengan campuran 36% asam dan 64% air, maka berat jenis larutan elektrolit pada baterai sekitar 1,270.
Gambar 5.10. Campuran asam dan air pada larutan elektrolit
2.3.Kapasitas baterai(Aki)
Sebuah baterai harus mempunyai kapasitas yang cukup agar mampu memberikan energi listrik yang cukup untuk memutarkan motor starter saat mesin dihidupkan. Kapasitas baterai merupakan besarnya energi listrik yang dapat diberikan oleh baterai saat baterai tersebut dalam kondisi terisi penuh. Kapasitas baterai dipengaruhi oleh kualitas dan volume larutan lektrolit, jumlah sel dalam baterai, ukuran dan jumlah plat dalam baterai. Istilah yang umum digunakan
untuk menyatakan kapasitas baterai adalah CCA (cold cranking ampere), RC (reserve capacity),
AH (amper hour), dan daya (power, Watt).
CCA (cold cranking ampere, arus starter dingin)
Fungsi utama baterai adalah memberikan energi listrik pada motor starter saat mesin
dihidupkan dan memberikan energi listrik ke sistem kelistrikan lainnya. Saat mesin di-start,
pengeluaran energi listrik sangat besar dan singkat. CCA secara khusus menyatakan kemampuan baterai (masih penuh terisi) untuk mengeluarkan arus (dalam Amper) beban penuh
pada temperatur 00F (-17,80C) selama 30 detik. Tegangan dipertahankan pada 1,2 V pada tiap
sel atau 7,2 V untuk enam sel pada baterai 12 V. Harga CCA baterai sekitar 350 sampai 560 A tergantung tipe dan jenis baterai.
RC (reserve capacity, kapasitas cadangan)
Selain menyediakan energi listrik yang besar saat mesin di-start, baterai juga harus
dapat menyediakan energi cadangan untuk sistem pengapian, sistem lampu- lampu, dan
menyatakan waktu (dalam menit) suatu baterai yang terisi penuh untuk mengalirkan arus sebesar 25 A dan tegangan pada tiap sel dipertahankan 1,75 V atau 10,5 V untuk enam sel pada baterai 12 V. Besarnya nilai RC berkisar antara 55 sampai 115 menit.
AH (amper-hour, amper-jam)
Bahan aktif pada plat baterai harus tahan terhadap kondisi penerapan beban lampu-lampu yang membutuhkan daya tertentu saat menyala. Metode pengujian ini disebut juga metode pemakaian baterai 20 jam. Baterai pada umumnya menyatakan kapasitasnya dalam satuan amper-jam. AH menyatakan besarnya arus yang dapat mengalir dalam waktu 20 jam
pada temperatur 270C (800F) sementara selama pengujian tegangan dipertahankan pada 1,75 V
pada tiap sel atau 10,5 V untuk enam sel pada baterai 12 V. Misalnya, sebuah baterai dapat mengalirkan arus sebesar 3 A dalam waktu 20 jam, maka kapasitas baterai tersebut adalah 3 A x 20 jam = 60 amper-jam.
Power atau daya (Watt)
Besarnya energi listrik yang dikeluarkan oleh baterai pada saat mesin di-start juga dapat
dinyatakan dalam Watt. Daya baterai ditentukan dengan menentukan arus dan tegangan baterai
pada 00F (17,80C). Kedua besaran tersebut kemudian dikalikan sehingga didapat daya. Daya
pada baterai berkisar antara 2000 sampai 4000 W.
2.4.Cara Kerja Aki (Reaksi Elektrokimia)
Baterai dan bagian-bagiannya saling bekerja sama untuk menghasilkan energi listrik. Dasar kerja baterai adalah mengubah energi kimia menjadi energi listrik. Pada bagian ini akan dijelaskan bagaimana kerja baterai, mulai dari teori sel sampai dengan reaksi elektrokimia.
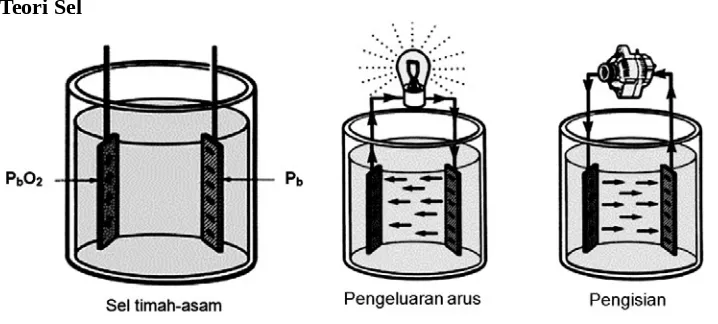
Teori Sel
Gambar 5.11. Dasar kerja sel
Dasar sel dari sebuah baterai terdiri dari beberapa komponen, yaitu plat positif, plat negatif, elektrolit, dan kotak sel. Kedua plat terendam dalam larutan elektrolit campuran antara asam sulfat dan air. Plat positif terbuat dari bahan yang berwarna merah kecoklatan yang
disebut dioksida timah (lead dioksida, PbO2) sedangkan plat negatif terbuat dari timah (Pb)
dan sebuah beban (gambar 5.11) dihubungkan dengan kedua plat tersebut, maka akan terjadi aliran arus dari plat positif ke plat negatif dan menyebabkan lampu menyala. Proses
pengeluaran isi (discharging) ini akan terus berlangsung sampai kedua logam itu menjadi sama
(PbSO4) dan seluruh asam sudah termanfaatkan sehingga cairan yang ada hanya berupa air
(H2O). Dalam kondisi seperti ini maka sel (baterai) tersebut dikatakan kosong (discharged) dan
tidak dapat menghasilkan arus listrik lagi. Kondisi sel yang sudah kosong ini dapat
dikembalikan seperti keadaan semula (terisi penuh, charged) dengan memberikan arus listrik ke
kedua plat pada sel tersebut dan secara berangsur-angsur akan terisi kembali.
2.5.Reaksi Elektrokimia
Baterai dapat dipakai dan diisi kembali secara berulang-ulang. Kerja baterai dalam menghasilkan arus listrik adalah berdasarkan reaksi elektrokimia. Cara kerja baterai dijelaskan
dalam tahapan yaitu dalam keadaan penuh (charged), pengeluaran arus (discharging), baterai
kosong (discharged), dan pengisian (charging).
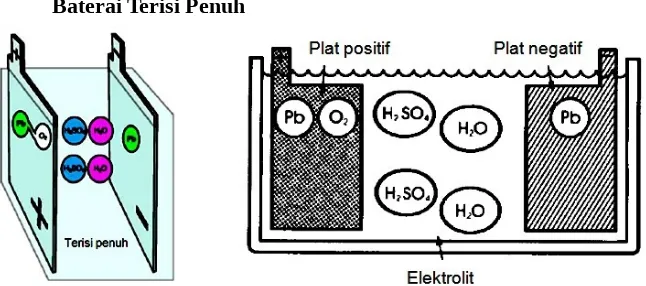
Baterai Terisi Penuh
Gambar 5.12. Baterai dalam kondisi terisi penuh (charged)
Baterai yang berada dalam kondisi terisi penuh, plat positif baterai tersebut adalah
PbSO4 sedangkan plat negatifnya adalah Pb. Larutan elektrolit yang ada pada baterai tersebut
merupakan campuran dari asam sulfat (H2SO4) dan air (H2O).
Baterai Mengeluarkan Arus
Apabila sebuah beban, misalnya lampu, dihubungkan dengan terminal positif dan negatif baterai, larutan elektrolit akan bereaksi dengan plat-plat baterai sehingga menghasilkan
arus listrik dan lampu akan menyala. Elektrolit terbagi menjadi hidrogen (H2) dan sulfat (SO4).
Hidrogen (H2) bereaksi dengan oksigen (O) dari plat positif baterai dan menghasilkan air (H2O).
Sulfat (SO4) bereaksi dengan Pb pada plat negatif dan plat positif dan menghasilkan PbSO4.
Tabel 5.1. Reaksi Kimia saat Pengeluaran Arus (discharging)
Plat
Positif Elektrolit NegatifPlat PositifPlat Elektrolit NegatifPlat PbO2 + 2H2SO4 + Pb Î PbSO4 + 2H2O + PbSO4
Baterai dalam Keadaan Kosong (Discharged)
Gambar 5.14. Baterai kosong
Proses pengeluaran arus seperti dijelaskan pada gambar 5.13, dalam jangka yang lama
akan menyebabkan plat positif dan negatif menjadi PbSO4 dan larutan elektrolit hanya berupa air
saja (menjadi H2O). Dalam kondisi seperti ini maka tidak akan terjadi reaksi kimia antara plat
baterai dan cairan di dalam baterai. Jika pada kedua terminal baterai diberi sebuah lampu, maka lampu tidak akan menyala karena tidak ada arus listrik yang dihasilkan.
Pengisian Baterai (Charging)
Pengisian baterai bertujuan untuk mengembalikan kondisi baterai supaya kembali terisi penuh. Pada proses ini aksi kimia akan dikembalikan seperti semula. Dengan memberikan arus
listrik pada baterai tersebut, maka sulfat (SO4) akan lepas dari plat positif dan plat negatif dan
bereaksi kembali dengan hidrogen (H2) dan membentuk asam sulfat (H2SO4). Oksigen (O2)
bereaksi dengan timah (Pb) pada plat positif dan membentuk PbO2. Pada proses ini terjadi gas
pada saat baterai mendekati terisi penuh, dan gelembung hidrogen keluar dari plat negatif sedangkan pada plat positif terbentuk oksigen.
Tabel 5.2. Reaksi Kimia saat Pengisian Baterai (Charging)
Plat
Positif Elektrolit
Plat Negatif
Plat
Positif Elektrolit
Plat Negatif PbSO4 + 2H2O + PbSO4 Î PbO2 + 2H2SO4 + Pb
2.6.Karakteristik Elektrolit Aki
Seiring dengan penggunaan listrik dari baterai untuk berbagai macam keperluan
rangkaian listrik, maka kondisi baterai akan menurun. Berat jenis (specific gravity) elektrolit
berkurang secara proporsional sesuai dengan besarnya pemakaian listrik pada baterai. Gambar 5.16 memperlihatkan hubungan antara perubahan berat jenis dengan jumlah pengeluaran baterai (tingkat kekosongan baterai). Berat jenis
1.280 adalah berat jenis dengan kondisi baterai terisi penuh, dan 1.080 adalah berat jenis untuk kondisi baterai kosong. Dengan mengukur berat jenis elektrolit, bersarnya tingkat kekosongan
baterai (discharged) dapat diketahui.
Gambar 5.16. Hubungan berat jenis elektrolit dengan tingkat kekosongan baterai Jika
baterai yang sudah kosong tidak dipakai dalam jangka waktu yang lama,
maka elektroda bisa menjadi lead sulfate (PbSO4) secara permanen atau timbul kerusakan pada
plat baterai, sehingga baterai tidak dapat digunakan lagi. Jika berat jenisnya adalah 1.200 (200
Celcius), baterai harus diisi ulang. Jika baterai disimpan dalam jangka waktu yang lama, maka baterai tersebut harus diisi kembali sedikitnya satu kali untuk 15 hari. Perubahan temperatur akan mempengaruhi berat jenis
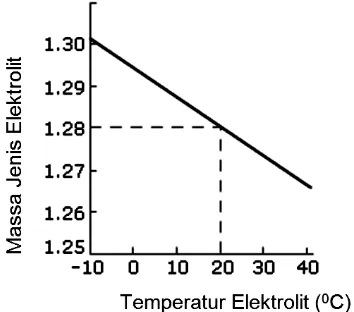
mengembang karena temperatur, sehingga berat per satuan volume berubah. Oleh sebab itu, jika temperatur naik, berat jenis elektrolit akan turun, dan jika temperatur turun, maka berat jenis elektrolit akan naik. Gambar berikut ini memperlihatkan pengaruh temperatur elektrolit terhadap berat jenis elektrolit.
Gambar 5.17. Hubungan berat jenis elektrolit dengan temperatur elektrolit
2.7.Penanganan Aki
Baterai memerlukan perawatan dan penanganan khusus agar umur baterai bisa panjang. Beberapa hal yang penting dilakukan terhadap baterai untuk merawat, memeriksa dan menguji baterai. Hal-hal tersebut dilakukan untuk mengetahui kondisi baterai, dan mengembalikan kondisi baterai.
2.8.Melepas dan Memasang Aki
Beberapa hal yang perlu diperhatikan dalam melepas baterai adalah sebagai berikut.
1. Pastikan kunci kontak berada dalam posisi Off dan semua aksesori atau sistem kelistrikan
dalam keadaan Off.
2. Lepas kabel baterai dengan terlebih dahulu melepas kabel negatif.
3. Lepas baterai dari kendaraan. Harap diperhatikan: hati-hati dalam melepas baterai karena
kemungkinan rumah baterai retak atau bocor sehingga cairan elektrolit dapat mengenai kulit anda. Gunakan sarung tangan saat mengeluarkan baterai agar lebih aman.
4. Periksa dudukan baterai dari kemungkinan rusak yang disebabkan oleh larutan elektrolit
baterai. Jika memang ada kerusakan akibat elektrolit, maka daerah itu perlu dibersihkan dengan air hangat dan baking soda. Gosok daerah tersebut dengan sikat kaku kemudian lap dengan kain yang direndam dengan air dan baking soda.
5. Bersihkan bagian atas baterai.
6. Lakukan pemeriksaan baterai secara visual (jika terdapat hal-hal yang memerlukan
pemeriksaan dan pengujian lanjut, lihat pada bagian khusus pemeriksaan dan pengujian baterai dalam bab ini juga).
7. Periksa kotak baterai dan tutupnya dari kemungkinan retak. Jika ada yang retak, baterai
harus diganti.
9. Bersihkan permukaan klem terminal dengan alat pembersih yang sesuai. Ganti kabel dan klem terminal yang rusak (Bila terjadi masalah pada baterai, lakukan pemeriksaan-pemeriksaan baterai seperti dijelaskan pada bagian pemerisaan baterai).
10. Pasang kembali baterai ke dalam mobil.
11. Hubungkan kabel terminal baterai, pastikan kabel terminal masuk ke dalam dengan aman. 12. Kencangkan baut terminal dengan benar.
13. Setelah dikencangakan, lapisi semua sambungan dengan gemuk (light mineral
grease).
PERHATIAN: saat baterai sedang diisi, maka akan keluar gas yang mudah terbakar di antara tutup selnya. Jangan merokok di area tempat baterai sedang atau baru saja diisi. Jangan melepas penjepit chager dari terminal baterai yang sedang diisi karena akan menimbukan percikan api yang dapat menyebabkan terbakarnya gas hidrogen yang dihasilkan pada proses pengisian.
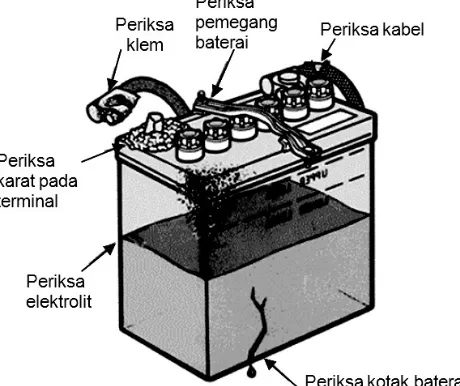
2.9.Pemeriksaan visual
Baterai yang dilepas dari kendaraan perlu diperiksa untuk mengetahui adanya kerusakan pada baterai. Pemeriksaan baterai secara visual dilakukan dengan langkah-langkah berikut.
1. Periksa keretakan pada kotak baterai, kerusakan pada terminal baterai, dan kebocoran
elektrolit. Jika ada keretakan yang menyebabkan bocornya elektrolit, ganti baterai.
2. Periksa keretakan atau kerusakan kabel baterai dan klem kabel, ganti jika diperlukan.
Gambar 5.18. Bagian-bagian baterai yang diperiksa secara visual
3. Periksa karat pada terminal, kotoran, atau elektrolit pada permukaan baterai. Bersihkan
Gambar 5.19. Membersihkan terminal dan kabel baterai
4. Periksa pemegang baterai yang kendor, atau klem baterai yang kendor. Bersihkan dan
kencangkan jika diperlukan.
2.10.Pengujian Kondisi Aki
Kondisi baterai diketahui dengan melakukan pengujian pada baterai. Pengujian isi baterai dilakukan dengan dua cara, yaitu dengan pengujian berat jenis elektrolit, dan dengan pengujian tegangan rangkaian terbuka.
2.11.Pengujian Berat Jenis Elektrolit
A).Pengujian dengan hidrometerBeberapa langkah yang perlu dilakukan untuk memeriksa berat jenis larutan elektrolit menggunakan hidrometer dijelaskan sebagai berikut.
1. Gunakan pelindung mata saat melakukan pengujian.
2. Lepas tutup ventilasi pada tiap sel baterai.
3. Tekan bola karet pada hidrometer dan masukan ujung hidrometer ke dalam lubang sel ke
yang paling dekat dengan terminal positif baterai.
Gambar 5.20. Penggunaan hidrometer untuk mengukur berat jenis elektrolit
4. Lepaskan penekanan bola karet secara perlahan-lahan agar elektrolit dapat terisap ke dalam
5. Baca angka pada skala yang ditunjukkan oleh pelampung. Yakinkan bahwa pelampung terapung dengan bebas, tidak bergesekan dengan bagian samping dan atas tabung hidrometer. Bungkukkan badan agar saat membaca hasil pengukuran posisi mata dan hidrometer dalam keadaan lurus.
Gambar 5.21. Membaca hasil pengukuran elektrolit menggunakan hidrometer
6. Catat hasil pembacaannya dan lanjutkan untuk sel-sel lainnya.
Berdasarkan hasil pengukuran berat jenis elektrolit, dapat ditentukan apakah baterai dalam kondisi penuh, harus diisi ulang, atau harus diganti. Dari hasil ini juga dapat ditentukan apakah baterai ini mempunyai energi yang cukup untuk melakukan suatu tes kapasitas atau tes beban berat. Baterai harus dalam kondisi minimal 75% terisi untuk melakukan tes beban berat. Dengan kata lain, tiap sel harus memiliki berat jenis 1,230 atau lebih.
Tabel 5.3. Berat jenis Elektrolit dan kondisi Isi baterai
No Berat jenis Elektrolit Isi baterai (%)
1 ≥1,27 100
2 1,230 75
3 1,190 50
4 1,145 25
5 1,000 0
Tabel 5.4. Contoh Harga Hasil Pembacaan Berat jenis Elektrolit
Sel 1 Sel 2 Sel 3 Sel 4 Sel 5 Sel 6
1,260 1,230 1,240 1,220 1,190 1,250
Perbedaan harga pada tiap sel ini dapat disebabkan oleh beberapa faktor, misalnya kualitas air yang ditambahkan ke dalam sel, elektrolit sudah menjadi air sehingga pembacaan berat jenis rendah. Pengisian baterai dengan laju pengisian lambat (5A) dapat mengurangi variasi harga berat jenis elektrolit dan dilakukan untuk memulihkan kondisi baterai dan memperpanjang umur baterai.
B).Pengujian dengan refraktometer
Pengukuran berat jenis elektrolit juga dapat dilakukan dengan alat refraktometer. Pada pengukuran ini, temperatur elektrolit tidak akan mempengaruhi hasil pembacaan. Langkah-langkah yang dilakukan adalah sebagai berikut.
1. Gunakan pelindung mata saat melakukan pengujian
2. Lepas tutup ventilasi pada bagian atas baterai.
3. Ambil satu tetes elektrolit pada sel yang terdekat dengan terminal positif baterai dan
letakan pada lensa kemudian tutup.
Gambar 5.22. Memeriksa berat jenis elektrolit dengan refraktometer
4. Pegang refraktometer dan arahkan ke cahaya kemudian baca hasil
pengukurannya dengan melihat pada bagian pembacaan.
5. Catat hasil pembacaan dan lanjutkan dengan sel lainnya.
Koreksi untuk hasil pembacaan karena dipengaruhi suhu
Temperatur yang tinggi akan menyebabkan viskositas (kekentalan) elektrolit menurun dan menyebabkan berat jenisnya turun dan temperatur yang rendah akan menyebabkan viskositas elektrolit naik sehingga berat jenisnya juga naik. Efek temperatur ini akan mempengaruhi hasil pembacaan saat mengukur berat jenis elektrolit. Untuk itu perlu dilakukan
koreksi terhadap hasil pembacaan tersebut. Temperatur elektrolit di atas atau di bawah 800F
perlu dikoreksi. Untuk setiap penurunan 100F dari 800F, kurangi hasil pembacaan dengan 0,004
dari pembacaan hidrometer, dan untuk setiap kenaikan 100F di atas 800F hasil pembacaan
Gambar 5.23. Koreksi harga berat jenis akibat perbedaan temperatur
Contoh 1 : dalam melakukan koreksi hasil pembacaan hidrometer. Hasil
pembacaan hidrometer : 1,250
Temperatur elektrolit : 400F
Pengurangan berat jenis : - 0,016
Berat jenis elektrolit yang dikoreksi : 1,250 – 0,016 = 1,234
Contoh 2: dalam melakukan koreksi hasil pembacaan hidrometer. Hasil
pembacaan hidrometer : 1,240
Temperatur elektrolit : 1000F
Pengurangan berat jenis : + 0,008
Berat jenis elektrolit yang dikoreksi : 1,240 + 0,008 = 1,248
C).Pemeriksaan elektrolit pada baterai jenis built-in hydrometer
Baterai jenis built-in hydrometer, sudah mempunyai hidrometer yang terpasang di
dalam baterai tersebut. Pemeriksaannya dilakukan dengan melihat indikator atau penunjuk yang terdapat pada baterai. Beberapa langkah yang dilakukan adalah sebagai berikut.
1. Gunakan pelindung mata saat melakukan pemeriksaan.
2. Amati hidrometer yang terdapat pada baterai tersebut.
3. Hasil pembacaannya adalah sebagai berikut. Jika titik berwarna hijau nampak pada
hidrometer, maka baterai dalam kondisi terisi penuh dan dapat digunakan untuk mengujian selanjutnya (tes beban berat). Jika yang terlihat adalah titik berwarna hijau gelap, maka baterai perlu diisi sebelum melakukan pengujian lanjutan. Jika titik berwarna kuning terlihat, maka kondisi baterai sudah jelek dan perlu diganti.
D).Pengujian Tegangan Rangkaian Terbuka (Open Circuit Voltage Test)
Pengujian ini dilakukan dengan menggunakan pengukur tegangan (volt meter) digital untuk mengukur tegangan rangkaian terbuka. Jika pengujian menggunakan volt meter analog, pembacaannya kurang akurat. Langkah-langkah yang dilakukan adalah sebagai berikut.
1. Hidupkan lampu kepala (lampu jauh) selama beberapa menit untuk menghilangkan
muatan permukaan (surface charge).
2. Matikan lampu kepala, kemudian hubungkan voltmeter digital pada terminal- terminal
baterai.
3. Baca voltmeter. Baterai yang masih baik dan terisi penuh, harga yang ditunjukkan pada
pengujian tegangan rangkaian terbuka ini adalah 12,6 V. Sebaliknya, jika tegangan yang terukur kurang dari 12,0 V maka baterai sudah jelek.
Gambar 5.25. Pengujian tegangan rangkaian terbuka
Apabila, tegangan baterai hasil pengujian tegangan rangkaian terbuka adalah 12,4 V
atau lebih, pengujian beban berat dapat dilakukan. Jika kurang dari 12,4 V
maka baterai harus diisi sampai penuh untuk dapat melakukan pengujian beban berat. Yakinkan
bahwa muatan permukaan (surface charge) sudah tidak ada. Jika diperlukan, pasang penguji
beban pada baterai dan bebani baterai selama 10 detik kira-kira 200 Amper. Biarkan beberapa menit agar baterai dalam kondisi normal lagi (setelah dibebani tadi), setelah itu lakukan pengujian tegangan rangkaian terbuka.
Tabel 5.5. Lembar Pemeriksaan Baterai(Aki)
Item Trouble Penyebab PerbaikanTindakan KeputusanPengambil
Permeriksaan Visual
Terminal baterai rusak
Kurang perawatan Pemilik Bengkel Kabel baterai dan
terminal kurang
kencang Ganti v
Tutup bocor Kurang penanganan v
Elektrolit bocor Tutup rusak Perapat tutup rusak
Kurang
penanganan Ganti v
Perapat rusak Ganti v
Pemeriksaan jumlah elektrolit
Tinggi elektrolit antar sel lebih dari 10 mm
Sel hubung singkat Penguapan yang disebabkan temperatur luar
ganti v v
Elektrolit habis Kehilangan elektrolit karena
over-charge
Ganti v
Pemeriksaan tegangan
Tegangan baterai >
13,2 Overcharge
Periksa sistem
pengisian v Tegangan baterai
antara 12,5 – 12,9 V Normal Tegangan baterai
antara 12,0 – 12,4 V Under-charge Lakukan tes beban v Tegangan < 11,0 V Kerusakan dalam baterai v
Tegangan baterai 11,0 V
Gangguan
pengisian v
Baterai dibiarkan terlalu lama tidak dipakai
v
E).Pengujian Tegangan antara Terminal Baterai dan Klem
Tahanan antara terminal-terminal baterai dengan klem kabel baterai dapat menyebabkan pengisian baterai menjadi tidak optimum dan hal ini bisa menjadi masalah. Meskipun kelihatannya klem menempel dengan baik terhadap terminal, ketidak-kencangan hubungan antara klem dan terminal baterai dapat menyebabkan terjadinya oksidasi pada logam dan sedikit timbul karat yang dapat menyebabkan tahanan antara klem dan terminal baterai menjadi besar
sehingga terjadi penurunan tegangan (voltage drop) dan menurunkan arus yang mengalir ke
Gambar 5.26. Pengukuran penurunan tegangan pada terminal baterai dan klem
Terminal-terminal baterai dan klemnya harus selalu dibersihkan saat melakukan pemeriksaan baterai. Untuk menguji kelebihan tahanan antara kedua komponen tersebut, dapat dilakukan dengan mengukur penurunan tegangan antara kedua komponen tersebut pada saat
mesin di-start. Pembacaan alat ukur saat mengetes penurunan tegangan harus 0,0 V. Bila hasil
pengukuran menunjukkan lebih besar dari 0,0 V, terminal baterai dan klemnya perlu diperiksa, dibersihkan dan dilakukan pengecekan penurunan tegangannya lagi.
F).Pengujian Beban Berat (Pengujian Kapasitas Aki)
Pengujian ini dilakukan untuk mengetahui kapasitas baterai saat dibebani dengan beban yang besar. Langkah-langkah pengujian ini adalah sebagai berikut.
1. Pasang alat uji beban (load tester) seperti gambar berikut.
Gambar 5.27. Pengujian beban berat
2. Bebani baterai dengan memutar pengontrol kenaikan beban sampai amper meter membaca
tiga kalinya nilai AH baterai tersebut atau satu setengah kali CCA-nya
3. Tahan beban selama tidak lebih dari 15 detik, dan baca penunjukkan harga volt meternya.
4. Jika volt meter menunjukkan harga 9,6 V atau lebih berarti baterai dalam keadaan baik.
Catatan: hasil pengukuran bisa bervariasi, tergantung temperatur. Temperatur yang rendah akan
menurunkan pembacaan tegangan, sehingga larutan elektrolit harus dipertahankan pada 700F
atau lebih. Jika tidak dapat melakukan pengaturan tegangan tersebut, tabel berikut dapat digunakan sebagai pengkonversi.
Tabel 5.6. Tabel Konversi Temperatur-Tegangan pada Pengujian Beban
No Tegangan (volt) Temperatur (0F)
1 9,6 70 atau lebih
2 9,5 60
3 9,4 50
4 9,3 40
5 9,1 30
6 8,9 20
7 8,7 10
8 8,5 0
2.12.Pengisian Baterai(Aki)
Berkaitan dengan pengisian baterai, hal yang sangat penting diketahui adalah alat
pengisi baterai (charger) dan prosedur atau cara mengisi baterai. Berikut ini dijelaskan tentang
alat pengisi baterai dan cara mengisi baterai.
A).Alat Pengisi Aki(Charger)
Gambar 5.28. Charger
Charger baterai secara umum terbagi menjadi dua, yaitu charger otomatis dan charger manual. Charger saat melakukan pengisian, charger akan mengalirkan arus ke baterai untuk mengisi kembali baterai, aksi kimia akan dikembalikan seperti semula. Dengan memberikan
arus listrik pada baterai tersebut, maka sulfat (SO4) akan lepas dari plat positif dan plat negatif
dan beraksi kembali dengan hidrogen (H2) dan membentuk asam sulfat (H2SO4). Oksigen (O2)
bereaksi dengan timah (Pb) pada plat positif dan membentuk PbO2. Pada proses ini terjadi gas
B).Prosedur Pengisian Aki
Pengisian baterai bertujuan untuk mengembalikan kondisi baterai agar siap untuk digunakan lagi. Pengisian baterai dilakukan dengan mengalirkan arus listrik dari pengisi baterai (charger) ke terminal-terminal baterai. Beberapa hal yang perlu diperhatikan saat melakukan pengisian baterai adalah sebagai berikut.
1. Selama pengisian, tutup ventilasi harus dilepas.
2. Ikuti selalu petunjuk pengisian sesuai dengan prosedur yang telah ditentukan pembuat
charger.
Gambar 5.29. Pengisian baterai
3. Lakukan pengisian baterai di ruangan yang ventilasinya baik, dan gunakan pakaian kerja
dan kaca mata.
4. Hindari api dan jangan merokok dekat baterai yang sedang diisi.
5. Isi baterai sesuai dengan laju pengeluaran arus yang biasanya terjadi pada baterai tersebut.
Jika pemakaian arus saat baterai digunakan kecil, maka lakukan pengisian dengan laju pengisian lambat. Jika sering digunakan untuk pengeluaran arus yang besar, maka laju pengisian menggunakan yang lebih besar. Jika ragu dengan penggunaan baterainya, lakukan pengisian dengan laju pengisian lambat.
6. Jangan mengisi baterai yang masih terpasang pada kendaraan. Lepas baterai dan lakukan
pengisian. Kelebihan tegangan akan dapat merusak rangkaian kelistrikan kendaraan.
7. Periksa berat jenis elektrolit secara periodik, tentukan apakah pengisian masih diperlukan.
8. Secara berkala, periksa kelebihan panas pada baterai. Jika temperaturnya lebih dari 1250F,
hentikan dulu pengisian dan biarkan baterai dingin dan lakukan pengisian dengan laju yang lambat.
C).Pengisian Cepat (Fast Charging)
Pengisian cepat digunakan untuk mengisi kembali baterai dengan waktu
pengisian yang pendek dengan laju aliran arus yang tinggi. Pengisian jenis ini dapat memperpendek umur baterai. Jika tidak mendesak, sebaiknya menggunakan cara pengisian
lambat. Beberapa baterai low maintanance tidak bisa dilakukan pengisian cepat.
Langkah-langkah untuk melaksanakan pengisian cepat dijelaskan sebagai berikut. 1. Persiapan pengisian:
a. Bersihkan kotoran dan karat pada baterai, dan jika perlu bersihkan terminal- terminal baterai.
c. Jika baterai diisi dalam keadaan masih terpasang pada kendaraan, lepas kedua kabel positif dan negatif baterai.
2. Tentukan arus pengisian dan waktu untuk pengisian cepat: beberapa charger mempunyai alat penguji untuk menentukan arus pengisian dan waktu yang diperlukan. Jika tidak ada alat tersebut pada charger, lihat tabel untuk menentukan arus dan waktu pengisian.
Tabel 5.7. Besarnya Arus dan Lamanya Waktu Pengisian
Laju Pengisian untuk Baterai Kosong Besarnya
RC Besarnya AH 5 Amper 10 Amper 20 Amper 30 Amper 40 Amper 75 menit
atau lebih ≤ 50 AH 10 jam 5 jam 2,5 jam 2 jam 75 – 115
menit 50 – 75 AH 15 jam 7,5 jam 3,25 jam 2,5 jam 2 jam 115 – 160
menit
75 – 100
AH 20 jam 10 jam 5 jam 3 jam 2,5 jam 160 – 245
menit 100 – 150AH 30 jam 15 jam 7,5 jam 5 jam 3,5 jam
3. Menggunakan charger:
a. yakinkan saklar utama dan timer berada pada posisi OFF dan diatur pada posisi minimum.
b. Hubungkan kabel positif charger ke terminal positif baterai dan kabel negatif charger ke terminal negatif baterai.
c. Hubungkan kabel power charger ke sumber listrik.
d. Set saklar pengatur tegangan ke besarnya tegangan baterai yang benar. e. Geser saklar utama ke posisi ON.
f. Setel timer ke waktu yang diinginkan dan setel arus pengisian sesuai dengan yang telah ditentukan.
4. Setelah timer OFF, periksa hasil pengisian dengan voltmeter. Pembacaan voltmeter harus 12,6 V atau lebih. Jika tegangan tidak naik atau jika tidak muncul gelembung-gelembung gas berapa lamapun diisi, kemungkinan ada masalah pada baterai, misalnya hubungan singkat di bagian dalam baterai.
5. Apabila tegangan sudah mencapai tegangan yang disyaratkan, a. Posisikan saklar arus ke posisi minimum
b. Matikan saklar charger.
c. Lepas kabel-kabel baterai dari terminal-terminal baterai. d. Bersihkan kotak baterai jika ada asam yang tercecer.
D).Pengisian Lambat
Pengisian yang cepat sebenarnya tidak disarankan untuk dilakukan karena memperpendek umur pakai baterai. Untuk menghasilkan pengisian yang sempurna, diperlukan pengisian dengan arus yang rendah. Prosedur pengisian lambat sama dengan prosedur pengisian cepat, kecuali beberapa hal berikut.
1. Arus pengisian maksimum harus kurang dari 1/10 dari kapasitas baterai. Misalnya baterai
40 H harus diisi dengan lambat pada arus pengisian 4 amper atau kurang.
3. Atur ulang pengontrol arus jika diperlukan selama pengisian.
4. Saat baterai hampir penuh, gas hidrogen dihasilkan pada proses ini. Jika tidak ada lagi
kenaikan tegangan baterai selama satu jam, berarti baterai sudah terisi penuh. Tegangan baterai 12,6 V atau lebih.
F).Start dengan Aki Bantuan
Gambar 5.30. Menjamper baterai
Baterai yang sudah habis atau kosong tidak dapat digunakan untuk menghidupkan mesin melalui sistem starter. Untuk membantu mengaktifkan sistem starter diperlukan baterai lain untuk membantu memberikan arus listrik. Penambahan baterai ini harus dihubungkan secara paralel sehingga tegangan yang ada tetap sama namun arus yang dikeluarkan baterai dapat lebih besar. Untuk melakukan jamper diperlukan kabel baterai warna merah dan hitam. Langkah-langkah yang perlu dilakukan adalah sebagai berikut.
1. Siapkan baterai bantuan dan kabel baterai warna merah dan hitam yang ujungnya
mempunyai penjepit.
2. Sambungkan kabel warna merah ke terminal positif baterai kosong dan ujung kabel lainnya
ke terminal positif baterai bantuan.
3. Sambungkan kabel baterai berpenjepit warna hitam ke terminal negatif baterai bantuan dan
ujung kabel lainnya ke bodi mesin atau rangka yang terhubung baik dengan massa. Hindari kabel negatif ini langsung ke terminal negatif baterai kosong untuk mengurangi resiko percikan api yang dapat menimbulkan ledakan.
4. Jika dijumper dari baterai mobil yang lain, hidupkan dulu mesin mobil tersebut dan set di
Gambar 5.31. Menjumper baterai pada kendaraan
G).Hubungan Seri pada Aki
Sistem kelistrikan pada kendaraan, terutama pada kendaraan besar, biasanya menggunakan sistem yang bertegangan 24 volt. Jika tidak tersedia baterai dengan tegangan 24 volt, maka untuk memenuhinya dapat dilakukan dengan menggunakan dua buah baterai 12 volt yang dihubungkan secara seri. Gambar di bawah mengilustrasikan dua buah baterai yang dihubungkan secara seri, yaitu menghubungkan terminal positif baterai 1 dengan terminal negatif baterai 2. Terminal negatif baterai 1 dihubungkan dengan massa dan terminal positif baterai 2 dihubungkan ke rangkaian.
BAB III
PENUTUP
3.1.
Kesimpulan
Adapun kesimpulan dari pembuatan makalah ini yaitu:
1.
Aki atau Storage Battery adalah sebuah sel atau elemen sekunder dan merupakan
sumber
arus listrik searah yang dapat mengubah energy kimia menjadi energy listrik.
2.
Terdapat reaksi redoks yang terjadi pada aki
3.
Aki memiliki berbegai jenis dan bermanfaat dalam menyimpan energi listrik
4.
Terdapat berbagai cara yang digunakan dalam merawat aki.
3.2. Saran
Hal-hal penting yang harus diperhatikan tentang accumulator :
Accu termasuk benda yang mudah terbakar, oleh sebab itu jangan memindahkan posisi
Accu mobil pada lokasi yang kurang aman.
Selalu meng-kontrol ketinggian
air Accu
. Jika kurang segera tambahkan karena akan
mempengaruhi kinerjanya. Tetapi jangan sampai melebihi, karena Accu dapat meledak
akibat tidak ada ruang untuk melepaskan uapnya.
Periksa
terminal Accu
. Jika ada kerak putih, gosok dengan sikat kawat atau siram
dengan air panas jika sudah tebal. Kerak putih ini berbahaya karena dapat menggerus
terminal dan membuat terminal dan elemen kabel saling mengikat.
Accu
mengandung bahan beracun berbahaya, jangan sembarangan membuang Accu
bekas. Umumnya pedagang aki menerima atau membeli aki bekas untuk didaur ulang.
Selain menjaga lingkungan, Accu bekas ini dapat mengurangi biaya pembelian Accu baru.
DAFTAR PUSTAKA
Purba M, 2006. KIMIA 3. Jakarta. Penerbit Erlangga.
Situs Internet:
http://www.inverterplus.com/2010/04/tips-merawat-aki-mobil.html
http://www.indobatt.com/in/smart.php