TEKN IK IS OLAS I D N A
D ARI D ARAH
Pe n yu s u n
Hidayat, dr
NIP. 19751220 200312 1 001
D EP ARTEMEN BIOKIMIA
FAKU LTAS KED OKTERAN
DAFTAR ISI
DAFTAR ISI
……… iBAB 1. PENDAHULUAN
………..……… 1BAB 2. TINJAUAN PUSTAKA
DNA (Deoxyribose Nucleic Acid)
………..… 3Ekspresi Genetik
………...…….………..… 4Isolasi DNA
……….………..… 4BAB 3. PEMBUATAN REAGENSIA UNTUK
ISOLASI DNA
………..………... 7BAB 4. ISOLASI DNA DANPENGUKURAN
KONSENTRASI DNA DARI WHOLE BLOOD
.……….…. 15BAB 5. PENUTUP
………. 191
BAB 1.
PENDAHULUAN
Latar Belakang
Isolasi DNA merupakan salah satu langkah awal yang harus dilakukan dalam proses
pemeriksaan DNA. Sampai saat ini, pemeriksaan terhadap DNA sudah banyak dilakukan di
berbagai institusi, tidak hanya yang bersifat penelitian, tetapi juga sudah mulai dilakukan
untuk pelayanan kesehatan.
Dalam upaya pengembangan ilmu di bidang pemeriksaan DNA ini, tentunya harus
sudah dimulai pada institusi pendidikan kesehatan, terutama pada institusi pendidikan
kedokteran. Mahasiswa kedokteran sudah seharusnya mendapatkan pembelajaran tentang
pemeriksaan DNA, dimulai dari teknik isolasi DNA, Polymerase Chain Reaction (PCR),
Elektroforesis, dan sebagainya.
Beberapa tahun yang lalu, Penulis mendapatkan kesempatan dari Departemen Biokimia
Fakultas Kedokteran USU untuk mempelajari dasar-dasar pemeriksaan DNA di Lembaga
Biologi Molekuler Eijkman di Jakarta. Selama satu bulan, penulis mempelajari tentang
metode pemeriksaan DNA, dimulai dari mempersiapkan reagensia yang akan dipergunakan,
teknik mengisolasi DNA dari darah, PCR, Elektroforesis, Restriction Fragment Length
Polymorfism (RLFP), serta pemahaman dasar tentang Sequencing DNA.
Artikel maupun tulisan tentang teknik pemeriksaan DNA sudah dapat kita jumpai di
beberapa buku maupun dari sumber-sumber lainnya, namun penulis berusaha untuk mengulas
kembali tentang pemeriksaan DNA secara detil, dan pada kesempatan ini, penulis membatasi
tentang teknik untuk melakukan isolasi DNA dari darah serta cara-cara mempersiapkan
reagensia yang akan digunakan.
Tujuan
Sejak awal, Departemen Biokimia FK USU berupaya memberikan dasar-dasar
pengetahuan tentang Biokimia kepada mahasiswa. Dalam perkembangan ilmu, Biokimia
sudah berkembang ke tingkat molekuler, oleh karena itu Departemen Biokimia FK USU juga
telah dilaksanakan adalah dengan mengirimkan penulis mengikuti pelatihan/ magang di
Lembaga Biologi Molekuler Eijkman di Jakarta, dengan harapan bahwa segala hal yang telah
didapatkan saat pelatihan, dapat disosialisasikan dan diaplikasikan kembali di departemen.
Oleh karena itu, tulisan ini dibuat sebagai sarana berbagi pengalaman ilmu dengan
tujuan utama agar kiranya perkembangan ilmu pengetahuan khususnya tentang pemeriksaan
DNA dapat dikembangkan di Fakultas Kedokteran USU. Penulis berupaya agar tulisan ini
dapat memberikan pengetahuan secara rinci dan detil tentang teknik melakukan isolasi DNA
dari darah, sehingga nantinya dapat diaplikasikan dan diimplementasikan ke dalam kurikulum
Fakultas Kedokteran USU, terutama dalam proses pembelajaran praktikum mahasiswa di
laboratorium.
Selain itu, penulis juga berharap bahwa tulisan ini tidak hanya menjadi pedoman di
Fakultas Kedokteran USU, tetapi juga bisa bermanfaat bagi bidang ilmu yang fokus terhadap
BAB 2.
TINJAUAN PUSTAKA
DNA (Deoxyribose Nucleic Acid)
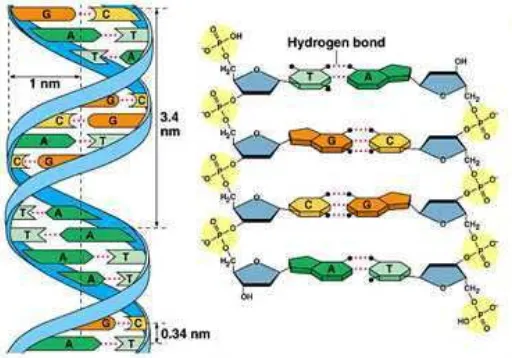
Asam deoksiribonukleat (Deoxyribose Nucleic Acid, DNA) adalah suatu makromelekul yang mengandung informasi genetik pada makhluk hidup, termasuk juga virus.
Komposisi DNA berupa polimer nukleotida yang terdiri atas gula deoksiribosa, gugus
fosfat dan 2 macam basa nitrogen yakni purin (adenin dan guanin) atau pirimidin (timin atau
sitosin). Gugus fosfat akan berikatan dengan gula deoksiribosa pada posisi 5’ atau 3’ melalui
ikatan fosfodiester, sedangkan basa nitrogen akan berikatan dengan gula deoksiribosa pada
posisi 1’ melalui ikatan glikosida.
DNA pada eukariot maupun prokariot, memiliki struktur heliks ganda (gambar 1).
Struktur tersebut dibentuk dari dua rantai polinukleotida yang saling berkomplemen antara
basa purin di rantai yang satu, berpasangan dengan basa pirimidin di rantai yang lainnya
melalui ikatan hidrogen. Kedua rantai polinukleotida tersebut memiliki arah ikatan yang
berbeda (antiparalel), dengan satu rantai berarah 5’ ke 3’ sedangkan rantai lainnya berarah 3’
ke 5’. Stabilitas struktur DNA disebabkan oleh interaksi hidrofobik antara tumpukan
pasangan basa aromatik antar nukleotida. Meskipun begitu tetap dapat mengalami gangguan
yang menyebabkan terjadinya hidrolisis ataupun denaturasi. DNA dapat mengalami hidrolisis
dalam suasana asam yang kuat, sedangkan denaturasi dapat terjadi akibat temperatur tinggi,
suasana basa (pH≥9) dan penambahan urea atau formamida.
Gambar 1. Sketsa Struktur DNA
Informasi genetik pada DNA dapat mengalami perubahan melalui mutasi. Mutasi yang
terjadi pada tingkat DNA dapat berupa mutasi yang tidak menyebabkan perubahan asam
amino yakni mutasi diam (silent), mutasi yang membuat susunan polipeptida menjadi berubah bentuk/ fungsi yakni mutasi missense, dan mutasi yang menyebabkan terhentinya sintesis peptida yakni mutasi nonsense. Sebagai konsekuensi, mutasi pada gen dapat mengakibatkan perubahan pada struktur maupun aktivitas protein. Lebih lanjut lagi dapat
menyebabkan terjadinya perubahan tampilan (fenotif) pada individu dengan kata lain terjadi
manifestasi klinis.
Ekspresi Genetik
DNA sebagai materi genetik berfungsi menyimpan informasi jenis protein yang akan
dihasilkan pada proses ekspresi gen. Perlengkapan untuk ekspresi gen seperti tRNA dan
rRNA juga disandikan dari DNA.
Urut-urutan nukleotida pada DNA yang diterjemahkan menjadi urut-urutan asam amino
pada protein disebut sebagai kode genetik atau kodon dengan 3 nukleotida terurut (triplet)
sebagai satu kodon. Satu kodon dapat menyandikan satu jenis asam amino sedangkan satu
macam asam amino dapat disandi oleh beberapa jenis kodon. Penterjemahan kodon menjadi
polipeptida terjadi melalui suatu proses transkripsi DNA menjadi RNA (mRNA, rRNA, dan
tRNA). Selanjutnya mRNA akan ditranslasi dalam kompleks ribosom yang mengandung
rRNA menjadi jenis asam amino yang dibawakan oleh tRNA, susunan asam-asam amino
yang tersusun membentuk polipeptida yang kemudian mengalami proses paskatranslasi
menjadi bentuk protein yang dimaksud. Protein-protein tersebut kemudian akan berfungsi
secara struktural, berperan dalam pensinyalan, transport, imunitas, nutrisi, regulasi, maupun
secara katalitik menghasilkan fenotif tertentu pada individu.
Isolasi DNA
Isolasi DNA merupakan tahap awal yang dilakukan sebelum kita melakukan penelitian
lebih lanjut pada DNA. Apabila kita sudah meng-isolasi DNA, maka tahap berikutnya kita
dapat melakukan amplifikasi DNA, Polymerase Chain Reaction, Sequencing, dan lain-lain.
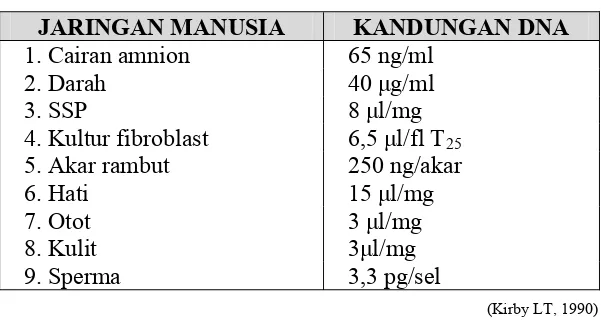
Dalam isolasi maupun pemeriksaan DNA, mutu sample harus diperhatikan. Jika
5 Alternatif lainnya adalah cairan semen, akar rambut, saliva atau urin. Sampel segar
merupakan sample yang paling baik, tetapi jika tidak memungkinkan, misalnya lokasi
pemeriksaan/pengambilan yang cukup jauh, maka bercak darah atau sperma kering
merupakan pilihan yang cukup baik.
Tabel 1. Kandungan DNA pada berbagai jaringan
JARINGAN MANUSIA KANDUNGAN DNA
1. Cairan amnion 65 ng/ml
DNA rantai ganda secara kimia bersifat sangat inert tetapi secara fisika bersifat sangat rapuh (fragile). Karena panjang dan berpilin, dengan stabilitas lateral yang rendah, DNA dengan BM yang tinggi mudah terpotong oleh tekanan hidrodinamik. Aliran hidrodinamik
(yang dihasilkan dari pipetting, pengocokan, dan pengadukan) memiliki kemampuan untuk memotong kedua rantai DNA. Makin panjang rantai DNA, makin rendah tekanan yang
dibutuhkan untuk menghancurkannya. Oleh karena itu DNA genom mudah diperoleh dalam
bentuk terfragmentasi.
Modifikasi metode isolasi DNA dari sel mamalia banyak dilakukan untuk keperluan
penggunaan DNA tersebut lebih lanjut. Contohnya untuk konstruksi pada vector
bacteriophage λ, diperlukan DNA (100-150 kb). Untuk keperluan tersebut, biasanya sel mamalia didigesti menggunakan proteinase K dengan penambahan EDTA dan detergen misalnya SDS (Sodium Dodecyl Sulphate), selanjutnya dilakukan ekstraksi menggunakan fenol. Sedangkan untuk konstruksi dalam cosmid, panjang DNA harus (> 200 kb). Sulit untuk
memperoleh isolate DNA dengan ukuran sebesar itu bila digunakan metode isolasi
menggunakan pelarut organic dan mechanical shearing karena DNA akan banyak yang hilang.
Beberapa prosedur isolasi DNA dari sel dan jaringan mamalia :
1. Cara Blind dan Stafford (1976); Isolasi dilakukan menggunakan proteinase K dengan penambahan EDTA dan SDS. EDTA berfungsi menghilangkan kation divalent dan menghambat DNA-se, sedangkan SDS berfungsi untuk melarutkan membrane sel serta men-denaturasi protein. Selanjutnya dilakukan ekstraksi menggunakan pelarut organik
seperti fenol. RNA kontaminan dieliminasi dengan RNA-se, sedangkan kontaminan dengan BM rendah dihilangkan dengan dialysis. DNA yang dihasilkan berukuran 100-150 kb, cukup untuk konstruksi genome DNA libraries dalam vector bakteriophage . 2. Cara Kupiec, dkk (1987); Mencakup proses digesti menggunakan proteinase K, disosiasi
kompleks DNA-protein dengan formamide konsentrasi tinggi, dan residu proteinase K dihilangkan dengan dialysis. Metode ini membutuhkan waktu yang lebih lama dan
konsentrasi DNA yang dihasilkan lebih rendah (~ 10 µg/ml).
3. Cara Bowteli (1987); Menggunakan guanidine HCl untuk menghancurkan sel. DNA yang dihasilkan lebih kecil (~ 80 kb). Keuntungannya, metode ini lebih cepat dan dapat
digunakan untuk mengekstraksi DNA secara simultan dari sel-sel yang berasal dari
jaringan yang berbeda.
Untuk kuantifikasi DNA/RNA dapat digunakan alat spektrofotometer. Pengukuran
harus dilakukan pada panjang gelombang ( ) 260 nm dan 280 nm. Pengukuran pada 260 nm
digunakan untuk menghitung konsentrasi asam nukleat dalam sample. 1 OD (Optical Density)
sebanding dengan ± 50 µg/ml dsDNA. Dari nilai perbandingan antara OD260 / OD280 dapat
diperkirakan kemurnian asam nukleat tersebut. Kemurnian hasil preparasi DNA memiliki
nilai :
OD260 / OD280 > 1,75
BAB 3.
PEMBUATAN REAGENSIA UNTUK ISOLASI DNA
LARUTAN BUFFER DAN REGENSIA ISOLASI DNA
Larutan buffer dan reagensia yang digunakan saat melakukan isolasi DNA sebenarnya
dapat kita peroleh dengan membelinya dari toko atau supplier bahan-bahan biologi molekuler.
Untuk kepentingan praktikum mahasiswa, kita dapat membuat larutan buffer dan reagensia
tersebut dengan pertimbangan lebih efisien dan ekonomis.
Adapun larutan buffer dan reagensia yang akan kita buat adalah sebagai berikut :
● 1 X RBC Lysis Solution ● Isopropanol
● Cell Lysis Solution ● 70 % Ethanol
● RNAse 5 mg/ml ● Tris-EDTA
● 5 M Ammonium acetate
Dalam proses pembuatan larutan di laboratorium, dikenal istilah Stok Solution dan
Work Solution. Stok Solution adalah larutan yang dibuat pertama kali dan nantinya akan dijadikan sebagai larutan utama dan akan disimpan. Work Solution adalah larutan yang
dibuat dari Stok Solution dengan melakukan pengenceran, oleh karena itu larutan ini
mempunyai konsentrasi yang lebih rendah dibandingkan Stok Solution.
Prosedur pembuatan larutan yang akan digunakan untuk isolasi DNA adalah sebagai
berikut :
1. 1 X RBC (RED BLOOD CELL) LYSIS SOLUTION
7 Seperti yang telah dijelaskan di atas, pertama sekali kita akan membuat Stok Solution, yaitu
larutan 10 X RBC Lysis. Berikut komposisi dan urut-urutan bahan kimia yang akan diproses
untuk membuat larutan ini :
10 X RBC Lysis 1,45 M NH4Cl
100 mM KHCO3
100 mM EDTA pH 8,0
Stok Solution : 10 X RBC Lysis
a. 1,45 M NH4Cl
1 M NH4Cl ≈ 1 satuan berat molekul NH4Cl (gr) dalam 1 liter dd H2O
≈ 53,5 gr NH4Cl dalam 1 liter dd H2O
1,45 M NH4Cl ≈ 1,45 x 53,5 gr NH4Cl dalam 1 liter dd H2O
≈ 77,575 gr NH4Cl dalam 1 liter dd H2O
Untuk 100 ml ≈ 100/1000 ml x 77,575 gr NH4Cl
≈ 7,7575 gr NH4Cl.
Cara membuat :
1. Timbang 7,76 gr NH4Cl dalam sebuah gelas ukur dengan menggunakan timbangan
digital ( pada saat gelas ukur di atas timbangan dan zat NH4Cl belum dimasukkan
ke dalamnya, timbangan harus dikalibrasi sampai menunjukkan angka 0,00 ).
2. Tuang 100 ml ddH2O ( menggunakan tabung ukur ) ke dalam gelas ukur tadi.
3. Aduk campuran tadi dengan menggunakan stirrer.
4. Bila larutan sudah homogen, tuang ke dalam botol kaca khusus tempat larutan.
b. 100 mM KHCO3
1 M KHCO3 ≈ 1 satuan berat molekul KHCO3 (gr) dalam 1 liter dd H2O
≈ 100,12 gr KHCO3 dalam 1 liter dd H2O
100 mM KHCO3 ≈ 0,1 M KHCO3
0,1 M KHCO3 ≈ 0,1 x 100,12 gr KHCO3 dalam 1 liter dd H2O
≈ 10,012 gr KHCO3 dalam 1 liter dd H2O
Untuk 100 ml ≈ 100/1000 ml x 10,012 gr KHCO3
≈ 1,0012 gr KHCO3.
Cara membuat :
1. Timbang 1,00 gr KHCO3.
2. Tuang 100 ml ddH2O.
3. Aduk campuran tadi dengan menggunakan stirrer.
c. 100 mM EDTA pH 8,0
1 M EDTA ≈ 1 satuan berat molekul EDTA (gr) dalam 1 liter dd H2O
≈ 292,2 gr EDTA dalam 1 liter dd H2O
100 mM EDTA ≈ 0,1 M EDTA
0,1 M EDTA ≈ 0,1 x 292,2 gr EDTA dalam 1 liter dd H2O
≈ 29,22 gr EDTA dalam 1 liter dd H2O
Untuk 100 ml ≈ 100/1000 ml x 29,22 gr EDTA
≈ 2,922 gr EDTA.
Cara membuat :
1. Timbang 2,92 gr EDTA.
2. Tuang 80 ml ddH2O dulu (nanti sisa ddH2O diberikan di akhir setelah penyetaraan
pH).
3. Aduk campuran tadi dengan menggunakan stirrer (stirrer diletakkan dekat dengan
pH-meter).
4. Set/ Kalibrasi pH-meter antara 7 dan 9
(Celupkan elektroda pada lar. standar pH=7 tekan tombol Cal pH=7,00;
Celupkan elektroda pada lar. Standar pH=9 tekan tombol Cal pH=9,03)
5. Celupkan elektroda pH-meter ke dalam larutan EDTA yang masih di stirrer.
6. Tekan tombol “Read” hasil pH=3,00
7. Teteskan 1 M KOH sampai pH larutan 8,0 dengan menggunakan pipet transfer
( Bila perlu saat pH mendekati 8,0, ganti pipet transfer dengan pipet Eppendorf ).
8. Bila pH sudah 8,0, tuang larutan ke dalam tabung ukur
9. Tambahkan ddH2O sampai skala 100 ml.
10.Tuang ke dalam botol kaca khusus tempat larutan.
10 X RBC Lysis
100 ml 1,45 M NH4Cl + 100 ml 100 mM KHCO3 + 100 ml EDTA pH 8,0
1. Campurkan ke-3 larutan yang sudah dibuat tadi dalam sebuah botol larutan.
2. Tempelkan label pada botol.
3. Lapisi tutup botol dengan kertas.
4. Sterilisasi dengan menggunakan autoclave pada 121oC selama 15` 5. Simpan pada temperature kamar.
1 X RBC Lysis
Cara membuat :
V1 . N1 = V2 . N2
V1 . 10 = 100 ml . 1
10 V1 = 100 ml
V1 = 10 ml
1. Ambil 10 ml larutan 10 X RBC Lysis.
2. Tambahkan 90 ml dd H2O.
Larutan 1 X RBC Lysis 100 ml.
2. CELL LYSIS SOLUTION
Komposisi dan urut-urutan bahan kimia yang akan diproses untuk membuat larutan ini adalah
sebagai berikut :
Cell Lysis Solution 2 M Tris-HCl 0,25 M EDTA pH 8,0 20% SDS
a. 2 M Tris-HCl
1 M Tris base ≈ 1 satuan berat molekul Tris (gr) dalam 1 liter dd H2O
≈ 121,14 gr Tris dalam 1 liter dd H2O
2 M Tris base ≈ 2 x 121,14 gr Tris dalam 1 liter dd H2O
≈ 242,28 gr Tris dalam 1 liter dd H2O
Untuk 10 ml ≈ 10/1000 ml x 242,28 gr Tris
Cara membuat :
1. Timbang 2,42 gr Tris.
2. Tuang 8 ml ddH2O dulu (nanti sisa ddH2O diberikan di akhir setelah penyetaraan
pH).
3. Aduk campuran tadi dengan menggunakan stirrer (stirrer diletakkan dekat dengan
pH-meter).
4. Set/ Kalibrasi pH-meter antara 7 dan 9
5. Celupkan elektroda pH-meter ke dalam larutan Tris yang masih di stirrer.
6. Tekan tombol “Read” hasil pH=10,2
7. Teteskan 1 M HCl sampai pH larutan 8,0 dengan menggunakan pipet transfer ( Bila
perlu saat pH mendekati 8,0, ganti pipet transfer dengan pipet Eppendorf ).
8. Bila pH sudah 8,0, tuang larutan ke dalam tabung ukur
9. Tambahkan ddH2O sampai skala 10 ml.
10.Tuang ke dalam botol kaca khusus tempat larutan.
b. 0,25 M EDTA pH 8,0
1 M EDTA ≈ 1 satuan berat molekul EDTA (gr) dalam 1 liter dd H2O
≈ 292,2 gr EDTA dalam 1 liter dd H2O
0,25 M EDTA ≈ 0,25 x 292,2 gr EDTA dalam 1 liter dd H2O
≈ 73,05 gr EDTA dalam 1 liter dd H2O
Untuk 100 ml ≈ 100/1000 ml x 73,05 gr EDTA
≈ 7,305 gr EDTA.
Cara membuat :
1. Timbang 7,30 gr EDTA.
2. Tuang 80 ml ddH2O dulu (nanti sisa ddH2O diberikan di akhir setelah penyetaraan
pH).
3. Aduk campuran tadi dengan menggunakan stirrer (stirrer diletakkan dekat dengan
pH-meter).
4. Set/ Kalibrasi pH-meter antara 7 dan 9
5. Celupkan elektroda pH-meter ke dalam larutan EDTA yang masih di stirrer.
6. Tekan tombol “Read” hasil pH=3,00
7. Teteskan 1 M KOH sampai pH larutan 8,0 dengan menggunakan pipet transfer
( Bila perlu saat pH mendekati 8,0, ganti pipet transfer dengan pipet Eppendorf ).
8. Bila pH sudah 8,0, tuang larutan ke dalam tabung ukur
9. Tambahkan ddH2O sampai skala 100 ml.
10.Tuang ke dalam botol kaca khusus tempat larutan.
c. 10% SDS pH 7,2
Cara membuat :
1. Timbang 10 gr SDS.
2. Tuang 90 ml ddH2O dulu (nanti sisa ddH2O diberikan di akhir setelah penyetaraan
pH).
3. Aduk campuran tadi dengan menggunakan stirrer (stirrer diletakkan dekat dengan
pH-meter).
4. Set/ Kalibrasi pH-meter antara 7 dan 9
5. Celupkan elektroda pH-meter ke dalam larutan EDTA yang masih di stirrer.
6. Tekan tombol “Read”
7. Teteskan 1 M HCl sampai pH larutan 7,2 dengan menggunakan pipet transfer ( Bila
perlu saat pH mendekati 7,2 ganti pipet transfer dengan pipet Eppendorf ).
8. Bila pH sudah 7,2 tuang larutan ke dalam tabung ukur.
9. Tambahkan ddH2O sampai skala 100 ml.
10.Tuang ke dalam botol kaca khusus tempat larutan.
Cell Lysis Solution
2 M Tris-HCl : 1250 μl 0,25 M EDTA pH 8,0 : 12,5 ml 10% SDS pH 7,2 : 6,25 ml
1. Campurkan ke-3 larutan yang sudah dibuat tadi sebanyak di atas dalam sebuah botol
larutan.
2. Tempelkan label pada botol.
4. Sterilisasi dengan menggunakan autoclave pada 121oC selama 15` 5. Simpan pada temperatur kamar.
3. RNA-ASE 5 MG/ML
Larutan RNA-se diperoleh melalui pemesanan/ pembelian dari toko kimia yang menjual/
menyediakan bahan-bahan untuk biologi molekuler.
4. 5 M AMMONIUM ACETATE
1 M NH4OAc ≈ 1 satuan berat molekul NH4OAc (gr) dalam 1 liter dd H2O
≈ 77,09 gr NH4OAc dalam 1 liter dd H2O
5 M KHCO3 ≈ 5 x 77,09 gr NH4OAc dalam 1 liter dd H2O
≈ 385,45 gr NH4OAc dalam 1 liter dd H2O
Untuk 50 ml ≈ 50/1000 ml x 385,45 gr NH4OAc
≈ 19,275 gr NH4OAc.
Cara membuat :
1. Timbang 19,27 gr NH4OAc.
2. Tuang 50 ml ddH2O.
3. Aduk campuran tadi dengan menggunakan stirrer.
4. Bila larutan sudah homogen, tuang ke dalam botol kaca khusus tempat larutan.
5. Tempelkan label pada botol.
6. Lapisi tutup botol dengan kertas.
7. Sterilisasi dengan menggunakan autoclave pada 121oC selama 15`. 8. Simpan pada temperature kamar.
5. ISOPROPANOL
Merupakan bahan dasar dalam bentuk larutan yang dapat dibeli dari toko kimia.
6. 70 % ETHANOL
Larutan ethanol 70 % didapatkan dari pengenceran larutan ethanol 96 %.
7. TRIS - EDTA
Komposisi dan urut-urutan bahan kimia yang akan diproses untuk membuat larutan ini adalah
sebagai berikut :
1 X Tris-EDTA
1 M NH4Cl pH 8,0 5 ml
0,25 M EDTA pH 8,0 2 ml
15
BAB 4.
ISOLASI DAN PENGUKURAN KONSENTRASI DNA DARI
WHOLE BLOOD
A. ISOLASI DNA
ALAT DAN BAHAN
ALAT
1. Spuit disposable.
2. Tabung sentrifugasi Falcon 12 ml.
3. Tabung sentrrifugasi Sarstedt 10 ml.
4. Rak tabung.
5. Pipet transfer.
6. Alat vortex (Thermolyne type 37600 mixer).
7. Refrigerate Centrifuge (SORVALL 6000B-Dupont).
8. Micropipette (Eppendorf)
9. Tip biru/ kuning.
10.Waterbath 37oC.
BAHAN
1. Sampel darah vena.
2. Larutan 1 X RBC Lysis.
3. Larutan Cell Lysis.
4. RNAse 5 mg/ml.
5. Larutan protein presipitation (5 M Ammonium acetate).
6. Isopropanol.
7. Ethanol 70 %.
CARA KERJA (MODIFIKASI DARI PUREGENE)
1. Ambil 2,5 ml Whole Blood yang telah bercampur dengan EDTA ke dalam tabung
centrifuge.
2. Tambahkan 7,5 ml (3 x volume darah) larutan 1 X RBC Lysis. Bolak-balik tabung 2-3
kali. Inkubasi selama 10 menit dalam temperature ruang.
3. Sentrifugasi tabung dengan kecepatan 1500 rpm selama 10 menit pada 36 oC.
4. Buang supernatant, sisakan lapisan bawah yang mengandung sel darah putih (pellet sel
darah putih). Hancurkan pellet sel darah putih dengan menggunakan pipet transfer. Bila
telah hancur, tambahkan larutan 1 X RBC Lysis. Kemudian sentrifugasi kembali tabung
dengan kecepatan 1500 rpm selama 10 menit pada 36 oC. Ulangi langkah ini sampai 2-3 kali.
5. Pada pengulangan yang terakhir, setelah pellet sel darah putih hancur, tambahkan 625 l
Larutan Cell Lysis ke dalam tabung sentrifuge dan kocok dengan menggunakan pipet
transfer untuk menghancurkan sel hingga homogen.
6. Tambahkan 2,5 ml RNAse A (5 mg/ml) ke dalam tabung sentrifuge. Campur larutan
dengan mengocoknya bolak-balik selama 25 kali.
7. Inkubasi selama 30 menit atau lebih pada suhu 37oC di dalam waterbath.
8. Tambahkan 416,5 l Ammonium acetate 5 M ke dalam tabung sentrifuge untuk
mengendapkan protein. Lalu tabung divortex.
9. Sentrifugasi tabung dengan kecepatan 3000 rpm selama 15 menit pada 4 oC. Pada akhir tahap ini, akan terlihat endapan protein berwarna coklat pada dasar tabung (pellet protein).
10.Tuangkan supernatant yang mengandung DNA ke dalam tabung lain yang sudah berisi
1925 l isopropanol. Bolak-balik tabung 25-30 kali hingga tampak seperti benang-benag
DNA.
11.Sentrifugasi tabung dengan kecepatan 3000 rpm selama 5 menit pada 4 oC. Pada akhir tahap ini, akan terlihat endapan DNA berwarna putih pada dasar tabung (pellet DNA).
12.Buang supernatant dan tambahkan 2082 l Ethanol 70%. Bolak-balik tabung beberapa
kali untuk mencuci DNA.
13.Sentrifugasi kembali tabung dengan kecepatan 3000 rpm selama 5 menit pada 4 oC. 14.Buang supernatant yang merupakan ethanol, biarkan DNA mengering di udara (selama 1
malam).
17 16.Inkubasi selama 2 jam pada suhu 37oC di dalam waterbath.
17.Setelah selesai diinkubasi, tabung divortex terlebih dahulu, kemudian pindahkan larutan
DNA ke dalam tabung Eppendorf dengan menggunakan mikropipet.
18.Simpan DNA pada temperature -20 oC.
B. PENGUKURAN KONSENTRASI DNA
ALAT DAN BAHAN
ALAT
1. Spektrofotometer UV (Pharmacia LKB – Ultraspec III).
2. Kuvet.
3. Micropippet (Eppendorf).
4. Tip biru/ kuning.
5. Botol semprot.
6. Beaker glass (untuk wadah buangan).
BAHAN
1. DNA yang akan diperiksa.
2. ddH2O steril.
3. Ethanol 70 %.
CARA KERJA
1. Nyalakan alat spektrofotometer selama ± ½ jam untuk memanaskannya terlebih dahulu.
2. Bersihkan kuvet dengan ethanol 70%.
3. Set alat pada panjang gelombang ( ) 260 nm dengan menekan tombol wavelength +/-.
4. Isi kuvet dengan 995 l ddH2O steril (gunakan sebagai blanko).
5. Masukkan kuvet tersebut ke dalam alat (perhatikan cara meletakkan bagian yang akan
dilalui sinar).
6. Tekan tombol “Set Ref”. Layar akan menunjukkan angka OD = 0,000. Keluarkan kuvet
berisi ddH2O steril tadi dari alat spektrofotometer.
7. Ambil kuvet yang lain dan isi ke dalamnya dengan 5 l DNA (dalam hal ini berarti DNA
8. Masukkan kuvet ke dalam spektrofotometer dan catat nilai OD-nya.
9. Keluarkan kuvet dan buang larutan isinya. Cuci kuvet dengan ddH2O steril dan keringkan
dengan tissue.
10.Ulangi tahap 3-8 untuk pada panjang gelombang ( ) 280 nm.
HASIL DAN PERHITUNGAN
HASIL
Panjang gelombang (λ) Optical Density (OD)
19
BAB 5.
PENUTUP
Metode Isolasi DNA cara Puregene dapat digunakan untuk isolasi DNA dari darah
perifer dengan perolehan konsentrasi DNA yang cukup tinggi. Selanjutnya, pengukuran
konsentrasi DNA hasil isolasi dapat dilakukan dengan metode spektrofotometri.
Beberapa hal yang menjadi bahan diskusi dalam proses mengisolasi DNA dari whole
blood adalah :
1. Prinsip metode isolasi DNA dari darah.
DNA yang akan diisolasi adalah DNA inti, dan yang mempunyai inti adalah sel darah
putih, oleh karena itu sel darah merah harus dihancurkan terlebih dahulu menggunakan
larutan RBC lysis.
Fungsi larutan lainnya adalah :
Cell lysis : untuk menghancurkan (melisis) sel darah putih, sehingga inti sel keluar
dari sel. Larutan ini mengandung EDTA (untuk menghilangkan kation
divalent dan menghambat DNAse) dan SDS (untuk melarutkan
membrane sel dan mendenaturasi protein)
RNAse A : untuk menghilangkan RNA yang ada karena yang diinginkan hanya
DNA
Isopropanol : untuk mengikat DNA yang berada dalam supernatant
Ethanol : untuk mencuci isopropanol
Tris-EDTA : untuk merehidrasi DNA yang diperoleh.
2. Dari hasil pengukuran menggunakan spektrofotometer, diperoleh konsentrasi DNA
sebesar 910 ng/ l dengan nilai kemurnian (OD260 /OD260) = 1,96 (nilai berada pada batas
yang ditentukan). Dengan demikian kita mendapatkan isolasi DNA dengan kemurnian
yang cukup baik. Bila nilai berada di luar batas yang ditentukan, maka hal ini terjadi
karena Hal ini mungkin terjadi akibat ketidaktelitian pemeriksa pada saat presipitasi
protein, pengambilan supernatant atau pembersihan isopropanol pada sample sehingga
masih ada zat-zat lain selain DNA yang turut terbaca sebagai DNA (false +). Bila hal ini
terjadi, maka sebaiknya DNA yang kita isolasi tersebut tidak kita lanjutkan kepada
Tekn ik Isolasi DN A dari Darah
DAFTAR PUSTAKA
Alberts, B., A.Johnson, J.Lewis, M.Raff, K.Roberts, P.Walter. 2002. Molecular Biology
of the Cell, edisi ke-4. Hlm 129, 335-535, 509, Garland Publishing Inc. New York.
Bamberg, E., H.Passow (Eds). 1992. Progress in Cell Research. Elsevier Science Publishers
B.V.
Evard R., D. Schrodetzki. 1976. Chemical Evolution. Origins 3 (1) : 9-37.
Fraser, Angus R. 1995. Haematology Medical Laboratory Technology. The Singapore
Polytechnic. Singapore.