AKTIVITAS ANTIBAKTERI PROPOLIS LEBAH
Trigona
spp.
ASAL PANDEGLANG TERHADAP
Enterobacter sakazakii
FITRIANNUR
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ii
ABSTRAK
FITRIANNUR. Aktivitas Antibakteri Propolis Lebah
Trigona
spp. Asal
Pandeglang Terhadap
Enterobacter sakazakii
. Dibimbing oleh SURYANI, A.E
ZAINAL HASAN, dan SRI ESTUNINGSIH.
Propolis memiliki banyak manfaat dan potensi khusus, karena memiliki
sifat sebagai antibakteri, antivirus, dan antikanker. Sifat dan karakteristik
E. sakazakii
telah banyak diteliti sifat fisiologis dan ketahanannya dalam
lingkungan. Penelitian ini diharapkan dapat menunjukkan potensi propolis
Trigona
spp. sebagai antibakteri terhadap
E. sakazakii
.
Propolis diekstrak dari sarang lebah
Trigona
spp dengan maserasi
menggunakan alkohol 70% (ekstrak propolis) menghasilkan rendemen 17,76%.
Uji aktivitas antibakteri dilakukan dengan metode difusi sumur agar pada tiga
isolat bakteri
E. sakazakii
IB-19b, IB-29a, dan ATCC 35217. Melalui uji
pendahuluan diperoleh aktivitas propolis lebih tinggi daripada propolis komersial,
dan lebih rendah daripada ampisilin. Efektivitas propolis terhadap propolis
komersial pada masing-masing isolat IB-19b, IB-29a, dan ATCC 35217
berturut-turut adalah 143,99%, 169,65%, dan 155,76%. Efektivitas ekstrak propolis
terhadap ampisilin pada masing-masing isolat IB-19b, IB-29a, dan ATCC 35217
adalah 39,37%, 38,94%, dan 47,37% berturut-turut. Konsentrasi hambat tumbuh
minimum yang diperoleh pada masing-masing isolat berbeda-beda, Konsentrasi
hambat tumbuh minimum isolat IB-19b, IB-29a, dan ATCC 35217 berturut-turut
adalah 12,50%, 25,00%, dan 50,00%. Aktivitas propolis pada masing-masing
isolat menunjukkan aktivitas yang tergantung konsentrasi propolis, semakin kecil
konsentrasi propolis semakin berkurang aktivitas antibakterinya.
iii
ABSTRACT
FITRIANNUR. Antibacterial Activity of
Trigona
spp.
Bee Propolis From
Pandeglang Against
Enterobacter sakazakii
. Under the direction of SURYANI,
A.E ZAINAL HASAN, and SRI ESTUNINGSIH.
Propolis has many advantages and specific potencies, due to its properties
as antibacterial, antivirus, and anticancer. The characteristics and properties of
E.
sakazakii
has been studied well due to its physiological properties and resistances
in the environment. The research aim is to determine the propolis potency of
Trigona
spp as antibacterial agent against
E. sakazakii
.
iv
AKTIVITAS ANTIBAKTERI PROPOLIS LEBAH
Trigona
spp.
ASAL PANDEGLANG TERHADAP
Enterobacter sakazakii
FITRIANNUR
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
v
Judul Skripsi : Aktivitas Antibakteri Propolis Lebah
Trigona
spp. Asal
Pandeglang Terhadap
Enterobacter sakazakii
Nama
: Fitriannur
NIM
: G44104047
Disetujui
Dr. Suryani, M.Sc
Ketua
Ir. AE Zainal Hasan, M.Si Dr. drh. Sri Estuningsih, M.Si
Anggota Anggota
Diketahui
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
vi
PRAKATA
Alhamdulillah, segala puji bagi Allah SWT atas segala rahmat dan
karunia-Nya sehingga penulis dapat menyelesaikan penelitian ini. Penelitian dengan judul
Aktivitas Antibakteri Propolis Lebah
Trigona
spp. Asal Pandeglang Terhadap
Enterobacter sakazakii
dilaksanakan pada bulan Mei hingga September 2008 di
Laboratorium Biokimia Departemen Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam, dan Laboratorium Mikrobiologi Medik, Fakultas Kedokteran
Hewan IPB.
Penulis mengucapkan terimakasih kepada Ibu Dr. Suryani, M.Sc, Bapak
Ir. A.E. Zainal Hasan, M.Si, dan Ibu Dr. drh. Sri Estuningsih, M.Si yang telah
membimbing penulis selama penelitian dan menyelesaikan penulisan laporan ini.
Terima kasih kepada Pemerintah Kabupaten Kutai Kartanegara, Kalimantan
Timur yang telah menyediakan beasiswa dalam program Beasiswa Utusan Daerah
(BUD) IPB. Terima kasih untuk Intan, Indra, Dedi, Tanti, Mbak Nur, Ummul,
Putri, Juliana, Hanifah, Wiena, keluarga mahasiswa dari Kutai, dan teman-teman
biokimia angkatan 41. Ucapan terima kasih juga penulis haturkan teknisi dan
laboran Laboratorium Biokimia, FMIPA, dan Laboratorium Mikrobiologi Medik,
FKH, IPB. Ucapan terimakasih terdalam kepada keluarga untuk segala perhatian
dan dukungan serta doa yang tulus. Semoga karya ilmiah ini dapat bermanfaat
bagi semua pihak.
Bogor, Februari 2009
Fitriannur
vii
RIWAYAT HIDUP
Penulis dilahirkan di Tenggarong, Kalimantan Timur pada tanggal 27 Mei
1987 dari ayah Zulkifli (Alm) dan ibu Maimunah. Penulis merupakan anak
ke-lima dari enam bersaudara.
Tahun 2004, penulis menyelesaikan pendidikan Madrasah Aliyah dari PPKP
Ribathul Khail Tenggarong. Pada tahun yang sama, penulis lulus seleksi masuk
IPB melalui jalur Beasiswa Utusan Daerah dari Kabupaten Kutai Kartanegara,
Kalimantan Timur, dan terdaftar sebagai mahasiswa pada program studi Biokimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
viii
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Lebah
Trigona
spp.
... 1
Propolis ... 2
Enterobacter sakazakii
... 2
Antimikrob ... 3
BAHAN DAN METODE
Alat dan Bahan ... 4
Metode
...
4
HASIL DAN PEMBAHASAN
Rendemen
Ekstrak
Propolis
... 5
Efektivitas Ekstrak Propolis terhadap Propolis X dan Ampisilin ... 5
Penentuan Konsentrasi Hambat Tumbuh Minimum (KHTM) ... 7
SIMPULAN DAN SARAN ... 8
Simpulan
... 8
Saran ... 8
DAFTAR PUSTAKA ... 8
ix
DAFTAR GAMBAR
Halaman
1 Koloni
E. sakazakii
... 3
2 Hasil uji pendahuluan aktivitas antibakteri ... 7
3 Efektivitas ekstrak propolis terhadap propolis X
dan ampisilin ... 7
4 Penentuan konsentrasi hambat tumbuh minimum
E. sakazakii
... 9
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian ... 12
2 Ekstraksi propolis ... 12
2 Rendemen ekstrak propolis ... 13
4 Data hasil uji pendahuluan aktivitas antibakteri ... 13
5 Penentuan Konsentrasi Hambat Tumbuh Minimum
E. sakazakii
IB-19b ... 14
6 Penentuan Konsentrasi Hambat Tumbuh Minimum
E. sakazakii
IB-29a ... 14
7 Penentuan Konsentrasi Hambat Tumbuh Minimum
E. sakazakii
ATCC 35217 ... 15
8 ANOVA konsentrasi hambat tumbuh minimum
E. sakazakii
IB-19b ... 15
9 Hasil analisis uji Duncan diameter zona bening
E. sakazakii
IB-19b ... 15
10 ANOVA konsentrasi hambat tumbuh minimum
E. sakazakii
IB-29a ... 16
11 Hasil analisis uji Duncan diameter zona bening
E. sakazakii
IB-29a ... 16
12 ANOVA konsentrasi hambat tumbuh minimum
E. sakazakii
ATCC 35217 ... 16
13 Hasil analisis uji Duncan diameter zona bening
E. sakazakii
ATCC 35217 ... 16
14 Hasil diameter zona bening uji pendahuluan aktivitas antibakteri
propolis ... 17
PENDAHULUAN
Propolis merupakan salah satu produk alami yang dihasilkan lebah madu, dan telah banyak dimanfaatkan sebagai obat atau suplemen, pencuci mulut, anti-peradangan, terapi penyakit, mempercepat penyembuhan luka, dan lain-lain. Selain itu, propolis banyak memiliki manfaat dan potensi khusus, karena memiliki sifat sebagai anti-bakteri, anti-virus, dan dapat menghambat pertumbuhan kanker. Melihat potensi propolis ini, maka perlu dibuktikan secara ilmiah tentang potensi dan pemanfaatan propolis terutama sebagai antibakteri.
Propolis sangat berperan dalam menjaga lingkungan internal sarang yang aseptik. Bukti signifikan tentang sifat antimikrobanya berasal dari kegunaan produk ini di dalam sarang itu sendiri, yaitu untuk membungkus bangkai hewan pengganggu yang sudah mati dengan propolis, karena hewan ini terlalu berat untuk dapat dibuang dari sarangnya (misalnya ular kecil atau tikus). Prosesnya menghasilkan efek serupa pembalseman, karena tubuh mati hewan tersebut mengering tanpa mengalami pembusukan (Salatino et al. 2005). Hal ini tentu sangat penting untuk melindungi sarang lebah dari infeksi bakteri yang dapat menyebar luas. Pengetahuan keefektifan antiseptik propolis sudah diketahui sejak lama. Aristoteles menyarankan penggunaan propolis untuk merawat abses dan luka (Salatino et al. 2005).
Sifat dan karakteristik E. sakazakii telah banyak diteliti dalam hal fisiologi dan ketahanannya terhadap lingkungan (Breeuwer et al. 2003). Penelitian tentang sifat-sifat bakteri ini merupakan langkah penting dalam usaha untuk mengeliminasi bakteri ini dari lingkungan produksi pangan yang penting seperti pada pembuatan susu bubuk formula. Akan tetapi, tentang bahan tambahan alami untuk mencegah terjadinya kontaminasi susu oleh bakteri ini belum banyak diketahui. Salah satu bahan alami yang telah diuji berpotensi sebagai antibakteri adalah propolis Trigona spp. Penelitian ini diharapkan dapat menunjukkan potensi propolis Trigona spp. sebagai antibakteri terhadap E. sakazakii, sehingga propolis ini dapat dimanfaatkan sebagai bahan pengawet alami untuk mencegah atau mengurangi kontaminasi bakteri pada susu formula bayi.
Penelitian bertujuan menentukan aktivitas antibakteri propolis dan menentukan konsentrasi hambat tumbuh minimum (KHTM) propolis terhadap E. sakazakii.
Hipotesis penelitian ini adalah propolis mempunyai aktivitas antibakteri terhadap E. sakazakii. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah tentang propolis sebagai antibakteri E. sakazakii, dan dapat mendukung penelitian-penelitian selanjutnya untuk memperluas aplikasi dan nilai guna propolis.
Penelitian ini dilakukan di Laboratorium Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, dan Laboratorium Mikrobiologi Medik, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian dilaksanakan dari bulan Mei-September 2008.
TINJAUAN PUSTAKA
Lebah Trigona spp.
Lebah Trigona spp. merupakan serangga sosial yang hidup berkelompok membentuk suatu koloni. Lebah ini mudah dijumpai di daerah tropis dan subtropis di Amerika Selatan, setengah bagian Afrika Selatan, dan Asia Tenggara. Koloninya terdiri dari 300-800.000 ekor lebah (Free 1982). Trigona spp. (gala-gala, lebah lilin), dalam bahasa daerah dinamakan klanceng, lenceng (jawa), atau teuweul (sunda) (Perum Perhutani 1986 diacu dalam Lasmayanty 2007). Jumlah madu yang dihasilkan lebih sedikit dan lebih sulit diekstrak, namun jumlah propolis yang dihasilkan lebih banyak dibandingkan dengan lebah jenis lain (Singh 1962 diacu dalam Lasmayanty 2007).
Trigona spp. memiliki sengat sisa, namun tidak digunakan sebagai alat pertahanan. Lebah ini akan menggigit musuhnya atau membakar kulit musuhnya dengan larutan basa. Organ vital (mata, hidung, dan telinga) musuh akan dikelilingi oleh lebah lain dalam satu koloninya. Lebah ini juga dilengkapi sistem kekebalan untuk menyerang serangga pengganggu lain (Free 1982). Koloni lebah madu terdiri dari dua golongan, yaitu golongan reproduktif (lebah jantan dan ratu) dan golongan non reproduktif (lebah pekerja). Mereka dapat dibedakan satu dengan lainnya dari bentuk, rupa, warna, dan tingkah laku. Satu koloni lebah memiliki hanya satu ekor ratu, ratusan ekor lebah jantan, dan ribuan ekor lebah pekerja (Sumoprastowo 1980).
AKTIVITAS ANTIBAKTERI PROPOLIS LEBAH
Trigona
spp.
ASAL PANDEGLANG TERHADAP
Enterobacter sakazakii
FITRIANNUR
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ii
ABSTRAK
FITRIANNUR. Aktivitas Antibakteri Propolis Lebah
Trigona
spp. Asal
Pandeglang Terhadap
Enterobacter sakazakii
. Dibimbing oleh SURYANI, A.E
ZAINAL HASAN, dan SRI ESTUNINGSIH.
Propolis memiliki banyak manfaat dan potensi khusus, karena memiliki
sifat sebagai antibakteri, antivirus, dan antikanker. Sifat dan karakteristik
E. sakazakii
telah banyak diteliti sifat fisiologis dan ketahanannya dalam
lingkungan. Penelitian ini diharapkan dapat menunjukkan potensi propolis
Trigona
spp. sebagai antibakteri terhadap
E. sakazakii
.
Propolis diekstrak dari sarang lebah
Trigona
spp dengan maserasi
menggunakan alkohol 70% (ekstrak propolis) menghasilkan rendemen 17,76%.
Uji aktivitas antibakteri dilakukan dengan metode difusi sumur agar pada tiga
isolat bakteri
E. sakazakii
IB-19b, IB-29a, dan ATCC 35217. Melalui uji
pendahuluan diperoleh aktivitas propolis lebih tinggi daripada propolis komersial,
dan lebih rendah daripada ampisilin. Efektivitas propolis terhadap propolis
komersial pada masing-masing isolat IB-19b, IB-29a, dan ATCC 35217
berturut-turut adalah 143,99%, 169,65%, dan 155,76%. Efektivitas ekstrak propolis
terhadap ampisilin pada masing-masing isolat IB-19b, IB-29a, dan ATCC 35217
adalah 39,37%, 38,94%, dan 47,37% berturut-turut. Konsentrasi hambat tumbuh
minimum yang diperoleh pada masing-masing isolat berbeda-beda, Konsentrasi
hambat tumbuh minimum isolat IB-19b, IB-29a, dan ATCC 35217 berturut-turut
adalah 12,50%, 25,00%, dan 50,00%. Aktivitas propolis pada masing-masing
isolat menunjukkan aktivitas yang tergantung konsentrasi propolis, semakin kecil
konsentrasi propolis semakin berkurang aktivitas antibakterinya.
iii
ABSTRACT
FITRIANNUR. Antibacterial Activity of
Trigona
spp.
Bee Propolis From
Pandeglang Against
Enterobacter sakazakii
. Under the direction of SURYANI,
A.E ZAINAL HASAN, and SRI ESTUNINGSIH.
Propolis has many advantages and specific potencies, due to its properties
as antibacterial, antivirus, and anticancer. The characteristics and properties of
E.
sakazakii
has been studied well due to its physiological properties and resistances
in the environment. The research aim is to determine the propolis potency of
Trigona
spp as antibacterial agent against
E. sakazakii
.
iv
AKTIVITAS ANTIBAKTERI PROPOLIS LEBAH
Trigona
spp.
ASAL PANDEGLANG TERHADAP
Enterobacter sakazakii
FITRIANNUR
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
v
Judul Skripsi : Aktivitas Antibakteri Propolis Lebah
Trigona
spp. Asal
Pandeglang Terhadap
Enterobacter sakazakii
Nama
: Fitriannur
NIM
: G44104047
Disetujui
Dr. Suryani, M.Sc
Ketua
Ir. AE Zainal Hasan, M.Si Dr. drh. Sri Estuningsih, M.Si
Anggota Anggota
Diketahui
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
vi
PRAKATA
Alhamdulillah, segala puji bagi Allah SWT atas segala rahmat dan
karunia-Nya sehingga penulis dapat menyelesaikan penelitian ini. Penelitian dengan judul
Aktivitas Antibakteri Propolis Lebah
Trigona
spp. Asal Pandeglang Terhadap
Enterobacter sakazakii
dilaksanakan pada bulan Mei hingga September 2008 di
Laboratorium Biokimia Departemen Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam, dan Laboratorium Mikrobiologi Medik, Fakultas Kedokteran
Hewan IPB.
Penulis mengucapkan terimakasih kepada Ibu Dr. Suryani, M.Sc, Bapak
Ir. A.E. Zainal Hasan, M.Si, dan Ibu Dr. drh. Sri Estuningsih, M.Si yang telah
membimbing penulis selama penelitian dan menyelesaikan penulisan laporan ini.
Terima kasih kepada Pemerintah Kabupaten Kutai Kartanegara, Kalimantan
Timur yang telah menyediakan beasiswa dalam program Beasiswa Utusan Daerah
(BUD) IPB. Terima kasih untuk Intan, Indra, Dedi, Tanti, Mbak Nur, Ummul,
Putri, Juliana, Hanifah, Wiena, keluarga mahasiswa dari Kutai, dan teman-teman
biokimia angkatan 41. Ucapan terima kasih juga penulis haturkan teknisi dan
laboran Laboratorium Biokimia, FMIPA, dan Laboratorium Mikrobiologi Medik,
FKH, IPB. Ucapan terimakasih terdalam kepada keluarga untuk segala perhatian
dan dukungan serta doa yang tulus. Semoga karya ilmiah ini dapat bermanfaat
bagi semua pihak.
Bogor, Februari 2009
Fitriannur
vii
RIWAYAT HIDUP
Penulis dilahirkan di Tenggarong, Kalimantan Timur pada tanggal 27 Mei
1987 dari ayah Zulkifli (Alm) dan ibu Maimunah. Penulis merupakan anak
ke-lima dari enam bersaudara.
Tahun 2004, penulis menyelesaikan pendidikan Madrasah Aliyah dari PPKP
Ribathul Khail Tenggarong. Pada tahun yang sama, penulis lulus seleksi masuk
IPB melalui jalur Beasiswa Utusan Daerah dari Kabupaten Kutai Kartanegara,
Kalimantan Timur, dan terdaftar sebagai mahasiswa pada program studi Biokimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
viii
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Lebah
Trigona
spp.
... 1
Propolis ... 2
Enterobacter sakazakii
... 2
Antimikrob ... 3
BAHAN DAN METODE
Alat dan Bahan ... 4
Metode
...
4
HASIL DAN PEMBAHASAN
Rendemen
Ekstrak
Propolis
... 5
Efektivitas Ekstrak Propolis terhadap Propolis X dan Ampisilin ... 5
Penentuan Konsentrasi Hambat Tumbuh Minimum (KHTM) ... 7
SIMPULAN DAN SARAN ... 8
Simpulan
... 8
Saran ... 8
DAFTAR PUSTAKA ... 8
ix
DAFTAR GAMBAR
Halaman
1 Koloni
E. sakazakii
... 3
2 Hasil uji pendahuluan aktivitas antibakteri ... 7
3 Efektivitas ekstrak propolis terhadap propolis X
dan ampisilin ... 7
4 Penentuan konsentrasi hambat tumbuh minimum
E. sakazakii
... 9
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian ... 12
2 Ekstraksi propolis ... 12
2 Rendemen ekstrak propolis ... 13
4 Data hasil uji pendahuluan aktivitas antibakteri ... 13
5 Penentuan Konsentrasi Hambat Tumbuh Minimum
E. sakazakii
IB-19b ... 14
6 Penentuan Konsentrasi Hambat Tumbuh Minimum
E. sakazakii
IB-29a ... 14
7 Penentuan Konsentrasi Hambat Tumbuh Minimum
E. sakazakii
ATCC 35217 ... 15
8 ANOVA konsentrasi hambat tumbuh minimum
E. sakazakii
IB-19b ... 15
9 Hasil analisis uji Duncan diameter zona bening
E. sakazakii
IB-19b ... 15
10 ANOVA konsentrasi hambat tumbuh minimum
E. sakazakii
IB-29a ... 16
11 Hasil analisis uji Duncan diameter zona bening
E. sakazakii
IB-29a ... 16
12 ANOVA konsentrasi hambat tumbuh minimum
E. sakazakii
ATCC 35217 ... 16
13 Hasil analisis uji Duncan diameter zona bening
E. sakazakii
ATCC 35217 ... 16
14 Hasil diameter zona bening uji pendahuluan aktivitas antibakteri
propolis ... 17
PENDAHULUAN
Propolis merupakan salah satu produk alami yang dihasilkan lebah madu, dan telah banyak dimanfaatkan sebagai obat atau suplemen, pencuci mulut, anti-peradangan, terapi penyakit, mempercepat penyembuhan luka, dan lain-lain. Selain itu, propolis banyak memiliki manfaat dan potensi khusus, karena memiliki sifat sebagai anti-bakteri, anti-virus, dan dapat menghambat pertumbuhan kanker. Melihat potensi propolis ini, maka perlu dibuktikan secara ilmiah tentang potensi dan pemanfaatan propolis terutama sebagai antibakteri.
Propolis sangat berperan dalam menjaga lingkungan internal sarang yang aseptik. Bukti signifikan tentang sifat antimikrobanya berasal dari kegunaan produk ini di dalam sarang itu sendiri, yaitu untuk membungkus bangkai hewan pengganggu yang sudah mati dengan propolis, karena hewan ini terlalu berat untuk dapat dibuang dari sarangnya (misalnya ular kecil atau tikus). Prosesnya menghasilkan efek serupa pembalseman, karena tubuh mati hewan tersebut mengering tanpa mengalami pembusukan (Salatino et al. 2005). Hal ini tentu sangat penting untuk melindungi sarang lebah dari infeksi bakteri yang dapat menyebar luas. Pengetahuan keefektifan antiseptik propolis sudah diketahui sejak lama. Aristoteles menyarankan penggunaan propolis untuk merawat abses dan luka (Salatino et al. 2005).
Sifat dan karakteristik E. sakazakii telah banyak diteliti dalam hal fisiologi dan ketahanannya terhadap lingkungan (Breeuwer et al. 2003). Penelitian tentang sifat-sifat bakteri ini merupakan langkah penting dalam usaha untuk mengeliminasi bakteri ini dari lingkungan produksi pangan yang penting seperti pada pembuatan susu bubuk formula. Akan tetapi, tentang bahan tambahan alami untuk mencegah terjadinya kontaminasi susu oleh bakteri ini belum banyak diketahui. Salah satu bahan alami yang telah diuji berpotensi sebagai antibakteri adalah propolis Trigona spp. Penelitian ini diharapkan dapat menunjukkan potensi propolis Trigona spp. sebagai antibakteri terhadap E. sakazakii, sehingga propolis ini dapat dimanfaatkan sebagai bahan pengawet alami untuk mencegah atau mengurangi kontaminasi bakteri pada susu formula bayi.
Penelitian bertujuan menentukan aktivitas antibakteri propolis dan menentukan konsentrasi hambat tumbuh minimum (KHTM) propolis terhadap E. sakazakii.
Hipotesis penelitian ini adalah propolis mempunyai aktivitas antibakteri terhadap E. sakazakii. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah tentang propolis sebagai antibakteri E. sakazakii, dan dapat mendukung penelitian-penelitian selanjutnya untuk memperluas aplikasi dan nilai guna propolis.
Penelitian ini dilakukan di Laboratorium Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, dan Laboratorium Mikrobiologi Medik, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian dilaksanakan dari bulan Mei-September 2008.
TINJAUAN PUSTAKA
Lebah Trigona spp.
Lebah Trigona spp. merupakan serangga sosial yang hidup berkelompok membentuk suatu koloni. Lebah ini mudah dijumpai di daerah tropis dan subtropis di Amerika Selatan, setengah bagian Afrika Selatan, dan Asia Tenggara. Koloninya terdiri dari 300-800.000 ekor lebah (Free 1982). Trigona spp. (gala-gala, lebah lilin), dalam bahasa daerah dinamakan klanceng, lenceng (jawa), atau teuweul (sunda) (Perum Perhutani 1986 diacu dalam Lasmayanty 2007). Jumlah madu yang dihasilkan lebih sedikit dan lebih sulit diekstrak, namun jumlah propolis yang dihasilkan lebih banyak dibandingkan dengan lebah jenis lain (Singh 1962 diacu dalam Lasmayanty 2007).
Trigona spp. memiliki sengat sisa, namun tidak digunakan sebagai alat pertahanan. Lebah ini akan menggigit musuhnya atau membakar kulit musuhnya dengan larutan basa. Organ vital (mata, hidung, dan telinga) musuh akan dikelilingi oleh lebah lain dalam satu koloninya. Lebah ini juga dilengkapi sistem kekebalan untuk menyerang serangga pengganggu lain (Free 1982). Koloni lebah madu terdiri dari dua golongan, yaitu golongan reproduktif (lebah jantan dan ratu) dan golongan non reproduktif (lebah pekerja). Mereka dapat dibedakan satu dengan lainnya dari bentuk, rupa, warna, dan tingkah laku. Satu koloni lebah memiliki hanya satu ekor ratu, ratusan ekor lebah jantan, dan ribuan ekor lebah pekerja (Sumoprastowo 1980).
2
rayap dan membangun sarangnya di bebatuan di bawah tanah (Free 1982). Sarang lebah dibuat dengan mencampur lilin dan resin propolis dari tanaman. Sarang tersusun atas sel anakan yang dikelilingi dengan pelepah lembut yang disebut involucrum dan sel besar yang terdiri dari madu serta cadangan polen (Free 1982).
Propolis
Propolis merupakan resin lengket yang dikumpulkan oleh lebah pekerja dari kuncup, kulit kayu, dan dari bagian tumbuhan lain (Gojmerac 1983). Kata propolis berasal dari bahasa Yunani, dari akar kata pro yang berarti pertahanan terhadap sesuatu, dan polis yang berarti kota (Salatino et al.2005). Arti kata ini mengimplikasikan suatu produk yang terlibat dalam pertahanan dari suatu komunitas lebah terhadap pengganggu. Propolis merupakan produk alami lebah yang menunjukkan efek antimikroba (Dharmayanti 2000). Lebah madu membuat propolis dengan mengumpulkan getah damar dari tanaman yang dicampur dengan lilin pada sarangnya. Lebah madu memerlukan propolis karena lebah madu rentan terhadap infeksi virus dan bakteri (Chinthapally et al.1993). Selain itu, propolis digunakan untuk mengisi celah dan retakan serta menghaluskan permukaan yang kasar pada sarang lebah madu (Gojmerac 1983).
Komposisi utama propolis adalah lilin, resin, dan senyawa volatil. Lilin merupakan sekresi dari lebah itu sendiri, sedangkan dua senyawa lainnya diperoleh dari tumbuhan. Aktivitas biologis dari propolis dihubungkan dengan sifatnya sebagai substansi turunan dari tumbuhan (Salatino et al. 2005). Kemudian, meskipun propolis merupakan hasil produksi hewan, proporsi komponen penyusunnya, yang terutama sebagian besarnya memiliki aktivitas biologis, merupakan turunan dari tumbuhan. Karena itu secara kimia, propolis sangat kompleks dan kaya akan senyawa terpena, asam benzoat, asam kafeat, asam sinamat, dan asam fenolat. Tabel 1 menunjukkan hasil analisis uji fitokimia propolis Pandeglang.
Propolis juga mengandung flavonoid yang sangat tinggi sehingga banyak peneliti lebih memilih propolis sebagai senyawa flavonoid (Chinthapally et al. 1993). Resinnya mengandung sebagian besar senyawa yang ditemukan dalam ekstrak alkohol yang dikonsumsi oleh masyarakat dari berbagai daerah sebagai tambahan makanan atau obat
alternatif. Propolis juga mengandung penyusun lainnya, seperti polen dan asam amino (Salatino et al.2005).
Beberapa hasil penelitian menunjukkan bahwa propolis dapat berfungsi sebagai antibakteri alami dengan aktivitas yang tinggi. Beberapa penelitian ilmiah menunjukkan bahwa propolis memiliki aktivitas penghambatan terhadap beberapa spesies Streptococcus yang dapat menyebabkan karies gigi (Lasmayanty 2007). Selain itu, propolis juga dapat melawan Staphylococcus aureus, bakteri yang berbahaya karena sering menyebabkan kematian, infeksi, keracunan darah, dan beberapa tipe pneumonia (Miorin et al. 2003). Menurut Chinthapally et al. (1993) ekstrak propolis dengan etanol mempunyai efek sinergis terhadap aktivitas anti-staphylococcus pada antibiotik streptomisin dan siklosiklin, dan memberikan sedikit efek tersebut pada antibiotik lainnya. Propolis lebah memiliki efek antimikroba dan anti-inflamatori, dan secara in vitro telah menunjukkan efektivitas dalam penghambatan Helicobater pylori pada penyakit gastroduodenal (McLoughlin et al. 2004).
Efek sinergis dari berbagai kandungan fitokimia ekstrak propolis masing-masing memiliki mekanisme aktivitas antibakteri yang berbeda-beda. Berdasarkan penelitian Bankova et al.(2006), diperoleh 15 senyawa murni dari golongan flavonoid, triterpenoid, dan minyak atsiri yang merupakan konstituen bioaktif propolis merah dari Brazil yang berperan dalam aktivitas antibakteri terhadap Staphylococcus aureus dan Escherichia coli.
Tabel 1 Hasil analisis fitokimia ekstrak propolis (Lasmayanti 2007)
Senyawa Ekstrak propolis pandeglang
Alkaloid + Flavonoid + Minyak atsiri +
Triterpenoid + Saponin +
Tanin +
Keterangan: (+) = ada
Enterobacter sakazakii
3
cloacae berpigmen kuning (Gambar 1). Kemudian pada tahun 1980, bakteri ini diperkenalkan sebagai spesies baru, berdasarkan produksi asam dari D-sorbitol dan dinamakan sebagai penghormatan kepada penemunya, seorang ahli mikrobiologi Jepang Riichi Sakazaki. Bakteri ini telah terdeteksi pada berbagai jenis makanan lain, tetapi hanya susu formula bubuk yang sudah diketahui memiliki hubungan dengan timbulnya beberapa penyakit. Adanya kasus nekrosis usus dan radang selaput otak yang disebabkan oleh E. sakazakii telah dilaporkan terjadi di unit perawatan intensif bayi yang baru lahir karena kontaminasi dan ketahanan E. sakazakii dalam susu bubuk formula dan perlengkapan penyajian makanan (Simmons et al.1989; van Acker et al.2001).
E. sakazakii memiliki sifat patogen oportunistik, yaitu organisme yang dapat menyebabkan penyakit hanya pada kondisi tertentu. E. sakazakii merupakan kontaminan pada susu formula bubuk yang dapat menyebabkan penyakit langka bakterimia, necrotizing enterocolitis (NEC), dan radang selaput otak setelah tertelan (Muytjens et al. 1983; Iversen & Forsthye 2003; Estuningsih et al. 2007). Bayi-bayi yang beresiko tinggi terhadap infeksi E. sakazakii adalah bayi prematur, lahir dengan berat badan rendah, dan berusia kurang dari 28 hari. Dosis infektif berkisar dari 103 sampai 108 sel (Osaili et al. 2007). Komisi Internasional Spesifikasi Mikrobiologis dalam Makanan (2002) mengkategorikan bakteri ini sebagai ‘sangat berbahaya untuk populasi terbatas, membahayakan nyawa atau substansi kronis lanjut dalam jangka panjang. Pada akhirnya, bakteri ini menjadi sama berbahayanya dengan patogen dalam makanan lainnya yang lebih dikenal seperti Listeria monocytogenes, Salmonella enterica, Clostridium botulinum, dan Cryptosporidium parvum (Forsythe 2005).
Berdasarkan Forsythe (2003) bakteri ini bisa bertahan pada kondisi kering dalam susu bubuk formula selama 2 tahun. Sifat-sifat bakteri ini yang bisa meningkatkan patogenisitasnya antara lain, sifat termostabil, menghasilkan biofilm dan enterotoksin. Kemudian dari sifat virulensi, telah diteliti bahwa bakteri ini dapat menghasilkan enterotoksin, adhesi pada sel otak, dan pengaruh endotoksin yang dihasilkan meningkatkan translokasi bakteri-bakteri usus dan E. sakazakii pada tikus neonetus (Mange et al. 2006; Pagotto et al. 2003; Townsend et al. 2003).
Gambar 1 Koloni E. sakazakii (Forsythe 2005).
Antimikrob
Antimikrob merupakan senyawa pembasmi mikrob khususnya mikrob yang merugikan manusia, bakteri patogen maupun bakteri pembusuk (Ganiswarna et al. 1995). Bahan antimikrob merupakan salah satu penghambatan mikroorganisme secara kimia yang mengganggu pertumbuhan dan metabolisme mikrob. Antimikrob yang digunakan harus memiliki tingkat toksisitas selektif setinggi mungkin. Toksisitas selektif berarti obat tersebut haruslah bersifat sangat toksik pada mikroba patogen namun relatif aman bagi inang. Berdasarkan toksisitas selektif, terdapat dua jenis antimikrob, yaitu antimikrob bersifat bakterisidal dan bakteriostatik. Jika suatu antibakteri mampu membunuh bakteri patogen maka antibakteri tersebut memiliki aktivitas bakterisidal. Jika antibakteri hanya mampu menghambat pertumbuhan bakteri patogen maka antibakteri tersebut memiliki aktivitas bakteriostatik. Aktivitas antimikrob tertentu dapat meningkat dari bakteriostatik menjadi bakterisidal jika konsentrasi antimikrobnya ditingkatkan. Terdapat beberapa faktor yang dapat mempengaruhi penghambatan mikrob oleh antimikrob. Faktor tersebut adalah konsentrasi zat antimikrob, jumlah mikroorganisme, spesies mikroorganisme, temperatur, dan adanya bahan organik (Pelczar & Chan 1988).
4
rendah mampu menghambat proses penting dalam kehidupan satu spesies atau lebih mikroorganisme (Siswandono & Soekardjo 1995).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan adalah autoklaf, shaker, rotavapor, crock borrer diameter 5 mm, laminar air flow cabinet, inkubator, pipet mikro, neraca analitik, batang gelas penyebar, vorteks, jangka sorong, mortar, jarum ose, cawan petri, dan beberapa alat gelas lainnya.
Bahan-bahan yang digunakan adalah propolis kasar Trigona spp. dari daerah Pandeglang (Propolis Pandeglang, PrP), propolis komersil (Propolis X), tiga isolat bakteri, E. sakazakii IB-19b (enterotoksin negatif), E. sakazakii IB-29a (enterotoksin positif), dan E. sakazakii ATCC 35217 (E. sakazakii American Type Culture Collection) dari kultur koleksi Fakultas Kedokteran Hewan, media Tryptone Soy Broth (TSB), media Tryptone Soy Agar (TSA), media Müeller-Hinton Agar (MHA), standar McFarland, etanol 70%, propilen glikol teknis, ampisilin 500 mg, dan akuades.
Bakteri yang berasal dari kultur primer diambil sebanyak satu ose bakteri, diinokulasikan ke media TSB yang baru, lalu diinkubasi pada temperatur 37 °C selama 24 jam dalam inkubator. Bakteri dari kultur TSB digores ke cawan TSA sebanyak satu ose, lalu diinkubasi pada temperatur 37 °C selama 24 jam dalam inkubator untuk memperoleh koloni murni. Kultur regenerasi ini akan digunakan sebagai stok kerja yang digunakan pada uji aktivitas antibakteri. Komposisi media TSA dalam 1 liter akuades adalah tripton 15.0 g, soya pepton 5.0 g, NaCl 5.0 g, dan agar 15.0 g. Komposisi media TSB dalam 1 liter akuades adalah tripton 17.0 g, soya pepton 3.0 g, dekstrosa 2.5 g, NaCl 5.0 g, dan K
Metode
Ekstraksi Propolis
Propolis diekstraksi menggunakan metode Matienzo dan Lamorena (2004). Ekstraksi dilakukan secara maserasi dengan pelarut alkohol 70%. Sebanyak 150 g propolis kasar Trigona spp. direndam dengan 500 mL etanol 70%. Suspensi tersebut ditutup dan dikocok dengan shaker di ruang gelap selama satu minggu. Setelah itu, suspensi tersebut disaring, filtratnya diambil dan residunya dimaserasi kembali. Selanjutnya filtrat tersebut diambil setiap hari selama tujuh hari. Setelah tujuh hari, filtrat terakhir yang dihasilkan berwarna jernih dan teknik maserasi diakhiri.
Setelah seluruh filtrat hasil maserasi terkumpul, filtrat tersebut dipekatkan dengan menggunakan rotavapor pada temperatur 40 °C. Ekstrak pekat yang diperoleh ditimbang untuk mendapatkan nilai rendemennya, kemudian ekstrak tersebut dilarutkan dengan propilen glikol dengan perbandingan propolis:propilen glikol adalah 1:1, sebagai ekstrak propolis 100%.
Uji Aktivitas Antibakteri
Uji aktivitas antibakteri diuji menggunakan metode difusi sumur agar yang sudah dimodifikasi (Rojas et al. 2006). Pembanding yang digunakan adalah tablet ampisilin 500 mg dengan konsentrasi 10 mg/mL (kontrol positif), propolis merek X, akuades (kontrol negatif), dan kontrol pelarut propilen glikol.
Pembuatan Stok Kerja Bakteri
2HPO4 2.5 g.
Uji Pendahuluan
Uji pendahuluan aktivitas antibakteri dilakukan dengan metode difusi sumur agar. Bakteri dari stok kerja sebanyak satu ose dipindahkan ke dalam 25 mL TSB steril dan diinkubasi pada 37 °C selama 24 jam dalam inkubator. Kemudian kultur bakteri disentrifus pada kecepatan 5000 g selama 15 menit dan tiga kali pencucian dengan akuades steril. Pelet bakteri disuspensikan dengan akuades steril, lalu disesuaikan dengan standar McFarland 1 (3×108 CFU/mL). Sebanyak 50 µL suspensi bakteri disebar ke agar Müeller-Hinton. Kemudian agar dilubangi dengan diameter ± 5 mm menggunakan crock borrer steril. Ekstrak propolis dan kontrol pembanding sebanyak 25 µL dimasukkan ke dalam lubang tersebut lalu diinkubasi pada temperatur 37 °C selama 24 jam. Zona bening yang terlihat di sekeliling lubang diukur dalam satuan mm, dan menandakan sampel memiliki aktivitas antibakteri.
Penentuan Konsentrasi Hambat Tumbuh Minimum (KHTM)
5
pengenceran propolis dengan akuades sehingga didapatkan beberapa konsentrasi (100, 50, 25, 12,5, 6,25, 3,13, 1,56, dan 0,78%). Masing-masing konsentrasi sebanyak 25 µL diuji dengan memasukkan ekstrak propolis ke lubang media agar Müeller-Hinton yang telah diinokulasi dengan bakteri uji, diinkubasi pada temperatur 37 °C selama 24 jam. Aktivitas antibakterinya diperoleh dengan mengukur daerah bening di sekeliling lubang sampel dalam satuan mm.
Analisis Statistik
Analisis statistik yang digunakan dalam pengolahan data adalah rancangan percobaan satu faktor dalam Rancangan Acak Lengkap. Berikut ini merupakan model rancangannya (Mattjik dan Sumertajaya 2002):
Yij = μ + τi + εij
Yij = Pengamatan pada perlakuan ke-i dan ulangan ke-j
μ = Pengaruh rataan umum
τ = Pengaruh perlakuan ke-i
ε = pengaruh acak pada perlakuan ke-i ulangan ke-j
Rancangan percobaan ini digunakan pada penentuan nilai KHTM. Data yang diperoleh dianalisis dengan ANOVA (Analysis of Variance) pada taraf α 0,05 menggunakan program piranti lunak SPSS 11. Uji lanjut yang digunakan adalah uji Duncan.
HASIL DAN PEMBAHASAN
Rendemen Ekstrak Propolis
Rendemen ekstrak propolis yang diperoleh (17,76%) pada penelitian ini lebih besar dari yang diperoleh pada penelitian Anggraini (2006) dan Lasmayanti (2007), yaitu sebesar 8,25% dan 8,20% berturut-turut. Pelarut yang digunakan pada penelitian ini, serta penelitian Anggraini (2006) dan Lasmayanti (2007) adalah etanol 70%. Etanol merupakan pelarut yang memiliki sifat semipolar sehingga komponen aktif dengan kepolaran yang beragam dapat terekstraksi lebih sempurna. Keuntungan etanol sebagai pelarut adalah memiliki titik didih yang rendah, sehingga memudahkan pemisahannya dengan komponen aktif dalam propolis, serta mengurangi jumlahnya dalam ekstrak.
Menurut Harborne (1987), golongan senyawa flavonoid dapat diekstraksi dengan baik menggunakan etanol 70%. Flavonoid merupakan senyawa aktif dan terpenting dalam ekstrak propolis (Chintapally 2003).
Ekstraksi propolis dengan maserasi menggunakan etanol 70% menghasilkan rendemen 20% lebih tinggi daripada menggunakan etanol absolut. Oleh karena itu, penggunaan etanol 70% dapat meningkatkan jumlah senyawa aktif yang terekstrak. Selain itu, karena menggunakan propolis kasar yang merupakan sarang propolis, maka ada komponen-komponen penyusun lain yang dapat terekstrak dari sarang lebah, terutama malam (waxe) atau lilin. Lilin lebah terutama terdiri atas monoester sederhana asam lemak dan alkohol dengan rantai karbon jenuh yang panjang (Hart et al. 2003). Maka, penggunaan etanol 70% juga berdasarkan bahwa lilin tidak terekstrak karena tidak larut dalam etanol 70%.
Propolis kasar yang digunakan diambil dari sarang lebah Trigona spp. Lebah jenis ini memproduksi propolis dalam jumlah yang lebih banyak daripada produksi madunya (Gojmerac 1983). Semua senyawa fenol memiliki serapan kuat di daerah ultraviolet karena memiliki struktur cincin aromatik (Harborne 1987). Warna propolis tergantung dari komposisi senyawa fenol yang terdapat dalam ekstrak, yaitu senyawa flavonoid. Ekstrak propolis yang diperoleh dalam penelitian ini berwarna coklat. Propolis yang berwarna lebih gelap dalam pelarut etanol, mengandung flavonoid lebih banyak, sehingga hasil rendemennya juga lebih tinggi dibandingkan dengan propolis berwarna lebih muda (Salomao et al. 2004).
Efektivitas Ekstrak Propolis terhadap Propolis X dan Ampisilin
6
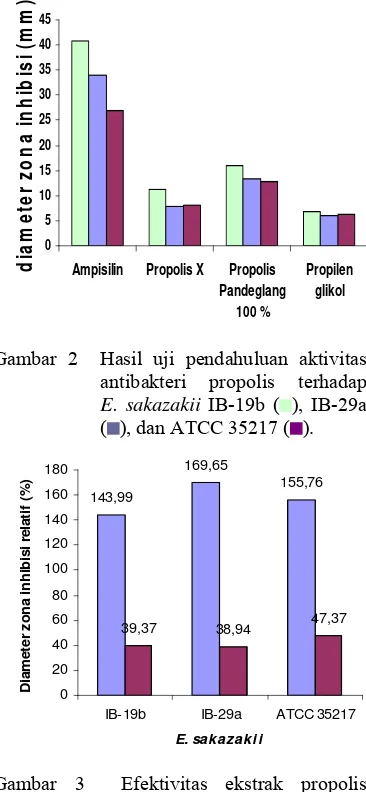
35217 berturut-turut adalah 16,07, 13,25, dan 12,71 mm. Sedangkan diameter zona hambat propolis X pada masing-masing isolat E. sakazakii IB-19b, IB-29a, dan ATCC 35217 berturut-turut adalah 11,16, 7,81, dan 8,16 mm.
Menurut Bankova et al. (2001), propolis memiiliki aktivitas yang lebih rendah terhadap bakteri gram negatif daripada bakteri gram positif. Uji aktivitas antibakteri ekstrak propolis yang sama yang dilakukan oleh Anggraini (2006) terhadap dua bakteri Gram negatif (Escherichia coli dan Pseudomonas aeruginosa) menunjukkan aktivitas yang lebih rendah dibandingkan dua bakteri Gram positif yang diuji (Bacillus subtilis dan Staphylococcus aureus). Perbedaan ini disebabkan oleh perbedaan penyusun dan struktur dinding sel bakteri Gram negatif dan Gram positif. Membran luar bakteri Gram positf memiliki kandungan peptidoglikan yang tinggi dan berlapis tunggal serta tidak mempunyai lapisan polisakarida. Membran luar bakteri Gram negatif mengandung peptidoglikan yang kaya akan lipid dan membentuk lapisan lipopolisakarida. Lapisan ini bersifat semipermeabel, tidak dapat dilewati oleh molekul-molekul besar, tetapi dapat dilewati oleh molekul-molekul kecil seperti nukleosida, oligosakarida, dan asam amino.
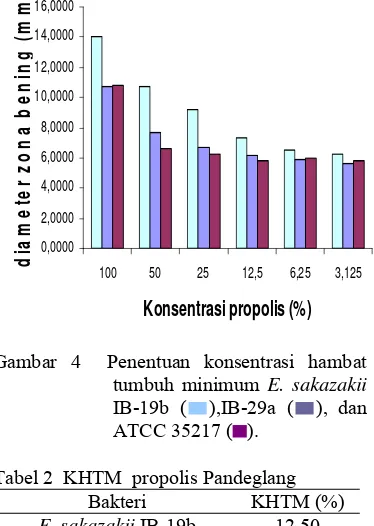
Berdasarkan analisis statistik, pada masing-masing isolat, ekstrak propolis memiliki aktivitas yang berbeda nyata terhadap ampisilin. Secara matematis, efektivitas ekstrak propolis terhadap ampisilin pada masing-masing isolat E. sakazakii IB-19b, IB-29a, dan ATCC 35217 berturut-turut adalah 39,37%, 38,94%, dan 47,37% (Gambar 3). Presentase ini menunjukkan aktivitas ampisilin sangat berbeda nyata dan lebih besar dibandingkan ekstrak propolis. Nilai efektivitas tersebut berbeda dan aktivitas ampisilin lebih besar dibandingkan dengan ekstrak propolis karena perbedaan tingkat sensitifitas bakteri terhadap antibakteri. Akan tetapi dengan sifat antibakteri yang dimiliki oleh propolis, menjadi satu pertimbangan untuk menggunakan propolis sebagai bahan aktif antibakteri ketika terjadi resistensi bakteri terhadap antibiotik.
Menurut Surawiria dalam Rahmawati (2006), pengukuran kekuatan antibiotik-antibakteri berdasarkan metode David-Stout, menyatakan bila diameter zona bening ≤ 5 mm menunjukkan aktivitas antibakteri lemah, diameter 5-10 mm menunjukkan aktivitas
antibakteri sedang, diameter 10-20 mm menunjukkan aktivitas antibakteri kuat, dan diameter > 20 mm menunjukkan aktivitas antibakteri sangat kuat. Berdasarkan standar ini, maka aktivitas hambatan propolis Pandeglang terhadap semua isolat termasuk kategori kuat dan lebih tinggi daripada aktivitas propolis X, yaitu dalam kisaran 10-20 mm. Aktivitas propolis X terhadap E. sakazakii IB-19b termasuk kuat (10-20 mm), kemudian terhadap E. sakazakii IB-29a dan E. sakazakii ATCC 35217 termasuk sedang (5-10 mm).
Aktivitas yang ditunjukkan oleh ampisilin termasuk kategori aktivitas sangat kuat (> 20 mm), bahkan pada isolat E. sakazakii IB-19b aktivitas ampisilin menunjukkan bakteri ini sangat rentan terhadap ampisilin dengan diameter zona bening 40,82 mm. Pada E. sakazakii IB-29a, aktivitas ampisilin termasuk sangat kuat (34,02 mm), dan aktivitas ampisilin terhadap E. sakazakii ATCC 35217 juga termasuk sangat kuat (26,82 mm). Berdasarkan Freney et al. (1988), yang menguji kerentanan 6 galur bakteri E. sakazakii, menunjukkan bahwa bakteri ini
rentan terhadap ampisilin, hasil ini bersesuaian dengan hasil yang diuji pada 195 isolat E. sakazakii yang diperoleh oleh Muytjens dan van der Ros-van de Repe (1986).
7
mengurangi permeabilitas dinding sel, mempermudah bahan aktif lain untuk merusak dinding sel, dan melisis sel (Harborne 1987; Murphy 1999).
Ampisilin merupakan antibiotik β-laktam dan termasuk ke dalam golongan penisilin semisintetik. Mekanisme kerja ampisilin yaitu menghambat pembentukan dinding sel bakteri dengan mencegah bergabungnya asam N-asetil muramat ke dalam struktur peptidoglikan. Penghambatan biosintesis peptidoglikan menyebabkan kekuatan dinding sel melemah, dan tidak dapat menahan tekanan dari sitoplasma sehingga sel pecah. Mekanisme kerja yang spesifik yang dimiliki ampisilin tersebut menyebabkan ampisilin memiliki daya antibakteri yang besar dan bersifat bakterisidal dengan spektrum yang luas, dapat menghambat bakteri Gram positif maupun Gram negatif.
0 5 10 15 20 25 30 35 40 45
Ampisilin Propolis X Propolis Pandeglang 100 % Propilen glikol di a m e te r z ona i nhi b is i ( m m )
Gambar 2 Hasil uji pendahuluan aktivitas antibakteri propolis terhadap E. sakazakii IB-19b ( ), IB-29a ( ), dan ATCC 35217 ( ).
143,99
169,65
155,76
39,37 38,94 47,37
0 20 40 60 80 100 120 140 160 180
IB-19b IB-29a ATCC 35217
E. sa k a za k i i
D ia m e te r z ona i nhi b is i r e la ti f ( % )
Gambar 3 Efektivitas ekstrak propolis terhadap propolis X ( ) dan ampisilin ( ).
Penentuan Konsentrasi Hambat Tumbuh Minimum (KHTM)
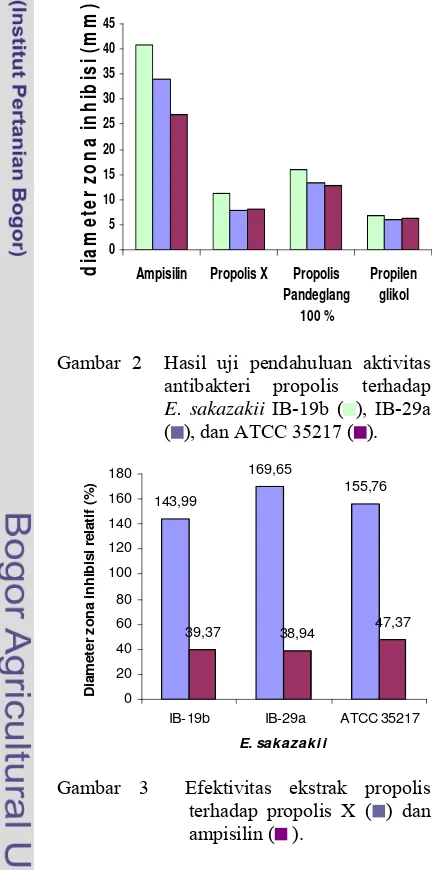
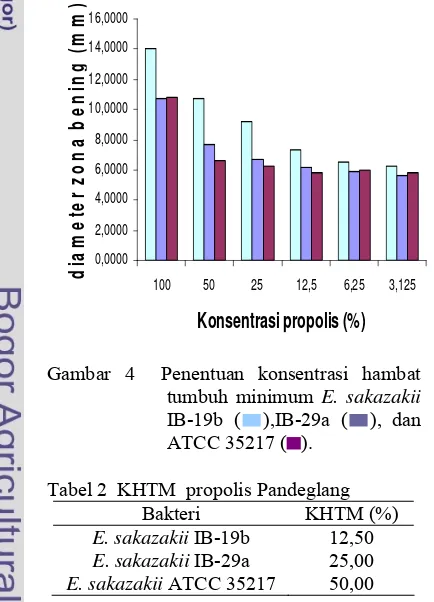
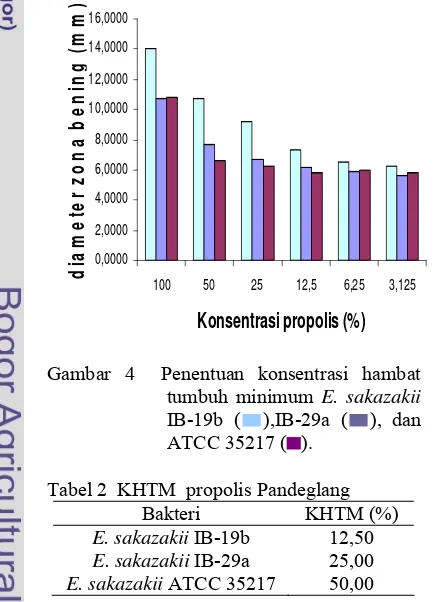
Penentuan KHTM dilakukan untuk menentukan konsentrasi terendah ekstrak propolis yang masih dapat menghambat pertumbuhan bakteri E. sakazakii. Parameter adanya penghambatan pertumbuhan pada E. sakazakii adalah dengan mengukur zona bening pada variasi konsentrasi 100, 50, 25, 12,5, 6,25, dan 3,125% (Gambar 4). Konsentrasi ini dipilih berdasarkan penelitian Anggraini (2006) dan Lasmayanti (2007), selain itu untuk menunjukkan jika ada penurunan aktivitas dengan penurunan konsentrasi yang semakin kecil. Pada penentuan KHTM, E. sakazakii IB-29a dan ATCC 35217 menunjukkan adanya aktivitas pada kontrol pelarut, akan tetapi berdasarkan analisis statistik, pengaruh pelarut propilen glikol tidak signifikan, karena aktivitas yang ditunjukkan oleh ekstrak propolis berbeda nyata dengan propilen glikol (P<0,05). Aktivitas ekstrak propolis sendiri pada masing-masing bakteri uji menunjukkan kecenderungan yang berbeda. Hal ini menunjukkan bahwa masing-masing bakteri memiliki sensitivitas yang berbeda.
Aktivitas antibakteri yang diperoleh menunjukkan variasi aktivitasnya yang tergantung pada konsentrasi dan jenis bakteri, terjadi penurunan aktivitas propolis dengan menurunnya konsentrasi. Begitu pula pada isolat yang berbeda, diperoleh perbedaan yang nyata pada aktivitas propolis terhadap masing-masing isolat. Ketiga isolat menunjukkan hasil yang berbeda dapat disebabkan oleh kerentanan yang berbeda. Karena pada dasarnya ketiga isolat merupakan bakteri Gram negatif, hasil uji yang berbeda menggunakan ekstrak propolis menunjukkan perbedaan reaksi yang berbeda terhadap bahan antibakteri dalam ekstrak propolis. Berdasarkan hasil penentuan KHTM, propolis menunjukkan efektivitas yang tinggi pada isolat IB-19b hingga konsentrasi efektif terkecil 12,5%, dan kurang efektif terhadap bakteri ATCC 35217. Hal ini mungkin disebabkan pada zona inhibisi yang terjadi sangat dipengaruhi oleh beberapa faktor antara lain toksisitas bahan uji, kemampuan difusi bahan uji pada media, dan kondisi lingkungan mikro in vitro (Sabir 2005).
8
dapat menghasilkan bahan kapsular pelekat sehingga bakteri ini dapat membentuk biofilm (Pelczar & Chan 1988; Scheepe-Leberkühne & Wagner 1986 dalam Iversen et al. 2004). Karena beberapa galur memiliki kapsul dan membentuk biofilm, maka penetrasi ke dalam sel bakteri oleh bahan aktif propolis menjadi lebih lambat.
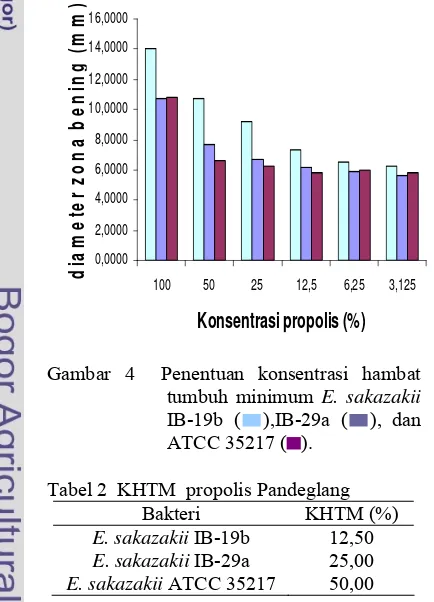
Hasil penentuan KHTM juga menunjukkan aktivitas propolis yang tergantung konsentrasi. Aktivitas antibakteri propolis tertinggi pada konsentrasi 100 %, dan terjadi penurunan aktivitas dengan menurunnya konsentrasi. Melalui analisis ststistik, pengaruh konsentrasi menunjukkan pengaruh yang tidak berbeda nyata pada masing-masing isolat pada konsentrasi 3,125%. Akan tetapi, pada konsentrasi ini nilainya tidak berbeda nyata dengan kontrol pelarut propilen glikol. Oleh karena itu KHTM yang ditentukan adalah pada konsentrasi yang melalui uji statistik berbeda secara nyata dengan propilen glikol dengan aktivitas yang lebih tinggi dari propilen glikol. Nilai KHTM pada masing-masing isolat berbeda-beda, KHTM isolat IB-19b, IB-29a, dan ATCC 35217 berturut-turut adalah 12,50% (7,33 mm), 25,00% (6,69 mm), dan 50,00% (6,62 mm) (Tabel 2).
0,0000 2,0000 4,0000 6,0000 8,0000 10,0000 12,0000 14,0000 16,0000
100 50 25 12,5 6,25 3,125
Konsentrasi propolis (%)
di a m e te r z o na b e ni n g ( mm )
Gambar 4 Penentuan konsentrasi hambat tumbuh minimum E. sakazakii IB-19b ( ),IB-29a ( ), dan ATCC 35217 ( ).
Tabel 2 KHTM propolis Pandeglang
Bakteri KHTM (%) E. sakazakii IB-19b 12,50
E. sakazakii IB-29a 25,00 E. sakazakii ATCC 35217 50,00
SIMPULAN DAN SARAN
Simpulan
Propolis diekstrak dari sarang lebah Trigona spp dengan maserasi menggunakan alkohol 70% menghasilkan rendemen 17,76%. Melalui uji pendahuluan diperoleh aktivitas propolis lebih tinggi daripada propolis X, dan lebih rendah daripada ampisilin. Efektivitas propolis terhadap propolis X pada masing-masing isolat IB-19b, IB-29a, dan ATCC 35217 berturut-turut adalah 143,99%, 169,65%, dan 155,76%. Efektivitas ekstrak propolis terhadap ampisilin pada masing-masing isolat IB-19b, IB-29a, dan ATCC 35217 berturut-turut adalah 39,37%, 38,94%, dan 47,37%. Konsentrasi hambat tumbuh minimum yang diperoleh pada masing-masing isolat berbeda-beda, KHTM isolat IB-19b, IB-29a, dan ATCC 35217 berturut-turut adalah 12,50%, 25,00%, dan 50,00%.
Saran
Saran untuk penelitian selanjutnya dapat dilakukan penelitian yang mempelajari tentang pengaruh metode ekstraksi yang berbeda, dan perbedaan kandungan senyawa dari sumber propolis yang berbeda, serta pada jenis mikroorganisme patogen yang berbeda.
DAFTAR PUSTAKA
Anggraini AD. 2006. Potensi propolis lebah madu Trigona spp. sebagai bahan antibakteri. [skripsi]. Bogor: Program Studi Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bankova V. 2005. Recent trends and important developments in propolis research. eCAM 2:29-32.
Bankova V, Popova M. 2007. Propolis of stingless bees: a promising source of biologically active compounds. Pharmacognosy Reviews 1:88-92.
Bankova et al. 2006. Bioactive constituents of Brazillian red propolis. eCAM 3:249–254.
9
Chinthapally V, Rao, Valhalla NY. 1993. Propolis. Medical Journal 53:1482-1488.
Dharmayanti NLP, Sulistyowati E, Tejolaksono MN, Prasetya R. 2000. Efektifitas pemberian propolis lebah dan royal jelly pada abses yang disebabkan Staphylococcus aureus. Berita Biologi 5:41-48.
Estuningsih S, Wibawan IWT, Naim R. 2007. Potensi kejadian meningitis pada neonatus akibat infeksi Enterobacter sakazakii yang diisolasi dari makanan bayi dan susu formula. http://web.ipb.ac.id/~lppm/ID/ index.php?view=penelitian/hasilcari. [27 Juli 2008].
Freney J et al. 1988. Susceptibilities to antibiotics and antiseptics of new species of the Family Enterobacteriaceae. Antimicriobial Agents and Chemotherapy 32:873-876.
Free JB. 1982. Bees and Mankind. London: George Allen & Unkwin.
Forsythe SJ. 2005. Enterobacter sakazakii and other bacteria in powdered infant milk formula. Maternal and Child Nutrition 1:44–50.
Forsythe SJ, Iversen C, Lane M. 2003. The growth profile, thermotolerance and biofilm formation of Enterobacter sakazakii grown in infant formula milk. Journal of Applied Microbiology 95:967– 973.
Ganiswarna SG et al. 1995. Farmakologi dan Terapi. Jakarta: UI Pr.
Gojmerac WL. 1983. Bee, Beekeeping, Honey and Pollination. Westport: Avi.
Grange JM, Davey RW. 1990. Antibacterial properties of propolis (bee glue). Journal of the Royal Society of Medicine 83:159-160.
Harborne HB. 1987. Metode Fitokimia I. Ed ke-2. Padmawinat K, penerjemah; Bandung: ITB. Terjemahan dari: Phytochemical Method.
Hart H, Craine LE, Hart DJ. 2003. Kimia Organik Ed 11. Achmadi SS, penerjemah; Jakarta: Erlangga. Terjemahan dari: Organic Chemistry 11th Edition.
Jordan K, Arku B, Mullane N, Fox E, Fanning S. 2008. Enterobacter sakazakii survives
spray drying. International Journal of Dairy Technology 61:102-108.
Lasmayanty M. 2007. Potensi antibakteri propolis lebah madu Trigona spp. terhadap bakteri kariogenik (Streptococcus mutans). [skripsi]. Bogor: Program Studi Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Mange JP et al. 2006. Adhesive properties of Enterobacter sakazakii to human epithelial and brain microvascular endothelial cells. BMCMicrobiology 6:58.
Mantienzo AC, Lamorena M. 2004. Extraction and initial characterization of propolis from stingless bees (Trigona Biroi Friese). Di dalam: Proceeding of the 7th Asian Apicultural Association Conference and 10th BEENET Symposium and Technofora; Los Banos, 23-27 Februari 2004. Los Banos: Univ Philippines. Hlm 321-329.
Mattjik AA, Sumertajaya M. 2000. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid I. Bogor: IPB Pr.
McLoughlin R, Racz I, Buckley M, O’Connor HJ, O’Morain C. 2004. Therapy of Helicobacter pylori. Helicobacter 9:42–48.
Miorin PL, Levy Junior NC, Custodio AR, Bretz WA, Marcucci MC. 2003. Antibacterial activity of honey and propolis from Apis mellifera and Tetragonisca angustula against Staphylococcus aureus. Journal of Applied Microbiology 95:913–920.
Murphy MC. 1999. Plant products as antimicrobial agents. Clinical Microbiology Review 12:564-5821.
Muytjens HL, Repe Ros van de Joke van der. 1986. Comparative in vitro susceptibilities of eight Enterobacter with special reference to Enterobacter sakazakii Species. Antimicrobial Agents and Chemotherapy 29:367-370.
Nair MKM, Venkitanarayanan KS. 2006.
10
Pagotto FJ, Nazarowec-White M, Bidawid S, Farber JM. 2003. Enterobacter sakazakii : infectivity and enterotoxin production in vitro and in vivo. Journal of Food Protection 66:370-377.
Osaili TM, Shaker RR, Ayyash MM , Holley RA. 2007. Effect of Bifidobacterium breve on the growth of Enterobacter sakazaki in rehydrated infant milk formula. Journal of Food Safety 28:34-46.
Pelczar MJJr, Chan ECS. 1988. Dasar-Dasar Mikrobiologi. Volume ke-1, 2. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
Rojas JJ, Ochoa VJ, Saul A Ocampo SA, John F Muñoz JF. 2006. Screening for antimicrobial activity of ten medicinal plants used in Colombian folkloric medicine: A possible alternative in the treatment of non-nosocomial infections. BMC Complementary and Alternative Medicine 6:2. [terhubung berkala]. http://www.biomedcentral.com/1472-6882/6/2. [27 Juli 2008].
Sabir A. 2005. Aktivitas antibakteri flavonoid propolis Trigona sp terhadap bakteri Streptococcus mutans (in vitro). Majalah Kedokteran Gigi 38:135-141.
Salatino A, Teixeira ÉW, Negri G, Message D. 2005. Origin and chemical variation of Brazilian propolis. eCAM 2:33–38.
Siswandono, Soekardjo B. 1995. Kimia Medisinal. Surabaya: Airlangga Univ Pr.
Salomao K et al. 2004. Chemical composition and microbicidal activity of extracts from Brazilian and Bulgarian propolis. Letters in Applied Microbiology 38:87–92.
Townsend S, Caubilla BJ, Loc-Carrillo C, Forsythe S. 2006. The presence of endotoxin in powdered infant formula milk and the influence of endotoxin and Enterobacter sakazakii on bacterial translocation in the infant rat. Food Microbiology 24:67-74.
Townsend S, Hurrel E, Forsythe S. 2008. Virulence studies of Enterobacter
12
Lampiran 1 Tahapan penelitian
Lampiran 2 Ekstraksi propolis
Sterilisasi alat dan bahan Ekstraksi propolis Peremajaan Biakan
Uji Aktivitas Antibakteri
Analisis Statistik
150 g propolis kasar
Maserasi dengan 500 mL pelarut etanol 70% selama
7 hari
Filtrat
EndapanDipekatkan
dengan rotavapor
Maserasi kembali selama 7 hari, filtrat diambil
setiap hari Ekstrak pekat ditimbang
(nilai rendemen)
+ PEG 1 × volume
Ekstrak propolis 100 % Ekstrak propolis 100 %
13
Lampiran 3 Rendemen ekstrak propolis
Bobot propolis kasar = 150,46 gram
Pelarut etanol 70%
= 1100 mL
Robot ekstrak propolis pekat = 26,7367 gram
Rendemen =
(gram)
kasar
propolis
bobot
(gram)
pekat
propolis
ekstrak
bobot
× 100%
=
g
45
,
150
g
7367
,
26
× 100%
= 17,76%
Lampiran 4 Data hasil uji pendahuluan aktivitas antibakteri
Diameter zona inhibisi (mm)*
Perlakuan
E. sakazakii
IB-19b
E. sakazakii
IB-29a
E. sakazakii
ATCC 35217
Propolis Pandeglang 100 %
16,07
13,25
12,71
Ampisilin 10 mg/mL
40,82
34,02
26,83
Propolis X
11,16
7,81
8,16
Propilen glikol
6,75
5,98
6,30
*: nilai yang tercantum termasuk ukuran diameter lubang (± 5 mm)
Diameter Zona Inhibisi
Relatif (DZIR)
E. sakazakii
IB-19b
E. sakazakii
IB-29a
E. sakazakii
ATCC 35217
Ekstrak propolis (PrP)
terhadap propolis X (%)
143,99 169,65 155,76
Ekstrak propolis (PrP)
terhadap ampisilin (%)
39,37 38,94 47,37
Perhitungan :
% DZIR =
antibiotik
DZI
sampel
DZI
× 100%
% DZIR Propolis terhadap ampisilin (IB-19B) =
82
,
40
07
,
16
× 100%
= 39,37%
% DZIR = % Diameter Zona Inhibisi Relatif
14
Lampiran 5 Penentuan konsentrasi hambat tumbuh minimum
E. sakazakii
IB-19b
Diameter zona inhibisi (mm)* Perlakuan
Ulangan 1 Ulangan 2 Ulangan 3 Rerata ± SD
100 % 12,65 15,22 14,25 14,0400 ± 1,2978
50 % 11,14 10,56 10,36 10,6867 ± 0,4051
25 % 9,14 9,11 9,48 9,2433 ± 0,2055
12,5 % 7,26 7,33 7,4 7,3300 ± 0,0700
6,25 % 6,69 5,9 6,98 6,5233 ± 0,5590
3,125 % 6,4 6,18 6,32 6,3000 ± 0,1114
Propolis X 10,8 9,57 9,34 9,9033 ± 0,7850 Propilen glikol 5,72 5,68 5,70 5,7000 ± 0,0200
ampisilin 39,4 18,85 18,67 25,6400 ± 11,9168
akuades 5,34 5,57 5,38 5,4300 ± 0,1229
*: nilai yang tercantum termasuk ukuran diameter lubang (± 5 mm)
Lampiran 6 Penentuan konsentrasi hambat tumbuh minimum
E. sakazakii
IB-29a
Perlakuan Diameter zona inhibisi (mm) *
Ulangan 1 Ulangan 2 Ulangan 3 Rerata ± SD
100 % 10,46 11,21 10,47 10,7133 ± 0,4302
50 % 8,98 5,94 8,03 7,6500 ± 0,4051
25 % 6,97 5,7 7,39 6,6867 ± 0,2055
12,5 % 6,53 5,48 6,54 6,1833 ± 1,5552
6,25 % 5,82 5,72 6,11 5,8833 ± 0,8799 3,125 % 5,72 5,52 5,72 5,6533 ± 0,6091
Propolis X 8,45 6,43 6,85 7,2433 ± 1,0659
Propilen glikol 7,11 6,62 5,62 6,4500 ± 0,7594
ampisilin 35,55 35,74 34.57 35,6450 ± 0,1344
akuades 5,49 5,52 5,38 5,4633 ± 0,0737
15
Lampiran 7 Penentuan konsentrasi hambat tumbuh minimum
E. sakazakii
ATCC
35217
Perlakuan Diameter zona inhibisi (mm)*
Ulangan 1 Ulangan 2 Ulangan 3 Rerata ± SD
100 % 11,21 10,48 10,78 10,8233 ± 0,3669
50 % 6,51 6,72 6,62 6,6167 ± 0,1050
25 % 6,82 5,94 6,04 6,2667 ± 0,4818
12,5 % 5,72 5,7 6,08 5,8333 ± 0,2139
6,25 % 5,85 6,07 6,04 5,9867 ± 0,1193
3,125 % 5,92 5,66 5,82 5,8000 ± 0,1311
Propolis X 7,82 6,85 6,41 7,0267 ± 0,7214 Propilen glikol 7,10 6,29 6,41 6,6000 ± 0,4371
ampisilin 28,25 29,12 27,84 28,4033 ± 0,6536
akuades 5,62 5,11 5,57 5,4333 ± 0,2811
*: nilai yang tercantum termasuk ukuran diameter lubang (± 5 mm)
Lampiran 8 ANOVA KHTM
E. sakazakii
IB-19b
Sum of Squares
df Mean Square F Sig.
Between Groups 1043,849 10 104,385 7,914 ,000 Within Groups 290,166 22 13,189
Total 1334,014 32
Lampiran 9 Hasil analisis uji Duncan diameter zona bening
E. sakazakii
IB-19b
Subset for alpha = .05 SAMPEL N
1 2 3
Propilen glikol 3 5,7000 3,125 % 3 6,3000 6,25 % 3 6,5233
12,50 % 3 7,3300 7,3300 25,00 % 3 9,2433 9,2433 Propolis X 3 9,9033 9,9033 50,00 % 3 10,6867 10,6867 100,00 % 3 14,0100
16
Lampiran 10 ANOVA KHTM
E. sakazakii
IB-29a
Sum of Squares
df Mean Square F Sig.
Between Groups 2287,851 10 228,785 420,999 ,000 Within Groups 11,956 22 ,543
Total 2299,806 32
Lampiran 11 Hasil analisis uji Duncan diameter zona bening
E. sakazakii
IB-29a
Subset for alpha = .05 SAMPEL N
1 2 3 4 5
3,125 % 3 5,6533
6,25 % 3 5,8833 5,8833 12,50 % 3 6,1833 6,1833
Propilen glikol 3 6,4500 6,4500 6,4500 25,00 % 3 6,6867 6,6867 6,6867 Propolis X 3 7,2433 7,2433
50,00 % 3 7,6500
100,00 % 3 10,7133
Ampisilin 10 mg/mL
3 35,2867
Sig. ,067 ,053 ,080 1,000 1,000
Lampiran 12 ANOVA KHTM
E. sakazakii
ATCC 35217
Sum of Squares
df Mean Square F Sig.
Between Groups 1358,667 10 135,867 923,236 ,000 Within Groups 3,238 22 ,147
Total 1361,905 32
Lampiran 13 Hasil analisis uji Duncan diameter zona bening
E. sakazakii
ATCC 35217
Subset for alpha = .05 SAMPEL N
1 2 3 4 5 6
3,125 % 3 5,8000 5,8000 12,50 % 3 5,8333 5,8333
6,25 % 3 5,9867 5,9867 5,9867 25,00 % 3 6,2667 6,2667
Propilen glikol 3 6,6000 6,6000 50,00 % 3 6,6167 6,6167
Propolis X 3 7,0267
100,00 % 3 10,8233
Ampisilin 10 mg/ml 3 28,4033
17
Lampiran 14 Hasil diameter zona bening uji pendahuluan aktivitas antibakteri
propolis
Ak Amp
PX
Ak Amp
PK
Ak
Amp PK
PG
PG PG
PrP PrP
PrP
(a) (b) (c)
Keterangan:
E. sakazakii
(a) IB-19b; (b) IB-29a; (c) ATCC 35217
Amp=
Ampislin
Ak = Akuades
PG = Propilen Glikol
PX = Propolis X
18
Lampiran 15 Hasil uji penentuan konsentrasi hambat tumbuh minimum
S6
S2 Amp
S1
S7
PG
Ak S5
PX
S4 S8
S3
E. sakazakii
IB-19b
S1 S7 S8 Amp
S2
PG
S4 Ak PX
S3 S6 S5
E. sakazakii
IB-29a
S1 S8
PX S7
S2
Ak
S4 S5
Amp PG
S3 S6
E. sakazakii
ATCC 35217
AKTIVITAS ANTIBAKTERI PROPOLIS LEBAH
Trigona
spp.
ASAL PANDEGLANG TERHADAP
Enterobacter sakazakii
FITRIANNUR
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
iv
AKTIVITAS ANTIBAKTERI PROPOLIS LEBAH
Trigona
spp.
ASAL PANDEGLANG TERHADAP
Enterobacter sakazakii
FITRIANNUR
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
v
Judul Skripsi : Aktivitas Antibakteri Propolis Lebah
Trigona
spp. Asal
Pandeglang Terhadap
Enterobacter sakazakii
Nama
: Fitriannur
NIM
: G44104047
Disetujui
Dr. Suryani, M.Sc
Ketua
Ir. AE Zainal Hasan, M.Si Dr. drh. Sri Estuningsih, M.Si
Anggota Anggota
Diketahui
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
PENDAHULUAN
Propolis merupakan salah satu produk alami yang dihasilkan lebah madu, dan telah banyak dimanfaatkan sebagai obat atau suplemen, pencuci mulut, anti-peradangan, terapi penyakit, mempercepat penyembuhan luka, dan lain-lain. Selain itu, propolis banyak memiliki manfaat dan potensi khusus, karena memiliki sifat sebagai anti-bakteri, anti-virus, dan dapat menghambat pertumbuhan kanker. Melihat potensi propolis ini, maka perlu dibuktikan secara ilmiah tentang potensi dan pemanfaatan propolis terutama sebagai antibakteri.
Propolis sangat berperan dalam menjaga lingkungan internal sarang yang aseptik. Bukti signifikan tentang sifat antimikrobanya berasal dari kegunaan produk ini di dalam sarang itu sendiri, yaitu untuk membungkus bangkai hewan pengganggu yang sudah mati dengan propolis, karena hewan ini terlalu berat untuk dapat dibuang dari sarangnya (misalnya ular kecil atau tikus). Prosesnya menghasilkan efek serupa pembalseman, karena tubuh mati hewan tersebut mengering tanpa mengalami pembusukan (Salatino et al. 2005). Hal ini tentu sangat penting untuk melindungi sarang lebah dari infeksi bakteri yang dapat menyebar luas. Pengetahuan keefektifan antiseptik propolis sudah diketahui sejak lama. Aristoteles menyarankan penggunaan propolis untuk merawat abses dan luka (Salatino et al. 2005).
Sifat dan karakteristik E. sakazakii telah banyak diteliti dalam hal fisiologi dan ketahanannya terhadap lingkungan (Breeuwer et al. 2003). Penelitian tentang sifat-sifat bakteri ini merupakan langkah penting dalam usaha untuk mengeliminasi bakteri ini dari lingkungan produksi pangan yang penting seperti pada pembuatan susu bubuk formula. Akan tetapi, tentang bahan tambahan alami untuk mencegah terjadinya kontaminasi susu oleh bakteri ini belum banyak diketahui. Salah satu bahan alami yang telah diuji berpotensi sebagai antibakteri adalah propolis Trigona spp. Penelitian ini diharapkan dapat menunjukkan potensi propolis Trigona spp. sebagai antibakteri terhadap E. sakazakii, sehingga propolis ini dapat dimanfaatkan sebagai bahan pengawet alami untuk mencegah atau mengurangi kontaminasi bakteri pada susu formula bayi.
Penelitian bertujuan menentukan aktivitas antibakteri propolis dan menentukan konsentrasi hambat tumbuh minimum (KHTM) propolis terhadap E. sakazakii.
Hipotesis penelitian ini adalah propolis mempunyai aktivitas antibakteri terhadap E. sakazakii. Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah tentang propolis sebagai antibakteri E. sakazakii, dan dapat mendukung penelitian-penelitian selanjutnya untuk memperluas aplikasi dan nilai guna propolis.
Penelitian ini dilakukan di Laboratorium Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, dan Laboratorium Mikrobiologi Medik, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian dilaksanakan dari bulan Mei-September 2008.
TINJAUAN PUSTAKA
Lebah Trigona spp.
Lebah Trigona spp. merupakan serangga sosial yang hidup berkelompok membentuk suatu koloni. Lebah ini mudah dijumpai di daerah tropis dan subtropis di Amerika Selatan, setengah bagian Afrika Selatan, dan Asia Tenggara. Koloninya terdiri dari 300-800.000 ekor lebah (Free 1982). Trigona spp. (gala-gala, lebah lilin), dalam bahasa daerah dinamakan klanceng, lenceng (jawa), atau teuweul (sunda) (Perum Perhutani 1986 diacu dalam Lasmayanty 2007). Jumlah madu yang dihasilkan lebih sedikit dan lebih sulit diekstrak, namun jumlah propolis yang dihasilkan lebih banyak dibandingkan dengan lebah jenis lain (Singh 1962 diacu dalam Lasmayanty 2007).
Trigona spp. memiliki sengat sisa, namun tidak digunakan sebagai alat pertahanan. Lebah ini akan menggigit musuhnya atau membakar kulit musuhnya dengan larutan basa. Organ vital (mata, hidung, dan telinga) musuh akan dikelilingi oleh lebah lain dalam satu koloninya. Lebah ini juga dilengkapi sistem kekebalan untuk menyerang serangga pengganggu lain (Free 1982). Koloni lebah madu terdiri dari dua golongan, yaitu golongan reproduktif (lebah jantan dan ratu) dan golongan non reproduktif (lebah pekerja). Mereka dapat dibedakan satu dengan lainnya dari bentuk, rupa, warna, dan tingkah laku. Satu koloni lebah memiliki hanya satu ekor ratu, ratusan ekor lebah jantan, dan ribuan ekor lebah pekerja (Sumoprastowo 1980).
PENDAHULUAN
Propolis merupakan salah satu produk alami yang dihasilkan lebah madu, dan telah banyak dimanfaatkan sebagai obat atau suplemen, pencuci mulut, anti-peradangan, terapi penyakit, mempercepat penyembuhan luka, dan lain-lain. Selain itu, propolis banyak memiliki manfaat dan potensi khusus, karena memiliki sifat sebagai anti-bakteri, anti-virus, dan dapat menghambat pertumbuhan kanker. Melihat potensi propolis ini, maka perlu dibuktikan secara ilmiah tentang potensi dan pemanfaatan propolis terutama sebagai antibakteri.