PENGGUNAAN IAA DAN BAP
UNTUK MENSTIMULASI ORGANOGENESIS
TANAMAN
Anthurium andreanum
DALAM KULTUR
IN VITRO
Oleh :
SITI SYARA
A34301027
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
PENGGUNAAN IAA DAN BAP
UNTUK MENSTIMULASI ORGANOGENESIS
TANAMAN
Anthurium andreanum
DALAM KULTUR
IN VITRO
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
Oleh :
SITI SYARA
A34301027
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
RINGKASAN
SITI SYARA. Penggunaan IAA dan BAP Untuk Menstimulasi Organogenesis Tanaman Anthurium andreanum Dalam Kultur In Vitro.
Dibimbing oleh NURHAJATI ANSORI MATTJIK.
Penelitian ini bertujuan untuk mengetahui dan menganalisa pengaruh
kombinasi zat pengatur tumbuh IAA dan BAP terhadap pembentukan planlet
Anthurium andreanum dalam kultur in vitro. Pelaksanaan penelitian dilakukan
pada bulan Juni hingga November 2005 yang bertempat di Laboratorium
Bioteknologi Departemen Agronomi dan Hortikultura Fakultas Pertanian, IPB.
Penelitian ini menggunakan rancangan perlakuan faktorial dengan dua
faktor yang disusun dalam Rancangan Lingkungan Acak Lengkap.
Faktor-faktornya adalah konsentrasi IAA yang terdiri dari 5 taraf, yaitu 0.0 ppm (A0), 0.1
ppm (A1), 0.2 ppm (A2), 0.3 ppm (A3) dan 0.4 ppm (A4) serta konsentrasi BAP
yang terdiri dari 4 taraf yaitu 0.0 ppm (B0), 1.0 ppm (B1), 2.0 ppm (B2) dan 3.0
ppm (B3). Dua faktor tersebut menghasilkan 20 kombinasi perlakuan yang
masing-masing diulang sebanyak 10 kali, sehingga terdapat 200 satuan percobaan.
Setiap ulangan terdiri dari 1 botol yang berisi 1 eksplan.
Pelaksanaan penelitian terdiri dari persiapan dan sterilisasi alat, persiapan
air kelapa, pembuatan media, sterilisasi dan penanaman bahan tanam, penanaman
eksplan dan pengamatan. Eksplan yang digunakan adalah potongan batang
Anthurium sepanjang 0.5 cm dengan memiliki satu buku yang diperoleh dari
proses perkecambahan secara in vitro. Peubah-peubah yang diamati yaitu, tinggi
tanaman, jumlah tunas, jumlah daun, jumlah akar serta panjang akar terpanjang.
Interaksi antara IAA dan BAP pada beberapa kultur menunjukkan
pertumbuhan kalus. Pertumbuhan kalus mulai terlihat pada pengamatan minggu
ke-2 setelah tanam. Pada awal kemunculannya, kalus berwarna hijau kekuningan
yang kemudian berubah menjadi hijau tua. Perlakuan air kelapa 15% (v/v) + 0.2
ppm IAA + 2.0 ppm BAP cenderung membentuk kalus lebih cepat.
Interaksi antara IAA dan BAP tidak memberikan pengaruh nyata terhadap
peubah tinggi tanaman, serta jumlah organ daun dan akar yang terbentuk.
kelapa 15%(v/v) cenderung mendorong pertumbuhan tinggi tanaman serta
pembentukan organ daun dan akar. Diduga bahwa 0.3 ppm IAA serta 2.0 ppm dan
1.0 ppm BAP secara efektif mampu mendorong sel-sel membesar membentuk
kalus hingga akhirnya sel-sel kalus kemudian berdiferensiasi membentuk organ
daun dan akar. Interaksi antara air kelapa 15%(v/v), 0.2 ppm IAA dan 2.0 ppm
BAP memberikan pengaruh nyata terhadap pembentukan tunas. Hal ini diduga
bahwa kombinasi tersebut secara efektif mampu meningkatkan kemampuan
sel-sel berdiferensiasi membentuk tunas-tunas baru. Interaksi antara 0.4 ppm IAA dan
1.0 ppm BAP disertai penambahan air kelapa 15%(v/v) memberikan pengaruh
nyata terhadap perkembangan sistem perakaran dengan menghasilkan panjang
akar terpanjang tertinggi (2.09 mm). Sedangkan interaksi air kelapa 15%(v/v)+0.2
ppm IAA+3.0 ppm BAP dan air kelapa 15%(v/v)+0.3 ppm IAA+3.0 ppm BAP
menghasilkan panjang akar terpanjang terendah (1.22 mm). Diduga bahwa auksin
yang terkandung pada jaringan tanaman tidak hanya berasal dari auksin sintetik
tapi juga berasal dari auksin endogen. Hal ini menyebabkan konsentrasi auksin
menjadi terlalu tinggi sehingga menghambat proses pemanjangan akar.
Kesimpulan dari penelitian ini adalah eksplan memberikan respon
pertumbuhan berupa pembentukan kalus, tunas, daun serta akar. Perlakuan 0.3
ppm IAA serta 2.0 ppm dan 1.0 ppm BAP cenderung mendorong pertumbuhan
tinggi tanaman serta pembentukan organ daun dan akar. Interaksi antara 0.2 ppm
IAA dan 2.0 ppm BAP memberikan pengaruh nyata terhadap pembentukan tunas
dengan menghasilkan jumlah tunas terbanyak. Interaksi antara 0.4 ppm IAA dan
1.0 ppm BAP memberikan pengaruh nyata terhadap perkembangan sistem
Judul : PENGGUNAAN IAA dan BAP UNTUK MENSTIMULASI ORGANOGENESIS TANAMAN Anthurium andreanum
DALAM KULTUR IN VITRO
Nama : Siti Syara Nrp : A34301027
Menyetujui, Dosen Pembimbing
Prof. Dr. Ir. Nurhajati Ansori Mattjik, MS NIP 130 367 074
Mengetahui,
Dekan Fakultas Pertanian
Prof. Dr. Ir. H. Supiandi Sabiham, M.Agr NIP 130 422 698
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 18 Oktober 1982.
Penulis merupakan anak kedua dari tiga bersaudara dari pasangan Mukhlis
Iskandar dan Imas Mahdiati.
Pendidikan formal penulis dimulai di TK Kesatuan Bogor pada tahun 1987
dan SD Negeri Polisi 1 pada tahun 1989. Tahun 1995 penulis melanjutkan
pendidikan ke SMP Negeri 2 Bogor. Penulis melanjutkan pendidikan ke SMU
Negeri 3 Bogor pada tahun 1998 dan lulus tahun 2001.
Tahun 2001 penulis diterima di Program Studi Hortikultura Departemen
Agronomi dan Hortikultura Fakultas Pertanian Institut Pertanian Bogor melalui
jalur USMI. Selama masa perkuliahan, penulis pernah melakukan magang di
kebun hidroponik PD Grace Lembang (2003) dan menjadi asisten pada mata
KATA PENGANTAR
Puji dan syukur penulis panjatkan atas kehadirat Allah SWT sebagai
pemilik alam semesta ini karena atas segala rahmat dan karunia-Nya penulis dapat
menyelesaikan penelitian yang berjudul “Penggunaan IAA dan BAP Untuk
Menstimulasi Organogenesis Tanaman Anthurium andreanum Dalam Kultur In
Vitro”.
Penulis menyampaikan terima kasih kepada
1. Yang tercinta Mama, Papa, ‘Mbu, ‘Mbah dan ‘Mak (alm) untuk cinta, doa dan
dukungan yang tidak pernah putus. Semoga penulis diberi kesempatan untuk
bisa membahagiakan mereka.
2. Prof. Dr. Ir. Nurhajati Ansori Mattjik, MS selaku dosen pembimbing yang
telah memberikan pengarahan dan bimbingan dalam penelitian dan penulisan
skripsi ini.
3. Dr. Ir. Agus Purwito, MSc dan Ir. Megayani Sri Rahayu, MS yang telah
bersedia menjadi dosen penguji.
4. Dr. Ir. Winarso D. Widodo, MS selaku dosen pembimbing akademik yang
telah memberikan bimbingan kepada penulis selama masa perkuliahan.
5. Dr. Ir. Diny Dinarti, MSi selaku Pimpinan Laboratorium Bioteknologi
Departemen Agronomi dan Hortikultura untuk masukan-masukan yang sangat
membantu dalam kelancaran penelitian dan penulisan skripsi.
6. Pak Ulih Ciapus, Pak Yus INLITHI, Bu Umi SMUNTI, Pak Iip, rekan-rekan
dan seluruh staff Laboratorium Bioteknologi Departemen Agronomi dan
Hortikultura, Fakultas Pertanian IPB.
7. Teh Isti, de Eil, a Keni, a Wahyu dan seluruh keluarga besar yang telah
banyak membantu dan mendoakan penulis.
8. Yang tersayang Thury, ‘Na, Le, Noey, Tsuqo, Winna, Puri, Ali, Ayu dan
Windy untuk persahabatan, doa dan dukungannya dari jauh.
9. Batara Setiadi untuk waktu, pengertian, kesabaran, dukungan dan doanya
selama ini. Terima kasih karena kamu selalu ada.
11.Anto, Encep, Fajar, Mono, Rully, Aldi, Maya, Surya dan seluruh Hortiez’ 38
untuk tahun-tahunnya selama masa perkuliahan.
12.Lesa Ilma Grenti dan Asep Yanuar Arifin yang telah banyak membantu
penulis dalam pelaksanaan penelitian.
Semoga skripsi ini dapat bermanfaat bagi yang membutuhkan.
Bogor, Mei 2006
DAFTAR ISI
Syarat Tumbuh dan Budidaya Anthurium andreanum ... 5
Kultur Jaringan Tanaman ... 6
Eksplan ... 6
Media ... 7
Zat Pengatur Tumbuh ... 8
Air Kelapa ... 9
Kultur Jaringan Anthurium andreanum ... 10
DAFTAR TABEL
Nomor Halaman
Teks
1. Pengaruh Interaksi IAA dan BAP Terhadap Jumlah Tunas Pada 12
MST ... 22
2. Pengaruh Interaksi IAA dan BAP Terhadap Panjang Akar Terpanjang Pada 12 MST ... 27
Nomor Halaman Lampiran 3. Komposisi Larutan Stok Media Murashige and Skoog (MS) ... 33
4. Data Produksi Tanaman Hias di Indonesia Tahun 2003 ... 34
5. Daftar Harga Bunga Potong Segar ... 35
6. Sidik Ragam Tinggi Tanaman ... 36
7. Sidik Ragam Jumlah Tunas ... 37
8. Sidik Ragam Jumlah Daun ... 39
9. Sidik Ragam Jumlah Akar ... 40
PENGGUNAAN IAA DAN BAP
UNTUK MENSTIMULASI ORGANOGENESIS
TANAMAN
Anthurium andreanum
DALAM KULTUR
IN VITRO
Oleh :
SITI SYARA
A34301027
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
PENGGUNAAN IAA DAN BAP
UNTUK MENSTIMULASI ORGANOGENESIS
TANAMAN
Anthurium andreanum
DALAM KULTUR
IN VITRO
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
Oleh :
SITI SYARA
A34301027
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
RINGKASAN
SITI SYARA. Penggunaan IAA dan BAP Untuk Menstimulasi Organogenesis Tanaman Anthurium andreanum Dalam Kultur In Vitro.
Dibimbing oleh NURHAJATI ANSORI MATTJIK.
Penelitian ini bertujuan untuk mengetahui dan menganalisa pengaruh
kombinasi zat pengatur tumbuh IAA dan BAP terhadap pembentukan planlet
Anthurium andreanum dalam kultur in vitro. Pelaksanaan penelitian dilakukan
pada bulan Juni hingga November 2005 yang bertempat di Laboratorium
Bioteknologi Departemen Agronomi dan Hortikultura Fakultas Pertanian, IPB.
Penelitian ini menggunakan rancangan perlakuan faktorial dengan dua
faktor yang disusun dalam Rancangan Lingkungan Acak Lengkap.
Faktor-faktornya adalah konsentrasi IAA yang terdiri dari 5 taraf, yaitu 0.0 ppm (A0), 0.1
ppm (A1), 0.2 ppm (A2), 0.3 ppm (A3) dan 0.4 ppm (A4) serta konsentrasi BAP
yang terdiri dari 4 taraf yaitu 0.0 ppm (B0), 1.0 ppm (B1), 2.0 ppm (B2) dan 3.0
ppm (B3). Dua faktor tersebut menghasilkan 20 kombinasi perlakuan yang
masing-masing diulang sebanyak 10 kali, sehingga terdapat 200 satuan percobaan.
Setiap ulangan terdiri dari 1 botol yang berisi 1 eksplan.
Pelaksanaan penelitian terdiri dari persiapan dan sterilisasi alat, persiapan
air kelapa, pembuatan media, sterilisasi dan penanaman bahan tanam, penanaman
eksplan dan pengamatan. Eksplan yang digunakan adalah potongan batang
Anthurium sepanjang 0.5 cm dengan memiliki satu buku yang diperoleh dari
proses perkecambahan secara in vitro. Peubah-peubah yang diamati yaitu, tinggi
tanaman, jumlah tunas, jumlah daun, jumlah akar serta panjang akar terpanjang.
Interaksi antara IAA dan BAP pada beberapa kultur menunjukkan
pertumbuhan kalus. Pertumbuhan kalus mulai terlihat pada pengamatan minggu
ke-2 setelah tanam. Pada awal kemunculannya, kalus berwarna hijau kekuningan
yang kemudian berubah menjadi hijau tua. Perlakuan air kelapa 15% (v/v) + 0.2
ppm IAA + 2.0 ppm BAP cenderung membentuk kalus lebih cepat.
Interaksi antara IAA dan BAP tidak memberikan pengaruh nyata terhadap
peubah tinggi tanaman, serta jumlah organ daun dan akar yang terbentuk.
kelapa 15%(v/v) cenderung mendorong pertumbuhan tinggi tanaman serta
pembentukan organ daun dan akar. Diduga bahwa 0.3 ppm IAA serta 2.0 ppm dan
1.0 ppm BAP secara efektif mampu mendorong sel-sel membesar membentuk
kalus hingga akhirnya sel-sel kalus kemudian berdiferensiasi membentuk organ
daun dan akar. Interaksi antara air kelapa 15%(v/v), 0.2 ppm IAA dan 2.0 ppm
BAP memberikan pengaruh nyata terhadap pembentukan tunas. Hal ini diduga
bahwa kombinasi tersebut secara efektif mampu meningkatkan kemampuan
sel-sel berdiferensiasi membentuk tunas-tunas baru. Interaksi antara 0.4 ppm IAA dan
1.0 ppm BAP disertai penambahan air kelapa 15%(v/v) memberikan pengaruh
nyata terhadap perkembangan sistem perakaran dengan menghasilkan panjang
akar terpanjang tertinggi (2.09 mm). Sedangkan interaksi air kelapa 15%(v/v)+0.2
ppm IAA+3.0 ppm BAP dan air kelapa 15%(v/v)+0.3 ppm IAA+3.0 ppm BAP
menghasilkan panjang akar terpanjang terendah (1.22 mm). Diduga bahwa auksin
yang terkandung pada jaringan tanaman tidak hanya berasal dari auksin sintetik
tapi juga berasal dari auksin endogen. Hal ini menyebabkan konsentrasi auksin
menjadi terlalu tinggi sehingga menghambat proses pemanjangan akar.
Kesimpulan dari penelitian ini adalah eksplan memberikan respon
pertumbuhan berupa pembentukan kalus, tunas, daun serta akar. Perlakuan 0.3
ppm IAA serta 2.0 ppm dan 1.0 ppm BAP cenderung mendorong pertumbuhan
tinggi tanaman serta pembentukan organ daun dan akar. Interaksi antara 0.2 ppm
IAA dan 2.0 ppm BAP memberikan pengaruh nyata terhadap pembentukan tunas
dengan menghasilkan jumlah tunas terbanyak. Interaksi antara 0.4 ppm IAA dan
1.0 ppm BAP memberikan pengaruh nyata terhadap perkembangan sistem
Judul : PENGGUNAAN IAA dan BAP UNTUK MENSTIMULASI ORGANOGENESIS TANAMAN Anthurium andreanum
DALAM KULTUR IN VITRO
Nama : Siti Syara Nrp : A34301027
Menyetujui, Dosen Pembimbing
Prof. Dr. Ir. Nurhajati Ansori Mattjik, MS NIP 130 367 074
Mengetahui,
Dekan Fakultas Pertanian
Prof. Dr. Ir. H. Supiandi Sabiham, M.Agr NIP 130 422 698
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 18 Oktober 1982.
Penulis merupakan anak kedua dari tiga bersaudara dari pasangan Mukhlis
Iskandar dan Imas Mahdiati.
Pendidikan formal penulis dimulai di TK Kesatuan Bogor pada tahun 1987
dan SD Negeri Polisi 1 pada tahun 1989. Tahun 1995 penulis melanjutkan
pendidikan ke SMP Negeri 2 Bogor. Penulis melanjutkan pendidikan ke SMU
Negeri 3 Bogor pada tahun 1998 dan lulus tahun 2001.
Tahun 2001 penulis diterima di Program Studi Hortikultura Departemen
Agronomi dan Hortikultura Fakultas Pertanian Institut Pertanian Bogor melalui
jalur USMI. Selama masa perkuliahan, penulis pernah melakukan magang di
kebun hidroponik PD Grace Lembang (2003) dan menjadi asisten pada mata
KATA PENGANTAR
Puji dan syukur penulis panjatkan atas kehadirat Allah SWT sebagai
pemilik alam semesta ini karena atas segala rahmat dan karunia-Nya penulis dapat
menyelesaikan penelitian yang berjudul “Penggunaan IAA dan BAP Untuk
Menstimulasi Organogenesis Tanaman Anthurium andreanum Dalam Kultur In
Vitro”.
Penulis menyampaikan terima kasih kepada
1. Yang tercinta Mama, Papa, ‘Mbu, ‘Mbah dan ‘Mak (alm) untuk cinta, doa dan
dukungan yang tidak pernah putus. Semoga penulis diberi kesempatan untuk
bisa membahagiakan mereka.
2. Prof. Dr. Ir. Nurhajati Ansori Mattjik, MS selaku dosen pembimbing yang
telah memberikan pengarahan dan bimbingan dalam penelitian dan penulisan
skripsi ini.
3. Dr. Ir. Agus Purwito, MSc dan Ir. Megayani Sri Rahayu, MS yang telah
bersedia menjadi dosen penguji.
4. Dr. Ir. Winarso D. Widodo, MS selaku dosen pembimbing akademik yang
telah memberikan bimbingan kepada penulis selama masa perkuliahan.
5. Dr. Ir. Diny Dinarti, MSi selaku Pimpinan Laboratorium Bioteknologi
Departemen Agronomi dan Hortikultura untuk masukan-masukan yang sangat
membantu dalam kelancaran penelitian dan penulisan skripsi.
6. Pak Ulih Ciapus, Pak Yus INLITHI, Bu Umi SMUNTI, Pak Iip, rekan-rekan
dan seluruh staff Laboratorium Bioteknologi Departemen Agronomi dan
Hortikultura, Fakultas Pertanian IPB.
7. Teh Isti, de Eil, a Keni, a Wahyu dan seluruh keluarga besar yang telah
banyak membantu dan mendoakan penulis.
8. Yang tersayang Thury, ‘Na, Le, Noey, Tsuqo, Winna, Puri, Ali, Ayu dan
Windy untuk persahabatan, doa dan dukungannya dari jauh.
9. Batara Setiadi untuk waktu, pengertian, kesabaran, dukungan dan doanya
selama ini. Terima kasih karena kamu selalu ada.
11.Anto, Encep, Fajar, Mono, Rully, Aldi, Maya, Surya dan seluruh Hortiez’ 38
untuk tahun-tahunnya selama masa perkuliahan.
12.Lesa Ilma Grenti dan Asep Yanuar Arifin yang telah banyak membantu
penulis dalam pelaksanaan penelitian.
Semoga skripsi ini dapat bermanfaat bagi yang membutuhkan.
Bogor, Mei 2006
DAFTAR ISI
Syarat Tumbuh dan Budidaya Anthurium andreanum ... 5
Kultur Jaringan Tanaman ... 6
Eksplan ... 6
Media ... 7
Zat Pengatur Tumbuh ... 8
Air Kelapa ... 9
Kultur Jaringan Anthurium andreanum ... 10
DAFTAR TABEL
Nomor Halaman
Teks
1. Pengaruh Interaksi IAA dan BAP Terhadap Jumlah Tunas Pada 12
MST ... 22
2. Pengaruh Interaksi IAA dan BAP Terhadap Panjang Akar Terpanjang Pada 12 MST ... 27
Nomor Halaman Lampiran 3. Komposisi Larutan Stok Media Murashige and Skoog (MS) ... 33
4. Data Produksi Tanaman Hias di Indonesia Tahun 2003 ... 34
5. Daftar Harga Bunga Potong Segar ... 35
6. Sidik Ragam Tinggi Tanaman ... 36
7. Sidik Ragam Jumlah Tunas ... 37
8. Sidik Ragam Jumlah Daun ... 39
9. Sidik Ragam Jumlah Akar ... 40
DAFTAR GAMBAR
Nomor Halaman
Teks
1. Kondisi Serangan Cendawan ... 17
2. Kondisi Pertumbuhan Kalus ... 19
3. Tinggi Planlet Pada Beberapa Taraf Konsentrasi IAA ... 20
4. Tinggi Planlet Pada Beberapa Taraf Konsentrasi BAP ... 20
5. Kultur dengan perlakuan air kelapa 15%(v/v) + 0.2 ppm IAA + 2.0 ppm BAP ... 21
6. Kultur dengan perlakuan air kelapa 15%(v/v) + 0.0 ppm IAA + 0.0 ppm BAP ... 21
7. Jumlah Daun Pada Beberapa Taraf Konsentrasi IAA ... 23
8. Jumlah Daun Pada Beberapa Taraf Konsentrasi BAP ... 23
9. Jumlah Akar Pada Beberapa Taraf Konsentrasi IAA ... 25
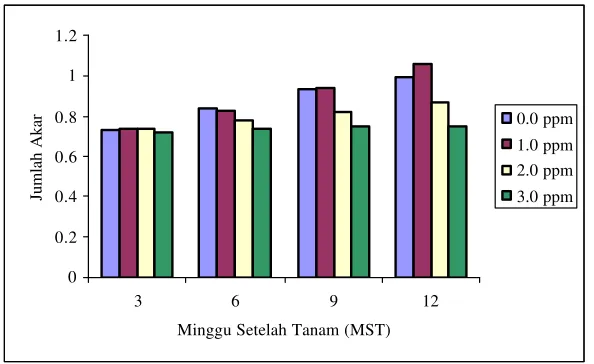
10. Jumlah Akar Pada Beberapa Taraf Konsentrasi BAP ... 26
PENDAHULUAN
Latar Belakang
Indonesia sebagai daerah yang terletak di wilayah tropis memiliki
keunggulan dalam keanekaragaman tanaman. Hal tersebut ditunjukkan dengan
beraneka macamnya tanaman hias, baik itu tanaman hias bunga maupun tanaman
hias daun. Tanaman-tanaman hias tersebut memiliki penampilan yang menjadi ciri
khas masing-masing.
Dengan semakin meningkatnya permintaan akan tanaman hias baik dalam
pot maupun bunga potong di dalam negeri khususnya kota-kota besar, maka hal
ini mendorong para produsen untuk terus meningkatkan perkembangan produksi
tanaman hias. Konsumen terbesar berasal dari hotel, restoran dan perkantoran.
Umumnya permintaan mengalami peningkatan pada saat perayaan hari besar
keagamaan, kemerdekaan serta pernikahan. Dari sekian banyak bunga potong
yang dihasilkan, Anthurium merupakan salah satu jenis bunga yang juga dicari
oleh konsumen.
Anthurium diminati oleh konsumen karena memiliki bentuk yang unik dan
warna yang menarik. Hal-hal tersebut memberikan manfaat ganda pada
Anthurium itu sendiri, yaitu sebagai tanaman hias daun dan tanaman hias bunga.
Spesies Anthurium yang cocok digunakan sebagai tanaman hias terdiri dari tiga
macam, yaitu Anthurium andreanum, A.scherzerianum dan A.crystallinum.
A.andreanum merupakan salah satu jenis tanaman hias yang juga populer sebagai
bunga potong. Seludang bunganya yang berbentuk jantung dan memiliki beraneka
macam warna seperti merah, putih, merah muda atau hijau muda memberikan
nilai tambah pada Anthurium itu sendiri.
Bunga Anthurium memiliki lama kesegaran yang panjang yaitu sekitar 14
hari. Karena bunga ini begitu menonjol penampilannya, maka yang terdapat di
pasaran telah bebas dari hama penyakit tetapi masih dapat dijumpai cacat akibat
kerusakan fisik dan bentuk tangkai yang tidak lurus. Bunga Anthurium jenis hibrid
dijual individual per tangakai dan setiap kuntum dibungkus dengan plastik. Hal ini
dilakukan karena ukuran bunga yang cukup besar dan harga pertangkainya yang
Untuk perbanyakan A.andreanum dapat dilakukan dengan menggunakan
biji maupun pemisahan anakan. Namun cara-cara tersebut memiliki kelemahan
yaitu memakan waktu lama. Biji-biji Anthurium dapat dihasilkan dari proses
penyilangan. Penyerbukan sendiri bunga Anthurium jarang bisa terjadi, sebab
waktu matangnya bunga jantan dan betina tidak bersamaan (Prihmantoro, 1992).
Dengan semakin berkembangnya ilmu pengetahuan, maka perbanyakan
A.andreanum dapat dilakukan dengan cara teknik kultur jaringan. Kultur jaringan
merupakan suatu metode untuk mengisolasi bagian dari tanaman seperti protoplas,
sel, sekelompok sel, jaringan dan organ serta menumbuhkannya dalam kondisi
aseptik sehingga bagian-bagian tersebut dapat me mperbanyak diri dan
beregenerasi menjadi tanaman utuh kembali. Tujuan pokok dari perbanyakan
mikro ini adalah dapat memproduksi tanaman dalam jumlah besar dalam waktu
yang singkat (Gunawan, 1992).
Dalam perbanyakan secara kultur jaringan, peranan zat pengatur tumbuh
sangatlah besar. Zat pengatur tumbuh yang dihasilkan oleh tanaman disebut
fitohormon, sedangkan yang sintetik disebut zat pengatur tumbuh tanaman sintetik
(Wattimena, 1988). Auksin dan Sitokinin merupakan dua golongan zat pengatur
tumbuh yang sering dipergunakan untuk mempengaruhi pertumbuhan dan
morfogenesis dalam kultur sel, jaringan dan organ (Gunawan, 1992).
Gunawan (1992) menyatakan bahwa selain zat pengatur tumbuh sering
pula ditambahkan bahan organik lainnya kedalam media kultur jaringa n, dalam
hal ini air kelapa merupakan salah satu bahan organik yang biasa digunakan. Air
kelapa dapat memberikan efek yang lebih baik pada pertumbuhan kalus bila
dalam media juga diberikan auksin. Bahan-bahan yang terkandung dalam air
kelapa antara lain, asam amino, asam-asam organik, asam nukleat, purin, gula,
gula alkohol, vitamin, mineral dan zat pengatur tumbuh.
Perbanyakan A. andreanum secara kultur jaringan ini telah banyak
dilakukan oleh para peneliti karena masalah yang dihadapi yaitu dalam hal
budidaya. Oleh karena itu Kunisaki pada tahun 1980 melakukan penelitian
perbanyakan Anthurium secara in vitro pada media MS cair yang telah ditambah
dengan bahan-bahan kimia, zat pengatur tumbuh serta air kelapa. Berdasarkan
ternyata mampu meningkatkan proliferasi tunas-tunas. Proses ini merupakan alat
yang efektif untuk mendapatkan tanaman secara cepat (Hennen, 1983).
Tujuan
Penelitian ini bertujuan untuk mengetahui dan menganalisa pengaruh
kombinasi zat pengatur tumbuh IAA dan BAP terhadap pembentukan planlet
Anthurium andreanum dalam kultur in vitro
Hipotesis
1. Konsentrasi yang tepat dari IAA akan berpengaruh baik terhadap
pembentukan organ eksplan Anthurium andreanum.
2. Konsentrasi yang tepat dari BAP akan berpengaruh baik terhadap
pembentukan organ eksplan Anthurium andreanum.
3. Terdapat interaksi konsentrasi yang tepat antara IAA dengan BAP untuk
TINJAUAN PUSTAKA
Anthurium andreanum merupakan tanaman hias famili Araceae yang
berkerabat dekat dengan Spathiphyllum, Calla lilly, Aglonema, Caladium,
Dieffenbachia dan Philodendron. Tanaman ini berasal dari Colombia, Peru,
Brazil, Venezuela, Amerika Selatan dan Tengah. Anthurium sendiri termasuk
kedalam kelompok tanaman epifit.
Anthurium berasal dari kosakata Yunani yang berarti ‘bunga ekor’.
Disebut begitu karena seludang bunga berbentuk jantung, kemudian muncul
tongkol menyerupai ekor (www.minggupagi.com).
Kelebihan lain bunga Anthurium adalah kesegaran bunga ini yang bisa
bertahan lama. Bila berada di pohon, bunga bisa tetap segar selama sekitar 25
hari. Tapi bila dipotong, bisa bertahan kurang lebih 15 hari. Anthurium juga
diminati oleh konsumen karena keindahan warnanya yang terdiri dari berbagai
macam. Karena kelebihan-kelebihannya ini, Anthurium lebih tepat dijadikan
sebagai tanaman hias in door (www.minggupagi.com).
Berdasarkan informasi yang diperoleh dari Direktorat Bina Produksi
Hortikultura, perkembangan produksi tanaman hias tahun 1996-2002 mengalami
perubahan yang signifikan. Total produksi tanaman hias tertinggi diperoleh pada
tahun 1996 sebesar 226 549 581 dan terendah sebesar 51 030 043 terjadi pada
tahun 1999. Pada tahun 2000, produksi tanaman hias mulai mengalami
peningkatan kembali dan pada tahun 2002 total produksi tanamana hias diperoleh
sebesar 118 855 089. Produksi bunga potong Anthurium sendiri menurut
Departemen Pertanian cenderung mengalami peningkatan pada beberapa tahun
belakangan. Tahun 2004 total produksi Anthurium diperoleh sekitar 1 285 061.
Botani Anthurium andreanum
Tanaman hias A. andreanum L. yang termasuk kedalam famili Araceae
merupakan tanaman herba perdu dengan ketinggian 0.7-1.5 m dan memiliki akar
rimpang. Tangkai daun berwarna hijau dengan panjang 35-60 cm dengan pangkal
daun berbentuk pelepah. Helaian daun berukuran 25-40 cm x 14-30 cm dengan
Menurut Steenis (1978), bunga pada A. andreanum berkumpul dalam
suatu tongkol (spadix) yang memiliki daun pelindung (seludang) pada bagian
pangkalnya. Selanjutnya Madison (1980) menambahkan bahwa tongkol (spadix)
pada A. andreanum memiliki ujung yang runcing.
Daun pelindung Anthurium memiliki bentuk menyerupai jantung atau
bulat telur dengan ujung meruncing dan pangkal yang memeluk tangkai. Beberapa
tulang daun yang berkumpul pada pangkal berwarna merah mengkilat kemudian
kehijau-hijauan (Steenis, 1978). A. andreanum memiliki tongkol yang lurus dan
daun pelindung yang berbentuk jantung (Swithinbank, 1991).
Syarat Tumbuh dan Budidaya Anthurium andreanum
Menurut Prihmantoro (1992), agar pertumbuhannya baik tanaman ini
membutuhkan tempat terbuka (ventilasi cukup) tapi tidak terkena sinar matahari
langsung (ternaungi) dengan intensitas cahayanya sekitar 40-60%. Daunnya akan
hangus terbakar bila cahaya matahari langsung mengenainya. Selain suhu,
kelembaban yang diperlukan yaitu sekitar 80-90% minimal 60%, demikian pula
dengan kelembaban tanah.
A. andreanum merupakan tanaman yang cocok berada di lingkungan
dengan suhu sekitar 18-28o C (Swithinbank, 1991 dan Davidson and Bland, 1993).
Suhu pada malam hari sekitar 4-10o C dapat menyebabkan pertumbuhan tanaman
ini menjadi lambat dan daunnya akan berubah menjadi kuning. Tanaman ini tidak
toleran pada suhu yang beku (www.oglesbytc.com) .
Menurut Prihmantoro (1992), A. andreanum cocok ditanam didataran
dengan ketinggian 600-900 m dpl. Selanjutnya Davidson and Bland (1993)
menambahkan bahwa untuk pertumbuhannya yang optimal, A. andreanum
membutuhkan media tanam yang porous, mengandung kompos, basah sepanjang
waktu namun tidak boleh tergenang air serta memerlukan tanah yang kaya akan
bahan organik.
Perbanyakan Anthurium dapat dilakukan dengan biji maupun pemisahan
anakan. Biji-biji tersebut diperoleh dari proses persilangan dengan bantuan
manusia. Penyerbukan sendiri bunga Anthurium jarang bisa terjadi, sebab waktu
dalam media pasir atau spagnum moss. Kecambah dapat dipindahkan ke tempat
pembesaran 2 bulan kemudian dan baru bisa ditanam ke lahan setelah daunnya
berjumlah 5-7 helai serta memiliki ketinggian sekitar 20-25 cm. Bibit ditanam di
lahan dengan jarak tanam 15 cm x 25 cm, 25 cm x 25 cm atau 40 cm x 40 cm
tergantung pada ukuran varietas tanamannya (Prihmantoro, 1992).
Kultur Jaringan Tanaman
Menurut Hennen (1983), kultur jaringan tanaman merupakan suatu metode
untuk memproduksi tanaman yang berasal dari potongan kecil suatu jaringan atau
sel individu. Gunawan (1992) menyatakan bahwa kultur jaringan adalah suatu
metode untuk mengisolasi bagian dari tanaman seperti protoplasma, sel,
kelompok sel, jaringan dan organ, yang ditumbuhkan dalam kondisi aseptik
sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi
menjadi tanaman yang utuh.
Eksplan
Menurut Conger (1980), eksplan adalah potongan dari jaringan atau organ
suatu tanaman untuk tujuan perbanyakan. Faktor-faktor yang mempengaruhi
keberhasilan perbanyakan dengan eksplan yaitu genotipe eksplan, ukuran eksplan,
jaringan asal eksplan dan umur fisiologi eksplan. Jaringan muda memiliki
kemampuan morfogenesis yang lebih tinggi dibandingkan jaringan yang tua.
Pernyataan diatas didukung oleh Wetherell (1982) dan Collin and Edwards (1998)
yang menyatakan bahwa untuk keberhasilan perbanyakan secara in vitro
sebaiknya tanaman yang dijadikan sebagai sumber eksplan merupakan tanaman
yang sehat dan tumbuh kuat serta menggunakan jaringan yang muda dan ukuran
eksplan yang cukup besar.
Jaringan yang berasal dari eksplan yang berbeda tapi memiliki spesies
yang sama dapat menunjukkan variasi morfologi (Thomas and Davey, 1975).
Tidak semua jaringan tana man memiliki kemampuan yang sama untuk
berdiferensiasi. Eksplan yang berukuran sangat kecil memiliki daya tahan yang
rendah untuk dikulturkan. Banyak sedikitnya tunas yang dihasilkan dipengaruhi
berukuran 0.5 – 1.55 cm mampu memproduksi tunas yang lebih banyak (Conger,
1980).
Menurut Conger (1980), eksplan yang digunakan dapat berasal dari daun,
petiol, umbi, petal dan anther. Gunawan (1992) menambahkan bahwa eksplan
yang akan digunakan dalam perbanyakan kultur jaringan harus dalam keadaan
aseptik.
Media
Menurut Paul (1972), media merupakan faktor penting untuk
mengkulturkan sel dan jaringan. Selanjutnya Thomas and Davey (1975)
menambahkan bahwa pertumbuhan dan morfologi suatu jaringan berhubungan
dengan komposisi media kultur, taraf konsentrasi hormon pertumbuhan, eksplan
yang digunakan serta spesies tanaman tersebut.
Komposisi suatu media adalah salah satu faktor yang memiliki peranan
penting untuk pertumbuhan dan morfogenesis jaringan tanaman di dalam
perbanyakan (Conger, 1980). Media kultur jaringan tanaman menyediakan tidak
hanya unsur-unsur hara makro dan mikro, tetapi juga karbohidrat yang pada
umumnya berupa gula untuk menggantikan karbon yang biasanya didapatkan dari
atmosfer melalui fotosintesis (Gunawan, 1992).
Berdasarkan hasil penelitian Harijadi dan Pamenang (1982), penggunaan
sukrosa 2% dan 15% (v/v) air kelapa muda pada media padat menyebabkan
eksplan anggrek Dendrobium pompadour dapat tumbuh dan berkembang dengan
baik. Sedangkan untuk mempercepat perbanyakan plb yang terbentuk dapat
menggunakan medium padat tanpa sukrosa dengan penambahan air kelapa 20%.
Hal ini didukung oleh pernyataan Hennen (1983) bahwa penambahan sukrosa
sebagai sumber energi pada media kultur dapat membantu pertumbuhan eksplan.
Sukrosa tersebut diserap oleh jaringan tanaman dan digunakan jika tanaman
Zat Pengatur Tumbuh
Dalam perbanyakan secara kultur jaringan, peranan Zat Pengatur Tumbuh
(ZPT) sangatlah besar. ZPT yang dihasilkan oleh tanaman disebut fitohormon,
sedangkan yang sintetik disebut zat pengatur tumbuh tanaman sintetik
(Wattimena, 1988).
Menurut Moore (1979), hormon merupakan faktor penting dalam proses
perkembangan tanaman. Wattimena (1988) dan Salisbury and Ross (1992)
menyatakan bahwa hormon tanaman didefinisikan sebagai senyawa organik yang
aktif dalam jumlah kecil (konsentrasi yang rendah) yang disintesiskan pada bagian
tertentu dari tanaman dan dipindahkan ke bagian lain dimana zat tersebut
menimbulkan respon secara biokimia, fisiologi dan morfologi.
Zat pengatur tumbuh adalah bahan organik bukan nutrient yang dalam
konsentrasi yang rendah dapat mempengaruhi dan menghambat pertumbuhan
serta perkembangan tanaman (Moore, 1979). Penggunaan zat pengatur tumbuh
pada konsentrasi yang rendah efektif dalam mengatur inisiasi dan perkembangan
tunas dan akar pada eksplan serta embrio pada media padat maupun cair (Beyl,
2000).
Auksin, sitokinin dan giberellin adalah hormon-hormon yang memiliki
peran ganda. Dalam propagasi secara in vitro, hormon-hormon ini sering
digunakan karena memiliki kemampuan untuk merangsang pertumbuhan eksplan
dan mempengaruhi pertumbuhan akar (Wareing and Phillips, 1970 dan Wetherell,
1982).
Menurut Wetherell (1982) dan Janick (1986), sitokinin dan auksin
memiliki pengaruh yang berlawanan oleh karena itu dalam pemakaian kedua ZPT
tersebut harus mempertimbangkan perbandingannya dalam media. Perbandingan
sitokinin-auksin yang tinggi baik untuk pembentukan tunas, sedangkan
perbandingan sitokinin-auksin yang rendah baik untuk pembentukan akar. Beyl
(2000) menyatakan bahwa auksin dan sitokinin adalah ZPT yang paling penting
dan sering digunakan pada kultur jaringan.
Thimann (1969) dan Wetherell (1982) menyatakan bahwa auksin
mendorong dalam pembesaran sel. Beyl (2000) menambahkan bahwa auksin
dan pembengkakan jaringan, dominasi apikal, pembentukan akar adventif dan
morfogenesis somatik.
Auksin merupakan ZPT yang efektif digunakan pada konsentrasi rendah
(Thimann, 1969 dan Moore, 1979). Pada konsentrasi yang rendah, auksin mampu
mendorong inisiasi akar dan pada konsentrasi yang tinggi menyebabkan terjadinya
pembentukan kalus (Beyl, 2000).
Wareing and Phillips (1981) dan Wattimena (1988) menyatakan bahwa
sitokinin memiliki peranan penting dalam proses pembelahan sel, selain itu
sitokinin juga berperan dalam proses senesen dan dominasi apikal. Wattimena
(1988) menambahkan bahwa selain memberikan beberapa efek fisiologis lainnya,
sitokinin juga mempengaruhi perkembangan embrio dan memperlambat proses
penghancuran butir-butir klorofil.
Menurut Wetherell (1982) dan Beyl (2000), selain pembelahan sel,
sitokinin mampu menstimulasi pertumbuhan tunas dalam kultur in vitro. Beyl
(2000) menambahkan bahwa pada konsentrasi yang tinggi (1 – 10 mg/l) sitokinin
dapat menginduksi pembentukan tunas.
Air Kelapa
Air kelapa merupakan salah satu persenyawaan organik kompleks yang
biasa ditambahkan kedalam media kultur jaringan. Air kelapa dapat memberikan
efek yang lebih baik pada pertumbuhan kalus bila dalam media juga diberikan
auksin (Gunawan, 1992).
Hasil penelitian Widiastoety dan Syafril (1993) menunjukkan bahwa
pembentukan akar terbanyak pada planlet anggrek Dendrobium terdapat pada
perlakuan penambahan air kelapa 15% pada medium padat namun terjadi
penurunan pertumbuhan planlet pada penambahan air kelapa 30%. Sedangkan
Wigati (2001) menunjukkan bahwa 100% eksplan tanaman snapdragon
mengalami multiplikasi pada perlakuan air kelapa 25% yang dikombinasikan
dengan BAP 0.5 mg/l dan IAA 0.1 mg/l.
Conger (1980) menyatakan bahwa dari semua bahan organik kompleks
yang ditambahkan pada media kultur jaringan, air kelapa merupakan yang terbaik.
air kelapa baik digunakan dalam kultur jaringan. Air kelapa muda menghasilkan
kualitas produk yang lebih baik sementara itu air dari kelapa yang tua justru dapat
menghambat pertumbuhan jaringan. Menurut Gunawan (1992), bahan-bahan yang
terkandung dalam air kelapa antara lain, asam amino, asam-asam organik, asam
nukleat, purin, gula, gula alkohol, vitamin, mineral dan zat pengatur tumbuh.
Kultur Jaringan Anthurium andreanum
Teknik perbanyakan secara kultur jaringan telah dilakukan pada
tanaman-tanaman famili Araceae yaitu, Anthurium sp, Spathiphyllum sp. dan Zantedeschia
sp. Pada tahun 1980, Kunisaki melakukan penelitian pada tanaman Anthurium
andreranum Cv. Kaumana secara in vitro. Eksplan yang digunakan adalah tunas
vegetatif yang diperoleh dari tanaman dewasa. Eksplan dikulturkan pada media
MS cair yang telah ditambah dengan 0.4 mg/l thiamine-HCl, 0.5 mg/l Nicotinic
acid, 0.5 mg/l pyridoxine-HCl, 20 g/l sukrosa dan 15%(v/v) air kelapa serta BA
pada beberapa taraf konsentrasi. Berdasarkan hasil penelitian, 0.2-1.0 mg/l BA
mampu meningkatkan proliferasi tunas. Penggunaaan 0.2 mg/l BA merupakan
taraf yang optimum karena pada konsentrasi yang semakin tinggi dapat
meningkatkan pembentukan kalus dan tunas-tunas yang terbentuk akan berukuran
kecil (kerdil).
Kuehnle dan Sugii pada tahun 1991 melakukan dua percobaan pada
Anthurium. Percobaan pertama yaitu antara jaringan asal eksplan (daun dan petiol)
pada tujuh kultivar A. Andreanum dengan beberapa jenis media (me dia P, media
Pmod, media F&vS, media Cmod, media Dmod dan media D). Pada percobaan
pertama menunjukkan bahwa eksplan daun pada media Pmod memberikan
pengaruh nyata dengan menghasilkan persentase pembentukan kalus yang paling
tinggi. Media Pmod memberikan respon terbaik pada jaringan eksplan daun.
Eksplan petiol tidak memberikan pengaruh pada media P, media Pmod dan media
F&vS namun pada media Cmod dan D mampu menghasilkan kalus yang
terbanyak. Percobaan Kuehnle dan Sugii yang kedua yaitu antara beberapa jenis
media (media D, media Cmod dan Dmod) dengan tiga tanaman Anthurium hasil
persilangan (UH965, UH1060 dan UH1003). Berdasarkan hasil percobaan
terbanyak (32%). Selain itu dapat disimpulkan bahwa terdapat perbedaan
kemampuan beregenerasi pada genotipe yang sama yang ditanam pada media
yang berbeda.
Penelitian pada A. andreanum kembali dilakukan oleh Whei pada tahun
1997. Penelitian ini bertujuan untuk mengetahui pengaruh jenis media dan ukuran
inokulum terhadap regenerasi tunas adventif. Berdasarkan hasil penelitian,
diketahui bahwa ukuran inokulum sangat mempengaruhi jumlah tunas yang
beregenerasi. Inokulum yang lebih besar memiliki kemampuan beregenerasi yang
lebih baik.
Prihatmanti (2002) melakukan penelitian pada A. andreanum dengan
perlakuan BAP, NAA dan air kelapa pada beberapa taraf konsentrasi. Hasil
penelitian menunjukkan bahwa eksplan Anthurium dengan perlakuan NAA 0.2
mg/l memberikan respon berupa pembentukan kalus. Perlakuan BAP 1.0 mg/l dan
2.0 mg/l menunjukkan kecenderungan warna kalus menjadi hijau yang
selanjutnya diikuti organogenesis tunas. Penggunaan air kelapa 0% dan 10% yang
dikombinasikan dengan NAA 0.2 mg/l dan BAP 1.0 mg/l dan 2.0 mg/l
menunjukkan kecenderungan pertumbuhan eksplan yang lebih baik mulai dari
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juni hingga November 2005
bertempat di Laboratorium Bioteknologi Departemen Agronomi dan Hortikultura
Fakultas Pertanian, Institut Pertanian Bogor.
Bahan dan Alat
Bahan-bahan yang digunakan adalah biji tanaman Anthurium andreanum,
media dasar MS, agar-agar, gula, air steril dan spirtus. ZPT berupa IAA, BAP dan
air kelapa 15%(v/v). Deterjen, Alkohol 70%, Bethadine, Dithane, Agreep dan
Clorox 10%, 20% dan 30% sebagai desinfektan.
Peralatan yang digunakan adalah timbangan analitik, pH meter, cawan
petri, erlenmeyer, gelas ukur, pipet, pengaduk gelas, hand sprayer, autoklaf,
Laminar Airflow Cabinet (LAC), alat-alat tanam (gunting dan pinset), botol
kultur, plastik, karet gelang, lampu UV, rak kultur dan alat tulis.
Metode Penelitian
Penelitian ini menggunakan rancangan perlakuan faktorial dengan dua
faktor yang disusun dalam Rancangan Lingkungan Acak Lengkap. Faktor pertama
adalah pemberian IAA dengan 5 taraf konsentrasi, yaitu 0.0 ppm (A0), 0.1 ppm
(A1), 0.2 ppm (A2), 0.3 ppm (A3) dan 0.4 ppm (A4). Faktor kedua adalah
pemberian BAP dengan 4 taraf konsentrasi, yaitu 0.0 ppm (B0), 1.0 ppm (B1), 2.0
ppm (B2) dan 3.0 ppm (B3). Kombinasi dua faktor tersebut akan menghasilkan 20
perlakuan yang masing-masing diulang sebanyak 10 kali, sehingga terdapat 200
Model matematika yang digunakan adalah :
berpengaruh nyata, maka dilanjutkan dengan uji lanjut DMRT taraf 5%.
Pelaksanaan Penelitian Persiapan dan Sterilisasi Alat
Alat-alat yang digunakan untuk kegiatan penanaman harus dalam keadaan
steril. Botol kultur, cawan petri, alat-alat tanam (gunting dan pinset) dicuci
terlebih dahulu kemudian dikeringkan. Setelah itu peralatan-peralatan tersebut
dibungkus dengan kertas lalu disterilisasi dalam autoklaf pada suhu 121oC dan
pada tekanan 17.5 psi (pound per square inch) selama satu jam. Penghitungan
waktu sterilisasi dimulai setelah tekanan yang diinginkan tercapai.
Persiapan Air Kelapa
Air kelapa diperoleh dari buah kelapa yang masih muda dan segar yang
kemudian disaring dengan saringan dan disimpan didalam lemari es selama satu
malam. Air kelapa kemudian ditambahkan kedalam media MS sebanyak 15%
(v/v) untuk semua perlakuan.
Pembuatan Media
Media dibuat dengan mencampur larutan stok makro, mikro A, mikro B,
CaCl2, Myo-inositol, stok Fe dan vitamin. Campur larutan stok tersebut dengan air
kelapa yang telah disaring sebanyak 15%(v/v) serta IAA dan BAP sesuai dengan
Tambahkan KOH/NaOH atau HCl hingga diperoleh pH 5.7. Masukan 30 g/l gula
dan 7 g/l agar-agar, aduk dan didihkan. Setelah mendidih tuang 25 ml larutan
kedalam botol kultur yang telah disterilisasi, tutup botol dengan plastik dan karet
gelang. Botol-botol yang berisi media disterilisasi dengan autoklaf pada suhu
121°C dan bertekanan 17.5 psi selama 30 menit. Penghitungan waktu sterilisasi
dimulai setelah tekanan yang diinginkan tercapai.
Sterilisasi dan Penanaman Bahan Tanaman
Sterilisasi bahan tanaman dilakukan diluar dan didalam Laminar Airflow
Cabinet (LAC). Biji-biji Anthurium yang diperoleh dilapang dicuci terlebih
dahulu dengan deterjen dibawah air mengalir kemudian direndam dalam larutan
Dithane dan Agreep selama 2 jam. Biji yang telah direndam kemudian dicuci
kembali dibawah air mengalir untuk menghilangkan sisa-sisa Dithane dan Agreep.
Setelah dibersihkan, biji direndam dan dikocok dalam alkohol 70% selama 1
menit, angkat serta tiriskan kemudian dimasukkan kedalam LAC untuk proses
sterilisasi selanjutnya. Biji direndam dan dikocok dalam larutan clorox 30%
selama 10 menit, kemudian bilas dengan air steril sebanyak tiga kali. Biji
direndam kembali dalam larutan clorox 20% dan dikocok selama 15 menit, bilas
dengan air steril sebanyak tiga kali. Rendam kembali biji dalam larutan clorox
10% dan kocok selama 20 menit, bilas dengan air steril sebanyak tiga kali. Biji
yang sudah disterilisasi ditaruh pada cawan petri berisi air steril yang telah
ditambah tiga tetes betadine dan siap dikecambahkan pada media MS0 (tanpa
penambahan ZPT dan bahan organik). Botol kultur yang telah berisi biji disimpan
di rak kultur selama 12 minggu untuk proses perkecambahan.
Penanaman Eksplan
Penanaman eksplan dilakukan didalam LAC yang telah disterilkan dengan
alkohol 70%. Pada saat kegiatan penanaman akan dilakukan, peralatan-peralatan
yang akan dimasukan kedalam LAC disemprot terlebih dahulu dengan alkohol
70%. Gunting dan pinset yang digunakan untuk memindahkan bahan tanaman
dibakar dahulu kemudian dimasukan kedalam air steril. Eksplan yang digunakan
buku yang diperoleh dari proses perkecambahan secara kultur in vitro. Batang
yang telah dipotong dikeluarkan dari botol kultur kemudian diletakan pada cawan
petri yang berisi air steril dan telah ditambahkan betadine sebanyak 3 tetes.
Eksplan kemudian ditanam pada media yang telah diberi penambahan ZPT sesuai
dengan perlakuan dan pada setiap botol kultur terdapat 1 eksplan. Setelah eksplan
ditanam, botol ditutup dengan plastik dan ikat rapat dengan karet gelang. Botol
kultur siap dipindah ke ruang kultur.
Pengamatan
Peubah yang diamati pada penelitian ini adalah tinggi tanaman, jumlah
tunas, jumlah daun, jumlah akar serta panjang akar terpanjang. Kegiatan
pengamatan dilakukan pada saat 1 MST hingga 12 MST.
Tinggi tanaman
Tinggi tanaman diukur mulai dari minggu pertama setelah eksplan ditanam
pada media perlakuan hingga 12 MST. Proses pengukuran menggunakan
penggaris yang ditempel pada dinding botol kultur, dimana tanaman tidak
dikeluarkan dari botol kultur. Diukur mulai dari batas media hingga permukaan
atas tanaman.
Jumlah tunas
Jumlah tunas dihitung mulai dari tunas yang telah terbentuk muncul
pertama kali, dihitung setiap minggu hingga 12 MST.
Jumlah daun
Jumlah daun dihitung mulai dari daun yang telah terbuka penuh muncul
pertama kali, dihitung setiap minggu hingga 12 MST.
Jumlah akar
Jumlah akar dihitung mulai dari akar yang muncul pertama kali, dihitung
Panjang akar Terpanjang
Panjang akar diukur pada akhir pengamatan (12 MST). Proses pengukuran
HASIL dan PEMBAHASAN
Keadaan Umum
Eksplan yang ditanam pada setiap kombinasi IAA dan BAP disertai
penambahan 15% (v/v) air kelapa untuk semua perlakuan menunjukkan
kemampuan beregenerasi. Hal ini ditunjukkan dengan terjadinya pertambahan
tinggi tanaman, jumlah tunas, jumlah daun dan jumlah akar pada setiap
minggunya serta kondisi perakaran berupa panjang akar terpanjang yang hanya
diamati pada minggu akhir pengamatan.
Kondisi bahan tanaman, sterilisasi alat tanam dan lingkungan pada saat
proses penanaman dilakukan sangat mempengaruhi tahap pertumbuhan dan
perkembangan hingga tanaman siap dipindahkan ke lapang. Selama proses
percobaan berlangsung, kontaminasi hanya disebabkan oleh cendawan sebesar 3%
dari total populasi yang pada akhirnya menyebabkan kematian eksplan. Selain
kontaminasi oleh cendawan, kematian eksplan juga disebabkan oleh proses
pencokelatan (browning) sebesar 3.5 % dari total populasi. Tidak terjadi
kontaminasi oleh bakteri, diduga bahwa eksplan yang ditanam pada media
perlakuan steril karena eksplan berasal dari proses perkecambahan secara in vitro
terlebih dahulu.
Serangan cendawan mulai terlihat pada 2 MST, cendawan bukan berasal
dari bahan tanam melainkan muncul pada media yang kontak langsung dengan
tepi botol kultur (Gambar 1). Hal ini diduga bahwa cendawan berasal dari botol
kultur yang tidak bersih pada saat proses pencucian, alat tanam yang tidak bersih
atau terbawa oleh sirkulasi udara didalam laminar pada saat proses penanaman
dilakukan.
Browning mulai terlihat pada 6 MST yang ditandai dengan perubahan
warna pada eksplan dari hijau menjadi cokelat dimulai dari tepi yang mengalami
pelukaan hingga akhirnya menyebar keseluruh bagian eksplan. Hal ini diakibatkan
oleh senyawa fenolik yang berasal dari bagian tanaman yang luka dan dapat
menyebabkan kematian. Menurut Wetherell (1982), browning merupakan
terjadinya warna cokelat pada jaringan yang baru dipotong. Hal ini disebabkan
karena terjadinya reaksi antara senyawa fenolik yang diproduksi jaringan dengan
oksigen. Collin dan Edwards (1998) menambahkan bahwa senyawa fenolik
diproduksi sebagai respon atas kondisi stress yang dialami oleh tanaman.
Senyawa ini bersifat racun dan dapat menyebabkan kematian pada jaringan
tanaman.
Selama 12 minggu pengamatan, terdapat eksplan yang belum
menunjukkan respon pertumbuhan berupa pembentukan kalus dan organ-organ
tanaman. Meskipun demikian eksplan masih tetap berwarna hijau seperti pada saat
penanaman dilakukan. Hal ini diduga bahwa walaupun eksplan belum
menunjukkan respon pertumbuhan, sel-sel jaringan tanaman masih memiliki
kemampuan untuk berorganogenesis pada waktu selanjutnya.
Menurut Conger (1980), terdapat faktor-faktor yang mempengaruhi
keberhasilan perbanyakan dengan eksplan yaitu genotip eksplan, ukuran eksplan,
jaringan asal eksplan dan umur fisiologi eksplan. Tidak semua jaringan tanaman
memiliki kemampuan yang sama untuk berdiferensiasi. Wetherell (1982)
menambahkan bahwa tanaman yang memiliki hubungan kekerabatan yang dekat
pun belum tentu menunjukkan respon in vitro yang sama.
Interaksi antara IAA dan BAP pada beberapa kultur menunjukkan
pertumbuhan kalus. Pertumbuhan kalus mulai terlihat pada pengamatan minggu
ke-2 setelah tanam. Pada awal kemunculannya, kalus berwarna hijau kekuningan
yang kemudian berubah menjadi hijau tua. Hal ini diduga bahwa sitokinin secara
efektif mampu mempertahankan warna hijau butir-butir klorofil. Wattimena
(1988) menyatakan bahwa sitokinin memiliki kemampuan memperlambat proses
penghancuran butir-butir klorofil.
Terlihat pada gambar 2 bahwa kalus yang dihasilkan oleh kultur berwarna
kalus akan muncul tunas-tunas kecil dengan ujung berwarna kemerahan. Ukuran
diameter kalus mengalami penambahan tiap minggunya. Umumnya kalus
berdiameter 0.5-2.5 cm pada akhir pengamatan.
Gambar 2. Kondisi Pertumbuhan Kalus
Selama masa pengamatan, kombinasi air kelapa 15%(v/v) + 0.2 ppm IAA
+ 2.0 ppm BAP cenderung membentuk kalus lebih cepat. Diduga bahwa interaksi
antara 0.2 ppm IAA, 2.0 ppm BAP disertai penambahan air kelapa 15%(v/v)
cenderung mampu mendorong sel-sel membelah dan membesar sehingga
membentuk kalus lebih cepat. Menurut Steward dan Krikorian (1971),
pembelahan sel selalu diikuti oleh pembesaran sel. Wetherell (1982)
menambahkan bahwa sel-sel pada jaringan tanaman mengalami proses
pembelahan dan pembesaran karena adanya pengaruh dari auksin. Penambahan
auksin dalam jumlah yang lebih cenderung menyebabkan terjadinya pertumbuhan
kalus dari eksplan.
Tinggi Tanaman
Interaksi antara IAA dan BAP tidak memberikan pengaruh nyata terhadap
tinggi tanaman namun perlakuan IAA sendiri mulai memberikan pengaruh nyata
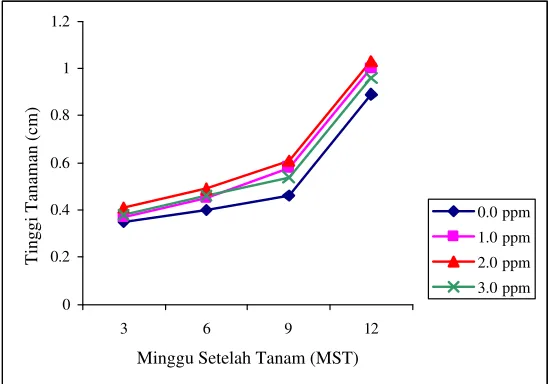
terhadap tinggi tanaman pada minggu akhir pengamatan (12 MST). Terlihat pada
gambar 3 bahwa 0.3 ppm IAA cenderung menghasilkan tinggi tanaman tertinggi
yaitu 1.02 cm dan media tanpa pemberian IAA menghasilkan tinggi tanaman
terendah (0.69 cm). Pada minggu ke-9 hingga ke-12, eksplan mengalami
peningkatan tinggi tanaman untuk setiap taraf konsentrasi IAA namun pada
0
Gambar 3. Tinggi Planlet Pada Beberapa Taraf Konsentrasi IAA
Perlakuan BAP memberikan pengaruh nyata terhadap tinggi tanaman
hingga minggu akhir pengamatan. Dapat terlihat pada gambar 4 bahwa 0.0 ppm
BAP cenderung menghasilkan tinggi tanaman terendah dan BAP 2.0 ppm
menghasilkan tinggi tanaman tertinggi pada tiap minggunya. Pada 12 MST, 2.0
ppm BAP menghasilkan tinggi tanaman tertinggi yaitu 1.03 cm dan 0.0 ppm
menghasilkan tinggi tanaman terendah yaitu 0.89 cm. Hal ini diduga bahwa
auksin dan sitokinin secara efektif mampu mendorong pembesaran dan
pembelahan sel-sel jaringan sehingga terjadi penambahan ukuran eksplan.
0
Menurut Wattimena (1988), sitokinin mempengaruhi berbagai proses
fisiologi di dalam tanaman, salah satunya adalah mendorong pembelahan sel. Hal
ini dibuktikan oleh penelitian Mirzada (1994) yang menemukan bahwa
penggunaan BAP pada konsentrasi yang lebih tinggi (4.0 mg/l) pada perbanyakan
calla lily menyebabkan pemanjangan tunas-tunas tertekan.
Pada gambar 5 dan 6 terlihat bahwa terjadi perbedaan tinggi tanaman pada
akhir pengamatan. Secara keseluruhan dari kombinasi yang ada, perlakuan air
kelapa 15%(v/v) + 0.2 ppm IAA + 2.0 ppm BAP menunjukkan tinggi tanaman
tertinggi dan perlakuan air kelapa 15%(v/v) + 0.0 ppm IAA + 0.0 ppm BAP
menunjukkan tinggi tanaman terendah.
Gambar 5. Kultur dengan perlakuan air Gambar 6. Kultur dengan perlakuan air
kelapa 15%+0.2 ppm IAA+ ke1apa 15%+0.0 ppm IAA+
2.0 pm BAP 0.0 ppm BAP
Jumlah Tunas
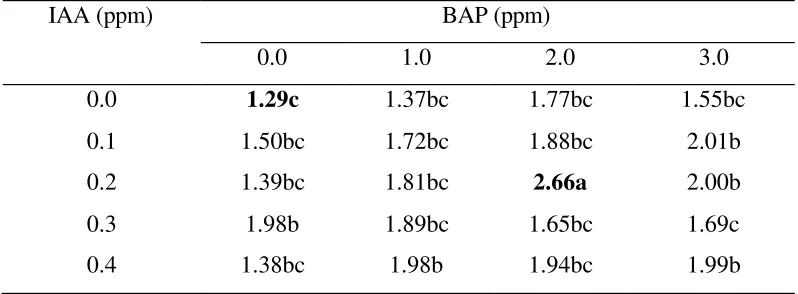
Pada 12 MST, interaksi antara IAA dan BAP memberikan pengaruh nyata
terhadap peubah jumlah tunas. Pada tabel 1 dapat terlihat bahwa kombinasi antara
0.2 ppm IAA dan 2.0 ppm BAP berbeda nyata dengan seluruh kombinasi IAA
dan BAP. Pada kombinasi tersebut menghasilkan jumlah tunas terbanyak yaitu
2.66. Jumlah tunas pada media tanpa penambahan IAA dan BAP hanya
menghasilkan jumlah tunas sebanyak 1.29. Diduga bahwa kombinasi tersebut
secara efektif mampu meningkatkan kemampuan sel-sel berdiferensiasi
membentuk tunas-tunas baru, sedangkan pada media tanpa penambahan IAA dan
BAP eksplan masih memiliki kemampuan membentuk tunas karena adanya
Tabel 1. Pengaruh Interaksi IAA dan BAP Terhadap Jumlah Tunas Pada 12 MST
Hasil penelitian De Guzman (1983) pada beberapa varietas padi
menunjukkan bahwa terjadi perbanyakan tunas pada media MS yang hanya
ditambah dengan air kelapa. Selanjutnya Nurwahyuni (1993) menemukan bahwa
sitokinin yang terkandung dalam air kelapa mampu mendorong proliferasi sel-sel
kalus.
Wareing dan Phillips (1981) menyatakan bahwa sitokinin yang
dikombinasikan dengan auksin mampu menstimulasi pembelahan sel tanaman dan
interaksinya dengan auksin mendorong sel-sel untuk berdiferensiasi. Hartmann et
al (1997) menambahkan bahwa penggunaan sitokinin dengan konsentrasi yang
tinggi dan auksin yang rendah sangat penting dalam pembentukan tunas.
Peningkatan konsentrasi sitokinin selain mampu merangsang prolifaerasi tunas
lateral ternyata dapat menghambat pemanjangan tunas.
Jumlah Daun
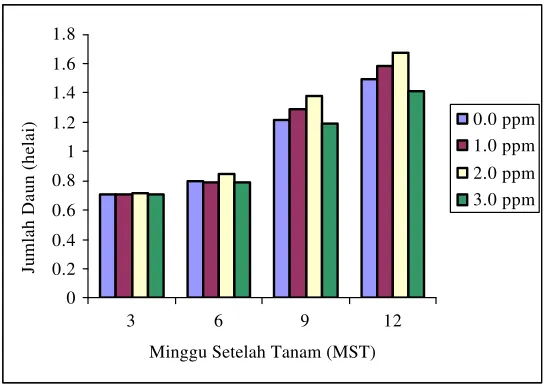
Perlakuan IAA, BAP dan interaksi keduanya tidak memberikan pengaruh
nyata terhadap jumlah daun selama 12 minggu pengamatan. Meskipun IAA tidak
memberikan pengaruh nyata namun pada gambar 7 dapat terlihat bahwa terjadi
peningkatan jumlah daun tiap minggunya hingga akhir pengamatan. Umumnya
cenderung terjadi peningkatan jumlah daun mulai dari 0.0 ppm hingga 0.3 ppm
dan pada konsentrasi IAA yang lebih tinggi (0.4 ppm) terjadi penurunan jumlah
0
Gambar 7. Jumlah Daun Pada Beberapa Taraf Konsentrasi IAA
Eksplan mengalami peningkatan jumlah daun seiring dengan semakin
tingginya konsentrasi BAP, namun pada konsentrasi yang lebih tinggi (3.0 ppm)
cenderung mengalami penurunan jumlah daun. Berdasarkan hasil penelitian
Mirzada (1994), perlakuan BAP 1.0 mg/l pada calla lilly membentuk persentase
daun terbanyak sebesar 83.33% sedangkan terendah 33.33% pada perlakuan BAP
3.0 mg/l.
Selama pengamatan, terjadi peningkatan jumlah daun pada tiap minggunya
namun ada pula beberapa kultur yang tidak mengalami penambahan jumlah daun.
Hal ini diduga adanya pengaruh auksin endogen yang diproduksi secara alami
oleh pucuk-pucuk tanaman sehingga mempengaruhi pembentukan daun-daun
baru. Meskipun tidak terjadi interaksi yang nyata antara IAA dan BAP, namun
kombinasi antara 0.2 ppm IAA dan 2.0 ppm BAP cenderung menghasilkan
jumlah daun terbanyak dibandingkan seluruh kombinasi dan media tanpa
penambahan IAA dan BAP menghasilkan jumlah daun terendah. Wareing dan
Phillips (1970) menyatakan bahwa konsentrasi dari auksin dan sitokinin pada
media kultur menunjukkan bahwa hormon-hormon tersebut memiliki peranan
penting dalam pembentukan organ.
Jumlah Akar
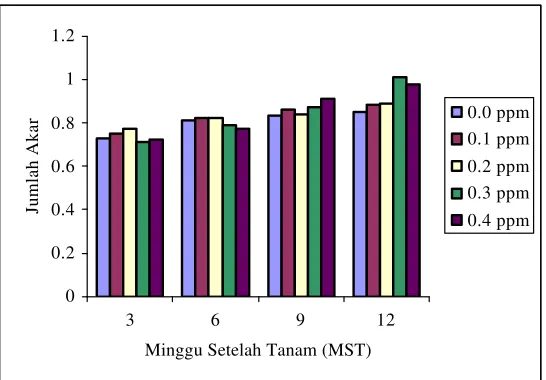
Pertumbuhan akar mulai terlihat pada 2 MST. Perlakuan IAA serta
interaksi antara IAA dan BAP tidak memberikan pengaruh nyata pada setiap
minggunya hingga akhir pengamatan. Terjadi peningkatan jumlah akar yang
dihasilkan dengan semakin tingginya taraf konsentrasi IAA, namun pada taraf
yang lebih tinggi (0.4 ppm) eksplan cenderung mengalami penurunan jumlah
akar. Diduga bahwa meskipun auksin berperan dalam pembentukan akar namun
pada konsentrasi yang tinggi justru dapat menghambat sel-sel dalam membentuk
akar. Menurut Moore (1979), auksin aktif pada konsentrasi yang rendah.
Wetherell (1982) menambahkan bahwa auksin dalam konsentrasi yang lebih
0
Gambar 9 . Jumlah Akar Pada Beberapa Taraf Konsentrasi IAA
BAP mulai memberikan pengaruh nyata terhadap jumlah akar pada 7-12
MST. Pada minggu ke-12, BAP memberikan pengaruh nyata dengan
menghasilkan jumlah akar terbanyak yaitu 1.06 dan tidak berbeda nyata dengan
perlakuan tanpa BAP (0.99). Jumlah akar terendah diperoleh pada taraf 3.0 ppm,
yaitu 0.75. Pada media tanpa penambahan BAP, eksplan masih memiliki
kemampuan membentuk akar. Diduga bahwa sel-sel jaringan masih memiliki
kemampuan berdiferensiasi membentuk akar karena adanya pengaruh auksin
endogen. Hal ini didukung oleh pernyataan Wetherell (1982) yang menyatakan
bahwa akar dapat tumbuh pada media tanpa penambahan hormon apabila pucuk
tanaman tumbuh dengan baik sehingga mampu memproduksi auksin alami yang
0
Gambar 10 . Jumlah Akar Pada Beberapa Taraf Konsentrasi BAP
Selama 12 minggu pengamatan, dari seluruh kombinasi perlakuan terdapat
beberapa kultur yang belum menghasilkan akar, yaitu air kelapa 15%(v/v) + 0.2
ppm IAA + 3.0 pp BAP dan air kelapa 15%(v/v) + 0.3 ppm IAA + 3.0 ppm BAP.
Namun jika daun-daun pada planlet tumbuh dengan baik, maka ada kemungkinan
akan terbentuk akar karena adanya auksin yang diproduksi alami oleh
pucuk-pucuk tanaman. Menurut Salisbury dan Ross (1992), cara kalus membentuk
tumbuhan baru cukup beragam. Jika nisbah sitokinin-auksin cukup tinggi, sering
hanya sistem tajuk yang mula-mula berkembang kemudian akar-akar liar
terbentuk secara spontan dari batang. Altman (1998) menambahkan bahwa pada
proses organogenesis, eksplan akan menghasilkan tunas dan akar. Namun
keduanya tidak akan muncul bersamaan, biasanya tunas yang akan terbentuk
pertama kali.
Menurut Wetherell (1982), auksin sering digunakan dalam propagasi
secara in vitro karena selain memiliki kemampuan untuk merangsang
pertumbuhan eksplan juga mempengaruhi pertumbuhan akar. Agar terjadi
pertumbuhan akar komposisi hormon dalam media kultur harus dirubah, hormon
Panjang Akar Terpanjang
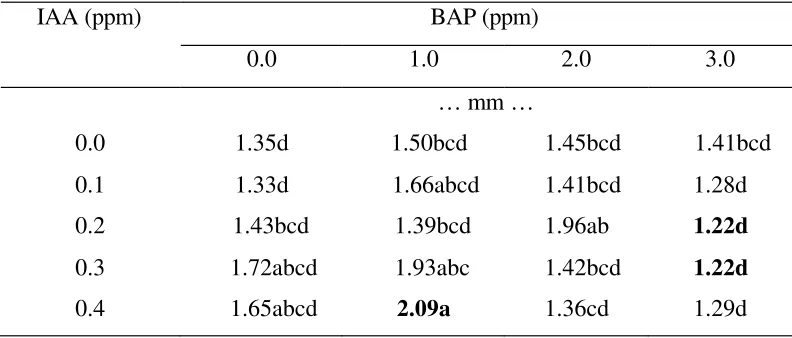
Interaksi antara IAA dan BAP menunjukkan pengaruh nyata pada panjang
akar terpanjang. Pada tabel 2 terlihat bahwa panjang akar terpanjang tertinggi
dihasilkan oleh interaksi antara 0.4 ppm IAA+1.0 ppm BAP yaitu 2.09 mm. Pada
interaksi antara air kelapa 0.2 ppm IAA+3.0 ppm BAP dan 0.3 ppm IAA +3.0
ppm BAP menghasilkan panjang akar terpanjang terendah yang sama yaitu 1.22
mm.
Interaksi antara 0.2 ppm IAA+3.0 ppm BAP dan 0.3 ppm IAA+3.0 ppm
BAP menghasilkan panjang akar terpanjang terendah. Diduga bahwa auksin yang
terkandung pada jaringan tanaman tidak hanya berasal dari auksin sintetik tapi
juga berasal dari auksin yang diproduksi alami oleh tanaman. Hal ini
menyebabkan konsentrasi auksin menjadi terlalu tinggi sehingga menghambat
proses pemanjangan akar. Leopold (1964) menyatakan bahwa akar sangat
dipengaruhi oleh auksin. Wetherell (1982) menamb ahkan bahwa kadar auksin
yang tinggi dapat menghambat pertumbuhan berupa pemanjangan akar itu sendiri.
Kedua pernyataan tersebut didukung oleh Beyl (2000) yang menyatakan bahwa
auksin berperan dalam proses-proses perkembangan, salah satunya adalah
pemanjangan akar.
KESIMPULAN DAN SARAN
Kesimpulan
1. Eksplan memberikan respon pertumbuhan berupa pembentukan kalus, tunas,
daun serta akar.
2. Perlakuan IAA 0.3 ppm cenderung mendorong pertumbuhan tinggi tanaman
dan pembentukan organ daun dan akar.
3. Perlakuan BAP 2.0 ppm dan 1.0 ppm cenderung mendorong pertumbuhan
tinggi tanaman dan pembentukan organ daun dan akar.
4. Interaksi antara 0.2 ppm IAA dan 2.0 ppm BAP memberikan pengaruh nyata
terhadap pembentukan tunas dengan menghasilkan jumlah tunas terbanyak.
5. Interaksi antara 0.4 ppm IAA dan 1.0 ppm BAP memberikan pengaruh nyata
terhadap perkembangan sistem perakaran dengan menghasilkan panjang akar
terpanjang tertinggi.
Saran
Perlu dilakukan penelitian lebih lanjut dalam mendorong pembentuk
organ-organ. Dalam hal ini dapat dilakukan dengan penggunaan bahan organik
lain seperti ekstrak touge, pepaya ataupun pisang, Selain itu perlu dicoba
menggunakan Anthurium andreanum dengan varietas tertentu.
Untuk pembentukan akar, perlu dilakukan tahap pengakaran yang
dilakukan pada media terpisah dengan hanya penambahan zat pengatur tumbuh
DAFTAR PUSTAKA
Altman, A. And B. Loberant. 1998. Micropropagation : Clonal Plant Propagation In Vitro. p.19-42. In Arie Altman (Ed). In Agricultural Biotechnology. Marcel Dekker Inc. New York.
Beyl, C. A. 2000. Getting Started With Tissue Culture, Media Preparation, Sterile Technique and Laboratory Equipment. p.21-38. In Robert N. Trigiano and Dennis J. Gray (Eds.). Plant Tissue Culture Concepts and Laboratory Exercise Second Edition. CRC Press. New York.
Collin, H. A. and Edwards. 1998. Plant Cell Culture. BIOS Sci.Publ.Ltd. Singapore.158 p.
Conger, B. V. 1980. Cloning Agricultural Plants Via In Vitro Technique. CRC Press Inc. Florida. 11-22 p.
Davidson, W and J. Bland. 1993. The Complete Book Of Conservatory Plants. Ward Lock Ltd. England. p.130-131.
De Guzman, E. V. 1983. Recent Progress in Rice Embryo Culture at IRRI. Proc Cell and Tissue Culture Technique For Cereal Crops Improvement. The Institute of Genetic Academia Sinica and The International Rice Research Institute. Beijing. p.215-228.
Departemen Pertanian. 2004. Data Produksi Tanaman Hias di Indonesia Tahun 2003. Departemen Pertanian. Jakarta. www.deptan.go.id. (21 Juli 2005).
---. 2005. Data Produksi Bunga Potong Anthurium di Indonesia. Departemen Pertanian. Jakarta. www.deptan.go.id. (3 April 2006).
Direktorat Bina Produksi Hortikultura. 2003. Laporan Perkembangan Produksi Tanaman Hias Tahun 1996-2002. Departemen Pertanian. Jakarta.
www.deptan.go.id. (28 Februari 2005).
Gunawan, L.W. 1992. Teknik Kultur Jaringan Tumbuhan. Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor. Bogor. 158 hal.
Hartmann, H. T., D. E. Kester, F. T. Davies Jr and R. L. Geneve. 1997. Plant Propagation Principles and Practices Sixth Edition. Prentice Hall Inc. New Jersey. 647 p.
Hennen, G. 1983. The basic of plant tissue culture. Aroideana. 6(2):43-48.
Janick, J. 1986. Horticultural Science Fourth Edition. W.H.Freeman and Co. New York. 746 p.
Kristina, D., D. Herlina dan S. Wuryaningsih. 1994. Inventarisasi dan karakterisasi beberapa jenis bunga potong komersial di pasaran bunga Cipanas, Lembang, Bandung dan Jakarta. Bul.Pen.Tan.Hias. 2(1):7-19.
Kuehnle, A. R and N. Sugii. 1991. Callus induction and planlet regeneration in tissue cultures of hawaiian Anthuriums. HortSci. 26(7):919-921.
Kunisaki, J. T. 1980. In vitro propagation of Anthurium andreanum L. HortSci. 15(4):508.
Leopold, A. C. 1964. Plant Growth and Development. McGraw-Hill Book Co. New York. 466 p.
Madison, M. 1980. Aroid profile no.6: Anthurium andreanum. Aroideana.
3(2):58-60.
Mirzada, C. D. 1994. Pengaruh Beberapa Taraf BAP dan IBA Terhadap Perbanyakan Calla Lily Secara In Vitro. Skripsi. Fakultas Pertanian Institut Pertanian Bogor. Departemen Budidaya Pertanian. 55 hal. [Tidak Dipublikasikan]
Moore, T. C. 1979. Biochemistry and Physiology of Plant Hormones. Springer-Verlag. New York. 274 p.
Nurwahyuni, I. 1993. Induksi Kalus dan Regenerasi Tanaman Dioscorea
composita Hemi. Laporan Penelitian IPB. Bogor. 15 hal.
Paul, J. 1972. Cell and Tissue Culture. Livingtone Ltd. London. 430 p.
Prihatmanti, D. 2002. Penggunaan Zat Pengatur Tumbuh NAA dan BAP Serta Air
Kelapa Untuk Menginduksi Organogenesis Tanaman Anthurium
Institut Pertanian Bogor. Departemen Budidaya Pertanian. 32 hal. [Tidak Dipublikasikan]
Prihmantoro, H. 1992. Menanam Anthurium. Trubus. XXXIII(270) : 38-39.
Salisbury, F. B. and C. W. Ross. 1992. Fisiologi Tumbuhan Jilid 3. Perkembangan Tumbuhan dan Fisiologi Lingkungan Edisi Keempat. Institut Teknologi Bandung. Bandung. 343 hal.
Steenis, C.G.G.J. 1978. Flora. Pradnya Paramita. Jakarta. 141-144 hal.
Steward, F. C. and A. D. Krikorian. 1971. Plants, Chemicals and Growth. Academic Press Inc. New York.232 p.
Swithinbank, A. 1991. Gardeners’s World Book Of House Plants. BCC Enterprises Ltd. London. 29-30 p.
Thimann, K. V. 1969. The Auxins. p.3-37. In Malcolm B. Wilkins (Ed).
Physiology of Plant Growth and Development. McGraw-Hill Publ.Co. London.
Thomas, E. and M. R. Davey. 1975. From Single Cells o Plants. Wykeham Publ. Ltd. London. 171 p.
Wareing, P. F. and I. D. J. Phillips. 1970. The Control of Growth and Differentiation in Plants. Pergamon Press Ltd. England. 303 p.
---. 1981. Growth Differentiation in Plants Third Edition. Pergamon Press Ltd. England. 343 p.
Wattimena, G.A. 1988. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor. Bogor. 1-93 hal.
Wetherell, D. F. 1982. Pengantar Propagasi Tanaman Secara In Vitro Seri Terjemahan Oleh Dra. Koensoemardiyah Seri Kultur Jaringan Tanaman. Avery Publ.Group Inc. New Jersey. 110 p.
Widiastoety, D. dan Syafril. 1993. Pengaruh air kelapa terhadap pertumbuhan protocorm like bodies anggrek Dendrobium dalam medium padat. Bul Pen.Tan.Hias. 1(1):7-12.
Wigati, S. 2001. Penggunaan Zat Pengatur Tumbuh BAP dan IAA Serta Air Kelapa Untuk Menstimulasi Organogenesis Tanaman Snapdragon (Antirrhinum majus) Secara In Vitro. Skripsi. Fakultas Pertanian Institut Pertanian Bogor. Departemen Budidaya Pertanian. 55 hal. [Tidak Dipublikasikan]
Minggu pagi. 2002. Anthurium, Simbol Martabat Pemilik. www.minggupagi.com
(14 Februari 2005).
Lampiran 1
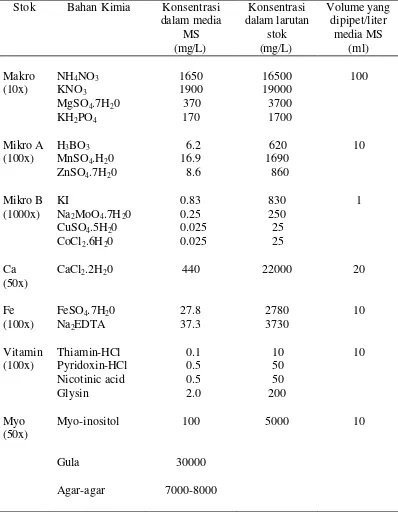
Tabel 3. Komposisi Larutan Stok Media Murashige and Skoog (MS)
Stok Bahan Kimia Konsentrasi
Lampiran 2
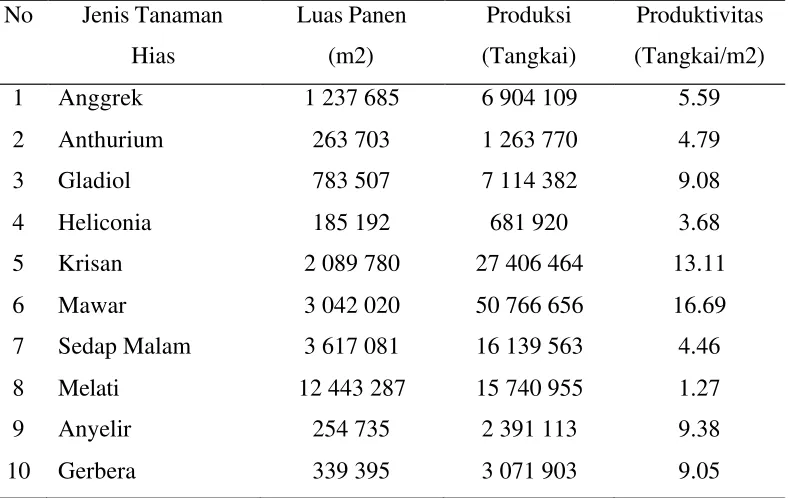
Tabel 4. Data Produksi Tanaman Hias di Indonesia Tahun 2003
No Jenis Tanaman
Hias
Luas Panen
(m2)
Produksi
(Tangkai)
Produktivitas
(Tangkai/m2)
1 Anggrek 1 237 685 6 904 109 5.59
2 Anthurium 263 703 1 263 770 4.79
3 Gladiol 783 507 7 114 382 9.08
4 Heliconia 185 192 681 920 3.68
5 Krisan 2 089 780 27 406 464 13.11
6 Mawar 3 042 020 50 766 656 16.69
7 Sedap Malam 3 617 081 16 139 563 4.46
8 Melati 12 443 287 15 740 955 1.27
9 Anyelir 254 735 2 391 113 9.38
10 Gerbera 339 395 3 071 903 9.05
Lampiran 3
Tabel 5. Daftar Harga Bunga Potong Segar
No Komoditi Harga (Rp) Keterangan
1. Mawar 10 000.- 1 tangkai
Sumber : Indra Florist Gift and Flower Gallery, November 2005