II. TINJAUAN PUSTAKA
2.1 Ubi Kayu
Ubi kayu (Manihot utilissima pohl) berasal dari Benua Amerika dan Bangsa Portugis membawanya ke Afrika dan digunakan sebagai bahan makanan. Ubi kayu saat ini penyebarannya hampir keseluruh dunia dan berkembang di negara-negara yang terkenal wilayah pertaniannya. Ubi kayu ditanam secara komersial di wilayah Indonesia sekitar tahun 1810, setelah sebelumnya diperkenalkan orang Portugis pada abad ke-16 ke Nusantara dari Brasil. Klasifikasi tanaman ubi kayu adalah :
Kingdom : Plantae atau tumbuh-tumbuhan Divisi : Spermatophyta atau tumbuhan berbiji Sub Divisi : Angiospermae atau berbiji tertutup Kelas : Dicotyledoneae atau biji berkeping dua Ordo : Euphorbiales
Famili : Euphorbiaceae Genus : Manihot
Spesies : Manihot utilissima Pohl ; Manihot esculenta Crantz sin.
Ubi kayu termasuk tumbuhan berbatang pohon lunak atau mudah patah. Ubi kayu berbatang bulat dan bergerigi yang terjadi dari bekas pangkal tangkai daun, bagian tengahnya bergabus dan termasuk tumbuhan yang tinggi. Ubi kayu bisa mencapai ketinggian 1-4 meter. Ubi kayu mempunyai panjang fisik rata-rata bergaris tengah 2-3 cm dan panjang 50-80 cm, tergantung dari jenis ubi kayu yang ditanam. Daging umbinya berwarna putih atau kekuning-kuningan. Ubi kayu biasanya diperdagangkan dalam bentuk masih berkulit. Umbinya mempunyai kulit yang terdiri dari 2 lapis yaitu kulit luar dan kulit dalam. Daging umbi berwarna putih atau kuning. Di bagian tengah daging umbi terdapat suatu jaringan yang tersusun dari serat. Antara kulit dalam dan daging umbi terdapat lapisan kambium.
Ubi kayu menghasilkan umbi setelah tanaman berumur 6 bulan. Setelah tanaman berumur 12 bulan dapat menghasilkan umbi basah sampai 30 ton per ha. Daun umbi
muda dari jenis yang beracun berguna untuk berbagai macam sayur. Daun yang kering untuk makanan ternak. Batangnya dapat digunakan untuk kayu bakar dan kadang-kadang untuk pagar hidup. Salah satu varietas tanaman ini mempunyai daun yang indah warnanya yang dimanfaatkan sebagai tanaman hias (Syarief 1988).
Ubi kayu mengandung racun yang disebut asam sianida (HCN). Berdasarkan kandungan asam sianidanya, ubi kayu dapat digolongkan menjadi empat yaitu (a) golongan tidak beracun, mengandung HCN 50 mg per kg umbi segar yang telah diparut, (b) beracun sedikit mengandung HCN antara 50 dan 80 mg per kg, (c) beracun, mengandung HCN antara 80 dan 100 mg per kg dan (d) sangat beracun, mengandung HCN lebih besar dari 100 mg per kg. Ubi kayu yang tidak beracun dikenal sebagai ubi kayu manis sedangkan ubi kayu yang beracun disebut ubi kayu pahit.
Ubi kayu memiliki kelebihan sebagai bahan baku bioetanol yaitu dapat tumbuh di tanah yang kurang subur, memiliki daya tahan yang tinggi terhadap penyakit, dan dapat diatur waktu panennya. Potensi pengembangan produksi ubi kayu di Indonesia disajikan pada Tabel 1.
Tabel 1. Perkembangan produksi ubi kayu Indonesia Tahun Luas Areal (Ha) Produksi (Ton)
2000 1.284.040 16.089.020 2001 1.317.912 17.054.648 2002 1.276.533 16.912.901 2003 1.244.543 18.523.810 2004 1.255.805 19.424.707 2005 1.213.460 19.321.183 2006 1.227.459 19.986.640. 2007 1.201.481 19.988.058 2008 1.178.306 20.834.241
Sumber : Departemen Pertanian (2008)
Ubi kayu sebagai bahan baku energi alternatif hanya memiliki kadar karbohidrat sekitar 32 – 35 % dan dengan kadar pati sekitar 83,8% setelah diproses menjadi tepung. Sifat fisiko kimia ubi kayu dan tepung ubi kayu disajikan pada Tabel 2 berikut.
Tabel 2. Sifat fisiko kimia ubi kayu dan tepung ubi kayu Jumlah (%) (b/b)
Komponen
Ubi kayu(a) Ubi kayu(b)
Air 62 – 65 59,40 Karbohidrat 32 – 35 38,10* Protein 0,7 – 2,6 0,70 Lemak 0,2 – 0,5 0,20 Serat 0,8 – 1,3 0,6 Abu 0,3 – 1,3 1,00
Sumber : a. Kay (1979); b Balagopalan et al.(1988) Keterangan :*)Dihitung berdasarkan by difference
2.2 Polisakarida Dalam Ubi Kayu
Polisakarida yang menyusun ubi kayu terdiri dari pati, selulosa dan hemiselulosa. Pati pada tumbuhan dipergunakan sebagai cadangan makanan yang dapat diuraikan menjadi glukosa dan dikonversikan menjadi energi. Pada saat yang tepat, tubuh tanaman akan mensintesa α-amilase, β-amilase dan R-enzim yang secara bersama-sama dipergunakan untuk memutuskan ikatan-ikatan rantai pati menjadi molekul-molekul glukosa bebas (Tjokroadikoesoemo 1986).
Pati merupakan homopolimer glukosa dengan ikatan α-glikosidik. Pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas yaitu fraksi amilosa dan amilopektin. Fraksi amilosa sifatnya larut dalam air panas dan fraksi amilopektin bersifat tidak larut. Amilosa mempunyai struktur lurus dengan ikatan α-(1,4)-D-glukosa, sedang amilopektin mempunyai cabang dengan ikatan α-(1,6)-D-glukosa sebanyak 4 – 5 % dari berat total (Winarno 1992). Hidrolisis amilosa menghasilkan maltosa, glukosa dan oligosakarida lainnya. Pada amilopektin sebagian dari molekul-molekul glukosa di dalam rantai percabangannya saling berikatan melalui gugus α-1,6. Ikatan α-1,6 sangat sukar diputuskan, apalagi jika dihidrolisis menggunakan katalisator asam.
Selulosa merupakan polimer glukosa dengan rantai linier yang terdiri dari satuan glukosa anhidrida yang saling berikatan melalui atom karbon pertama dan keempat. Ikatan yang terbentuk disebut dengan ikatan β-1,4 glikosidik. Struktur linier
menyebabkan selulosa bersifat kristalin, tidak mudah larut dan tidak mudah didegradasi secara kimia maupun mekanis. Rumus bangun selulosa disajikan pada Gambar 2.
Gambar 2 Struktur selulosa
Selulosa bersama-sama dengan hemiselulosa, pektin dan protein berfungsi untuk membentuk struktur jaringan dinding sel tanaman (Holtzapple 1993). Selulosa dapat berasosiasi dengan lignin sehingga sering disebut lignoselulosa. Selulosa, hemiselulosa dan lignin merupakan komponen utama penyusun tanaman yang dihasilkan melalui proses fotosintesis. Komponen-komponen ini dapat diuraikan menjadi komponen-komponen yang lebih sederhana oleh aktifitas mikroorganisme dan dipergunakan sebagai sumber energi (Enari 1983).
2.3 Bioetanol
Bioetanol merupakan etanol atau kependekan dari etil alkohol (C2H5OH) atau sering juga disebut dengan grain alcohol. Etanol berbentuk cairan tidak berwarna dan mempunyai bau khas. Berat jenis pada suhu 15oC sebesar 0,7937 dan titik didihnya 78,32 oC pada tekanan 76 mmHg. Sifat lainnya adalah larut dalam air dan eter dan mempunyai panas pembakaran 328 Kkal.
Etanol dapat diperoleh dari hasil proses fermentasi gula dengan menggunakan bantuan mikroorganisme. Dalam industri, etanol digunakan sebagai bahan baku industri turunan alkohol, campuran untuk miras, bahan dasar industri farmasi, dan campuran bahan bakar untuk kendaraan. Etanol terbagi dalam tiga grade, yaitu grade industri dengan kadar alkohol 90-94%, netral dengan kadar alkohol 96-99,5% umumnya digunakan untuk minuman keras atau bahan baku farmasi dan grade bahan bakar dengan kadar alkohol diatas 99,5% (Hambali et al. 2007).
Bioetanol dapat dipergunakan sebagai bahan bakar alternatif memiliki beberapa keunggulan yaitu mampu menurunkan emisi CO2 hingga 18 %, bioetanol merupakan bahan bakar yang tidak beracun dan cukup ramah lingkungan serta dihasilkan melalui proses yang cukup sederhana yaitu melalui proses fermentasi menggunakan mikrobia tertentu. Bioetanol sebagai bahan bakar memiliki nilai oktan lebih tinggi dari bensin sehingga dapat menggantikan fungsi aditif seperti metil tertiary butyl ether (MTBE) yang menghasilkan timbal (Pb) pada saat pembakaran. Di Indonesia, minyak bioethanol sangat potensial untuk diolah dan dikembangkan karena bahan bakunya merupakan jenis tanaman yang banyak tumbuh di negara ini dan sangat dikenal masyarakat. Tumbuhan yang potensial untuk menghasilkan bioetanol adalah tanaman yang memiliki kadar karbohidrat tinggi atau selulosa, seperti: tebu, nira, sorgum, ubi kayu, garut, ubi jalar, sagu, jagung, jerami, bonggol jagung, dan kayu.
Tahap inti proses pembuatan bioetanol adalah fermentasi gula baik yang berupa glukosa, fruktosa maupun sukrosa oleh yeast atau ragi terutama S. cerevisiae dan bakteri
Z. mobilis. Pada proses ini gula dikonversi menjadi etanol dan gas karbon dioksida.
Secara umum proses pembuatan bioetanol meliputi tiga tahapan, yaitu persiapan bahan baku, fermentasi dan pemurnian. Pada tahap persiapan, bahan baku berupa padatan terlebih dahulu harus dikonversi menjadi larutan gula sebelum difermentasi menjadi etanol. Untuk bahan-bahan yang sudah berada dalam bentuk larutan seperti molase dapat langsung difermentasi. Proses pengecilan ukuran dengan cara menggiling dapat dilakukan sebelum memasuki tahap pemasakan.
Tahap pemasakan meliputi proses likuifikasi dan sakarifikasi. Pada tahap ini tepung dikonversi menjadi gula melalui proses pemecahan menjadi gula kompleks. Pada tahap likuifikasi dilakukan penambahan air dan enzim alpha amilase. Proses ini dilakukan pada suhu 80-90oC. Berakhirnya proses likuifikasi ditandai dengan parameter cairan seperti sup. Tahap sakarifikasi dilakukan pada suhu 50 – 60oC. Enzim yang ditambahkan pada tahap ini adalah enzim glukoamilase. Pada tahap sakarifikasi akan terjadi pemecahan gula kompleks menjadi gula sederhana.
Tahap fermentasi merupakan tahap kedua dalam proses produksi bioetanol. Pada tahap ini terjadi pemecahan gula-gula sederhana menjadi etanol dengan melibatkan enzim dan ragi. Fermentasi dilakukan pada kisaran suhu 27 – 32 oC. Pada tahap ini akan
dihasilkan gas CO2 dengan perbandingan stokiometri yang sama dengan etanol yang dihasilkan yaitu 1 : 1. Setelah melalui proses pemurnian, gas CO2 dapat digunakan sebagai bahan baku gas dalam pembuatan minuman berkarbonat.
Fermentasi adalah suatu proses perubahan kimia pada substrat organik, baik karbohidrat, protein, lemak atau lainnya, melalui kegiatan katalis biokimia yang dikenal sebagai enzim dan dihasilkan oleh jenis mikroba spesifik (Prescott dan Dunn 1981). Secara biokimia fermentasi juga dapat diartikan sebagai pembentukan energi melalui senyawa organik. Secara sederhana proses fermentasi alkohol dari bahan baku yang mengandung gula atau glukosa terlihat pada reaksi berikut:
Glukosa 2C2H5OH + 2CO2+ 2 ATP + 5 Kkal
Dari reaksi diatas, 70% energi bebas yang dihasilkan dibebaskan sebagai panas dan secara teoritis 100% karbohidrat diubah menjadi 51,1% etanol dan 48,9 % menjadi CO2. Fermentasi menurut jenis medianya dapat dibedakan menjadi dua, yaitu fermentasi media padat dan media cair. Fermentasi media padat adalah fermentasi yang subtratnya tidak larut dan tidak mengandung air bebas, tetapi cukup mengandung air untuk keperluan mikroba. Fermentasi media cair adalah proses fermentasi yang subtratnya larut atau tersuspensi dalam media cair. Fermentasi media padat umumnya berlangsung pada media dengan kadar air berkisar antara 60-80 %.
Dalam proses fermentasi, glukosa dapat diubah secara anaerobik menjadi alkohol oleh bermacam-macam mikroorganisme. Khamir sering digunakan dalam proses fermentasi etanol, seperti Saccharomyces cerevisiae, S. uvarum, Schizosaccharomyces sp dan Kluyveromyces sp. Secara umum khamir dapat tumbuh dan memproduksi etanol secara efisien pada pH 3,5-6,0 dan suhu 28-35oC. Laju awal produksi etanol dengan menggunakan khamir akan meningkat pada suhu yang lebih tinggi, namun produktifitas keseluruhan menurun karena adanya pengaruh peningkatan etanol yang dihasilkan. (Ratledge 1991). Khamir yang sering dipergunakan dalam proses fermentasi etanol adalah Saccharomyces cereviseae. Khamir ini bersifat fakultatif anaerobik, tumbuh baik pada suhu 30oC dan pH 4,0 – 4,5 (Oura 1983).
Produksi etanol dari substrat gula oleh khamir Saccharomyces cereviseae merupakan proses fermentasi dengan kinetika sangat sederhana karena hanya melibatkan satu fasa pertumbuhan dan produksi. Pada fase tersebut glukosa diubah secara simultan
menjadi biomassa, etanol dan CO2. Terdapat dua parameter yang mengendalikan pertumbuhan dan methabolisme khamir dalam keadaan anaeorobik, yaitu konsentrasi gula dan etanol. Secara kinetik glukosa berperan ganda, pada konsentrasi rendah (kurang dari 1 g/l) merupakan substrat pembatas, sedangkan pada konsentrasi tinggi (lebih dari 300 g/l) akan menjadi penghambat (Mangunwidjaja 1994). Pada permulaan proses fermentasi, khamir memerlukan oksigen untuk pertumbuhannya. Setelah terjadi akumulsi CO2 dan reaksi berubah menjadi anaerob, alkohol yang terbentuk akan menghalangi proses fermentasi lebih lanjut setelah konsentrasi alkohol mencapai 13-15 persen volume dan biasanya maksimum 13 persen volume (Prescott dan Dunn 1981). Selama proses fermentasi juga menimbulkan panas, bila tidak dilakukan pendinginan, maka suhu akan terus meningkat sehingga proses fermentasi terhambat (Oura 1983).
Faktor lingkungan seperti suhu, pH, kebutuhan nutrient dan kofaktor perlu diperhatikan dalam kehidupan khamir. Sejumlah kecil oksigen harus disediakan pada proses fermentasi oleh khamir karena oksigen merupakan komponen yang diperlukan dalam biosintesis beberapa asam lemak tidak jenuh. Untuk kebutuhan oksigen dalam proses fermentasi, biasanya diberikan tekanan oksigen 0,05 – 0,10 mm Hg. Jika tekanan oksigen yang diberikan lebih besar dari nilai tersebut, maka konversi akan cenderung kearah pertumbuhan sel. Kebutuhan relatif nutrien sebanding dengan komponen utama sel khamir, yaitu mencakup karbon, oksigen, nitrogen dan hidrogen. Pada jumlah lebih rendah, fosfor, sulfur, potasium dan magnesium juga harus tersedia untuk sintesis komponen-komponen mineral. Beberapa mineral seperti Mn, Co, Cu dan Zn serta faktor pertumbuhan organik seperti asam amino, asam nukleat dan vitamin diperlukan dalam jumlah besar untuk pertumbuhan khamir.
2.4 Hidrolisis Asam
Konversi polisakarida menjadi monomer-monomer dapat dilakukan dengan proses hidrolisis baik secara enzimatis maupun secara kimiawi. Hidrolisis secara kimiawi biasanya menggunakan asam. Asam yang sering dipergunakan adalah asam sulfat, asam klorida dan asam fosfat. Hidrolisis asam pada dasarnya ada 2 jenis, yaitu hidrolisis pada suhu rendah dengan konsentrasi asam tinggi (concentrated-acid
hydrolisis) (Taherzadeh dan Keikhosro 2007). Pemilihan antara kedua metode kimiawi
ini didasarkan pada pertimbangan laju hidrolisis, tingkat degradasi, produk dan biaya total produksi. Perbandingan keuntungan dan kelemahan antara concentrated-acid
hydrolisis dengan dilute-acid hydrolisis disajikan pada Tabel 3 berikut ini :
Tabel 3 Perbandingan keuntungan dan kelemahan antara concentrated-acid hydrolisis dengan dilute-acid hydrolisis
Metode hidrolisis Keuntungan Kelemahan
Hidrolisis pada suhu rendah dengan konsentrasi asam tinggi
–Dioperasikan pada suhu rendah
–Rendemen gula tinggi
– Konsentrasi asam tinggi
–Korosi peralatan –Energi tinggi untuk
pengambilan asam Hidrolisis pada suhu tinggi
dengan konsentrasi asam rendah
–Konsentrasi asam rendah –Waktu tinggal singkat
–Suhu operasi tinggi –Yield gula rendah – Korosi peralatan Sumber: Taherzadeh dan Keikhosro (2007).
Hidrolisis asam dengan konsentrasi rendah (dilute-acid) dilakukan dalam dua tahap yaitu: pertama, tahap yang melibatkan asam encer untuk menghidrolisis gula dari golongan pentosa umumnya yang terdapat fraksi hemiselulosa. Tahapan ini biasanya menggunakan 1% H2SO4 pada suhu 80-120oC selama 30-240 menit. Tahap kedua menggunakan asam dengan konsentrasi yang lebih tinggi untuk menghidrolisis gula yang berasal dari golongan heksosa seperti selulosa menjadi glukosa, biasanya dilakukan dengan konsentrasi asam 5-20 % H2SO4 dengan suhu mendekati 180 oC. Dengan menggunakan hidolisis bertahap ini, maka kondisi optimum untuk memaksimalkan hasil glukosa dan miminimumkan hasil samping yang tidak diinginkan (Purwadi 2006). Proses pemisahan antara fraksi gula dengan fraksi asam dapat dilakukan dengan proses pertukaran ion dan asam dapat dikonsentrasikan kembali dengan proses evaporasi (Demirbas 2007).
Hidrolisis asam dengan konsentrasi rendah merupakan proses yang murah dan cepat untuk memperoleh gula dari bahan lignoselulosa. Namun, proses ini akan menghasilkan senyawa-senyawa penghambat yang bersifat toksik untuk mikroorganisme pada proses fermentasi, termasuk yeast. Toksik ini dapat menurunkan hasil produktivitas dan merusak pertumbuhan sel. Proses hidrolisis asam pada bahan lignoselulosik biasanya
akan menghasilkan glukosa, manosa, xilosa atau campuran senyawa-senyawa fenolik. Selama proses hidrolisis asam gula pentosa akan menghasilkan furfural dan gula heksosa menghasilkan 5-hidroksimetilfurfural (HMF) (Lopez et al.(2004).
Hidrolisis asam dengan konsentrasi rendah dapat dipergunakan sebagai langkah perlakuan awal (pretreatment) untuk proses hidrolisis secara enzimatik. Perlakuan awal hidrolisis enzimatik pada limbah lignoselulosik menggunakan H2SO40,1-1 % pada suhu 140-190oC akan dapat melemahkan ikatan-ikatan selulosa. Pretreatment dapat dilakukan selama 5 menit pada suhu 180 oC atau 30-90 menit pada suhu 120 oC (Taherzadeh dan Karimi 2007)
2.5 Hidrolisis Enzim
Enzim adalah satu atau beberapa gugus polipeptida atau protein yang berfungsi sebagai katalis dalam suatu reaksi kimia. Enzim bekerja dengan cara menempel pada permukaan molekul zat-zat yang bereaksi sehingga dapat mempercepat proses reaksi. Percepatan terjadi karena enzim menurunkan energi pengaktifan yang dengan sendirinya akan mempermudah terjadinya reaksi. Enzim bekerja secara khas, yang artinya setiap jenis enzim hanya dapat bekerja pada satu macam senyawa atau reaksi kimia. Hal ini disebabkan perbedaan struktur kimia tiap enzim yang bersifat tetap. Sebagai contoh, enzim α-amilase hanya dapat digunakan pada proses perombakan pati menjadi glukosa.
Hidrolisis pati dapat menggunakan enzim amilase dan glukoamilase. Enzim α-amilase merupakan endo-enzim yang dapat memecah ikatan α-1,4 glikosidik secara acak dibagian dalam molekul baik pada amilosa maupun pada amilopektinnya. Hasil akhir hidrolisis amilosa adalah glukosa dan maltosa dengan perbandingan 13 % dan 17 %, sedangkan hasil akhir hidrolisis amilopektin menghasilkan campuran limit dekstrin bercabang dan tidak bercabang yang terdiri dari hepta, heksa, penta, tetra dan trisakarida juga maltosa dan isomaltosa disertai sedikit glukosa.
Hidrolisis pati juga dapat menggunakan enzim glukoamilase. Enzim ini juga dikenal dengan nama α-1,4 glukan glukohidrolase. Enzim glukoamilase mampu memecah ikatan polimer monosakarida pada bagian luar dan menghasilkan unit-unit glukosa dari ujung non-pereduksi rantai polimer polisakarida. Enzim glukoamilase dapat diperoleh dari strain Aspergillus dan Rhizopus. Enzim ini bersifat eksoamilase, yaitu
memutuskan rantai pati menjadi molekul-molekul glukosa pada bagian non pereduksi, baik pada ikatan α-1,4 dan α-1,6 glikosidik (Tjokroadikoesoemo 1986).
Selulosa dapat dikonversi menjadi produk-produk bernilai ekonomi yang lebih tinggi seperti etanol, glukosa dan pakan ternak dengan jalan menghidrolisis selulosa dengan bantuan selulase sebagai biokatalisator atau dengan hidrolisis asam atau basa. Selulase adalah enzim yang dapat mengkatalis terjadinya reaksi hidrolisis selulosa menjadi glukosa. Keuntungan hidrolisisi ensim dibandingkan dengan hidrolisis asam adalah kondisi reaksi ringan dan tidak terjadi reaksi samping yang berarti.
Enzim selulase dapat diproduksi oleh mikroorganisme, seperti T.viride atau T.
reesei. Mikroorganisme selulolitik mampu menghasilkan selulase kompleks, yaitu suatu
campuran beberapa jenis selulase yang berbeda. Selulase kompleks mampu menghidrolisis kristal selulosa menjadi gula-gula terlarut secara efisien. Beberapa spesies bakteri yang dapat memproduksi enzim selulase dan hemiselulase adalah
Clostridium, Cellumonas, Thermomonospora, Bacillus, Bacteriodes, Ruminococcus, Erwinia, Acetovibrio, Microbispora dan Streptomyces, dan jamur seperti Tricoderma, Penicillium, Fusarium, Phanerochaete, Humicola dan Schizophillum spp. Walaupun
enzim selulase dapat diproduksi oleh berbagai macam mikroorganisme, enzim selulase dari T. reesei atau T viride telah banyak dipelajari dan mempunyai karakteristik yang paling baik.
Enzim selulase kompleks terdiri dari tiga enzim utama yaitu endoglukanase, eksoglukanase dan selobiase. Endoglukanase menghidrolisis ikatan 1,4 β-glikosidik secara acak pada daerah amorf selulosa menghasilkan glukosa, selobiosa dan selodekstrin. Eksoglukanase menghidrolisis selodekstrin dengan memutus unit selobiosa dari ujung rantai polimer. Selobiase menghidrolisis selobiosa dan selo-oligosakarida menjadi glukosa ( Wu et al. 2000; Jeewon 1997).
Enzim endoglukonase atau endoselulase menguraikan kristal-kristal penyusun serat selulosa dan melepaskan ikatan pada rantai kristal membentuk selulosa tunggal. Selulosa tunggal tersebut diurai oleh eksoglukonase atau eksoselulase menjadi unit-unit selobiase yang merupakan disakarida. Selobiase diuraikan menjadi glukosa oleh β-glukosidase.
Faktor-faktor yang berpengaruh pada proses hidrolisis enzim diantaranya yaitu kualitas dan konsentrasi substrat, metode perlakuan awal yang diaplikasikan, aktivitas enzim selulase dan kondisi proses hidrolisis seperti suhu dan pH. Suhu dan pH optimum merupakan fungsi dari bahan, sumber enzim dan waktu hidrolisis. Suhu dan pH optimum pada enzim selulase umumnya pada 40 – 50 oC dan pH 4 – 5, sehingga waktu yang digunakan tergantung pada kondisi tersebut.
Hidrolisis enzimatik tongkol jagung yang diberi perlakuan awal H2SO4 1% pada suhu 180 oC kemudian dihidrolisis dengan enzim selulase kasar T. viride dan enzim glukoamilase kasar A.niger yang dilakukan pada suhu 50 oC, pH 4,8 selama 60 jam menghasilkan 45,7 g/L etanol melalui sistem produksi fed batch (Chen et al. 2007)
Salah satu faktor utama yang berpengaruh terhadap hasil yang diperoleh dan kecepatan hidrolisis enzimatis adalah substrat. Konsentrasi substrat yang tinggi dapat menyebabkan penghambat yang memperlambat proses hidrolisis. Terjadinya penghambat oleh substrat tergantung pada perbandingan antara banyaknya enzim terhadap banyaknya substrat. Masalah pengadukan dan perpindahan panas juga akan timbul pada substrat yang berkonsentrasi tinggi. Banyaknya enzim yang ditambahkan pada substrat sangat berpengaruh terhadap kecepatan proses hidrolisis. Semakin banyak enzim yang ditambahkan akan semakin cepat proses hidrolisis yang terjadi dan hasil yang diperoleh juga semakin banyak, tetapi semakin tinggi biaya yang harus dikeluarkan. Banyaknya enzim yang ditambahkan pada substrat biasanya 5 – 35 FPU/gram substrat. Pengurangan biaya untuk penyediaan enzim pada proses hidrolisis enzim dapat dilakukan dengan daur ulang enzim selulase. Bercampurnya enzim dalam hidrolisat dan terbentuknya sisa proses yang berupa padatan (kemungkinan lignin) mempersulit proses pemisahan enzim. Alternatif yang dapat dilakukan untuk mengatasi hal tersebut adalah dengan aplikasi imobilisasi enzim selama proses.
2.6 Trichoderma viride
T. viride termasuk dalam genur Trichoderma, famili Moniliaceae dan ordo Moniliales. Kapang ini mudah dilihat karena penampakannya berserabut seperti kapas, namun jika spora telah timbul akan tampak berwarna hijau tua. T. viride mampu memproduksi komplek enzim selulase yang lengkap yaitu endoselulase dan eksoselulase
yang dapat menghidrolisis selulosa kristalin dan selulosa non kristalin. Pada enzim selulase dapat terjadi sinergisme antara eksoselulase dengan endoselulase, melainkan juga antar eksoselulase.
Pertumbuhan T. viride optimal pada pH sekitar 4,0, sedangkan untuk produksi enzim selulase mendekati ph 3,0. Selama produksi enzim, pH harus dipertahankan dalam kisaran 3,0 – 4,0 karena inaktivasi enzim akan terjadi di bawah pH 2,0. Suhu optimum pertumbuhan sekitar 32 – 35 oC dan untuk produksi enzim sekitar 25 – 28 oC. Karakteristik dari enzim selulase T. viride adalah memiliki pH optimum 4,0 dan akan tetap stabil pada pH 3 – 7. suhu optimum adalah 50 oC dan aktivitasnya akan menurun jika suhunya lebih dari 50oC.
T. viride selain mampu memproduksi enzim selulase, juga dapat menghasilkan enzim endo-1,4-β-xilanase yang dapat mendegradasi xilan. Berat molekul xilanase yang dihasilkan dari T. viride adalah sebesar 22.000 dalton ( Ujiie et al. 1991; Tholudur 1999). Palmvist et al. (1997) dan Larsson et al. (1999), melaporkan Trichoderma
mampu secara simultan melakukan proses detoksifikasi dan produksi enzim secara simultan pada hidrolisat asam yang mengandung senyawa-senyawa inhibitor seperti furfural dan HMF. Kapang ini juga mampu memetabolisme gula dari golongan pentosa maupun heksosa dan tidak terlalu sensitif terhadap material-material lignoselulosik.
2.7 Aspergillus niger
Aspergillus niger termasuk genus Aspergillus, famili Eurotiaceae dan ordo
Eurotiales. Kapang ini mempunyai miselium bercabang dan berseptat. Kapang umumnya bersifat aerob dan tumbuh baik pada kisaran suhu 25 – 30 oC, namun genus Aspergillus dapat tumbuh pada kisaran suhu 35 – 37oC. Kapang ini dapat tumbuh dengan baik pada suhu 30 oC dengan pH optimum 7,0 atau agak asam dan besifat tidak tahan panas. A.
niger dalam media pertumbuhan dapat langsung mengkonsumsi molekul-molekul
sederhana seperti gula dan komponen lain yang larut disekitar hifa, namun untuk molekul-molekul yang lebih kompleks seperti selulosa, pati dan protein harus dipecah terlebih dahulu sebelum masuk kedalam sel.
Pembentukan enzim ekstraseluler A. niger berlangsung lebih baik pada suhu kamar yaitu 25 – 28 oC dari pada suhu optimum pertumbuhannya (37,8 oC). Sintesis
enzim akan menurun pada suhu lebih dari 30 oC karena energi respirasi lebih banyak dipergunakan untuk pembentukan spora dari pada untuk membentuk miselium.
A. niger dikenal sebagai kapang penghasil asam sitrat, anilin, pektinase, selulase,
β-1,4-glikan hidrolase, protease, amilase, glukoamilase, maltase, β-galaktosidase, α-glukosidase, β-glukosidase, asam glukonat, glukosa oksidase, asam oksalat, fosfodiestrase, ribonuklease, pupulan 4- glukanohidrolase, β-xilosidase, xilanase dan lipase. Glukoamilase dari A. niger menunjukkan bobot molekul berkisar 54-112 k D dan pH optimum berkisar antara 4,0-5,0. Temperatur optimum aktivasi berkisar antara 40 – 65oC ( Selvakumar et al. 1996).
2.8 Saccharomyces cerevisiae
Saccharomyces cerevisiae termasuk ke dalam kelas Ascomycetes yang dicirikan
dengan pembentukan askus yang merupakan tempat pembentukan askospora. S. serevisiae memperbanyak diri secara aseksual yaitu dengan bertunas (Pelezar dan Chan 1986). Dinding sel S. cerevisiae terdiri dari komponen-komonen glukan, manan, protein, kitin dan lemak (Waluyo 2004).
Saccharomyces cerevisiae sering digunakan dalam fermentasi etanol karena
sangat tahan dan toleran terhadap kadar etanol yang tinggi (12-18% v/v), tahan pada kadar gula yang cukup tinggi dan tetap aktif melakukan fermentasi pada suhu 4-32oC. S.
cerevisiae mempunyai aktivitas optimum pada suhu 30 – 35oC dan tidak aktif pada suhu lebih dari 40 oC. S. cerevisiae dapat memfermentasi glukosa, sukrosa, galaktosa serta rafinosa (Kunkee dan Mardon 1970). Biakan S. cerevisiae mempunyai kecepatan fermentasi optimum pada pH 4,48 (Harrison dan Graham 1970)
Rendemen alkohol dari heksosa dalam fermentasi menggunakan khamir dari genus Saccharomyces dapat mencapai 90 % (Boyles 1984). Proses fermentasi oleh
Saccharomyces adalah proses pengubahan sebagian besar energi dari gula ke dalam
bentuk etanol. Efisiensi pengubahan energi tersebut dapat mencapai 97 % (Campbel 1983). Mekanisme pembentukan etanol oleh kamir melalui jalur
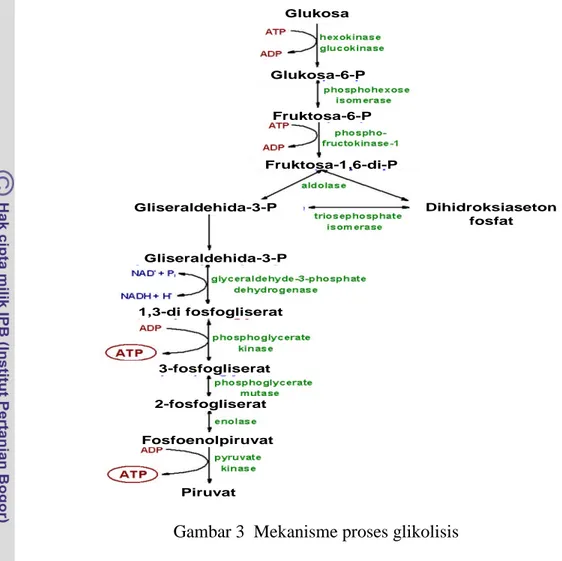
Embden-Meyerhof-Parnas Pathway (EMP) atau glikolisis. Hasil dari EMP adalah memecah glukosa menjadi 2 molekul piruvat. Mekanisme glikolisis disajikan pada Gambar 3.
Glukosa Glukosa-6-P Fruktosa-6-P Fruktosa-1,6-di-P Gliseraldehida-3-P Dihidroksiaseton fosfat Gliseraldehida-3-P 1,3-di fosfogliserat 3-fosfogliserat 2-fosfogliserat Fosfoenolpiruvat Piruvat Glukosa Glukosa-6-P Fruktosa-6-P Fruktosa-1,6-di-P Gliseraldehida-3-P Dihidroksiaseton fosfat Gliseraldehida-3-P 1,3-di fosfogliserat 3-fosfogliserat 2-fosfogliserat Fosfoenolpiruvat Piruvat Glukosa Glukosa-6-P Fruktosa-6-P Fruktosa-1,6-di-P Gliseraldehida-3-P Dihidroksiaseton fosfat Gliseraldehida-3-P 1,3-di fosfogliserat 3-fosfogliserat 2-fosfogliserat Fosfoenolpiruvat Piruvat
Gambar 3 Mekanisme proses glikolisis
Setelah melalui tahap glikolisis, piruvat yang terbentuk kemudian dirubah menjadi asetaldehid dan CO2 oleh enzim piruvat decarboksilase, setelah itu oleh enzim alkohol dehidrogenase dirubah menjadi etanol.