III. METODE PENELITIAN 3.1. Waktu Penelitian
Penelitian dilakukan pada Bulan April sampai September 2007 di Laboratorium Pengolahan Balai Besar Pengembangan dan Pengendalian Hasil Perikanan, Jakarta. Analisis laboratorium dilakukan di Laboratorium Kimia, Laboratorium Mikrobiologi, Laboratorium Organoleptik Balai Besar Pengembangan dan Pengendalian Hasil Perikanan, Jakarta, Laboratorium Pascapanen Pertanian, Bogor, Laboratorium Pusat Antar Universitas, IPB, Bogor, dan Laboratorium Anatomi, Fakultas Kedokteran Hewan, IPB, Bogor.
3.2. Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah rumput laut kering jenis Euchema cotonii, tepung beras, tepung hunkwee, air, daun suji (Pleomele angustifolia), dan bahan-bahan kimia yang diperlukan untuk analisis di laboratorium. Alat yang digunakan yaitu cetakan cendol, saringan, freeze dryer skala laboratorium Merk Labconco Freeze Dry system, mikroskop, kamera digital Merk Canon, blender, mixer, jangka sorong, wadah, peralatan gelas, serta peralatan laboratorium untuk pengujian kimia dan organoleptik sesuai dengan parameter yang sudah ditentukan.
3.3. Metode Penelitian
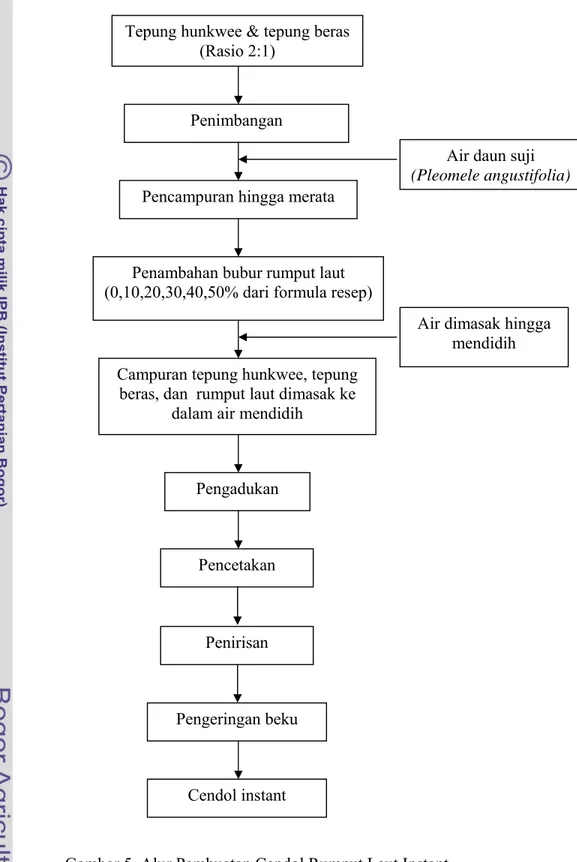
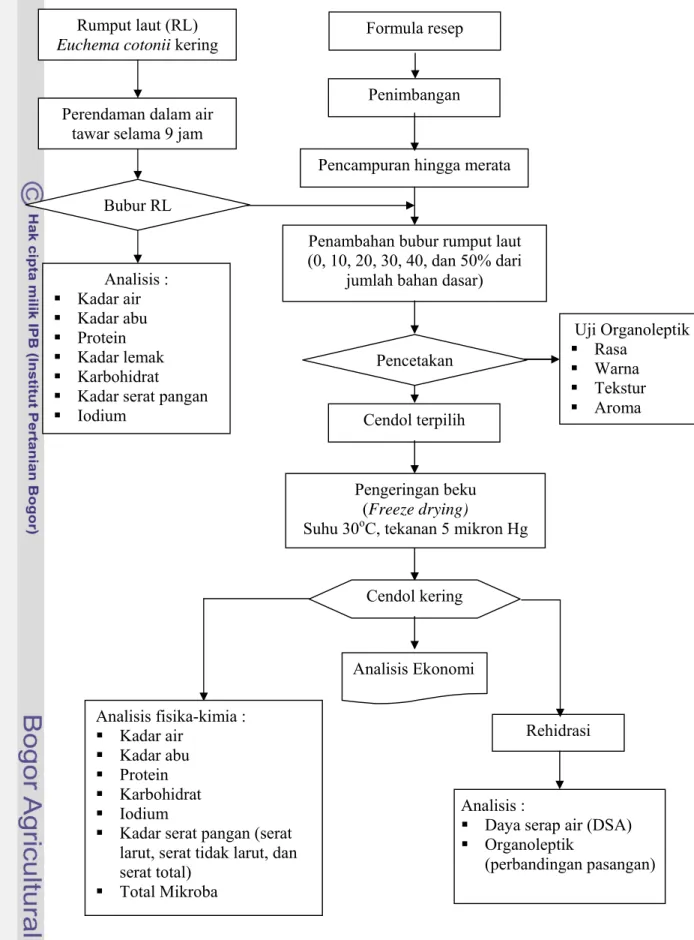
Penelitian ini melalui beberapa tahapan yang sistematis, yaitu pembuatan bubur rumput laut termasuk didalamnya proses perendaman rumput laut yang bertujuan untuk menghilangkan bau amisnya, formulasi cendol rumput laut, pengeringan beku (freeze drying), uji organoleptik (uji kesukaan dan perbandingan pasangan), dan analisis ekonomi cendol rumput laut instant. Alur pembuatan cendol instan dapat dilihat pada Gambar 5 dan alur penelitian dapat dilihat pada Gambar 6. a. Pembuatan bubur rumput laut Euchema cotonii
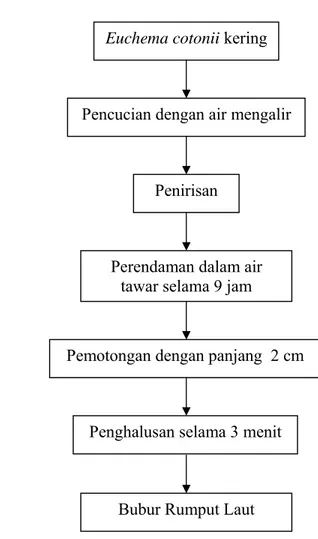
Sebelum rumput laut Euchema cotonii dibuat bubur, rumput laut tersebut lebih dahulu dilakukan perendaman untuk menghilangkan bau amisnya. Penghilangan bau amis pada rumput laut segar dapat dilakukan dengan merendam rumput laut selama empat hari dengan perbandingan air dan rumput laut 1 : 0.5, air perendam diganti setiap 24 jam (Astawan et al., 2004). Sedangkan untuk rumput laut kering, penghilangan bau amis dapat dilakukan dengan perendaman dalam air tawar selama 9 jam (Chaidir, 2007). Selain untuk menghilangkan bau amis, perendaman juga bertujuan untuk mendapatkan rumput laut dengan kenampakan (warna) putih dan tekstur yang tidak lembek.
Rumput laut yang telah direndam selanjutnya dipotong-potong sehingga menghasilkan ukuran yang lebih kecil. Pemotongan rumput laut bertujuan untuk memudahkan dalam proses peghancuran (diblender) dan proses blender menjadi lebih singkat. Rumput laut tersebut diblender selama 3 menit.
Bubur rumput laut yang telah dibuat selanjutnya dilakukan analisis proksimat (kadar air, abu, protein, dan karbohidrat), kadar serat pangan (serat pangan larut, serat pangan tidak larut, dan serat pangan total), dan Iodium. Diagram alir pembuatan bubur rumput laut dapat dilihat pada Gambar 7.
b. Formulasi Cendol Rumput Laut
Formulasi cendol rumput laut bertujuan untuk mendapatkan komposisi cendol yang paling baik. Cendol rumput laut dibuat dengan menambahkan bubur rumput laut ke dalam adonan formula resep, dengan konsentrasi 0% (formula A), 10% (formula B), 20% (formula C), 30% (formula D), 40% (formula E), dan 50% (formula F). Sebagai contoh, jika berat bahan adonan yang akan dibuat adalah 100
gram dan jumlah rumput laut yang akan ditambahkan adalah 20% maka bubur rumput laut yang akan ditambahkan adalah 20 gram dalam 100 gram bahan adonan.
Bahan pewarna dalam cendol penelitian ini digunakan pewarna alami, yaitu daun suji (Pleomele angustifolia). Larutan daun suji dibuat dengan cara mencampurkan air ke dalam daun suji yang telah diblender dengan perbandingan daun suji dan air 1:5 (Anggraeni, 2002). Misalkan daun suji yang digunakan adalah 100 gram, maka air yang ditambahkan adalah 500 ml. Daun suji dan air tersebut diblender selama 3 menit, dan disaring. Hasil saringan tersebut siap digunakan sebagai bahan pewarna cendol rumput laut.
c. Pengeringan Beku Cendol Rumput Laut
Cendol rumput laut dari formula terpilih selanjutnya dilakukan pengeringan. Pengeringan secara umum bertujuan untuk menghilangkan air atau hilangnya pelarut organik. Hilangnya air menjamin stabilitas dan pengawetan yang efektif (Voight, 1994). Dengan pengeringan beku produk akhir diharapkan memiliki karakteristik tidak keriput (bentuk tetap), bau, warna, dan cita rasa tidak berubah serta proses rehidrasi lebih cepat.
Proses pengeringan pada pengeringan beku berlangsung pada saat bahan dalam kondisi beku, sehingga proses yang terjadi adalah sublimasi. Proses sublimasi terjadi pada suhu dan tekanan rendah, di bawah titik triple air. Mula-mula bahan dalam keadaan beku dimasukkan ke dalam ruang pengering yang hampa udara, panas sublimasi akan diberikan dengan menempatkan lempeng pemanas di dalam ruang pengering, dan panas akan diradiasikan dari lempeng pemanas ke permukaan (Rachdiani, 2001).
Menurut Liapis dan Bruttini (1995) proses pengeringan beku berlangsung dalam tiga tahap, yaitu a) tahap pembekuan, dimana seluruh bahan didinginkan hingga menjadi beku; b) tahap pengeringan primer, dimana air dan pelarut dikeluarkan dalam keadaan beku secara sublimasi; c) tahap pengeringan sekunder, mencakup pengeluaran uap air terikat yang ada di lapisan kering. Tahap pengeringan sekunder dimulai setelah tahap pengeringan primer berakhir.
Tahap pengeringan beku cendol rumput laut dapat dibagi menjadi dua proses utama yaitu pembekuan dan pengeringan. Prosedur yang dilakukan pada proses pembekuan adalah ;
a. Cendol rumput laut yang telah terpilih dimasukkan ke dalam wadah contoh. b. Cendol rumput laut dan wadah contoh dibekukan pada plat pembeku yang
terdapat pada alat pengering beku pada suhu -30 0C selama 8 jam. c. Proses pembekuan dihentikan sampai suhu bahan hampir seragam. Prosedur pengeringan dalam pengeringan beku yaitu ;
a. Cendol rumput laut yang telah beku selanjutnya dikeringkan menggunakan freeze drier padasuhu 30 0C dengan lama pengeringan 36 jam.
b. Proses pengeringan dihentikan setelah kekeringan akhir bahan hampir seragam.
3.4. Analisis Data
Penelitian uji penambahan rumput laut dan uji pengeringan beku dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL). Faktor yang berpengaruh pada formulasi cendol rumput laut adalah komposisi (persentase) rumput laut yang ditambahkan pada bahan cendol (0, 10, 20, 30, 40, dan 50%). Data yang didapat selanjutnya dianalisis dengan analisis sidik ragam (ANOVA) untuk mengetahui pengaruh dari perlakuan. Bila ada perbedaan dilanjutkan dengan uji Less Significant Difference (LSD). Model yang digunakan adalah :
Yij = µ + αi + εij
Dimana :
Yij : Nilai pengamatan dari perlakuan ke-i, pada ulangan ke-j µ : Nilai rata-rata tengah umum
αi : Pengaruh perlakuan ke-i
Gambar 5. Alur Pembuatan Cendol Rumput Laut Instant.
Air daun suji (Pleomele angustifolia)
Penambahan bubur rumput laut (0,10,20,30,40,50% dari formula resep)
Campuran tepung hunkwee, tepung beras, dan rumput laut dimasak ke
dalam air mendidih
Air dimasak hingga mendidih Pengadukan Pengeringan beku Cendol instant Pencetakan Penirisan
Tepung hunkwee & tepung beras (Rasio 2:1)
Penimbangan
Gambar 6. Diagram Alir Penelitian.
Pencampuran hingga merata
Penambahan bubur rumput laut (0, 10, 20, 30, 40, dan 50% dari
jumlah bahan dasar)
Uji Organoleptik Rasa Warna Tekstur Aroma Penimbangan Formula resep Pengeringan beku (Freeze drying)
Suhu 30oC, tekanan 5 mikron Hg Cendol terpilih
Rumput laut (RL) Euchema cotonii kering
Perendaman dalam air tawar selama 9 jam
Analisis : Kadar air Kadar abu Protein Kadar lemak Karbohidrat Kadar serat pangan Iodium Rehidrasi Analisis fisika-kimia : Kadar air Kadar abu Protein Karbohidrat Iodium
Kadar serat pangan (serat larut, serat tidak larut, dan serat total)
Total Mikroba
Analisis :
Daya serap air (DSA) Organoleptik (perbandingan pasangan) Cendol kering Bubur RL Pencetakan Analisis Ekonomi
Gambar 7. Alur Penghilangan Bau Amis dan Pembuatan Bubur Rumput Laut.
3.5. Analisis Daya Serap Air (DSA) (Rasper dan J.M de Man, 1980)
Sebanyak 10 gram cendol direndam dalam air 100 ml. Setelah mencapai waktu optimum (seluruh bagian cendol sudah mengembang), cendol ditiriskan selama 5 menit. Cendol kemudian ditimbang dan dikeringkan pada suhu 105 0C sampai bobotnya konstan kemudian ditimbang kembali.
DSA = 100% )] 1 ( [ )] ( ) [( x awal sampel air kadar x awal sampel bobot awal sampel bobot x awal air kadar B A − − − Keterangan :
A = Berat cendol setelah direhidrasi B = Berat cendol awal sebelum direhidrasi
Euchema cotonii kering
Pencucian dengan air mengalir
Penirisan
Perendaman dalam air tawar selama 9 jam
Pemotongan dengan panjang 2 cm
Penghalusan selama 3 menit
3.6. Sifat Kimia Cendol Rumput Laut Euchema cotonii a. Kadar air (Apriyantono et al., 1989)
Kadar air diukur dengan metode oven. Sebanyak 5 gram contoh dikeringkan dalam oven pada suhu 105 0C selama 16-24 jam sehingga diperoleh bobot yang konstan. Kadar air (%) = x 100% C B A − Keterangan :
A = bobot wadah dan bahan awal (gr) B = bobot wadah setelah dikeringkan (gr) C = bobot bahan
b. Kadar abu (Apriyantono et al., 1989) Cara penentuan kadar abu yaitu ; - cawan pengabuan dibakar dalam tanur
- didinginkan dalam desikator dan ditimbang beratnya - sampel ditimbang 3-5 gram dalam cawan
- sampel pangabuan didinginkan dan ditimbang
Kadar abu (%) = 100% ) ( ) ( x gr sampel Berat gr abu Berat
c. Kadar lemak (Apriyantono et al., 1989)
Penentuan kadar lemak dengan metode soxhlet. Labu lemak dikeringkan dalam oven, didinginkan dalam desikator. Sejumlah kecil (3-5 gram) sampel dibungkus dengan kertas saring dan diletakkan dalam alat ekstraksi soxhlet, kemudian kondensor diletakkan diatasnya dan labu lemak di bawahnya. Setelah pelarut dietil eter atau petroluem eter dituangkan dalam labu lemak, maka dilakukan refluks selama minimal 5 jam sampai pelarut yang turun ke labuh lemak kembali berwarna jernih. Selanjutnya labu lemak yang berisi lemak hasil ekstraksi dipisahkan dalam dalam oven pada suhu 105 0C. Setelah dikeringkan sampai berat konstan dan didinginkan dalam desikator, labu berisi lemak ditimbang.
Kadar lemak (%) = 100% ) ( ) ( x gr sampel berat gr lemak berat
d. Kadar protein (Apriyantono et al., 1989)
Analisis kadar protein pada penelitian ini menggunakan metode mikrokjeldahl. Prinsip kerjanya adalah sejumlah sampel ditimbang, lalu dimasukkan ke dalam tabung kjeldahl 30 ml. Kedalammnya ditambahakan 1,9 gram K2SO4, 40 mg HgO dan 20 ml H2SO4. Jika sampel lebih dari 15 mg kemudian di tambahkan 0,1 ml H2SO4 untuk setip 10 mg bahan organik. Selanjutnya sampel di didihkan selama 1-1,5 jam sampai cairan jernih dan di dinginkan.
Isi labu kjeldahl di pindah kan dalam alat destilasi.labu di cuci dan dibilas 1-5 kali dengan 1-2 ml air.Air cucian di masukan dalam alat destilasi kemudian di tambahkan 8-10 ml larutan NaOH-Na2S2O3. Erlemeyer 125 ml yang berisi 5 ml H3BO3 dan 2-4 tetes indikator di letakan di bawah kondensor. Ujung tabung kodensor harus terendam di bawah larutan H3BO3.setelah itu di lakukan destasi sampai di peroleh kira kira 15 ml destilasi dalam erlenmeyer.
Tabung kondensor dibilas air dan bilasanya di tampung dalam erlenmeyer yang sama. Isi erlenmeyer di encerkan sampai 50 ml kemudian dititrasi dengan HCI 0,02 N sampai terjadi perubahan warna menjadi abu-abu. Hal ini di lakukan terhadap blanko. Kadar protein (%) = ( ) 14,007 6,25 x100% sampel Berat x x N x B A− Keterangan :
A : Volume (ml) HCl untuk mentitirasi larutan dalam contoh B : Volume (ml) HCl larutan blanko
N : Normalitas HCl standar yang digunakan 14,007 : Berat atom Nitrogen
e. Kadar karbohidrat (by different)
Kadar karbohidrat dihitung setelah nilai kadar protein, kadar lemak, kadar abu, dan kadar air diperoleh. Kadar karbohidrat dihitung dengan menggunakan rumus sebagai berikut :
Kadar karbohidrat (%) = 100% - (kadar air + kadar protein + kadar lemak + kadarabu)
f. Kadar serat pangan (Asp et al., 1983)
Contoh kering homogen diekstraksi lemaknya dengan petroleum eter selama 15 menit pada suhu kamar. Kemudian diambil 1 gram dan dimasukkan ke dalam labu erlenmeyer dan ditambahkan 25 ml 0,1 M buffer Natrium fosfat pH 6,0 dan dicampur secara merata. Setelah itu ditambahkan 0,1 ml alfa amilase (termamyl 120 L) dan labu ditutup dengan aluminium foil, kemudian diinkubasi selama 15 menit dalam penangas air panas bergoyang pada suhu 80 0C. Selanjutnya didinginkan lalu ditambahkan 20 ml air destilata, pH diatur menjadi 1,5 dengan HCl 0,1 N dan elektroda dibersihkan dengan air. Kemudian ditambahakan pepsin 0,1 gram, ditutup dengan aluminium foil dan diinkubasi dalam penangas air bergoyang pada suhu 40 0C selama 1 jam. lalu ditambahkan 20 ml air destilata dan pH diatur menjadi 6,8 dengan NaOH, elektroda dibersihkan dengan 5 ml air. Selanjutnya ditambahkan 0,1 gram pankreatin, kemudian labu ditutup dengan alumunium foil dan didinkubasi dalam penangas air bergoyang pada suhu 40 0C selama 1 jam, pH diatur menjadi 4,5 dengan HCl 0,1 N. Kemudian disaring dengan crucible, dicuci dengan 2 x 10 ml air destilata.
Serat pangan tidak larut (Residu / insoluble dietary fiber)
Residu dalam crucible dicuci dengan 2 x 10 ml etanol 90% dan 2 x 10 ml aseton. Crucible dikeringkan pada suhu 105 0C sampai bobot tetap dan ditimbang setelah didinginkan dalam desikator (D1). Kemudian diabukan pada suhu 550 0C selama kurang lebih 5 jam, serta ditimbang setelah pendinginan dalam desikator (I1).
Serat pangan larut (Filtrat/soluble dietary fiber)
Volume filtrat diatur dan dicuci dengan air sampai 100 ml kemudian ditambahkan 400 ml etanol 95% dengan suhu 60 0C dan dibiarkan presipitasi selama
60 menit. Lalu disaring dengan crucible kering (porositas 2) yang menngandung 0,5 gram celite, selanjutnya dicuci berturut dengan 2 x 10 ml etanol 78%, 2 x 10 ml aseton. Setelah itu filter gelas dikeringkan dalam oven suhu 105 0C sampai beratnya konstan dan ditimbang setelah didinginkan dalam desikator (D2), dan diabukan pada suhu 550 0C selama kurang lebih 5 jam serta ditimbang setelah pendinginan dalam desikator (I2).
Dilakukan juga perhitungan serat blanko dengan mengunakan prosedur seperti di atas, tetapi tidak digunakan sampel. Nilai blanko ini harus diperiksa secara berkala dan bila enzim yang digunakan berasal dari batch baru.
Perhitungan : IDF (%) = 1 1 1 x100% W B I D − − SDF (%) = 2 2 2 x100% W B I D − − TDF (%) = IDF + SDF Keterangan :
W = berat sampel (gram)
D = berat setelah peneringan (gram) I = berat setelah pengabuan (gram) B = blanko bebas serat (gram)
g. Kadar Iodium
Salah satu cara penetapan kuantitatif untuk menetapkan kadar iodium dalam bahan makanan adalah berdasarkan reduksi katalis ion Ce4+ (kuning) menjadi Ce3+ (tidak berwarna). Metode ini terdiri dari 4 bagian, yaitu pembuatan larutan pereaksi, pembuatan kurva standar, persiapan contoh, dan perhitungan kadar iodium.
Pembuatan larutan pereaksi
1. Asam arsenit 0,02 N : sebanyak 0,986 gram arsen trioksida (As2O3) dilarutkan dalam 10 ml NaOH 0,5 N dalam sebuah gelas piala dan dipanaskan. Selanjutnya dimasukkan secara kuantitatif ke dalam labu takar 1 liter, diencerkan dengan 850 air suling dan ditambahkan 20 ml asam klorida pekat dan 20,6 ml asam sulfat pekat, kemudian ditepatkan dengan air suling sehingga volume 1 liter.
2. seri ammonium sulfat 0,03 N : 48,6 ml asam sulfat pekat ditambahkan ke dalam air suling dalam labu takar 1 liter. Kemudian tambahkan 20 gram seri ammonium sulfat dan dilarutkan, volume ditepatkan hingga 1 liter.
3. larutan pengabuan : sebanyak 212 gram natrium karbonat anhydrous dan 20 gram kalium hipoklorida dilarutkan dalam 1 liter air suling.
4. larutan standar indul iodium 4 µg/ml dibuat dengan melarutkan standar kalium iodide ke dlam air suling
5. standar kerja ioduim : larutan standar iodium dipipet ke dalam tabung takar 100 ml masing-masing 1, 2, 3, dan 4 ml dan ditepatkan hingga tanda garis. Larutan ini mengandung 0,04; 0,08; 0,12; dan 0,16 µg iodium/ml.
Pembuatan kurva standar
Sebanyak 5 ml masing-masing larutan standar kerja iodium 0; 0,04; 0,08; 0,12; dan 0,16 µg iodium/ml dipipet ke dalam tabung pereaksi atau kuvet dan direndam dalam penangas air bersuhu 37 0C. Setelah suhu 37 0C tercapai, ditambahkan dengan 0,1 ml larutan seri ammonium sulfat ke dalam tabung. Setelah 20 menit, reduksi seri ammonium kepada sero diukur dengan spektrofotometer dengan panjang gelombang 420 nm. Dilakukan juga blanko tanpa sampel atau standar. Selanjutnya dibuat kurva hubungan konsentrasi (µg iodium/ml) versus serapan masing-masing larutan standar.
Persiapan contoh
Sebanyak 5 gram contoh (mengandung 0,04-0,08 µg iodium) ditimbang ke dalam tabung pyrex 22 x 220 mm (15 x 125 mm) dan ditambahkan larutan pembantu pengabuan 0,5 ml. Kemudian campuran tersbut dikeringkan dalam oven pada suhu 105-110 0C selama ± 2 jam. Selanjutnya tabung dipindahkan ke dalam tanur lalu suhu dinaikkan perlahan-lahan dan contoh diabukan pada suhu 500 0C selama 4 – 6 jam. Tabung didinginkan, kemudian abu dikestrak dengan menambahkan 10 ml larutan asam arsenit dan didiamkan selama ± 15 menit. Campuran diputarkan pada 200 rpm selama 20 menit dan sebanyak 5 ml supernatan dipipet ke dalam tabung reaksi atau kuvet dan direndam dalam penangas air bersuhu 37 0C. Setelah suhu 37 0C tercapai, ditambahkan dengan pipet 1,0 ml larutan seri ammonium sulfat ke dalam
tabung tepat setelah 20 menit, reduksi seri kepada sero diukur dengan spektrofotometer pada panjang gelombang 420 nm.
Perhitungan : Iodium (µg/100 gram) = B x V x C 100 Keterangan :
C = konsentrasi larutan sampel yang terbaca dari kurva standar (µg iodium/ml).
V = volume ekstrak sampel dalam ml (10 ml) B = berat sampel (gram)
3.7. Total Mikroba (Fardiaz, 1989)
Sebanyak 10 g sampel dimasukkan ke dalam plastik tahan panas yang telah disterilkan yang berisi 90 ml larutan pengencer steril. Sampel tersebut kemudian dihancurkan dengan menggunakan alat stomacher selama 60 detik, dan dihasilkan sampel dengan pengenceran 1:10. Campuran dikocok, diambil 1 ml kemudian dimasukkan ke dalam tabung reaksi 9 ml larutan pengencer steril (10-2). Dengan cara yang sama diperoleh pengenceran 10-3,10-4, dan seterusnya.
Dari tiap-tiap pengenceran, dipipet secara aseptis 1 ml suspensi sampel dan dimasukkan ke dalam cawan petri steril. Selanjutnya ditambahkan 15-20 ml medium PCA steril pada suhu 47-50oC (duplo). Setelah medium membeku, cawan petri diinkubasi dengan posisi terbalik pada inkubator suhu 37oC selama 2-3 hari. Perhitungan total mikroba menggunakan metode Standar Plate Count (SPC), dengan rumus;
Faktor pengenceran = pengenceran awal x pengenceran selanjutnya x Σ yang ditumbuhkan
Koloni per ml/gr = Σ koloni x
n pengencera faktor
3.8. Uji Organoleptik
Uji organoleptik dilakukan terhadap cendol rumput laut yang masih basah (belum dilakukan proses pengeringan beku) dan cendol kering yang telah direhidrasi. Untuk cendol yang basah dilakukan uji kesukaan (hedonik), sedangkan untuk cendol kering dilakukan uji perbandingan berpasangan dengan produk cendol komersial.
a. Uji kesukaan (hedonik)
Uji kesukaan (hedonik) meliputi parameter warna, aroma, rasa, dan tekstur. Uji kesukaan dilakukan oleh 20 orang panelis dengan menggunakan score sheet dengan skala 1-9 yang mendeskripsikan sampel cendol yang diujikan. Dalam uji ini, cendol yang disajikan dalam bentuk segar dan tidak dicampur dengan larutan gula kelapa dan larutan santan kelapa. Uji hedonik menggunakan angka 9 untuk nilai tertinggi (amat sangat suka) dan angka 1 untuk nilai terendah (amat sangat tidak suka). Kriteria penilaian uji kesukaan seperti pada Tabel 7 dan score sheet kriteria uji kesukaan dapat dilihat pada Lampiran 1.
Tabel 7. Kriteria Uji Kesukaan
Skala hedonik Nilai
Sangat suka 9
Suka 7
Agak suka 6
Netral 5
Agak tidak suka 4
Tidak suka 3
Sangat tidak suka 1
b. Uji perbandingan pasangan (Rahayu, 2001)
Formula terpilih selanjutnya dilakukan uji perbandingan pasangan dengan produk komersial. Pada uji perbandingan pasangan, cendol yang diuji disajikan dalam kondisi siap saji sebagaimana cendol komersil disajikan, yaitu dengan penambahan larutan gula kelapa 40 ml dan larutan santan kelapa 30 ml. Menurut Anggraeni (2002), dalam pembuatan larutan gula kelapa, perbandingan antara gula kelapa dan air yang paling baik adalah 1 : 2,5, sedangkan untuk larutan santan kelapa perbandingan yang paling baik antara santan kelapa dan air adalah 2 : 5. Panelis melakukan penilaian berdasarkan formulir isian (Lampiran 2) dengan memberikan angka berdasarkan skala kelebihan, yaitu lebih baik atau lebih buruk.
Angka 3 untuk penilaian sangat lebih baik, sedangkan angka -3 untuk penilaian sangat lebih buruk. Kriteria uji perbandingan berpasangan seperti pada Tabel 8.
Tabel 8. Kriteria Uji Perbandingan Pasangan Skala perbandingan Nilai
Sangat lebih baik 3
Lebih baik 2
Agak lebih baik 1
Tidak berbeda 0
Agak lebih buruk -1
Lebih buruk -2
Sangat lebih buruk -3
3.9. Analisis Ekonomi
Analisis ekonomi dilakukan untuk menilai kelayakan suatu usaha berdasarkan biaya-biaya yang dikkeluarkan selama proses produksi dengan jangka waktu tertentu. Dalam penelitian ini, penilaian kelayakan dititik beratkan pada kelayakan usaha cendol instan yang dikeringkan dengan mesin pengering beku (Freeze dryer) yang notabene menggunakan energi yang tinggi terutama energi listrik dalam prosesnya.
Hal pertama yang harus dilakukan dalam analisis kelayakan usaha cendol instan ini adalah menggolongkan biaya-biaya yang dikeluarkan selama proses produksi. Berdasarkana perilakunya terhadap perubahan volume produksi, biaya dalam usaha cendol instan dapat digolongkan menjadi biaya tetap (fixed cost) dan biaya variabel (variable cost) (Garrison, 1997). Biaya tetap adalah jenis-jenis biaya yang selama periode kerja pengoperasian usaha tetap dan tidak tergantung pada jumlah produk yang dihasilkan, sedangkan biaya variabel adalah biaya yang berubah sesuai dengan pertambahan jumlah produksi.
a. Keuntungan usaha (profit)
Keuntungan usaha digunakan untuk melihat keuntungan dari suatu usaha berdasarkan perhitungan finansial. Perhitungan besarnya keuntungan diperoleh dengan persamaan :
Dimana : TR = Total Revenue (Penerimaan total) TC = Total Cost (Biaya total)
Kriteria : TR > TC = usaha menguntungkan TR < TC = usaha rugi
TR = TC = impas b. Benefit/cost ratio (B/C Ratio)
Analisis ini digunakan untuk mengetahui sejauh mana hasil yang diperoleh dari usaha tertentu cukup menguntungkan dengan membandingkan antara penerimaan dengan biaya. Perhitungan B/C Ratio dihitung dengan persamaan :
B/C = CjPj
Dimana : Pj = NPV dari aliran uang tunai proyek mulai pada periode t=0 Cj = NPV dari biaya yang dikeluarkan mulai pada periode t= 1 Kriteria : B/C > 1 = usaha menguntungkan
B/C < 1 = usaha rugi B/C = 1 = usaha impas c. Net Present Value (NPV)
NPV adalah selisih harga sekarang antara penerimaan dan pengeluaran pada tingkat suku bunga tertentu. NPV merupakan salah satu metode menghitung selisih nilai sekarang investasi dengan penerimaan kas di masa yang akan datang. NPV dirumuskan dalam persamaan berikut :
NPV =
∑
= + − n t t i Ct Bt 1 (1 )Dimana : NPV = Net Present Value
Bt = Penerimaan total pada tahun ke-t Ct = Biaya total pada tahun ke-t
n = umur ekonomis proyek
Kriteria : NPV ≥ 0 = usaha layak untuk dilaksanakan NPV < 0 = usaha tidak layak dilaksanakan
d. Internal Rate of Return (IRR)
Usaha cendol instan layak dilaksanakan jika dioperasikan pada tingkat suku bunga di bawah suku bunga IRR, atau dengan kata lain nilai IRR lebih tinggi dari
tingkat suku bunga yang berlaku. Untuk mendapatkan nilai IRR dirumuskan dengan persamaan : IRR = i + ( ' '') '' ' ' i i NPV NPV NPV − −
Dimana : NPV’ = NPV dari ulangan i’ yang bernilai positif NPV’’ = NPV dari ulangan ii’ yang bernilai negatif
i’ = tingkat suku bunga yang memberikan NPV positif i’’ = tingkat suku bunga yang memberikan NPV negatif e. Break even Point (BEP)
Break even point atau titik impas merupakan titik dimana usaha yang dijalankan tidak memperoleh keuntungan maupun kerugian. Titik impas bisa dalam satuan jumlah produk atau dalam jumlah nilai penjualan. Titik impas dirumuskan dengan persamaan (Riyanto, 1996) :
BEP (Q) = ) ' (P VC FC − BEP (Rp) = ) /' ' 1 ( VC S FC −
Dimana : BEP (Q) = titik impas dalam unit
P = harga jual per unit
VC’ = biaya variabel per unit
VC’’ = biaya variabel total
FC = biaya tetap total
S = volume penjualan
f. Pay Back Period (PBP)
Pay back periode atau waktu pengembalian investasi adalah waktu yang dibutuhkan untuk mengembalikan seluruh investasi selama periode operasi. Pengembalian investasi dilakukan dengan pembayaran laba bersih ditambah dengan penyusutan (Madani, 2002). PBP dirumuskan sebagai berikut :
PBP = x tahun Periodik Penerimaan Awal Investasi 1