PERIODE PERTUMBUHAN RANGGAH
Abstrak
Aktivitas spermatogenesis dan kualitas semen pada muncak diduga
berhubungan erat dengan periode pertumbuhan ranggahnya seperti yang
dilaporkan pada spesies rusa lainnya. Sejauh mana keterkaitan tersebut perlu
dilakukan kajian untuk mengetahui tahapan spermatogenik pada periode
ranggah keras (RK); spermatogenesis dan kualitas semen pada periode casting
(C), ranggah velvet (RV), dan ranggah keras (RK). Jaringan testis diperoleh dari
seekor muncak jantan dewasa pada periode RK yang diproses menjadi sediaan
histologi dan diwarnai dengan pewarna hematoksilin-eosin (HE). Fragmen testis
dan semen (ejakulat) diperoleh dari dua ekor muncak jantan dewasa, yaitu ♂#2
dan ♂#3 selama periode C, RV, dan RK. Fragmen testis diperoleh dengan
metode core needle biopsy, diproses secara histologi dan diwarnai dengan
periodic acid
Schiff (PAS), sedangkan semen dikoleksi menggunakan metode
elektroejakulasi. Hasil pengamatan dengan metode morfologi tubular (pewarnaan
HE), ditemukan delapan tahap epitel tubuli seminiferi (tahap I-VIII) pada muncak
dengan frekuensi masing-masing tahapan yang bervariasi. Frekuensi tahap pre
meiosis
(tahap I-III), meiosis (tahap IV), dan post meiosis (tahap V-VIII)
berturut-turut adalah 47.75%, 6.87%, dan 43.37%, dengan durasi setiap tahapan adalah
5.07 hari, 0.73 hari, dan 4.81 hari. Aktivitas spermatogenesis ditemukan pada
ketiga periode ranggah (C, RV, dan RK), ditandai dengan adanya reaksi PAS
positif (warna magenta) pada akrosom round dan elongated spermatid. Lingkar
skrotum (cm) kedua muncak memperlihatkan perbedaan pada ketiga periode
ranggah, yaitu 13.05 ± 0.91 (C), 13.86 ± 0.51 (RV), dan 15.76 ± 0.30 (RK). Hasil
evaluasi semen pada periode C, RV, dan RK memperlihatkan adanya
spermatozoa motil dengan konsentrasi berbeda. Rataan konsentrasi
spermatozoa kedua muncak tertinggi (juta/ml) ditemukan pada periode RK
(506.25 ± 61.87), dan sedikit menurun pada periode C (288.75 ± 37.12), dan RV
(362.60 ± 17.68). Dapat disimpulkan bahwa aktivitas spermatogenesis untuk
menghasilkan spermatozoa tetap berlangsung walaupun muncak berada pada
periode C dan RV. Hal tersebut dibuktikan dengan ditemukannya spermatozoa
motil pada semen kedua muncak pada periode C dan RV.
Kata kunci: spermatogenesis, periode ranggah, muncak jantan, spermatozoa
Abstract
There was possibility that spermatogenic activity and quality of semen in
male muntjaks showed correlation to the antler cycle periods as reported in other
deer species. In order to know that correlation, the study concerning
spermatogenesis according to the identification of spermatogenic stages in hard
antler (RK) periods; spermatogenesis and semen quality in casting (C), velvet
antler (RV), and RK periods were important to be investigated. Testicular tissue
was found from an adult male muntjaks in hard antler period
and processed to
histological preparation that subsequently stained with hematoxylin-eosin (HE).
Additionally, testicular fragmen and semen were obtained from two adult male
muntjaks:
♂#2 and ♂#3 during C, RV, and RK periods. Core needle biopsy
method was applied to obtain testicular fragmen that processed histologically and
stained with periodic acid Schiff (PAS), whereas semen (ejaculate) was collected
using electroejaculation method. The results showed that there were eight stages
of seminiferi tubules epithelium (Stage I-VIII) according to the tubular morphology
method using HE staining in male muntjak with differentiation of frequency and
duration in each of stage. The frequency of pre meiosis (stage I to III), meiosis
(stage IV), and post meiosis (stage V to VIII) was 47.75%, 6.87%, and 43.37%
with duration 5.07, 0.73, and 4.81 days respectively. Spermatogenic activities
were observed in C, RV, and RK periods which were marked by PAS positive
staining (magenta) in round and elongated spermatid acrosomes. Scrotal
circumference (cm) differed in each antler periods: 13.05 ± 0.91 (C), 13.86 ± 0.51
(RV), and 15.76 ± 0.30 (RK). In addition, based on semen evaluation in C, RV,
and RK periods, motile spermatozoa were found with different concentration. The
highest amount of sperm (x 10
6spermatozoa/ml) in both of muntjaks was
appeared in RK (506.25 ± 61.87), and slightly decreased in C (288.75 ± 37.12),
and RV periods (362.60 ± 17.68). In conclusion, spermatogenesis to produce
spermatozoa is taken place while muntjaks are in C and RV periods that provable
with the existency of motile spermatozoa from ejaculates in both of male
muntjaks during C and RV periods.
Keywords: spermatogenesis, antler periods, male muntjak, spermatozoa
Pendahuluan
Spermatogenesis merupakan proses pembelahan dan diferensiasi sel
dengan produk akhir spermatozoa yang berlangsung di tubuli seminiferi testis.
Proses tersebut melibatkan sel-sel germinal testis, yaitu spermatogonia,
spermatosit dan spermatid serta didukung oleh sel somatis (sel Sertoli) dan sel
Leydig di jaringan interstisial. Spermatogenesis terbagai atas tiga proses penting,
yaitu spermatositogenesis (pembelahan mitosis), meiosis, dan spermiogenesis
(diferensiasi spermatid) (Johnson et al. 2000). Tahapan tubuli seminiferi
didefinisikan sebagai rangkaian perubahan yang terjadi pada suatu kelompok sel
germinal di sepanjang tubuli seminiferi. Satu siklus spermatogenik atau siklus
epitel tubuli seminiferi adalah seluruh perubahan yang terjadi di antara dua
proses spermiasis pada bagian tertentu dari tubuli seminiferi (de Kretser dan
Kerr 1994; Johnson et al. 2000).
Identifikasi dan penentuan tahapan tubuli seminiferi diperlukan untuk
mengetahui durasi satu siklus epitel tubuli seminiferi testis. Selain itu dapat pula
diketahui frekuensi dari tiap tahapan tubuli seminiferi (Bitencourt et al 2006).
Tahapan epitel tubuli seminiferi, frekuensi dan durasi masing-masing tahapan
pada muncak sampai saat ini belum dilaporkan. Ada dua metode yang umum
digunakan untuk mengamati tahapan epitel tubuli seminiferi. Metode pertama
adalah dengan melakukan pengamatan terhadap karakteristik komponen tubuli
seminiferi yang dikenal dengan metode morfologi tubular. Pewarnaan yang
sering digunakan untuk metode tersebut adalah pewarnaan hematoksilin-eosin
(HE) (Almeida et al. 2006). Metode kedua adalah pengamatan terhadap
diferensiasi spermatid pada proses spermiogenesis menggunakan pewarnaan
periodic acid
Schiff (PAS) (Dreef et al. 2007). Pengamatan spermatogenesis
pada periode ranggah keras dilakukan dengan metode morfologi tubular,
sedangkan untuk mengetahui aktivitas spermatogenesis pada periode casting
(C), ranggah velvet (RV), dan ranggah keras (RK) digunakan metode identifikasi
terhadap diferensiasi spermatid dengan pewarnaan PAS.
Produk akhir spermatogenesis adalah spermatozoa. Untuk mengetahui
karakteristik dan kualitas spermatozoa perlu dilakukan evaluasi terhadap semen.
Kualitas semen yang meliputi spermatozoa dan plasma semen merupakan salah
satu parameter pendukung untuk menentukan pola reproduksi pada Cervidae
jantan termasuk muncak. Pada red deer yang hidup di wilayah beriklim sedang,
kualitas semen menunjukkan perbedaan pada setiap periode reproduksinya,
yaitu pada periode pre-mating, mating dan post-mating. Kualitas semen terbaik
ditemukan pada saat periode musim kawin (mating) yang berlangsung dari akhir
September sampai akhir Oktober saat rusa tersebut berada pada periode RK.
Kondisi tersebut ditandai dengan tingginya libido rusa jantan untuk mengawini
betina (Gizejewski 2004). Handarini et al. (2004) menyatakan bahwa rusa timor
memiliki kualitas semen terbaik dan konsentrasi spermatozoa tertinggi saat rusa
tersebut berada pada periode RK.
Perbedaan kualitas semen pada setiap periode ranggah dapat dilihat dari
beberapa parameter pengamatan makroskopis seperti volume, warna dan
konsistensi dan pengamatan mikroskopis seperti: gerakan massa, motilitas,
konsentrasi, persentase hidup dan abnormalitas spermatozoa. Data yang
diperoleh dari pengamatan spermatogenesis dan kualitas semen, khususnya
karakteristik dan kualitas spermatozoa pada periode C, RV, dan RK dapat
digunakan untuk menentukan fertilitas muncak jantan selama satu siklus
ranggah. Oleh karena itu tujuan dari penelitian ini adalah: 1) menentukan jumlah
tahapan tubuli seminiferi, frekuensi dan durasi masing-masing tahapan pada
periode RK; 2) mengetahui aktivitas spermatogenesis melalui pengamatan
diferensiasi spermatid pada periode C, RV, dan RK; 3) menentukan kualitas
semen khususnya spermatozoa pada periode C, RV, dan RK. Informasi awal
terkait spermatogenesis dan kualitas spermatozoa muncak selama periode
pertumbuhan ranggah dapat digunakan untuk mendukung program
pengembangbiakan muncak, baik yang dilakukan dengan kawin alam maupun
penerapan teknologi reproduksi seperti inseminisasi buatan dengan
memanfaatkan semen segar atau semen hasil preservasi.
Bahan dan Metode
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Unit Rehabilitasi Reproduksi
(URR) Departemen Klinik, Reproduksi dan Patologi serta di Laboratorium Riset
Anatomi, Bagian Anatomi, Histologi dan Embriologi, Departemen Anatomi,
Fisiologi dan Farmakologi Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Penelitian ini dimulai dari bulan Januari 2009 sampai Juli 2010.
Hewan Penelitian
Tiga ekor muncak jantan dewasa digunakan pada penelitian ini, yaitu :
muncak ♂#1 (umur sekitar 4 tahun, bobot badan 19 kg); muncak ♂#2
(umur 5 tahun, bobot badan 19.5 kg); dan muncak ♂#3 (umur 3 tahun, bobot
badan 17 kg). Ketiga muncak dinyatakan sehat secara klinis dan memperlihatkan
aktivitas reproduksi yang berjalan normal. Penggunaan muncak sesuai dengan
Surat Keputusan Menteri Kehutanan Republik Indonesia Nomor: SK.
23/Menhut-II/2011. Muncak berasal dari Kabupaten Cilacap, Jawa Tengah dan dipelihara di
kandang individual berukuran 1 x 2 m
2yang dilengkapi dengan kandang terbuka
(kandang exercise) selama penelitian berlangsung. Pakan diberikan dua kali per
hari, pagi dan sore, berupa irisan wortel, rumput dan pelet, sedangkan air minum
diberikan secara ad libitum. Selama penelitian berlangsung, kedua muncak diberi
akses untuk berdekatan dengan muncak betina dewasa.
Bahan dan Alat
Bahan yang digunakan meliputi: anastetikum xylazine HCl 2% (Seton
®)
dan ketamin HCl 10% (Ketamil
®), kapas, kertas tisu, larutan iodin, antibiotik, NaCl
fisiologis, paraformaldehid 4%, larutan Bouin, alkohol dengan konsentrasi
bertingkat (70, 80, 90, 95 % dan absolut), silol, parafin, akuades, pewarna
hematoksilin-eosin (HE), pewarna periodic-acid Schiff (PAS), air sulfit, pewarna
Meyer’s hematoksilin dan bahan perekat Entelan®, pewarna eosin-negrosin,
pewarna William, kloramin 0.5%, glutaraldehid 2.5%, bahan perekat Neofren®
2%, asam tanin 2%, osmium tetraoksida (OsO
4), 1%, larutan t-butanol dan
platinum-paladium.
Sedangkan alat-alat yang digunakan adalah: spuit ukuran 5 ml, alat biopsi
tipe core needle biopsy (Dr. Japan
®, Toray) dengan jarum berukuran 14 gouce
(14G), pinset, wadah penyimpan jaringan, tissue cassette, gelas objek dan
penutup, inkubator 37
OC, inkubator parafin, blok kayu, bunsen, mikrotom, water
bath
, hot plate, termometer, pena parafin, kamera digital, micro caliper digital
(mm), pita ukur (cm), spuit 5 ml, elektroejakulator, tabung penampung semen
berskala, gelas objek dan gelas penutup, hot plate, gelas objek kecil ukuran
0.5 x 0.5 cm
2, pipet, hemositometer dan kamar hitung Neubauer, microtube,
sentrifus, micropipet, freeze dryer, ion coater, mikrometer eye piece, mikroskop
cahaya (Olympus CH30), mikroskop yang dilengkapi dengan kamera digital,
kamera digital (Sony Cybershoot DSC-W30) dan mikroskop elektron (scanning
electron microscope)
tipe JSM-5310LV, Japan.
Metode Penelitian
Penelitian ini terbagi atas beberapa kegiatan, yaitu: 1) pengamatan
tahapan epitel tubuli seminiferi testis, frekuensi dan durasi setiap tahapan pada
periode RK, 2) pengamatan spermatogenesis pada periode C, RV, dan RK, dan
3) pengamatan karakteristik dan kualitas spermatozoa muncak pada periode C,
RV, dan RK.
Spermatogenesis pada periode ranggah keras
Kegiatan ini menggunakan sampel testis dari seekor muncak jantan
dewasa (♂#1) yang berada pada periode RK. Jenis pewarnaan yang digunakan
pada kegiatan ini adalah pewarnaan HE. Prosedur dimulai dengan pembuatan
sediaan testis dengan urutan kerja seperti yang dilakukan pada penelitian I
1. Penentuan tahapan epitel tubuli seminiferi dan frekuensinya
Pengamatan tahapan epitel tubuli seminiferi menggunakan metode
morfologi tubular berdasarkan perubahan morfologi sel germinal yang ditemukan
di dalam sayatan melintang tubuli seminiferi testis. Selanjutnya, dilakukan
identifikasi dan penghitungan jumlah tahapan spermatogenesis. Untuk
menentukan frekuensi relatif dari masing-masing tahapan dilakukan
penghitungan terhadap 800 tubuli seminiferi. Penentuan durasi dari
masing-masing tahapan dilakukan dengan mengalikan nilai persentase masing-masing-masing-masing
tahapan tersebut dengan nilai durasi satu siklus epitel tubuli seminiferi kambing,
yaitu 10.6 hari (França et al. 1999). Hasil yang diperoleh merupakan suatu
asumsi nilai durasi spermatogenesis pada muncak.
2. Pengukuran diameter inti sel germinal testis
Pengukuran diameter inti sel germinal pada masing-masing tahapan
epitel tubuli seminiferi, dilakukan terhadap foto histologi testis dengan
perbesaran lensa objektif 40 kali dan telah dilengkapi dengan skala mikrometer
untuk perbesaran yang sama. Pengukuran inti sel germinal tubuli seminiferi
meliputi inti sel spermatogonia; spermatosit primer dalam fase leptotene,
pachytene
, zygotene dan diplotene; serta spermatid (round dan elongated
spermatid) menggunakan software ImageJ (McMaster Biophotonic Facility).
Jumlah inti sel yang diukur adalah 20 inti sel untuk setiap tipe sel.
Prosedur anastesi dan pengukuran morfometri testis
Pada kegiatan ini digunakan dua muncak, yaitu ♂#2 dan ♂#3. Kedua
muncak terlebih dahulu dianastesi menggunakan kombinasi anastetikum xylazin
HCl dan ketamin HCl, dengan dosis masing-masing 1 mg/kg berat badan
(Dradjat 2000). Muncak yang telah teranastesi ditempatkan pada posisi terbaring
pada sisi kanan agar rumen berada di bagian dorsal. Pengambilan data
morfometri testis muncak dalam skrotum meliputi panjang, lebar, dan lingkar
skrotum. Pengukuran morfometri menggunakan micro caliper digital dan pita
ukur. Selain itu juga dilakukan palpasi testis untuk mengetahui konsistensinya.
Kegiatan ini dilakukan pada periode C, RV, dan RK
Spermatogenesis selama periode pertumbuhan ranggah
Aspirasi fragmen testis kedua muncak dilakukan setelah pengukuran
morfometri testis dan skrotum. Metode biopsi yang diaplikasikan adalah metode
biopsi tertutup menggunakan alat biopsi tipe core needle biopsy (CNB). Biopsi
dilakukan sekali per periode pertumbuhan ranggah, yaitu periode C, RV, dan RK.
Dalam keadaan teranastesi, jarum biopsi ditusukkan ke bagian testis yang telah
ditentukan melewati kulit skrotum. Tekanan negatif dari alat (gun) biopsi
dilepaskan apabila jarum telah berada di dalam testis yang bertujuan untuk
memotong jaringan testis. Jaringan testis yang diperoleh selanjutnya difiksasi di
dalam larutan Bouin selama 24 jam dan diproses hingga menjadi preparat
histologi. Pembuatan preparat tersebut sama dengan prosedur pada kegiatan
sebelumnya. Preparat histologi testis dengan ketebalan sayatan 2-3 µm
selanjutnya diwarnai dengan pewarnaan PAS dengan prosedur sebagai berikut:
1. Preparat histologi dideparafinisasi dalam larutan silol dengan tiga kali
ulangan dan dilanjutkan dengan rehidrasi dalam alkohol dari konsentrasi
absolut sampai konsentrasi 70%.
2. Perendaman preparat dalam larutan periodic acid selama 5 menit dan
dibilas dengan akuades.
3. Inkubasi dengan larutan Schiff (Schiff reagent) selama 30 menit pada
temperatur ruangan. Setelah reaksi positif terbentuk, dilakukan
pembilasan dengan air sulfit dan dilanjutkan dengan akuades.
4. Pewarnaan latar (counterstain) dengan larutan Meyer’s hematoksilin, dan
dibilas dengan akuades.
5. Dehidrasi preparat dalam alkohol dengan konsentrasi bertingkat dan
clearing
dalam larutan silol.
6. Tahap terakhir adalah penutupan jaringan dengan gelas penutup
(mounting)
menggunakan bahan perekat Entellan®.
Pengamatan hasil pewarnaan dilakukan dengan mikroskop cahaya dengan
perbesaran objektif 40 kali. Reaksi PAS positif ditandai dengan terbentuknya
warna merah-keunguan (magenta) pada akrosom spermatid.
Karakteristik dan Kualitas Semen Muncak
Koleksi semen
Koleksi semen muncak ♂#2 dan ♂#3 dilakukan sekali per periode
ranggah (C, RV, dan RK) yang ditampung sebelum aspirasi jaringan testis.
Penampungan semen menggunakan elektroejakulator dengan stimulator AC
100 Hz dan probe rektal berdiameter 1.5 dengan empat elektroda sirkular
(Fujihira, FHK), mengacu pada prosedur yang dilakukan oleh Dradjat (2002) dan
Prasetyaningtyas et al. (2006), yaitu:
1. Penis dikeluarkan dari preputium dan dicuci dengan NaCl fisiologis
hingga bersih.
2. Tabung gelas penampung semen yang dilengkapi dengan skala ukuran
volume semen terlebih dahulu disterilkan. Selanjutnya ujung penis
ditempatkan di tengah tabung gelas penampung.
3. Probe ejakulator diberi vaseline dan dimasukkan kedalam rektum dengan
kedalaman sekitar 10 cm dengan posisi elektroda probe mengarah ke
bagian ventral ruang pelvis.
4. Stimulasi listrik dilakukan secara bertahap dengan voltase antara
3 V sampai 7 V selama 5 detik per voltase dan diulangi sebanyak tiga
kali ulangan dengan interval setiap ulangan selama 5 detik. Proses ini
dilakukan hingga semen diperoleh. Setelah semen terkumpul, stimulasi
listrik dihentikan atau setelah 2 menit walaupun semen tidak berhasil
dikoleksi.
Evaluasi semen
Cairan semen yang terkumpul pada tabung pengumpul, selanjutnya
dievaluasi secara makroskopis untuk mengetahui warna, volume, dan pH dan
secara mikroskopis untuk menentukan konsentrasi spermatozoa, motilitas
spermatozoa, prosentase spermatozoa hidup dan abnormalitas, serta morfologi
spermatozoa individual. Prosedur evaluasi mikroskopis terhadap semen muncak
adalah:
1. Konsentrasi spermatozoa
Pengamatan terhadap konsentrasi spermatozoa dilakukan dengan
menggunakan hemositometer dan kamar hitung Neubauer. Semen diteteskan
pada ujung gelas penutup yang berada di atas gelas objek. Cairan yang mengalir
diamati dengan penghitungan pada kamar hitung, dengan ketentuan: konsentrasi
spermatozoa adalah jumlah spermatozoa yang diperoleh dikalikan dengan faktor
pengencer serta faktor hemositometer.
2. Motilitas spermatozoa
Semen diteteskan pada gelas objek dan ditutup dengan gelas penutup,
selanjutnya diamati di bawah mikroskop dengan melihat aktivitas gerak progresif
spermatozoa per individu. Penilaian dilakukan dengan skoring dalam kisaran
0–100% pada skala 5%.
3. Presentase spermatozoa hidup dan abnormalitas
Semen diteteskan pada gelas objek dan diwarnai dengan eosin 2% dan
dibuat preparat ulas secara tipis dan merata, kemudian diamati dibawah
mikroskop. Spermatozoa yang mati akan menyerap warna eosin, sedangkan
yang mati tidak menyerap warna eosin. Abnormalitas spermatozoa dapat diamati
dari morfologi spermatozoa.
4. Morfologi spermatozoa individual
Pengamatan terhadap morfologi spermatozoa secara individual dilakukan
dengan dua metode, yaitu 1) preparasi semen dengan pewarnaan William untuk
pengamatan morfologi dan morfometri spermatozoa menggunakan mikroskop
cahaya, dan 2) preparasi semen untuk pengamatan ultrastruktur spermatozoa
menggunakan SEM.
Prosedur pewarnaan William terhadap sampel semen muncak mengacu
prosedur yang dilakukan Yudi et al. (2010). Pengamatan morfologi dilakukan
dengan mikroskop cahaya dengan mengamati bentuk kepala dan ekor
spermatozoa normal dan abnormal dan selanjutnya difoto dengan kamera
mikroskop. Pengukuran morfometri spermatozoa individual yang meliputi
panjang dan lebar kepala, serta panjang ekor dari 100 spermatozoa kedua
muncak pada periode RV dan RK. Pengukuran dilakukan dengan menggunakan
mikrometer eye piece yang telah dikalibrasi sesuai dengan tipe mikroskop yang
digunakan pada perbesaran lensa objektif 40 kali. Prosedur preparasi SEM
yang dilakukan pada penelitian ini mengacu pada prosedur yang dilakukan
Prasetyaningtyas et al. (2004).
Analisis Data
Data pengamatan spermatogenesis dan tahapan epitel tubuli seminiferi
atau tahapan spermatogenik testis dianalisis secara deskriptif dan disajikan
dalam bentuk gambar, sedangkan untuk nilai durasi spermatogenesis dan
ukuran diameter inti sel germinal ditabulasikan dalam nilai rataan ± SB. Data
pengamatan spermatogenesis pada periode C, RV, dan RK dengan pewarnaan
PAS dianalisis secara deskriptif dengan pemberian skor. Kriteria skor terdiri
atas: +++: banyak; ++: sedang; + sedikit, dan -: tidak ditemukan. Kualitas
semen dianalisis secara diskriptif dalam bentuk rataan dan gambar.
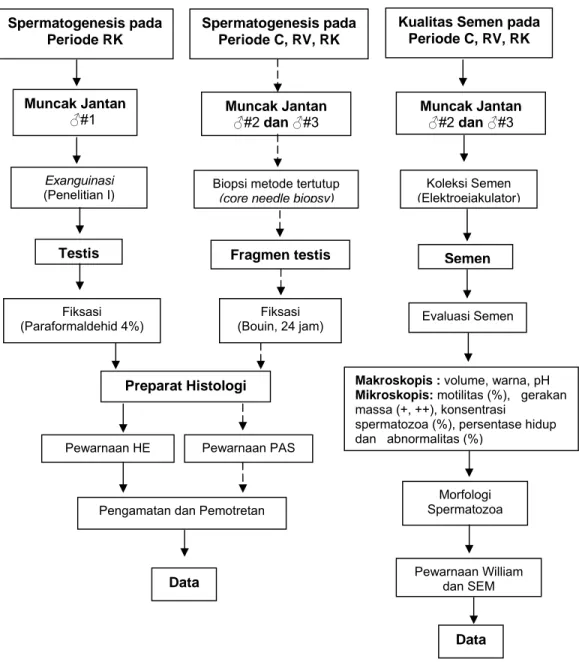
Gambar 44 Bagan alir disain penelitian IV: spermatogenesis dan kualitas semen muncak selama periode pertumbuhan ranggah. Casting (C), ranggah keras (RK), ranggah velvet (RV), hematoksilin dan eosin (HE), periodic acid Schiff (PAS), scanning electron microscope (SEM).
Pengamatan dan Pemotretan
Data Morfologi Spermatozoa Pewarnaan William dan SEM Data
Pewarnaan HE Pewarnaan PAS
Preparat Histologi Makroskopis : volume, warna, pH Mikroskopis: motilitas (%), gerakan massa (+, ++), konsentrasi
spermatozoa (%), persentase hidup dan abnormalitas (%)
Muncak Jantan ♂#2 dan ♂#3
Biopsi metode tertutup
(core needle biopsy)
Fragmen testis Testis Muncak Jantan ♂#1 Exanguinasi (Penelitian I) Fiksasi (Bouin, 24 jam) Fiksasi (Paraformaldehid 4%) Koleksi Semen (Elektroejakulator) Evaluasi Semen Semen Spermatogenesis pada Periode RK Spermatogenesis pada Periode C, RV, RK Muncak Jantan ♂#2 dan ♂#3 Kualitas Semen pada
Hasil dan Pembahasan
Spermatogenesis pada Periode Ranggah Keras
Penentuan tahapan (staging) dari satu siklus spermatogenik atau siklus
epitel tubuli seminiferi testis muncak dilakukan berdasarkan karakteristik
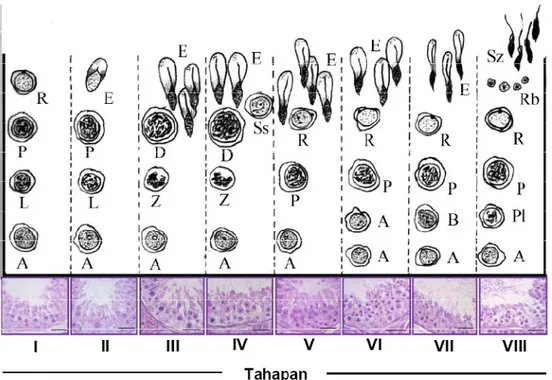
morfologi komponen tubuli seminiferi (Gambar 45). Terdapat delapan tahap
epitel tubuli seminiferi pada muncak yang diamati pada periode ranggah keras
dengan gambaran masing-masing tahapan sebagai berikut:
Tahap I
Pada tahap ini ditemukan spermatid berinti bulat atau round spermatid
(R) dengan granul preakrosom (PG) yang membentuk beberapa lapis sel pada
epitel tubuli. Nuklei sel Sertoli dapat diamati dengan sitoplasma pucat dan
nukleoli berukuran kecil. Pada membran basal tubuli ditempati oleh
spermatogonia, sedangkan spermatosit primer tipe pachytene (P) yang terletak
diantara spermatogonia dan inti sel Sertoli (Gambar 45A).
Tahap II
Karakteristik tahap ini adalah munculnya spermatid berinti lonjong atau
elongated
spermatid (E) yang berdiferensiasi dari spermatid R dengan posisi
ujung kepala mengarah ke nukleus sel Sertoli. Sel lainnya adalah spermatogonia
dan spermatosit primer tipe leptotene (L) dan P (Gambar 45B).
Tahap III
Pada tahap ini spermatid tipe R mulai mengumpul (berkelompok) dengan
posisi kepala mengarah ke membran basal dan nukleus sel Sertoli. Spermatosit
primer beriferensiasi membentuk spermatosit tipe L dan P. Selain itu
spermatogonia dan sel Sertoli juga ditemukan pada tahapan ini (Gambar 45C).
Tahap IV
Ciri khas tahap ini adalah terjadinya proses pembelahan meosis dari
spermatosit diplotene (D) menjadi spermatosit sekunder (haploid) yang akan
berdiferensiasi menjadi spermatid tipe R. Spermatosit primer tipe P juga
ditemukan di lapisan atas sel spermatogonia (Gambar 45D).
Tahap V
Pada tahap ini ditemukan spermatid R yang berasal dari pembelahan
meiosis spermatosit sekunder. Ukuran dan bentuk inti sel antara spermatosit
sekunder dan spermatid R sangat mirip, sehingga keduanya sulit dibedakan.
Kumpulan spermatid tipe E juga ditemukan dengan beberapa sel yang berada
hampir mendekati membran basal dan nukleus sel Sertoli serta diantara sel-sel
epitel tubuli. Sama seperti tahap sebelumnya, spermatogonia dan sel Sertoli juga
dapat diamati. Sedangkan spermatosit primer ditemukan dengan tipe zygotene
(Z) dan D (Gambar 45E).
Tahap VI
Gambaran
tahap
VI ini mirip dengan tahap sebelumnya (tahap V), yaitu
tubuli seminiferi diisi oleh spermatid tipe R dan E, spermatosit primer tipe Z dan
D, spermatogonia dan sel Sertoli. Ciri khas dari tahap ini adalah ditemukannya
kumpulan spermatid tipe E yang mulai memisahkan diri dan mengarah ke lumen
tubuli (Gambar 45F).
Tahap VII
Spermatid tipe E yang berkelompok dengan bentuk kepala dan ekor yang
semakin jelas berada pada posisi sejajar di permukaan lumen tubuli seminiferi
sebelum dilepaskan ke dalam lumen tubuli seminiferi. Sel germinal lainnya
adalah spermatogonia, spermatosit primer tipe Z dan D, spermatid tipe E dengan
PG, serta sel Sertoli (Gambar 45G).
Tahap VIII
Tahapan ini merupakan tahapan terakhir dari siklus tubuli seminiferi testis
muncak. Ciri khas pada tahap ini adalah ditemukannya tahap akhir diferensiasi
spermatid tipe E dan terjadinya porses pelepasan spermatozoa dari epitel tubuli
menuju lumen tubuli. Selain itu ditemukan pula badan residu (residual bodies)
yang merupakan sisa sitoplasma spermatid yang telah mengalami spermiasis.
Sel lainnya adalah spermatid tipe R dengan PG, spermatosit primer P dan
spermatogonia di membran basal tubuli (Gambar 45H).
Gambar 45 De (P (M Ta elapan tahapan e P), dan round spe M), R, dan E. Tah ahap VIII (VIII): S
epitel tubuli semin ermatid (R). Taha hap V (V): Sg, Z, g, spermatosit pr niferi muncak. Ta ap II (II): Sg, L, P , P, R, E, dan se releptotene (Pl), P
ahap I (I): sperma P, dan E. Tahap I el Sertoli (S). Tah P, R, S, residual b atogonia (Sg), spe III (III): Sg, Z, D, hap VI (VI): Sg, P bodies (Rb), dan ermatosit primer dan E. Tahap IV P, R, E, dan S. T spermatozoa (Sz leptotene (L), sp V (IV): Sg, Z, D, p Tahap VII (VII): z). Pewarnaan HE ermatosit pachyt pembelahan meio Sg, P, R, E, dan E. Skala: 30 µm. ene osis n S.
139
Gambar 46 Skema delapan tahapan epitel tubuli seminiferi testis muncak. Tahap I-VIII dicirikan dengan tipe sel spesifik yang berdiferensiasi untuk menghasilkan spermatozoa. Spermatogonia A (A), dan spermatogonia B (B); spermatosit primer: preleptotene (Pl), leptotene (L), zygotene (Z), pachytene (P), dan diplotene (D); spermatid sekunder (Ss); spermatid bulat/round spermatid (R) dan elongated spermatid (E); spermatozoa (Sz); dan residual bodies (Rb). Pewarnaan HE, skala 30 µm (tahap I-VIII).
Delapan tahapan epitel tubuli seminiferi testis muncak pada periode
ranggah keras dapat diidentifikasi dengan jelas berdasarkan pengamatan
karakteristik sel-sel epitel germinal pada setiap tahapan. Metode ini sebelumnya
telah diaplikasikan pada beberapa spesies mamalia seperti babi (França dan
Cardoso 1998), kambing (França et al. 1999), babi liar (Almeida et al. 2006), dan
domba garut (Basrizal 2007). Ada delapan tahapan epitel tubuli seminiferi yang
diidentifikasi pada ruminansia dan beberapa spesies mamalia seperti kambing
(França et al. 1999; Onyango et al. 2000), babi landrace (Garcia-Gil et al. 2002),
keledai (Neves et al. 2002), roe deer (Schoen et al. 2004), babi liar
(Almeida et al. 2006), puma (Leite et al. 2006), da rusa timor (Handarini 2006;
Gambar 46 memperlihatkan perkembangan sel germinal tubuli seminiferi
testis muncak yang dimulai dari spermatogonia sampai spermatozoa (tahap
I-VIII). Perkembangan sel germinal selama spermatogenesis pada muncak
memperlihatkan kemiripan dengan beberapa spesies lainnya, yaitu kerbau rawa
(McCool et al. 1988), keledai (Neves et al. 2002), puma (Leite et al. 2006), babi
(Almeida et al. 2006), serta kucing, jaguar, dan cougar (Costa et al. 2006).
Spermatogonia A yang berada pada membran basal tubuli (tahap I-VI)
berdiferensiasi menjadi spermatogonia B pada tahap VII, dengan bentuk nukleus
yang lebih tebal dan struktur kromatin yang mulai memadat. Pada tahap VIII,
spermatogonia B berdiferensiasi menjadi spermatosit primer tipe preleptotene.
Perubahan tipe spermatogonia pada tahap VI dan perkembangan menjadi
spermatosit primer pada tahap VIII berbeda dengan ruminansia lainnya seperti
kambing (Franca et al. 1999). Pada spesies tersebut ditemukan spermatogonia
tipe intermediate pada tahap V dan VI. Spermatogonia intermediate selanjutnya
berdiferensiasi menjadi spermatogonia tipe B pada tahap VII dan VIII.
Spermatosit primer tipe preleptotene berkembang menjadi spermatosit
primer tipe leptotene pada tahap I dan II, serta spermatosit primer tipe zygotene
pada tahap III-V. Pada tahap V, spermatosit primer tipe zygotene berkembang
menjadi tipe pachytene (tahap V-VIII, serta tahap I-II), dan selanjutnya pada
tahap III berdiferensiasi menjadi spermatosit pachytene, dan diplotene yang
ditandai dengan ukuran inti lebih besar dari pada pachytene. Spermatosit
diplotene
mengalami pembelahan meiosis menjadi spermatosit sekunder pada
tahap IV yang memiliki ukuran hampir sama dengan spermatid bulat (round
spermatid)
, namun spermatosit sekunder sulit ditemukan karena waktu
pembelahan yang singkat (Senger 2005) dan akan segera berdiferensiasi
menjadi spermatid bulat yang ditemukan pada tahap V–VIII, dan tahap I. Pada
tahap II spermatid bulat mulai memanjang dan terus berdiferensiasi sampai
tahap VIII. Pada tahap VII dan VIII, inti spermatid memanjang dengan ukuran inti
sel lebih kecil, karena adanya suatu mekanisme fisiologi pemadatan inti yang
telah diselubungi oleh akrosom dan akhirnya berdiferensiasi menjadi
spermatozoa yang dilepaskan ke lumen tubuli pada tahap VIII (Kwan 2002).
Dalam satu sayatan melintang tubuli seminiferi muncak terkadang dapat
ditemukan beberapa tahapan (multistage), seperti yang ditemukan pada primata
(Wistuba et al. 2003). Hal ini terjadi karena ukuran sel hasil pembelahan mitosis
(spermatogonia dan spermatosit primer) yang baru masih berukuran kecil,
sehingga ada ruang untuk berkembangnya sel-sel spermatogenik baru dengan
tahap satu tingkat lebih rendah dibandingkan dengan tahap yang telah
berkembang sebelumnya (Ehmcke et al. 2005). Teramatinya satu atau lebih
tahapan dalam satu sayatan melintang tubuli seminiferi, tidak menunjukkan tinggi
rendahnya kemampuan spermatogenesis atau kemampuan fertilisasi
spermatozoa hewan jantan (Wistuba et al. 2007). Pada muncak, dalam satu
sayatan melintang tubuli seminiferi, umumnya hanya ditemukan satu tahapan,
walaupun ada beberapa tubuli yang memiliki dua sampai tiga tahapan. Hal yang
sama dilaporkan pada ruminansia lain, seperti kambing (Onyango et al. 2000)
dan sapi bali (McCool 1989) serta pada mamalia lain, seperti babi hutan
(Garcia-Gil et al. 2002), keledai (Neves et al. 2003), puma (Leite et al. 2006), dan
rodensia (Paula et al. 1999).
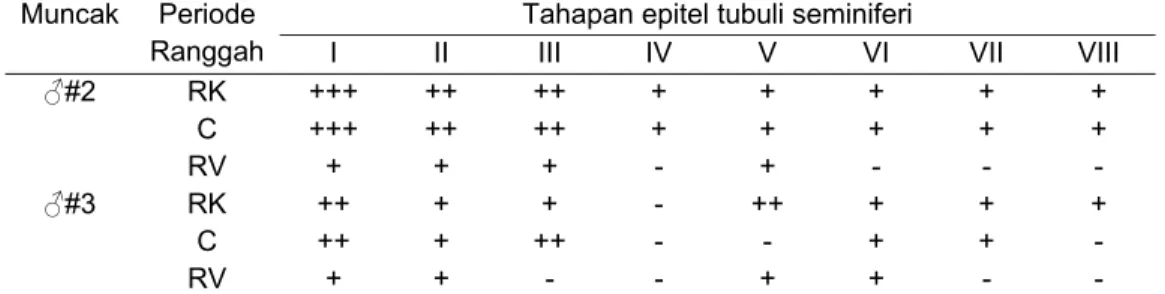
Frekuensi dan durasi tahapan tubuli seminiferi
Frekuensi relatif dari setiap tahapan (tahap I-VIII) dikelompokkan menjadi
tahap pre meiosis (tahap I-III), tahap meiosis (tahap IV), dan tahap post meiosis
(tahap V-VIII). Frekuensi relatif setiap tahapan disajikan pada Tabel 13 dan
Gambar 47. Frekuensi tahapan epitel tubuli seminiferi tertinggi ditemukan pada
tahap III (17.75%), sedangkan yang paling rendah terdapat pada tahap IV
(6.87%). Frekuensi tahap pre-meiosis (tahap I-III) adalah 47.75 %, tahap meiosis
(tahap IV) adalah 6.87 %, dan tahap post-meiosis (tahapan V-VIII) adalah
45.37%. Hasil ini menunjukkan bahwa pada muncak frekuensi tahap pre-meiosis
memiliki nilai lebih besar dibandingkan tahap meiosis dan post-meiosis. Hasil ini
mirip dengan frekuensi per tahap pada kerbau rawa (McCool et al. 1988), sapi
bali (McCool 1989), kambing (França et al.1999, Onyango et al. 2000) dan
domba garut (Basrizal 2007). Perbedaan nilai frekuensi tahapan
spermatogenesis bersifat spesifik spesies yang disebabkan oleh adanya
pengaruh genetik, lamanya waktu yang dibutuhkan untuk mencapai dewasa
kelamin, dan perilaku kawin (musiman atau terjadi sepanjang tahun)
(Neves et al. 2002).
Tahapan pre meiosis (tahap I-III) atau yang dikenal sebagai proses
spermatositogenesis, merupakan suatu proses proliferasi satu spermatogonia
secara mitosis dan menghasilkan dua spermatogonia lain dengan tipe sama dan
bersifat diploid. Durasi pada tahap IV menunjukkan proses tersingkat dalam
spermatogenesis muncak, yaitu proses meiosis. Meiosis merupakan suatu
s
s
Tubuli seminif Rataan Frekue (%) Durasi Gproses diha
bersifat dipl
spermiogen
spermatozo
proses sper
Tabel 13 F
I feri 119 n±SB 59.5±3 ensi 14.8 (hari) 1.58 Gambar 47 P e d S p ( sasilkannya s
loid
. Tahapa
esis adala
a matang y
miasis (Sen
Frekuensi da
II 9 121 3.5 60.5±7.8 7 15.12 8 1.6 Perkembanga epitel tubuli s durasi, dan Spermatogoni preleptotene ( D); spermato spermatid lonjspermatid h
an post meio
ah suatu
yang akan
ger 2005).
an durasi del
Tahapan III 142 71±5.7 27 17.75 1.89 an sel germina seminiferi mu huruf dalam ia A (A) d (Pl), leptoten osit sekunder jong (elongathaploid
dari
osis
(tahap
proses d
dilepaskan
apan tahapa
n epitel tubuli IV V 55 5 7.5±4.9 29.5 6.87 7.3 0.73 0.7al, durasi spe uncak. Lebar setiap kolo an spermato ne (L), zygote r (II); sperma ted spermatid
spermatos
V-VIII) atau
diferensiasi
ke lumen t
an epitel tub
i seminiferi V VI 9 99 ±3.5 49.5±3. 37 12.37 78 1.31 ermatogenesis tiap tahapan om menunjuk ogonia B (B ene (Z), pach atid bulat (ro d) (E); serta spit primer ya
u yang diken
spermatid
tubuli semin
buli seminifer
VII 104 .5 52±2.8 13.0 1.38 s, dan frekue n menunjukka kkan tipe se B); spermato hytene (P), da ound spermat permatozoa (ang masih
nal dengan
menjadi
niferi pada
ri muncak
To VIII 101 80 50.5±3.5 12.62 10 1.34 10 ensi tahapan an lamanya el germinal. osit primer: an diplotene tid) (R) dan Sz). otal 00 00 0.6Penetapan durasi spermatogenesis untuk tiap tahapan pada muncak,
dilakukan dengan menggunakan nilai durasi dari satu siklus epitel tubuli
seminiferi testis kambing, yaitu 10.6 hari (França et al. 1999). Hal ini bertujuan
untuk memprediksi durasi spermatogenesis atau waktu yang dibutuhkan untuk
satu siklus epitel tubuli seminiferi pada muncak. Pemilihan nilai durasi kambing
tersebut dikarenakan nilai durasi spermatogenesis kambing cenderung lebih
konstan dibandingkan rusa totol atau chital deer (Loudon dan Curlewis 1988).
Durasi tahapan epitel tubuli seminiferi tersingkat ditemukan pada tahap IV
(0.73 hari), diikuti tahap V (0.78 hari), sedangkan durasi terlama ditemukan pada
tahap III (1.89 hari). Tahap pre meosis merupakan tahap dengan durasi terlama
dibandingkan tahap meiosis dan post meiosis. Durasi ketiga tahap tersebut
berturut-turut adalah 5.07 hari, 0.73 hari, dan 4.81 hari.
Tahapan pre-meiosis memperlihatkan frekuensi lebih besar dan durasi
yang lebih panjang dibandingkan dengan tahapan meiosis dan post-meiosis. Hal
tersebut berhubungan dengan life span spermatosit primer yang lebih panjang
dibandingkan dengan life span spermatosit sekunder yang ditemui pada tahapan
post meiosis
(de Kretser dan Kerr 1994). Pada kondisi patologis, frekuensi relatif
dari tahapan pre-meiosis, meiosis, dan post-meiosis dapat digunakan sebagai
indikator
adanya
perubahan
kinetik
dari
proses
spermatogenesis
(Hess et al. 1990). Perubahan yang terjadi pada proses tersebut berpengaruh
terhadap produksi spermatozoa harian per gram testis (França dan Cardoso
1998; Johnson et al. 2000). Menurut Costa et al. (2008), pengetahuan mengenai
durasi spermatogenesis pada suatu spesies bermanfaat untuk menentukan
efisiensi spermatogenesis atau produksi spermatozoa harian yang dapat
dikomparasikan dengan spesies hewan lainnya.
Almeida et al. (2006) menyatakan, untuk mengetahui durasi
spermatogenesis secara tepat, diperlukan suatu metode khusus dengan
menginjeksi thymidine sebagai bahan pelacak pada proses pembelahan sel.
Thymidine
diinjeksikan secara intratestikular, kemudian setelah melalui periode
waktu tertentu, testis diambil dengan cara kastrasi (Costa et al. 2010) atau
melalui prosedur biopsi (Leite et al. 2006). Jaringan testis yang diperoleh
selanjutnya diproses menjadi preparat histologi dan diwarnai dengan pewarnaan
toluidine blue
. Metode lain yang umum digunakan menurut Nakai et al. (2004)
adalah penggunaan bromodeoxyuridine (BrdU) yang disuntikkan secara
intraperitoneal. Pada hewan eksotik dan dilindungi seperti muncak dengan
jumlah individu yang terbatas, metode tersebut belum dapat dilakukan, sehingga
diperlukan suatu asumsi durasi spermatogenesis kambing untuk memberikan
gambaran mengenai durasi spermatogenesis pada muncak.
Diameter inti sel germinal tubuli seminiferi testis
Diameter inti sel germinal pada setiap tahapan epitel tubuli seminiferi
ditampilkan pada Tabel 14
.
Diameter inti spermatogonia, spermatosit primer
preleptotene
hingga diplotene yang ditemukan pada tahapan tertentu mengalami
peningkatan. Diameter inti spermatogonia dari tahap I sampai tahap VIII
mengalami perkembangan dengan rataan diameter pada tahap I adalah
4.07 ± 0.89 µm. Diameter pada tahap VIII meningkat sebesar 4.5% menjadi
4.46 ± 0.66 µm. Diameter inti spermatosit primer preleptotene hanya dapat diukur
pada tahap VIII, yaitu 5.15 ± 0.66 µm. Ukuran tersebut sedikit lebih kecil
dibandingkan tahap leptotene dengan diameter terbesar pada tahap II, yaitu
5.33 ± 0.32 µm. Spermatosit primer zygotene juga mengalami perkembangan
sebesar 2.2% yang diamati pada tahap III-V. Spermatosit primer pachytene
ditemukan pada tahap I, II, dan tahap V-VII, dengan diameter terbesar ditemukan
pada tahap II, yaitu 7.81 ± 0.36 µm. Spermatosit primer diplotene merupakan tipe
spermatosit dengan ukuran inti sel terbesar dibandingka inti sel germinal lainnya,
yaitu 8.97 ± 1.0 µm yang hanya ditemukan pada tahap III dan IV. Diameter inti
sel spermatid bulat (round spermatid) relatif stabil pada kisaran 5.32-5.84 µm.
Secara umum, diameter inti sel germinal testis muncak lebih kecil
dibandingkan diameter inti sel germinal sapi pedaging. Diameter spermatogonia
B, spermatosit primer pachytene, dan spermatid sapi pedaging, berturut-turut
adalah: 9.2 ± 0.3 µm, 11.4 ± 0.4 µm, dan 7.5 ± 0.5 µm (Cerelli dan
Johnson 1999). Pengukuran inti sel germinal muncak pada periode RK penting
untuk dilakukan. Data yang diperoleh merupakan data awal untuk mengetahui
ada tidaknya perbedaan diameter inti sel germinal pada saat periode ranggah
lainnya (C dan RV). Selain itu, data tersebut dapat digunakan untuk mengetahui
potensi produksi spermatozoa harian per gram testis (efisiensi spermatogenesis)
pada muncak, baik pada periode RK, maupun periode C, dan RV. Pada sapi
pedaging, data diameter inti germinal tersebut digunakan untuk mengetahui
pengaruh pemberian suplemen tertentu terhadap laju degenerasi sel germinal
yang berpengaruh terhadap produksi spermatozoa harian per gram testis (Cerelli
dan Johnson 1999; Johnson et al. 2000).
Tabel 14 Diameter inti sel germinal tubuli seminiferi testis muncak
No. Tipe sel germinal Ukuran inti sel (µm) / Tahap
I II III IV V VI VII VIII 1 Spermatogonia 4.07 ± 0.79 4.11 ± 0.13 4.09 ± 0.91 4.28 ± 0.44 4.33 ± 0.11 4.42 ± 0.17 4.50 ± 0.75 4.46 ± 0.66 2 Spermatosit primer a. preleptotene - - - 5.15 ± 0.66 b. leptotene 5.29 ± 0.25 5.33 ± 0.52 - - - c. zygotene - - 5.76 ± 0.42 5.98 ± 0.53 6.02 ± 0.89 - - - d. pachytene 7.18 ± 0.33 7.81 ± 0.36 - - 6.94 ± 0.41 6.39 ± 0.35 6.59 ± 0.29 6.92 ± 0.48 e. diplotene - - 8.97 ± 1.01 8.72 ± 0.17 - - - - 3 Round spermatid 5.32 ± 0.38 - - 5.84 ± 0.12 5.63 ± 0.41 5.32 ± 0.32 5.81 ± 0.37 5.56 ± 0.14 4 Elongated spermatid 4.35 ± 0.19 5.19 ± 0.43 5.44 ± 0.37 6.05 ± 0.36 6.43 ± 0.38 5.78 ± 0.53 5.71 ± 0.35
146
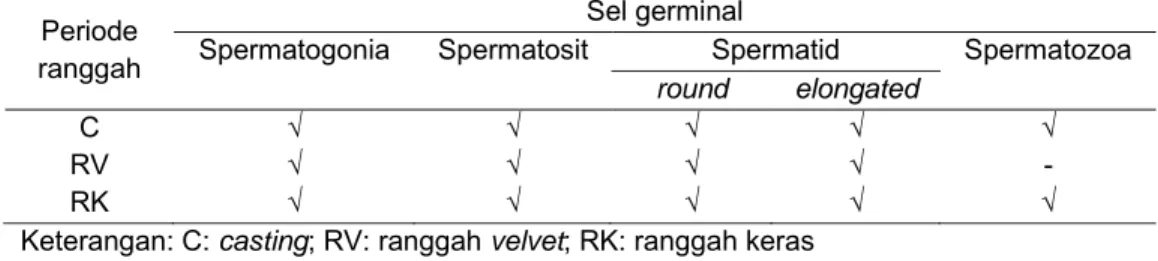
Spermatogenesis Selama Periode Pertumbuhan Ranggah
Deteksi spermatogenesis dari fragmen testis hasil biopsi yang diwarnai
dengan pewarnaan periodic acid-Schiff (PAS) pada setiap periode ranggah
(C, RV, dan RK) dapat diamati pada penelitian ini. Keberadaan spermatid yang
meliputi spermatid bulat (round spermatid) dan spermatid lonjong (elongated
spermatid)
pada tubuli seminiferi testis muncak ditampilkan pada Gambar 48 dan
Tabel 15 dan 16. Tahapan epitel tubuli seminiferi testis (I-VIII) pada periode
ranggah keras (RK), casting (C) dan ranggah velvet (RV) dapat diamati
(Tabel 15). Pada periode RK, ditemukan tahap I-VIII dari sayatan melintang
fragmen testis ♂#3, sedangkan pada ♂#2, tahap IV tidak ditemukan. Pada
periode C, ditemukan tahap I-VIII (♂#3), sedangkan pada ♂#2 hanya ditemukan
tahap I, II, III, VI dan VII. Dari ketiga periode ranggah, pada periode RV hanya
ditemukan tahap I-III dan V pada ♂#3, dan tahap I, II, V dan VI pada ♂#2.
Tabel 15 Tahapan epitel tubuli seminiferi testis pada setiap periode ranggah.
Muncak PeriodeRanggah
Tahapan epitel tubuli seminiferi
I II III IV V VI VII VIII
♂#2 RK +++ ++ ++ + + + + + C +++ ++ ++ + + + + + RV + + + - + - - - ♂#3 RK ++ + + - ++ + + + C ++ + ++ - - + + - RV + + - - + + - -
Keterangan: kriteria skoring tahapan epitel tubuli seminiferi testis: +++: banyak; ++: sedang; + sedikit dan -: tidak ditemukan.
Perbedaan pemunculan tahapan pada kedua muncak selama periode
RK, C, dan RV disebabkan oleh kecilnya ukuran sampel yang diperoleh dari
metode core needle biopsy (2-3 mm), sehingga dalam satu fragmen testis
gambaran tubuli seminiferi dengan tahap yang berbeda tidak ditemukan. Namun
demikian, aktivitas spermatogenesis tetap berlangsung. Hal tersebut dibuktikan
dengan ditemukannya kedelapan tahapan epitel tubuli seminiferi dari fragmen
testis ♂#2 pada periode RK dan C.
Gambar 47A - 47F memperlihatkan perkembangan sistem akrosom
spermatid berdasarkan adanya reaksi PAS positif saat berlangsungnya
diferensiasi spermatid bulat menjadi spermatid lonjong dan spermatozoa. Reaksi
PAS positif dengan visualisasi warna merah-keunguan (magenta) menandakan
keberadaan karbohidrat netral pada jaringan testis yang diperlukan selama
proses
sperm
pada f
Gambas spermato
matid bulat p
fase maturas
ar 48 Sperma ranggah velvet ( magent spermaogenesis be
pada fase go
si.
atogenesis pa h. Periode ra (RV) (E, F). ta) terjadi p atid, R: rounderlangsung.
olgi cap, fas
ada tubuli sem anggah keras Tanda pana pada proses spermatid. P
Reaksi po
se akrosom
miniferi testis s (RK) (A, B, ah menunjukk perkembang ewarnaan PAositif kuat d
dan berea
muncak pada , C); casting kan reaksi P gan spermat AS. Skala: 30ditemukan
ksi positif le
a berbagai pe (D); dan ran PAS positif (w tid. E: elong 0 µm.pada
emah
eriode nggah warna gatedTabel 16 Tipe sel germinal tubuli seminiferi muncak yang ditemukan pada
jaringan testis hasil biopsi
Periode ranggah
Sel germinal
Spermatogonia Spermatosit Spermatid Spermatozoa round elongated
C √ √ √ √ √
RV √ √ √ √ -
RK √ √ √ √ √
Keterangan: C: casting; RV: ranggah velvet; RK: ranggah keras
Indikator lain yang memperlihatkan aktivitas spermatogenesis pada ketiga
periode ranggah adalah dengan keberadaan elongated spermatid (Tabel 16).
Indikator tersebut juga telah digunakan untuk menentukan tingkat fertilitas empat
spesies badak, yaitu badak hitam, badak putih, badak india dan badak sumatera
(Hermes et al. 2006). Prosedur biopsi testis pada badak tersebut dilakukan
dengan metode fine needle biopsy menggunakan jarum yang berukuran lebih
kecil (17-18G) dibandingkan ukuran jarum core needle biopsy (14G) yang
digunakan pada penelitian ini. Namun demikian, kedua metode biopsi yang
dilakukan pada badak dan muncak telah memberikan hasil yang dapat
menggambarkan aktiftas spermatogenesis untuk penentuan tingkat fertilitas
kedua satwa tersebut.
Berdasarkan pengamatan yang dilakukan, aktivitas spermatogenesis
pada muncak tetap berlangsung walaupun muncak berada pada periode C dan
RV. Namun demikian aktivitas spermatogenesis pada kedua periode tersebut
mengalami sedikit penurunan. Adanya variasi aktivitas spermatogenesis pada
muncak berhubungan erat dengan perbedaan konsentrasi testosteron antara
periode C, RV, dan RK. Variasi tersebut juga dilaporkan pada spesies Cervidae
lainnya seperti, roe deer (Blottner et al. 1996), rusa timor (Handarini 2006), chital
deer
(Umapathy et al. 2007), dan formosan muntjak (Pei et al, 2009). Namun
demikian variasi tesebut bersifat spesifik spesies, bergantung pada wilayah
penyebaran spesies. Pada chital deer yang berada di wilayah beriklim sedang
(Texas, USA), elongated spermatid masih ditemukan saat rusa tersebut berada
pada periode RV, dan spermatozoa kauda epididimidis tetap ditemukan
sepanjang tahun (Willard dan Randel 2002). Laporan berbeda dilaporkan oleh
Umapathy et al. (2007) pada chital deer yang hidup di habitat asli (India), bahwa
fluktuasi konsentrasi testosteron plasma sangat berpengaruh terhadap aktivitas
spermatogenesis. Spermatozoa tidak ditemukan pada kauda epididimidis saat
chital deer
berada pada periode RV. Perbedaan tersebut dipengaruhi oleh faktor
lingkungan, seperti photoperiod untuk wilayah beriklim sedang dan pola curah
hujan tahunan untuk wilayah tropis (Mishra dan Wemmer 1987). Pada roe deer
(Blottner et al. 1996), dan eld’s deer (Monfort et al. 1993) yang tersebar di
wilayah beriklim sedang, aktivitas spermatogenesis hanya berlangsung pada
periode RK. Pada kedua spesies tersebut, photoperiod merupakan faktor utama
yang berpengaruh terhadap sintesis testosteron oleh sel Leydig testis yang
diperlukan untuk spermatogenesis dan aktivitas reproduksi lainnya.
Sejauh mana perbedaan aktivitas spermatogenesis pada setiap periode
ranggah juga dapat diketahui dari kualitas spermatozoa yang dihasilkan dari
proses spermatogenesis. Hasil yang diperoleh memperkuat laporan penelitian
Chapman dan Harris (1991) pada revees muntjak, dan Pei et al. (2009) pada
formosan muntjak
. Aktivitas reproduksi pada kedua muncak tersebut tetap
berlangsung walaupun berada pada periode RV yang ditandai dengan
ditemukannya spermatozoa pada kauda epididimidis. Namun demikian,
gambaran aktivitas spermatogenesis di level testikular tidak dilaporkan pada
kedua spesies tersebut.
Karakteristik dan Kualitas Semen Muncak
Morfometri testis pada priode casting, ranggah velvet, dan ranggah keras
Morfometri testis yang berada dalam kantong skrotum pada kedua
muncak selama periode, C, RV, dan RK tercantum pada Tabel 17. Rataan
panjang dan lebar testis dexter et sinister, dan lingkar skrotum menunjukkan
peningkatan pada setiap periode ranggah. Rataan ukuran panjang, lebar testis
dan lingkar skrotum terendah ditemukan pada saat kedua muncak berada pada
periode C, meningkat pada periode RV, dan tertinggi pada periode RK.
Peningkatan panjang dan diameter testis secara langsung berpengaruh terhadap
lingkar skrotum. Peningkatan lingkar skrotum ♂#2 dari periode C ke periode RV
adalah 1.7%, dan dari periode RV ke periode RK adalah 5.5%. Hal yang sama
juga ditemukan pada ♂#3, yaitu terjadi peningkatan sebesar 4.2% dari periode C
ke periode RV, dan 6.9% dari periode RV ke periode RK. Secara umum ♂#2
memiliki lingkar testis yang lebih besar dibandingkan ♂#3 pada setiap periode
ranggah, yaitu: 4.9% (C), 2.6% (RV), dan 1.3% (RK). Selain itu, konsistensi testis
juga berbeda antara ketiga periode ranggah. Konsistensi testis pada periode RK
lebih kenyal dibandingkan periode C dan RV.
Tabel 17 Morfometri testis dan skrotum muncak selama periode ranggah
Parameter pengukuran ♂#2 ♂#3 C RV RK C RV RK Testis: Panjang (mm) 61.7 ± 0.4 53.7 ± 0.5 75.8 ± 0.2 68.1 ± 2.8 76.6 ± 0,4 70.5 ± 1.1 Diameter (mm) 24.5 ± 0.3 24.3 ± 0.2 25.6 ± 0.7 25.7 ± 0.1 27.0 ± 0.1 26.9 ± 0.1 Lingkar skrotum (cm) 13.7 14.2 15.9 12.4 13.5 15.5Keterangan: C: casting; RV: ranggah velvet; RK: ranggah keras
Perbedaan morfometri testis dan lingkar skrotum antara periode RK dan
RV juga dilaporkan pada Cervidae lainnya seperti rusa timor. Ukuran panjang,
diameter, dan lingkar testis rusa timor lebih besar dan berbeda nyata pada
periode RK dibandingkan periode RV. Konsistensi testis pada periode RK lebih
kenyal dibandingkan periode RV (Handarini 2006). Perbedaan morfometri testis
dan lingkar skrotum pada muncak dan Cervidae lainnya merefleksikan aktivitas
spermatogenesis pada tubuli seminiferi testis. Tingginya konsentrasi testosteron
pada periode RK menyebabkan aktivitas steroidogenesis dan spermatogenesis
testikular meningkat. Sebaliknya, penurunan konsentrasi testosteron pada
periode C dan RV mengakibatkan penurunan aktivitas spermatogenesis serta
produksi spermatozoa. Hubungan antara konsentrasi testosteron dengan ukuran
testis juga dilaporkan pada north american moose. Peningkatan testosteron pada
akhir musim panas meningkatkan ukuran testis dan aktivitas spermatogenesis
untuk menghasilkan spermatozoa yang diperlukan saat musim kawin yang
berlangsung pada musim gugur (Schwartz 1992). Korelasi yang sama juga
dilaporkan pada soay sheep yang berasal darii wilayah beriklim sedang, dimana
peningkatan ukuran testis, aktivitas spermatogenesis, dan konsentrasi
testosteron terjadi secara paralel pada musim kawin (Preston et al. 2011).
Morfologi dan morfometri spermatozoa muncak
Berdasarkan hasil pengamatan mikroskopis menggunakan mikroskop
cahaya, ditemukan morfologi spermatozoa muncak yang mirip dengan morfologi
spermatozoa pada ruminansia lainnya (Gambar 49). Spermatozoa terbagi atas
kepala yang berbentuk oval, leher, ekor tengah (mid piece), ekor utama (principal
piece),
dan ujung ekor (end piece). Bentuk leher spermatozoa yang
menghubungkan kepala dan ekor tidak jelas teramati dengan pewarnaan
William
(Gamb
memp
(Gamb
Gamba Gambam. Gambara
bar 50). L
perlihatkan
bar 50B).
ar 49 Morfolo (2); eko ekor (en ar 50 Ultrastr (3) ekor electronan tersebut d
Leher sperm
struktur y
gi spermatoz or tengah (mi nd piece) (5). ruktur sperma r utama (princ n microscopedapat dilihat
matozoa te
yang lebih
zoa muncak d id-piece) (3); Pewarnaan atozoa munca ciple piece) (4 (SEM) 20 KVt pada hasil
erletak di
tebal dib
dengan mikros ekor utama William. Ska ak. Kepala (1 4); dan ujung V. Skala:15 µpengamata
bagian dist
bandingkan
skop cahaya. (principal pie la: 10 µm. 1); leher (2); b ekor (end pie m (A); 2 µm (an dengan
tal kepala
struktur
. Kepala (1); ce) (4); dan badan (mid p ece) (5). Sca (B dan C)SEM
dan
ekor
leher ujung piece) nningMorfometri spermatozoa individual meliputi ukuran panjang dan lebar
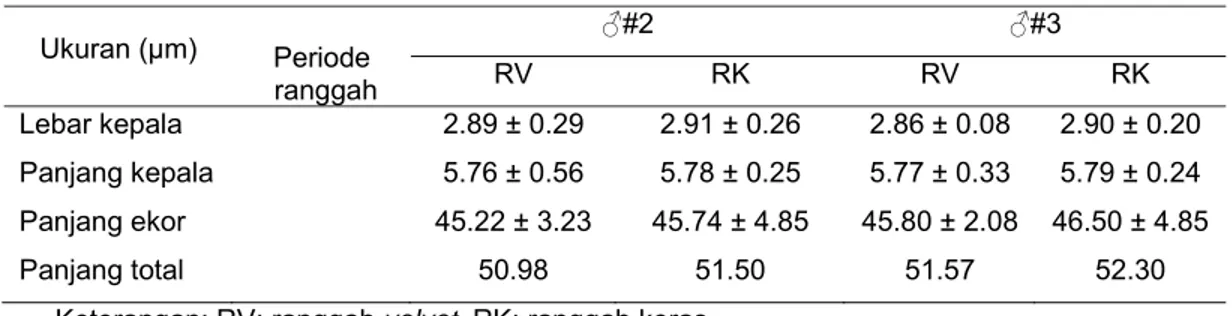
kepala serta panjang ekor pada ♂#2 dan ♂#3 selama periode RV dan RK,
ditampilkan pada Tabel 18. Secara umum morfometri spermatozoa pada kedua
periode pertumbuhan ranggah tersebut relatif sama. Panjang total spermatozoa
(panjang kepala dan ekor) ♂#2 adalah 50.98 µm pada periode RV dan 51.50 µm
pada periode RK. Muncak ♂#3 memiliki panjang spermatozoa total pada periode
RV adalah 51.57 µm dan 52.30 µm pada periode RK. Rataan panjang
spermatozoa keseluruhan ♂#2 dan ♂#3 pada periode RK adalah 51.90 µm, dan
51.27 µm pada periode RV.
Tabel 18 Morfometri spermatozoa muncak
Ukuran (µm) Periode ranggah ♂#2 ♂#3 RV RK RV RK Lebar kepala 2.89 ± 0.29 2.91 ± 0.26 2.86 ± 0.08 2.90 ± 0.20 Panjang kepala 5.76 ± 0.56 5.78 ± 0.25 5.77 ± 0.33 5.79 ± 0.24 Panjang ekor 45.22 ± 3.23 45.74 ± 4.85 45.80 ± 2.08 46.50 ± 4.85 Panjang total 50.98 51.50 51.57 52.30Keterangan: RV: ranggah velvet, RK: ranggah keras
Rataan morfometri spermatozoa muncak pada periode RK, berukuran
lebih kecil dibandingkan morfometri spermatozoa rusa timor pada periode
ranggah yang sama. Panjang dan lebar kepala, panjang bagian tengah, dan ekor
spermatozoa rusa timor adalah: 7.71 ± 0.32 µm, 4.13 ± 0.09 µm, 13.35 ±
1.38 µm, dan 42.05 ± 0.86 µm (Handarini 2006), dengan panjang total 63.11 µm.
Gizejewski et al. (2002) melaporkan bahwa terdapat perbedaan panjang kepala
spermatozoa red deer antara periode pre mating season, mating season, dan
post mating season
, berturut-turut adalah: 8.40 ± 0.49 µm, 8.49 ± 0.48 µm, dan
8.17 ± 0.48 µm, dengan ukuran lebih panjang pada periode mating season.
Al-Makhzoomi et al. (2008) menyatakan bahwa perbedaan morfologi
spermatozoa dipengaruhi oleh kualitas ejakulat, umur, individu (pejantan), dan
musim. Faktor lain yang berpengaruh terhadap morfometri spermatozoa adalah
konsentrasi spermatozoa dalam ejakulat. Ejakulat Landrace boar dengan
konsentrasi spermatozoa lebih tinggi memiliki ukuran kepala spermatozoa lebih
kecil dibandingkan ejakulat dengan konsentrasi spermatozoa lebih rendah
(Wysokinska et al. 2009).
Panjang keseluruhan spermatozoa kancil adalah 36.52 ± 5.6 µm,
dengan panjang dan lebar kepala 5.55 ± 0.8 µm, dan 4.77 ± 0.5 µm.
(Prasetyaningtyas 2005), domba garut 49.19 µm (Rizal 2005), sedangkan
landrace boar
54.81 ± 1.87 µm (Wysokinska et al. 2009). Hasil perbandingan
dengan ruminansia tersebut memperlihatkan panjang keseluruhan spermatozoa
muncak pada periode RK dan RV lebih panjang dibandingkan spermatozoa
kancil, dan domba garut, namun lebih pendek dibandingkan spermatozoa sapi.
Menurut Handarini (2006), morfometri spermatozoa rusa timor pada periode RV
tidak dapat diukur, karena pada periode tersebut abnormalitas spermatozoa
mencapai 92% (pada salah satu individu rusa penelitian).
Kualitas Semen Muncak Selama Periode Ranggah
Kualitas semen muncak yang dikoleksi dengan elektroejakulator pada
periode C, RV dan RK dari kedua muncak penelitian dapat dilihat pada Tabel 19.
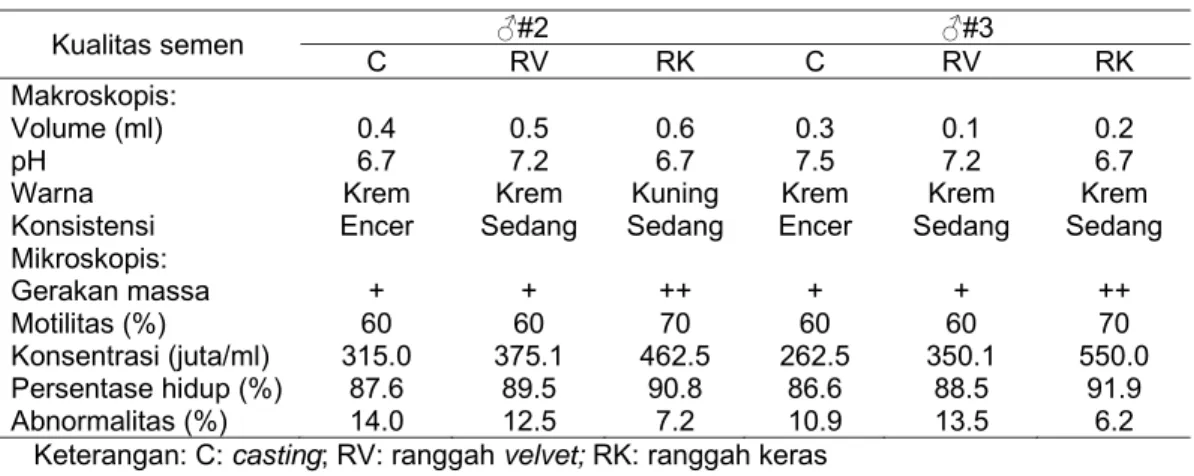
Dari pengamatan makroskopis, volume semen muncak yang diperoleh pada
ketiga periode ranggah berada pada kisaran 0.1-0.6 ml. Volume semen ♂#2
pada setiap periode pertumbuhan ranggah lebih tinggi dibandingkan volume
semen ♂#3. Sedangkan konsistensi semen bervariasi pada kedua muncak
tersebut, yaitu konsistensi encer pada periode C dan konsistensi sedang pada
periode RV dan RK, dengan warna antara krem muda pada periode C (♂#2 dan
♂#3), krem pada periode RV (♂#2 dan ♂#3), krem (♂#3) dan kuning (♂#2) pada
periode RK. Adapun pH semen berada pada kisaran 6.7-7.5.
Rataan volume semen muncak pada ketiga periode ranggah, yaitu
0.35 ± 0.07 ml (C), 0.3 ± 0.28 ml (RV), dan 0.4 ± 0.28 ml (RK), lebih rendah
dibandingkan rusa timor, yaitu 1.16 ± 0.45 ml pada periode RV, dan 1.88 ± 0.67
ml pada periode RK. Volume tersebut juga lebih rendah dibandingkan roe deer
pada periode RK, yaitu 1.1 ml (Goeritz et al. 2003), rusa sambar 1.3 ± 0.5 ml
(Cheng et al. 2004), domba 0.8-1.2 ml, sapi 5-8 ml, dan kuda 60-100 ml (Garner
dan Hafez 2000). Namun rataan volume semen muncak (periode RK) hampir
sama dengan volume semen sika deer, yaitu 0.5 ± 0.4 ml (Cheng et al. 2004).
Bila dibandingkan dengan rataan volume semen kancil, yaitu 19.44 ± 6.8 µl
(Prasetyaningtyas et al. 2006), rataan volume semen muncak pada ketiga
periode ranggah jauh lebih tinggi dibandingkan kancil.
Perbedaan volume dan kualitas semen pada ruminansia dan mamalia
lainnya disebabkan oleh faktor spesies, breed, musim, umur, dan frekuensi
koleksi semen (Kondracki et al. 2007; Al-Makhzoomi et al. 2008). Morfologi dan
morfometri tubuh muncak lebih kecil dibandingkan rusa timor, rusa sambar, dan
spesies Cervidae lainnya. Selain itu, kualitas dan kuantitas semen yang
diperoleh dengan metode penampungan alami dan vagina buatan lebih baik dan
lebih banyak dibandingkan dengan metode elektroejakulator (Asher et al. 2000).
Namun demikian, aplikasi metode elektroejakulasi untuk koleksi semen
menggunakan elektroejakulator pada satwa-satwa eksotik seperti Cervidae telah
menjadi prosedur rutin untuk mengetahui kualitas semen. Metode
elektroejakulasi telah diaplikasikan pada rusa sambar (Semiadi et al. 1994),
gazella
(Gomendio et al. 2000), roe deer (Goeritz et al. 2003), beruang hitam
(Okano et al. 2004), kancil (Prasetyaningtyas et al. 2006), red deer
(Gizejewski et al. 2004; Gizejewski et al. 2010), badak (Roth et al. 2005), rusa
timor (Handarini 2006, Nalley et al. 2012), chital deer (Umapathy et al. 2007),
anoa (Yudi et al. 2010), west african dwarf goat (Olugbenga et al. 2011), dan
spesies eksotik lainnya.
Pada pelaksanaannya, metode elektroejakulasi memerlukan tindakan
anastesi. Walaupun tindakan anastesi berisiko tinggi pada spesies-spesies
tersebut, namun metode ini lebih aman bagi operator dan lebih hemat waktu.
Pemilihan kombinasi anastetikum xylazine HCl dan ketamin HCl pada muncak
mengacu pada prosedur anastesi yang telah dilakukan pada rusa timor
(Handarini et al. 2004; Nalley et al. 2012), dan Axis deer (Sontakke et al. 2007).
Volume semen muncak yang berhasil dikoleksi menggunakan elektroejakulator
sangat memadai untuk keperluan evaluasi semen, sehingga kualitas semen
muncak selama periode ranggah dapat diketahui. Pada penelitian ini, periode
koleksi semen muncak terbatas, yaitu hanya sekali per periode ranggah. Hal ini
disebabkan karena tingginya risiko yang ditimbulkan pada muncak dengan
tingkat stres yang lebih tinggi dibandingkan Cervidae lainnya. Keterbatasan
koleksi semen sekali per periode ranggah juga dilakukan oleh Drajat (2000) pada
rusa timor yang berada pada periode RK dan RV.
Tabel 19 Kualitas semen muncak selama periode pertumbuhan ranggah
Kualitas semen ♂#2 ♂#3 C RV RK C RV RK Makroskopis: Volume (ml) 0.4 0.5 0.6 0.3 0.1 0.2 pH 6.7 7.2 6.7 7.5 7.2 6.7Warna Krem Krem Kuning Krem Krem Krem
Konsistensi Encer Sedang Sedang Encer Sedang Sedang Mikroskopis: Gerakan massa + + ++ + + ++ Motilitas (%) 60 60 70 60 60 70 Konsentrasi (juta/ml) 315.0 375.1 462.5 262.5 350.1 550.0 Persentase hidup (%) 87.6 89.5 90.8 86.6 88.5 91.9 Abnormalitas (%) 14.0 12.5 7.2 10.9 13.5 6.2
Keterangan: C: casting; RV: ranggah velvet; RK: ranggah keras