BAB 2
TINJAUAN PUSTAKA
2.1 Tinjauan Umum Tentang Virus
Virus adalah suatu partikel yang mengandung bahan genetik berupa DNA atau RNA yang diselubungi oleh protein yang disebut kapsid dan pada beberapa virus juga ada komponen lain, misalnya lemak. Satuan dasar virus disebut virion. Virus hanya dapat memperbanyak diri jika berada di dalam suatu sel inang yang sesuai. Jika berada di luar sistem selular, virus tidak mampu memperbanyak diri karena tidak mempunyai sistem enzim yang dapat digunakan untuk sintesis partikel virus yang baru. Oleh karena itu, virus disebut sebagai parasit obligat dan seringkali juga dianggap sebagai batas antara jasad hidup dan jasad mati.
Diameter virus bervariasi dari 200-300nm sehingga ukurannya lebih kecil dari sel prokaryot yang paling kecil. Pada awalnya virus diklasifikasikan berdasarkan atas inang yang ditumpanginya, sehingga ada tiga kelompok virus yaitu :
1. Virus hewan 2. Virus tumbuhan
3. virus bakteri (bakteriofag)
Sedangkan sistem klasifikasi Baltimore, membagi virus berdasarkan mekanisme produksi mRNA. Virus harus memproduksi mRNA dari genom mereka untuk memproduksi protein dan bereplikasi, namun berbagai macam mekanisme berbeda digunakan untuk memenuhi hal tersebut. Genom viral mungkin single-standed (ss) atau double-stranded (ds), RNA atau DNA, menggunakan atau tidak
menggunakan reverse transcriptase (RT). Pada dasarnya klasifikasi ini dibagi menjadi 7 kelompok (Van Regenmortel, 2004; Mayo, 1999; de Villiers et.al., 2004).
Tabel 2.1 Klasifikasi virus berdasarkan sistem klasifikasi Baltimore
No. Klasifikasi Contoh virus
I. Virus dsDNA Adenovirus,
Herpesvirus,Poxvirus
II. Virus ssDNA (+) sense DNA Parvovirus
III. Virus dsRNA Reovirus
IV. Virus (+) ssRNA (+) sense RNA Picornavirus, Togavirus V. Virus (-) ssRNA (-) sense RNA Orthomyxovirus,
Rhabdovirus VI. Virus ssRNA-RT (+) sense RNA dengan DNA
intermediate pada siklus hidup
Retrovirus
VII. Virus dsDNA-RT Hepadnavirus
Bahan genetik virus ada yang berupa molekul DNA dan ada yang berupa RNA. Molekul DNA dan RNA tersebut ada yang berupa molekul untai-tunggal (single stranded) dan ada yang berupa molekul untai ganda (double stranded). Ekspresi genetik virus dilakukan dengan menggunakan sistem enzim yang ada didalam sel inang. Meskipun virus bersifat parasit, namun perkembangan dalam genetika molekular telah memungkinkan eksploitasi virus untuk kepentingan-kepentingan praktis. Bahan genetik virus tertentu telah dipelajari secara rinci dan
dimanipulasi untuk digunakan dalam eksperimen genetik (rekayasa genetik) (Yuwono, 2005)
2.2 Tinjauan Tentang Avian Influenza 2.2.1 Struktur virus avian influenza
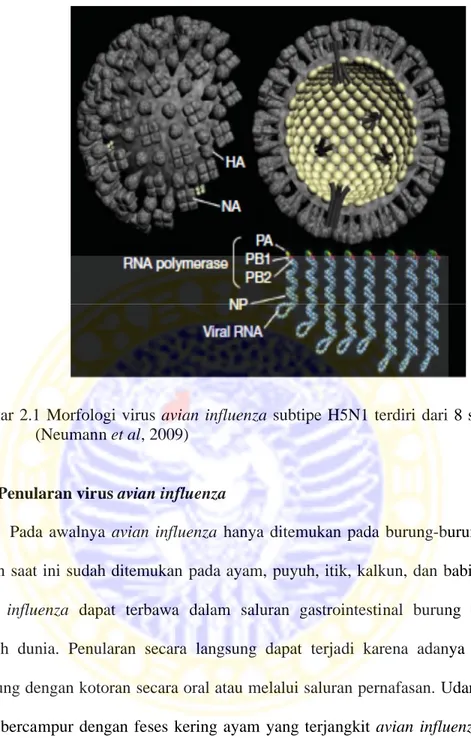
Virus influenza merupakan virus RNA bersegmen dan memiliki envelope, termasuk dalam family Orthomyxoviridae. Virus influenza diklasifikasikan menjadi 3 yaitu influenza A, B, dan C (Rahardjo dan Nidom, 2004). Virus influenza A memiliki kemampuan untuk menginfeksi mamalia dan unggas, sedangkan virus influenza B dan C hanya menginfeksi manusia. Virus influenza A sampai saat ini telah diketahui mempunyai 16 protein Hemaglutinin (HA) (H1-H16) dan 9 macam protein Neuraminidase (NA) (N1-N9) (Horimoto dan Kawaoka, 2001). Virus avian influenza memiliki delapan gen yang terdiri dari gen Hemaglutinin (HA) dan Neuraminidase (NA) yang merupakan gen eksternal, gen Matiks (M), Nukleoprotein (NP), Polymerase A (PA), Polymerase B2 (PB2) dan gen Non-struktural (NS) yang merupakan gen internal. Kedelapan gen ini masing-masing mempunyai Open Reading Frame (ORF), sehingga proses ekspresi proteinnya tidak tergantung satu sama lainnya (Nidom, 2005). Gen HA dan NA memiliki peranan terhadap proses masuknya virus ke dalam sel melalui perlengkatan reseptor asam sialik pada sel hospes, dan memberikan fasilitas penggabungan antara virus dengan membran sel. Selain itu, determinan antigenik utama menentukan kunci terhadap vaksin influenza (Vines et al, 1998).
Berdasarkan bentuknya virus avian influenza atau virus influenza A subtipe H5N1 memiliki bentuk spherical dengan diameter 100-200 nm dan terdiri atas 8 segmen atau gen dengan untai tunggal RNA negatif. Virus avian influenza
memiliki mRNA yang bersifat monosistronik yang mengkode 10 protein. Genome RNA dari virus flu burung terdiri atas gen nukleoprotein (NP) dan 3 subunit RNA polimerase kompleks (PA, PB1, dan PB2) yang memiliki peranan penting di dalam proses replikasi dan bergabung bersama dengan komplek ribonukleoprotein (RNP). Bagian dalam kapsul terdiri atas protein Matriks (M1) dan chanel ion protein M2 dalam jumlah yang tidak terlalu banyak. Selain itu, juga terdapat protein non-struktural yaitu protein NS2 dan NS1. Protein NS2 memiliki peranan yang penting dalam mengambil RNP (Ribonucleoprotein complex) dari nukleus dan berinteraksi dengan protein M1. Protein NS1 memiliki berbagai peranan antara lain mengatur pemisahaan dan pengambilan bahan-bahan yang dibutuhkan dari nukleus menuju mRNA seluler dan memiliki peranan yang penting dalam menstimulasi terjadinya translasi untuk umpan balik terhadap aktifitas interferon pada hospes. Untuk protein HA dan NA yang terletak pada permukaan virus memiliki peranan dalam proses: 1) perlekatan, 2) penggabungan dan masuk ke dalam sel hospes, 3) perkembangbiakan virus dari sel hospes yang terinfeksi oleh virus flu burung. Selain itu, protein HA dan NA merupakan dua protein yang bertanggungjawab secara langsung terhadap mekanisme netralisasi antibodi oleh respon imun yang dihasilkan oleh hospes yang terinfeksi oleh virus H5N1 (Suzuki, 2005).
Gambar 2.1 Morfologi virus avian influenza subtipe H5N1 terdiri dari 8 segmen (Neumann et al, 2009)
2.2.2 Penularan virus avian influenza
Pada awalnya avian influenza hanya ditemukan pada burung-burung liar, namun saat ini sudah ditemukan pada ayam, puyuh, itik, kalkun, dan babi. Virus avian influenza dapat terbawa dalam saluran gastrointestinal burung liar ke seluruh dunia. Penularan secara langsung dapat terjadi karena adanya kontak langsung dengan kotoran secara oral atau melalui saluran pernafasan. Udara yang kotor bercampur dengan feses kering ayam yang terjangkit avian influenza akan terhirup oleh ayam lain dan manusia yang hidup di lokasi peternakan, seperti pekerja kandang dan peternak (Soejoedono dkk, 2006).
Resiko penularan dari burung liar ke unggas peliharaan terutama terjadi kalau unggas peliharaan tersebut dibiarkan bebas berkeliaran. Sebuah penelitian menemukan bahwa virus AI H5N1 dapat disebarkan melalui burung yang
bermigrasi di daerah Asia Tenggara (Whittaker, 2001). Manusia jarang terpapar virus AI sehingga manusia memiliki imunitas yang lebih sedikit dibanding unggas atau hewan lain. Hal ini menyebabkan virus AI menjadi ganas apabila terjadi penularan terhadap manusia dan dapat menyebabkan pandemik.
2.2.3 Patogenisitas virus avian influenza
Berdasarkan patogenisitasnya virus AI dibagi menjadi dua yaitu virus AI yang sangat pathogen atau HPAI (Highly Pathogenic Avian Influenza) dan virus AI yang tidak pathogen atau LPAI (Low Patoghenic Avian Influenza). Virus dikategorikan HPAI apabila virus tersebut memiliki kemampuan menimbulkan mortalitas sebesar 75% pada ayam 4-8 minggu yang diinfeksi secara intavena. Virus AI juga dikategorikan HPAI jika isolat tersebut dapat membunuh 1-5 ekor ayam walaupun tidak termasuk subtipe H5 atau H7. Kategori lain yang dipakai yaitu jika tejadi pertumbuhan virus dalam kultur sel dengan pembentukan CPE atau plaque tanpa menggunakan tripsin. Virus LPAI bereplikasi terutama di dalam usus dan organ respirasi yang selanjutnya dapat dikeluarkan melalui feses burung yang terinfeksi, sehingga transmisi virus melalui rute faecal-contaminated-water-oral yang merupakan mekanisme penularan virus diantara burung air. Infeksi oleh virus HPAI konsentrasi tinggi yang bereplikasi secara sistemik pada unggas yang juga dikeluarkan melalui feses. Namun virus HPAI akan ditransmisikan diantara spesies unggas melalui rute nasal dan oral yang kontak dengan material yang terkontaminasi virus (Horimoto and Kawaoka, 2005)
Virus LPAI menyebabkan infeksi lokal di dalam saluran pernafasan atau saluran pencernakan yang akan menimbulkan infeksi sedang/asimptomatik. Ayam yang terinfeksi virus HPAI menimbulkan gejala klinis umum seperti swelling
endotel dari pembuluh darah kecil, hemorraghi dan thrombosis. Virus HPAI dapat bereplikasi dengan efisien di dalam sel endotel pembuluh darah dan sel parenkim perivaskular sehingga dapat menimbulkan infeksi sistemik (Horimoto and Kawaoka, 2005).
2.2.4 Epidemiologi virus avian influenza
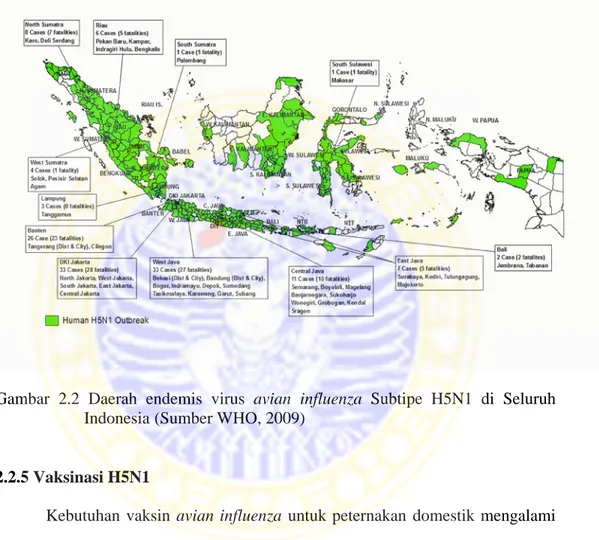
Kasus avian influenza pada ayam diyakini muncul pertama kali pada bulan Agustus tahun 2003 di beberapa peternakan ayam ras komersial di Jawa Barat dan Jawa Tengah. Kasus tersebut cepat meluas ke berbagai daerah di Jawa Tengah, Jawa Barat, Jawa Timur, Daerah Istimewa Yogyakarta (DIY), Lampung, Bali, dan beberapa daerah di Sumatera dan Kalimantan. Pada tahun 2003, wilayah yang terjangkit penyakit tersebut mencakup 9 propinsi, yang terdiri dari 51 kabupaten/kota dan jumlah ayam/unggas yang mati mencapai 4,13 juta ekor. Jenis unggas yang terserang meliputi ayam ras petelur, pedaging, ayam bibit, ayam buras, ayam arab, itik, entog, burung puyuh, burung merpati, burung perkutut, dan burung merak. Sampai dengan bulan Desember 2004, jumlah kumulatif kasus kematian ternak unggas akibat virus avian influenza mencapai 6,27 juta ekor yang berasal dari 16 propinsi yang mencakup 100 kabupaten/kota. Angka kematian akibat virus avian influenza pada ternak unggas terutama ditemukan di Jawa Tengah, Jawa Barat, Jawa Timur, dan Lampung dengan jumlah kematian masing-masing lebih dari satu juta ekor. Sekitar bulan Februari 2005 terjadi perluasan kasus avian influenza ke daerah baru, yaitu Sulawesi Selatan dan selanjutnya menyebar ke Sulawesi Tenggara dan Sulawesi Barat, dan terakhir telah di laporkan juga di Nangroe Aceh Darussalam. Jumlah kematian unggas akibat serangan virus avian influenza sejak bulan Agustus 2003 sampai dengan
November 2005 diperkirakan telah mencapai 10,45 juta ekor. Jumlah kematian unggas pada tahun 2005 cenderung menurun drastis dibandingkan dengan tahun 2003 maupun tahun 2004, walaupun daerah yang terserang cenderung lebih luas (Rahardjo dan Nidom,2004)
Gambar 2.2 Daerah endemis virus avian influenza Subtipe H5N1 di Seluruh Indonesia (Sumber WHO, 2009)
2.2.5 Vaksinasi H5N1
Kebutuhan vaksin avian influenza untuk peternakan domestik mengalami peningkatan. Ini disebabkan adanya kebijakan penggunaan vaksin untuk peternakan dan merupakan keputusan yang penting yang dikeluarkan oleh dinas peternakan seperti Thailand dan Vietnam yang merupakan negara pengeskpor untuk unggas. Vaksin yang baik adalah vaksin yang mampu melindungi dari infeksi, memiliki kesamaan antara antigen yang digunakan pada vaksin dengan strain yang sedang bersirkulasi dan mampu mengurangi jumlah virus dibawah
tingkat yang memiliki kemampuan untuk menular pada organisme lain. Sebaliknya vaksin yang tidak baik adalah vaksin yang tidak memiliki kemampuan untuk mencegah infeksi dan gejala klinis yang muncul namun tidak mampu mencegah terjadinya ekspresi virus pada tingkat yang mampu menularkan virus pada organisme lain. Selain itu, vaksin yang tidak baik memicu penyebaran virus pada peternakan yang tidak terdeteksi atau silent virus, pada pasar yang menjual unggas hidup dan memicu terjadinya penularan. China dan Indonesia mengadopsi vaksinasi pada peternakan untuk mengendalikan virus avian influenza dan Vietnam telah lebih dulu mencoba vaksin pada peternakan namun yang menjadi permasalahaan adalah di Indonesia, virus avian influenza menyerang pada unggas dan babi. Sedangkan di China, virus avian influenza terdeteksi pada unggas yang sehat di pasar unggas hidup. Ini memberikan gambaran bahwa beberapa vaksin memiliki kualitas yang kurang optimal dan kemungkinan terjadi ko-infeksi dengan agen penyakit lainnya. Strategi vaksin juga digunakan di Meksiko tahun 1980 dan vaksin yang digunakan adalah vaksin H5N2. Vaksin H5N2 mampu mereduksi timbulnya infeksi namun tidak mampu mengeliminasi virus H5N2 dan memberikan kontribusi terhadap penyebaran virus secara luas di Amerika Tengah dan menyebabkan terjadinya antigenic drift (Webster et al, 1992).
Sejak 24 Januari 2004, Dirjen Produksi Peternakan menetapkan penyakit avian influenza (AI) pada hewan dan unggas berstatus wabah. Pada awal terjadinya wabah tahun 2003, banyak vaksin ilegal asal China yang beredar. Vaksin ini mengandung virus AI dengan yang berbagai macam tipe dan terkadang tidak jelas tipe virus AI yang terkandung di dalamnya. Efektifitas vaksin ini di lapangan juga bermacam-macam. OIE meragukan kualitas dari beberapa vaksin
produksi China. Tetapi laporan FAO (Food and Agriculture Organization) dari Vietnam menunjukkan bahwa vaksin China sudah memberikan dampak pada pengendalian wabah AI pada unggas. Untuk saat ini vaksin avian influenza yang digunakan di lapangan dan diuji coba di laboratorium meliputi vaksin inaktif, vaksin konvensional dengan menggunakan virus utuh, vaksin inaktif dengan menggunakan teknologi reverse genetik, vaksin sub unit dengan menggunakan baculovirus dan mengekspresikan antigen H5 secara secara invitro, vaksin rekombinan dengan menggunakan fowl pox virus secara invivo, virus ND, vektor virus infectious laryngotracheitis dan DNA vaksin. Vaksin-vaksin tersebut memiliki kemampuan untuk melindungi dan mengeliminasi virus avian influenza. Selain itu juga, memiliki kemampuan untuk mereduksi virus yang dikeluarkan setelah diuji tantang (Harder and Warner, 2006). Di Indonesia terdapat 2 jenis vaksin AI untuk menangani virus flu burung yaitu vaksin homolog dan vaksin heterolog. Vaksin homolog inaktif pada umumnya digunakan untuk mengendalikan wabah AI di Indonesia pada tahun awal ditemukannya wabah penyakit ini. Vaksin semacam ini juga sudah diproduksi di Indonesia dan peternak unggas di lapangan umumnya menyatakan bahwa efektifitas vaksin ini cukup baik, ditinjau dari pemeriksaan serologis sebelum dan sesudah vaksinasi dan juga daya proteksinya terhadap serangan penyakit AI. Vaksin homolog ini mengandung virus mati dengan tipe H5N1, yaitu tipe yang sama dengan penyebab wabah AI di Indonesia. Bibit virus untuk pembuatan vaksin ini juga berasal dari isolat lokal virus penyebab wabah AI di Indonesia. Vaksin heterolog adalah vaksin inaktif dengan kandungan virus AI dari tipe yang berbeda dari virus penyebab wabah AI di Indonesia. Vaksin heterolog yang telah beredar adalah
vaksin yang mengandung tipe virus H5N2, vaksin inaktif yang mengandung tipe virus H5N9 dan sebagainya (Harder and Warner, 2006; Nidom, 2005; Jamalludin, 2008).
Berdasarkan hasil penelitian yang dilakukan oleh tim peneliti Laboratorium Avian Influenza Universitas Airlangga (Vienansyah 2010, Mutti dan Rizkyawan 2011) menunjukan bahwa titer antibodi pada ayam baik broiler dan layer dengan hasil uji Heamaglutinasi Inhibisi lebih dari 27mampu menetralisasi virus berdasarkan hasil pengujian dengan menggunakan uji netralisasi baik dengan menggunakan kultur sel maupun dengan menggunakan TAB (telur ayam berembrio). Selain itu juga ditemukan bahwa tidak adanya kesesuaian antara antibodi protektif dari vaksin H5N1 terhadap infeksi virus flu burung pada unggas (OIE menetapkan antibodi protektif terhadap vaksin H5N1 23berdasarkan hasil uji Haemaglutinasi Inhibisi). Terjadinya kesenjangan antara pengujian secara serologis maupun dengan pengujian secara netralisasi terhadap virus H5N1 membutuhkan kajian yang lebih mendalam dari sudut pandang yang berbeda misalnya proteomik sehingga memberikan solusi terhadap vaksin H5N1 dan memotong penyebaran virus avian influenza di Indonesia.
Saat ini masih belum banyak dilakukan vaksinasi H5N1 pada manusia. Sebagai upaya pencegahan, WHO merekomendasikan untuk orang-orang yang mempunyai risiko tinggi kontak dengan unggas atau orang yang terinfeksi, dapat diberikan terapi profilaksis dengan 75 mg oseltamivir sekali sehari, selama 7 sampai 10 hari (WHO, 2005).
Beberapa negara lain yang juga tengah mengembangkan vaksin H5N1 antara lain adalah Jepang, China, Hongaria,dan lain-lain. (WHO, 2005). Menurut
penelitian Koopmans (2004) Lebih dari 56% dari infeksi H7 yang dilaporkan muncul sebelum vaksinasi dan program pengobatan. Setelah 19 orang telah didiagnosa menderita infeksi, semua pekerja menerima vaksinasi influenza virus dan pengobatan dengan oseltamivir.
Vaksin yang saat ini dikembangkan adalah vaksin yang dibuat dengan modifikasi molekuler yang lebih efektif. Selain memungkinkan pengembangan vaksin dengan pendekatan berbasis peptida akan memiliki keuntungan untuk menghindari penggunaan virus influenza hidup yang berbahaya selama produksi massal. Salah satu penelitian menemukan bahwa peptida urutan DTVQIIKLL hadir dalam protein PB2 dari virus H5N1, diperkirakan akan mengikat HLA-A26 yang dibatasi reseptor sel sistem kekebalan tubuh permukaan. Oleh karena itu, peptida terikat mungkin mampu merangsang perlindungan dari sitotoksik limfosit T. kemudian dikonfirmasi dalam penelitian laboratorium, dan vaksin yang efektif dikembangkan untuk individu mengekspresikan HLA-A26 reseptor. Karena PB2 memiliki laju mutasi jauh lebih rendah dari H dan N, sehingga dapat mengatasi masalah pada pembuatan vaksin dengan virus utuh (Gillis, 2005).
2.2.6 Spesifisitas reseptor virus avian influenza
Virus avian influenza memiliki afinitas yang tinggi terhadap asam sialid α2-3 dan memiliki jumlah yang banyak di jaringan epitel daerah endodermik (usus dan paru-paru) pada unggas yang merupakan target dari virus avian influenza. Hal ini berbeda dengan virus influenza yang berasal dari manusia yaitu lebih banyak memiliki residu α 2-6 yang lebih predominan pada sel epitel pada saluran pernafasan manusia. Perbedaan reseptor menyebabkan terhambatnya penularan virus flu burung dari unggas ke manusia. Namun berdasarkan beberapa
hasil penelitian yang telah dilakukan menunjukan bahwa sel epitel bersilia pada trakea manusia memiliki reseptor virus avian influenza dari unggas dalam jumlah yang sedikit. Hal sebaliknya juga terdapat pada ayam, memiliki reseptor yang berasal dari virus influenza dari manusia (α 2-6) (Beare dan Webster 1991; Harder and Warner,2006).
Pada babi dan unggas air kedua reseptor yaitu α 2-3 dan α 2-6 memiliki densitas yang lebih tinggi dibandingkan dengan hewan lain sehingga memberikan kesempatan pada kedua hewan tersebut untuk terjadinya mixing vessel antara virus flu burung dengan virus influenza yang menginfeksi pada manusia (H1N1,H3N2).
2.2.7 Siklus infeksi virus avian influenza
Infeksi virus diawali dengan terjadinya perlekatan protein HA virus ke reseptor asam sialat sel host (Swyne, 2008). Pengikatan virus influenza ke reseptor akan diikuti dengan endositosis melalui celah yang dilapisi clathrin dan vesikel. Fusi antara virus dengan membrane sel berlangsung pada kompartemen endosomal yang selanjutnya akan memicu transfer nukleokapsid virus ke dalam sitoplasma untuk bermigrasi ke dalam inti sel tempat transkripsi dan replikasi RNA virus. Pada awal replikasi, virus memerlukan pH asam dari endosom melalui pompa proton sel ( Cross et al., 2001). Bagian dalam virus juga mengalami penurunan pH menjadi asam dengan bantuan M2 (protein membrane integral) yang menyebakan ion H+ masuk ke dalam virion sehingga memicu perubahan konformasi protein HA yang menyebabkan domain fusi pada protein HA menjadi aktif. Suasana asam di dalam virus juga memicu nukleokapsid virus berdisosiasi
dari protein matriks virus (M1) sehingga segmen gen virus dapat masuk ke dalam inti sel tempat replikasi dan transkripsi RNA virus berlangsung (Swyne, 2008).
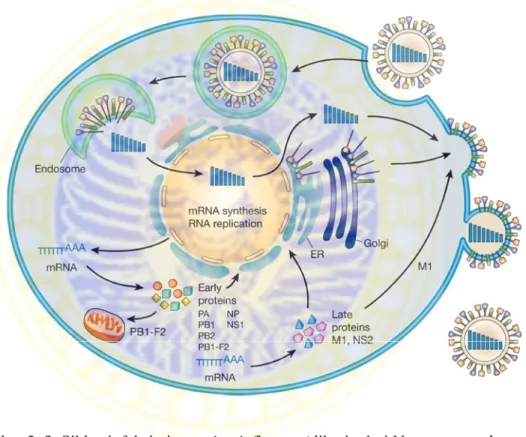
Pada proses transkripsi RNA virus akan terbentuk mRNA yang selanjutnya dikeluarkan dari inti sel menuju sitoplasma untuk proses translasi membentuk protein virus. Protein virus yang terbentuk (early protein viral) yang diperlukan untuk proses replikasi dan transkripsi di dalam inti sel akan ditransport kembali ke dalam inti sel (Neumann et al., 2009).
Gambar 2. 3. Siklus infeksi virus avian influenza (dikutip dari Neumann et al., 2009)
Pada akhir siklus infeksi virus influenza, protein M1 dan NS2 membantu keluarnya ribonukleoprotein virus (vRNP) baru terbentuk dari inti sel menuju sitoplasma, sedangkan PB1-F2 akan berasosiasi dengan mitokondria (Neumann et al, 2009). Virus influenza baru hasil replikasi dalam sel host selanjutnya akan dirakit dan keluar dari sel host melalui proses budding pada bagian apical
membrane plasma sel yang terpolarisasi (sel epitel paru dari host terinfeksi). Hal ini memiliki peran penting pada patogenesis serta tissue tropism virus karena virus yang budding dari permukaan dalam sel cenderung menyebabkan penyakit sistemik, sedangkan virus influenza yang budding dari permukaan external sel pada umumnya memiliki tissue tropism yang terbatas (Swyne, 2008).
2.2.8 Replikasi virus avian influenza
Genoma virus influenza A berisi delapan segmen virus (vRNA) untai negatif. Selama siklus replikasi virus, genoma vRNA mengalami transkripsi menjadi untai positif mRNA dan RNA komplementer (cRNA) dalam inti sel. Mekanisme ini yang membedakan dengan virus RNA lainnya. Sebagai promoter sintesis mRNA diletakkan pada bagian struktur untai ganda RNA yang dibentuk dari urutan ujung 5’ dan 3’ dari segmen genoma vRNA (Honda et al, 2002; Mikulasova et al, 2000)
Selama replikasi, virus influenza memerlukan aktivitas glikoprotein permukaan yaitu protein HA dan NA. Glikoprotein HA bertanggung jawab untuk berikatan dengan asam sialat yang terletak pada glikokonjugat permukaan sel, dan glikoprotein NA yang berfungsi dalam aktivitas enzimatis terhadap pelepasan asam sialat dari glikokonjugat sel dan juga dalam sintesis protein untuk memfasilitasi virion baru dalam budding sel (Kobasa et al, 2001).
Setelah berikatan dengan reseptor tropism cell, virus influenza A akan masuk ke dalam sel melalui proses endositosis. Adanya pH yang rendah pada endosom akan menginduksi perubahan konformasi dalam protein HA menghasilkan fusi antara membran virus dengan membran endosom. Di dalam endosom, saluran proton M2 terbuka dan RNP akan keluar ke sitoplasma. Proses
ini dapat berlangsung beberapa saat. Berdasarkan pengamatan di laboratorium, dalam waktu 10 menit, proses endositosis sudah berlangsung 50%. Proses endositosis ini berlangsung sampai semua genoma RNA virus ke luar dan masuk ke dalam sitoplasma (Horimoto and Kawaoka, 2001; Raharjo dan Nidom, 2004).
Proses selanjutnya genoma RNA akan masuk ke dalam inti sel dan megalami transkripsi, guna mengubah bentuk polaritas negatif (-) menjadi polaritas positif (+). Sebagian genoma keluar kembali masuk sitoplasma mengambil cap RNA sel inang dan poli A guna melakukan translasi untuk menghasilkan berbagai protein termasuk protein selubung yang selanjutnya digunakan oleh virus baru. Protein tersebut meliputi protein hemaglutinin (HA), neuraminidase (NA), matriks (M) dan non struktural (NS) (Horimoto and Kawaoka, 2001; Raharjo dan Nidom, 2004).
Genoma RNA sebanyak delapan segmen yang berada dalam inti sel melakukan replikasi. Setelah melakukan replikasi dalam inti sel, kedelapan segmen RNA ini akan dibungkus dengan protein HA, NA, M dan NS. Untuk keperluan pelepasan (budding) virus akan terjadi penempelan pada reseptor di permukaan luar sel yang akan dilakukan oleh protein NA. Proses replikasi virus ini dapat berlangsung selama dua jam sejak terjadinya penempelan virus influenza pada reseptor sel (Horimoto dan Kawaoka, 2001; Raharjo dan Nidom, 2004).
2.2.9 Transmisi virus avian influenza A pada manusia
Menurut WHO (2007), infeksi virus AI H5N1penularan ke manusia dapat terjadi melalui penularan dari unggas ke manusia, mungkin dari lingkungan ke manusia dan penularan dari manusia ke manusia secara terbatas. Sedangkan menurut Knipe (2007) transmisi virus AI dari manusia ke manusia belum pernah
dilaporkan. Pada umumnya virus AI tidak bereplikasi secara efisien pada manusia, sehingga transmisi langsung virus AI ke manusia sangat jarang terjadi. Penularan virus AI ke manusia memerlukan paparan jumlah virus yang banyak untuk menimbulkan tingkat replikasi virus yang cukup pada manusia. Kemampuan pertumbuhan virus AI yang terbatas pada manusia diperkirakan sebagai barier munculnya pandemik virus AI melalui transmisi langsung dari unggas ke manusia (Horimoto and Kawaoka, 2005)
Kasus infeksi virus AI di Hongkong tahun 1997 telah terjadi penularan langsung dari ayam ke manusia. Berdasarkan dari hasil analisisnya ternyata delapan segmen virus tersebut berasal dari virus unggas dan masih terikat ke reseptor unggas SA α-2,3. Kemudian diketahui juga bahwa donor gen HA virus tersebut adalah A/goose/Guangdong/I/96 (H5N1) masih bersirkulasi di Cina (Lipatov, 2004). Berdasarkan studi epidemiologi menunjukkan bahwa transmisi langsung virus dari burung dan kejadian transmisi dari manusia ke manusia hanya terjadi pada beberapa kasus saja, sehingga hal ini mengindikasikan bahwa virus masih belum beradaptasi penuh pada host manusia (Horimoto and Kawaoka, 2005).
Pada tahun 2002 terjadi kasus infeksi H5N1 lain di Hongkong yang menunjukkan bahwa terjadi mutasi antigenic drift yang bersifat highly pathogenic pada bebek serta unggas air lain. Hal ini terus berlanjut pada awal tahun 2003 dimana virus H5N1 telah menginfeksi satu keluarga di Hongkong yang mengakibatkan kematian pada tiga orang dalam satu keluarga ( Horimoto and Kawaoka, 2005).
Virus AI tidak menyebabkan infeksi persisten atau laten pada manusia, tetapi virus influenza dipertahankan pada populasi manusia melalui penyebaran langsung dari manusia ke manusia selama infeksi akut (Knipe, 2007). Namun demikian penularan virus AI H5N1 ke manusia dikhawatirkan dapat memicu terjadinya pandemic influenza, apalagi bila penularan tersebut disertai dengan perubahan spesifitas reseptor yang mengarah SA α-2,6 (Mansfield, 2006)
Pada prinsipnya flu pandemik terjadi ketika suatu virus influenza dari unggas memiliki protein permukaan HA yang tidak dapat dieliminasi oleh respon imun tubuh manusia (Nichol et al.2000). Beberapa kemungkinan terjadinya penularan H5N1 pada manusia dan terjadinya flu pandemik, karena terjadi penularan antar manusia. Kemungkinan pertama menggunakan peran babi sebagai hewan perantara atau “mixing vessel”. Tubuh babi akan terinfeksi oleh dua macam virus influenza yang berbeda, virus avian influenza dan virus human influenza, kemudian terjadi penataan ulang dari keduanya pada saat melakukan replikasi pada tubuh babi. Hasil replikasinya berupa sebuah virus dengan protein permukaan HA dari virus human influenza sedangkan genoma lainnya berasal dari virus avian influenza. Pada saat terjadi wabah Spanish flu, terjadi perubahan spesifitas reseptor virus avian influenza H1N1 selama replikasi dalam tubuh babi, sehingga virus menjadi teradaptasi dalam tubuh babi dan tidak memerlukan virus human influenza untuk menginfeksi manusia.
Kemugkinan lainnya terjadi penularan langsung pada tubuh manusia. Pada kejadian wabah di Hong Kong pada tahun 1997 dan Vietnam, Thailand dan Kamboja pada tahun 2004 dan 2005, menunjukkan model baru penularan dari unggas ke tubuh manusia. Mekanisme yang dimungkinkan adalah terjadinya
penataan ulang antara virus avian influenza dengan virus human influenza pada tubuh manusia tersebut, kemudian virus avian influenza ini memiliki gen HA dari virus human influenza. Mekanisme lain yaitu terjadinya adaptasi virus avian influenza pada tubuh manusia (Nichol et al.,2000).
2. 3 Tinjauan Tentang Protein Virus
Protein adalah senyawa kompleks yang memiliki berat molekul tinggi yang merupakan polimer dari asam amino yang dihubungkan satu sama lain dengan ikatan peptida. Molekul protein mengandung karbon, hidrogen, oksigen, nitrogen, sulfur, serta fosfor. Virus influenza A termasuk virus avian influenza subtipe H5N1 memiliki 10 protein yang terdiri dari dua protein eksternal (HA dan NA) dan delapan protein internal (PA, PB1, PB2, M1, M2, NS1, NS2, dan NP). Protein tersebut berperan penting dalam struktur dan fungsi semua sel makhluk hidup dan virus.
2.3.1. Protein hemaglutinin (HA)
Protein HA merupakan protein utama pada virus influenza A dan B, sedangkan pada virus Influenza C berupa Hemaglutinin-esterase (HE) yang merupakan protein homolog dengan protein HA (Suzuki, 2002). Protein HA disintesis sebagai polimer 580-585 asam amino, kemudian mengalami modifikasi pasca translasi berupa glikosilasi pada posisi 5-7 saat transit di reticulum endoplasmic dan sitoplasma sebelum ke membrane sel (Knipe, 2007). Selanjutnya protein HA akan dipecah menjadi dua bagian oleh suatu signal peptidase yang memiliki 20 asam amino. Kedua bagian protein HA ini terdiri dari protein HA1 yang terdiri dari 320 asam amino dan protein HA2 yang terdiri dari 220 asam amino. Protein HA1 yang akan berikatan dengan reseptor pada sel tropisma dan
merupakaan target utama untuk respon imun, sedangkan protein HA2 sebagai protein jangkar (anchor) pada envelope dan berfungsi sebagai perantara terjadinya fusi antara envelope dan membran endosomal sel (Suzuki, 2002). Pembelahan HA merupakan penentu awal untuk fusi virus dengan membran endosomal serta infektivitas virus (Neumann and Kawaoka, 2006).
Meskipun virulensi virus influenza A ini merupakan poligenik, tetapi protein HA mempunyai peran penting. Pada awal infeksi akan berikatan dengan reseptor sel dan melepaskan protein ribonukleoprotein. Aktivasi proteolitik post translasi dari perkusor HA (HA0) menjadi HA1 dan HA2 oleh protease inang akan menghasilkan bagian fusogenik di bagian terminal HA2 yang akan memfasilitasi fusi antara envelope virus dengan membran endosomal. Oleh karena itu, aktivasi proteolitik molekul HA merupakan hal yang penting untuk infektivitas dan penyebaran virus ke seluruh tubuh (Suzuki, 2002).
Protein HA dari virus avian influenza yang avirulen biasanya dipecah secara terbatas oleh protease beberapa sel, sehingga virus hanya menyebabkan infeksi yang bersifat lokal pada saluran pernafasan atau pencernakan saja dan sifat infeksinya ringan atau asimptomatik. Sebaliknya protein HA dari virus avian influenza yang virulen dapat dipecah oleh protease sel inang dalam jumlah dan jangkauan yang lebih luas sehingga mampu menimbulkan penyakit sistemik dan mematikan pada ayam (Horimoto and Kawaoka, 2001).
Pada gen HA terdapat suatu region yang disebut cleavage site yaitu suatu region dimana pada bagian tersebut terjadi pembelahan gen HA saat infeksi virus AI ke sel inang. Secara struktur berdasarkan jumlah asam amino yang menyusun
tempat pembelahan gen HA maka hal ini akan membedakan virus influenza yang avirulen dan virulen. Virus AI yang avirulen biasanya mempunyai satu basic amino acid yaitu arginin (R) yang terdapat pada tempat pembelahan, sedangkan untuk virus yang virulen mempunyai beberapa basic amino acid yang terletak dekat tempat pembelahan. Pada umumnya virus influenza mempunyai asam amino arginin (R) pada ujung karboksil protein HA1 dan glisin pada ujung amino protein HA2 yang diikuti oleh asam amino lisin (L) (Horimoto and Kawaoka, 2001).
2.3.2 Protein neuraminidase (NA)
Gen NA (Neuraminidase) mengekspresikan protein NA yang merupakan protein membran berupa tetramer tipe II dengan aktivitas sialidase yang membelah residu asam sialat dari glikokonjugat sel inang dan HA, sehingga NA dikenal sebagai enzim penghancur reseptor. Aktivitas sialidase ini sangat penting untuk pelepasan progeni virion dari permukaan sel inang dengan tujuan untuk mencegah agregasi progeni virus berkenaan dengan aktivitas pengikatan HA virus dengan glikoprotein virus yang lain. Maka aktivitas pengikatan reseptor HA virus dengan aktivitas penghancuran reseptor NA harus dalam keadaan seimbang agar replikasi virus influenza A berjalan efisien (Hughes, 2001). Gen NA mempunyai urutan serta panjang yang bervariasi tergantung dari virusnya. Jika terjadi pemendekan sekuen NA maka aktivitas pelepasan virus menjadi kurang efisien (Horimoto and Kawaoka, 2001). Namun pada penelitian Korteweg (2008) virus AI subtipe H5N1 yang diisolasi pada wabah tahun 1997 di Hongkong ditemukan telah terjadi delesi 19 asam amino pada gen NA (stalk NA) yang menyebabkan
virus tersebut dapat beradaptasi sehingga menular dari unggas air ke unggas domestik. Hal ini juga sesuai dengan penyataan Swyne (2008) bahwa delesi pada region stalk NA merupakan tanda adaptasi virus AI pada unggas. Delesi tersebut juga menimbulkan penurunan aktivitas NA dengan membuat perubahan pada protein HA yang akan menurunkan afinitas pengikatan ke asam sialat melalui penambahan tempat glikolisasi dekat dengan reseptor binding site. Menurut Hughes (2001) mutasi gen NA virus akan meningkatkan kemampuan virus Influenza A beradaptasi pada lingkungan baru. Seperti yang dinyatakan Horimoto dan Kawaoka (2001) ketika virus influenza asal unggas yang memiliki gen NA dari subtipe N2 dikenalkan ke populasi manusia ternyata aktivitas pembelahan SAα-2,6 meningkat, hal ini menunjukkan bahwa telah terjadi adaptasi NA virus ke spesifitas reseptor SAα-2,6 dari HA manusia.
Fungsi lain dari protein NA yaitu dapat membantu proses masuknya virus influenza ke dalam sel target pada saluran pernafasan melalui aktivitas degradasi mucus (Matrosovich, 2004). Peranan NA pada saat infeksi virus influenza sangat penting. Menurut Knipe (2007), protein NA juga berperanan untuk mengeluarkan asam sialat dari lapisan musin sehingga memudahkan virus influenza mencapai permukaan sel epitel. Protein NA juga berpengaruh terhadap host restriction virus influenza karena aktivitas NA dari virus influenza asal unggas lebih resisten terhadap pengaruh pH rendah didalam saluran pencernakan bagian atas dibanding virus asal manusia atau babi. Disebutkan pula bahwa aktivitas NA dapat mempengaruhi patogenitas virus karena jika terjadi kehilangan rantai karbohidrat pada posisi 146 dari NA akan menyebabkan protein NA lebih mudah terikat ke
plasminogen (suatu prekusor plasmin) sehingga hal tersebut dapat membantu pembelahan HA dan berefek terhadap peningkatan patogenitas virus.
NA merupakan glikoprotein utama kedua serta protein membran integral II dari virus influenza A dengan ujung N-nya berorientasi ke bagian dalam virus. Antibodi yang mengarah terhadap NA biasanya tidak dinetralisasi, tetapi imunisasi dengan aktivitas enzimatik protein NA diperlukan untuk mengeluarkan asam sialat dan akhirnya mengeluarkan asam sialat dari karbohidrat yang terdapat pada glikoprotein virus sehingga tidak terjadi agregasi antar virus (Swyne, 2008).
2.3.3 Protein matriks (M1 dan M2)
Virus Influenza pada RNA segmen 7 yang bisistronik, mengkode protein M1 dan M2. Protein M1 merupakan komponen mayor dari virion yang termasuk dalam rangkaian di dalam amplop dan terlibat dalam pembentukan virus baru. Protein matrik memiliki bentuk tetramer dan memiliki aktifitas chanel ion H+dan akan teraktifasi oleh pH yang rendah dalam endosom, terjadinya pengasaman di dalam virion akan memberikan fasilitas terhadap pelepasan virus di dalam sel hospes. Protein M1 berada pada envelope dan berfungsi sebagai perkembangbiakan dan pertunasan virus. Selain protein HA dan NA juga terdapat protein M2 yang tergabung dalam virion. Protein M2 merupakan protein integral membran yang merupakan saluran ion dari sambungan RNA yang memfasilitasi migrasi RNP virus di dalam sel (Webster et al, 1992).
Selain protein M1 dan M2, juga terdapat protein NP (nukleoprotein) dan 3 subunit polimerase yaitu (PB1,PB2 dan PA). Keempat protein tersebut membentuk sebuah komplek RNP (ribonukleoprotein) yang berfungsi dalam replikasi RNA dan transkripsi. Protein NS2 berada di virion dan memiliki
peranan yang penting dalam pengeluaran RNP (ribonukleoprotein) melalui interaksi dengan protein M1(Webster et al, 1992).
2.3.4 Protein non struktural (NS1 dan NS2)
RNA segmen 8 mengkodekan dua protein nonstruktural yaitu NS1 dan NS2. mRNA NS1 colinear dengan vRNA, sedangkan mRNA NS2 adalah diperoleh dari splicing. Protein ini, khususnya NS1, jumlahnya banyak dalam sel yang terinfeksi (NS1 terutama terdapat dalam inti, NS2 terutama terdapat dalam sitoplasma) tetapi tidak masuk dalam progeni virion. Kedua protein berfungsi dalam replikasi virus, tetapi fungsinya belum sepenuhnya didefinisikan. NS2 muncul untuk sintesis NS. Protein NS1 merupakan protein nonstruktural virus Influenza A dan memiliki fungsi yang bermacam-macam meliputi pengaturan pemisahaan dan pengeluaran nukleus dari mRNA seluler yang merupakan hasil rangsangan translasi (Webster et al, 1992).
2.3.5 Protein polymerase basic (PB1 dan PB2)
Protein PB1 dikodekan oleh RNA segmen 2, berfungsi dalam RNA polimerase sebagai protein yang bertanggung jawab untuk pemanjangan virus mRNA dan untuk perpanjangan untuk template RNA dan sintesis vRNA. Protein PB1 ada dalam inti sel yang terinfeksi.
Protein PB2 dikodekan oleh RNA segmen 1. Protein ini adalah protein kompleks yang membantu RNA aktivitas polimerase. Protein ini berfungsi selama transkripsi mRNA virus sebagai protein yang mengikat 5 ' mRNA sel inang sebagai transkripsi mRNA virus primer. Protein PB2 berperan pada proses sintetis RNA, yaitu, sintesis template full-length dan vRNA, sejak proses ini tidak
memerlukan primer karena disintesis protein PB2 sehingga virus bermigrasi ke inti sel terinfeksi (Webster et al, 1992).
2.3.6 Protein polymerase A (PA)
Protein PA dikode oleh RNA segmen 3. Letak dari protein ini ada di dalam inti sel yang terinfeksi dan merupakan RNA polimerase kompleks bersama dengan PB1 dan PB2 namun perannya dalam sintesis RNA virus tidak diketahui. Fungsi protein PA adalah berikatan dengan RNA dan protein polimerase dan membentuk komponen utama virus (Webster et al, 1992)
2.3.7 Protein nukleoprotein (NP)
NP dikode oleh RNA segmen 5. Protein NP masuk ke dalam inti sel yang terinfeksi, di mana ia mengikat RNA virus. NP berperan dalam pertukaran RNA polimerase virus pada proses sintesis mRNA untuk cRNA dan sintesis vRNA. Dalam jumlah yang banyak NP disintesis dalam sel yang terinfeksi dan merupakan protein yang banyak di virion virus influenza. NP juga merupakan target utama respon imun dari sitotoksik T-sel (Webster et al, 1992).
2.4. Mutasi Virus Influenza A
Virus influenza mengalami evolusi secara terus menerus, terutama pada glikoprotein permukaan. Variabilitas pada virus merupakan hasil dari akumulasi perubahan molekuler dari delapan segmen RNA yang dapat terjadi melalui mekanisme mutasi titik (antigenic drift) dan reassortment gen (antigenic shift) (Webster, 1992). Mutasi yang meliputi substitusi, delesi, dan insersi adalah salah satu mekanisme yang paling penting yang menyebabkan variasi dalam virus influenza. Enzim polymerase virus ini tidak memiliki proofreading sehingga
diperkirakan berperan dalam kesalahan replikasi sekitar 1 basa dalam setiap 104 basa (Metreveli, 2006).
Antigenic drift merupakan mutasi yang dialami oleh virus influenza A yang berjalan lambat. Antigenic drift terjadi karena perubahan kecil pada gen HA dan NA yang disebabkan akumulasi mutasi titik secara random dan hal ini merupakan penyebab terjadinya masa interpandemik serta permasalahan ketika produksi vaksin dilakukan secara massal. Sedangkan antigenic shift merupakan hasil reassortment antara virus Influenza A yang berasal dari unggas (H5N1) dan virus Influenza dari manusia (H3N2, H1N1) sehingga menimbulkan perubahan pada gen HA dan tidak dikenali oleh respon imun manusia. Virus hasil reassortment antara virus yang berasal dari unggas dan manusia memiliki kemampuan untuk menyebar secara cepat dan menyebabkan morbiditas dan mortalitas yang tinggi (Treanor, 2004; Knipe, 2007). Namun perlu diketahui bahwa kapan mutasi terjadi pada virus yang menyebabkan virus menjadi lebih virulen tidak dapat diprediksi dan biasanya mutasi bisa segera terjadi setelah virus menular dari inang alaminya (Knipe, 2007).
Dari analisis filogenetik diperoleh bahwa semua subtipe virus Influenza A terdapat pada spesies unggas, sehingga semua virus influenza A pada mamalia berasal dari unggas. Pada level nukleotida dan asam amino tingkat evolusi virus avian influenza sangat rendah. Kenyataannya, dalam tubuh unggas air liar virus influenza tampak dalam tahap evolusi. Hal ini menunjukkan bahwa adaptasi optimal virus tersebut pada host alaminya. Sehingga substitusi asam amino mungkin tidak memberikan keuntungan seleksi. Maka, walaupun mutasi terjadi dengan frekuensi yang sama hal tersebut tidak menimbulkan perubahan asam
amino. Sebaliknya, semua segmen gen dari unggas peliharaan dan mamalia terus mengakumulasi substitusi asam amino (Knipe, 2007).
Untuk virus influenza A, tingkat evolusinya berbeda diantara segmen yang dimiliki. Hal ini mungkin menunjukkan perbedaan dalam seleksi tekanan host. Sebagai contoh, tingkat evolusi gen HA dari virus H3 lebih cepat dibanding gen PB2, PB1, PA, NP, dan M1. Terjadi rasio silent mutation yaitu total perubahan berbeda secara signifikan diantara gen-gen yang berbeda. Untuk gen HA virus H3 manusia hanya 57% dari semua perubahan yang terjadi merupakan silent mutation sedangkan untuk gen PB2 lebih dari 90%. Variasi mutasi yang terjadi pada gen HA mungkin terseleksi karena mutasi pada gen HA dapat menyebabkan virus mampu menghindar dari respon imun host. Sebaliknya gen PB2 pengaruh tekanan respon imun hanya sedikit (Knipe, 2007).
2.4.1. Antigenic drift dan antigenic shift
Antigenic drift adalah perubahan kecil dari virus yang kontinyu dan gradual melalui akumulasi mutasi spontan yang terjadi di tempat pengikatan antibodi pada HA, NA atau keduanya yang dapat meniadakan pengikatan antibodi (Treanor, 2004; CDC, 2005).
Enzim polymerase virus influenza tidak mempunyai kemampuan proof reading sehingga diperkirakan berperan dalam kesalahan replikasi yaitu sekitar 1 basa dalam setiap 104 basa. Hal inilah yang mengakibatkan seringnya terjadi mutasi pada virus influenza. Mutasi yang meliputi subsitusi, delesi dan insersi adalah salah satu mekanisme yang paling penting dalam menyebabkan variasi pada virus influenza. (Holland et al., 1982; Stainhauer dan Holland, 1987).
Mutasi titik dapat terjadi pada berbagai posisi tertentu dari nukleotida genom penyandi dua glikoprotein permukaan virus influenza yaitu HA dan NA. Pada mamalia, antigenic drift sebagai akibat dari seleksi positif dari mutan spontan oleh antibodi penetralisir. Perubahan kecil dan gradual dari virus yang sering terjadi ini menimbulkan strain virus baru yang mungkin tidak dikenali oleh antibodi dari strain virus influenza sebelumnya pada tubuh manusia (CDC, 2004; Kamps et al., 2006, Knipe et al., 2007).
Frekuensi mutasi pada asam amino HA dan NA dari virus influenza manusia kurang dari 1 % pertahun. Meski begitu, antigenic drift dapat menghasilkan varian atau strain baru dan dapat menimbulkan epidemik serta bertahan hinggga 2-5 tahun sebelum digantikan oleh strain atau varian baru (Knipe et al., 2007). Proses yang terjadi adalah sebagai berikut : seseorang yang terinfeksi dengan strain virus influenza tertentu akan memproduksi antibodi untuk melawan virus tersebut dan ketika strain baru muncul maka antibodi yang digunakan untuk melawan virus influenza sebelumnya tidak lagi mengenali virus yang baru. Itulah sebabnya kenapa seseorang bisa terkena flu lebih dari sekali. Strain baru dari virus influenza sebagai hasil dari antigenic drift ini dapat menyebabkan epidemi yang muncul setiap 1-2 tahun sekali. Hal ini yang menjadi dasar vaksinasi influenza harus diperbarui setiap tahun (CDC, 2004).
Contoh kasus dari hasil antigenic drift virus influenza adalah perubahan susunan 13 asam amino dari subunit HA1 virus influenza A/Fujian/411/2002 bila dibandingkan dengan strain H3 sebelumnya yakni A/Panama/2007/99. Perubahan ini mempengaruhi pengikatan antibodi dengan HA, dimana pada penelitian didapatkan data kadar antibodi yang meningkat bila diuji dengan
A/Panama/2007/99 akan menurun hingga seperempat titer ketika diuji dengan A/Fujian/411/2002 (Treanor, 2004).
Antigenic shift adalah perubahan yang besar dan drastis, yang dapat terjadi pada virus influenza A, menghasilkan virus influenza A subtipe baru yang dapat menginfeksi manusia dan memiliki protein HA dan atau kombinasi protein HA dan NA yang belum pernah dijumpai sebelumnya pada populasi manusia dalam jangka waktu yang lama (CDC, 2004).
Pandemi merupakan kejadian langka yang muncul setiap 10-50 tahun. Pada abad ke-20, sudah terjadi 5 kali pandemi influenza A; Spanish flu (1918-1919) yang menelan korban jiwa lebih dari 50 juta orang, Asian flu (1957), Hong Kong flu (1968), Russian flu (1977) dan yang terbaru adalah Swine flu (2009) (Neumann et al., 2009; Novel S-OIV investigation team, 2009).
Terdapat tiga cara terjadinya antigenic shift, yaitu : 1) Terjadi reassortment – subtipe virus baru yang muncul merupakan reassortant dari infeksi ganda, sehingga kedelapan segmen RNA dari masing-masing virus akan melakukan reassortment. Virus yang melakukan reassortment biasanya berasal dari spesies inang yang berbeda bukan dari spesies inang yang sama, misalnya antara virus manusia dengan virus avian. Mekanisme yang terjadi adalah sebagai berikut : unggas air akan “memberikan” virus influenza A strain avian ke inang perantara seperti babi atau ayam. Manusia juga “memberikan” virus influenza A strain manusia ke inang perantara yang sama. Jika kedua jenis virus ini menginfeksi sel yang sama maka proses reassortment akan terjadi. Virus baru ini menyebar dari inang perantara tersebut ke manusia kembali. 2) Virus influenza A strain avian, tanpa mengalami perubahan dapat “melompat” langsung dari unggas air / burung
ke manusia. Strain yang baru dapat berevolusi sehingga bisa menyebar antar manusia. 3) Virus influenza A strain avian, tanpa mengalami perubahan dapat “melompat” langsung dari unggas air / burung ke inang perantara seperti babi lalu ke manusia (Kamps et al, 2006).
Antigenic shift dapat menghasilkan subtipe virus influenza A yang baru. Jika subtipe baru ini ‘dikenalkan’ pada populasi manusia atau jika manusia tidak atau sedikit memiliki proteksi terhadap virus baru ini, dan jika virus ini dapat dengan mudah menyebar antar manusia, maka pandemi dunia akan terjadi (CDC, 2005).
Antigenic shift umumnya disebabkan oleh reassortment, seringkali antara virus manusia dan virus avian. Melalui analisis filogenetik, virus influenza yang menyebabkan Spanish flu disebabkan oleh ‘pengenalan’ virus avian pada populasi manusia. Demikian pula dengan pandemik influenza tahun 1957 dan 1968, keduanya merupakan hasil reassortment dari virus manusia dan virus avian (Guan et al., 2004).
2.5 Tinjauan tentang Monyet (Macaca fascicularis)
Monyet mempunyai nama umum yang sangat bervariasi, misalnya kera ekor panjang atau monyet, monyet pemakan kepiting (Cynomolgus macaque). Macaca mulata monyet yang berasal dari India dan monyet ekor babi (Macaca nemestrina) dari Asia Tenggara, tetapi nama ilmiahnya adalah Macaca fascicularis (Nidom, 2010; Gardner, 2008). Hewan ini termasuk ordo primatas, famili cercopithecidae, genus macaca, spesies Macaca fascicularis. Bentuk fisik secara umum memiliki panjang tubuh dewasa 38-55 cm, ekor lebih panjang dari tubuhnya sekitar 40-65 cm, dengan berat badan monyet jantan 5-9 kilogram,
monyet betina 3-6 kilogram. Monyet merupakan hewan social yang berkelompok, omnivora fakultatif dan mencapai umur dewasa untuk betina sekitar lima sampai enam bulan (Nidom, 2010).
Gambar 2. 4 Monyet ekor panjang ( Macaca fascicularis) (koleksi foto AIRC-Unair)
Macaca merupakan hewan primata yang banyak digunakan sebagai model untuk penelitian biomedik selama lebih dari 70 tahun guna meneliti penyakit-penyakit infeksius yang disebabkan oleh bakteri, virus, jamur, parasit dan prion. Melalui studi eksperimental pada macaca, maka para peneliti dapat mengamati tentang mekanisme patogenik serta pendekatan vaksin dan pengobatan baru berbagai penyakit karena dianggap macaca memiliki kedekatan dengan manusia. Keunggulan lain dari macaca sebagai hewan coba adalah karena bersifat omnivora, mudah beradaptasi pada lingkungan yang beragam (Gardner, 2008).
Kemiripan genetik dan fisiologis antara manusia dan hewan primata maka macaca merupakan hewan model yang memiliki respon sangat dekat dengan
manusia terhadap infeksi virus influenza dibanding hewan mamalia lain seperti mencit dan ferret. Oleh karena itu hewan primata banyak digunakan untuk penelitian infeksi virus influenza yang Highly pathogenic seperti virus avian influenza H5N1. Primata sangat peka terhadap infeksi sejumlah virus influenza A yang tidak beradaptasi pada manusia seperti H1N1 pandemi 2009, virus pandemi 1918, H3N2 dan H5N1. Infeksi pada rhesus macaca secara intranasal dengan virus PR8 tidak nampak gejala infeksi seperti demam, anoreksia atau gejala pernafasan, hanya menampakkan gejala leucopenia serta netralisasi antibodi terhadap virus yang diinfeksikan pada hari ke sepuluh. Lain halnya jika virus diinokulasikan langsung ke dalam trakea akan menunjukkan gejala serta symptom yang sama seperti infeksi influenza paling tidak selama dua hari setelah infeksi. Sedangkan macaca yang diinfeksikan dengan virus HPAI H5N1 akan menunjukkan gejala demam dua hari setelah infeksi serta menunjukkan gejala seperti batuk, anoreksia, dan cyanosis perifer (Bouvier, 2010).
2.6 Tinjauan tentang ayam (Gallus gallus)
Ayam merupakan host virus influenza A (H5N1), sehingga ayam dapat digunakan sebagai hewan coba infeksi virus H5N1 untuk mendapatkan gambaran klinis maupun patogenisitas infeksi virus H5N1. Menurut Haga dan Horimoto (2010), dalam bidang penelitian veteriner host alami dapat digunakan sebagai hewan coba penelitian infeksi secara eksperimental.
Gambar 2.5 Ayam (Gallus gallus) (koleksi foto AIRC-Unair)
Infeksi virus HPAI pada ayam akan menimbulkan gejala berupa swelling endotel pembuluh darah, kongesti yang bersifat sistemik, hemoragi, infiltrasi sel mononuclear di pervaskular dan thrombosis. Virus HPAI akan bereplikasi secara efisien di dalam endotel pembuluh darah, dan sel parenkim perivaskuler sehingga dapat menimbulkan gejala infeksi sistemik. Infeksi virus HPAI dosis tinggi akan menyebabkan replikasi virus secara sistemik pada unggas yang akan dikeluarkan melalui feses (shedding virus). Sebaliknya infeksi pada ayam dengan virus LPAI terutama akan bereplikasi dalam usus dan organ respirasi selanjutnya akan dikeluarkan melalui feses unggas yang terinfeksi. Virus akan ditransmisikan melalui rute fecal-contaminated water oral ke unggas yang lain (Haga and Horimoto, 2010)
2.7 Tinjauan tentang Ferret (Mustela putorius)
Ferret adalah mamalia dari jenis Mustela putorius furo. Ferret jantan lebih besar dibanding dengan ferret betina. Mereka biasanya memiliki warna coklat, bulu hitam, putih, atau campuran. Mereka memiliki panjang rata-rata 20 inci (51
cm) termasuk 5 inci (13 cm) ekor, berat sekitar 1,5-4 kg (0,7-2 kg), dan berumur antara 7 sampai 10 tahun.
Gambar 2.6 Ferret (Mustela pustorius) (koleksi foto AIRC-Unair)
Taksonomi dari ferret adalah sebagai berikut: Kingdom: Animalia, Phylum: Chordata, Class: Mammalia, Order: Carnivora, Family: Mustelidae, Genus: Mustela, Species: Mustela putorius, Subspecies: Mustela pustorius furo.
Ferret menjadi hewan coba untuk influenza sejak tahun 1933 dimana terjadi kasus influenza yang disebabkan rhinitis. Sejak saat itu ferret digunakan sebagai hewan coba untuk mempelajari berbagai aspek infeksi virus influenza pada manusia. Menurut Maher (2004) ferret telah terbukti menjadi hewan coba yang baik untuk mempelajari influenza karena alasan sebagai berikut: 1) Infeksi influenza pada ferret memiliki tanda-tanda klinis, patogenesis, dan imunitas menyerupai pada manusia. 2) Virus influenza tipe A dan B pada manusia secara alami dapat menginfeksi ferret, sehingga dapat diamati interaksi penularan, infeksi penyakit, dan variasi urutan asam amino dalam glikoprotein dari virus influenza.
3) Ferret memiliki karakteristik fisik lainnya yang menjadikannya hewan coba yang ideal untuk menguraikan manifestasi dari penyakit.
Ferret diyakini menjadi hewan coba yang baik untuk penelitian virus HPAI karena transmisi langsung dari virus HPAI H5N1 dari unggas ke manusia. Hal ini diamati pada kasus di Hong Kong pada tahun 1997 dimana virus yang diisolasi dari manusia dievaluasi pada ferret ternyata memiliki kemampuan untuk meniru dan menyebabkan penyakit di ferret. Tahun 1997 wild type H5N1 pada manusia virus dari Hong Kong yang sangat virulen pada ferret , tidak seperti patogenitas diferensial dihasilkan pada tikus. Wildtype tahun 2004 virus H5N1 manusia dari Vietnam dan Thailand menyebabkan penyakit yang fatal bagi ferret saat diinokulasi intranasal. Gejala yang tampak adalah demam tinggi, penurunan berat badan, anoreksia, lesu ekstrim, dan diare yang diamati (Haga and Horimoto, 2010).
2.8 SDS PAGE
SDS-PAGE (Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis) merupakan salah satu teknik pemisahan protein berdasarkan massa molekul relatifnya (Da atau kDa) dalam suatu medan listrik. Teknik ini dapat digunakan untuk menentukan massa molekul relatif suatu protein, penentuan kemurnian suatu protein, penentuan konsentrasi protein, penentuan adanya proteolisis dan deteksi adanya modifikasi pada protein.
Protein yang akan dipisahkan terlebih dahulu direaksikan dengan SDS, suatu detergen anionic yang mampu mendenaturasi struktur sekunder dan tersier tanpa ikatan disulfida protein, serta memberikan muatan negatif terhadap
masing-masing protein. Protein dengan berat molekul yang sama akan mengalami migrasi gel jika struktur tersiernya berbeda. Dengan adanya SDS, protein akan berada dalam bentuk liniernya sehingga pemisahan terjadi berdasarkan perbedaan berat molekulnya.
Ketika dialiri suatu medan listrik, protein yang bermuatan negatif akan bermigrasi sepanjang gel menuju kutub positif. Protein akan mempunyai pergerakan yang berbeda sesuai berat molekulnya, protein yang lebih kecil akan lebih mudah melewati pori gel sehingga terletak pada bagian bawah gel sedangkan protein yang lebih besar relatif bermigrasi lebih lama sehingga terletak pada bagian atas. Untuk mengetahui hasil pemisahan protein maka setelah proses elektroforesis gel harus diwarnai dengan larutan pewarna (Bollag, 1996).
2.9 Western Blot
Western blot adalah suatu teknik analisis yang digunakan untuk mendeteksi protein spesifik dari sampel suatu jaringan tertentu. Sebelumnya protein pada sampel dipisahkan menggunakan gel electrophoresis. Kemudian hasil electrophoresis di transfer ke membran nitrocellulos atau PVDF, dimana probe digunakan untuk mendeteksi antibodi spesifik untuk protein target tertentu.