Perspektif Vol. 16 No. 1 /Juni 2017. Hlm 24 - 32 DOI: http://dx.doi.org/10.21082/psp.v16n1.2017., 24 -32 ISSN: 1412-8004
POTENSI JAMUR Metarhizium anisopliae (METSCH.) SOROKIN UNTUK
PENGENDALIAN SECARA HAYATI HAMA URET TEBU Lepidiota stigma
(COLEOPTERA: SCARABAEIDAE)
Potency of Metarhizium anisopliae (Metsch.) Sorokin for biocontrol of sugarcane white
grub, Lepidiota stigma (Coleoptera: Scarabaeidae)
IGAA. INDRAYANI
Balai Penelitian Tanaman Pemanis dan Serat Indonesian Sweetener and Fiber Crops Research Institute
Jl. Raya Karangploso Km-4, Kotak Pos 199 Malang 65152 E-mail: indrayanigustiagung2016@gmail.com
ABSTRAK
Tebu (Saccharum officinarum L) adalah komoditas penting di Indonesia yang beberapa tahun terakhir mengalami penurunan produktivitas, yang disebabkan oleh cara-cara budi daya yang tidak sesuai prosedur dan adanya serangan hama uret, Lepidiota stigma. Hama uret berkembang sangat cepat dan stadia yang paling merusak adalah instar 3. Serangan yang terjadi pada tanaman tebu muda mengakibatkan tanaman layu kemudian mati. Hama uret sulit dikendalikan karena sebagian besar hidupnya (stadia larva) ada di dalam tanah. Umumnya hama uret dikendalikan secara intensif dengan pestisida kimia yang diaplikasikan ke dalam tanah dan berpotensi mengakibatkan pencemaran, sehingga diperlukan alternatif pengendalian yang ramah lingkungan. Uret tebu dapat dikendalikan dengan musuh alami, yaitu jamur Metarhizium anisopliae. Jamur M. anisopliae efektif mengendalikan berbagai spesies serangga hama yang hidup di atas dan di bawah permukaan tanah. Satu isolat unggul jamur M. anisopliae (JTMa-2) telah diperoleh melalui isolasi sampel tanah dari pertanaman tebu di Jawa Timur. Setelah melalui pengujian di laboratorium dan rumah kasa selama dua tahun berturut-turut, terbukti bahwa isolat JTMa-2 sangat patogenik terhadap hama uret. Upaya pengembangan JTMa-2 menjadi biopestisida di masa depan memerlukan dukungan teknik perbanyakan massal yang mudah dan efisien, serta perlu disempurnakan dengan teknik formulasi yang tepat, sehingga dapat melindungi bahan aktif inokulum jamur dari pengaruh radiasi ultraviolet ketika diaplikasikan di lapangan. Untuk mengoptimalkan potensi jamur M. anisopliae dalam pengendalian uret diperlukan pula kajian mengenai sinergisme dengan cara-cara pengendalian yang lain, terutama
penggunaan varietas tahan dan musuh alami (parasitoid dan predator).
Kata kunci: Tebu, uret, isolat, patogen serangga, inokulum
ABSTRACT
Sugarcane is an important crop in Indonesia, however its productivity is decrease currently due to insect pests mainly white grub, Lepidiota stigma. The white grub is one of the pests limiting the production of sugarcane. The grub grows rapidly and the third instar is very destructive when feeding the root of the plant. The root damage can be very severe when grub feeding on younger plants of sugarcane that cause the plant die. White grub is difficult to control because they live in soil. The control method of this grub is usually by using chemical pesticides applied into soil that harm the soil environment due to insecticides residues. Therefore, an alternative control method should be found. Sugarcane white grub can be controlled biologically using their natural enemies, including entomopathogenic fungi Metarhizium anisopliae. The most pathogenic isolate of M. anisopliae (JTMa-2) has been isolated from soil collected in sugarcane plantation in East Java. Through laboratory and screen house studies this isolate showed highly pathogenic against L. stigma. Based on those studies, the most pathogenic isolate of M. anisopliae is promising to be a biological control agents against sugarcane white grub. To develop the most promising isolate to become a biopesticide, it can be massively produced easily using local materials for low cost and support by an appropriate formulation method in order to maintain its virulence against the insect host when applied in the field. To optimize the potential of this entomopathogenic fungi, its synergism with other
control methods, especially resistant varieties of sugar cane and natural enemies, e.g. parasitoids or predators need to be studied.
Key words: Sugar cane, white grub, isolate, entomopathogen, inoculum
PENDAHULUAN
Serangan hama uret perusak akar, Lepidiota
stigma (Coleoptera: Scarabaeidae) menjadi penyebab rendahnya produksi tebu, selain penerapan cara-cara budi daya yang kurang optimal. Pada tahun 2008 dilaporkan lebih dari 40 ha tanaman tebu di wilayah Tulungagung, Jawa Timur dirusak oleh L. stigma (Anonim, 2012b). Pada tahun 2011 serangan L. stigma yang cukup tinggi terjadi di pertanaman tebu di wilayah Kabupaten Bondowoso, Jawa Timur dan mengakibatkan produksi tebu menurun, yaitu hanya mencapai 40% (400 kuintal/ha) dari potensi produksi rata-rata 1000 kuintal/ha (Alimin, 2013). Hal tersebut disebabkan belum tersedianya teknologi pengendalian L. stigma yang efektif, sehingga setiap tahun masih terjadi serangan yang cukup tinggi di beberapa lokasi tanaman tebu di Jawa Timur, seperti di Banyuputih dan Situbondo.
L. stigma merupakan salah satu serangga
hama yang potensial menimbulkan kerusakan pada tanaman tebu. Hama tersebut merusak tanaman tebu muda dengan cara memakan akar dan membuat lobang gerekan yang cukup besar pada pangkal batang tebu. Gejala awal tanaman tebu muda terserang L. stigma yaitu layu pada bagian pucuk tanaman, daun tebu yang semula hijau menjadi berwarna kekuningan mirip dengan gejala kekeringan, diikuti oleh kematian tanaman. Apabila serangan L. stigma berlanjut hingga tanaman dewasa, maka potensi penurunan produksi tebu sangat besar atau bahkan gagal panen.
Teknik pengendalian L. stigma secara mekanis pernah diterapkan dengan mengumpulkan dan memusnahkan larva (uret), menangkap imago menggunakan lampu perangkap, dan penggenangan lahan. Pestisida kimia mulai jarang digunakan dalam pengendalian L. stigma karena telah terbukti
mengakibatkan pencemaran lingkungan, khususnya pada tanah yang menjadi habitat alami berbagai biota. Hal ini menjadi salah satu pertimbangan perlunya mencari teknik pengendalian L. stigma yang efektif, efisien, dan ramah lingkungan.
Lebih dari 700 spesies dari 90 genus jamur patogen dilaporkan patogenik terhadap spesies serangga dari berbagai ordo (Zimmermann, 1993; Mohiuddin et al., 2006), namun hanya
Metarhizium anisopliae yang dikenal sangat efektif
mengendalikan serangga hama (Chroton, 2007; Roberts et al., 2004). Jamur M. anisopliae hidup di dalam tanah dan menjadi sumber infeksi potensial bagi serangga inangnya (Rodrigues et
al., 2005). Selain itu, jamur M. anisopliae dapat
mengalami dormansi (tidak aktif) apabila belum menemukan inang yang akan diinfeksi (Thakur dan Sandhu, 2010). Adanya kesamaan habitat antara L. stigma dan jamur M. anisopliae akan meningkatkan peluang terjadi infeksi. Berkaitan dengan hal tersebut, sangat penting untuk dilakukan isolasi isolat lokal (indigenus) jamur
M. anisopliae dalam upaya memperoleh isolat
yang potensial dalam pengendalian L. stigma. Tulisan ini membahas potensi jamur M.
anisopliae untuk pengendalian L. stigma secara
hayati.
SERANGAN L. Stigma DAN KERUGIAN
SECARA EKONOMI PADA TANAMAN
TEBU
Musim penghujan memberi kondisi yang menguntungkan bagi perkembangan L. stigma yang mengakibatkan meningkatnya serangan ke seluruh pertanaman sehingga diperlukan penanaman ulang yang membutuhkan biaya ekstra. Stadia larva menyerang perakaran, sedangkan stadia dewasa mencari makanan pada kanopi tanaman di sekitar lahan tebu, terutama pada pada malam hari.
L. stigma termasuk hama polifagus yang
merusak perakaran tanaman tebu. Serangan L.
stigma dapat terjadi pada individu maupun
populasi tanaman (Gambar 1). Penyebaran L.
stigma pada tanaman tebu dapat terjadi secara
cepat karena tersedia tanaman dan ratun tebu secara terus-menerus. Selain itu, ketersediaan
tanaman inang alternatif seperti keladi (talas), pisang, kelapa, gadung, kacang-kacangan, labu, ganyong, semangka, dan sebagainya juga berkontribusi terhadap penyebaran populasi L.
stigma. Hasil observasi terdahulu menunjukkan
bahwa populasi L. stigma pada lahan tebu yang berdekatan dengan pemukiman penduduk (desa) lebih tinggi dibandingkan dengan lahan yang berjarak ± 100 m dari desa (Kalshoven, 1981).
Pada tahun 2009 – 2010, sekitar 600 ha tanaman tebu di Slemen dan Purworejo dilaporkan terserang L. stigma (Anonim, 2015). Di Jawa Timur, khususnya di Tulungagung, L.
stigma dilaporkan telah merusak ± 300 ha lahan
tebu sehingga menyebabkan produktivitas tebu menurun (Anonim, 2012b). Di wilayah kabupaten Bondowoso dan Jember, sebagian petani menggali lahan tebu yang terserang L. stigma hingga kedalaman 1 m (kedalaman maksimal L.
stigma di dalam tanah), kemudian
menyewakannya untuk ditanami tanaman selain tebu (Anonim, 2012a). Hal tersebut dilakukan untuk mempertahankan produktivitas lahan agar tetap memberikan pendapatan. Tindakan tersebut bukanlah solusi yang tepat dalam mengatasi serangan L. stigma, karena tanpa disadari pemilik lahan telah melakukan kegiatan merusak alam. Beberapa lokasi di wilayah Kecamatan Asembagus, luas areal tebu yang terserang L. stigma cukup tinggi setiap tahunnya. Berdasarkan hasil observasi, setiap rumpun tanaman tebu muda yang rusak ditemukan 5 - 6 ekor larva di sekitar perakaran sehingga menyebabkan tanaman tebu mati muda.
Biasanya serangan L. stigma cepat menyebar pada tanaman tebu dalam rumpun yang sama sehingga mengakibatkan tanaman rebah dengan akar terangkat. Imago L. stigma aktif pada malam hari dan bertelur di tanah yang mengandung bahan organik tinggi. Larva L. stigma berkembang cepat dan dalam waktu 2,5 bulan ukuran tubuhnya telah mencapai ± 4 cm. Jika dibiakkan di laboratorium, satu siklus hidup L.
stigma mencapai ± 380 hari (Kalsoven, 1981).
Spesies hama uret yang merusak tanaman tebu di berbagai negara berbeda-beda. Salah satu spesies yang banyak merusak tanaman tebu di beberapa negara Afrika adalah Heteronychus licas (Conlong dan Ganeshan, 2016). Di Mauritius serangan H. licas mengakibatkan kehilangan hasil tebu hingga 100%. Spesies lain Cochcliothis
melolonthoides menyerang tanaman tebu di
Tanzania dan menyebabkan kehilangan hasil tebu ratun sekitar 70% (Behary-Paray et al., 2012). Di Tanzania, serangan hama uret menyebabkan penurunan produksi tebu dari 125 t/ha pada tebu tanam awal dan 60 t/ha pada tebu ratun menjadi rata-rata 50 t/ha pada kedua tipe ekosistem tersebut (Rahama et al., 2014).
Di India, Holotrichia consanguines Blancard dan H. nagpurensis Khan and Ghai merupakan hama uret ke dua dan ke tiga setelah H. serrata yang menyebabkan kerusakan parah pada tanaman tebu sepanjang Himalaya hingga Gujarat (Sreedevi dan Tyagi, 2015). Di Queensland Australia, lebih dari 19 spesies hama uret dilaporkan merusak tanaman tebu dan Gambar 1. Serangan L. stigma pada individu (A) dan populasi tanaman (B)
berpotensi menyebabkan kehilangan hasil tebu sekitar 23 - 55% (Miller dan Allsopp, 2000).
Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan (BBPPTP) Jawa Timur mencatat bahwa sampai dengan tahun 2011, L.
stigma menjadi kendala utama pengembangan
tebu di Jawa, dan mengakibatkan kerusakan lahan sekitar 75% di Sleman dan 80% di Purworejo (Anonim, 2015). Kerugian secara ekonomi akibat serangan hama uret pada tebu belum terdokumentasi secara lengkap, namun beberapa petani mengalami permasalahan yang cukup serius antara lain tanam ulang, panen lebih awal, atau bahkan gagal panen.
BIOLOGI JAMUR M. anisopliae DAN
INFEKSINYA PADA HAMA URET TEBU
L. stigma
Metarhizium adalah salah satu jamur patogen
serangga yang dikenal sebagai jamur green
muscardine karena mempunyai konidia (spora)
berwarna hijau. Jamur Metarhizium pertama kali diisolasi oleh Metschnikoff dari serangga hama yang menyerang tanaman gandum Anisoplia
austriaca pada tahun 1879 dan didentifikasi
sebagai Entomophthora anisopliae, dan pada tahun 1888 jamur ini digunakan pertama kali dalam pengendalian hama secara hayati (Genthner dan Middaugh, 1995). Sejak saat itu eksplorasi isolat jamur M. anisopliae semakin berkembang ke kelompok serangga lainnya, seperti Lepidoptera, Hemiptera, Diptera, Hymenoptera, dan Coleoptera (Latch, 1965). Beberapa spesies
Metarhizium berhasil diidentifikasi dari berbagai
hama kumbang Coleoptera (Gams dan Rozsypal, 1973), tetapi hanya spesies jamur M. anisopliae yang dilaporkan efektif menginfeksi kelompok Scarabaeidae (Coleoptera).
Jamur mempunyai mekanisme menginfeksi serangga yang lebih unik dibandingkan dengan bakteri, virus, dan protozoa. Inglis et al. (2001) menyatakan bahwa infeksi jamur pada hemokul serangga hanya dapat terjadi melalui kontak dengan kutikula. Meskipun jamur tertelan melalui mulut tetapi tidak akan mampu berkembang dalam usus dan akan keluar bersama feses. Infeksi jamur terjadi setelah adanya kontak antara konidia yang virulen
dengan bagian kutikula serangga yang peka. Larva yang baru berganti kulit dan pupa yang masih muda cenderung lebih peka terhadap infeksi jamur dibandingkan dengan larva atau pupa dengan kutikula yang sudah mengeras.
Pada fase awal infeksi, serangga menunjukkan gejala terinfeksi ringan, tetapi pada infeksi tahap lanjut serangga menjadi tidak aktif, aktivitas makan menurun dan kehilangan koordinasi. Serangga yang terinfeksi patogen biasanya akan bergerak menuju ke tempat yang lebih tinggi, sedangkan yang berada di dalam tanah akan muncul ke permukaan tanah. Infeksi menyebabkan serangga mengalami mumifikasi dengan tubuh mengeras dan ada inisiasi pertumbuhan jamur M. anisopliae (Gambar 2).
Gambar 2. Mikosis (mumifikasi) pada L. stigma yang terserang jamur M. anisopliae
PEMANFAATAN JAMUR M. anisopliae
DALAM PENGENDALIAN HAMA URET
TEBU L. stigma
Jamur M. anisopliae dilaporkan efektif mengendalikan berbagai spesies serangga hama baik yang hidup di dalam tanah (Jonason et al., 2005; Ravindran et al., 2015), maupun pada kanopi tanaman (Pereira et al., 2011; Agarwal et
al., 2012). Kisaran inang yang luas menunjukkan
jamur ini berpotensi menginfeksi berbagai spesies serangga hama. Zimmermann (1993) menyatakan bahwa M. anisopliae telah dimanfaatkan dalam pengendalian berbagai spesies serangga hama di beberapa negara, seperti Switzerland, Austria, New Zealand, Australia, Brasil, India, dan Mauritius. Menurut Bruck (2005), sasaran utama infeksi jamur M.
anisopliae adalah serangga hama tanah, terutama
yang merusak akar tanaman.
Hasil-hasil penelitian membuktikan bahwa jamur M. anisopliae sangat efektif mengendalikan hama uret pada tebu. Thamarai-Chelvi et al. (2010b) melaporkan bahwa aplikasi jamur M.
anisopliae pada konsentrasi 8 x 109 konidia/ml
efektif mengendalikan populasi hama uret dan meningkatkan produktivitas tebu. Hasil penelitian lainnya juga mengungkapkan bahwa aplikasi jamur M. anisopliae bersama-sama dengan jamur B. bassiana sangat potensial meningkatkan pengendalian spesies H. serrata (Thamarai-Chelvi et al., 2010a).
Penggunaan jamur M. anisopliae mampu menurunkan populasi spesies H. serrata yang mendominasi pertanaman tebu di India hingga mencapai 81% (Thamarai-Chelvi et al., 2011). Hasil penelitian lainnya di India juga menunjukkan bahwa terjadi penurunan populasi
H. serrata sebesar 92% pada 60 hari setelah
dikendalikan dengan jamur M. anisopliae dengan dosis 4 x 109 konidia/ha (Manisegaran et al., 2011).
Penggunaan jamur M. anisopliae pada dosis 1 x 1013 konidia/ha yang setara dengan 100 kg/ha
sama efektifnya dengan insektisida kimia chlorpyriphos dalam menekan populasi H. serrata (Srikanth dan Singaravelu, 2011). Selain itu, penambahan bahan organik kompos pada jamur
M. anisopliae juga efektif meningkatkan mortalitas H. serrata (Yadav et al., 2004).
Beberapa hasil penelitian pemanfaatan jamur M. anisopliae di Australia juga menunjukkan bahwa jamur tersebut sangat potensial mengendalikan hama uret pada tebu. Samson et al. (1999) menyatakan bahwa penurunan populasi hama uret pada tebu PC (plant cane) dan RC (ratoon cane) berturut-turut mencapai 50 - 60% dan 70 - 90% setelah dilakukan pengendalian dengan jamur M.
anisopliae dengan dosis 3,3 x 1013 konidia/ha.
Aplikasi produk komersial jamur M. anisopliae,
Biocane pada dengan 5 g/m baris tanaman tebu
telah efektif mengendalikan spesies Antitrogus
consanguineus hingga tahun ke dua setelah
aplikasi (Samson et al., 2010).
Selain diaplikasikan secara tunggal, jamur
M. anisopliae juga dapat dikombinasikan dengan
pupuk kandang. Aplikasi jamur M. anisopliae
dengan dosis 5 x 1013 konidia/ha yang dicampur
dengan pupuk kandang mampu meningkatkan produksi tebu di India hingga 81,4t/ha dibandingkan dengan penggunaan jamur B.
bassiana yang dikombinasikan dengan pupuk
kandang dalam dosis yang sama dengan produktivitas hanya mencapai 76,6 t/ha (Visalakshi et al., 2015). Hasil penelitian lainnya juga menunjukkan bahwa pengendalian hama uret tebu dengan jamur M. anisopliae dengan dosis 1 x 1013 konidia/ha, efektif menurunkan
populasi larva sebesar 91,9% pada 60 hari setelah perlakuan dengan produktivitas tebu tertinggi 94,2 t/ha (Kesarasing et al., 2010). Hasil-hasil penelitian tersebut di atas membuktikan bahwa potensi jamur M. anisopliae cukup tinggi dalam mengendalikan serangan hama uret pada tebu untuk meningkatkan produksi tebu.
Publikasi hasil-hasil penelitian pemanfaatan jamur M. anisopliae untuk pengendalian L. stigma yang diterapkan pada era sebelum tahun 2000 di Indonesia sangat terbatas. Salah satu hasil penelitian yang cukup berdampak positif terhadap pengembangan jamur M. anisopliae dalam pengendalian L. stigma menunjukkan bahwa aplikasi M. anisopliae di lapangan efektif mengurangi populasi L. stigma dan meningkatkan produksi tebu hingga lebih dari 60% (Harjaka et al., 2011).
POTENSI ISOLAT LOKAL JAMUR M.
anisopliae DALAM PENGENDALIAN
HAMA URET TEBU L. stigma
Jamur patogen serangga, termasuk M.
anisopliae telah menyebar di berbagai ragam
tanah seperti gurun, hutan, dan agroekosistem pertanian (Meyling dan Eilenberg, 2006; Thakur dan Sandhu, 2010; Tkaczuk et al., 2012; Khudhair
et al., 2014; Kolczarek dan Jankowski, 2014).
Sebagai habitat alami, tanah menyediakan lingkungan yang sesuai bagi perkembangan jamur, terutama untuk melindungi dari pengaruh radiasi ultraviolet dan berbagai faktor biotik-abiotik lain yang potensial menghambat perkembangan dan penyebarannya (Quesada-Moraga et al., 2007). Sebagian besar infeksi jamur
M. anisopliae terjadi pada inang yang hidup di
maka inokulum akan mengalami dormansi sampai ditemukan inang yang baru (Hasan et al., 2012). Hal tersebut menunjukkan bahwa peluang untuk menemukan inokulum jamur M. anisopliae cukup tinggi karena isolasi dari dalam tanah juga relatif mudah (Zimmermann,1993).
Hasil eksplorasi isolat yang dilakukan pada tahun 2013 menunjukkan bahwa 55% contoh tanah yang diambil dari lahan tebu di Jawa Timur mengandung inokulum jamur M. anisopliae berdasarkan pada data mortalitas ulat Tenebrio molitor yang digunakan sebagai umpan
(Indrayani et al., 2014). Hasil uji patogenisitas di laboratorium menunjukkan bahwa isolat JTMa-2 paling patogenik terhadap L. stigma instar 3 dengan mortalitas tertinggi 91,7% (Indrayani et
al., 2014).
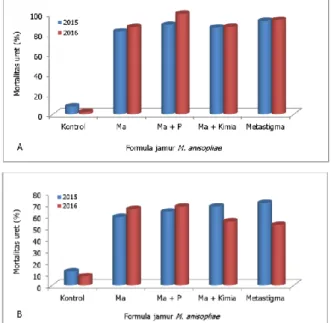
Efektivitas formula jamur M. anisopliae yang masing-masing ditambahkan bahan-bahan aditif, seperti tanah steril, pupuk kandang dan insektisida kimia sistemik (imidakloprid) juga telah diuji terhadap L. stigma selama dua tahun berturut-turut (2015 dan 2016). Gambar 3 menunjukkan tingkat mortalitas L. stigma yang konsisten tinggi selama dua tahun pengujian di laboratorium dan rumah kasa (Indrayani et al., 2015).
Gambar 3. Mortalitas L. stigma pada berbagai formula jamur M. anisopliae di laboratorium (A) dan rumah kasa (B).
Dengan mengetahui potensi jamur M.
anisopliae dalam pengendalian L. stigma, maka
sangat berpeluang untuk dikembangkan menjadi pestisida hayati. Namun demikian, untuk dapat menjadi biopestisida komersial diperlukan dukungan teknologi perbanyakan massal yang mudah dan murah, misalnya menggunakan bahan-bahan lokal seperti jagung atau beras yang diproses secara liquid-solid diphasic method, yaitu kombinasi antara media cair dan padat (Bhadauria et al., 2012; Latifian et al., 2014; Sujatha
et al., 2016).
Upaya pengembangan jamur M. anisopliae menjadi biopestisida komersial diperlukan dukungan pengetahuan dan informasi mengenai sinergisme dengan cara-cara pengendalian lainnya, terutama penggunaan varietas tahan dan musuh alami (parasitoid dan predator) untuk mengoptimalkan peran jamur M. anisopliae dalam pengendalian L. stigma dan mendukung keberlanjutan strategi pengendalian hama secara terpadu.
KESIMPULAN DAN SARAN
Serangan L. stigma dapat menyebabkan kematian pada tanaman tebu muda dan menurunkan produktivitas pada tanaman dewasa. Pengendalian secara mekanis maupun budi daya yang pernah diterapkan belum bermanfaat secara optimal dalam menurunkan serangan L. stigma. Pengendalian secara hayati dengan memanfaatkan jamur M. anisopliae merupakan solusi yang cukup bijak untuk mengatasi serangan L. stigma. Isolat unggul lokal jamur M. anisopliae (JTMa-2) sangat patogenik terhadap L. stigma dan berpeluang untuk dikembangkan menjadi biopestisida. Oleh karena itu diperlukan dukungan teknik perbanyakan massal yang efisien menggunakan bahan-bahan lokal dan teknik formulasi yang tepat agar tetap efektif di lapangan. Untuk mengoptimalkan potensi jamur M. anisopliae dalam pengendalian
L. stigma, maka masih diperlukan pengetahuan
dan informasi mengenai sinergisme dengan teknik pengendalian lainnya, terutama varietas tahan dan musuh alami (parasitoid dan predator) yang memiliki kemampuan mengoptimalkan
peran jamur M. anisopliae dan mendukung keberlanjutan pengendalian secara hayati.
DAFTAR PUSTAKA
Agarwal, R., A. Choudhary, N. Tripathi, S. Patil, S. Agnihotri, and D. Bharti. 2012. Biopesticidal formulation of
Metarhizium anisopliae effective against
larvae of Helicoverpa armigera.
International Journal of Agricultural and Food Science 2(2): 32-36.
Anonim. 2012a. Pengendalian hama uret tebu (Lepidiota stigma) secara terpadu. Tani45.blogspot.co.id/2012/09/pengen dalian-hsms-uret-tebu-Lepidiota.html. [diunduh Tgl 19 Agustus 2017]. Anonim. 2012b. Lepidiota stigma menyerang
tanaman tebu di Kecamatan Kedungwaru, Tulungagung, Jawa
Timur. Bpp
kedungwaru.blogspot.co.id/2012/II/le pidiota.stigma-menyerang-tanaman-tebu.html. [diunduh Tgl. 15 Juli 2016]. Anonim, 2015. Jamur Metarhizium anisopliae
efektif basmi hama uret. Https://www.ugm.ac.id/id/berita/9654 /jamur.metarhizium.anisopliae.efektif. basmi.hama.uret.[diunduh Tgl. 4 Agustus 2017]
Alimin, 2013. Pengendalian uret tebu di Kabupaten Bondowoso. http://ditjenbun.pertanian.go.id/Sinta. html. [diunduh Tgl. 15 Juli 2016]. Behary-Paray, N., S. Mmanga, J.L. Hatting, D.E.
Conlong, and S. Ganeshan. 2012. Detection, isolation and characterization of white grub (Coleoptera: Scarabaeidae) pathogens in Mauritius and Tanzania. Proc. S. Afr. Sug. Technol Ass 85: 123-126. Bhadauria, B.P., S. Puri, and P.K. Singh. 2012.
Mass production of entomopathogenic fungi using agricultural products. The Bioscan 7(2): 229-232.
Bruck, D.J. 2005. Ecology of Metarhizium
anisopliae in soilless potting media and
the rhizosphere implications for pest
management. Biological Control 32: 155-163.
Chroton, P. 2007. Insect pest control by entomopathogenic fungi. Mycologia 16(2): 23-27.
Conlong, .E. and S. Ganeshan. 2016. Sugarcane whitegrubs (Coleoptera: Scarabaeidae) in Africa and Indian Ocean Islands: Their pest status and the potential for fungal entomopathogenic control. Proc. S. Afr. Sug. Technol. Ass. 89: 116-124.
Gams, W. and J. Rozsypal. 1973. Metarhizium
flavoviridae isolated from insects and
from soil. Acta Botanica Neerlandica 22: 518-521.
Genthner, F. J. and D.P. Middaugh. 1995. Nontarget tesing of an insect control fungus: effects of Metarhizium anisopliae on developing embryos of
the inland silverside fish Menidia
betyllina. Dis. Aquat. Org. 22: 163-171.
Harjaka, T., E. Martono, Witjaksono, dan B.H. Sunarminto. 2011. Potensi jamur
Metarhizium anisopliae untuk
pengendalian uret perusak akar tebu. Semnas Pesnab IV di Jakarta. 12 hlm. Hasan, W.A., L.H. Assaf and S.K. Abdullah. 2012.
Occurrence of entomopathogenic and other opportunistic fungi in soil collected from insect hibernation sites and evaluation of their entomopatogenic potential. Bull. Iraq nat. Hist. Mus 12(1): 19-27.
Indrayani, IGAA., D. Winarno dan A.M. Amir. 2014. Bioinsektisida berbasis jamur
Metarhizium anisopliae untuk
pengendalian hama uret tebu. Laporan Teknis Kegiatan Penelitian Balai Penelitian Tanaman Pemanis dan Serat. 10 hlm.
Indrayani, IGAA., D. Winarno dan A.M. Amir. 2015. Efektivitas formula biopestisida berbasis jamur Metarhizium anisopliae terhadap hama uret perusak akar tebu. Laporan Teknis Kegiatan Penelitian Balai Penelitian Tanaman Pemanis dan Serat. 10 hlm.
Inglis, G.D., M.S. Goettel, M.T. Butt, and H. Strasser. 2001. Use of Hyphomyceteous Fungi for Managing Insect Pests. In: Fungi as Biocontrol Agents – Progress, Problems and Potential (T.M. Butt, C. Jackson and N. Magan) (eds.). CABI Press, Wallingford, UK., pp. 23-69.
Jonason, N.B., M.A. Boetel, J.D. Eide, L.G. Campbell, and B.R. Marepalli. 2005. Virulence of Metarhizium anisopliae (Deuteromycotina: Hyphomycetes) to sugarbeet root maggot (Diptera: Ulidiidae) larvae. Journal of Sugarbeet Research 42(3-4): 2005. Kalshoven, L.G.E. 1981. The Pests of Crops in
Indonesia. Revised by P.A. Van Der Laan. PT. Ichtiar Baru Jakarta. 701pp. Kesarasing, U.H., R.K. Patil and Y.H. Sujay. 2010.
Field evaluation of Metarhizium anisopliae (Metschnikoff) Sorokin against white grubs in sugarcane and arecanut. Society for Biocontrol Advancement 24(4). 1p. Abstract. Khudhair, M.W., H.F. AlRubeai, M.Z. Khalaf,
A.K. Shabar, B.S. Hamad and H.S. Khalaf. 2014. Occurrence and distribution of entomopathogenic fungi in Iraqi agro-ecosystems. International Journal of Entomology Research 02(02): 117-124.
Kolczarek, R. and K. Jankowski. 2014. Occurrence of entomopathogenic fungi in soils from Festuca pratensis Huds. crop. J. Ecological Engineering 15(2): 73-77.
Latifian, M., B. Rad and M. Amani. 2014. Mass production of entomopathogenic fungi Metarhizium anisopliae by using agricultural products based on liquid-solid diphasic method for date palm pest control. International Journal of Farming and Allied Sciences 3(4): 368-372.
Manisegaran, S., S.M. Lakshmi, and V. Srimohanapriya. 2011. Field evaluation of Metarhizium anisopliae (Metschnikoff) Sorokin against
Holotrichia serrata (Blanch) in
sugarcane. Journal of Biopesticides 4(2): 190-193.
Meyling, N.V. and J. Eilenberg. 2006. Occurrence and distribution of soil borne entomopathogenic fungi within a single organic agroecosystem. Agriculture, Ecosystems and Environment 113: 336-341.
Miller, L.J. and P.G. Allsopp. 2000. Identification of Australian canegrubs (Coleoptera: Scarabaeidae: Melolonthini). Invertebrate Taxonomy 14: 377-409. Mohiuddin, S., F.A. Zaki, N.A. Munzi, A. Jan, and
P. Sultan. 2006. Evaluation of some entomopathogenic fungal isolates from Kashmir for the biocontrol of white grub infesting turf in golf course. Journal of Biological Control 20: 45-49.
Pereira, A., P. Casals, A.M. Salazar, and M. Gerding. 2011. Virulence and pre-lethal reproductive effects of
Metarhizium anisopliae var anisopliae on Pseudococcus viburni (Hemiptera: Pseudococcidae). Chilean Journal of Agricultural Research 71(4): 554-559. Quesada-Moraga, E., J.A. Navas-Cortez, A.A.
Maranhao, A.S. Ortiz-Urquiza, dan C. Santiago-Alvarez. 2007. Factors affecting the occurrence and distribution of entomopathogenic fungi in natural and cultivated soils. Mycol. Res., 111:947-966.
Rahama, O.R.M., A.M. Abdalla, and A.M. El Naim. 2014. Control of white grubs
Adoretus emarginatus Ohaus and
Heteronychus licas Klug (Coleoptera:
Scarabaeidae) in sugarcane. World Journal of Agricultural Research 2(4): 155-158.
Ravindran, K., D. Qiu and S. Sivaramakrishnan. 2015. Sporulation characteristics and virulence of Metarhizium anisopliae against subterranean termites (Coptotermes formosanus). International Journal of Microbiological Research 6 (1): 01-04.
Roberts, D.W. and R.J. St. Leger. 2004.
Metarhizium spp., cosmopolitan
insect-pathogenic fungi: mycological aspects. Adv. Appl. Microbiol. 54: 1-70.
Rodrigues, S., R. Paveling, P. Nagel, and S. Keller. 2005. The nature distribution of the entomopathogenic soil fungus
Metarhizium anisopliae in different
regions and habitat types in Switzerland. Insect Pathogens and Insect Parasitic Nematodes: Melolontha. IOBC/wprs Bulletin 28(2): 185-188.
Samson, P.R., R.J. Milner, G.K. Ballard, and D.M. Hogorth. 1999. Development of
Metarhizium as biopesticides for sugarcane pest management, current progress and future prospects, pp. 156-163. In Proceedings of the 1999 Conference of the Australian Society of Sugarcane Pest Technologist, Town Ville Queensland, Australia.
Samson, P.R., G.S. Bade, and W.J. Harris. 2010. Efficacy of Biocane against southern one-year canegrub, Antitrogus consanguineus. Proc. Aust. Soc. Sugar
Cane Technol. 32: 50-61.
Sreedevi, K. and S. Tyagi. 2015. Species diversity of white grubs associated with sugarcane ecosystem of western Uttar Pradesh – A. case study. Current Biotica 8(4): 404-410.
Srikanth, J. and B. Singaravelu. 2011. White grub (Holotrichia serrata) as pest of sugarcane and its management. Technical Bulletin No. 97 pp. 1-8, Sugarcane Breeding Institute Coimbatore, India.
Sujatha, K., C. Srilakshmi and E.A. Lenin. 2016. Selection of a suitable medium for the mass production of some selected entomopathogenic fungus. International Journal of Recent Scientific Research 7(7): 12370-12372. Thakur, R. dan S.S. Sandhu. 2010. Distribution,
occurrence and natural invertebrate hosts of indigenous entomo-pathogenic fungi of Central India. Indian J. Microbiol. 50(1): 89-96.
Thamarai-Chelvi, C., R. Thilagaraj, R. Kandasamy. 2010a. A laboratory and field efficacy of entomopathogenic fungi Beauveria brongniarti, Beauveria
bassiana and Metarhizium anisopliae in
the control of sugarcane white grub (Holotrichia serrata). Biopestic. Int. 6(1): 85-88.
Thamarai-Chelvi, C., W.R. Thilagaraj, and R. Kandasamy. 2010b. Field efficacy of the biopesticide (Metarhizium
anisopliae) against sugarcane white
grubs (Holotrichia serrata). Green Farming 1: 85-87.
Thamarai-Chelvi, C., W.R. Thilagaraj, and R. Nalini. 2011. Field efficacy of formulations of microbial insecticide
Metarhizium anisopliae (Hyphocreales:
Clavicipitaceae) for the control of sugarcane white grub Holotrichia
serrata F. (Coleoptera: Scarabaeidae).
Tkaczuk, C., T. Krzyczkowski and R. Wegensteiner. 2012. The occurrence of entomopathogenic fungi in soils from mid-field woodlots and adjacent small-scale arable fields. Acta Mycologica 47(2): 191-202.
Visalakshi, M., B. Bhavani and S. Govinda Rao. 2015. Field evaluation of entomopathogenic fungi against white grub, Holotrichia consanguineus Blanch in sugarcane. Informatics Journals 29(2). Abstract.
Yadav, B.R., P.C. Trivedi and CPS. Yadava. 2004. Application of entomopatogen,
Metarhizium anisopliae and Beauveria bassiana against egg, pupa and adult of
white grub (Holotrichia consanguineus Blach). Ann. Agri. Bio-Research 9(1): 71-73.
Zimmermann. 1993. The entomopathogenic fungus Metarhizium anisopliae and its potential as a biocontrol agent. Pesticide Science 37:375-379.