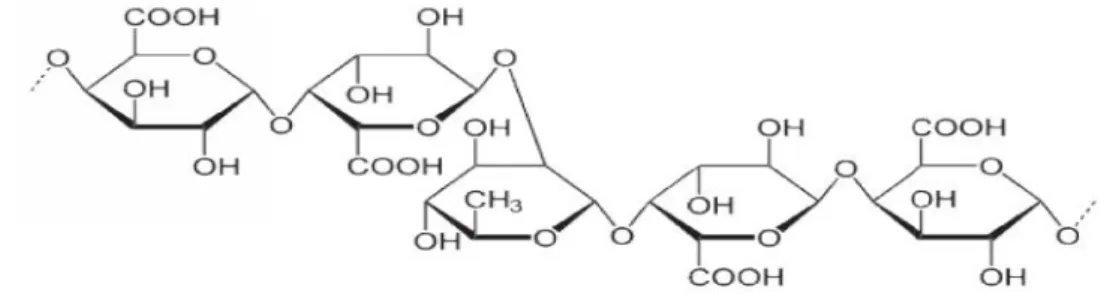
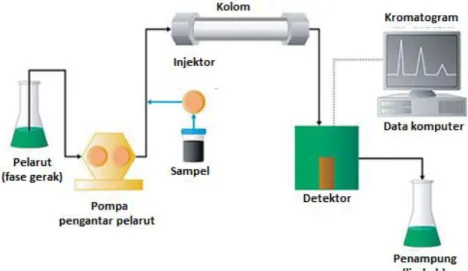
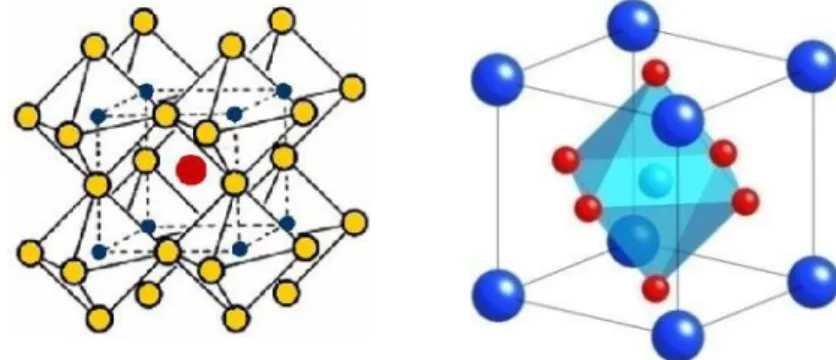
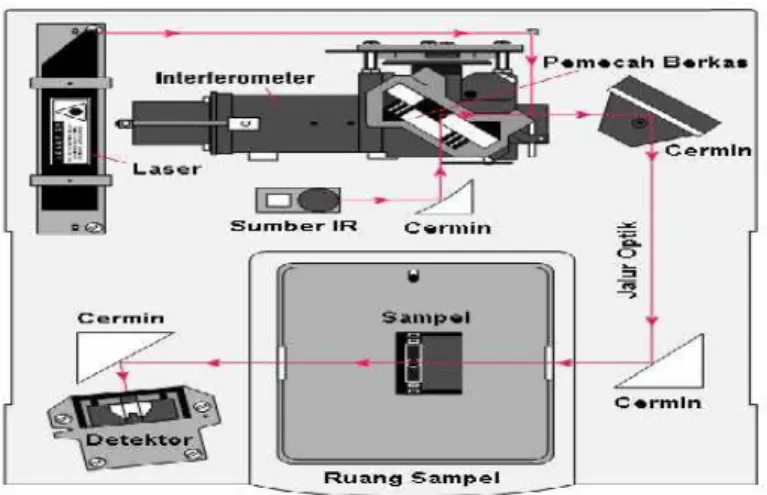
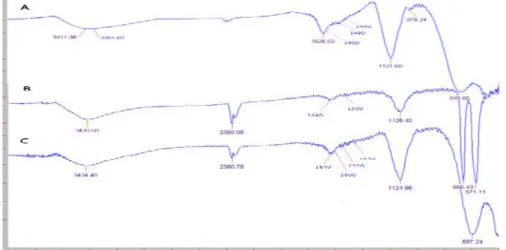
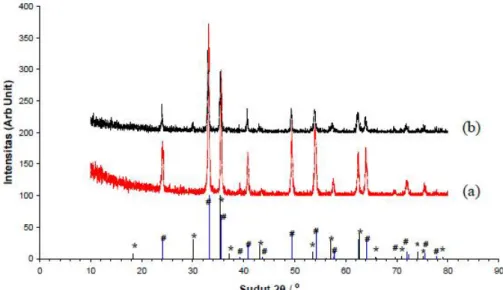
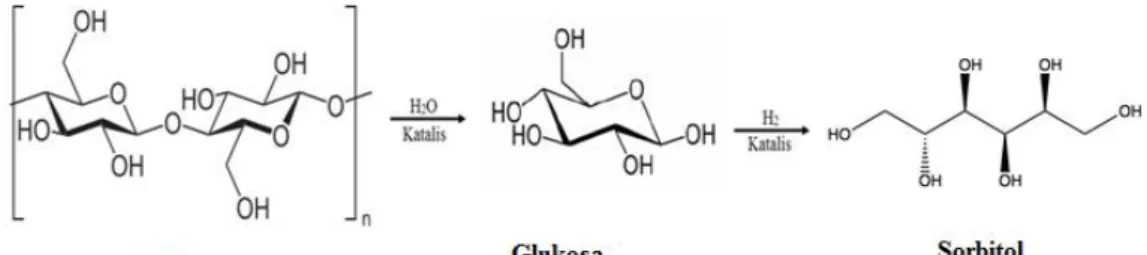
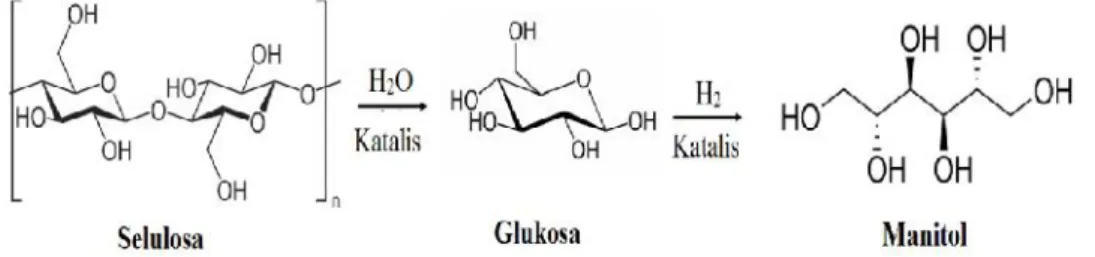
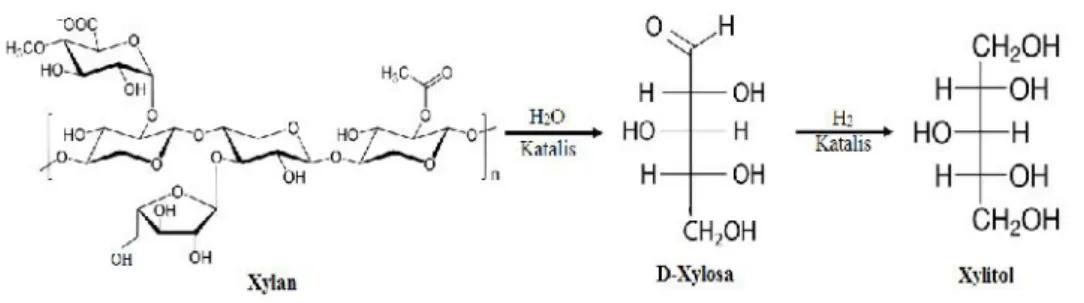
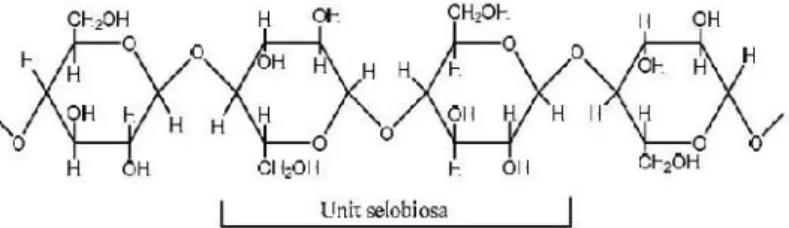
UJI AKTIVITAS NANOFOTOKATALIS LaCr 0,98 Mo 0,02 O 3 YANG DIIRADIASI SINAR-UV UNTUK KONVERSI NANOSELULOSA MENJADI GULA ALKOHOL.
Teks penuh
Gambar
Garis besar
Dokumen terkait
Adapun kriteria pemilihan kasus yang dianalisis adalah: (1) Tindak kriminal yang dilakukan oleh ODGJ, bukan pelaku yang menderita gangguan jiwa setelah melakukan tindak kriminal;
Pada populasi hasil perbanyakan kultur jaringan, ramet akan memiliki alel yang sama dengan ortetnya kecuali ramet tersebut mengalami variasi somaklonal atau berasal dari
Jika atom-atom logam aktif didispersikan ke permukaan pengemban yang memiliki luas permukaan besar, maka diharapkan luas permukaan katalis semakin besar dan jumlah situs aktif
Komponen utama dalam strategi perniagaan kami adalah dari segi perkhidmatan, kami berusaha untuk memberikan perkhidamatan yang terbaik kepada pelanggan kami.. Kaedah ini
Sedangkan sumber data yang digunakan oleh peneliti untuk menguji keterbacaan pengembangan modul ini adalah mahasiswa non matematika yang telah mengikuti mata
Parameter yang divariasikan pada model yang digunakan adalah jarak antara silinder yang menggunakan helical strakes dengan splitter plate (G) dan lebar
Pengendalian Standar Pengabdian Kepada Masyarakat merupakan manajemen kendali mutu yang berisi kegiatan tindak lanjut dari hasil evaluasi Standar Pengabdian Kepada
Walau bagaimanapun, TIADA caj keuntungan tambahan yang akan dikenakan sepanjang tempoh tersebut Pada akhir 3 bulan tersebut, anda perlu membayar ansuran bulanan penuh anda