PENENTUAN KONDISI OPTIMUM UNTUK ISOLASI PROTOPLAS
DAUN Dendrobium Thong Chai Golden
SKRIPSI
Diajukan untuk Memenuhi Sebagian dari Syarat untuk Memperoleh Gelar Sarjana Sains Program Studi Biologi
Disusun oleh
AULIA MUMTAHANA
0800601
PROGRAM STUDI BIOLOGI
JURUSAN PENDIDIKAN BIOLOGI
FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS PENDIDIKAN INDONESIA
PENENTUAN KONDISI OPTIMUM UNTUK ISOLASI
PROTOPLAS DAUN Dendrobium Thong Chai Golden
Oleh Aulia Mumtahana
Sebuah skripsi yang diajukan untuk memenuhi salah satu syarat memperoleh gelar Sarjana pada Fakultas Pendidikan Matematika Dan Ilmu Pengetahuan Alam
© Aulia Mumtahana 2013 Universitas Pendidikan Indonesia
April 2013
Hak Cipta dilindungi undang-undang.
LEMBAR PENGESAHAN
PENENTUAN KONDISI OPTIMUM UNTUK ISOLASI PROTOPLAS
DAUN Dendrobium Thong Chai Golden
Oleh
Aulia Mumtahana 0800601
DISETUJUI DAN DISAHKAN OLEH:
Pembimbing I
Dr. rer. nat Adi Rahmat, M.Si NIP. 196512301992021001
Pembimbing II
Dra. R. Kusdianti, M.Si NIP. 196402261989032004
Mengetahui,
PENENTUAN KONDISI OPTIMUM UNTUK ISOLASI
PROTOPLAS DAUN Dendrobium Thong Chai Golden
Aulia Mumtahana, Adi Rahmat dan Kusdianti
Program Studi Biologi, FPMIPA, Universitas Pendidikan Indonesia Jl. Dr. Setiabudhi 229 Bandung, e-mail : [email protected]
ABSTRAK
Protoplas merupakan sumber material terbaik bagi pengembangan hibridisasi somatik pada anggrek. Penelitian ini bertujuan untuk memperoleh kondisi
optimum untuk isolasi protoplas dari daun Dendrobium Thong Chai Golden
dengan menentukan konsentrasi manitol sebagai osmotikum, kombinasi larutan enzim, dan lamanya inkubasi daun dalam larutan enzim. Penentuan konsentrasi manitol dilakukan menggunakan metode konvensional dengan menentukan
konsentrasi yang menyebabkan kondisi incipient plasmolysis. Penelitian tentang
pengaruh larutan enzim dan lamanya inkubasi daun dalam larutan enzim terhadap jumlah protoplas yang dihasilkan dilakukan berdasakan rancangan acak lengkap faktorial yang terdiri dari dua faktor. Faktor pertama adalah kombinasi enzim yang terdiri dari (1,5% selulase + 0,2% pektinase), E2 (1% selulase + 1% pektinase), dan E3 (1% selulase + 0,5% pektinase). Faktor kedua adalah lamanya lamanya inkubasi daun dalam larutan enzim yang terdiri dari 3, 5, 16, dan 21 jam. Eksplan adalah daun dari tanaman yang berumur satu tahun yang ditanam secara in vitro. Protoplas dikultur dalam medium ½ MS yang ditambahkan dengan kombinasi NAA dan BAP dan diamati setiap harinya selama dua minggu. Hasil menunjukan bahwa konsentrasi manitol terbaik sebagai osmotik adalah 0,5 M. Tidak ada interaksi pengaruh larutan enzim dan waktu inkubasi. Jumlah protoplas
paling banyak (86,5 ± 22,7 x 104 protoplas/g berat basah) dihasilkan dari
kombinasi enzim E1 dan inkubasi 16 jam. Duncan multiple range tests
menunjukan tidak ada perbedaan signifikan dalam jumlah protoplas ketika daun diinkubasi selama 16 jam pada semua kombinasi enzim. Setelah dua minggu masa kultivasi dalam medium ½ MS yang ditambahkan seluruh kombinasi NAA dan
BAP, plating efficiency kultur protoplas tidak dapat ditentukan.
OPTIMALIZATION FOR ISOLATION CONDITION OF Dendrobium
Thong Chai Golden LEAVE PROTOPLAST
Aulia Mumtahana, Adi Rahmat dan Kusdianti
Program Studi Biologi, FPMIPA, Universitas Pendidikan Indonesia Jl. Dr. Setiabudhi 229 Bandung, e-mail : [email protected]
ABSTRACT
Protoplast is the best source of material for improvement of somatic hybridization on orchids. This study was aimed to obtain an optimum condition for protoplast
isolation of Dendrobium Thong Chai Golden leave protoplast by determining
mannitol concentration as osmotic agent, combination of enzyme solution, and duration of leaves incubation in enzyme solution. Determination of mannitol concentration was conducted using conventional method by determining a concentration causing incipient plasmolysis. The study of the effect of enzyme solution and duration of leave incubation in enzyme solution on the number of released protoplasts was done according to factorial complete random design consisted of two factors. The first factor was enzyme combination consisted of E1 (1,5% cellulase + 0,2% pectinase), E2 (1% cellulase + 1% pectinase), and E3 (1% cellulase + 0,5% pectinase). The second factor was duration of leave incubation in
enzyme solution consisted of 3, 5, 16 and 21 hours. The explanused was a one
year old in vitro leaves. The protoplasts were cultured in ½ MS medium that was
supplemented with several combination of NAA and BAP and observed every days for two weeks. The result showed that the best mannitol concentration as osmotic agent was 0,5 M. There were no interaction effect of enzyme solution and
duration of incubation. The highest protoplast number (86,5 ± 22,7 x 104
protoplasts/ fresh weight) was yield by enzyme combination E1 and 16 hours incubation. Duncan multiple range tests showed No significant differences in protoplast number when the leaves were incubated for 16 hours in all enzyme combinations. After two weeks cultivation in ½ MS medium that was supplemented by all combination of NAA and BAP, plating efficiency of protoplast culture could not determined.
DAFTAR ISI
BAB II ISOLASI DAN KULTUR PROTOPLAS DAUN Dendrobium Thong Chai Golden ... 7
A. DESKRIPSI TANAMAN ... 7
B. PEMULIAAN TANAMAN ... 11
C. ISOLASI DAN KULTUR PROTOPLAS ... 16
1. Faktor – faktor yang Mempengaruhi Isolasi dan Kultur Protoplas ... 17
a. Sumber Eksplan ... 17
b. Perlakuan Enzimatis . ... 18
c. Osmotikum ... 18
d. Kebutuhan Nutrisi ... 19
2. Perkembangan Protoplas dalam Medium Kultur ... 20
BAB III METODE PENELITIAN ... 22
A. RANCANGAN PENELITIAN ... 22
B. POPULASI DAN SAMPEL ... 22
C. WAKTU DAN LOKASI PENELITIAN ... 23
D. ALAT DAN BAHAN ... 23
E. PROSEDUR KERJA ... 23
1. Tahap Persiapan ... 23
a. Pembuatan Larutan dan Medium ... 23
1). Larutan Stok ... 23
2). Larutan Isolasi, Larutan Enzim, Larutan Cuci dan Medium Kultur ... 24
3). Medium ½ MS ... 24
b. Sterilisasi Alat ... 24
2. Tahap Percobaan a. Penentuan Osmotikum Larutan dan Medium ... 25
a. Isolasi Protoplas ... 25
b. Purifikasi Protoplas ... 25
c. Perhitungan Jumlah Protoplas ... 26
d. Kultur dan Pengamatan Protoplas ... 26
F. ANALISIS DATA ... 26
G. ALUR PENELITIAN ... 27
BAB IV HASIL DAN PEMBAHASAN A. HASIL PENELITIAN ... 28
1. Penentuan Konsentrasi Manitol sebagai Agen Osmotik ... 28
2. Interaksi antara Campuran Enzim dan Waktu Inkubasi terhadap Perolehan Jumlah Protoplas ... 30
3. Pengaruh Campuran Enzim ... 31
4. Pengaruh Waktu Inkubasi ... 32
B. PEMBAHASAN ... 37
BAB V KESIMPULAN DAN SARAN ... 46
A. KESIMPULAN ... 46
B. SARAN ... 46
DAFTAR PUSTAKA ... 47
LAMPIRAN-LAMPIRAN ... 52
DAFTAR TABEL
Tabel
2.1 Data Luas Panen dan Produksi Anggrek dari Tahun 2007-2011 ... 12
2.2 Perkembangan Volume dan Nilai Ekspor dan Impor Anggrek Indonesia dari
Tahun 2007-2011 ... 12
4.1 Konsentrasi manitol yang menyebabkan plasmolisis daun Dendrobium
Thong Chai Golden ... 28
4.2 Pengaruh Konsentrasi Campuran Larutan Enzim terhadap Perolehan Jumlah
Protoplas ... 31
DAFTAR GAMBAR
Gambar
2.1 Morfologi tanaman Dendrobium Thong Chai Golden ... 9
2.2 Bunga Dendrobium Thong Chai Golden ... 10
3.1 Alur Penelitian ... 27
4.1 Plasmolisis sel daun Dendrobium Thong Chai Golden dalam larutan manitol pada berbagai konsentrasi ... 29
4.2 Pengaruh interaksi antara konsentrasi campuran enzim dan waktu inkubasi ... 30
4.3 Sedimentasi protoplas setelah sentrifugasi ... 33
4.4 Protoplas hasil isolasi ... 34
4.5 Sejumlah protoplas, sel dan senyawa yang ditemukan pada isolasi ... 35
BAB I
PENDAHULUAN
A. LATAR BELAKANG
Sejak awal keberadaanya, tanaman anggrek telah menarik berbagai
kalangan seperti ahli botani, peneliti, pemulia tanaman dan masyarakat. Tanaman
anggrek adalah tanaman hias yang memiliki keindahan bunga yang khas dengan
warna dan bentuk bunga yang beragam. Tanaman anggrek juga termasuk salah
satu komoditas penting bernilai ekonomi tinggi dalam industri holtikultura.
Secara taksonomi, tanaman anggrek termasuk tanaman berbiji tertutup yang
berasal dari famili Orchidaceae yaitu salah satu famili terbesar dari tanaman
bunga, terdiri dari 800 genus dengan 25.000 spesies dengan kelimpahan spesies
tertinggi ditemukan di daerah tropis (Arditti, 1992), sehingga anggrek sering
dianggap sebagai simbol bunga khas tropis. Indonesia memiliki sekitar 5000 jenis
anggrek atau sebesar 25 – 33,3 % dari total jenis anggrek di dunia yang
terdistribusi diseluruh nusantara (Sarwono, 2002). Diantara genus-genus yang
terdapat dalam famili Orchidaceae, genus Dendrobium merupakan genus terbesar
kedua meliputi lebih dari 1100 spesies yang terdistribusi luas dari Asia Tenggara
hingga Australia (Yin dan Hong, 2009). Menurut Gandawidjaya dan Sastrapradja
(1980), Dendrobium merupakan salah satu kekayaan alam Indonesia yang
jumlahnya diperkirakan mencapai 275 spesies.
Sebagian besar jenis anggrek yang ada dipasaran saat ini merupakan hasil
silangan atau hibrida. Jumlahnya mencapai lebih dari 75.000 anggrek (Teoh,
2005). Salah satu jenis yang cukup menarik perhatian adalah Dendrobium Thong
Chai Golden. Dendrobium Thong Chai Golden merupakan hibrida interspesifik
yang memiliki karakteristik bunga berbentuk bintang berwarna kuning terang
(gold). Bibirnya berwarna magenta gelap, sangat kontras berbeda dengan warna
2
Permintaan pasar terhadap anggrek jenis Dendrobium dan hibridanya baik
sebagai tanaman pot maupun dalam bentuk bunga potong masih tinggi. Akibatnya
kultivasi anggrek Dendrobium dan hibridanya terutama melalui teknik
mikropropagasi, paling banyak dilakukan dan persentasenya mencapai 80 % dari
jumlah total kultivasi anggrek tropis (Griesbach, 2003; Saiprasad et al., 2004).
Sejalan dengan permintaan anggrek yang cukup besar, maka usaha peningkatan
dan penganekaragaman produk anggrek jenis Dendrobium menjadi sangat
penting. Potensi Dendrobium sebagai komoditas holtikultura telah dikembangkan
dan dimanfaatkan oleh Indonesia, namun pengembangannya masih belum
optimal. Menurut Widiastoety et al. (2010), secara umum beberapa kendala yang
menghambat kemajuan pengembangan anggrek di Indonesia diantaranya
rendahnya produktivitas dan kualitas anggrek sehingga tidak dapat bersaing
dipasaran internasional. Usaha peningkatan dan penganekaragaman produk
anggrek penting dilakukan untuk meningkatkan daya saing dan mempermudah
perluasan pasar di dalam dan luar negeri. Usaha peningkatan kualitas dan
penganekaragaman anggrek termasuk kedalam kegiatan pemuliaan tanaman.
Pemuliaan tanaman pada anggrek Dendrobium telah dilakukan sejak lama
oleh para pemulia tanaman melalui teknik konvensional dan variasi somaklonal
melalui kultur jaringan. Teknik konvensional melalui persilangan seksual telah
berkontribusi besar terhadap peningkatan kualitas dan keragaman pada anggrek
Dendrobium, akan tetapi pada teknik persilangan seksual sering ditemui beberapa
keterbatasan seperti adanya ketidaksesuaian genom tetua antara kedua spesies dan
inkompatibilitas seksual sehingga sulit dihasilkan hibrida interspesifik dan
intergenerik (Widiastoety et al., 2010). Dengan kemajuan ilmu pengetahuan dan
teknologi yang berkembang pesat saat ini, maka bioteknologi modern menjadi
solusi alternatif dalam mengatasi keterbatasan yang ditemui pada persilangan
seksual yaitu melalui teknik hibridisasi somatik atau fusi protoplas. Hibridisasi
somatik melalui fusi protoplas memberikan kemungkinan untuk terjadinya
persilangan beda genus dan spesies (Davey et al., 2005).
3
terjadi secara buatan melalui dua cara yaitu secara kimiawi seperti perlakuan
dengan sodium nitrat, ion kalsium, polietilen glikol (PEG) atau menggunakan
medan listrik seperti mikrofusi dan elektrofusi dalam mengatasi hambatan
persilangan telah berhasil pada sejumlah besar tanaman (Bajaj, 1994; Chawla,
2002).
Saat ini, hibridisasi somatik telah menjadi satu alat paling signifikan dari
bioteknologi modern karena peranannya yang sangat luas dalam pemuliaan
tanaman seperti rekayasa tanaman resisten penyakit dan pestisida, peningkatan
produk metabolisme sekunder dan pembentukan tanaman poliploid. Dalam hal ini
protoplas tanaman menyediakan sistem sel tunggal dan menjadi sumber material
terbaik bagi pengembangan tanaman melalui fusi protoplas (Bhojwani dan
Razdan, 1983). Akibatnya metode ini telah menarik banyak perhatian dari para
pemulia tanaman dan peneliti sehingga pengembangannya dilaboratorium terus
berjalan (Davey et al., 2005). Dengan demikian, protoplas dari Dendrobium
Thong Chai Golden dapat menjadi sumber material yang baik untuk fusi protoplas
dalam rangka pengembangan tanaman tersebut. Hibridisasi intergenerik maupun
interspesifik pada anggrek telah dilakukan pada beberapa anggrek diantaranya
pada Angraecum giryamae dengan sumber protoplas berasal dari sepal hijau
(Price dan Earle, 1984 dalam Teixeira da Saliva, 2013) dan pada hibrida bigeneric
Renantanda (Renanthera x Vanda) dengan Phalaenopsis dimana sumber
protoplas berasal dari daun muda (Teo dan Neumann, 1978a, 1978b dalam
Teixeira da Saliva, 2013).
Salah faktor yang sangat penting dalam menentukan keberhasilan
penggunaan protoplas sebagai sumber material dalam hibridisasi somatik adalah
kondisi isolasi protoplas (Bajaj, 1994). Kondisi isolasi optimum akan
menghasilkan protoplas viabel dalam jumlah banyak. Beberapa faktor yang
menentukan perolehan jumlah protoplas diantaranya campuran enzim, medium
isolasi, konsentrasi osmotikum, dan waktu inkubasi (Bhojwani dan Razdan,
1983). Pembentukan protokol isolasi pada Dendrobium dan hibridinya telah
4
mengenai protokol isolasi protoplas pada Dendrobium Thong Chai Golden. Oleh
karena itu perlu dilakukan penelitian dalam menentukan kondisi optimum untuk
isolasi protoplas Dendrobium Thong Chai Golden sebagai satu kajian awal untuk
pengembangan hibridisasi somatik pada tanaman anggrek.
B. RUMUSAN MASALAH
Berdasarkan uraian latar belakang tersebut, masalah dalam penelitian ini dapat dirumuskan sebagai berikut : “ Bagaimana kondisi optimum untuk isolasi
protoplas daun Dendrobium Thong Chai Golden terhadap perolehan jumlah
protoplas ” ?
Dari rumusan masalah yang telah dikemukakan, maka dapat dijabarkan
menjadi beberapa pertanyaan penelitian sebagai berikut :
1. Berapa konsentrasi manitol osmotikum untuk memperoleh jumlah protoplas
paling banyak ?
2. Berapa konsentrasi campuran enzim optimal untuk memperoleh jumlah
protoplas paling banyak ?
3. Berapa lama waktu inkubasi optimal untuk memperoleh jumlah protoplas
paling banyak ?
4. Adakah interaksi antar konsentrasi campuran enzim dan lamanya waktu
inkubasi terhadap perolehan hasil protoplas ?
5. Berapa lama waktu yang dibutuhkan protoplas untuk mensintesis dinding
sel baru ?
6. Berapa lama waktu yang dibutuhkan protoplas untuk terjadinya pembelahan
sel ?
C. BATASAN MASALAH
Agar tidak meluas dalam pelaksanaanya, maka ruang lingkup penelitian ini
dibatasi pada beberapa hal diantaranya yaitu
1. Eksplan yang digunakan adalah daun dari tanaman juvenile in vitro
5
2. Beberapa faktor yang mempengaruhi isolasi protoplas untuk memperoleh
kondisis optimumnya diuji dan dievaluasi diantaranya penentuan
konsentrasi osmotikum, konsentrasi campuran enzim dan durasi perlakuan
enzim atau lamanya waktu inkubasi.
3. Penentuan osmotikum dilakukan terpisah dari perlakuan enzim sebagai
tahap pra penelitian
4. Konsentrasi osmotikum terdiri dari 0,3, 0,4, 0,5 dan 0,6 M manitol
5. Campuran enzim terdiri dari tiga macam kombinasi yaitu E1 (1,5 %
Selulase dan 0,2 % Pektinase), E2 (1 % Selulase dan 1 % Pektinase) dan E3
(1 % Selulase dan 0,5 % Pektinase).
6. Waktu inkubasi terdiri dari empat durasi yaitu 3, 5, 16 dan 21 jam.
7. Pengamatan dilakukan setiap harinya setelah ditanam dalam media kultur
8. Respon perkembangan protoplas yang diamati adalah pembentukan dinding
sel baru dan pembelahan sel secara kualitatif.
D. TUJUAN
Tujuan penelitian ini adalah memperoleh kondisi optimum untuk isolasi
protoplas daun Dendrobium Thong Chai Golden terutama dengan mencari
kombinasi campuran enzim dan lamanya waktu inkubasi optimal.
E. MANFAAT
Dari penelitian ini diharapkan dapat diperoleh protokol isolasi protoplas
yang tepat dan efisien sehingga dapat digunakan sebagai metode acuan dan
6
F. ASUMSI
1. Isolasi protoplas dipengaruhi oleh banyak faktor dan kondisi optimumnya.
Dua faktor penting yang mempengaruhi perolehan hasil dan viabilitas
protoplas adalah osmotikum dan perlakuan enzimatis (Bhojwani dan
Razdan, 1983; Chawla, 2002 dan Davey et al., 2005).
2. Manitol dianggap relatif inert secara metabolik dan penggunaannya paling
luas pada isolasi protoplas sejumlah besar tanaman, terutama untuk isolasi
sel mesofil daun (Chawla, 2002).
3. Konsentrasi campuran enzim selulase dan pektinase optimal untuk
perolehan hasil protoplas tinggi sebesar 1 % selulase dan 1 % pektinase
pada Dendrobium Pompadour (Kanchanapoom et al., 2001), 1 % selulase
dan 0,2 % pektinase pada Dendrobium Sonia (Khentry et al., 2006), serta 1
% selulase dan 0,5 % pektinase pada Cymbidium (Pindel, 2007).
4. Lamanya waktu inkubasi pada isolasi protoplas Dendrobium terjadi antara
interval waktu tiga hingga 16 jam dalam kondisi gelap (Kanchanapoom et
al., 2001; Kunasakdakul dan Smitamana, 2003; Khentry et al., 2006;
Jayanti, 2011).
G. HIPOTESIS
Hipotesis yang dapat diambil sebagai berikut :
1. Ada pengaruh konsentrasi campuran enzim terhadap perolehan jumlah
protoplas
2. Ada pengaruh lamanya waktu inkubasi terhadap perolehan jumlah protoplas
3. Ada interaksi antara konsentrasi campuran enzim dengan lamanya waktu
BAB III
METODE PENELITIAN
A. RANCANGAN PENELITIAN
Penelitian ini merupakan penelitian eksperimen yang dilaksanakan dengan
Rancangan Acak Lengkap Faktorial dua faktor yaitu faktor kombinasi larutan
enzim dan lamanya waktu inkubasi. Kombinasi larutan enzim terdiri dari E1 (1,5
% Selulase + 0,2 % Pektinase), E2 (1% Selulase + 1 % Pektinase) dan E3 (1 %
Selulase + 0,5 % Pektinase) dan lamanya waktu inkubasi terdiri dari 3, 5, 16 dan
21 jam. Setiap perlakuan merupakan kombinasi dari semua taraf faktor, sehingga
terdapat dua belas perlakuan. Banyaknya pengulangan diperoleh dari hasil
perhitungan menurut Gomez dan Gomez (1983) sebagai berikut:
(t) (r - 1) ≥ 21 (12) (r - 1) ≥ 21
12r ≥ 33
r ≥ 2
r = 3
Keterangan : t = banyak perlakuan
r = banyak pengulangan
Berdasarkan perhitungan tersebut, maka banyaknya pengulangan untuk setiap
perlakuan adalah tiga kali dan tiap ulangan akan diwakili oleh satu cawan petri.
B. POPULASI DAN SAMPEL
Populasi dalam penelitian ini adalah seluruh tanaman anggrek Dendrobium
Thong Chai Golden dan sampel yang digunakan dalam penelitian ini adalah daun
dari tanaman juvenil Dendrobium Thong Chai Golden.yang ditanam secara in
23
C. WAKTU DAN LOKASI PENELITIAN
Penelitian dimulai pada bulan Juni 2012 hingga Februari 2013. Isolasi dan
kultur protoplas dilakukan di Laboratorium Fisiologi Tumbuhan, sedangkan
pengamatan protoplas dilakukan di Laboratorium Struktur Tumbuhan Jurusan
Pendidikan Biologi FMIPA UPI.
D. ALAT DAN BAHAN
Alat-alat dan bahan yang digunakan dalam penelitian ini terlampir pada
Lampiran 1, sedangkan komposisi medium Murishage dan Skoog dengan
setengah kekuatan (MS 0,5 ) terlampir pada Lampiran 2.
E. PROSEDUR KERJA
Prosedur kerja dalam penelitian ini dibagi kedalam beberapa tahap
pelaksanaan yaitu tahap persiapan, tahap percobaan dan tahap pengamatan.
1. Tahap Persiapan
Tahap persiapan meliputi pembuatan larutan dan medium serta sterilisasi
alat yang digunakan dalam penelitian.
a. Pembuatan Larutan dan Medium
1) Larutan Stok
Larutan stok terdiri dari makronutrien, mikronutrien, dan vitamin dan dibuat
menjadi 7 kelompok larutan yaitu
24
Larutan stok 1 dan 2 dilarutkan dalam 200 ml aquades, sedangkan larutan
stok 3-4 dalam 100 ml aquades. Untuk melarutkan bahan stok 6 ditambahkan
sedikit demi sedikit HCl 1 N kedalam larutan. Stok zat pengatur tumbuh dibuat
dengan melarutkan masing-masing NAA dan BAP dengan sedikit NaOH 1 N,
kemudian ditambahkan akuades hingga volumenya mencapai 100 ml. Stok NAA
dan BAP dibuat dengan konsentrasi 0,05 mg/ml.
2) Larutan Isolasi, Larutan Enzim, Larutan Cuci dan Medium Kultur
Komposisi zat yang terkandung dalam larutan isolasi, larutan enzim dan
larutan cuci ditunjukan pada Lampiran 2. Derajat keasamaan (pH) setiap larutan
dan medium diatur hingga 5,8. Larutan enzim disterilisasi dengan filtrasi
menggunakan filter selulosa asetat (pori 0,2 µm), sedangkan larutan cuci dan
medium kultur disterilisasi dengan autoklaf.
3) Medium ½ MS
Medium ½ MS mengandung setengah konsentrasi dari makro dan
mikronutrien. Untuk membuat 1 liter larutan MS, setiap larutan stok dimasukan
kedalam beaker glass sesuai volume yang telah dihitung. Aquades ditambahkan
sebanyak 50 ml, kemudian aduk dengan magnetic stirer diatas hot plate. Jika
sudah homogen, sukrosa ditambahkan sebanyak 30 gr dan volume digenapkan
menjadi 1 liter, selanjutnya pH medium diatur hingga 5,8 menggunakan pH meter.
Medium disterilisasi dalam autoklaf selama 15 menit.
b. Sterilisasi Alat
Semua alat tanam seperti pinset, pisau bedah, cawan petri, tips makro dan
mikropipet, plastic mesh 50µm, centrifuge tube, dan botol kultur disterilisasi
dalam autoklaf selama 15 menit. Cawan petri diisi dengan kertas saring dan
25
2. Tahap Percobaan
Tahap ini merupakan tahap inti dari penelitian, diawali dengan
dilakukannya penentuan osmotikum sebagai tahap pra penilitian, selanjutnya
tahap isolasi, purifikasi dan penanaman dalam medium kultur.
a. Penentuan Osmotikum Larutan dan Medium
Manitol digunakan sebagai agen osmotikum. Konsentrasi manitol yang diuji
adalah 0,3 M, 0,4 M, 0,5 M, dan 0,6 M. Daun dipotong menjadi potongan kecil
dan diinkubasi selama satu jam dalam 10 ml larutan manitol. Inkubasi dilakukan
dalam keadaan gelap diatas shaker pada kecepatan 40 rpm. Plasmolisis sel diamati
dibawah mikroskop cahaya. Persentasi sel yang plasmolisis dihitung mengikuti
rumus sebagai berikut :
Plasmolisis (%) = jumlah sel plasmolisis x 100
jumlah sel yang dihitung
Konsentrasi manitol yang menyebabkan gejala incipient plasmolysis dipilih
sebagai konsentrasi manitol untuk isolasi protoplas.
b. Isolasi Protoplas
Prosedur isolasi diadaptasi dari penelitian yang telah dilakukan oleh Rahmat
(2002). Isolasi dilakukan secara steril didalam laminar. Tahapan isolasi diawali
dengan tahap preplasmolisis. Sebanyak 1 g daun dipotong-potong menjadi
bagian-bagian kecil dalam cawan petri, kemudian direndam dalam 5 ml larutan isolasi
dan dibiarkan selama 30 menit. Sebanyak 1 ml larutan enzim dengan konsentrasi
berbeda (E1, E2 dan E3) ditambahkan kedalam larutan potongan daun dan
diinkubasi pada keadaan gelap diatas shaker pada kecepatan 50 rpm selama 3, 5,
16 dan 21 jam.
c. Purifikasi Protoplas
Campuran protoplas dan larutan enzim kemudian difilter melalui plastic
26
disentrifugasi pada kecepatan 750 rpm selama 10 menit. Supernatant dibuang dan
pelet diresuspensikan dalam 5 ml larutan cuci yang selanjutnya disentrifugasi
kembali selama 5 menit. Protoplas diresuspensikan dalam 6 ml larutan cuci untuk
dihitung.
d. Perhitungan Jumlah Protoplas
Jumlah protoplas dihitung dengan Improved Neubauer Haemocytometer.
Sebanyak 20 µl suspensi protoplas dipipet kedalam salah satu kamar hitung pada
haemositometer. Jumlah protoplas dihitung berdasarkan keberadaannya pada
empat bidang besar berukuran 0,1 mm disetiap sisi pada kamar hitung. Banyaknya
protoplas ditetapkan sebagai protoplas hasil per gram berat basah jaringan. Jumlah
protoplas dihitung mengikuti rumus pada penelitian sebelumnya (Ling et al, 2010)
sebagai berikut :
Jumlah Protoplas (Protoplas/gFW) = rata-rata jumlah sel x suspensi protoplas (ml)
berat basah jaringan (g)
e. Kultur dan Pengamatan Protoplas
Protoplas dikultur dalam medium ½ MS cair. Sebanyak 2 ml dari suspensi
protoplas dikultur kedalam 3 ml medium kultur. Cawan kultur disegel dengan
plastic wrap dan disimpan dalam ruang kultur pada suhu kamar dan keadaan
gelap. Pengamatan perkembangan protoplas dengan mikroskop inverter.
F. Analisis Data
Untuk membandingkan rerata antar kelompok perlakuan dengan antara
kedua faktor yaitu kombinasi enzim dan waktu inkubasi terhadap perolehan
jumlah protoplas hasil maka digunakan analisis statistik berupa Two Way
ANOVA pada taraf kepercayaan 0,05 menggunakan program SPSS 19 for
windows. Duncan Multiple Range Test (DMRT) dilakukan untuk mengetahui
27
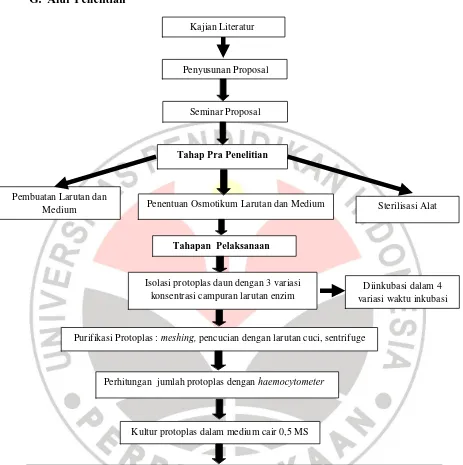
G. Alur Penelitian
Gambar 3.1 Alur Penelitian
Kajian Literatur
Penyusunan Proposal
Seminar Proposal
Tahap Pra Penelitian
Pembuatan Larutan dan
Medium Penentuan Osmotikum Larutan dan Medium
Diinkubasi dalam 4 variasi waktu inkubasi
Purifikasi Protoplas : meshing, pencucian dengan larutan cuci, sentrifuge
Perhitungan jumlah protoplas dengan haemocytometer Tahapan Pelaksanaan
Isolasi protoplas daun dengan 3 variasi konsentrasi campuran larutan enzim
Sterilisasi Alat
Kultur protoplas dalam medium cair 0,5 MS
Pengamatan perkembangan protoplas dalam medium kultur selama dua minggu setelah masa tanam
BAB V
KESIMPULAN
A. KESIMPULAN
Dari hasil penelitian diperoleh kondisi optimum untuk isolasi protoplas dari
daun Dendrobium Thong Chai Golden adalah konsentrasi manitol sebagai agen
osmotik sebesar 0,5 M, campuran enzim mengandung 1,5 % Selulase dan 0,2 %
Pektinase serta waktu inkubasi selama 16 jam. Kultivasi protoplas pada medium
cair ½ MS dengan penambahan NAA dan BAP belum menunjukan adanya
pembelahan sel sehingga plating efficiency tidak dapat ditentukan.
B. SARAN
Penelitian lebih lanjut perlu dilakukan untuk menstimulasi terjadinya
pembentukan mikrokoloni dengan cara menentukan kondisi optimum kultur
protoplas khususnya metode kultur, jenis medium dan kebutuhan zat pengatur
47
DAFTAR PUSTAKA
Anonim. (2009). Dendrobium Thong Chai Golden. [Online]. Tersedia :
http://www.orchidsonline.com.au/node/6242. [20 Desember 2012].
Anwar, J., Damanik, S.J., Hisyam, N dan Whitten, A.J. (1994). Ekologi Ekosistem
Sumatera. Yogyakarta : UGM Press.
Arditti, J. (1992). Fundamentals of Orchid Biology. , New York: John Wiley & Sons.
Bajaj, Y.P.S. (1994). Somatic Hybridization in Crop Improvement. Germany:
Springer-Verlag Berlin Heidelberg.
Balestri, E dan Cinelli, F. (2001). “ Isolation and Cell Wall Regeneration of
Protoplasts from Posidonia oceanica and Cymodocea nodosa “. Aquatic
Botany. 70, 237–242.
Bechtel, H., Cribb, P dan Launert, E. (1992). The Manual of Cultivated Orchids
Species. London : Blandford Press.
Bhojwani, S.S dan Razdan, M.K. (1983). Plant Tissue Culture : Theory and
Pratice. Netherlands: Elsevier Science Publishers.
Carsono, N. (2008). “ Peran Pemuliaan Tanaman dalam Meningkatkan Produksi Pertanian di Indonesia “. Makalah pada Seminar on Agricultural Sciences Mencermati Perjalanan Revitalisasi Pertanian, Perikanan dan Kehutanan dalam Kajian Terbatas Bidang Produksi Tanaman Pangan, Tokyo.
Chawla, H.S. (2002). Introduction to Plant Biotechnology (Second ed.). United
States of America : Science Publishers.
Cheng, Y dan Bélanger, RR. (2000). “ Protoplast Preparation and Regeneration
from Spores of the Biocontrol Fungus Pseudozyma flocculosa “. FEMS
Microbiol. Lett. 190, 287-291.
Cronquist, A. (1981). An Integrated system of Classification of Flowering Plants.
Davey, M.R., Anthony, P., Power, J.B dan Lowe, K.C. (2005). “ Plant protoplasts: status and biotechnological perspectives “. Biotechnology Advances. 23,
131–171.
Direktorat Budidaya dan Pascapanen Florikultura. (2013). Rekapitulasi Luas
Panen, Rata-rata Hasil dan Produksi Tanaman Hias di indonesia. [Online].
Tersedia : http://florikultura.org/index.php/beranda/data_prod. [20
Desember 2012].
Direktorat Budidaya dan Pascapanen Florikultura. (2013). Perkembangan Ekspor
Impor Florikultura. [Online]. Tersedia : http://hortikultura.deptan.go.id/?q=node/420. [20 Desember 2012].
Direktorat Jendral Pengolahan dan Pemasaran Hasil Pertanian. (2005). Road Map
Pasca Panen Dan Pemasaran Anggrek, 2005-2010. Jakarta
Farina, J.L., Cheng, T.M dan Alic, M. (2004). “ Formation and Regeneration of
Protoplast in Sclerotium rolfsii “. J. Appl. Microbiol. 96, 254-262.
Gandawidjaya, D. dan Sastrapradja, S. (1980). “ Plasma nutfah Dendrobium asal
Indonesia ”. Bull. Kebun Raya. 4, (4), 113−125.
Gomez, K.A dan Gomez, A.A. (1983). Statistical Procedures for Agricultural
Research. (second Ed). New York : John Wiley and Sons.
Griesbach, R.J. (2003). “ Orchids Emerge as Major World Floral Crop “.
Chronica Horticulturae. 43, 6-12.
Grzebelus, E., Szklarezyk, M dan Baranski, R. (2011). “ An Improved Protocol for Plant Regeneration from Leaf and Hypocotyl-derived Protoplast of Carrot “. Plant Cell Tiss Organ Cult.
Gumiwang, R. (2012, 9 Mei). Ekspor Anggrek Thailand 7,7 Triliun Indonesia
cuma Rp. 10,5 Miliar. Bisnis Jabar. [Online]. Tersedia : http://www.bisnis- jabar.com/index.php/berita/ekspor-anggrek-thailand-rp77-triliun-indonesia-cuma-rp105-miliar. [20 Desember 2012].
Kanchanapoom, K., Jantaro, S dan Rakchad, D. (2001). “ Isolation and Fusion of
Protoplasts from Mesophyll Cells of Dendrobium Pompadour “.
ScienceAsia. 27, 29-34.
Kim, S.W., Oh, S.C., In, D.S dan Liu, J.R. (2003). “ Plant Regeneration of Rose (Rosa hybridia) from Embryogenic Cell-derived Protoplasts. Plant Cell, Tiss, Org Culture. 73, 15-19.
Kuehnle, A.R dan Nan, G.L. (1990). " Factors influencing the Isolation and
Culture of Protoplast from Hwaiian Dendrobium Cultivars “. Proceedings
of the 13 th World Orchid Conference, Aukland.
Kunasakdakul, K dan Smitamana, P. (2003). “ Dendrobium Pratum Red
Protoplast “. Thailand Journal Agriculture Science. 36, (1), 1-8.
Li, L.H., Wang, X.P., Hou, W.R., Liu, X.L dan He, Y.K. (2005). " An Efficient Protocol for Plant Regeneration from Protoplast of the Moss Atrichum undulatum P. Beauv in vitro “. Plant Cell, Tissue and Organ Culture. 82: 281-288
Li, L., Yin, Q., Liu, X dan Yang, H. (2010). “ An Efficient Protoplas Isolation and
Regeneration System in Coprinus comatus “. African Journal of
Microbiology Research. 4, (6), 459-465.
Mizuhiro, M., Kenichi, Y., Ito, K., Kadowaki, S., Ohashi, H dan Mii, M.. (2001). “ Plant Regeneration from Cell Suspension-derived Protoplasts of Primula malacoides and Primulaobconica “. Plant Sci. 160, 1221-1228.
Mohanty, P., Das, M.C., Kumaria, S dan Tandon, P. (2012). “ High Efficiency
Cryopreservation of the Medicinal Orchid Dendrobium nobile Lindl. “.
Plant Cell Tiss Organ Cult. 109, 297–305
Morinaga, T., Kikuchi, M., dan Nomi, R. (1985). Formation and Regeneration of
protoplast in Coprinus pellucidus and Coprinus cinereus “. Agric. Biol.
Chem. 49, (2), 523-524.
Navratilova, B., Rokytova, L dan Lebeda, A. (2000). “ Isolation of Mesophyll Protoplasts Using Fluorescence and Scanning Electron Microscopy “. Japan Journal Crop Science. 61, 487-493.
Oshiro, M.A. dan Steinhart, W.L. (1991). “ Preparation of Protoplasts from Cells
of Orchids Representing Various Genera. Lindleyana. 6, 36-41.
Pindel, A. (2007). “ Optimization of Isolation Conditions of Cymbidium Protoplast “. Folia Horticulture Ann. 19, (2), 79-88.
Rahayu, S., Suyanto, Z.A., dan Anggia, E.N. (2004). “ Peningkatan kualitas
anggrek Dendrobium hibrid dengan pemberian kolkhisin “. Agric. Ilmu
Pertanian. 11, (1), 13-21.
Rahmat, A. (2002). Somatische Embryogenese und Gen Transfer bei
Ausgewahlten Tannenarten (Gattung Abies Mill.). Dissetation Mathematisch Naturwissenschaftlichen Fakultat I der Humboldt Universitat Zu Berlin.
Rao, K.S dan Prakash, A.H. (1995). ” A Simple Method for the Isolation of Plant Protoplast. J. Biosci. 20, 645-655.
Razdan, M.K. (2003). Introduction to Plant Tissue Culture (Second Ed).USA:
Science Publishers, Inc.
Saiprasad, G.V.S., Raghuveer, P., Khetarpal S dan Chandra, R. (2004). “ Effect of
Various Polyamines on Production of Protocorm-like bodies in Orchid –
Dendrobium „Sonia‟. Indian Journal of Plant Physiology. 6, 284-288.
Sarwono B. (2002). Merawat Anggrek. Jakarta: Penebar Swadaya.
Tamura, M., Tao, R dan Sugiura, A. (1995). " Regeneration of Plants from
Protoplasts of Diospyros kaki L. (Japanease Persimmon) ". Biotechnology in
Agriculture and Forestry. 34, 43-45.
Tee, CS., Lee, P.S., Pick Kiong, A.L dan Mahmood, M. (2010). ” Optimisation of
Protoplast Isolation Protocols Using In Vitro Leaves of Dendrobium
crumenatum (Pigeon Orchid) “.African Journal of Agriculture Research. 5,
(19), 2685-2693.
Teixeira da Saliva, J.A. (2013). “ Orchids : Advances in Tissue Culture, Genetics,
Phytochemistry dan Transgenic Biotechnology “. Floriculture and
Ornamental Biotechnology. 7, (1), 1-52.
Teoh, E. (2005). Orchids of Asia. (3rd ed). Singapore: Times Edition-Marshall
Cavendish.
Tholakalabavi, A., Zwiazek, J.J., dan Thorpe, T.A. (1994). “ Effect of Mannitol dan Glucose-induced Osmotic Stress on Growth, Water Relations, and
Solute Composition of Cell Suspension Cultures of Poplar (Populus
Deltoides Var. Occidentalis) in Relation to Anthocyanin Accumulatio “. In Vitro Cell. 164-170.
Widiastoety, D., Solvia, N dan Soedarjo, M. (2010). “ Potensi Anggrek Dendrobium dalam Meningkatkan Variasi dan Kualitas Anggrek Bunga Potong “. Jurnal Litbang Pertanian. 29, (3).
Yin, M dan Hong, S. (2009). “ Cryopreservation of Dendrobium candidum Wall.
Ex Lindl. Protocorm-like bodies by encapsulation virtification “. Plant cell
TissueOrg. Cult. 98, 179-185.
Zhang, J., Shen, W., Yan, P., Li, Y dan Zhou, P. (2011). “ Factors that influence
the yield and viability of protoplasts from Carica papaya L. “. African
Journal of Biotechnology. 10, (26), 5137-5142.