BAB III
METODE PENELITIAN
3.1. Waktu dan Lokasi Penelitian
Penelitian dilakukan pada bulan September sampai Desember 2017 di Laboratorium Mikrobiologi dan Biokimia, Program Studi Pendidikan Biologi, dan Laboratorium Biologi Farmasi, Fakultas Farmasi, Universitas Muhammadiyah Purwokerto.
3.2. Alat
Alat yang digunakan dalam penelitian yaitu autoclave, bunsen, tabung reaksi, rak tabung reaksi, hot plate stirrer, magnetic stirrer, tabung erlenmeyer, beaker glass, botol alkohol 96%, sprayer alkohol 70%, bunsen, ose, Laminar Air Flow (LAF), cawan petri, tip, mikropipet, batang drugalsky, blank disc, mortar, pestle, pisau, timbangan analitik, spatula, vortex, jangka sorong, dan inkubator.
3.3. Bahan
Bahan yang digunakan dalam penelitian yaitu air kelapa dari buah yang masih muda. Sampel kelapa berupa jenis kelapa hijau, kelapa kuning, kelapa obat kuning, kelapa obat hijau. Sebagai kontrol digunakan larutan obat diare Lodia. Bahan lain yang digunakan adalah aquades steril, air bersih, sabun, alkohol 70%, spirtus, alumunium foil, plastik wrap, tissu, kultur Escherichia coli, kultur Salmonella typhi, kultur Shigella sp., medium Nutrien Broth (NB), medium Nutrien Agar (NA), dan aquades.
3.4. Rancangan Penelitian
Metode yang digunakan pada penelitian adalah eksperimen. Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL) faktorial dengan 2 faktor. Faktor pertama adalah jenis bakteri yang digunakan, yaitu Escherichia coli, Salmonella typhii, dan Shigella sp. Faktor kedua adalah jenis kelapa, yaitu air kelapa hijau, air kelapa kuning, air kelapa obat hijau, dan air kelapa obat kuning. Selain itu digunakan juga kontrol positif mengggunakan obat diare Lodia dan kontrol negatif menggunakan aquades steril. Masing-masing perlakuan diulang sebanyak 3 kali.
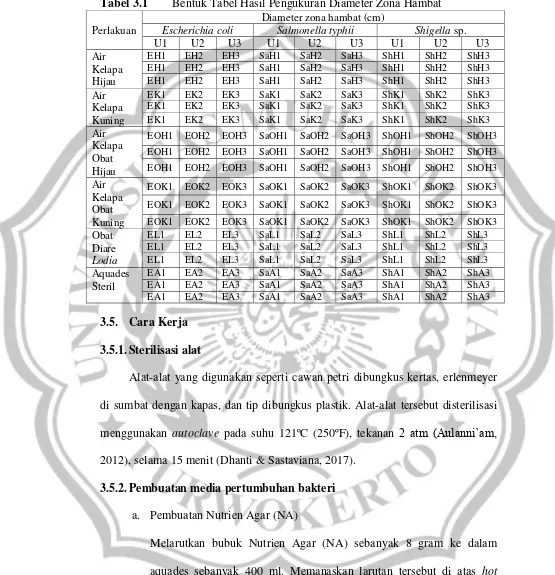
Pengujian dilakukan dengan metode Kirby Bauer (kertas cakram). Parameter yang diamati adalah diameter zona hambat di sekitar kertas cakram yang terbentuk. Pengukuran dilakukan menggunakan jangka sorong setelah 1 x 24 jam diinkubasi. Tabel hasil pengukuran diameter zona hambat ditunjukkan pada
Tabel 3.1 Bentuk Tabel Hasil Pengukuran Diameter Zona Hambat Perlakuan
Diameter zona hambat (cm)
Escherichia coli Salmonella typhii Shigella sp.
U1 U2 U3 U1 U2 U3 U1 U2 U3
Alat-alat yang digunakan seperti cawan petri dibungkus kertas, erlenmeyer di sumbat dengan kapas, dan tip dibungkus plastik. Alat-alat tersebut disterilisasi menggunakan autoclave pada suhu 121ºC (250ºF), tekanan 2 atm (Aulanni’am, 2012), selama 15 menit (Dhanti & Sastaviana, 2017).
3.5.2.Pembuatan media pertumbuhan bakteri
a. Pembuatan Nutrien Agar (NA)
masing-alumunium foil dan plastik wrap Medium kemudian disterilkan menggunakan autoclave pada suhu 121ºC (250ºF), tekanan 2 atm (Aulanni’am, 2012), selama 15 menit (Dhanti & Sastaviana, 2017).
b. Pembuatan Nutrien Broth (NB)
Melarutkan bubuk Nutrien Broth (NB) sebanyak 0,8 gram ke dalam aquades sebanyak 100 ml. Memanaskan larutan tersebut kemudian di atas hot plate stirrer. Menuangkan medium ke dalam tabung reaksi masing-masing sebanyak 10 ml. Menutup tabung reaksi menggunakan alumunium foil dan plastik wrap. Medium kemudian disterilkan menggunakan autoclave pada suhu 121ºC (250ºF), tekanan 2 atm (Aulanni’am, 2012), selama 15 menit (Dhanti & Sastaviana, 2017).
3.5.3.Pembuatan aquades steril
Memasukkan aquades sebanyak 50 ml ke dalam erlenmeyer 100 ml. Menutup tabung erlenmeyer menggunakan sumbat kapas. Aquades kemudian disterilkan menggunakan autoclave pada suhu 121ºC (250ºF), tekanan 2 atm (Aulanni’am, 2012), selama 15 menit (Dhanti & Sastaviana, 2017).
3.5.4.Peremajaan bakteri
3.5.5.Pengambilan sampel air kelapa
Mengupas kelapa pada bagian atasnya, kemudian membuka sedikit tempurungnya menggunakan pisau steril untuk mengeluarkan air kelapa tersebut. Menampung air kelapa dalam beaker glass steril, kemudian menuangkan ke dalam tabung reaksi steril lebih kurang 10 ml.
3.5.6.Pembuatan larutan obat diare
Menumbuk tablet obat diare Lodia menggunakan mortar dan pestle. Menimbang sebanyak 0,1 gram. Serbuk obat kemudian dimasukkan ke dalam aquades steril 10 ml. Larutan divortex sampai homogen.
3.5.7.Uji efektifitas antimikroba dan pengukuran zona hambat
a. Mencairkan medium NA pada tabung reaksi.
b. Setelah cair, memindahkannya pada cawan petri dan menunggu hingga medium padat.
c. Memasukkan masing-masing bakteri uji yang dikultur pada medium NB ke dalam medium NA pada cawan yang telah padat sebanyak 100 µl. Setiap satu jenis bakteri ada 6 cawan. Lalu meratakan bakteri dengan metode spread plate menggunakan batang Drugalski.
d. Memasukkan 3 buah blank disc yang sudah ditetesi dengan air kelapa uji yang sama ke dalam setiap cawan berisi bakteri. Dilakukan juga untuk larutan obat Lodia dan aquades steril.
e. Menutup tepian cawan dengan plastik wrap.
g. Setelah 24 jam, mengamati zona hambat yang terbentuk. Lalu mengukur diameternya menggunakan jangka sorong. Jika zona hambat mempunyai bentuk yang tidak simetris, maka diukur bagian-bagian diameter yang representatif, kemudian hasil yang telah didapat dihitung rata-ratanya.
3.6. Penapisan fitokimia
3.6.1.Alkaloid
Mengambil larutan uji sebanyak 1 ml dan menuang ke dalam tabung reaksi, kemudian metambahkan 2 tetes pereaksi Dragendorf LP, jika terbentuk endapan jingga coklat, maka sampel dinyatakan positif mengandung alkaloid (Masitoh, 2011).
3.6.2.Flavonoid
Menguapkan 1 ml larutan uji dan menambahkan 2 ml etanol 95% dan 0,5 gram serbuk seng, kemudian metambahkan 2 ml HCl 2N, mendiamkan 1 menit. Setelah itu, menambahkan 10 tetes HCl pekat. Mengocoknya perlahan, kemudian mendiamkan 2 sampai 5 menit. Jika terbentuk warna merah, maka sample dinyatakan positif mengandung flavonoid (Masitoh, 2011).
3.6.3.Tanin
3.6.4.Saponin
Uji Saponin dilakukan dengan metode Forth yaitu dengan cara memasukkan 2 mL sampel kedalam tabung reaksi kemudian menambahkan 10 mL akuades lalu mengocoknya selama 30 detik, Mengamati perubahan yang terjadi. Apabila terbentuk busa yang mantap (tidak hilang selama 30 detik) maka identifikasi menunjukkan adanya saponin. Uji penegasan saponin dilakukan dengan menguapkan sampel sampai kering kemudian mencucinya dengan heksana sampai filtrat jernih. Menambahkan kloroform pada residu yang tertinggal, mengaduk 5 menit, kemudian menambahkan Na2SO4 anhidrat dan menyaringnya. Filtrat dibagi menjadi menjadi 2 bagian, A dan B. Filtrat A sebagai blangko, menetesi filtrat B anhidrat asetat, mengaduk perlahan, kemudian menambahkan H2SO4 pekat dan mengaduknya kembali. Jika terbentuknya cincin merah sampai coklat, maka menunjukkan adanya saponin (Marliana et al., 2005).
3.6.5.Steroid
3.7. Analisis Data