Kesetimbangan Fasa Cair-Cair dan Cair-Uap
Afdhal Junaidi*, Ana Nur Aida Putri, Rista Nabila, Caprilia Adiyat Prihasti, Ahmad Suteja Laili Amalia.
Kelompok 5, Kelas C, Jurusan Kimia, Fakultas MIPA, Universitas Brawijaya, Jl. Veteran 65145, Indonesia
ABSTRAK
Pada percobaan kesetimbangan fasa cair-cair dan cair-uap, dilakukan percobaan untuk membuat kurva kalibrasi indeks biar terhadap fraksi mol dan untuk membuat kurva kesetimbangan antara fasa cair-cair dan cair-uap. Metode yang digunakan untuk percobaan ini yaitu dengan menggunakan metode destilasi campuran biner dan pengukuran indeks bias menggunakan alat refraktometer. Praktikan melakukan pengukuran indeks bias terhadap pelarut murni dan campuran metanol dan aseton . Dari data tersebut, praktikan dapat membuat kurva hubungan antara indeks bias terhadap fraksi mol. Berdasarkan kurva tersebut, menunjukkan bahwa fraksi mol metanol berbanding lurus dengan indeks biasnya. Pada destilasi campuran biner, praktikan melakukan destilasi untuk memperoleh destilat dari campuran pelarut methanol dan aseton. Dengan memanaskan campuran pelarut tersebut, maka komponennya akan mengalami penguapan kemudian mengalami kondensasi dan menghasilkan destilat.. Praktikan memperoleh kurva hubungan antara titik didih dengan indeks bias dan titik didih dengan volatilifitas relatif (YA). Berdasarkan kurva tersebut menunjukkan bahwa temperature berbanding terbalik dengan indeks bias dan volatilitas relatif.
In the experimental phase equilibrium liquid-liquid and liquid-vapor, conducted an experiment to create a calibration curve so that the mole fraction index and to make the curve of phase equilibrium between liquid-liquid and liquid-vapor. The method used for this experiment is by using a binary mixture distillation method and the refractive index measurement using a refractometer. Practitioner measurement of the refractive index of the pure solvent and a mixture of methanol and acetone. From these data, the practitioner can make a curve relationship between the refractive index of the mole fraction. Based on the curve, showing that the mole fraction of methanol is directly proportional to the refractive index. In a binary mixture distillation, practitioner perform distillation to obtain a distillate from a mixture of methanol and acetone. By heating the solvent mixture, the components will undergo evaporation and then condenses and produces distillate. Practitioner gain curve relationship between the boiling point of refractive index and boiling point with relative volatilifitas (YA). Based on this curve shows that the temperature is inversely proportional to the refractive index and the relative volatility.
I. PENDAHULUAN
Destilasi adalah proses pemisahan senyawa cair yang didahului dengan penguapan senyawa cair dengan memanaskanya, kemudian mengembunkan uap yang terbentuk yang akan ditampung dalam wadah yang terpisah untuk mendapatkan destilat. Proses yang terjadi pada saat destilasi adalah perubahan fasa cair menjadi gas dengan pendidihan lalu terjadi penguapan, kemudian pengembunan tetapi destilat bukan merupakan urutan dua proses penguapan atau kondensasi. Tekanan uap merupakan suatu sifat-sifat dari zat cair yang tergantung pada suhu dan selalu bertambah dengan kenaikkan suhu. Destilasi dilakukan untuk memisahkan larutan berdasarkan titik didihnya [8].
Destilasi juga merupakan suatu perubahan cairan menjadi uap dan uap tersebut didinginkan kembali menjadi cairan. Unit operasi destilasi merupakan metode yang digunakan untuk memisahkan komponen-komponennya didasarkan pada perbedaan titik didih saling berdekatan yang terdapat dalam salah satu larutan atau campuran dan bergantung pada distribusi komponen-komponen tersebut antara fasa uap dan fasa cair. Syarat utama dalam operasi pemisahan komponen-komponen dengan cara destilasi adalah komposisi uap harus berbeda dengan komposisi cairan dengan terjadi kesetimbangan larutan-larutan dengan komponen-komponennya cukup dapat menguap [7].
Fasa adalah bagian system yang komposisi kimia dan sifat-sifat fisiknya seragam, yang terdapat dari bagian system lainnya oleh adanya bidang batas. Perilaku fasa yang dimiliki oleh suatu zat murni adalah sangat beragam dan sangat rumit, akan tetapi data-datanya dapat dikumpulkan dan kemudian dengan termodinamika dapat dibuat ramalan-ramalan. Pemahaman mengenai perilaku fasa berkembang dengan adanya aturan fasa gibbs. Hukum fasa gibbs, jumlah terkecil variable bebas yang dilakukan untuk menyatakan keadaan suatu system dengan tepat dengan kesetimbangan diungkapkan sebagai :
F = C – P + 2
Dimana: F = Jumlah derajat kebebasan C = Jumlah komponen P = Jumlah fasa - Jumlah komponen-komponen dalam suatu system didefinisikan sebagai jumlah minimum dari “variable bebas pilihan” yang dibutuhkan untuk menggambarkan komposisi tiap fase dari suatu system [6].
perubahan suhu pada sistem satu komponen. Fasa dapat didefinisikan sebagai setiap bagian sistem yang sebagai berikut [5]:
a. Homogen dan dipisahkan oleh batas yang jelas
b. Sifat fisik dan sifat kimia berbeda dari bagian sistem lain c. Dapat dipisahkan secara mekanik dari bagian lain sistem
Kesetimbangan fasa antara cairan dan uap terjadi ketika kedua proses yang berlawanan berlangsung dengan laju yang tepat sama. Maka jika distribusi laju molekuler diketahui untuk berbagai suhu kita dapat membuat perkiraaan teoritis dari tekanan uap sebagai fungsi dari suhu. Ketika cairan menguap molekul dengan kecepatan yang tinggilah yang lepas dari permukaaan. Sementara itu yang tertinggal rata-rata memiliki energi yang lebih sedikit; ini memberikan sudut pandang molekuler dari pendinginan dan pengembunan, [2].
Dalam pencampuran suatu zat, komposisinya dapat dihitung berdasarkan fraksi molnya. Fraksi mol adalah perbandingan antara jumlah mol satu komponen dengan jumlah mol total komponen yang ada dalam suatu campuran. Setiap komponen(khususnya cair) mempunyai tekanan uap murni, dan tekanan uap ketika berada dalam campuran, atau biasa disebut dengan tekanan uap parsial. Hubungan antara tekanan uap dengan fraksi mol ini dijelaskan oleh hukum Raoult. Hukum Raoult menyatakan bahwa tekanan uap parsial suatu komponen dalam campuran berbanding lurus dengan fraski molnya. Misalkan suatu campuran terdiri dari pentana dan heksana, maka [3] :
X
pentana=
jumlahmol pentana
(jumlahmol pentana+jumlahmol heksana)
X
heksana=
jumlah mol heksana
(jumlahmol pentana+jumlahmol heksana)
X
pentana+ X
heksana= 1
P
pentana= P
opentana. X
pentanaP
heksana= P
oheksana. X
heksanaP
total= P
pentana+ P
heksanan =
cv=
√ εε. μ0. μ0=
√ εr. μrμ=¿permeabilitas medium
μ0=permeabilitasruang hampa
μr=permeabilitasrelatif
ε=permitivitas
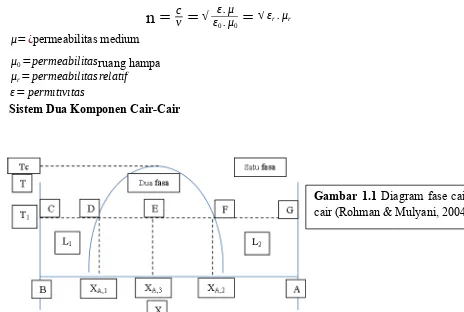
1. Sistem Dua Komponen Cair-Cair
Dua cairan dikatakan misibel sebagian jika A larut dalam jumlah yang terbatas, dan demikian pula dengan B, larut dalam A dalam jumlah yang terbatas. Bentuk yang paling umum dari diagram fasa T-X cair-cair pada tekanan tetap, biasanya 1 atm (seperti gambar diatas). Diagram diatas dapat diperoleh secara eksperimen dengan menambahkan suatu zat cair ke dalam cairan murni lain pada tekanan tertentu dengan variasi suhu [1].
Cairan B murni yang secara bertahap ditambahkan sedikit demi sedikit cairan A pada suhu tetap (T1). Sistem dimulai dari titik C (murni zat B) dan bergerak kea rah kanan secara horizontal sesuai dengan penambahan zat A. Dari titik C ke titik D diperoleh satu fasa (artinya A yang ditambahkan larut dalam B). Di titik D diperoleh kelarutan maksimum cairan A dalam cairan B pada suhu T1 [5].
Penambahan A selanjutnya akan menghasilkan sistem dua fasa (dua lapisan), yaitu lapisan pertama (L1) larutan jenuh A dalam B dengan komposisi XA,1 dan lapisan kedua (L2) larutan jenuh B dalam A dengan komposisi XA,2. Kedua lapisan ini disebut sebagai lapisan konyugat (terdapat bersama-sama di daerah antara D dan F). Komposisi keseluruhan ada diantara titik D dan F. Di titik E komposisi keseluruhan adalah XA,3. Jumlah relatif kedua fasa dalam kesetimbangan ditentukan dengan aturan lever. Di titik E lapisan pertama lebih banyak dari lapisan kedua. Penambahan A selanjutnya akan mengubah komposisi keseluruhan semakain ke kanan, sementara komposisi kedua lapisan akan tetap XA,1 dan XA,2 [6].
Perbedaan yang terjadi akibat penambahan A secara terus menerus terletak pada jumlah relative lapisan pertama dan kedua. Semakin ke kanan jumlah relative lapisan pertama akan berkurang sedangkan lapisan kedua akan bertambah. Di titik F cairan A
B dalam A. Dengan demikian sistem di F menjadi satu fasa. Dari F ke G, penambahan A hanya merupakan pengenceran larutan B dalam A. Untuk mencapai titik G di perlukan penambahan jumlah A yang tak terhingga banyaknya atau dengan melakukan percobaan mulai dari zat A murni yang kemudian di tambah zat B sedikit demi sedikit sampai di capai titik F dan seterusnya [1].
Jika percobaan dilakukan pada suhu tinggi akan di peroleh batas kelarutan yang berbeda. Semakin tinggi suhu, kelarutan masing-masing komponen satu sama lain meningkat, sehingga daerah fasa semakin menyempit. Kurva kelarutan pada akhirnya bertemu disuatu titik pada suhu konsolut atas, atau disebut juga suhu kelarutan kritis (Tc). Di atas titik Tc cairan saling melarut sempurna dalam berbagai komposisi [4].
2. Sistem Dua Komponen Cair-Uap
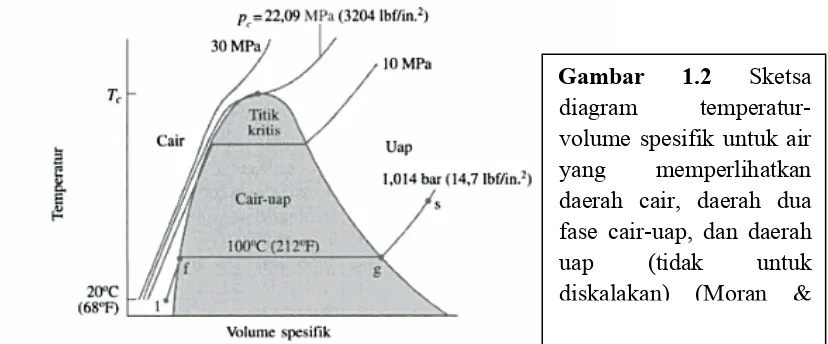
Ketika sistem berada pada keadaan cair jenuh (keadaan f pada Gambar 1.2), penambahan kalor pada tekanan tertentu menyebabkan pembentukan uap tanpa terjadi perubahan temperature, tetapi dengan peningkatan volume spesifik yang cukup berarti. Ketika campuran cair dan uap berada dalam kesetimbangan, fase cair merupakan cair jenuh dan fase uap merupakan uap jenuh. Jika sistem terus dipanaskan sampai butir cairan terakhir menguap, maka tercapai titik g pada Gambar 1.2, yaitu keadaan uap jenuh. Campuran dua fase cair-uap dapat dibedakan satu dengan yang lainnya menggunakan suatu sifat intensif yang dikenal sebagai kualitas [2]
Untuk suatu campuran dua fase cair dan uap, rasio massa uap terhadap massa total campuran merupakan kualitas, x, yang dapat dihitung sebagai berikut,
x
=
muapm uap+mcairKualitas mempunyai nilai dari nol sampai dengan satu: pada keadaan cair jenuh, x = 0, dan pada keadaan uap jenuh, x = 1,0. Meskipun didefinisikan sebagai nilai perbandingan, kualitas seringkali diberikan dalam bentuk persentase [3].
Gambar 1.2 Sketsa
Tujuan daripada percobaan ini yaitu membuat kurva kalibrasi indeks bias terhadap komposisi dan membuat kurva kesetimbangan antara uap dan cairan.
II. METODOLOGI
II.1. Alat dan Bahan
Alat yang dibutuhkan pada praktikum Kesetimbangan Fasa Cair-Cair dan Cair-Uap adalah satu set destilator sederhana, satu set refraktometer, gelas kimia 250 mL, pipet ukur 2,1 mL, tabung reaksi, pipet tetes dan kertas saring. Bahan-bahan yang diperlukan diantaranya metanol, akuades, etanol dan pelarut organik lainnya
II.2. Prosedur kerja
2.2.1 Kalibrasi komposisi melalui penentuan indeks bias
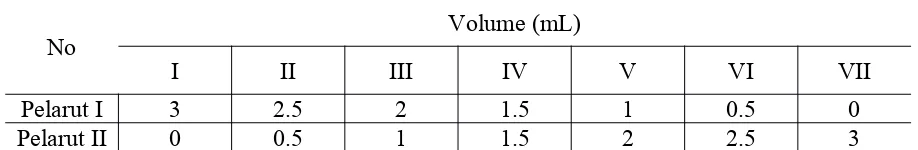
Pertama disiapkan 5 buah tabung reaksi dan isi dengan campuran pelarut sesuai dengan tugas dari asisten. Buat komposisi yang sesuai berdasarkan Tabel 2.1, kemudian hitung fraksi molnya
Tabel 2.1 : Komposisi pada campuran biner 1
No Volume (mL)
I II III IV V VI VII
Pelarut I 3 2.5 2 1.5 1 0.5 0
Pelarut II 0 0.5 1 1.5 2 2.5 3
Setelah memahami cara menggunakan refraktometer, maka langkah selanjutnya adalah membersihkan tempat sampel dengan menggunakan aseton 1-2 tetes, lalu lakukan pengukuran indeks bias dengan campuran pada tabel 2.1. terkahir buat kurva antra indeks bias dan fungsi komposisi.
2.2.2 Destilasi campuran biner
Pertama siapkan 5 seri campuran biner dengan komponen sama seperti tabel 2.1 tetapi berbeda komposisi sesuai tabel 2.2, setelah itu siapkan set alat destilasi sederhana lengkap dengan heating mantle, masukkan campuran I kedalam labu bundar, kemudian pasang pada alat destilasi, alirkan air dingin melalui kondensor lalu hidupkan heating mantle.
No Volume (mL) I Pelarut I (Metanol) 20
Pelarut II (Aseton) 8
Hitung temperatur sewaktu terjadi tetesan pertama sampai volume 2 mL dan ditampung sebagai komponen awal, lalukan cara yang sama sebanyak 7 kali pengamatan. Tampung setiap fraksi di tabung yang berbeda. Setelah itu ukur indeks bias masing masingnya, hentikan proses destilasi ketika sudah medapat 7 buah fraksi.
III. HASIL DAN PEMBAHASAN
3.1 Kalibrasi Komposisi melalui Penentuan Indeks Bias
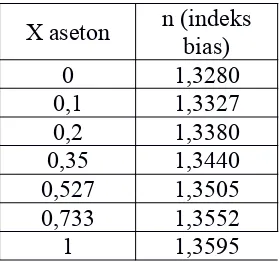
X aseton n (indeksbias)
Tabel 3.1. Indeks Bias dengan Fraksi Mol
0 0.2 0.4 0.6 0.8 1
Grafik 3.1. Indeks Bias dengan Fraksi Mol
bias sebesar 1,3380 didapatkan fraksi mol aseton 0,209 sehingga fraksi mol metanol 0,791. Campuran IV antara metanol 1,5 mL dengan aseton 1,5 mL didapatkan indeks bias sebesar 1,3440 didapatkan fraksi mol aseton 0,358 sehingga fraksi mol metanol 0,642. Campuran V antara metanol 1 mLdengan aseton 2 mL didapatkan indeks bias sebesar 1,3505 didapatkan fraksi mol aseton 0,527 sehingga fraksi mol metanol 0,473. Campuran VI antara metanol 0,5 mL dengan aseton 2,5 mL didapatkan indeks bias sebesar 1,3552 didapatkan fraksi mol aseton 0,733 sehingga fraksi mol metanol 0,267 dan untuk campuran VII aseton 3 mL didapatkan indeks bias 1,3595 didapatkan fraksi mol metanol 1. Berdasarkan data yang diperoleh dapat diketahui bahwa hubungan antara indeks bias dengan fraksi mol berbanding lurus. Semakin besar nilai indeks bias maka komposisi aseton semakin besar. Hal ini disebabkan karena fraksi mol aseton semakin meningkat. Hubungan antara kurva baku indeks bias dengan fraksi mol didapatkan persamaan y= 0,0319x + 1,3307 dan R2 = 0,959.
3.2 Destilasi Campuran Biner
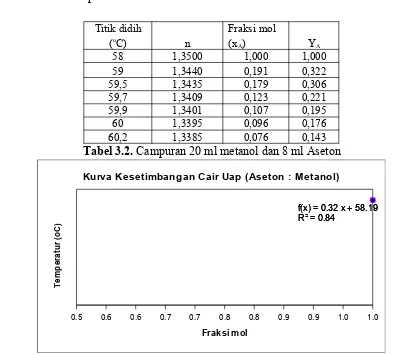
Tabel 3.2. Campuran 20 ml metanol dan 8 ml Aseton
0.5 0.6 0.6 0.7 0.7 0.8 0.8 0.9 0.9 1.0 1.0
Grafik 2. Campuran 20 ml Metanol dan 8 ml Aseton
relativitas volatilitas (YA) 0,221. Destilat kelima pada temperatur 59,9oC dengan indeks bias 1,3401 memiliki fraksi mol 0,107 dan relativitas volatilitas (YA) 0,195. Destilat keenam pada temperatur 60oC dengan indeks bias 1,3395 memiliki fraksi mol 0,096 dan relativitas volatilitas (YA) 0,176. Destilat ketujuh pada temperatur 60,2oC dengan indeks bias 1,3385 memiliki fraksi mol 0,076 dan relativitas volatilitas (YA) 0,143. Berdasarkan data yang diperoleh, dapat diketahui bahwa temperatur berbanding terbalik dengan fraksi mol. Semakin tinggi temperatur maka fraksi mol semakin menurun. Hal ini disebabkan karena kemampuan untuk menguap (volatil) dari metanol semakin tinggi sehingga komposisi dari metanol semakin menurun. Komposisi tiap komponen dapat diketahui melalui beberapa parameter fisik salah satunya harga indeks bias. Karena fraksi mol berbanding lurus dengan indeks bias, maka fraksi mol dalam destilasi campuran menyebabkan harga indeks bias dan relativitas volatil menurun. Persamaan untuk kurva yang terletak pada daerah fasa uap adalah y = -2,2709x + 60,192 dan R2 = 0,9174. Persamaan untuk kurva yang terletak pada daerah fasa cair adalah y = -2,0647x + 59,972 dan R2 = 0,8606.
IV. KESIMPULAN
Berdasarkan praktikum kali ini yaitu kesetimbangan cair-cair dan cair uap dapat disimpulkan bahwa grafik yang didapatkan antara indeks bias dengan fraksi mol yaitu berbanding lurus sehingga sesuai dengan teori, indeks bias berbanding lurus dengan fraksi mol. Pada percobaan destilasi campuran biner dapat disimpulkan bahwa grafik yang didapatkan memperlihatkan hubungan fraksi mol terhadap temperatur yaitu berbanding terbalik sehingga sesuai dengan teori, fraksi mol berbanding terbalik dengan temperatur.
V. DAFTAR PUSTAKA
[1] Atkins, P.W. 1990. Physical Chemistry. Oxford: Oxford University Press. [2] Dogra, SK dan S. Dogra. 1990. Kimia Fisik dan Soal-soal. Jakarta: UI-PRESS. [3] Hugh D. Young. 2002. Fisika Universitas Jilid 1 Edisi 10. Jakarta: Erlangga.
[4] Mohrig, Jerry R et.al. 2010. Techniques in Organic Chemistry. New York: W. H. Freeman and Company.
[5] Moran, Michael J., Howard N. Shapiro. 2004. Termodinamika Teknik Edisi ke-4. Jakarta: Erlangga.
[6] Rohman, Ijang dan Sri Mulyani. 2004. Kimia Fisika I. Jakarta: JICA.
[7] Santoso, Didik R. 2006. Petunjuk Praktikum Fisika Dasar-2. Malang: Laboratorium Fisika Dasar Jurusan Fisika Fakultas MIPA Universitas Brawijaya.
[8]Widjajanti, Endang. LFK. 2008. “Kesetimbangan Fasa”. (