BAB I PENDAHULUAN
1.1 LATARBELAKANG
Fasa adalah bagian sistem dengan komposisi kimia dan sifat – sifat fisik seragam, yang terpisah dari bagian sistem lain oleh suatu bidang batas. Pemahaman perilaku fasa mulai berkembang dengan adanya aturan fasa Gibbs. Untuk sistem satu komponen, persamaan Clausius dan Clausisus – Clapeyron menghubungkan perubahan tekanan kesetimbangan dengan perubahan suhu.
Jika campuran dua cairan nyata (real) berada dalam kesetimbangan dengan uapnya pada suhu tetap, potensial kimia dari masing – masing komponen adalah sama dalam fasa gas dan cairnya. Sistem biner paling sederhana yang mengandung fasa padat dan cair ditemui bila komponen – komponennya saling bercampur dalam fas cair tetapi sama sekali tidak bercampur pada fasa padat, sehingga hanya fasa padat dari komponen murni yang akan keluar dari larutan yang mendingin.
Jika suatu larutan dari dua zat A dan B didinginkan sampai suhu yang cukup rendah, akan muncul suatu padatan. Suhu ini adalah titik beku larutan, yang bergantung pada komposisi
1.2 RUMUSAN MASALAH
Adapun rumusan masalah dalam pembuatan makalah ini adalah:
1. Bagaimana kesetimbangan uap–cair dari campuran ideal dua komponen dan tekanan uap campuran non ideal?
2. Bagaimana Sistem azeotrop dan proses destilasi?
3. Bagaimana Diagram T-X sistem biner padat-cair dan Diagram dengan satu dan dua campuran eutektik?
1.3 TUJUAN
Adapun yang menjadi tujuan pembuatan makalah ini adalah:
a) Mengkonversi bentuk diagram P-X menjadi bentuk diagram T-X dan menjelaskan berbagai fenomena yang terjadi.
b) Menjelaskan proses destilasi sebagai aplikasi dari system azeotropis dengan menggunakan diagram T-X untuk kesetimbangan cair-uap.
c) Menggambarkan kurva suhu dan komposisi berbagai keadaan berdasarkan diagram T-X system biner padat-cair.
BAB II ISI
2.1 Kesetimbangan Uap – Cair dari Campuran Ideal Dua Komponen
Jika campuran dua cairan nyata (real) berada dalam kesetimbangan dengan uapnya pada suhu tetap, potensial kimia dari masing – masing komponen adalah sama dalam fasa gas dan cairnya.
μ
i(g)=
μ
i(l)... (3.20) Jika uap dianggap sebagai gas ideal, maka
μ
i(g)=
μ
io(g)+
RT
ln
P
iP
o ... (3.21)dimana Po adalah tekanan standar (1 bar). Untuk fasa cair,
μ
i(l)=
μ
io(l)+
RT
ln
a
i ... (3.22)Persamaan 3.25 menyatakan bahwa bila uap merupakan gas ideal, maka aktifitas dari komponen i pada larutan adalah perbandingan tekanan parsial zat i di atas larutan (Pi)
dan tekanan uap murni dari zat i (Pio).
Pada tahun 1884, Raoult mengemukakan hubungan sederhana yang dapat digunakan untuk memperkirakan tekanan parsial zat i di atas larutan (Pi ) dari suatu
komponen dalam larutan. Menurut Raoult,
Pernyataan ini disebut sebagai Hukum Raoult, yang akan dipenuhi bila komponen – komponen dalam larutan mempunyai sifat yang mirip atau antaraksi antar larutan besarnya sama dengan interaksi di dalam larutan (A – B = A – A = B – B). Campuran yang demikian disebut sebagai campuran ideal, contohnya campuran benzena dan toluena. Campuran ideal memiliki sifat – sifat
ΔHmix = 0
ΔVmix = 0
ΔSmix = - R Σni ln xi
Tekanan uap total di atas campuran adalah
P
=
P
1+
P
2
=
x
1P
1o+
x
2P
2o ... (3.27) Karena x2 = 1 – x1, makaP=P2o+
(
Po1−P2o)
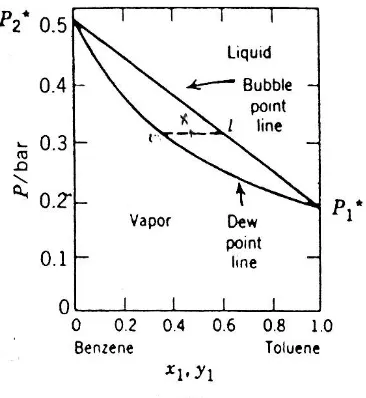
x1 ... (3.28)Persamaan di atas digunakan untuk membuat garis titik gelembung (bubble point line). Di atas garis ini, sistem berada dalam fasa cair. Komposisi uap pada kesetimbangan ditentukan dengan cara
x
i'=
P
P
i... (3.29)
Gambar 3.3. Tekanan total dan parsial untuk campuran benzena – toluena pada 60oC
Gambar 3.4. Fasa cair dan uap untuk campuran benzena – toluena pada 60oC
Garis titik embun (dew point line) dibuat dengan menggunakan persamaan
P= P1 oP
2
o
P1o+
(
P2o+P1o)
x1o ... (3.30)Di bawah garis ini, sistem setimbang dalam keadaan uap.
Pada tekanan yang sama, titik – titik pada garis titik gelembung dan garis titik embun dihubungkan dengan garis horisontal yang disebut tie line (lihat gambar 3.4). Jika diandaikan fraksi mol toluena adalah x, maka jumlah zat yang berada dalam fasa cair adalah
C
cair=
x
l
−
−
v
v
... (3.31) Sedangkan jumlah zat yang berada dalam fas uap adalah
C
uap=
l
l
−
−
x
v
... (3.32)
2.2. Tekanan Uap Campuran Non Ideal
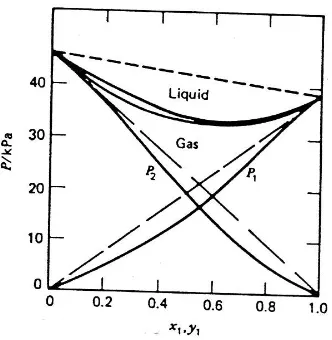
Tidak semua campuran bersifat ideal. Campuran – campuran non ideal ini mengalami penyimpangan / deviasi dari hukum Raoult. Terdapat dua macam penyimpangan hukum Raoult, yaitu
a. Penyimpangan positif
Penyimpangan positif hukum Raoult terjadi apabila interaksi dalam masing – masing zat lebih kuat daripada antaraksi dalam campuran zat ( A – A, B – B > A – B). Penyimpangan ini menghasilkan entalpi campuran (ΔHmix) positif (bersifat
endotermik) dan mengakibatkan terjadinya penambahan volume campuran (ΔVmix >
0). Contoh penyimpangan positif terjadi pada campuran etanol dan n – hekasana.
Gambar 3.5. Penyimpangan positif hukum Raoult
b. Penyimpangan negatif
Penyimpangan negatif hukum Raoult terjadi apabila antaraksi dalam campuran zat lebih kuat daripada interaksi dalam masing – masing zat ( A – B > A – A, B – B). Penyimpangan ini menghasilkan entalpi campuran (ΔHmix) negatif (bersifat
eksotermik) mengakibatkan terjadinya pengurangan volume campuran (ΔVmix < 0)..
Gambar 3.6. Penyimpangan negatif hukum Raoult
Pada gambar 3.5 dan 3.6 terlihat bahwa masing – masing kurva memiliki tekanan uap maksimum dan minimum. Sistem yang memiliki nilai maksimum atau minimum disebut sistem azeotrop. Campuran azeotrop tidak dapat dipisahkan dengan menggunakan destilasi biasa. Pemisahan komponen 2 dan azotrop dapat dilakukan dengan destilasi bertingkat. Tetapi, komponen 1 tidak dapat diambil dari azeotrop. Komposisi azeotrop dapat dipecahkan dengan cara destilasi pada tekanan dimana campuran tidak membentuk sistem tersebut atau dengan menambahkan komponen ketiga.
2.3 SISTEM AZEOTROP DAN PROSES DESTILASI
A. Pengertian
Destilasi adalah suatu proses pemisahan termal untuk memisahkan komponen-komponen yang mudah menguap dari suatu campuran cair dengan cara menguapkannya, yang diikuti dengan kondensasi uap yang terbentuk dan menampung kondensat yang dihasilkan.
suatu proses rektifikaasi. Dalam hal ini campuran dipisahkan menjadi dua, yaitu bagian yang mudah menguap dan bagian yang sukar menguap. Kemudian masing-masing bagian diolah lebih lanjut dengan cara rektifikasi. Uap yang dikeluarkan dari campuran disebut sebagai uap bebas, kondensat yang jatuh sebagai destilat dari bagian cairan yang tidak menguap sebagai residu. Biasanya destilat digunakan untuk menarik senyawa organic yang titik didihnya dibawah 250 oC, pendestilasian senyawa-senyawa yang titik didihnya
tinggi dikuatirkan akan rusak oleh pemanasan sehingga tidak cocok untuk ditarik dengan teknik destilasi.
B. Prinsip dan Proses Kerja Destilasi
Prinsip Destilasi
Pada prinsipnya pemisahan dalam suatu proses destilasi terjadi karena penguapan salah satu komponen dari campuran, artinya dengan cara mengubah bagian-bagian yang sama dari keadaan cair menjadi berbentuk uap. Dengan demikian persyarannya adalah kemudahan menguap (volatilitas) dari komponen yang akan dipisahkan berbeda satu dengan yang lainnya. Pada campuran bahan padat dalam cairan, persyaratan tersebut praktis selalu terpenuhi. Sebaliknya, pada larutan cairan dalam cairan biasanya tidak mungkin dicapai sempurna, karena semua komponen pada titik didih campuran akan mempunyai tekanan uap yang besar. Destilat yang murni praktis hanya dapat diperoleh jika cairan yang sukar menguap mempunyai tekanan uap yang kecil sekali sehingga dapat diabaikan.
Proses Destilasi
Secara umum proses yang terjadi pada destilasi sederhana atau biasa yaitu :
Penguapan komponen yang mudah menguap dari campuran dalam alat penguap
Pengeluaran uap yang terbentuk melalui sebuah pipa uap yang lebar dan kosong tanpa
perpindahan panas dan pemindahan massa yang disengaja atau dipaksakan yang dapat menyebabkan kondensat mengalir kembali ke lat penguap.
Jika perlu, tetes-tetes cairan yang sukar menguap yang ikut terbawa dalam uap
dipisahkan dengan bantuan siklon dan disalurkan kembali kedalam alat penguap.
Kondensasi uap dalam sebuah kondensor
Pendingin lanjut dari destilat panas dalam sebuah alat pendingin
Penampungan destilat dalam sebuah bejana
Pengeluaran residu dari alat penguap
Pendinginan lanjut dari residu yang dikeluarkan Penampungan residu dalam sebuah
bejana.
PERISTIWA YANG TERJADI PADA PROSES DESTILASI
C. DESTILASI AZEOTROP
Distilasi Azeotrop digunakan dalam memisahkan campuran azeotrop (campuran campuran dua atau lebih komponen yang sulit di pisahkan), biasanya dalam prosesnya digunakan senyawa lain yang dapat memecah ikatan azeotrop tsb, atau dengan menggunakan tekanan tinggi. Azeotrop merupakan campuran 2 atau lebih komponen pada komposisi tertentu dimana komposisi tersebut tidak bisa berubah hanya melalui distilasi biasa. Ketika campuran azeotrop dididihkan, fasa uap yang dihasilkan memiliki komposisi yang sama dengan fasa cairnya. Campuran azeotrop ini sering disebut juga constant boiling mixture karena komposisinya yang senantiasa tetap jika campuran tersebut dididihkan.
Untuk lebih jelasnya, perhatikan ilustrasi berikut :
Titik A pada pada kurva merupakan boiling point campuran pada kondisi sebelum mencapai azeotrop. Campuran kemudian dididihkan dan uapnya dipisahkan dari sistem kesetimbangan uap cair (titik B). Uap ini kemudian didinginkan dan terkondensasi (titik C). Kondensat kemudian dididihkan, didinginkan, dan seterusnya hingga mencapai titik azeotrop. Pada titik azeotrop, proses tidak dapat diteruskan karena komposisi campuran akan selalu tetap. Pada gambar di atas, titik azeotrop digambarkan sebagai pertemuan antara kurva saturated vapor dan saturated liquid. (ditandai dengan garis vertikal putus-putus Etanol dan air membentuk azeotrop pada komposisi 95.6%-massa etanol pada keadaan standar.
cair
Cara yang ditempuh untuk mengatasi campuran azeotrop yaitu :
1. Menambahkan zat ketiga, sehingga terjadi campuran azeotrop baru. Campuran azeotrop baru direfluks dan di destilasi kembali. Contoh : alkohol + air –> azeotrop Alkohol + air + benzene –> azeotrop baru
2. Menambahkan suatu zat yang dapat mengikat salah satunya. Cnth : alkohol dan air Alkohol + air + CaO –> alkohol + Ca(OH)2.
2.4 DIAGRAM T-X SISTEM BINER DUA KOMPONEN DENGAN FASA PADAT-CAIR
Sistem biner paling sederhana yang mengandung fasa padat dan cair ditemui bila komponen – komponennya saling bercampur dalam fas cair tetapi sama sekali tidak bercampur pada fasa padat, sehingga hanya fasa padat dari komponen murni yang akan keluar dari larutan yang mendingin.
I. Diagram fase cair-padat
Keterangan:
Pada titik a1 komponen dalam keadaan cair.
Cair + A terjadi proses pendinginan pertama yaitu pada titik a2, cairan + padatan A
dan kaya akan komponen B.
Pada titik a3 masih dalam pendinginan dan terbentuk padatan lebih banyak . dan
jumlah relatif padatan dan cairan (yang berada dalam kesetimbangan), pad tahap ini padatan dan cairan masing-masing berjumlah sama.
Fase cair lebih kaya akan B daripada sebelumnya (komposisi dinyatakan dengan b3)
karena komponen A sudah mengendap.
Cair + B; cairan + padatan B dan kaya akan komponen A.
Pada titik a4, komposisi cairan lebih sedikit dari pada di a3, membentuk padatan dan
terletak pada temperatur eutektik.
Tada Te padatan mudah dilelehkan.
Larutan dengan komposisi disebelah kanan e mengendapkan A ketika larutan itu
mendingin dan larutan disebelah kiri e mengedapkan B.
Pada titik a5, kedua fase titik a5’ untuk bagian padatan B hampir murni dan a5” untuk
padatan A hampir murni.
Sistem seperti itu digambarkan dalam diagram fasa Bi dan Cd berikut.
Bila suatu cairan yang mengandung hanya satu komponen didinginkan, plot suhu terhadap waktu memiliki lereng yang hampir tetap. Pada suhu mengkristalnya padatan yang keluar dari cairan, kurva pendingina akan mendatar jika pendinginan berlangsung lambat. Patahan pada kurva pendinginan disebabkan oleh terlepasnya kalor ketika cairan memadat. Hal ini ditunjukkan pada bagian kiri gambar 3.9, yaitu cairan hanya mengandung Bi (ditandai dengan komposisi Cd 0%) pada suhu 273oC dan cairan yang
hanya mengandung Cd (ditandai dengan komposisi Cd 100%) pada suhu 323oC.
Jika suatu larutan didinginkan, terjadi perubahan lereng kurva pendinginan pada suhu mulai mengkristalnya salah satu komponen dari larutan, yang kemudian memadat. Perubahan lereng ini disebabkan oleh lepasnya kalor karena proses kristalisasi dari padatan yan gkeluar dari larutan dan juga oleh perubahan kapasitas kalor. Hal ini dapat terlihat pada komposisi 20% dan 80% Cd. Untuk komposisi 40% Cd pada suhu 140oC,
terjadi pertemuan antara lereng kurva pedinginan Bi dan Cd yang menghasilkan garis mendatar. Pada suhu ini, Bi dan Cd mengkristal dan keluar dari larutan, menghasilkan padatan Bi dan Cd murni. Kondisi dimana larutan menghasilkan dua padatan ini disebut titik eutektik, yang hanya terjadi pada komposisi dan suhu tertentu. Pada titik eutektik terdapat tiga fasa, yaitu Bi padat, Cd padat dan larutan yang mengandung 40% Cd. Derajat kebebasan untuk titik ini adalah 0, sehingga titik eutektik adalah invarian. Eutektik bukan merupakan fasa, tetapi kondisi dimana terdapat campuran yang mengandung dua fasa padat yang berstruktur butiran halus.
2.5 DIAGRAM EUTEKTIK SEDERHANA PADA KESETIMBANGAN PADAT-CAIR
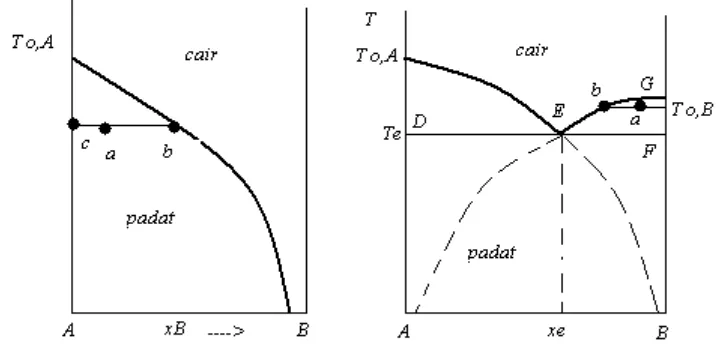
Jika suatu larutan dari dua zat A dan B didinginkan sampai suhu yang cukup rendah, akan muncul suatu padatan. Suhu ini adalah titik beku larutan, yang bergantung pada komposisi. Dalam diskusi pada penurunan titik beku larutan, kita memperoleh persamaan.
lnxA=−∆ H fusR (T1− 1
¿A)……….(6.4)
larutan.Plot dari fungsi ini tampak pada gambar 6.6.a. Titik di atas kurva menunjukkan keadaan cair dari sistem, sedangkan di bawah kurva menunjukkan keadaan padatan murni A ada dalam kesetimbangan dengan larutan. Kurvanya dinamakan kurva liquidus.
Gambar 6.6 Kesetimbangan padat–cair dalam sistem 2 komponen
Titik a menunjukkan larutan dengan komposisi b dalam kesetimbangan dengan padatan dengan komposisi c, yaitu, zat murni A. Dengan aturan lever, rasio jumlah mol larutan terhadap jumlah mol padatan A adalah sama dengan rasio bagian garis dari ac/ab. Makin rendah suhu, makin besar jumlah relatif padatan pada suatu keseluruhan komposisi tertentu. Kurva ini tidak dapat menunjukkan situasi meliputi keseluruhan daerah komposisi. Jika xB ---1, kita dapat mengharapkan padatan B akan membeku jauh di atas suhu yang ditunjukkan oleh kurva pada daerah ini. Jika larutan ideal, aturan yang sama berlaku untuk zat B :
lnxB=−∆ H fus BR (T1−ToB1 )………. (6.5)
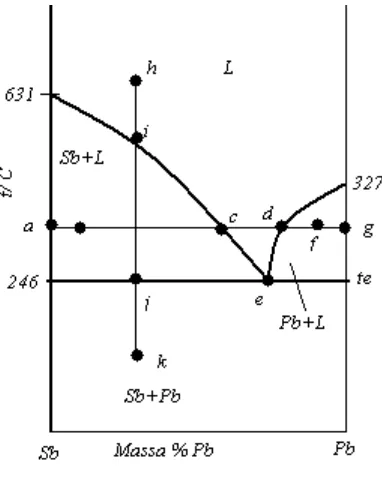
komposisi eutektik xe ada dalam kesetimbangan dengan padatan A dan padatan B. Jika terdapat tiga fase bersama, maka F’ = 3 – P = 3-3=0; sistemnya adalah invarian pada suhu ini. Jika panas keluar dari sistem ini, suhunya akan tetap sampai satu fase lenyap, sehingga jumlah relatif dari ketiga fase berubah hingga panas dihilangkan. Jumlah cairan berkurang sedangkan jumlah kedua padatan yang ada bertambah. Di bawah garis DEF adalah keadaan sistem yaitu hanya dua padatan, dua fase, murni A dan murni B. Beberapa contoh sistem kesetimbangan padat cair adalah : sistem Sb-Pb, yang diagram fasenya dapat dilihat di gambar 6.7. Daerah berlabel L adalah cairan, Sb adalah padatan Sb dan Pb adalah padatan Pb. Suhu eutektik adalah 2460C, komposisi eutektik adalah 87% massa Pb. Nilai xe dan te dihitung dengan persamaan 6.4 dan 6.5 dan ternyata sesuai dengan hasil eksperimen. Berarti cairan tersebut hampir menyerupai larutan ideal.
Gambar 6.7 Sistem Antimoni–lead
fase-1
fase-2
a’ a a”
l” l’
A x (nitrobenzen) B
T
Tuc
Banyak sistem biner, baik ideal maupun tidak, memiliki diagram fase bertipe eutektik sederhana. Invariansi sistem pada titik eutektik memungkinkan campuran eutektik dipergunakan sebagai bak bersuhu konstan. Misalnya padatan NaCl dicampur dengan es pada 0oC dalam labu vakum. Titik komposisi berpindah dari 0% ke sejumlah kecil nilai positif. Padahal pada komposisi ini titik beku es di bawah 0oC, sehingga sejumlah kecil es melebur. Karena sistem ada dalam labu terisolasi, meleburnya es mengurangi suhu campuran. Jika NaCl yang ditambahkan cukup, suhu akan turun sampai suhu eutektik,-21,1oC. Pada suhu eutektik ini, es,padatan garam dan larutan jenuh terdapat bersama sama dalam kesetimbangan. Suhu bertahan di suhu eutektik hingga es yang tersisa melebur karena panas yang menerobos secara lambat ke dalam labu.
2.6. DIAGRAM T-X SISTEM BINER CAIR-CAIR LARUT SEBAGIAN
a) Diagram fase cair-cair
Yang dimaksud dengan :
fase-1
Fase 2 adalah fase yang terdiri dari dua campuran heksana dan nitrobenzen dimana diantara keduanya masih dapat dibedakan satu sama lainnya.
a’ merupakan fase yang paling banyak mengandung komponen A dan sedikit dijenuhi oleh komponen B.
a” merupakan fase yang paling banyak mengandung komponen B dan sedikit dijenuhi
oleh komponen A. Misalnya :
Pada titik A adalah cairan Heksana dan pada titik B adalah cairaan nitrobenzen, pada temperatur tertentu cairn heksana mencapai suatu titik (a’) sedangkan cairan nitrobenzen mencapai titik tertentu (a”) sehingga kedua titik tersebut yaitu a’ dan a” dapat dihubungkan dengan satu gari hubung yang menghubungkan dua fase yang berada dalam kesetimbangan satu sama lain.
Garis hubung yang terlihat pada kurva menunjukkkan temperatur kritis atas (Tuc)
terjadi suatu tahapan dimana permukaan antara fase 1 dan fase 2 menghilang (terjadi pemisahan fase).
Fraksi mol a’ pada kisaran 0 < x < 0,2
Fraksi mol a” pada kisaran 0,8 < x < 1
II. Contoh lain diagram fase cair-cair
Keterangan :
Fase 1 adalah fase dimana komponen air dan etilen bercampur sempurna dan antar komponennya tidak bisa dibedakan lagi.
Fase 2 adalah fase yang terdiri atas dua campuran dan antar komponennya masih dapat dibedakan.
Pada temperatur kritis bawah terjadi penggabungan fase,sehingga beda antara kedua
fase tidak tampak lagi (membentuk satu fase).
a’ adalah komponen yang mengandung H2O dan sedikit dijenuhi oleh etilamina pada
suhu tertentu.
b’ adalah komponen yang mengandung banyak Et3N.
BAB III
PENUTUP
3.1. Kesimpulan
1.
Jika campuran dua cairan nyata (real) berada dalam kesetimbangan dengan uapnya pada suhu tetap, potensial kimia dari masing – masing komponen adalah sama dalam fasa gas dan cairnya,2.
Penyimpangan positif hukum Raoult terjadi apabila interaksi dalam masing – masing zat lebih kuat daripada antaraksi dalam campuran zat ( A – A, B – B > A – B)3.
Kondisi dimana larutan menghasilkan dua padatan ini disebut titik eutektik, yang hanya terjadi pada komposisi dan suhu tertentu. Pada titik eutektik terdapat tiga fasa, yaitu Bi padat, Cd padat dan larutan yang mengandung 40% Cd. Derajat kebebasan untuk titik ini adalah 0, sehingga titik eutektik adalah invarian. Eutektik bukan merupakan fasa, tetapi kondisi dimana terdapat campuran yang mengandung dua fasa padat yang berstruktur butiran halus.4.
Bila suatu cairan yang mengandung hanya satu komponen didinginkan, plot suhu terhadap waktu memiliki lereng yang hampir tetap5.
Jika pembentukan senyawa mengakibatkan terjadinya daerah maksimum pada diagram suhu – komposisi, maka disebut senyawa bertitik lebur sebangun (congruently melting compound).Daftar Pustaka
Atkins, P.W. 1999. Kimia Fisika Jilid I Edisi keempat. Jakarta: Erlangga
Chyul, ChyAy. 2010. Kesetimbangan Fasa Dua Komponen. Jakarta: UI Press.
Syukron, Ahmad. 2011. Fase, Komponen, dan Hukum Fase Gibbs. Bandung: Rineka Cipta.
Rohman, Ijang dan Sri Mulyani. 2004. Kimia Fisika 1. Jakarta: JICA.
Yoshito, Takeuchi. 2008. Kesetimbangan Fasa Dua Komponen.Jakarta: Erlangga.
http://www.chem-is-try.org/materi_kimia/kimia_dasar/cairan_dan_larutan/kesetimbangan-fasa-dan-diagram-fasa/