BAB 3
Perhitungan Perubahan Entalpi
3.1. Transisi Fasa
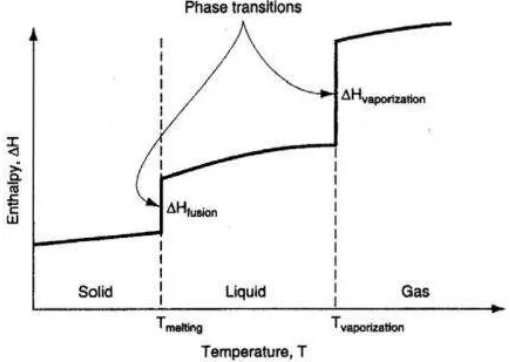
Transisi Fasa terjadi dari fasa padat menjadi fasa cair, dari fasa cair menjadi fasa gas, dan sebaliknya. Pada proses transisi ini terjadi perubahan entalpi (dan energi dalam) dimana terjadi pada temperature tetap yang disebut panas laten. Perubahan entalpi pada fasa yang sama disebut dengan panas sensible. Jenis-jenis panas laten :
a) Panas peleburan (Heat of Fusion) (∆Hfusion) Terjadi pada perubahan fasa dari padat ke cair b) Panas Pemadatan (Heat of Solidification)
Terjadi pada perubahan fasa dari cair ke padat c) Panas penguapan (Heat of Vaporization) (∆Hv)
Terjadi pada perubahan fasa dari cair ke gas d) Panas Kondensasi (Heat of Condentation) Terjadi pada perubahan fasa dari gas ke cair
Perubahan entalpi overall komponen murni ditunjukkan pada gambar 3.1
Perubahan entalpi masing-masing secara keseluruhan ditunjukkan pada persamaan 3.1
dT
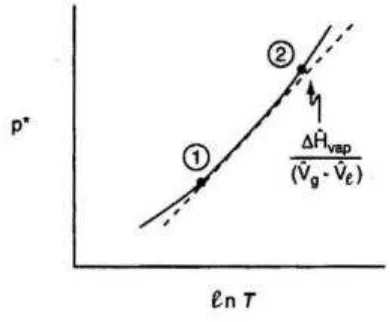
Persamaan-persamaan untuk mengestimasi Panas penguapan (Heat of Vaporization)
1. Persamaan Clapeyron
mengestimasi panas spesifik penguapan.
Gambar 3.2 Hv
terhubung langsung ke garis miring pada grafik
1. Vl
diabaikan jika dibandingkan dengan
V
g
2. Hukum pada gas ideal dapat diterapkan untuk
V
g
RT
/
p
*
Sehingga diperoleh persamaan 3.3
2
diasumsikan konstan pada range temperature tertentu maka persamaan 3.3 diintegralkan sehingga menjadi persamaan 3.4 yang disebut dengan PersamaanClausius-Clapeyron
2. Persamaan Chen
3. Persamaan Riedel
4. Persamaan Watson
Hv2
= Panas penguapan liquid murni pada suhu T2
Persamaan Watson digunakan untuk menentukan panas penguapan pada suhu tertentu dengan berdasar pada panas penguapan pada titik didih normal (pada 1 atm) yan telah diketahui
Contoh 3.1 Perhitungan panas penguapan menggunakan Persamaan Watson Hitung panas penguapan air pada 600 K jika diketahui properti air pada suhu 100 o
C adalah panas penguapan = 2256.1 kJ/kg, Tc air = 647.4 K
Penyelesaian :
Menggunakan persamaan 3.7
kg
kJ
H
H
H
H
V V
V V
/
1244
551
.
0
551
.
0
4
.
647
373
1
4
.
647
600
1
373 , 600
,
38 . 0
373 ,
600 ,
Contoh 3.2 Perbandingan perhitungan estimasi panas penguapan
Gunakan a) Persamaan Clausius-Clapeyron, b) Persamaan Chen, c) Persamaan Riedel untuk mengestimasi panas penguapan aseton pada titik didih normal dan bandingkan dengan nilai eksperimen yaitu 30.2 kJ/g mol yang terdaftar di Apendiks C buku Himmelblau edisi 7.
Penyelesaian :
Langkah penyelesaian 1) Basis 1 g mol
2) Mencari properti aseton di Apendiks D buku Himmelblau edisi 7 Titik didih normal : 392.2 K
Tc : 508.0 K
pc : 47.0 atm
3) Menghitung beberapa nilai variabel yang dibutuhkan pada persamaan estimasi
ln pc= ln (47.0)= 3.85
a) Menggunakan persamaan Clausius-Clapeyron
Dari persamaan 3.3 2
*
dan diferensiasi dari persamaan Antoine dT
Kombinasi 2 persamaan tersebut menjadi
2
Dari Apendiks G buku Himmelblau edisi 7 B = 2940.46, C = -35.93
Hasil perhitungan lebih rendah 1.9 % dari nilai eksperimen b) Persamaan Chen
Dari persamaan 3.5, maka
(lebih rendah 0.6% dari nilai eksperimen) c) Persamaan Riedel
Dari persamaan 3.6, maka
(lebih tinggi 0.09% dari nilai eksperimen) Soal !
2. Air sebanyak 315 g didinginkan pada 0 oC. Perubahan energi apa yang terjadi pada proses?
3. Seribu g air dalam fasa gas pada suhu 395 K. Berapa banyak energi yang dibutuhkan untuk mengkondensasikan semua air tersebut pada suhu 395 K?
3.2. Persamaan Kapasitas Panas
Perubahan entalpi pada komponen dalam satu fasa (bukan dalam fasa transisi) dapat dihitung dengan kapasitas panas seperti ditunjukkan pada persamaan 3.8.
dT
C
H
T
T p
2
1
(3.8)
Jika Cp konstan,
H
C
p
T
,
T
T
2
T
1 Pengertian kapasitas panas adalah sejumlah energi yang dibutuhkan untuk meningkatkan temperatur suatu zat sebanyak 1 derajat. Satuan kapasitas panas adalah (energi)/(perbedaan temperatur) (massa atau mol)
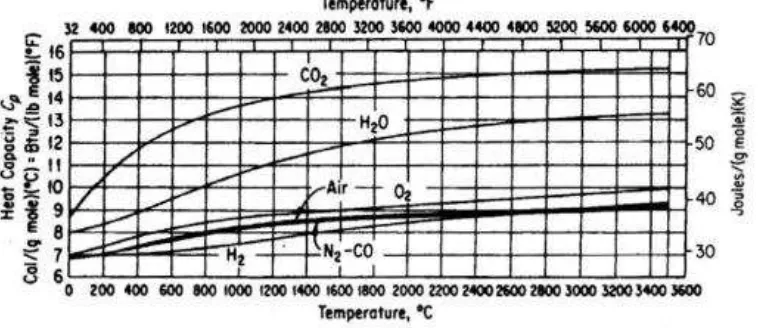
Untuk zat incompressible Cp = Cv. Cv tidak terlalu sering digunakan pada proses sehingga pada pembahasan ini akan difokuskan ke Cp. Grafik kapasitas panas untuk beberapa komponen pada berbagai temperatur ditunjukkan pada gambar 3.3.
Nilai kapasitas panas berubah terhadap suhu untuk padat, cair, dan gas nyata, tetapi fungsi temperatur yang kontinyu tersebut hanya tejadi pada wilayah transisi fasa
Untuk gas ideal, kapasitas panas pada tekanan konstan bernilai konstan meskipun temperatur berubah.
Tabel 3.1 Kapasitas Panas untuk Gas Ideal
Pada gas ideal, terdapat hubungan antara Cp dan Cv karena U dan H hanya merupakan fungsi temperatur :
RT U V p U H
RT V p
Diferensiasi nilai
Hterhadap temperatur,
RT C R dT
U d dT
H d
Cp v
(3.9)
Untuk Gas Ideal Campuran
p n
i i rata
rata
p
x
C
C
1
, (3.10)
Dimana xi fraksi mol komponen i.
2
cT
bT
a
C
p
(3.11)Sehingga persamaan perubahan entalpi dapat dituliskan pada persamaan 3.12 berikut : Contoh 3.3 Menghitung perubahan entalpi campuran gas menggunakan
persamaan kapasitas panas untuk masing-masing komponen
Konversi limbah padat menjadi gas yang tidak berbahaya dapat dilakukan dengan insenerator. Akan tetapi, gas panas yang keluar harus didinginkan atau dilarutkan ke udara. Komposisi limbah yang terbakar sebagai berikut :
CO2 9.2%
CO 1.5%
O2 7.3%
N2 82.0%
Total 100%
Berapa perubahan entalpi untuk gas ini per lb mol di antara bagian bawah dan atas cerobong asap jika suhu di bagian bawah adalah 550 oF dan suhu di bagian atas 200 oF.
Penyelesaian : Basis 1 lb mol gas
Persamaan kapasitas panas (T dalam oF, Cp = Btu/(lb mol) (oF)) dikalikan dengan kandungan masing-masing komponen dalam gas :
3
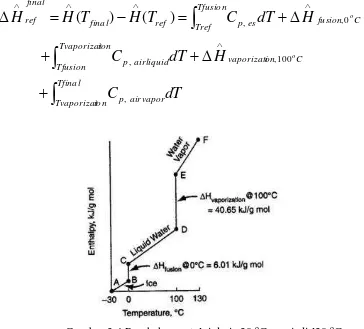
Perhitungan perubahan entalpi air dari suhu -30 oC menjadi l30 oC (gambar 3.4):
Tvaporizat p airvapor
C on vaporizati ion
Tvaporizat
Tfusion p airliquid
C
2. Entalpi suatu senyawa dapat diprediksi dengan rumus empiris 2
001
.
0
25
.
4
2
.
30
)
/
(
J
g
T
T
H
Dimana T dalam Kelvin, bagaimana hubungan kapasitas panas pada temperature konstan untuk senyawa tersebut?
3. Hitung perubahan entalpi dan energi dalam (J/g mol) yang terjadi saat N2 dipanaskan dari suhuh 30 oC menjadi 300 oC pada 1 atmosfer.
4. Uap air didinginkan dari 300 oF menjadi 0 oF. Gunakan kapasitas panas dan nilai transisi fasa untuk menghitung perubahan entalpi (dalam Btu/lb)
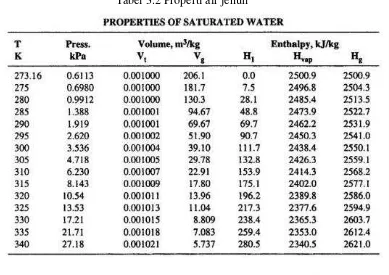
3.3. Tabel dan Grafik untuk Memperoleh Nilai Entalpi Tabel 3.2 Properti air jenuh
Berdasarkan tabel 3.2, maka untuk mendapatkan nilai entalpi pada suhu T = 307 K dilakukan interpolasi sebagai berikut
5
.
2557
)
305
307
(
305
310
1
.
2559
2
.
2568
1
.
2559
)
(
307 305305 310
305 307
305 307
H
H
H
H
H
H
H
H
Contoh 3.4 Perhitungan Perubahan Entalpi Gas Menggunakan nilai Entalpi dari data Tabel
Hitung perubahan entalpi untuk 1 kg mol gas N2 yang dipanaskan pada temperature konstan pada 100 kPa dari 18 oC menjadi 1100 oC
Penyelesaian :
100 kPa bernilai 1 atm, maka dapat digunakan tabel di Appendiks D6 (Himellblau Edisi 7) untuk menghituhng perubahan entalpi
Pada 1100 oC (1373 K) :
H = 34.715 kJ/kg mol (dengan interpolasi) Pada 18 oC (291 K) :
H= 0.524 kJ/kg mol Basis 1 kg N2
H = 34.715 – 0.524 = 34.191 kJ/kg mol
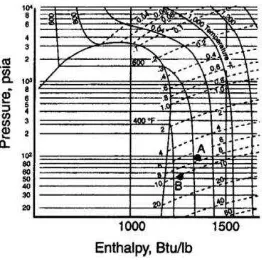
Contoh 3.5 Penggunaan steam table untuk menghitung perubahan entalpi
Steam didinginkan dari 640 oF pada 92 psia menjadi 480 oF pada 52 psia. Berapa
Hdalam Btu/lb? Penyelesaian
Perubahan
H yang terjadi pada soal ditunjukkan dari bagian A menjadi bagian B
seperti ditunjukkan pada gambar C3.1
Interpolasi dilakukan 2 kali untuk titik A dan B: 1.
Hdiinterpolasi antar tekanan pada temperature yang fixed 2.
Hdiinterpolasi antar temperatur pada tekanan yang fixed (yang telah diinterpolasi)
Pada steam tabel, setelah diinterpolasi
Hpada 600 oF pada 92 psia adalah 1328.6, berikut contoh interpolasinya
2/5 (1328.7 – 1328.4) = 0.4 (0.3) = 0.12 Pada p = 92 psia dan T = 600 oF,
H= 1328.7 – 0.12 = 1328.6 Perubahan entalpi yang terjadi pada soal adalah
H=1272.8 – 1348.4 = -75.6 Btu/lb
Contoh 3.6 Penggunaan steam table saat perubahan fasa telibat untuk menghitung kondisi akhir dari air.
Empat kg air pada suhu 27 oC dan 200 kPa dipanaskan pada tekanan konstan sampai dengan volume air menjadi 1000 kali lebih besar dari volume awal. Berapa suhu akhir air tersebut?
Penyelesaian :
Spesifik volume air pada 300 K = 0.001004 m3/kg, sehingga spesifik volume akhir = 0.001004 (1000) = 1.004 m3/kg.
Pada 200 kPa, interpolasi dilakukan antara suhu 400 K (V = 0.9024 m3) dan suhu 450 K (V = 1.025 m3) dimana range tersebut adalah range diantara nilai 1.004 m3/kg. Sehingga nilai T dapat ditentukan dengan interpolasi linear sebagai berikut
K
T
kg
m
K
T
K
kg
m
kg
m
441
5
.
2557
41
430
/
004
.
1
)
400
(
)
400
450
(
/
)
9024
.
0
025
.
1
(
/
9024
.
0
33 3
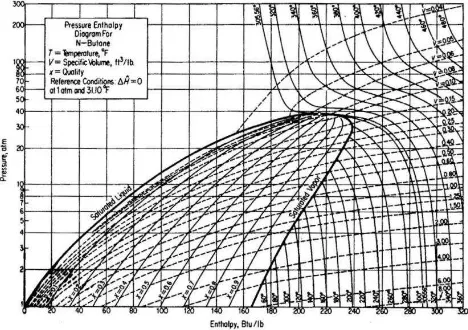
Gambar 3.5 Diagram tekanan-entalpi n-butana, garis titik-titik merupakan garis spsesifik volume, garis dengan suhu oF merupakan garis pada suhu tetap
Hitung H V T
,
, pada uap jenuh n-butana 1 lb dari 2 atm menjadi 20 atm (saturated)
Penyelesaian : Data dari gambar 3.5
Soal !
1. Berapa perubahan entalpi yang dibutuhkan untuk mengubah 3 lb air dari 32 oF, 60 psia menjadi steam pada 1 atm, 300 oF
2. Berapa perubahan entalpi yang dibutuhkan untuk mengubah campuran 1 lb air-steam dengan kualitas steam 60% menjadi kualitas 80%jika suhu campuran tersebut adalah 300 oF
3. Berapa perbuahan entalpi yan terjadi saat 1 kg air berubah dari 200 kPa dan 600 K menjadi 1000 kPa dan 400 K? Hitung juga untuk energi dalam. 4. Hitung
Huntuk 1 g mol gas NO2 dimana suhunya berubah dari 300 K menjadi 1000 K.