BIOSORPSI ION Ni(II) DAN Cr(VI) OLEH AMPAS SAGU
Paulina Taba*, Nursiah La Nafie, St. Fauziah, Mildayati and MaryamJurusan Kimia FMIPA Universitas Hasanuddin
*E-mail: ultita@yahoo.com.au
Diterima 17 November 2009, disetujui untuk diterbitkan 2 Desember 2009
ABSTRACT
The presence of heavy metal ions such as N(II) and Cr(VI) in the water environment could be dangerous to human health, thus the attempts to remove these metal ions are needed. Biosorption is an alternative method to remove these contaminants using biomaterial. In this research, the removal of Ni(II) and Cr(VI) ions was done using the dregs of industrial sago as a function of time, pH and solution initial concentration. The result showed that the biosorption equilibrium of Ni (II) and Cr(VI) ions was reached after 15 and 120 minutes, respectively. The biosorption of these metal ions followed the pseudo-second order rate constant with k2 values of 0.56 and 0.05 g min.-1 mg-1 for Ni(II) and Cr(VI) ions, respectively. The optimum pH
of the biosorption of these ions was 5 and 2 for Ni(II) and Cr(VI) ions, respectively. The biosorption of these two ions followed Langmuir isothermal with biosorption capacity of 11.01 and 3.05 mg/g for Ni(II) and Cr(VI) ions, respectively. Based on the analysis with FTIR, the functional group involved in the interaction was the hydroxyl group. The best desorption reagent to take the metal ions back after been adsorpted was EDTA 0.1 M for Ni(II) ion and NaHCO3 0.1 M for Cr(VI) ion.
Keywords: sago dregs, biosorption, Ni(II), Cr(VI), desorption 1. PENDAHULUAN
Kebanyakan ion logam sebagai unsur-unsur renik sangat esensial, tetapi dalam jumlah yang berlebihan dapat bersifat toksik. Pencemaran lingkungan oleh logam-logam berat memberi masalah serius dalam hal akumulasinya pada rantai makanan serta kelanjutan persistensinya dalam ekosistem1).Meningkatnya kebutuhan hidup pada produk teknologi yang mengandung logam berat memicu
bertambahnya beban lingkungan. Nikel dan kromium merupakan contoh logam yang banyak digunakan dalam teknologi modern. Nikel (Ni) dihasilkan sebagai buangan industri penyepuhan, elektronik dan pembersihan logam. Keberadaan ion logam ini di atas nilai kritis dapat menimbulkan berbagai gangguan kesehatan baik kronis maupun akut seperti beberapa kerusakan paru-paru dan ginjal, gastrointestinal distress, fibrosis pulmoneri dan edema renal serta dermatitis kulit2). Kromium pada konsentrai rendah dapat
menyebabkan iritasi kulit bahkan luka borok, sedangkan pada level yang lebih tinggi dapat menyebabkan gangguan ginjal dan hati3). Kromium valensi enam atau Cr(VI) bahkan diakui bersifat karsinogen terhadap
manusia melalui pernapasan4). Karena logam-logam tersebut dapat terakumulasi dalam rantai makanan dan
tidak dapat terdegradasi secara biologis, perhatian yang serius telah dilakukan untuk menemukan metode yang efektif dan efisien untuk menghilangkannya dari air limbah industri.
Penghilangan ion-ion logam berat dari limbah industri telah dilakukan sejak beberapa dekade tetapi efektivitasnya, terutama dalam hal biaya dari proses fisiko-kimia masih terbatas. Biomaterial yang relatif murah telah menunjukkan potensinya dalam menghilangkan ion-ion tersebut. Biomassa limbah seperti batang gandum digunakan untuk menghilangkan nikel dari efluen industri penyepuhan5). Adsorpsi oleh karbon aktif
yang dibuat dari biji apricot digunakan oleh Kobya et al.6) untuk menghilangkan ion-ion Ni(II), Co(II), Cd(II),
Cu(II), Pb(II), Cr(III) dan Cr(VI) dari larutannya. Kapasitas pengambilan logam-logam yang berbeda oleh fitomassa Quercus ilex (akar, batang dan daun) adalah, Ni > Cd > Pb > Cu > Cr (akar), Ni > Pb > Cu > Cd > Cr (batang), Ni . Cd > Cu > Pb > Cr (daun). Peneliti lain telah melaporkan penggunaan abu terbang Bagasse yang merupakan limbah industri gula sebagai adsorben ion Cr(VI) dari limbah penyepuhan.Ampas sagu merupakan biomaterial yang dihasilkan dari pembuatan sagu. Biomaterial ini umumnya dibuang ke sungai yang berada di sekitar industri pembuatan sagu sehingga dapat menimbulkan masalah lingkungan dan pendangkalan sungai. Limbah ini mengandung zat yang tidak larut dalam air seperti protein, lemak, dan karbohidrat7). Senyawa-senyawa yang ada dalam ampas sagu mengandung gugus-gugus seperti –NH2, -OH
yang dapat berikatan dengan ion logam berat membentuk senyawa kompleks. Hal ini menunjukkan bahwa ampas sagu mempunyai potensi yang besar untuk dijadikan sebagai biosorben logam berat sehingga dalam penelitian ini, ampas sagu digunakan untuk biosorpsi ion Ni(II0 dan Cr(VI).Penelitian ini dapat memberikan
informasi tentang kondisi optimum dan kapasitas biosorpsi dari ampas sagu terhadap ion-ion Ni(II) and Cr(VI). Data yang diperoleh dapat dijadikan dasar pertimbangan dalam pengolahan air buangan yang terkontaminasi oleh ion logam berat.
2. METODE PENELITIAN
2.1. Penyiapan Biosorben Ampas Sagu
Ampas sagu diambil dari pabrik pembuatan sagu dan dikeringkan. Ampas sagu kering kemudian diayak dan partikel dengan ukuran 100 – 230 mesh digunakan dalam penelitian ini.
2.2. Penentuan Waktu Optimum Biosorpsi Ion Ni(II) dan Cr(VI) oleh Ampas Sagu
Larutan Ni(II) dan Cr(VI) dengan konsentrasi 10 ppm disiapkan. pH larutan diatur pada pH 5 untuk ion Ni(II), dan pH 2 untuk ion Cr(VI). Ke dalam tiap-tiap 100 mL larutan ion logam ditambahkan 1 g ampas sagu. Tiap-tiap campuran dikocok dengan stirer magnet selama 2 menit dan disaring dengan kertas saring Whatman 42. Absorbansi filtrat diukur dengan SSA pada panjang gelombang maksimum. Percobaan kemudian diulangi dengan variasi waktu pengocokan (2, 4, 6, 8, 10, 12, 15, 20, 30, 40, 50, 60, 90, dan 120 menit). Setiap percobaan dilakukan 3 kali pengulangan.
Konsentrasi yang diserap untuk tiap waktu dihitung dari Persamaan (1):
Cadsorpsi= (Cawal – Cakhir) (1)
Banyaknya ion-ion logam yang teradsorpsi (mg) per gram biosorben (ampas sagu) ditentukan menggunakan Persamaan (2): a e o W V ) C (C qe = − (2)
dengan qe = jumlah ion logam yang teradsorpsi (mg/g), Co = konsentrasi ion logam sebelum adsorpsi, Ce =
konsentrasi ion logam setelah adsorpsi, V = volume larutan ion logam (L) dan Wa = jumlah biosorben (g)
Kinetika biosorpsi dapat dipelajari dengan persamaan orde satu semu. Persamaan diferensial orde satu semu (3) adalah sebagai berikut :
) q -(q k dt dq t e 1 t = (3)
dengan qe dan qt berturut-turut merupakan jumlah ion logam yang diadsorpsi (mg/g) pada kesetimbangan dan
pada waktu tertentu, t (menit), k1 merupakan tetapan laju orde satu semu (menit-1). Hasil integrasi
memberikan Persamaan (4): log t e e q q q − = 2,303 k1 t (4)
yang merupakan laju orde satu semu. Persamaan (4) ini dapat ditulis sebagai Persamaan (5): log
(
qe−qt)
= log qe -2,303
k1 t (5)
nilai-nilai tetapan laju, (k1), jumlah ion yang diadsorpsi pada keadaan setimbang, (qe), koefisien korelasi, (R2),
dihitung dari plot log (qe – qt) versus t.
Data kinetika juga dapat diolah dengan model kinetika orde dua semu. Persamaan diferensial (6) adalah sebagai berikut :
dt
dqt= k
2
(
qe−qt)
2 (6)dengan k2 adalah tetapan laju orde dua semu (g mg-1 min-1).
Integrasi Persamaan (6) menghasilkan :Persamaan (7) t e q q 1 − = qe 1 + k2 t (7)
Persamaan (7) ini dapat dituliskan dalam bentuk linier sebagai berikut (Persamaan 7):
t q 1 q k 1 q t e 2 e 2 e + = (7)
Jika kinetika orde dua semu dipenuhi, plot t/qt versus t akan menghasilkan garis lurus.
2.3. Penentuan pH Optimum Biosorpsi Ion Ni(II) dan Cr(VI) oleh Ampas Sagu
Ke dalam 100 mL larutan ion Ni(II) dan Cr(VI) dengan konsentrasi 10 ppm dan pH 2 ditambahkan 1 g ampas sagu. Campuran dikocok selama waktu optimum pada suhu kamar dan disaring dengan kertas saring Whatman 42. Absorbansi filtrat diukur dengan Spektrofotometer UV-Vis.
Percobaan di atas diulangi pada pH yang berbeda masing-masing 3, 4, 5, 6, 7, dan 8. Setiap percobaan dilakukan 3 kali pengulangan. Percobaan kontrol dilakukan dengan cara yang sama kecuali tanpa biosorben dan tanpa pengadukan.
2.4. Penentuan Kapasitas Biosorpsi Ion Ni(II) dan Cr(VI) oleh Ampas Sagu
Larutan ion Ni(II) dan Cr(VI) dengan konsentrasi 10, 20, 30, 40, 50, 75, 100, 150, dan 200 ppm disiapkan pada pH optimum. Ke dalam tiap-tiap 100 mL larutan tersebut ditambahkan 1 g ampas sagu. Tiap-tiap campuran dikocok selama waktu optimum pada pH optimum. Tiap-tiap campuran disaring dengan kertas saring Whatman 42. Absorbansi tiap-tiap filtrat diukur dengan SSA. Setiap percobaan dilakukan 3 kali pengulangan. Percobaan kontrol dilakukan dengan cara yang sama kecuali tanpa biosorben dan tanpa pengadukan.
Kapasitas biosorpsi dihitung dari persamaan Freundlich [log (x/m) = log k + 1/n (log C)] atau persamaan Langmuir (Ce/qe = 1/Qob + Ce/Qo) dengan mengalurkan log (x/m) terhadap log C untuk persamaan
Freundlich atau Ce/Qe terhadap Ce untuk persamaan Langmuir. Dari intercept persamaan Freundlich
diperoleh nilai k (kapasitas adsorpsi) dan dari slope persamaan Langmuir dapat diperoleh nilai Qo yang
berhubungan dengan kapasitas biosorpsi.
2.5. Penentuan Agen pengdesorpsi yang paling baik untuk menarik kembali Ion Ni(II) dan Cr(VI) dari Ampas Sagu
Untuk percobaan desorpsi, larutan asam mineral (HCl, HNO3 dan H2SO4), etilendiamin tetra asam
asetat (EDTA), natrium karbonat, natrium bikarbonat, natrium sitrat dan kalium klorida pada konsentrasi 0,1 M digunakan untuk mencari zat pengdesorpsi yang efektif. Ampas sagu (1 g) yang telah direndam dengan 100 mL ion Cd(II), Cu(II), Ni(II) dan Cr(VI) 10 mg L-1 dimasukkan ke dalam 10 mL zat pengdesorpsi. Campuran
diaduk dengan stirer (100 rpm) selama 30 menit lalu disaring. Kandungan ion Ni(II) dan Cr(VI) dalam larutan ditentukan dengan menggunakan Spektrofotometer Serapan Atom (SSA).
3. HASIL DAN PEMBAHASAN
3.1. Waktu Optimum Biosorpsi ion Ni(II) dan Cr(VI)
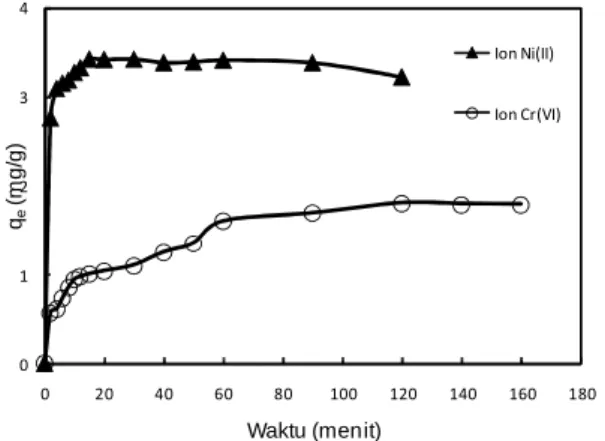
Pengaruh waktu terhadap jumlah ion yang diadsorpsi diperlihatkan pada Gambar 1. Gambar 1 menunjukkan bahwa dengan bertambahnya waktu, jumlah ion yang diadsorpsi bertambah hingga tercapai kesetimbangan dimana jumlah ion yang diadsorpsi cenderung tetap karena permukaan biosorben telah jenuh oleh ion-ion. Waktu dimana tercapai kesetimbangan (waktu optimum) biosorpsi ion Ni(II) dan Cr(VI) berturut-turut adalah 15 dan 120 menit.
Untuk mengetahui model kinetika biosorpsi ion Ni(II) dan Cr(VI), persamaan orde satu semu dan orde dua semu digunakan. Dengan membandingkan nilai garis kuadrat terkecil, maka dibakukan pola adsorpsi yang sesuai. Model kinetika biosorpsi berdasarkan persamaan orde satu semu dan orde dua semu dapat dilihat pada Gambar 2 dan Gambar 3.
0 1 2 3 4 0 20 40 60 80 100 120 140 160 180 qe (m g /g ) Waktu (menit) Ion Ni(II) Ion Cr(VI)
Gambar 1. Pengaruh waktu terhadap jumlah ion Ni(II) dan Cr(VI) yang diadsorpsi oleh ampas sagu Nilai R2, k
1 (tetapan kinetika orde satu semu), k2 (tetapan kinetika orde dua semu), dan qe hasil
perhitungan dan hasil eksperimen ditunjukkan pada Tabel 1.
Nilai kuadrat terkecil (R2) untuk model kinetika orde satu semu dan orde dua semu untuk biosorpsi
-1.2 -0.8 -0.4 0 2 4 6 8 10 12 a) y = -0,0747x -0.0920 R2 = 0,958 Waktu (menit) lo g ( qe qt ) -1.2 -0.8 -0.4 0 0.4 0 20 40 60 80 100 b) y = - 0,0118 x + 0,1360 R2 = 0,921 Waktu (menit) lo g ( qe qt )
Gambar 2. Kinetika orde satu semu untuk biosorpsi ion a) Ni(II), dan b) Cr(VI) oleh ampas sagu.
0 1 2 3 4 2 4 6 8 10 12 a) y = + 0,291 x +0,145 R2 = 0,999 Waktu (menit) t/ qe ( m e n it g m g -1 ) 0 15 30 45 60 75 0 20 40 60 80 100 b) y = + 0.5650 x + 5,7900 R2 = 0,972 Waktu (menit) t/ qe ( m e n it g m g -1 )
Gambar 3. Kinetika orde dua semu untuk biosorpsi ion a) Ni(II), dan b) Cr(VI) oleh ampas sagu. Tabel 1. Nilai R2, k
1, k2, qe hasil perhitungan dan hasil penelitian untuk biosorpsi ion Ni(II) dan Cr(VI) oleh
ampas sagu Ion R2 q e k1 k2 Orde 1 Orde 2 Hitung (orde 1) Hitung (orde 2) Eksp Ni(II) 0,958 0,9996 0,81 3,45 3,42 0,17 0,56 Cr(VI) 0,921 0,9720 1,24 1,77 1,80 0,03 0,05
satu semu untuk biosorpsi ion Ni(II); dan Cr(VI) berturut-turut adalah 0,81; dan 1,24 mg g-1 sedangkan nilai qe
yang dihitung berdasarkan kinetika orde dua semu berturut-turut untuk biosorpsi ion-ion tersebut adalah 3,45; dan 1,77 mg g-1. Hal ini menunjukkan bahwa nilai qe yang diperoleh dari model kinetika orde satu semu tidak
sesuai dengan nilai eksperimen, sedangkan nilai qe yang dihitung dari persamaan kinetika orde dua semu
hampir sama dengan nilai qe eksperimen yang nilainya berturut-turut adalah 3,42; dan 1,80 mg/g untuk
biosorpsi ion Ni(II); dan Cr(II). Data ini menyatakan bahwa biosorpsi kedua ion oleh ampas sagu mengikuti model kinetika orde dua semu dengan nilai tetapan laju biosorpsi (k2) berturut-turut adalah 0,56; dan 0,05 g
menit-1 mg-1 untuk biosorpsi ion Ni(II); dan Cr(VI).
3.2. pH Optimum Biosorpsi ion Ni(II) dan Cr(VI)
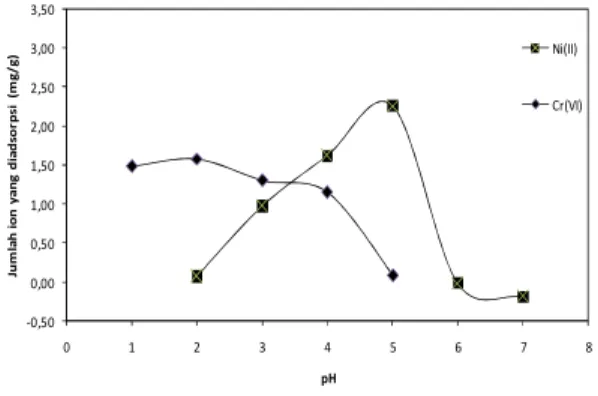
Jumlah ion yang diadsorpsi sebagai fungsi pH awal larutan diberikan pada Gambar 4. Rendahnya jumlah ion Ni(II) yang diadsorpsi pada pH rendah dapat dijelaskan oleh kenyataan bahwa pada pH yang rendah, konsentrasi ion H+ tinggi sehingga proton dapat berkompetisi dengan ion Ni(II) untuk berinteraksi
dengan pusat aktif permukaan karena pada pH rendah ion logam berada dalam larutan sebagai kation Ni2+
Dengan kata lain, pada pH rendah, permukaan biosorben ditutupi dengan ion-Ion H+ yang mencegah ion-ion
Ni(II) untuk mendekati permukaan biosorben tersebut karena adanya gaya tolak. Selain itu, ion-ion logam dalam larutan terlebih dahulu mengalami hidrolisis sebelum teradsorpsi oleh biosorben dan menghasilkan proton sesuai Persamaan reaksi (8) :
Mn+ + m H
-0,50 0,00 0,50 1,00 1,50 2,00 2,50 3,00 3,50 0 1 2 3 4 5 6 7 8 Ju m la h i o n y a n g d ia d so r p s i (m g / g ) pH Ni(II) Cr(VI)
Gambar 4. Pengaruh pH pada biosorpsi ion Ni(II) dan Cr(VI)
Kompleks hidrokso, [M(OH)mn-m]+, yang dihasilkan dari reaksi tersebut akan lebih mudah teradsorpsi
dibandingkan kation logam bebas (Mn+)8). Pada kondisi asam, persamaan di atas akan bergeser ke kiri
sehingga jumlah kompleks hidrokso logam yang terbentuk sedikit dan jumlah kation logam bebas bertambah. Pada kondisi asam, permukaan biosorben juga bermuatan positif sehingga tolakan antara permukaan biosorben dengan ion logam akan terjadi yang mengakibatkan rendahnya jumlah yang diadsorpsi.
Dengan bertambahnya pH, konsentrasi ion H+ berkurang dan permukaan biosorben menjadi lebih
negatif sehingga ion Ni(II) akan lebih mudah diadsorpsi. Pada pH yang lebih tinggi, jumlah ion Ni(II) yang diadsorpsi cenderung lebih rendah. Menurut Malkoc and Nuhoglu9), penurunan jumlah ion yang diadsorpsi
pada pH yang lebih tinggi disebabkan oleh terbentuknya kompleks hidroksil yang larut seperti Ni(OH4)2- yang
ditolak oleh permukaan biosorben yang bermuatan negatif sehingga jumlah ion yang diserap menjadi lebih kecil. Selain itu, pada pH yang lebih tinggi (mulai pH 6 untuk ion Ni(II), jumlah ion yang terdapat dalam larutan rendah karena sebagian dari ion-ion tersebut mengendap sehingga jumlah ion yang diadsorpsi menurun. Data pada Gambar 5 menunjukkan bahwa pH optimum untuk biosorpsi ion Ni(II) adalah 5. Beberapa peneliti melaporkan pH optimum yang sama untuk biosorpsi ion Ni(II) dengan menggunakan biosorben yang berbeda10, 11). Menurut Wilde et al.12) pH optimum untuk penghilangan ion logam tidak dapat diprediksi dan
sangat bergantung pada spesies tanaman yang digunakan dan kondisi yang lain.
Untuk biosorpsi ion Cr(VI), jumlah ion yang diadsorpsi pada pH 1 adalah 1,48 mg g-1. Pada pH 2,
jumlah ion yang diadsorpsi meningkat menjadi 1,58 mg g-1. Pada pH yang lebih tinggi, jumlah ion yang
diadsorpsi menurun. Jadi pH optimum untuk biosorpsi ion Cr(VI) oleh ampas sagu terjadi pada pH 2. Tewari
et al.13) juga melaporkan bahwa pH 2 merupakan pH optimum untuk biosorpsi ion Cr(VI). Peneliti-peneliti
sebelumnya 14 – 16) juga menggunakan pH optimum yang sama. Cr(VI) berada dalam bentuk anion kompleks
(Cr2O7=) sehingga pada pH rendah akan diadsorpsi lebih banyak. Pada pH rendah permukaan biosorben
bermuatan positif sehingga ion Cr2O7= akan lebih mudah berinteraksi dengan permukaan biosorben.
Sebaliknya dengan naiknya pH, ion OH- yang ada dalam larutan bertambah dan muatan total permukaan
biosorben menjadi negatif sehingga biosorpsi ion Cr(VI) seperti Cr2O7= berkurang karena ditolak oleh
permukaan biosorben yang negatif.
0 2 4 6 8 10 12 0 50 100 150 200 250 qe (m g / g ) Ce(mg/L) Ion Ni(II) ion Cr(VI)
Gambar 5. Isotermal biosorpsi ion Ni(II) dan Cr(VI) oleh ampas sagu 3.3. Kapasitas adsorpsi ion Ni(II) dan Cr(VI)
Hubungan antara jumlah ion yang diadsorpsi (qe) dan konsentrasi kesetimbangan (Ce) diberikan
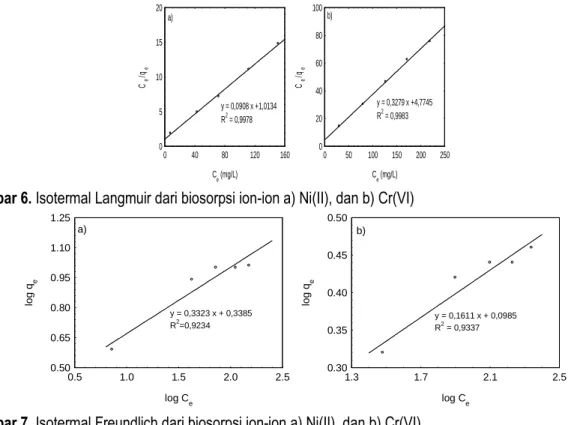
logam tersebut yang diadsorpsi. Tetapi kenaikan jumlah ion yang diadsorpsi menurun pada konsentrasi awal yang lebih tinggi. Untuk menentukan kapasitas biosorpsinya, isotermal adsorpsi Langmuir dan Freundlich digunakan yang ditunjukkan pada Gambar 6 dan 7.
Gambar 6 dan 7 menunjukkan bahwa biosorpsi ion Ni(II) dan Cr(VI) lebih memenuhi Isotermal Langmuir yang menyatakan bahwa biosorpsi ion-ion tersebut cenderung satu lapisan. Nilai kapasitas biosorpsi untuk ion-ion tersebut berturut-turut adalah 11,01 dan 3,05 mg/g yang menunjukkan bahwa jumlah ion Ni(II) yang diadsorpsi oleh ampas sagu > jumlah ion Cr(VI).
0 5 10 15 20 0 40 80 120 160 a) y = 0,0908 x +1,0134 R2 = 0,9978 C e (mg/L) Ce /qe 0 20 40 60 80 100 0 50 100 150 200 250 b) y = 0,3279 x +4,7745 R2 = 0,9983 C e (mg/L) Ce /qe
Gambar 6. Isotermal Langmuir dari biosorpsi ion-ion a) Ni(II), dan b) Cr(VI)
0.50 0.65 0.80 0.95 1.10 1.25 0.5 1.0 1.5 2.0 2.5 a) y = 0,3323 x + 0,3385 R2=0,9234 log Ce lo g qe 0.30 0.35 0.40 0.45 0.50 1.3 1.7 2.1 2.5 b) y = 0,1611 x + 0,0985 R2 = 0,9337 log Ce lo g qe
Gambar 7. Isotermal Freundlich dari biosorpsi ion-ion a) Ni(II), dan b) Cr(VI) 3.4. Karekterisasi Biosorben sebelum dan sesudah Biosorpsi
Gambar 8 menunjukkan spektra FTIR dari ampas sagu sebelum biosorpsi dan setelah biosorpsi ion-ion Ni)II), dan Cr(VI).
Gambar 8. Spektra FTIR ampas sagu a) sebelum biosorpsi, dan setelah biosorpsi dengan b) ion Ni(II) dan b) ion Cr(VI)
Hasil karakterisasi dengan FTIR menunjukkan bahwa puncak-puncak serapan yang terdapat dalam ampas sagu sebelum biosorpsi hampir sama dengan puncak-puncak yang terdapat setelah biosorpsi kecuali
puncak pada 3373,50 cm-1 (-O-H ulur) mengalami pergeseran ke arah bilangan gelombang yang lebih besar
dengan pergeseran sebesar 19 – 25 cm-1 setelah biosorpsi ion Ni)II), dan Cr(VI) yang menunjukkan bahwa
interaksi terjadi antara gugus hidroksil dan ion-ion logam tersebut. 3.5. Desorpsi Ion-ion Ni(II) dan Cr(VI) dari Ampas Tahu
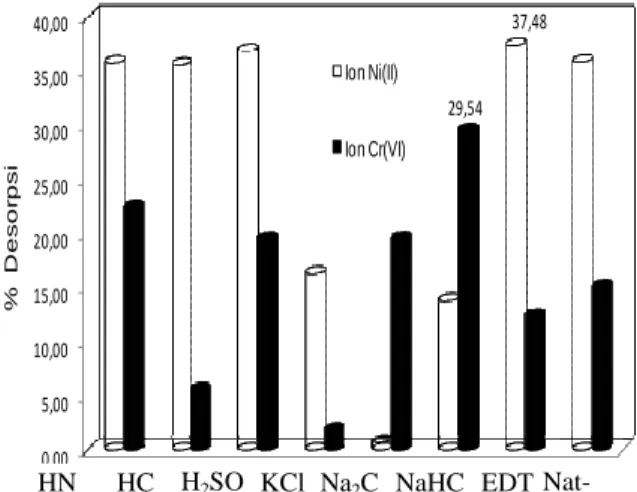
Desorpsi ion Ni(II) dan Cr(VI) dengan menggunakan berbagai agen pendesorpsi diberikan pada Gambar 9. 0,00 5,00 10,00 15,00 20,00 25,00 30,00 35,00 40,00 37,48 29,54 % D e s o rp s i Ion Ni(II) Ion Cr(VI)
Gambar 9. Desorpsi ion Ni(II) dan Cr(VI) dengan berbagai agen pengdesorpsi
Hasil menunjukkan bahwa agen pengdesorpsi yang paling baik untuk menarik kembali ion dari biosorben adalah EDTA 0,1 M untuk ion Ni(II) dan NaHCO3 0,1 M untuk ion Cr(VI). Gambar 9 juga
memberikan petunjuk bahwa ion Ni(II) yang dapat ditarik kembali dengan satu kali desorpsi (EDTA 0,1 M) adalah 37,48 %, sedangkan ion Cr(VI) yang dapat ditarik kembali dengan satu kali desorpsi (NaHCO3 0,1 M)
adalah 29,54 %. Hal ini menunjukkan bahwa untuk menarik kembali ion-ion yang telah diadsorpsi perlu dilakukan proses desorpsi beberapa kali.
4. KESIMPULAN DAN SARAN 4.1. Kesimpulan
Berdasarkan penelitian yang telah dilakukan, kesimpulan yang dapat diambil adalah sebagai berikut: biosorpsi ion-ion Ni(II) dan Cr(VI) mencapai kesetimbangan dalam waktu yang cepat (15 menit untuk ion Ni(II) dan 120 menit untuk ion Cr(VI). Biosorpsi ion-ion Ni(II) dan Cr(VI) mengikuti model kinetika orde dua semu dengan laju biosorpsi (k2) berturut-turut 0,56 dan 0,05 g menit-1 mg-1. pH optimum yang digunakan dalam
penentuan kapasitas biosorpsi untuk ion Ni(II) dan Cr(VI) berturut-turut adalah 5 dan 2. Biosorpsi ion-ion yang digunakan dalam penelitian memenuhi persamaan Langmuir dengan nilai Qo (kapasitas biosorpsi) ion
Ni(II) dan Cr(VI) berturut-turut adalah 11,01 dan 3,05 mg/g. Gugus fungsi yang terdapat dalam ampas sagu yang terlibat dalam biosorpsi adalah gugus hidroksil. Agen pengdesorpsi yang paling baik untuk desorpsi ion Ni(II) dan Cr(VI) berturut-turut adalah EDTA 0,1 M dengan persentasi desorpsi 37,48 % dan NaHCO3 0,1 M
dengan persentasi desorpsi 29,54 %. 4.2. Saran
Karena jumlah ion yang dapat ditarik kembali dengan satu kali desorpsi masih rendah, penelitian desorpsi perlu diteliti lebih lanjut dengan melakukan desorpsi beberapa kali.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Universitas Hasanuddin yang telah memberikan Hibah Strategi Nasional melalui dana DIPA Unhas dan kepada Laboratorium Kimia Analitik dan Kimia Fisika Universitas Hasanuddin yang telah membantu dalam pelaksanaan penelitian ini.
DAFTAR PUSTAKA
1. Volesky, B., and Holan, Z.R. 1995. Biosorption of Heavy Metals, Biotechnol Prog., 11: 235–250.
Nat-2. Akthar, M.N., Sastry, K.S., Mohan, P.M. 1996. Mechanism of metal ion Biosorption by fungal biomass.
Biometals., 9: 21–28.
3. Kiliç, E., 2007, Heavy Metals Pollution in Water. (Online), (http://www.tip2000.com/health/waterpollution.asp, diakses 23 Juni 2007).
4. Wikipedia. 2007. hexavalent chromium, (Online), (http://en.wikipedia.org/wiki/ Hexavalent_chromium, diakses 23 Juni 2007).
5. Verma, B. and Shukla, N.P. 2000. Removal of Nickel(II) from Electroplating Industry by Agrowaste Carbons. Indian J. Environ. Health., 42: 145–150.
6. Kobya, M., Demirbas, E., Senturk, E., Ince, M. 2005. Adsorption of Heavy Metal Ions from Aqueous Solution by Activated Carbon Prepared from Apricot Stone. Bioresour. Technol., 96: 1518–1521. 7. Haryanto, B. and Pangloli, P. 1992. Potensi dan Pemanfaatan Sagu, Kanisius, Yogyakarta.
8. Sembiring, Z., Buhani, Suharso dan Sumadi. 2009. Isoterm Adsorpsi ion Pb(II), Cu(II) dan Cd(II) pada Biomassa Nannochloropsis sp yang Dienkapsulasi Akuagel Silika. Indo. J. Chem., 9(1): 1 – 5.
9. Malkoc, E. and Nuhoglu, Y. 2005. Investigations of nickel(II) removal from aqueous solutions using tea factory waste. Hazardous Mater., B127: 120–128.
10. Amini, M., Younesi, H., dan Bahramifar, N. 2008. Biosorption of nickel(II) from aqueous solution by Aspergillus niger: Response surface methodology and isotherm study. Chemosphere. 75: 1483–149. 11. Lesage, E., Mundiaa, C., Rousseaub, D.P.L., Moortela, A.M.K.V., Lainga, G.D., Meersa, E., Tacka,
F.M.G., Pauwc, N.D., Verloo, M.G. 2006. Sorption of Co, Cu, Ni and Zn from industrial effluents by the submerged aquatic macrophyte Myriophyllum spicatum L. Ecol. Eng., 30: 320–325.
12. Wilde, E., and Bedemann, J. R. 1993. Bioremoval of Heavy Metals by the Use of Microalgae, Biotech.
Adv., 11: 781 – 812.
13. Tewari, N., Vasudevan, P. and Guha, B. K. 2005. Study on Biosorption of Cr(VI) by Mucor hiemalis.
Biochem. Eng. J., 23: 185 – 192.
14. Bai, R.S., and Abraham, T.E. 2001. Biosorption of Cr(VI) from aqueous solution by Rhizopus nigricans,
Bioresour. Technol., 79: 73–81.
15. Donmez, G.C., Aksu, Z., Ozturk, A. and Kutsal, T. 1999. A comparative study on heavy metal biosorption characteristics of some algae, Process. Biochem., 34: 885–892.
16. Prakasham, R.S., Merrie, J.S., Sheela, R., Saswathi, N. and Ramakrishna, S.V. 1999. Biosorption of chromium(VI) by free and immobilized Rhizopus arrhizus. Environ. Pollut., 104: 421–427