KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
SKRIPSI
diajukan untuk memenuhi sebagian syarat untuk memperoleh gelar Sarjana Sains Program
Studi Biologi Departemen Pendidikan Biologi
oleh:
Hestiarahma Purnamasari
NIM 1101713
PROGRAM STUDI BIOLOGI DEPARTEMEN PENDIDIKAN BIOLOGI
FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS PENDIDIKAN INDONESIA
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu HESTIARAHMA PURNAMASARI
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF
DAN SPORA Bacillus cereus DAN Bacillus subtilis
disetujui dan disahkan oleh pembimbing :
Pembimbing I
Hj. Any Fitriani, Dr., M. Si NIP. 196502021991032001
Pembimbing II
R. Kusdianti, Dra., M. Si NIP. 196402261989032004
Mengetahui
Ketua Departemen Pendidikan Biologi
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL
VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Oleh
Hestiarahma Purnamasari
Sebuah skripsi yang diajukan untuk memenuhi sebagian syarat untuk memperoleh gelar
Sarjana Sains Program Studi Biologi Departemen Pendidikan Biologi Fakultas Pendidikan
Matematika dan Ilmu Pengetahuan Alam
© Hestiarahma Purnamasari 2015
Universitas Pendidikan Indonesia
Agustus 2015
Hak Cipta dilindungi undang-undang.
Skripsi ini tidak boleh diperbanyak seluruhnya atau sebagian, dengan dicetak ulang,
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Dengan ini saya menyatakan bahwa skripsi dengan judul “Kemukus (Piper cubeba
L.) sebagai Antibakteri Terhadap Sel Vegetatif dan Spora Bacillus cereus dan Bacillus
subtilis” ini beserta seluruh isinya adalah benar-benar karya saya sendiri. Saya tidak melakukan penjiplakan atau pengutipan dengan cara-cara yang tidak sesuai dengan etika
ilmu yang berlaku dalam masyarakat keilmuan. Atas pernyataan ini, saya siap menanggung
resiko/sanksi apabila di kemudian hari ditemukan adanya pelanggaran etika keilmuan atau
Hestiarahma Purnamasari, 2015
ABSTRAK
Bakteri pembentuk spora seperti Bacillus cereus dan Bacillus subtilis seringkali ditemukan pada makanan dan menyebabkan pembusukan makanan. Saat ini pengawet buatan sudah biasa digunakan untuk mencegah pembusukan makanan tetapi kemudian diketahui bahwa bahan-bahan pengawet tersebut berbahaya bagi tubuh jika digunakan secara berlebihan. Bahan alami seperti rempah dapat menjadi alternatif untuk mencegah pembusukan makanan berdasarkan aktivitas antibakteri yang dimilikinya. Kemukus (Piper cubeba L.) merupakan tanaman asli Indonesia yang dijadikan sebagai bumbu dalam masakan, selain itu kemukus memiliki manfaat lain dalam hal kesehatan, antara lain memiliki aktivitas antioksidan dan antimikroba. Tujuan penelitian ini yaitu untuk mengevaluasi aktivitas antibakteri dari kemukus (Piper cubeba L.) terhadap B. cereus ATCC 33019 dan B. subtilis ATCC 6633. Aktivitas antibakteri diuji dengan metode disk
diffusion, minimum inhibitory concentration (MIC) dan minimum bactericidal concentration (MBC). Lebih lanjut, aktivitas antispora ekstrak
pun diujikan pada spora dari kedua bakteri. Hasil penelitian menunjukkan bahwa kedua species bakteri Bacillus spp. rentan terhadap ekstrak kemukus. Ekstrak mampu menghambat pertumbuhan B. cereus dan B. subtilis dengan nilai MIC sebesar 625 µg/mL. Nilai MBC ekstrak terhadap B. cereus sebesar 625 µg/mL dan >10000 µg/mL untuk B. subtilis. Aktivitas antispora dari ekstrak kemukus diujikan pada B. cereus dan B. subtilis dengan konsentrasi 0%, 1% dan 2% dengan waktu paparan 0 jam dan 1 jam. Hasil uji antispora ekstrak tidak menunjukkan adanya penurunan jumlah spora, hal ini mengindikasikan bahwa ekstrak kemukus tidak memiliki aktivitas antispora. Secara keseluruhan ekstrak kemukus menunjukkan potensi antibakteri terhadap sel vegetatif B. cereus dan B. subtilis. Oleh karena itu ekstrak kemukus dapat dikembangkan sebagai agen antibakteri terhadap strain-strain
Bacillus terutama B. cereus dan B. subtilis.
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu iv
ABSTRACT
Spore-forming bacteria like Bacillus cereus and B. subtilis are often present in food and cause food spoilage. Today synthetic preservatives usually used to prevent food spoilage but harmful for the body if overused. Natural ingredients like spices can be an alternative way to prevent food spoilage based on its antibacterial contains. Kemukus (Piper cubeba L.) is a native Indonesian’s plant that used as spice for food, in addition kemukus has other benefits in terms of health, such as antioxidant and antimicrobial activity. The aim of this study is to evaluate the antibacterial activity of kemukus against B. cereus ATCC 33019 and B. subtilis ATCC 6633 strains. Antibacterial activity assessed using disk diffusion method, minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC). Furthermore, the antisporicidal of the extract has tested against both spores of B. cereus and B. subtilis. Our result showed that kemukus extract was susceptible to both of Bacillus strains. The extract could inhibit the growth of B. cereus dan B. subtilis with MIC values of 625 µg/mL. MBC value of the extract was 625 µg/mL for B. cereus and >10000 µg/mL for B. subtilis. Antispore activity of kemukus extract has been tested against
B. cereus and B. subtilis spores at concentration of 0%, 1% and 2% with
exposure time of 0 hour and 1 hour. Antisporicidal test showed that extract did not show any reduction in the number of spores, it is indicate that the kemukus extract did not have antisporicidal activity. Overall, extract of kemukus shows potential antibacterial activity against B. cereus and B.
subtilis vegetative cells. Hence, the extract can be developed for
antibacterial agents against Bacillus strain.
Hestiarahma Purnamasari, 2015
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
ABSTRAK ... iii
DAFTAR ISI ... v
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
BAB I PENDAHULUAN ... 1
A. Latar Belakang Penelitian ... 1
B. Rumusan Masalah Penelitian ... 3
C. Pertanyaan Penelitian ... 3
D. Batasan Masalah ... 4
E. Tujuan Penelitian ... 4
F. Manfaat Penelitian ... 5
BAB II Kemukus (Piper cubeba L.) sebagai Antibakteri Terhadap Sel Vegetatif dan Spora Bacillus cereus dan Bacillus subtilis .... 6
A. Kemukus ... 6
1. Deskripsi ... 6
2. Kandungan dan Kegunaan ... 7
3. Farmakologi ... 8
B. Mikroorganisme Patogen ... 10
C. Antibakteri ... 11
D. Uji Antibakteri ... 14
1. Metode Disk Diffusion ... 14
2. MIC ... 15
3. MBC ... 16
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu vi
1. Sterilant ... 16
2. Desinfektan dan sanitizers ... 17
3. Antiseptik dan germisida ... 18
F. Antispora ... 20
G. Spora dan Sporulasi ... 21
H. Bakteri Pembentuk Spora ... 27
1. Bacillus ... 27
2. Bacillus cereus ... 29
3. Bacillus subtilis ... 31
BAB III METODE PENELITIAN ... 34
A. Jenis Penelitian ... 34
B. Desain Penelitian ... 34
C. Populasi dan Sampel ... 34
D. Lokasi dan Waktu Penelitian ... 34
E. Instrumen Penelitian ... 35
1. Alat ... 35
2. Bahan ... 36
F. Metode Kerja ... 37
1. Persiapan Medium Pertumbuhan Bakteri ... 37
a) TSA (Tryptic Soy Agar) ... 37
b) NA (Nutrient Agar) ... 37
c) MHA (Mueller Hinton Agar) ... 37
2. Persiapan Kultur B. cereus dan B. subtilis ... 37
3. Ekstraksi Kemukus ... 37
4. Persiapan Spora ... 38
5. Penghitungan Jumlah Spora ... 38
6. Pewarnaan Endospora ... 38
7. Uji Antibakteri ... 39
a) Metode Disk Diffusion ... 39
b) Penentuan MIC ... 39
Hestiarahma Purnamasari, 2015
8. Uji Antispora ... 39
9. Analisis Data ... 40
BAB IV TEMUAN DAN PEMBAHASAN ... 41
A. Aktivitas Antibakteri ... 42
1. Disk Diffusion ... 42
2. MIC dan MBC ... 44
B. Aktivitas Antispora ... 48
BAB V KESIMPULAN DAN SARAN ... 52
A. Kesimpulan ... 52
B. Saran ... 52
Daftar Pustaka ... 53
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu viii
DAFTAR TABEL
Halaman
Tabel 2.1. Uji Fitokimia Awal Ekstrak Metanol Kemukus ... 8
Tabel 2.2. Contoh Agen yang Termasuk Sterilant, Desinfektan dan Sanitizer ... 17
Tabel 2.3. Contoh Agen yang Termasuk Antiseptik ... 18
Tabel 2.4. Beberapa Tumbuhan yang Memiliki Aktivitas Antibakteri .. 19
Tabel 2.5. Perbedaan Sel Vegetatif dan Endospora ... 22
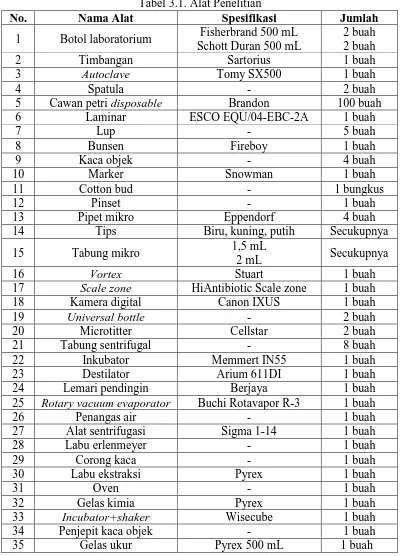
Tabel 3.1. Alat Penelitian ... 35
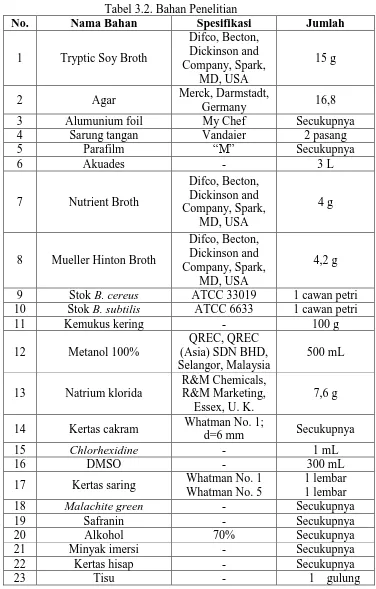
Tabel 3.2. Bahan Penelitian ... 36
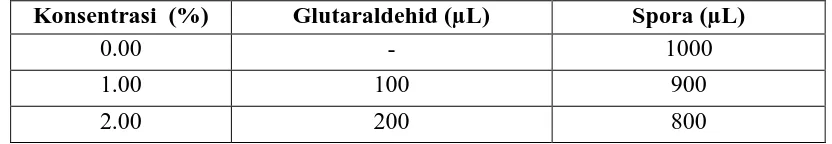
Tabel 3.3. Jumlah glutaraldehid dan spora yang digunakan pada masing-masing perlakuan ... 40
Tabel 3.4. Jumlah ekstrak dan spora yang digunakan pada masing-masing perlakuan ... 40
Tabel 4.1. Hasil Uji Disk Diffusion ... 42
Tabel 4.2. MIC dan MBC Ekstrak Kemukus ... 45
Tabel 4.3. Jumlah Spora B. cereus ... 50
Hestiarahma Purnamasari, 2015
DAFTAR GAMBAR
Halaman
Gambar 2.1. Buah Kemukus ... 7
Gambar 2.2. Aktivitas Bakteriostatik (a); Bakteriosidal (b); Bakteriolotik (c) ... 12
Gambar 2.3. Contoh Eksospora pada Streptomyces coacervatus ... 21
Gambar 2.4. Contoh Endospora pada B. subtilis ... 22
Gambar 2.5. Struktur Endospora ... 23
Gambar 2.6. Siklus Sporulasi yang Khas pada Bakteri Pembentuk Spora 26
Gambar 2.7. B. cereus Spore Stain ... 29
Gambar 2.8. B. subtilis ... 32
Gambar 4.1. Sel vegetatif B. cereus (merah); Spora B. cereus (hijau).. 41
Gambar 4.2. Spora Bacillus subtilis (hijau) ... 41
Gambar 4.3. Disk diffusion pada B. cereus ... 43
Gambar 4.4. Disk diffusion pada B. subtilis ... 43
Gambar 4.5. Hasil Pengujian MIC Terhadap B. cereus ... 44
Gambar 4.6. Hasil Pengujian MIC Terhadap B. subtilis ... 44
Gambar 4.7. Hasil Pengujian MBC Terhadap B. cereus ... 45
Gambar 4.8. Hasil Pengujian MBC Terhadap B. subtilis ... 46
Gambar 4.9. Koloni Spora B. cereus yang Tumbuh pada Waktu Inkubasi 0 jam ... 48
Gambar 4.10. Koloni Spora B. cereus yang Tumbuh pada Waktu Inkubasi 1 jam ... 49
Gambar 4.11. Koloni Spora B. subtilis yang Tumbuh pada Waktu Inkubasi 0 jam ... 49
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu x
DAFTAR LAMPIRAN
Lampiran 1. Ekstraksi Kemukus ... 63 Lampiran 2. Data Uji Disk Diffusion ... 63 Lampiran 3. Data Koloni Spora Tumbuh pada Pengujian Antispora Ekstrak
Kemukus ... 63 Lampiran 4. Pengolahan Data Uji Disk Diffusion pada B. cereus ... 64 Lampiran 5. Pengolahan Data Uji Disk Diffusion pada B. subtilis ... 66 Lampiran 6. Uji Perbandingan Rata-rata (Uji T) Hasil Disk Diffusion
B. cereus dan B. subtilis ... 68 Lampiran 7. Pengolahan Data Uji Antispora Ekstrak Kemukus 1% dan 10% Terhadap Spora B. cereus ... 70 Lampiran 8. Pengolahan Data Uji Antispora Ekstrak Kemukus 1% dan 10% Terhadap Spora B. subtilis ... 73 Lampiran 9. Pengolahan Data Uji Antispora Glutaraldehid Terhadap
Spora B. cereus ... 76 Lampiran 10. Pengolahan Data Uji Antispora Glutaraldehid Terhadap
Hestiarahma Purnamasari, 2015
BAB I
PENDAHULUAN
A. Latar Belakang Penelitian
Makanan merupakan kebutuhan pokok bagi manusia. Manusia membutuhkan
nutrisi yang bersumber dari makanan agar tubuh tetap sehat dan bugar sehingga
dapat menjalankan aktivitas dengan maksimal. Aktivitas manusia yang tinggi
tentu akan banyak menyita waktu, menuntut untuk melakukan segala sesuatu
seefisien mungkin, tak terkecuali dalam hal makanan. Dengan demikian saat ini
banyak makanan yang diolah dengan cara-cara tertentu agar dapat dimasak dan
dikonsumsi secara instan serta mampu bertahan dalam waktu relatif lebih lama,
seperti makanan dibuat kering atau diberi pengawet.
Teknik pengeringan atau pemberian pengawet pada makanan bertujuan untuk
menjadikan makanan tidak mudah basi. Makanan basi dapat disebabkan oleh
kombinasi dari berbagai macam faktor seperti cahaya, oksigen, panas,
kelembaban dan/atau mikroorganisme (EUFIC, 2015). Mikroorganisme yang
menyebabkan masalah pada makanan dan berperan dalam penyakit yang
ditularkan melalui makanan termasuk ke dalam mikroorganisme patogen.
Mikroorganisme ini tumbuh baik pada suhu ruangan (15-32⁰C) dan sebagian
besar tidak mampu tumbuh pada suhu di lemari pendingin. Berbagai macam
bakteri, ragi dan jamur dapat tumbuh baik pada suhu ruangan serendah-rendahnya
4⁰C. Saat terdapat mikroorganisme pembusuk pada makanan, penampilan serta
aroma dari makanan tersebut biasanya akan menjadi buruk (UNL Food, 2014).
Mikroorganisme yang mengontaminasi makanan akan turut masuk ke dalam
tubuh dan seringkali menimbulkan gejala-gejala seperti mual, muntah, kram perut
dan diare. Lima mikroorganisme patogen yang diketahui sangat erat kaitannya
dengan penyakit yang ditularkan melalui makanan adalah Norovirus, Salmonella,
Clostridium perfringens, Campylobacter spp. dan Staphylococcus aureus (CDC,
2014). Keamanan pangan membutuhkan pemantauan konstan untuk memastikan
2
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Anggapan bahwa mikroorganisme dalam makanan akan mati setelah makanan
tersebut melalui proses pemasakan tidak selamanya benar, karena masih terdapat
suatu kemungkinan bagi mikroorganisme tersebut untuk bertahan, seperti
membentuk spora pada bakteri. Bakteri pembentuk spora seringkali berada dalam
makanan, karena lebih tahan terhadap pemberian perlakuan antimikroba secara
fisik dan kimiawi (Rukayadi et al., 2009). Menurut Malakar (Rukayadi et al.,
2009) beberapa bakteri pembentuk spora seperti Bacillus dan Clostridium
berasosiasi dengan pembusukan makanan dan penularan penyakit yang
melibatkan makanan. Dua species dalam Genus Bacillus yaitu Bacillus cereus dan
Bacillus subtilis banyak mengontaminasi makanan. B. cereus terlibat dalam
penyakit yang disebarkan melalui makanan karena sporanya mampu bertahan
dalam prosedur pemasakan, selain itu bakteri ini menghasilkan racun selama
sporulasi yang merupakan penyebab dari keracunan makanan (Drobniewski,
1993; Rahimifard et al., 2007 dalam Dabiri & Karbasizade, 2014). Keterlibatan B.
subtilis dalam penyakit yang disebarkan melalui makanan ialah bakteri ini
memproduksi amilosin–suatu racun tahan panas, sehingga meskipun telah melalui
proses pemasakan racun ini akan tetap berada dalam makanan dan menjadi salah
satu penyebab timbulnya penyakit (Apetroaie-Constantin et al., 2008).
Terkait pengawetan makanan, seringkali produsen menambahkan bahan kimia
sintetis agar makanan tidak cepat basi. Namun belakangan diketahui bahwa
bahan-bahan tersebut bersifat racun bagi tubuh jika dikonsumsi berlebihan dalam
jangka waktu panjang. Untuk itu alangkah lebih baik jika pengawet berbahan
dasar alami sehingga tidak menimbulkan efek samping bagi tubuh, aman, namun
tidak mengubah rasa makanan. Penggunaan bahan-bahan alami yang digunakan
sebagai pengawet didasarkan pada kandungan senyawa yang memiliki aktivitas
antibakteri atau antioksidan. Senyawa-senyawa yang memiliki aktivitas
antibakteri atau antioksidan tersebut antara lain, minyak atsiri, asam organik,
enzim dan fitoaleksin (Meyer et al., 2002).
Tanaman rempah merupakan kelompok tanaman yang penggunaannya cukup
tinggi dalam bidang pangan, khususnya Indonesia. Rempah ini digunakan sebagai
bumbu pada makanan. Makanan khas Indonesia tidak dapat dipisahkan dengan
makanan. Rempah-rempah dapat dijadikan suatu alternatif dalam upaya
pengawetan makanan terkait sifat-sifat antimikroba yang dikandungnya. Kemukus
(Piper cubeba L.) merupakan tanaman asli Indonesia yang dijadikan sebagai
bumbu dalam masakan. Buah dan minyak atsiri dari tanaman ini banyak
digunakan. Dalam hal makanan, kemukus berperan sebagai perasa khususnya
pada kari, selain itu kemukus memiliki manfaat lain dalam hal kesehatan, antara
lain memiliki aktivitas antioksidan dan antimikroba (Lim, 2012). Kemukus yang
digunakan sebagai bumbu rempah dalam masakan diketahui memiliki aktivitas
antimikroba. Aktivitas antimikroba tersebut perlu diujikan terhadap bakteri
penyebab basi makanan, antara lain B. cereus dan B. subtilis sebagai studi awal
untuk pengembangan potensi penggunaan kemukus sebagai pengawet makanan
alami. Berdasarkan hal tersebut telah dilakukan penelitian untuk menguji aktivitas
antibakteri kemukus terhadap sel vegetatif dan spora dari B. cereus dan B.
subtilis.
B. Rumusan Masalah Penelitian
Berdasarkan latar belakang masalah di atas maka rumusan masalah pada
penelitian yang akan dilakukan adalah Bagaimana aktivitas antibakteri kemukus
terhadap sel vegetatif dan spora dari B. cereus dan B. subtilis?
C. Pertanyaan Penelitian
1. Apakah kemukus memiliki aktivitas antibakteri terhadap sel vegetatif
dari B. cereus dan B. subtilis?
2. Berapa besar zona hambat dari ekstrak kemukus terhadap B. cereus dan B.
subtilis pada konsentrasi yang berbeda?
3. Berapa konsentrasi minimum ekstrak kemukus yang dapat menghambat
pertumbuhan bakteri B. cereus dan B. subtilis?
4. Berapa konsentrasi minimum ekstrak kemukus yang dapat membunuh bakteri
B. cereus dan B. subtilis?
5. Apakah kemukus memiliki aktivitas antibakteri terhadap spora dari B. cereus
4
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
6. Berapakah konsentrasi optimum ekstrak kemukus yang dapat mereduksi
jumlah spora bakteri B. cereus dan B. subtilis?
7. Berapakah waktu inkubasi optimum ekstrak kemukus yang dapat mereduksi
jumlah spora bakteri B. cereus dan B. subtilis?
D. Batasan Masalah
1. Bagian tanaman kemukus yang digunakan yaitu buahnya.
2. Kemukus yang diujikan merupakan ekstrak kasar dengan pelarut metanol.
3. Bakteri yang dijadikan bakteri uji yaitu B. cereus ATCC 33019 dan B. subtilis
ATCC 6633.
4. Parameter yang diukur pada penelitian ini adalah :
a) Diameter zona hambat ekstrak kemukus terhadap B. cereus dan B. subtilis.
b) Nilai MIC (Minimum Inhibitory Concentration) dari ekstrak kemukus
terhadap B. cereus dan B. subtilis.
c) Nilai MBC (Minimum Bactericidal Concentration) dari ekstrak kemukus
terhadap B. cereus dan B. subtilis.
d) Jumlah spora bakteri B. cereus dan B. subtilis sebelum dan sesudah pemberian
perlakuan konsentrasi dan waktu inkubasi.
E. Tujuan Penelitian
1. Mengevaluasi aktivitas antibakteri ekstrak kemukus terhadap sel vegetatif dari
B. cereus dan B. subtilis.
2. Menentukan konsentrasi minimum ekstrak kemukus yang dapat menghambat
pertumbuhan bakteri B. cereus dan B. subtilis.
3. Menentukan konsentrasi minimum ekstrak kemukus yang dapat membunuh
bakteri B. cereus dan B. subtilis.
4. Mengevaluasi aktivitas antibakteri terhadap spora dari B. cereus dan B.
subtilis.
5. Menentukan konsentrasi optimum ekstrak kemukus yang dapat mereduksi
jumlah spora bakteri B. cereus dan B. subtilis.
6. Menentukan waktu inkubasi optimum ekstrak kemukus yang dapat mereduksi
F. Manfaat Penelitian
1. Memberikan informasi mengenai aktivitas antibakteri pada ekstrak kemukus
terhadap bakteri penyebab keracunan makanan, diantaranya B. cereus dan B.
subtilis.
2. Memberikan sumbangan ilmu pengetahuan dalam bidang mikrobiologi dan
kesehatan serta pangan.
3. Menambah potensi penggunaan kemukus di bidang kesehatan, yaitu sebagai
pengawet makanan alami.
4. Adanya solusi alternatif mengenai penggunaan pengawet pada makanan yang
lebih aman.
5. Membuka peluang diproduksinya pengawet berbahan alami, salah satunya
dari kemukus.
6. Sumber informasi baru di bidang penelitian dan memberikan dorongan atau
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu 34
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Jenis penelitian yang dilakukan termasuk ke dalam jenis penelitan
eksperimental dengan memberikan perlakuan konsentrasi dan waktu inkubasi
yang berbeda-beda.
B. Desain Penelitian
Desain penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL)
karena penelitian dilakukan di laboratorium dan kondisi yang homogen. Pada
pengujian aktifitas antispora digunakan konsentrasi ekstrak kemukus sebesar 0%,
1% dan 2% terhadap spora B. cereus dan B. subtilis. Pada pengujian disk-diffusion
digunakan konsentrasi 1% dan 10%, dengan chlorhexidine merupakan kontrol
positif serta DMSO 10% merupakan kontrol negatif. Digunakan pula konsentrasi
yang berbeda pada saat MIC dan MBC dengan konsentrasi pengujian berdasarkan
teknik pengenceran, yaitu 10000 µg/mL, 5000 µg/mL, 2500 µg/mL, 1250 µg/mL,
625 µg/mL, 312,5 µg/mL, 156,25 µg/mL, 78,1 µg/mL, 39 µg/mL dan 19,5
µg/mL. Setiap konsentrasi pengujian terdapat pengulangan, termasuk diantaranya
kontrol positif dan kontrol negatif. Pada pengujian MIC dan MBC terdapat
kontrol positif yang hanya terdiri dari medium sebanyak 200 µL dan kontrol
negatif yang hanya terdiri dari inokulum sebanyak 200 µL.
C. Populasi dan Sampel
Populasi yang digunakan dalam penelitian adalah tanaman kemukus,
sedangkan sampel dari penelitian ini adalah bagian buah dari tanaman kemukus.
D. Lokasi dan Waktu Penelitian
Penelitian dimulai dari tanggal 01 April 2015 sampai dengan tanggal 28 April
2015 yang dilaksanakan di Institute of Biosains (IBS), Universiti Putra Malaysia
E. Instrumen Penelitian 1. Alat
Alat-alat yang digunakan dalam penelitian ini sebagai berikut:
Tabel 3.1. Alat Penelitian
No. Nama Alat Spesifikasi Jumlah
1 Botol laboratorium Fisherbrand 500 mL Schott Duran 500 mL
2 buah 2 buah
2 Timbangan Sartorius 1 buah
3 Autoclave Tomy SX500 1 buah
4 Spatula - 2 buah
5 Cawan petri disposable Brandon 100 buah
6 Laminar ESCO EQU/04-EBC-2A 1 buah
7 Lup - 5 buah
8 Bunsen Fireboy 1 buah
9 Kaca objek - 4 buah
10 Marker Snowman 1 buah
11 Cotton bud - 1 bungkus
12 Pinset - 1 buah
13 Pipet mikro Eppendorf 4 buah
14 Tips Biru, kuning, putih Secukupnya
15 Tabung mikro 1,5 mL
2 mL Secukupnya
16 Vortex Stuart 1 buah
17 Scale zone HiAntibiotic Scale zone 1 buah
18 Kamera digital Canon IXUS 1 buah
19 Universal bottle - 2 buah
20 Microtitter Cellstar 2 buah
21 Tabung sentrifugal - 8 buah
22 Inkubator Memmert IN55 1 buah
23 Destilator Arium 611DI 1 buah
24 Lemari pendingin Berjaya 1 buah
25 Rotary vacuum evaporator Buchi Rotavapor R-3 1 buah
26 Penangas air - 1 buah
27 Alat sentrifugasi Sigma 1-14 1 buah
28 Labu erlenmeyer - 1 buah
29 Corong kaca - 1 buah
30 Labu ekstraksi Pyrex 1 buah
31 Oven - 1 buah
32 Gelas kimia Pyrex 1 buah
33 Incubator+shaker Wisecube 1 buah
34 Penjepit kaca objek - 1 buah
36
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu 2. Bahan
Bahan-bahan yang digunakan dalam penelitian ini sebagai berikut:
Tabel 3.2. Bahan Penelitian
No. Nama Bahan Spesifikasi Jumlah
1 Tryptic Soy Broth
Difco, Becton, Dickinson and Company, Spark,
MD, USA
15 g
2 Agar Merck, Darmstadt,
Germany 16,8
3 Alumunium foil My Chef Secukupnya
4 Sarung tangan Vandaier 2 pasang
5 Parafilm “M” Secukupnya
6 Akuades - 3 L
7 Nutrient Broth
Difco, Becton, Dickinson and Company, Spark,
MD, USA
4 g
8 Mueller Hinton Broth
Difco, Becton, Dickinson and Company, Spark,
MD, USA
4,2 g
9 Stok B. cereus ATCC 33019 1 cawan petri 10 Stok B. subtilis ATCC 6633 1 cawan petri
11 Kemukus kering - 100 g
12 Metanol 100%
QREC, QREC (Asia) SDN BHD, Selangor, Malaysia
500 mL
13 Natrium klorida
R&M Chemicals, R&M Marketing,
Essex, U. K.
7,6 g
14 Kertas cakram Whatman No. 1;
d=6 mm Secukupnya
15 Chlorhexidine - 1 mL
16 DMSO - 300 mL
17 Kertas saring Whatman No. 1 Whatman No. 5
1 lembar 1 lembar
18 Malachite green - Secukupnya
19 Safranin - Secukupnya
20 Alkohol 70% Secukupnya
21 Minyak imersi - Secukupnya
22 Kertas hisap - Secukupnya
F. Metode Kerja
1. Persiapan Medium Pertumbuhan Bakteri a) TSA (Tryptic Soy Agar)
Medium TSA dibuat dengan mencampurkan 15 g TSB (Tryptic Soy Broth), 7
g agar dan 500 mL akuades dalam botol laboratorium. Larutan medium kemudian
dihomogenkan dan disterilisasi menggunakan autoclave selama 90 menit
kemudian dituang ke dalam cawan petri (plating). Medium disimpan dalam lemari
pendingin dengan suhu 6⁰C.
b) NA (Nutrient Agar)
Medium NA dibuat dengan mencampurkan 4 g NB (Nutrient Broth), 7 g agar
dan 500 mL akuades ke dalam botol laboratorium. Larutan medium kemudian
dihomogenkan dan disterilisasi menggunakan autoclave selama 90 menit
kemudian dituang ke dalam cawan petri (plating). Medium disimpan dalam lemari
pendingin dengan suhu 6⁰C.
c) MHA (Mueller Hinton Agar)
Medium dibuat sebanyak 200 mL dengan mencampurkan 4,2 g MHB, 2,8 g
agar dan 200 mL akuades ke dalam botol laboratorium. Larutan medium
kemudian dihomogenkan dan disterilisasi menggunakan autoclave selama 90
menit kemudian dituang ke dalam cawan petri (plating). Medium disimpan dalam
lemari pendingin dengan suhu 6⁰C.
2. Persiapan Kultur B. cereus dan B. subtilis
Stok B. cereus ATCC 33019 dan B. subtilis ATCC 6633 didapatkan dari
Laboratory of Natural Products, Institute of Bioscience (IBS), Universiti Putra
Malaysia (UPM), Serdang, Selangor, Malaysia. Satu lup bakteri diambil dari stok
kemudian dipindahkan ke medium TSA. Kultur diinkubasi pada suhu 36⁰C
selama 24 jam untuk keperluan sel vegetatif, sedangkan untuk keperluan spora
inkubasi dilakukan selama 7 hari.
3. Ekstraksi Kemukus
Ekstraksi tanaman dilakukan berdasarkan Rukayadi et al. (2008) dengan
modifikasi. Buah kemukus kering dicacah kecil menggunakan blender kemudian
38
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
metanol 100% sebanyak 400 mL. Botol selanjutnya dilapisi dengan alumunium
foil lalu disimpan dalam suhu ruangan selama 5 hari. Ekstrak kemukus kemudian
disaring menggunakan kertas saring dan dipadatkan dengan rotary vacuum
evaporator pada suhu 50⁰C. Selanjutnya ekstrak dilarutkan dengan DMSO 100%
untuk mendapatkan larutan stok dengan konsentrasi 100 mg/mL (10 %).
4. Persiapan Spora
Spora B. cereus dan B. subtilis disiapkan berdasarkan metode yang dijelaskan
sebelumnya oleh Rukayadi et al. (2009) dengan modifikasi. Satu cawan petri
kultur bakteri B. cereus dan B. subtilis masing-masing dilarutkan dengan 10 mL
0,95% NaCl steril dalam tabung sentrifugal. Spora dipanen melalui sentrifugasi
(4500 rpm selama 5 menit) dan tiga kali pencucian menggunakan larutan 0,95%
NaCl steril. Setelah itu suspensi bakteri diinkubasi dalam penangas air dengan
suhu 60⁰C selama 90 menit, dengan melakukan tahapan ini sel-sel vegetatif
bakteri diasumsikan telah mati sehingga hanya spora yang masih bertahan.
Suspensi spora kemudian disimpan dalam freezer sampai akan digunakan.
5. Penghitungan Jumlah Spora
Jumlah spora pada stok yang akan digunakan untuk pengujian dihitung
terlebih dahulu. Stok spora B. cereus dan B. subtilis dibuat serial pengenceran
mulai dari 10-1 sampai 10-9. Pengenceran 10-3 sampai 10-6 kemudian disebar pada
medium NA. Medium diinkubasi selama 24 jam dalam suhu 37⁰C. Setelah 24 jam
koloni yang tumbuh dihitung dan menghasilkan nilai spora awal dari B. cereus
sebanyak 2,14×108 CFU/mL sedangkan untuk B. subtilis sebanyak 1,77×108
CFU/mL.
6. Pewarnaan Endospora
Untuk memastikan bahwa sampel spora dalam tabung benar-benar spora yang
akan diuji, maka dilakukan verifikasi dengan pewarnaan spora. Stok spora B.
cereus dan B. subtilis dibuat sediaan mikroskopis. Sediaan mikroskopis kemudian
ditutup dengan kertas hisap lalu ditetesi malachite green dan dipanaskan diatas
api, jika kertas hisap sudah mengering malachite green kembali ditambahkan, hal
ini dilakukan selama 5 menit. Kertas hisap dibuang lalu sediaan mikroskopis
dicuci dengan dialiri akuades. Safranin diteteskan di atas sediaan kemudian
menggunakan kertas hisap. Hasil pewarnaan dilihat dibawah mikroskop dengan
bantuan minyak imersi.
7. Uji Antibakteri
a) Metode Disk Diffusion
Metode diadaptasi dari Zainin et al. (2013). Inokulum B. cereus dan B. subtilis
diambil menggunakan cotton bud kemudian disebarkan secara merata. Kertas
cakram (d=6 mm) diletakkan di atas medium yang telah disebar bakteri
sebelumnya. Pada tiap kertas cakram diteteskan masing-masing 10 µL ekstrak
kemukus 1%, 10%, chlorhexidine (CHX) sebagai kontrol positif dan DMSO 10%
sebagai kontrol negatif. Kertas cakram ditunggu kering kemudian cawan petri
ditutup dan diinkubasi pada suhu 37⁰C selama 24 jam, kemudian luas zona
hambat diukur.
b) Penentuan MIC
Metode diadaptasi dari Zainin et al. (2013). Koloni B. cereus dan B. subtilis
diambil menggunakan lup kemudian dilarutkan dalam 1 mL medium MHB dalam
tabung mikro. Larutan kemudian dihomogenkan menggunakan vorteks. Sepuluh
µL larutan bakteri kemudian dimasukkan ke dalam tabung yang telah berisi 10
mL medium MHB. Larutan bakteri ini akan digunakan pada pengujian MIC
dengan metode two fold dilutions.
c) Penentuan MBC
Metode diadaptasi dari Zainin et al. (2013). Pengujian MBC dilakukan dengan
mensub-kultur suspensi (sebanyak 10 µL) dari sumur mikrotiter pengujian MIC.
Cawan petri kemudian diinkubasi selama 24 jam dalam suhu 37⁰C.
8. Uji Antispora
Pengujian antispora dilakukan berdasarkan metode yang telah dipaparkan oleh
Kida et al. (2004) dan Rukayadi et al. (2009) dengan modifikasi. Sebagai kontrol
positif digunakan glutaraldehid 10%. Konsentrasi glutaraldehid dan ekstrak
40
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Pengujian dilakukan dengan mencampurkan suspensi spora dengan ekstrak
kemukus atau glutaraldehid (Tabel 3.3 dan Tabel 3.4), larutan ini selanjutnya
disebut larutan uji.
Tabel 3.3. Jumlah glutaraldehid dan spora yang digunakan pada masing-masing perlakuan.
Konsentrasi (%) Glutaraldehid (µL) Spora (µL)
0.00 - 1000
1.00 100 900
2.00 200 800
Tabel 3.4. Jumlah ekstrak dan spora yang digunakan pada masing-masing perlakuan.
Konsentrasi (%) Ekstrak (µL) Spora (µL)
0.00 - 1000
1.00 100 900
2.00 200 800
Larutan uji diinkubasi dalam incubator shaker 37⁰C. Pada rentang waktu 0
dan 1 jam 10 µL larutan uji diambil dan diencerkan hingga pengenceran 10-2.
Setiap serial konsentrasi ekstrak kemukus dan glutaraldehid kemudian disebarkan
pada medium NA dan diinkubasi pada suhu 37oC selama 24 jam. Jumlah koloni
yang tumbuh dihitung dan dibandingkan dengan jumlah spora awal. Jika terdapat
penurunan jumlah spora maka mengindikasikan adanya aktivitas antispora.
9. Analisis Data
Data hasil pengujian diolah secara statistik dengan pengujian normalitas,
homogenitas, Oneway Anova, Kruskal Wallis dan uji T menggunakan software
Hestiarahma Purnamasari, 2015
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Ekstrak buah kemukus memiliki potensi aktivitas antibakteri terhadap sel
vegetatif, hal ini dapat diketahui secara kualitatif dari hasil uji disk diffusion.
Ekstrak kemukus 1% terhadap B. cereus dan B. subtilis menunjukkan luas zona
hambat sebesar 6,83 mm dan 8,30 mm, secara berurutan. Ekstrak kemukus 10%
menunjukkan luas zona hambat sebesar 10,00 mm pada B. cereus, sedangkan
pada B. subtilis sebesar 10,30 mm. Selanjutnya secara kuantitatif, konsentrasi
minimum ekstrak kemukus yang dapat menghambat pertumbuhan bakteri B.
cereus dan B. subtilis bernilai sama, yaitu 625 µg/mL. Lebih lanjut, konsentrasi
minimum ekstrak kemukus yang dapat membunuh bakteri B. cereus bernilai 625
µg/mL dan B. subtilis bernilai >10000 µg/mL. Sesuai dengan hasil uji kualitatif,
hasil uji kuantitatif pun menunjukkan bahwa kemukus memiliki potensi aktivitas
antibakteri.
Aktivitas antibakteri yang ditunjukkan kemukus masih belum mampu untuk
mencegah perkembangan atau perkecambahan dari spora kedua bakteri. Jumlah
spora tidak mengalami penurunan setelah diberi perlakuan berbagai konsentrasi
ekstrak kemukus dan waktu inkubasi. Secara keseluruhan hasil penelitian ini
mengindikasikan adanya potensi aktivitas antibakteri dari ekstrak buah kemukus
terhadap sel vegetatif kedua species Bacillus yang diujikan. Oleh karena itu
ekstrak kemukus dapat dikembangkan sebagai agen antibakteri terhadap
species-species Bacillus terutama B. cereus dan B. subtilis.
B. Saran
Untuk mengetahui lebih lanjut mengenai aktivitas antispora dari ekstrak
kemukus perlu dilakukan peningkatan konsentrasi ekstrak serta peningkatan lama
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu 53
DAFTAR PUSTAKA
Alliance for the Prudent Use of Antibiotics (APUA). (2014). Antibiotic Agent.
[Online]. Diakses dari:
http://www.tufts.edu/med/apua/about_issue/agents.shtml
Alexander, M. (1977). Introduction to Soil Microbiology. New York: John Wiley and Sons, Inc.
Apetroaie-Constantin, C., Mikkola, R., Andersson, M. A., Teplova, V., Suominen, I., Johansson, T., Salkinoja-Salonen, M. (2008). Bacillus subtilis and B. mojavensis strains connected to food poisoning produce the heat stable toxin amylosin. Journal of Applied Microbiology. 106. 1976–1985.
Arora, D. S. & Bhardwaj, S.K. (1997). Antibacterial activity of some medicinal plants. Geo Bios. 24. 127-131.
American Society for Microbiology (ASM). (2005). Manual of Antimicrobial
Susceptibility Testing. [Online]. Diakses dari:
http://www.asm.org/ccLibraryFiles/FILENAME/000000002484/Man ual%20of%20Antimicrobial%20Susceptibility%20Testing.pdf
Bastos, J. K., Carvalho, J. C. T., de Souza, G. H. B., Pedrazzi, A. H. P., Sarti, S. J. (2001). Anti-inflammatory activity of cubebin, a lignan from the leaves of Zanthoxyllum naranjillo Griseb. Journal of Ethnopharmacology. 75. 279- 282.
Borsato, M.L.C., Grael, C. F. F., Souza, G. E. P., Lopes, N. P. (2000). Analgesic activity of the lignans from Lychnophora ericoides. Phytochemistry. 55. 809-813.
Bottone, E. J. (2010). Bacillus cereus, a Volatile Human Pathogen. Clinical Microbiology Review. 23 (2). 382-398.
Centers for Disease Control and Prevention (CDC). (2014). Foodborne Illness,
Foodborne Disease, (sometimes called “Food Poisoning”). [Online].
Diakses dari: http://www.cdc.gov/foodsafety/facts.html
Chitnis, R., Abichandani, M., Nigam, P., Nahar, L., Sarker, S. D. (2007). Antioxidant and antibacterial activity of the extracts of Piper cubeba (Piperaceae). Ars Pharmaceutica. 48 (4). 343-350.
Choi, E. M. & Hwang, J. K. (2005). Effect of some medicinal plants on plasma antioxidant system and lipid levels in rats. Phytotherapy Research. (19). 382-386.
Claus, D. & Berkeley, R.C.W. (1986). Genus Bacillus, In : Bergeys Manual of Systematic Bacteriology, vol 2 (SNEATH, P.H.A., ed.), Williams and Wilkins, Baltimore : 1105 - 1139.
Clinical & Laboratory Standards Institute (CLSI). (1999). M26A: Methods for Determining Bactericidal Activity of Antibacterial Agent; Approved
Guideline. [Online]. Diakses dari:
shop.clsi.org/site/Sample_pdf/M26A_sample.pdf
Cowan, M. M. (1999). Plant Product As Antimicrobial Agent. CLINICAL MICROBIOLOGY REVIEWS. 12 (4). 564–582.
Cronquist, A. (1988). The Evolution and Classification of Flowering Plants. New York: The New York Botanical Garden.
Dabiri, A. & Karbasizade¸V. (2014). Evaluation of the Sporicidal Activity of Ethanol Extract of Arctium lappa Root against Bacillus cereus. Zahedan Journal of Research in Medical Science. 16 (10). 47-49.
Denton, G. W. (2001). Disinfection, Sterilization and Preservation. Philadelphia: Lippincott Wiliams & Wilkins. [Online]. Diakses dari: https://books.google.co.id/books?id=3fkPJ17_TYC&printsec=frontcover# v=onepage&q&f=false
55
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Trypanocidal activity of (-)-cubebin derivatives against free amastigote forms of Trypanosoma cruzi. Bioorganic and Medical Chemistry Letters. 15. 303-307.
Driks, A. (1999). Bacillus subtilis Spore Coat. Microbiology and Molecular Biology Reviews. 63 (1). 1-20.
Drobniewski, F.A. (1993). Bacillus cereus and related species. Clinical Microbiology Reviews. 6 (4). 324-338.
Edberg, S.C. (1991). US EPA human health assessment: Bacillus subtilis. Unpublished, U.S. Environmental Protection Agency, Washington, D.C.
Eisai Indonesia, P.T. (1995). Medicinal Herb Index in Indonesia, second ed. Jakarta.
Elfahmi, Ruslan, K. , Batterman, S., Bos, R., Kayser, O. Woerdenbag, H. J., Quax, W. J. (2007). Lignan Profile of Piper cubeba, An Indonesian Medicinal Plant. Biochemical Systematics and Ecology. 35. 397-402.
European Food Information Council (EUFIC). (2015). What causes food
spoilage?. [Online]. Diakses dari:
http://www.eufic.org/page/en/page/faq/faqid/food-spoilage/
Fankhauser, D. B. (2011). Bacillus subtilis. [Online]. Diakses dari: http://biology.clc.uc.edu/fankhauser/Labs/Microbiology/Prepared_Slides B_subtilis_spores_2000_P7260024.JPG
Food and Drug Administration (FDA). (2014). BBB - Bacillus cereus and other
Bacillus spp. [Online]. Diakses dari:
http://www.fda.gov/food/foodborneillnesscontaminants/causesofillnessbad bugbook/ucm070492.htm
Fitz-James & Young, P. C. E. (1969). Morphology of Sporulation. G. W. Gould and A. Hurst (ed.) The bacterial spore. Academic Press. New York. 39–72.
Granum, P. E. (2008). The Thin Line between Microbiological Quality and Safety:
Bacillus spp. [Online]. Diakses dari:
http://www.foodprotection.org/files/2008_european_speaker_presentation S5.pdf
Hatmanti, A. (2000). “Pengenalan Bacillus Spp.”. Oseana. 25, (1), 31-41.
Hudzicki, J. (2013). Kirby-Bauer Disk Diffusion Susceptibility Test Protocol.
[Online]. Diakses dari:
http://www.microbelibrary.org/component/resource/laboratory-test/3189 kirby-bauer-disk-diffusion-susceptibility-test-protocol
Hussey, M. A. & Zayaitz, A. (2013). Endospore Stain Protocol. [Online]. Diakses dari: http://www.microbelibrary.org/component/resource/laboratory test/3112-endospore-stain-protocol
International Commission on Microbiological Specifications for Foods (ICMSF). (1996). Microorganisms in Foods 5: Characteristics of Microbial Pathogens. Kluwer Academic/Plenum Publisher. [Online]. Diakses dari: http://books.google.co.id/books?id=lxycHnaPfCYC&pg=PA20&dq=bacil us+cereus&hl=id&sa=X&ei=3VoIVMycHcu0uASIuYCQBw&ved=0CB Q6AEwAA#v=onepage&q=bacillus%20cereus&f=false.
Janssen, A. M., Chin, N. L. J., Scheffer, J. J. C., Svendsen, A. B. (1986). Screening for antimicrobial activity of some essential oils by the agar overlay technique. Pharmaceutisch Weekblad Scientific Edition. 8. 289-292.
Jasmine, R., Selvakumar. B. N. & Daisy, P. (2011). Investigating The Mechanism of Action of Terpenoids and The Effect of Interfering Substances On An Indian Medicinal Plant Extract Demonstrating Antibacterial Activity. IJPSR . 2 (2). 19-24.
Karthikeyan, J. & Rani, P. (2003). Enzymatic and Non-enzymatic Antioxidant in Selected Piper Species. Indian Journal of Experimental Biology. 41. 135-140.
57
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Khadre, M. A. & Yousef, A. E. (2001). Sporicidal action of ozone and hydrogen peroxide: a comparative study. International Journal of Food Microbiology. 71. 131–138.
Kida, N. Mochizuki, Y. & Taguchi, F. (2004). An effective iodide formulation for killing Bacillus and Geobacillus spores over a wide temperature range. Journal of Applied Microbiology. 97. 402–409.
Kramer, J. M. & Richard, J. G. (1989). Foodborne Bacterial Pathogens. USA: Marcel Dekker, Inc.
Lau, K. Y & Rukayadi, Y. (2014). Screening of tropical medicinal plants for sporicidal activity. International Food Research Journal. 22 (1). 421-425.
Leuschner, R. (2003). Bacillus. [Online]. Diakses dari: http://www.extranet.elsevier.com/homepage_about/mrwd/fosa/BACILLU S%20Occurrence.pdf
Lim, T. K. (2012). Edible Medicinal And Non-Medicinal Plants: Volume 4, Fruits. Springer Science & Business Media. [Online]. Diakses dari: https://books.google.co.id/books?id=c4KuB3iGmbwC&pg=PA321&dq=pi
per+cubeba&hl=id&sa=X&ei=VTYiVZWHD86iugSm-4HYAg&ved=0CBsQ6AEwAA#v=onepage&q=piper%20cubeba&f=false
Madigan. M. T., Martinko, J. M., Stahl, D. A, Clark, D. P. (2010). Brock Biology of Microorganism. 13th edition. San Francisco: Benjamin Cummings.
Malakar, P.K Barker, G. C., & Peck, M. W. (2004). Modeling the prevalence of Bacillus cereus spores during the production of a cooked chilled vegetable product. Journal of Food Protection. 67. 939-946.
McDonnell, G. & Russell, A. D. (1999). Antiseptics and Disinfectants: Activity, Action, and Resistance. CLINICAL MICROBIOLOGY REVIEWS. 12 (1). 147-179.
Mikkola, R. (2006). Food and Indoor Air Isolated Bacillus Non-Protein Toxins: Stuctures, Physico-Chemical Properties and Mechanisms of Effects on Eukariotic Cells. (Disertasi). Helsinki, Finland.
Muliawan, S. Y. (2007). Bakteri Anaerob yang Erat Kaitannya dengan Problem di
Klinik. [Online]. Diakses dari:
https://books.google.co.id/books?id=HdpLPGyFZx8C&pg=PA9&lpg=PA 9&dq=endotoksin+dan+eksotoksin&source=bl&ots=CDSB5KSBC_&sig=
XaYx8ExfCvxHHjDM5naZX1qcpqg&hl=en&sa=X&ei=PO-YVZOsCoKUuQTGjIJo&ved=0CE0Q6AEwBjgK#v=onepage&q=endoto ksin%20dan%20eksotoksin&f=false
Murthy, J. M. & Rani, P. U. (2009). Biological activity of certain botanical extracts as larvicides against the yellow fever mosquito, Aedes aegypti L. Journal of Biopesticides, 2 (1). 72-76.
Nahak, G. & Sahu R. K. (2011). Phytochemical Evaluation and Antioxidant activity of Piper cubeba and Piper nigrum. Journal of Applied Pharmaceutical Science. 01 (08). 153-157.
Norris, J. R. Berkeley, R. C. W., Logan, N. A., O'donnell, A. G. (1981). The Genera Bacillus and Sporalactobacillus. In : The Prokaryotes, Vol 2 (Starr, M.P., Stolp, A., Truper, A.G., Balows, A., And Schlegel, H.G., Eds). New York: Springer -Verlag, 1711 - 1742.
OIE-World Organisation of Animal Health. (2012). Laboratory methodologies for bacterial antimicrobial susceptibility testing. [Online]. Diakses dari: http://www.oie.int/fileadmin/Home/fr/Our_scientific_expertise/docs/pdf/ GUIDE_2.1_ANTIMICROBIAL.pdf
Pachpute, A. P. & Deshmukh, T. A. (2013). Antioxidant And Hepatoprotective Activity Of An Ethanol Extract Of Piper cubeba Fruits. International Jiurnal of Research and Development in Pharmacy & Life Science. 2 (2). 321-329.
59
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Parvez, Md., Gayasuddin, Md., Basheer, Md. & Janakiraman, K. (2010). Screening of Piper cubeba (Linn) Fruits for Anti-ulcer Activity. International Journal of PharmTech Research. 2 (2). 1128-1132.
Pelczar, M. J. & Chan, E. C. S. (2008). Dasar-dasar Mikrobiologi. Jakarta: UI Press.
Pusat Penelitian dan Pengembangan Perkebunan. (2007). Konservasi Dan Potensi
Pengembangan Kemukus. [Online]. Diakses dari:
http://perkebunan.litbang.pertanian.go.id/?p=941
Purwoko, T. (2007). Fisiologi Mikroba. Jakarta: PT Bumi Aksara
Rahimifard, N., Fatholahzadeh, B., Pirali Hamedani, M., Noory, Z., , Saadati, S. H., Zavar, M., Pirouz, B., Asghari, S. H., Khezripour, M. , Saberi, S. (2007). Bacillus cereus contamination in infant formula: A study in food and drug control laboratory. Tehran University Medical Journal. 65 (8). 64-68.
Rheinheimer. (1980). Aquatic Microbiology. A. Willey Inter Science Publication Chichester: 225 pp.
Rollins, D.M. & Joseph, S.W. (2000). Basic Mechanisms of Antibiotic Action and
Resistance. [Online]. Diakses dari:
http://www.life.umd.edu/classroom/bsci424/Chemotherapy/AntibioticMe hanisms.htm.
Rukayadi, Y., Shim, J. S. & Hwang, J. K. (2008). Screening of Thai medicinal plants for anticandidal activity. Journal Compilation Mycoses. 51 (4). 308-312.
Rukayadi, Y., Lee, K., Han, S., Kim, S., Hwang, J. K. (2009). Antibacterial and Sporicidal Activity of Macelignan Isolated from Nutmeg (Myristica fragrans Houtt.) against Bacillus cereus. Food Science and Biotechnology. 18 (5). 1301-1304.
Russell, A. D. (1982). The destruction of bacterial spores. [Online]. Diakses dari: https://books.google.co.id/books?hl=en&lr=&id=pRO6QPKuZpcC&oi=fn d&pg=PA451&dq=The+destruction+of+bacterial+spores&ots=Ahjb0jHtO
E&sig=HF0Fd-6dSFF494CXQ9ePnURyTY8&redir_esc=y#v=onepage&q=The%20destru ction%20of%20bacterial%20spores&f=false
Salle, A. J. (1984). Fundamental of Principle of Bacteriology. New Delhi: McGraw Hill Publishing Company 812 pp.
Satroamidjojo. (2001). Obat Asli Indonesia. Jakarta: Dian Rakyat.
Schlegel, H. G & Zaborosch, C. (1993). General Biology. [Online]. Diakses dari: https://books.google.co.id/books?id=DrHQtIbiunkC&printsec=frontcover &dq=basic+microbiology&hl=en&sa=X&ei=M0tcVfy0FJS1uQSmw4Lw BQ&ved=0CCsQ6AEwAw#v=onepage&q=basic%20microbiology&f=fal se
Setlow, B. & Setlow, P. (1996). Role of DNA Repair in Bacillus subtilis Spore Resistance. Journal of Bacteriology. 178 (12). 3486-3495.
Shibazaki A., Omoto, Y., Kudo, T., Yaguchi, T., Saito, A., Ando, A., Mikami, Y., Gonoi, T. (2011). Streptomyces coacervatus sp. nov., isolated from the intestinal tract of Armadillidium vulgare. International Journal of Systematic and Evolutionary Microbiology. 61. 1073–1077.
Silva, M. L. A., Coímbra, H. S., Pereira, A. C., Almeida, V. A., Lima, T. C., Costa, E. S., Vinhólis, A. H. C., Royo, V. A., Silva, R., Filho, A. A. S., Cunha, W. R., Furtado, N. A. J. C., Martins, C. H. G., Carvalho, T. C., Bastos, J. K. (2007). Evaluation of Piper cubeba extract, (-)-cubebin and its semi-synthetic derivatives against oral pathogens. Phytotheraphy Research. 21 (5), 420–422.
Singh, G. S. & Pandeya, S. N. (2011). Natural products in discovery of potential and safer antibacterial agents. Research signpost. 37 (2). 63-101.
61
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Slepecky, R. A. & Hemphill, H. E. (2006). “The Genus Bacillus Nonmedical”. Prokariot. 4. 530-562.
Stansfield, W. D, Cano, R. J & Colome. J. S. (2006). Biologi Molekuler dan Sel. Jakarta: Erlangga
Tamadher, M. K. Al-Tememy. (2013). Antibacterial Activity Of Piper cubeba Linn. Fruit Extracts Against Selected Bacterial Pathogens In Basrah City. Basrah Journal of Veterinary Research. 12 (1). 142-151.
Tennen, R., Setlow, B., Davis, K.L., Loshon, C.A., Setlow, P. (2000). Mechanisms of killing of spores of Bacillus subtilis by iodine, glutaraldehyde and nitrous acid. Journal of Applied Microbiology. 89. 330-338.
The Global Biodiversity Information Facility: GBIF Backbone Taxonomy. (2013). Firmicutes. [Online]. Diakses dari: http://www.gbif.org/dataset/d7dddbf4-2cf0-4f39-9b2a-bb099caae36c
Tjitrosoepomo, G. (2009). Morfologi Tumbuhan. Yogyakarta: Gadjah Mada University Press.
Todar, K. (2008). Bacillus cereus Food Poisoning. Online Textbook of
Bacteriology. [Online]. Diakses dari:
http://textbookofbacteriology.net/B.cereus.html
Todar, K. (2008). Bacillus cereus spore stain. Online Textbook of
Bacteriology. [Online]. Diakses dari:
http://textbookofbacteriology.net/B.cereus.html
UNL Food. (2014). How Food Spoils. [Online]. Diakses dari: https://food.unl.edu/safety/spoilage
U. S. Enviromental Protection Agency. (1997). Bacillus subtilis Final Risk
Assesment. [Online]. Diakses dari:
http://www.epa.gov/biotech_rule/pubs/fra/fra009.htm
Valgas, C., de Souza, S. M., Smânia, E. F. A., Smânia Jr., A. (2007). Screening Methods to Determine Antibacterial Activity Of Natural Products. Brazilian Journal of Microbiology. 38. 369-380.
Vanden Berghe, D. A.& Vlietinck, A. J. (1991). Screening methods for antibacterial and antiviral agents from higher plants. In: Dey, P.M., Harbone, J.D. (eds), Methods in Plant Biochemistry, Academic Press, London. 47-69.
Vinter, V. & Slepecky, R. A. (1965). Direct transition of outgrowing bacterial spores to new sporangia without intermediate cell division. Journal of. Bacteriology. 90. 803–807.
Weiss, E. A. (2002). Spice Crops. New York: Cabi Publishing.
63
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu Lampiran 1. Ekstraksi Kemukus
Berat kemukus kering : 100 g
Pelarut : Metanol 100%
Rendemen ekstraksi : 7,61%
Bentuk ekstrak : Cairan kental
Warna ekstrak : Coklat gelap
Lampiran 2. Data Uji Disk Diffusion
No. Bakteri Diameter zona hambat (mm)
Kemukus 1% Kemukus 10% CHX DMSO
1 B. cereus
ATCC 33019 7 7 6,5 10 10 10 11 11 9,5 0 0 0
2 B. subtilis
ATCC 6633 8 8 9 10 11 13 11 11 12 0 0 0
Lampiran 3. Data Koloni Spora Tumbuh pada Pengujian Antispora Ekstrak Kemukus
Bacillus cereus
Waktu Inkubasi
Konsentrasi Ekstrak Kemukus
0% 1% 2%
10-1 10-1 10-2 10-2 10-1 10-1 10-2 10-2 10-1 10-1 10-2 10-2
0 jam 126 139 0 0 142 152 0 0 149 186 0 0
1 jam 116 70 0 31 87 154 0 0 90 113 0 0
Bacillus subtilis
Waktu Inkubasi
Konsentrasi Ekstrak Kemukus
0% 1% 2%
Lampiran 4. Pengolahan Data Uji Disk Diffusion pada B. cereus
1. Uji Normalitas
One-Sample Kolmogorov-Smirnov Test
Unstandardized
Residual
N 12
Normal Parametersa Mean .0000000
Std. Deviation 1.70293864
Most Extreme Differences Absolute .294
Positive .228
Negative -.294
Kolmogorov-Smirnov Z 1.020
Asymp. Sig. (2-tailed) .249
a. Test distribution is Normal.
2. Uji Homogenitas
Test of Homogeneity of Variances zona.hambat
Levene Statistic df1 df2 Sig.
12.800 3 8 .002
Nilai α yang digunakan dalam pengujian adalah 0,05 dengan hipotesis: H0 = Data tidak homogen
H1 = Data homogen
H0 diterima jika nilai signifikansi < 0,05 (P < 0,05)
H0 ditolak jika P > 0,05, jadi H1 diterima
Nilai signifikansi pada pengujian adalah 0,002 yang berarti P < 0,05 maka
65
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu 3. Uji Kruskal Wallis
Uji homogenitas menunjukkan bahwa data tidak homogen, maka untuk uji
perbedaan dilakukan uji Kruskal Wallis.
Ranks larutan.u
ji N Mean Rank
zona.hambat dmso 3 2.00
k1% 3 5.00
k10% 3 9.00
chx 3 10.00
Total 12
Test Statisticsa,b zona.hambat
Chi-Square 9.804
df 3
Asymp. Sig. .020
a. Kruskal Wallis Test
b. Grouping Variable: larutan.uji
Nilai α yang digunakan dalam pengujian adalah 0,05 dengan hipotesis: H0 = Data tidak berbeda signifikan
H1 = Data berbeda signifikan
H0 diterima jika nilai signifikansi > 0,05 (P > 0,05)
H0 ditolak jika P < 0,05, jadi H1 diterima
Nilai signifikansi pada pengujian adalah 0,020 yang berarti P < 0,05 maka
Lampiran 5. Pengolahan Data Uji Disk Diffusion pada B. subtilis
1. Uji Normalitas
One-Sample Kolmogorov-Smirnov Test
Unstandardized
Residual
N 12
Normal Parametersa Mean .0000000
Std. Deviation 2.31398908
Most Extreme Differences Absolute .246
Positive .246
Negative -.160
Kolmogorov-Smirnov Z .851
Asymp. Sig. (2-tailed) .463
a. Test distribution is Normal.
2. Uji Homogenitas
Test of Homogeneity of Variances zona.hambat
Levene Statistic df1 df2 Sig.
4.533 3 8 .039
Nilai α yang digunakan dalam pengujian adalah 0,05 dengan hipotesis: H0 = Data tidak homogen
H1 = Data homogen
H0 diterima jika nilai signifikansi < 0,05 (P < 0,05)
H0 ditolak jika P > 0,05, jadi H1 diterima
Nilai signifikansi pada pengujian adalah 0,039 yang berarti P < 0,05 maka
67
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu 3. Uji Kruskal Wallis
Uji homogenitas menunjukkan bahwa data tidak homogen, maka untuk uji
perbedaan dilakukan uji Kruskal Wallis.
Ranks larutan.u
ji N Mean Rank
zona.hambat dmso 3 2.00
k1% 3 5.00
k10% 3 9.33
chx 3 9.67
Total 12
Test Statisticsa,b zona.hambat
Chi-Square 9.663
df 3
Asymp. Sig. .022
a. Kruskal Wallis Test
b. Grouping Variable: larutan.uji
Nilai α yang digunakan dalam pengujian adalah 0,05 dengan hipotesis: H0 = Data tidak berbeda signifikan
H1 = Data berbeda signifikan
H0 diterima jika nilai signifikansi > 0,05 (P > 0,05)
H0 ditolak jika P < 0,05, jadi H1 diterima
Nilai signifikansi pada pengujian adalah 0,022 yang berarti P < 0,05 maka
Lampiran 6. Uji Perbandingan Rata-rata (Uji T) Hasil Disk Diffusion B. cereus dan B. subtilis
1. Uji Normalitas
Tests of Normality
bakteri
Kolmogorov-Smirnova Shapiro-Wilk
Statistic df Sig. Statistic df Sig.
zona.hambat bc .253 9 .100 .829 9 .044
bs .205 9 .200* .933 9 .510
a. Lilliefors Significance Correction
*. This is a lower bound of the true significance.
Nilai α yang digunakan dalam pengujian adalah 0,05 dengan hipotesis: H0 = Data tidak terdistribusi normal
H1 = Data terdistribusi normal
H0 diterima jika nilai signifikansi < 0,05 (P < 0,05)
H0 ditolak jika P > 0,05, jadi H1 diterima
Nilai signifikansi pada pengujian adalah 0,100 dan 0,200 yang berarti P > 0,05
maka data terdistribusi normal.
2. Uji Homogenitas
Test of Homogeneity of Variance
Levene Statistic df1 df2 Sig.
zona.hambat Based on Mean .082 1 16 .778
Based on Median .000 1 16 1.000
Based on Median and with
adjusted df .000 1 15.611 1.000
69
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu Nilai α yang digunakan dalam pengujian adalah 0,05 dengan hipotesis: H0 = Data tidak homogen
H1 = Data homogen
H0 diterima jika nilai signifikansi < 0,05 (P < 0,05)
H0 ditolak jika P > 0,05, jadi H1 diterima
Nilai signifikansi pada pengujian adalah 0,778 yang berarti P > 0,05 maka
data homogen.
3. Uji T
Nilai α yang digunakan dalam pengujian adalah 0,05 dengan hipotesis: H0 = Data tidak berbeda signifikan
H1 = Data berbeda signifikan
H0 diterima jika nilai signifikansi > 0,05 (P > 0,05)
H0 ditolak jika P < 0,05, jadi H1 diterima
Nilai signifikansi pada pengujian adalah 0,159 yang berarti P > 0,05 maka
Lampiran 7. Pengolahan Data Uji Antispora Ekstrak Kemukus 1% dan 10% Terhadap Spora B. cereus
1. Uji Normalitas
One-Sample Kolmogorov-Smirnov Test
Unstandardized
Residual
N 24
Normal Parametersa Mean .0000000
Std. Deviation 3.36811812E4
Most Extreme Differences Absolute .225
Positive .225
Negative -.131
Kolmogorov-Smirnov Z 1.102
Asymp. Sig. (2-tailed) .176
a. Test distribution is Normal.
2. Uji Homogenitas
A. Perbandingan Jumlah Spora Terhadap Konsentrasi Ekstrak
Test of Homogeneity of Variances spore_amount
Levene Statistic df1 df2 Sig.
.347 2 21 .711
Nilai α yang digunakan dalam pengujian adalah 0,05 dengan hipotesis: H0 = Data tidak homogen
H1 = Data homogen
H0 diterima jika nilai signifikansi < 0,05 (P < 0,05)
71
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Nilai signifikansi pada pengujian adalah 0,711 yang berarti P > 0,05 maka
data homogen.
B. Perbandingan Jumlah Spora Terhadap Waktu Inkubasi
Test of Homogeneity of Variances spore_amount
Levene Statistic df1 df2 Sig.
.362 1 22 .554
Nilai α yang digunakan dalam pengujian adalah 0,05 dengan hipotesis: H0 = Data tidak homogen
H1 = Data homogen
H0 diterima jika nilai signifikansi < 0,05 (P < 0,05)
H0 ditolak jika P > 0,05, jadi H1 diterima
Nilai signifikansi pada pengujian adalah 0,554 yang berarti P > 0,05 maka
data homogen.
3. Uji Oneway ANOVA
A. Perbandingan Jumlah Spora Terhadap Konsentrasi Ekstrak
ANOVA spore_amount
Sum of Squares df Mean Square F Sig.
Between Groups 8.962E8 2 4.481E8 .364 .699
Within Groups 2.586E10 21 1.231E9
Total 2.676E10 23
Nilai α yang digunakan dalam pengujian adalah 0,05 dengan hipotesis: H0 = Data tidak berbeda signifikan
H0 diterima jika nilai signifikansi > 0,05 (P > 0,05)
H0 ditolak jika P < 0,05, jadi H1 diterima
Nilai signifikansi pada pengujian adalah 0,699 yang berarti P > 0,05 maka
data tidak berbeda signifikan.
B. Perbandingan Jumlah Spora Terhadap Waktu Inkubasi
ANOVA spore_amount
Sum of Squares df Mean Square F Sig.
Between Groups 843750.000 1 843750.000 .001 .979
Within Groups 2.676E10 22 1.216E9
Total 2.676E10 23
Nilai α yang digunakan dalam pengujian adalah 0,05 dengan hipotesis: H0 = Data tidak berbeda signifikan
H1 = Data berbeda signifikan
H0 diterima jika nilai signifikansi > 0,05 (P > 0,05)
H0 ditolak jika P < 0,05, jadi H1 diterima
Nilai signifikansi pada pengujian adalah 0,979 yang berarti P > 0,05 maka
73
Hestiarahma Purnamasari, 2015
KEMUKUS (Piper cubeba L.) SEBAGAI ANTIBAKTERI TERHADAP SEL VEGETATIF DAN SPORA Bacillus cereus DAN Bacillus subtilis
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Lampiran 8. Pengolahan Data Uji Antispora Ekstrak Kemukus 1% dan 10% Terhadap Spora B. subtilis
1. Uji Normalitas
One-Sample Kolmogorov-Smirnov Test
Unstandardized
Residual
N 24
Normal Parametersa Mean .0000000
Std. Deviation 1.59480258E5
Most Extreme Differences Absolute .210
Positive .210
Negative -.121
Kolmogorov-Smirnov Z 1.028
Asymp. Sig. (2-tailed) .241
a. Test distribution is Normal.
2. Uji Homogenitas
A. Perbandingan Jumlah Spora Terhadap Konsentrasi Ekstrak
Test of Homogeneity of Variances spore_amount
Levene Statistic df1 df2 Sig.
.830 2 21 .450
Nilai α yang digunakan dalam pengujian adalah 0,05 dengan hipotesis: H0 = Data tidak homogen
H1 = Data homogen
H0 diterima jika nilai sig