MAKALAH SEMINAR UMUM
PANDANGAN MOLEKULER ATAS TOLERANSI TERHADAP SALINITAS TINGGI:
KASUS GANDUM DAN PADI
Disusun oleh :
Nama : Happy Dian Lestari
NIM : 09/281771/PN/11593
Dosen Pembimbing : Dr. Panjisakti Basunanda, S.P., M.P.
Hari dan Tanggal Presentasi : Kamis, 25 April 2013
PROGRAM STUDI PEMULIAAN TANAMAN JURUSAN BUDIDAYA PERTANIAN
FAKULTAS PERTANIAN UNIVERSITAS GADJAH MADA
YOGYAKARTA 2013
ii HALAMAN PENGESAHAN
PANDANGAN MOLEKULER ATAS TOLERANSI TERHADAP SALINITAS TINGGI:
KASUS GANDUM DAN PADI
OLEH:
Happy Dian Lestari 09/281771/PN/11593
Makalah seminar umum ini telah disahkan dan disetujui sebagai kelengkapan mata kuliah Seminar Umum (PNB 4085) pada semester II tahun ajaran 2012/2013 di Fakultas Pertanian, Universitas Gadjah Mada.
Menyetujui,
Dosen Pembimbing
Dr. Panjisakti Basunanda, S.P., M.P.
Tanda tangan
...
Tanggal
...
Mengetahui,
Komisi Seminar Umum Jurusan Budidaya Pertanian
Dr. Rudi Hari Murti, S.P., M.P.
Mengetahui,
... ...
Ketua Jurusan Budidaya Pertanian
Dr. Ir. Taryono, M. Sc. ... ...
1
INTISARI
Lahan dengan salinitas tinggi merupakan permasalahan kompleks dalam pertanian. Kadar ion Na+ yang berlebih pada tubuh tanaman menyebabkan gangguan, seperti penyerapan air dan unsur hara terhambat, mengganggu proses fotosintesis, yang akhirnya menghambat pertumbuhan tanaman tersebut. Pendekatan dari segi pemuliaan merupakan pendekatan yang dilakukan untuk mengetahui dan mengendalikan salinitas tinggi, dalam hal ini pada kasus tanaman gandum dan padi. Pendekatan dari segi pemuliaan, yaitu berdasarkan molekuler menggunakan QTL (Quantitative traits Loci) atau dikenal sebagai pemuliaan MAS (Marker Assisted Selection).
Mekanisme toleransi terhadap salinitas tinggi dapat dipahami dengan adanya protein HKT yang mampu menekan akumulasi ion Na+ agar tidak berlebih dan menyebabkan tanaman rentan terhadap salinitas tinggi. Pendekatan ini diharapkan dapat tercapai untuk mendapatkan tanaman yang toleran terhadap salinitas.
I. PENDAHULUAN
A. Latar Belakang
Pertanian di dunia sangat tergantung dengan irigasi. Permasalahan yang sering muncul berkaitan dengan irigasi yaitu salinitas tinggi. Salinitas yang tinggi akan menyebabkan penurunan hasil karena pertumbuhan dan perkembangan tanaman yang terhambat. Penurunan hasil disebabkan karena kondisi air yang tercekam sehingga akar tidak bisa menyerap dengan optimal, terdapat ion – ion tertentu dengan jumlah yang berlebihan sehingga bersifat toksik, serta ketidakseimbangan nutrisi di dalam tanah (Shannon, 1984, Gorham et al., 1985, Ashraf et al., 2008, Lenis et al., 2011).
Salinitas tinggi merupakan permasalahan kompleks karena tanah dan faktor lingkungan berkonstribusi terhadap akumulasi Na+ sehingga menyebabkan produksi menurun. Garam tersebut dihasilkan dari pelapukan batuan, serta penguapan air laut yang disebabkan oleh angin maupun hujan (James et al., 2012).
Pendekatan-pendekatan dalam mengatasi cekaman salinitas tinggi yaitu pendekatan dari segi teknologi dan pendekatan dari segi pemuliaan. Pendekatan dari segi teknologi hanya bersifat sementara karena dibutuhkan biaya yang cukup tinggi.
Pendekatan dari segi pemuliaan merupakan cara yang lebih tepat dan ekonomis untuk menciptakan strategi pemuliaan untuk ketahanan terhadap salinitas (Blum, 1988., Ashraf et al., 2008).
HKT merupakan gen yang berperan sebagai transporter dalam pengambilan Na+/K+ di apoplas. HKT juga berperan dalam menjaga homeostasis Na+/K+, sehingga jumlahnya tidak berlebihan dan menganggu aktivitas pertumbuhan tanaman (Hauser dan Horie, 2010).
2 Gandum durum (Triticum turgidum) merupakan gandum yang lebih sensitf terhadap salinitas tinggi dibandingkan dengan gandum roti (Triticum aestivum). Usaha yang dilakukan dalam meningkatkan toleransi terhadap salinitas tinggi pada gandum durum yaitu melakukan persilangan antara gandum durum dengan kerabat gandum lainnya yang toleran terhadap salinitas tinggi, sehingga diperoleh galur 149 sebagai penanda gandum tersebut toleran salinitas tinggi. Galur 149 ditemukan pada lokus Nax1 dan Nax2. Lokus Nax1 terletak di kromosom 2A sedangkan lokus Nax2 terletak di kromosom 5A. Lokus Nax1 mengindikasikan gen toleran terhadap salinitas tinggi pada gandum yaitu TmHKT1;4, sedangkan lokus Nax2 mengindikasikan gen toleran terhadap salinitas tinggi pada gandum yaitu Tm HKT1;5 (James et al., 2012).
Padi subspesies indica ‘Pokkali’ lebih sensitif terhadap salinitas tinggi dibandingkan dengan padi sub spesies japonica ‘Nipponbare’ yang memang toleran terhadap salinitas tinggi. Keduanya disilangkan untuk mendapatkan padi yang toleran terhadap salinitas tinggi. Padi yang toleran terhadap slainitas tinggi memiliki gen OsHKT1;4 dan OsHKT1;5 (Cotsaftis et al., 2012).
Perkembangan program pemuliaan dalam meningkatkan toleransi terhadap salinitas juga didukung dengan beberapa cara seperti teknik penyaringan (screening) yang efisien, identifikasi variabilitas genetik, pewarisan sifat tahan, serta strategi pemuliaan yang tepat untuk memindahkan sifat yang diinginkan (Foolad, 1999., Zhang and Blumwald, 2001., Ashraf and Akram, 2009., Uddin et al., 2011).
B. Tujuan
Membahas aspek molekular mekanisme ketahanan terhadap salinitas tinggi dan contoh pemanfaatannya pada serealia.
C. Kegunaan
Menjadi dasar bagi perbaikan genetik untuk merakit tanaman tahan terhadap salinitas tinggi.
3 II. PANDANGAN MOLEKULER ATAS TOLERANSI TERHADAP
SALINITAS TINGGI: KASUS GANDUM DAN PADI
1. Salinitas Tinggi
Kondisi salinitas tinggi, terutama di Australia menjadi permasalahan kompleks karena mengakibatkan penurunan hasil tanaman gandum lebih dari 20%. Hal ini dikarenakan pada tanah salin, kandungan Na+ sangat tinggi dan diserap oleh tanaman sampai ke permukaan daun yang akhirnya mengganggu proses fotosintesis, sehingga dibutuhkan tanaman gandum yang toleran terhadap salinitas tinggi sehingga dapat meningkatkan produktivitas. Lahan dengan salinitas tinggi merupakan permasalahan yang kompleks dalam pertanian. Hal ini diperhatikan karena kelebihan garam dapat menghambat pertumbuhan tanaman dengan cara menghalangi kemampuan tanaman untuk menyerap air dan unsur hara (Materechera, 2011).
Salinitas tinggi terjadi terjadi karena konsentrasi garam terlarut yang berlebihan dalam tanaman, dan biasanya terjadi pada kondisi tanah salin. Salinitas tinggi juga mengakibatkan tanaman mati. Garam yang dapat menimbulkan salinitas tinggi yaitu NaCl, karena adanya akumulasi Na+ berlebih di dalam tubuh tanaman tersebut (Follet et al., 1981 cit Sipayung, 2006).
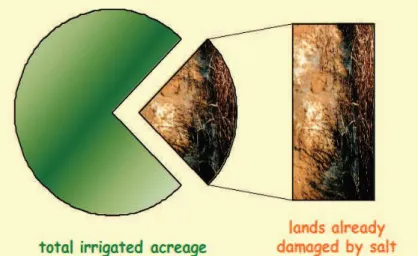
Tanah salin terjadi karena irigasi yang dikombinasikan dengan drainase yang buruk (gambar 1), sehingga menjadi permasalahan serius karena menyebabkan kehilangan lahan pertanian produktif (Zhu, 2007 cit Carillo et al., 2011).
Gambar 1. Persentase lahan yang rusak akibat salinitas tinggi (Carillo et al., 2011).
4 Tabel 1. Pengaruh tingkat salinitas pada tanaman
No. Tingkat Salinitas Konduktivitas (mmhos) Pengaruh Terhadap Tanaman
1 Non Salin 0-2 Dapat diabaikan
2 Rendah 2-4 Tanaman yang peka terganggu
3 Sedang 4-8 Kebanyakan tanaman terganggu
4 Tinggi 8-16 Tanaman yang toleran belum
terganggu
5 Sangat Tinggi > 16 Beberapa tanaman toleran tumbuh Sumber: Follet et al., 1981 cit Sipayung, 2006
Tingkatan salinitas dibagi menjadi lima macam dengan dampak yang berbeda terhadap tanaman (tabel 1) (Follet et al., 1981 cit Sipayung, 2006). Toleransi terhadap salinitas merupakan sifat yang dipengaruhi oleh faktor genetik dan lingkungan. Salah satunya dengan menggunakan penanda molekuler gen atau lokus sifat kuantitatif (QTL) yang mempengaruhi suatu sifat untuk lebih mudah teridentifikasi, sehingga dapat digunakan dalam meningkatkan efisiensi pemuliaan melalui seleksi penanda (MAS) (Ashraf and Majid, 2013).
2. Mekanisme Toleransi oleh Tanaman secara Fisiologis
Salinitas tinggi memberikan dampak negatif bagi pertumbuhan dan perkembangan tanaman, yaitu dalam penyerapan air dan hara, proses metabolisme, perubahan anatomi dan morfologi, serta penurunan hasil atau produktivitas. Tanaman memberikan respon yang berbeda dalam menetralkan efek kelebihan garam tersebut, misalnya mengakumulasikan untuk menjaga keseimbangan ion – ion, mengatur osmoregulasi, dan produksi antioksidan (Mittler, 2002., Byrt et al., 2007., Ashraf et al,.
2008).
Seleksi langsung di lapangan tentang sifat kuantitatif yang toleran terhadap salinitas tinggi masih sulit dilakukan karena faktor lingkungan yang tidak terkendali.
Salah satu pendekatan dalam meningkatkan efisiensi program pemuliaan yaitu dengan mengadopsi kriteria seleksi yang baru berdasarkan pengetahuan dari proses fisiologis, yang menjadi pembatas dari produksi tanaman pada saat terpapar salinitas tinggi (Ashraf, 2004).
Tanaman yang terkena salinitas tinggi tidak hanya berdampak negatif bagi pertumbuhan akar, tetapi juga disertai dengan mengeringnya titik tumbuh. Terdapat dua alasan yang mendasari terjadinya penurunan pertumbuhan akar karena salinitas tinggi, yaitu hilangnya tekanan turgor untuk pertumbuhan sel karena potensial osmotik
5 media tumbuh lebih rendah dibanding potensial osmotik di dalam sel dan kematian sel (Katsuhara dan Kawasaki, 1996).
Respon tanaman terhadap salinitas tinggi memiliki kemiripan dengan respon tanaman terhadap cekaman kekeringan. Perubahan bentuk morfologi dan anatomi tanaman, seperti ukuran daun lebih kecil, jumlah stomata lebih sedikit, penebalan kutikula, dan lignifikasi akar lebih awal. Bentuk mekanisme fisiologisnya yaitu kemampuan tanaman menyesuaikan diri terhadap tekanan osmotik yang mencakup penyerapan maupun akumulasi ion-ion dan sintesis senyawa organik, mengatur konsentrasi garam dalam sitoplasma melalui transport membran, dan ketahanan relatif membran dalam mengatur transfer ion dari sitoplasma dan vakuola serta organel lainnya (Maas & Hoffman 1998).
3. Pemuliaan dengan Bantuan Teknik Molekuler untuk Memperbaiki Toleransi Salinitas
Penanda molekuler dengan mengidentifikasi lokus sifat kuantitatif (QTL), juga dapat digunakan sebagai kriteria seleksi tidak langsung dalam meningkatkan efisiensi pemuliaan melalui seleksi penanda molekuler (MAS). Penggunaan MAS dalam memanipulasi beberapa sifat yang lebih sederhana terbukti efisien dalam program pemuliaan. Penggunaan MAS untuk mengidentifikasi sifat yang lebih kompleks biasanya pada fase pertumbuhan tanaman. QTL yang mengidentifikasi sifat toleransi terhadap salinitas tinggi pada tanaman berbeda-beda, namun beberapa galur dengan toleransi salinitas tinggi telah dikembangkan melalui MAS (Ashraf dan Foolad, 2013).
Penelitian dilakukan pada spesies tanaman yang berbeda untuk mengidentifikasi QTL yang secara langsung atau tidak langsung mempengaruhi berbagai tanggapan tanaman terhadap salinitas tinggi pada tahap perkembangan yang berbeda. Bagian yang mengatur jalur sistem pengangkutan homeostasis ion dalam pertumbuhan tanaman pada kondisi salin yaitu SOS (Salt Overly Sensitive) (Hasegawa et al., 2000., Zhu, 2000).
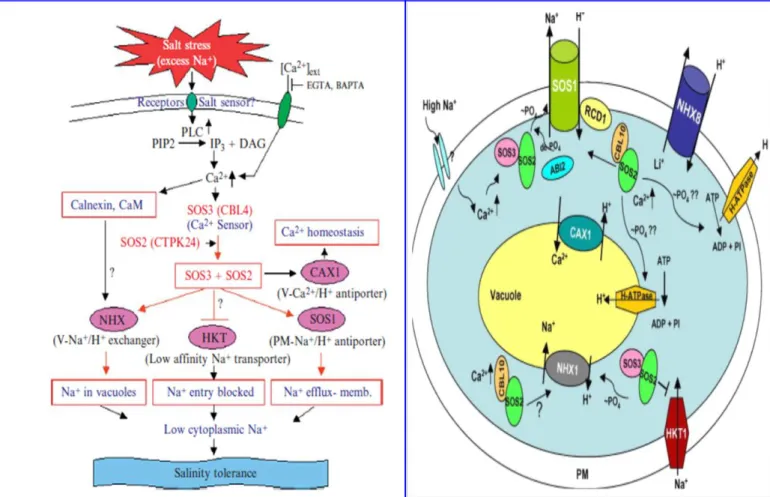
Penelitian Tuteja (2007) menunjukkan salinitas tinggi terjadi karena adanya akumulasi ion Na+ berlebih di dalam tubuh tanaman. Ion Na+ berlebih terdeteksi oleh reseptor di membran plasma. Ion Na+ yang berlebih akan menyebabkan ion Ca2+
berkurang. Berkurangnya ion Ca2 karena tertekan oleh EGTA atau BAPTA (asam amino karboksilat) yang menjaga agar ion Ca2+ tidak menurun jumlahnya. Pelepasan
6 Ca2+ ini karena peristiwa fosfolipase C (PLC) yang mengakibatkan hidrolisis fosfatydilinositol bifosfat (PIP2) menjadi inositol trifosfat (IP3) dan DAG. EGTA atau BAPTA ini menyebabkan ion Ca2+ tetap tinggi. SOS (Salt Overly Sensitive) terdapat tiga macam yaitu SOS1, SOS2 dan SOS3. SOS3 merupakan sensor Ca2+ yang mengatur protein calcineurin B. SOS2 merupakan serin/threonin protein kinase. SOS3- SOS2 bekerja sama untuk mengatur NHX, HKT, SOS1. NHX merupakan Na+/H+ yang berfungsi untuk menahan Na+ di vakuola. SOS1 ada di membran plasma yang merupakan Na+/H+ antiporter yang berfungsi untuk mengatur pelepasan Na+. HKT merupakan Histdin Kinase Transporter yang terletak di membran plasma dan berfungsi untuk menghambat masuknya Na+ ke sitosol. CAX1 merupakan Ca2+/H+ antiporter yang diaktivasi oleh SOS2 yang berfungsi untuk megatur homeostasis Ca2+. Adanya NHX, HKT, SOS1, dan CAX1 ini yang mengatur agar akumulasi Na+ rendah di sitosol, maka diperoleh tanaman yang toleran terhadap salinitas tinggi. Beberapa protein lain yaitu calnexin dan kalmodulin (CAM), berperan dalam mengikat Ca2+ (gambar 2).
Gambar 2. Mekanisme Toleransi terhadap Salinitas Tinggi (Sumber gambar: Tuteja, 2007).
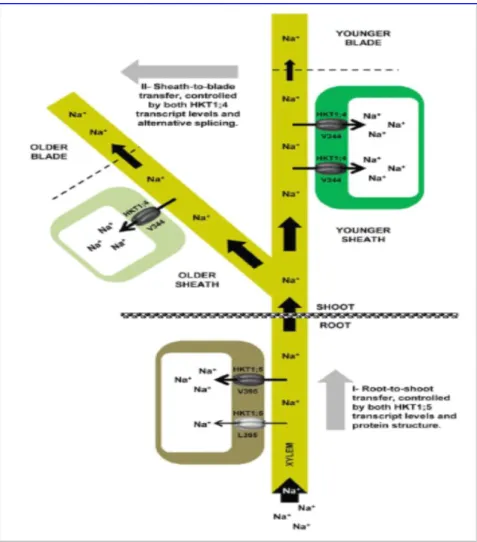
7 HKT berfungsi mengatur homeostasis Na+/K+ sehingga didapatkan tanaman yang toleran terhadap salinitas tinggi. Peranan OsHKT1;4 dan OsHKT1;5 sangat dibutuhkan dalam menciptakan tanaman toleran terhadap salinitas. OsHKT1;4 akan mengatur Na+ di bagian batang hingga helai daun, sedangkan OsHKT1;5 akan mengatur Na+ di bagian perakaran sehingga jumlah ion Na+ yang akan diserap batang dan daun tidak berlebihan jumlahnya. Mekanisme pelepasan Na+ pada tanaman padi dimulai dari bagian perakaran sampai ke bagian tajuk sangat kompleks (Cotsaftis et al., 2012).
Gambar 3. Mekanisme Pelepasan Na+ pada Tanaman Padi (Sumber gambar:
Cotsaftis et al., 2012).
Mekanisme pelepasan Na+ pada tanaman padi yang dikendalikan oleh OsHKT1;4 dan OsHKT1;5 (gambar 3). Akar menyerap air dan unsur hara, salah satunya ion Na+ dari dalam tanah lalu diakumulasikan ke bagian tubuh tanaman. Pada bagian akar, ion Na+ diserap namun sebagian di akumulasikan ke bagian perakaran sekitarnya. Pengakumulasian ion Na+ yang menyebar ke seluruh bagian perakaran
8 dilakukan oleh OsHKT1;5 agar ion tersebut tidak terakumulasi ke bagian batang dengan jumlah yang berlebihan. Ion-ion Na+ yang terakumulasi ke bagian batang akan dibagi menjadi 2 jalur, yaitu ditransfer ke bagian pelepah daun muda dan ke bagian pelepah daun tua. Ion-ion Na+ yang diakumulasikan ke bagian pelepah daun tua akan diatur oleh OsHKT1;4, sehingga ion tersebut tersimpan di pelepah daun dan tidak akan membahayakan pertumbuhan tanaman sedangkan Na+ yang diakumulasikan pada daun muda akan diatur oleh OsHKT1;4 yang akan mengakumulasikan sebagian ion Na+ ke bagian pelepah daun, sehingga jumlah Na+ yang menuju helai daun tidak berlebihan dan fotosintesis akan tetap berlangsung (Cotsaftis et al., 2012).
Tanaman gandum dan padi ada yang memiliki gen toleran terhadap salinitas tinggi, namun juga ada yang rentan terhadap salinitas tinggi. Tanaman gandum memiliki lokus genetik Nax1 berfungsi memindahkan Na+ dari xylem di bagian akar dan bagian pelepah daun. Lokus Nax2 berfungsi memindahkan Na+ dari xylem di bagian akar saja. Lokus Nax tersebut relatif terlihat pada gandum diploid seperti Triticum monococcum, namun tidak terlihat pada gandum modern. Lokus Nax1 terletak di kromosom 2A dan diidentifikasi membawa HKT7 (TmHKT1;4) sedangkan lokus Nax2 terletak di kromosom 5A dan diidentifikasi membawa HKT8 (TmHKT1;5).
Keduanya dihasilkan dari persilangan antara gandum durum (Triticum turgidum L.) dengan gandum roti (Triticum aestivum L.) melalui cara interspecific crossing dan MAS (Marker Assisted Selection) (James et al., 2011). Gandum durum tetraploid memiliki genom A dan B, sedangkan gandum roti hexaploid memiliki genom A, B, dan D. Gandum diploid yaitu T. monococcum hanya memiliki genom A. Persilangan ini menghasilkan gandum roti yang toleran terhadap salinitas tinggi (Munns et al., 2012).
Tanaman padi merupakan salah satu tanaman pokok yang penting dan dibutuhkan dalam jumlah besar. Tanaman padi yang toleran terhadap salinitas tinggi memiliki OsHKT yang berfungsi untuk mengatur homeostasis Na+/K+. OsHKT dihasilkan dari persilangan antara padi japonica ‘Nipponbare’ dengan padi indica
‘Pokkali’. OsHKT terdapat 2 macam yaitu OsHKT1 dan OsHKT2. OsHKT1 berfungsi mengatur masuknya Na+ tapi tidak mengatur masuknya K+. OsHKT2 berfungsi sebagai perantara masuknya Na+ dan K+ (Horie et al., 2001). Pada tanaman padi, HKT yang dimiliki yaitu OsHKT1;4 dan berfungsi sebagai Na+ transporter spesifik serta menghambat akumulasi Na+ berlebih di bagian daun sedangkan OsHKT1;5 berfungsi
9 sebagai Na+ transporter spesifik dan menghambat akumulasi Na+ berlebih di bagian akar (Cotsaftis et al., 2012).
HKT (Histidin Kinase Transporter) yaitu gen yang menyandikan transporter pada membran plasma sebagai perantara dalam pengambilan Na+/K+. HKT berfungsi untuk mengatur homeostasis Na+/K+ (Hauser dan Horie, 2010). HKT juga dimiliki oleh setiap tanaman, hanya saja tidak semua HKT tersebut aktif. Tanaman yang memiliki HKT aktif akan berperan dalam mengatur toleransi terhadap salinitas tinggi tidak hanya tanaman gandum dan padi, misalnya Arabidopsis thaliana L., bunga matahari, barley, tomat dan kedelai (Ashraf dan Foolad, 2013).
10
11
12 Gambar 4. Perbandingan Sekuens OsHKT1;4 pada fragmen DNA galur Padi. Po = Pokkali; NB = Nona Bokra; Ni = Nipponbare; KV = Kallurundai Vellai; Ka = Kalurundai; NSI = NSICRC106; and SAL = SAL208, IR29 dan FL478. Warna kuning atau biru menunjukkan sekuens homolog. Bagian yang ditandai di dalam kotak berwarna biru adalah kodon yang menyandikan residu Val. Bagian yang ditandai simbol kotak hitam menunjukkan bahwa ‘Nipponbare’ merupakan subspesies japonica, sedangkan delapan galur lainnya subspesies indica. Bagian yang dihilangkan (intron) merupakan bagian yang sudah tidak menyandikan protein dan ditunjukkan dengan simbol (-) (Sumber gambar : Cotsaftis et al., 2012).
13 Gambar 4 menunjukkan bahwa diketahui ‘Nipponbare’ termasuk subspesies japonica, sedangkan delapan galur lainnya termasuk subspesies indica. Terdapat dua bagian sekuens OsHKT1;4 yang berasal dari genom DNA sembilan galur padi. Bagian pertama (300 bp) diawali ujung 3’ pada ekson pertama sampai ujung 5’ pada intron pertama dan bagian kedua (500 bp) diawali pada ekson kedua sampai ujung 5’ pada ekson ketiga. Sekuens Ni-OsHKT1;4 berasal dari database. Tidak ada perbedaan yag teramati dari galur yang dianalisis selain terdapat mutasi titik pada intron kedua dari
‘Nipponbare’ yang menggambarkan adanya polimorfisme basa tunggal antara subspesies ‘japonica’ dengan ‘indica’. Simbol kotak berwarna hitam menunjukkan adanya perbedaan antara ‘Nipponbare’ dan delapan galur padi lainnya. Hal ini menandakan bahwa ‘Nipponbare’ subspesies japonica yang sensitif terhadap salinitas tinggi. Sekuens dideteksi dengan Align X (Invitrogen). Sekuens homolog ditunjukkan dengan warna kuning atau biru. Kodon yang menyandikan residu Val terletak pada posisi 344 dari OsHKT1;4 ditunjukkan dengan warna hijau di dalam kotak berwarna biru (Costaftis et al., 2012).
14 Gambar 5. Perbandingan Sekuens Protein OsHKT1;4. Warna kuning atau biru menunjukkan sekuens homolog. Bagian yang ditandai di dalam kotak berwarna biru adalah kodon yang menyandikan residu Val. Bagian yang ditandai simbol kotak hitam menunjukkan bahwa perbedaan sekuens protein Ni-OsHKT1;4 dan Po- OsHKT1;4. Bagian yang dihilangkan (intron) merupakan bagian yang sudah tidak menyandikan protein dan ditunjukkan dengan simbol (-) (Sumber gambar : Cotsaftis et al., 2012) (Sumber gambar: Costaftis et al., 2012).
Perbandingan sekuens protein OsHKT1;4 ‘Pokkali (Po) OsHKT1;4 menyandikan protein fungsional dan sekuens nukleotida yang ditranslasikan menjadi sekuens asam amino. (Gambar 5) Po-OsHKT1;4 menyandikan untuk 500 protein asam amino yang 99,8% homolog dengan protein OsHKT1;4 dari ‘Nipponbare’ (Ni). Salah satu perbedaan antara dua protein fungsional dari OsHKT1;4 ini yaitu penggantian simbol R menjadi Q pada posisi 110 di ‘Pokkali’ dan ditunjukkan di dalam kotak berwarna hitam. Struktur model dari protein OsHKT1;4 diprediksi bahwa penggantian ini terlokalisir di sitoplasma yang saling menghubungkan antar membran antara dua domain protein sehingga tidak mempengaruhi perpindahan Na+. Ni-OsHKT1;4 and Po- OsHKT1;4 kemudian dipadankan dengan prediksi sekuens protein terpotong yang dibuat berdasarkan varian-varian splicing. Sekuens prediksi ini ternyata lebih pendek 47 asam amino residu dan berbeda dari protein OsHKT1;4 lengkap pada 19 residu asam amino di ujung-C dan ditunjukkan di dalam simbol kotak berwarna merah.
Sekuens protein dideteksi dengan Align X (Invitrogen). Sekuens homolog ditunjukkan dengan warna kuning atau biru. Kodon yang menyandikan residu Val terletak pada posisi 344 dengan warna hijau dan simbol kotak berwarna biru (Costaftis et al., 2012).
15 4. Paralelisme Mekanisme Toleransi Terhadap Salinitas Antara Gandum dan
Padi
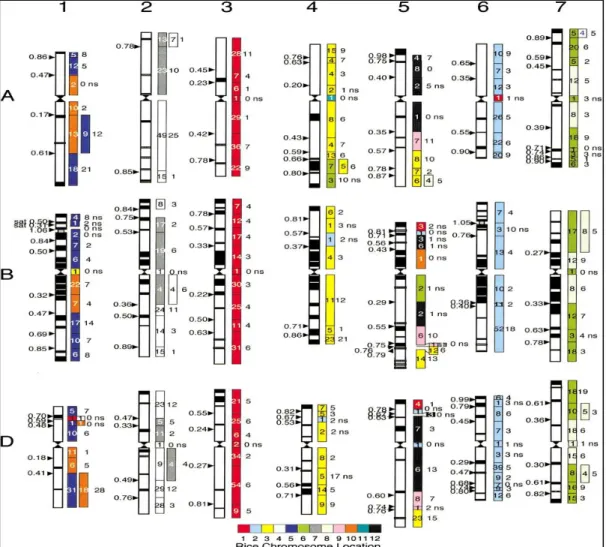
Mekanisme toleransi terhadap salinitas antara tanaman gandum dan padi ini memiliki kemiripan karena gen yang menyandikan toleransi tersebut sama. Hal ini terlihat dari hubungan genom antara gandum dan padi yang tertera pada (gambar 6) dan (gambar 7). Hubungan genom padi-gandum toleran terhadap salinitas tinggi yang memiliki kemiripan (gambar 6). Hal ini dikarenakan gen yang menyandikan toleransi terhadap salinitas tinggi sama, yaitu gen HKT1;4 dan HKT1;5. Kromosom padi ditunjukkan dengan warna-warna yang terdiri dari dua belas penomoran, sedangkan kromosom gandum ditunjukkan dengan kotak-kotak persegi panjang berwarna yang terdiri dari tujuh penomoran. Masing-masing kotak yang berwarna itu menunjukkan adanya kecocokan antara kromosom padi-gandum 80%. Kecocokan ini ditunjukkan dengan adanya warna kotak pada genom padi yang disesuaikan dengan warna kotak pada kromosom gandum. Simbol C merupakan letak sentomer padi (Sorrells et al., 2003).
Gambar 6. Hubungan Genom Padi-Gandum (Sumber gambar: Sorrells et al., 2003)
16 Hubungan genom gandum-padi menunjukkan bahwa terdapat tujuh kromosom dengan tiga genom yaitu genom A, B, dan D dengan dua belas kromosom padi dengan berbagai macam warna untuk menunjukkan lokasi (gambar 7). Kotak sebelah kiri menunjukkan adanya titik temu delesi. Kotak berwarna di sebalah kanan menunjukkan adanya kromosom gandum dan padi yang cocok. Kecocokan diantara keduanya ditandai dengan penomoran yan ada di dalam kotak berwarna yang disesuaikan dengan warna kotak lokasi kromosom. Genom A berasal dari T. monococcum, genom B berasal dari T. turgidum, dan genom D berasal dari T. aestivum (Sorrells et al., 2003).
Gambar 7. Hubungan Genom Gandum-Padi (Sumber gambar: Sorrells et al., 2003)
17 4. Hasil yang Dicapai
Pendeteksian gen-gen yang menyandikan toleransi terhadap salinitas tinggi dilakukan dengan menggunakan pendekatan QTL (Quantitative Trait Loci) atau lokus sifat kuantitatif (Ashraf dan Foolad, 2013).
Tabel 2: Identifikasi Lokus Sifat Kuantitatif (QTL) untuk Toleransi terhadap Salinitas
Tanaman Penanda
Molekuler
Lokus Sifat yang Diatur Sumber
Gandum (Triticum aestivum L.)
ESTs TmHKT17-A2 Mengurangi konsentrasi Na+ di helai daun dengan menahan Na+ di pelepah daun
Huang et al., 2006
SSR Nax1 Keduanya berperan dalam mengurangi pengambilan Na+ dan meningkatkan pengangkutan K+ ke xylem
Huang et al., 2006
Lindsay et al., 2004
EST Nax2
SSR Kna1 Mengatur perpindahan Na+/K+ dari akar ke batang dan menjaga rasio Na+/K+
Dubcovsky et al., 1996, Gorham et al.,1990
SSRs qRL-7, qBI-
1a dan qBI- 1b
Berperan pada panjang akar dan berat kering akar pada tahap persemaian
Sabouri and Sabouri, 2008
ESTs qSNC-7 dan
qSKC-1
Mempengaruhi konsentrasi Na+ dan K+ di batang Lin et al., 2004 Pushparajan et al., 2011
SSRs QNa, QNa:K, SKC1/OsHKT 8
Mengatur keseimbangan K+/ Na+ Ren et al., 2005
18 Padi (Oryza sativa L.)
SSRs qDM-3 dan
qDM-8, qSTR-6
Meningkatkan rasio Na+/K+ di bawah kondisi salin Sabouri et al., 2009
RFLPs, SSRs, AFLPs and isozymes
qST1 dan qST3
Mengahambat toleransi salinitas pada batang Enhance ST in shoots Lee et al., 2007
SSRs
qNAK-2 dan qNAK-6
Meningkatkan rasio Na+/K+ Ming-zhe et al.,
2005 SSRs Saltol dan
non-Saltol
Mengatur homeostasis Na+/K+ di batang Alam et al., 2011
SSRs Saltol Mengatur homeostasis Na+/K+ di batang Thomson et al., 2010
SSRs QKr1.2 Mengatur K+ di akar Ahmadi dan
Fotokian, 2011 Sumber : Ashraf dan Foolad, 2013
(Tabel 2) menunjukkan bahwa tanaman gandum dan padi memiliki lokus berbeda yang menandakan adanya gen toleran terhadap salinitas tinggi. Tanaman gandum memiliki TmHKT1;4 dan TmHKT1;5 yang menunjukkan toleransi terhadap salinitas tinggi dan kedua gen tersebut ada di lokus Nax1 dan Nax2. Tanaman padi memiliki OsHKT1;4 dan OsHKT1;5 yang menunjukkan toleransi
19 terhadap salinitas tinggi dan keduanya ada di lokus saltol. HKT yang aktif pada tanaman gandum dan padi tersebut mengakibatkan tanaman menjadi toleran terhadap salinitas tinggi (Ashraf dan Foolad, 2013).
Keterbatasan penggunaan penanda dalam meningkatkan toleransi terhadap salinitas disebabkan oleh beberapa hal diantaranya kurangnya usaha para pemulia dalam menciptakan tanaman toleran terhadap salinitas tinggi dibandingkan dengan usaha mereka dalam menciptakan tanaman tahan penyakit karena bernilai ekonomis lebih tinggi, kurangnya pengetahuan para pemulia tentang teknologi penanda, serta kurangnya informasi mengenai QTL untuk masing-masing tanaman. Seleksi genom yaitu seleksi berdasarkan genotipe penanda pada masing-masing tanaman menjadi lebih efektif dalam meningkatkan toleransi terhadap salinitas. Hal ini dikarenakan seleksi genom menggunakan data lengkap dari penanda sifat-sifat yang diinginkan tersebut, termasuk sifat toleran terhadap salinitas tinggi (Ashraf dan Foolad, 2013).
20 III. PENUTUP
A. Kesimpulan
1. HKT merupakan gen penyandi toleransi terhadap salinitas tinggi.
2. Pendekatan dengan QTL ini hanya efektif di awal. Hal ini dikarenakan penerapannya digunakan pada bagian awal saja untuk mengetahui sekuens gen tersebut.
3. Gen HKT pada gandum yaitu TmHKT1;4 dan TmHKT1;5 4. Gen HKT pada padi yaitu OsHKT1;4 dan OsHKT1;5
21 DAFTAR PUSTAKA
Ashraf, M. 2004. Some important physiological selection criteria for salt tolerance in plants. Flora. 199: 361–376.
Ashraf, M., H. R. Athar, P. J. C. Harris, and T. R. Kwon. 2008. Some prospective strategies for improving crop salt tolerance. Agronomy. 97: 45–110.
Ashraf, M., and N. A. Akram. 2009. Improving salinity tolerance of plants through conventional breeding and genetic engineering: an analytical comparison.
Biotechnology. 27: 744–752.
Ashraf, M. and Majid R. Foolad. 2013. Crop breeding for salt tolerance in the era of molecular markers and marker-assisted selection. Plant Breeding. 132: 10-20.
Blum, A. 1988. Plant Breeding for Stress Environment. CRC Press, Boca Raton, FL.
Byrt, C. S., J. D. Platten, W. Spielmeyer, R. A. James, E. S. Lagudah, E. S. Dennis, M.
Tester, and R. Munns. 2007. HKT1;5-like cation transporters linked to Na+ exclusion loci in wheat, Nax2 and Kna1. Plant Physiology. 143: 1918–1928.
Carillo P., Maria G.A., Giovanni P., Amodio F., dan Pasqualina W. 2011. Salinity Stress and Salt Tolerance, Abiotic Stress in Plants - Mechanisms and Adaptations. InTech, Eropa.
Cotsaftis, O., D. Plett, N. Shirley, M. Tester, dan M. Hrmova. 2012. A Two-Staged Model of Na+ Exclusion in Rice Explained by 3D Modeling of HKT Transporters and Alternative Splicing. Plos One. 7(7): 39865.
Foolad, M. R. 1999. Comparison of salt tolerance during seed germination and vegetative growth in tomato by QTL mapping. Genome. 42: 727–734.
Gorham, J., R. G. W. Jones, and E. McDonnell. 1985. Some mechanisms of salt tolerance in crop plants. Plant Soil. 89: 15–40.
Hasegawa, P.M., R.A. Bressan, J.K. Zhu, and H.J. Bohnert. 2000. Plant cellular and molecular responses to high salinity. Rev. Plant Physiology. Plant Molecular Biology. 51: 463-499.
Hauser F., dan Horie T. 2010. A conserved primary salt tolerance mechanism mediated by HKT transporters: a mechanism for sodium exclusion and maintenance of high K+/Na+ ratio in leaves during salinity stress. Plant, Cell and Environment. 33: 552–
565.
Horie, T., K. Yoshida, H. Nakayama, K. Yamada, S. Oiki dan A. Shinmyo. 2001.
Characterization of a HKT-type transporter in rice as a general alkali cation transporter. The Plant Journal. 31(4): 529-542.
22 James, R.A., Carol B., Caitlin S.B., dan Rana M. 2012. Major genes for Na+ exclusion, Nax1 and Nax2 (wheat HKT1;4 and HKT1;5), decrease Na+ accumulation in bread wheat leaves under saline and waterlogged conditions. Journal of Experimental Botany. 62(8): 2939–2947.
Katsuhara, M. dan T. Kawasaki. 1996. Salt Stress Induced Nuclear and DNA Degradation in Meristematic Cells of Barley Roots. Plant Cell Physiology. 37(2) : 169-173.
Lenis, J. M., M. Ellersieck, D. G. Blevins, D. A. Sleper, H. T. Nguyen, D. Dunn, J. D.
Lee, and J. G. Shannon. 2011. Differences in ion accumulation and salt tolerance among Glycine accessions. Journal Agronomy Crop Science. 197: 302–310.
Materechera, S.A. 2011. Soil salinity in irrigated fields used for urban agriculture under a semi-arid environment of South Africa. African Journal of Agricultural Research.
6(16): 3747-3754.
Mittler, R. 2002. Oxidative stress, antioxidants and stress tolerance. Trends Plant Science.
7: 405–410.
Marschner, H. 1995. Mineral Nutrition of Higher Plants, 2nd ed. Academic Press, London.
Munns, R., Richard A.J., Bo Xu, Asmini A., Simon J.C., Charlotte J., Caitlin S.B., Ray A.H., Stephen D.T., Mark T., Darren P., dan Matthew G. 2012. Wheat grain yield on saline soils is improved by an ancestral Na+ transporter gene. Nature Biotechnology. 30(4): 360-366.
Shannon, M. C. 1984. Breeding, selection and the genetics of salt tolerance. In: R. C.
Staples, and G. H. Toenniessen (eds), Salinity Tolerance in Plants. 231–254.
Sipayung, R. 2006. Cekaman Garam. <http://library.usu.ac.id/download/fp/bdp- rosita2.pdf>. Diakses tanggal 06 April 2013.
Tuteja, N. 2007. Mechanisms of High Salinity Tolerance in Plants, chapter twenty- four.
Methods in Enzymology. 428: 419-438.
Uddin, K. M., A. S. Juraimi, M. R. Ismail, R. Othman, and A. A. Rahim. 2011. Relative salinity tolerance of warm season turf grass species. Journal Environmental Biology 32: 309–312.
Zhang, H. X., and E. Blumwald. 2001. Transgenic salt-tolerant tomato plants accumulate salt in foliage but not in fruit. National Biotechnology 19: 765–768.
Zhu, J. K. 2000. Genetic analysis of plant salt tolerance using Arabidopsis. Plant Physiology. 124: 941–948.
23 LAMPIRAN DISKUSI SEMINAR
1. Hidayatur Rokhman (11615)
Pertanyaan :Bagaimana cara membaca hubungan genom padi-gandum?
Jawab : Dengan melihat 12 kromosom padi dan ada 7 kotak berwarna yang menunjukkan kromosom gandum. Lalu dilihat warna kromosom padi yang sama dengan warna kromosom gandum. Warna yang sama inilah menunjukkan adanya kemiripan antara genom padi-gandum.
2. Dharmesta Adhiwira (10321)
Pertanyaan : Pada Hubungan genom padi dan gandum, ABD itu sebagai apa?
Tau gen HKT itu darimana?
Jawab : Simbol A, B, D itu merupakan genom pada gandum. Genom A berasal dari T. monococcum, genom B berasal dari T. turgidum, dan genom D berasal dari T.
aestivum.
Setiap tanaman sebenarnya memiliki HKT. Hanya saja tidak semua HKT pada setiap tanaman itu aktif.
3. Rizqi Fadhilah Romadhona (11879)
Pertanyaan : Berdasarkan apa QTL dikatakan efektif?
Jawab : Sebenarnya tidak 100% efektif. Dikatakan efektif pada saat penggunaan awal saja, karena membantu dalam mengetahui sequence dari masing-masing tanaman dan HKT itu sendiri.
4. Enik Nurlaily Afifah (11848)
Pertanyaan : Padi yang toleran terhadap salinitas itu apakah hasil rekayasa genetik atau memang asli?
Jawab : Itu terjadi secara alami. Sebenarnya pada tanaman padi itu sudah memiliki gen toleran terhadap salinitas. Kemudian dilakukan persilangan dengan tanaman yang sudah tahan (sudah ada HKT) sehingga didapatkan gen yang toleran terhadap salinitas.
6. Idham Cholid Ramadhan
Pertanyaan : Jelaskan secara sederhana tentang HKT transporter?
Jawab : HKT merupakan Histidin Kinase Transporter yang berfungsi untuk mengatur akumulasi Na+ agar tidak berlebih di dalam tubuh tanaman. Ini bersifat potensial karena berlaku untuk semua jenis tanaman.