BAB II
TINJAUAN PUSTAKA
2.1 Durian
Durian adalah nama tumbuhan tropik yang berasal dari Asia Tenggara, sekaligus nama buahnya yang bisa dimakan. Nama ini diambil dari ciri khas kulit buahnya yang keras dan berlekuk-lekuk tajam sehingga menyerupai duri. Varian namanya yang juga populer adalah duren. Orang Sunda menyebutnya kadu. Sesungguhnya, tumbuhan dengan nama ini bukanlah spesies tunggal tetapi sekelompok tumbuhan dari marga (genus) Durio Namun umumnya, yang dimaksud dengan durian biasa (tanpa imbuhan apa-apa) adalah yang memiliki nama ilmiah Durio zibethinus. Sedangkan jenis-jenis durian lain yang dapat dimakan dan kadangkala ditemukan di pasaran setempat di Asia Tenggara di antaranya D. kutejensis (lai), D. oxleyanus (kerantungan), D. graveolens (durian kura-kura atau kekura), serta D. dulcis (lahung).
Banyak orang menganggap buah durian sebagai buah yang enak. Masyarakat sering menyebutnya "raja buah-buahan". Akan tetapi sebagian orang tidak tahan akan baunya dan menganggapnya berbau busuk . Durian terutama dipelihara orang untuk buahnya, yang umumnya dimakan adalah arilus atau salut bijinya dalam keadaan segar. Salut biji ini umumnya manis dan sangat bergizi karena mengandung banyak karbohidrat, lemak, protein dan mineral (http://id.wikipedia.org/wiki/Durian).
Berikut kandungan durian tiap 100 gram daging buah : Air 64,99 g, Energi 147 kcal, Protein 1,47 g, Lipid 5,33g, Karbohidrat 27,09 g, Serat 3,8 g, Ca 6 mg, Fe 0,43 mg, Mg 30 mg, P 39 mg, K 436 mg, Na 2 mg, Zn 0,28 mg, Cu 0,207 mg, Mn 0,325 mg, Vitamin C 19,7 mg, Thiamin 0,379 mg, Riboflavin 0,200 mg, Niacin 1,074 mg, Asam
Pantotenat 0,23 mg, Vitamin B-6 0,316 mg, Vitamin B-12 0,00 mg, Folat 217 mcg, Kolesterol 0 mg, karoten 138 mcg, karoten 36 mcg (USDA, 2008).
Berikut adalah klasifikasi ilmiah
dari durian Kingdom : Plantae
Class : Magnoliophyta
Ordo : Magnoliopsida
Family : Bombacea
Genus : Durio
Species : Durio zibethinus (http://id.wikipedia.org/wiki/Durian).
2.2 Natrium
Natrium adalah kation utama dalam cairan ekstraselular dan hanya sejumlah kecil natrium berada dalam cairan intraselular (Suhardjo dan Kusharto, 1992).
Makanan sehari – hari biasanya cukup mengandung natrium yang dibutuhkan tubuh. Oleh karena itu, tidak ada penetapan kebutuhan natrium sehari. Taksiran kebutuhan natrium sehari untuk orang dewasa adalah sebanyak 500 mg. Kebutuhan natrium didasarkan pada kebutuhan untuk pertumbuhan, kehilangan natrium melalui keringat dan sekresi lain. WHO (1990) menganjurkan pembatasan konsumsi garam dapur hingga 6 gram sehari (ekivalen dengan 2400 mg natrium). Pembatasan ini dilakukan karena peranan potensial natrium dalam menimbulkan tekanan darah tinggi (Almatsier, 2001)
Natrium juga menjaga keseimbangan asam basa didalam tubuh dengan mengimbangi zat – zat yang membentuk asam. Natrium berperan dalam transmisi saraf dan kontraksi otot. Natrium berperan pula dalam absorpsi glukosa dan sebagai alat
angkut zat – zat gizi lain melalui membran, terutama melalui dinding usus (Almatsier, 2001)
2.3 Kalium
Kalium merupakan ion bermuatan positif, akan tetapi berbeda dengan natrium, kalium terutama terdapat didalam sel, sebanyak 95% kalium berada di dalam cairan intraseluler (Almatsier, 2001). Peranan kalium mirip dengan natrium, yaitu kalium bersama – sama dengan klorida membantu menjaga tekanan osmotis dan keseimbangan asam basa. Bedanya, kalium menjaga tekanan osmotik dalam cairan intraselular (Winarno, 1995).
Absorpsi kalium dari makanan adalah secara pasif dan tidak memerlukan mekanisme spesifik. Absorpsi berlangsung di usus kecil selama konsentrasi di saluran cerna lebih tinggi daripada didalam darah.
Ginjal adalah regulator utama kalium didalam tubuh yang menjaga kadarnya tetap didalam darah dengan mengontrol eksresinya. Kadar kalium yang tinggi dapat meningkatkan eksresi natrium, sehingga dapat menurunkan volume darah dan tekanan darah (Anonim,2004)
Kalium merupakan bagian essensial semua sel hidup, sehingga banyak terdapat dalam bahan makanan. Kebutuhan minimum akan kalium ditaksir sebanyak 2000 mg sehari. Kalium terdapat dalam semua makanan mentah/segar, terutama buah, sayuran dan kacang – kacangan (Almatsier, 2001).
2.4 Kalsium
Peranan kalsium dalam tubuh pada umumnya dapat dibagi dua, yaitu membantu membentuk tulang dan gigi dan mengukur proses biologis adalam tubuh. Keperluan
kalsium terbesar pada waktu pertumbuhan, tetapi juga keperluan – keperluan kalsium masih diteruskan meskipun sudah mencapai usia dewasa. Pada pembentukan tulang, bila tulang baru dibentuk, maka tulang yang tua dihancurkan secara simultan.
Kalsium yang berada dalam sirkulasi darah dan jaringan tubuh berperanan dlam berbagai kegiatan, diantaranya untuk transmisi impuls syaraf, kontraksi otot, penggumpalan darah, pengaturan permeabilitas membran sel serta keaktifan enzim (Winarno,1992).
2.5 Hubungan antara Natrium dan Kalium dengan tekanan darah
Pengeluaran air dari tubuh diatur oleh ginjal dan otak. Hipotalamus mengatur konsentrasi garam didalam darah, dengan merangsang kelenjar pituitari mengeluarkan hormon antidiuretika (ADH). ADH dikelurkan bila volume darah atau tekanan darah terlalu rendah. ADH merangsang ginjal untuk menahan atau menyerap kembali air dan mengeluarkannya kembali kedalam tubuh.
Bila terlalu banyak air keluar dari tubuh, volume darah dan tekanan darah akan turun. Sel –sel ginjal akan mengeluarkan enzim renin. Renin mengaktifkan protein didalam darah yang dinamakan angiotensinogen kedalam bentuk aktifnya angiotensin. Angiotensin akan mengecilkan diameter pembuluh darah sehingga tekanan darah akan naik. Disamping itu angiotensin mengatur pengeluaran hormon aldosteron dari kelenjar adrenalin. Aldosteron akan mempengaruhi ginjal untuk menahan natrium dan air. Akibatnya, bila dibutuhkan lebih banyak air, akan lebih sedikit air dikeluarkan dari tubuh dan tekanan darah akan naik kembali (Almatsier, 2001).
Konsumsi natrium yang berlebih menyebabkan konsentrasi natrium didalam cairan ekstraselular meningkat. Untuk menormalkannya, cairan intraselular ditarik
keluar, sehingga volume cairan ekstraselular meningkat. Meningkatnya volume cairan ekstraselular tersebut menyebabkan meningkatnya volume darah (Astawan, 2003).
Disamping itu, konsumsi garam dalam jumlah yang tinggi dapat mengecilkan diameter dari arteri, sehingga jantung harus memompa lebih keras untuk mendorong volume darah yang meningkat melalui ruang yang semakin sempit dan akibatnya adalah hipertensi. Hal yang sebaliknya juga terjadi, ketika asuan natrium berkurang maka begitu pula volume darah dan tekanan darah pada beberapa individu (Hull, 1993).
Konsumsi kalium dalam jumlah yang tinggi, yang berasal dari buah – buahan dan sayur – sayuran dapat malindungi individu dari hipertensi. Asupan kalium yang meningkat akan menurunkan tekanan darah sistolik dan diastolik (Hull, 1993). Cara kerja kalium adalah kebalikan dari natrium. Konsumsi kalium yang banyak akan meningkatkan konsentrasinya didalam cairan intraselular, sehingga cenderung menarik cairan dari bagian ekstraselular dan menurunkan tekanan darah (Astawan, 2003).
Rasio kalium dan natrium dalam diet berperan dalam mencegah dan mengendalikan hipertensi. Bila buah – buahan dan sayur – sayuran segar ditingkatkan konsumsinya (makanan yang mengndung kalium) dan makanan yang
2.6 Spektrofotometri Serapan Atom
2.6.1 Teori Spektrofotometri Serapan Atom
Prinsip dasar Spektrofotometri serapan atom adalah interaksi antara radiasi elektromagnetik dengan sampel. Spektrofotometri serapan atom merupakan metode yang sangat tepat untuk analisis zat pada konsentrasi rendah (Khopkar, 1990). Teknik ini adalah teknik yang paling umum dipakai untuk analisis unsur. Teknik-teknik ini
didasarkan pada emisi dan absorbansi dari uap atom. Komponen kunci pada metode spektrofotometri Serapan Atom adalah sistem (alat) yang dipakai untuk menghasilkan uap atom dalam sampel. (Anonim, 2003)
Cara kerja Spektroskopi Serapan Atom ini adalah berdasarkan atas penguapan larutan sampel, kemudian logam yang terkandung di dalamnya diubah menjadi atom bebas. Atom tersebut mengapsorbsi radiasi dari sumber cahaya yang dipancarkan dari lampu katoda (Hollow Cathode Lamp) yang mengandung unsur yang akan ditentukan. Banyaknya penyerapan radiasi kemudian diukur pada panjang gelombang tertentu menurut jenis logamnya (Darmono,1995).
Larutan sampel diaspirasikan ke suatu nyala dan unsur-unsur di dalam sampel diubah menjadi uap atom sehingga nyala mengandung atom unsur-unsur yang dianalisis. Beberapa diantara atom akan tereksitasi secara termal oleh nyala, tetapi kebanyakan atom tetap tinggal sebagai atom netral dalam keadaan dasar (ground state). Atom-atom
ground state ini kemudian menyerap radiasi yang diberikan oleh sumber radiasi yang
terbuat oleh unsur-unsur yang bersangkutan. Panjang gelombang yang dihasilkan oleh sumber radiasi adalah sama dengan panjang gelombang yang diabsorpsi oleh atom dalam nyala. Absorpsi ini mengikuti hukum Lambert-Beer, yaitu absorbansi berbanding lurus dengan panjang nyala yang dilalui sinar dan konsentrasi uap atom dalam nyala. Kedua variabel ini sulit untuk ditentukan tetapi panjang nyala dapat dibuat konstan sehingga absorbansi hanya berbanding langsung dengan konsentrasi analit dalam larutan sampel. Teknik-teknik analisisnya yaitu kurva kalibrasi, standar tunggal dan kurva adisi standar (Anonim, 2003).
Aspek kuantitatif dari metode spektrofotometri diterangkan oleh hukum Lambert-Beer, yaitu:
A = ε . b . c atau A = a . b . c Dimana :
A = Absorbansi
ε = Absorptivitas molar (mol/L) a = Absorptivitas (gr/L)
b = Tebal nyala (nm) c = Konsentrasi (ppm)
Absorpsivitas molar (ε) dan absorpsivitas (a) adalah suatu konstanta dan nilainya spesifik untuk jenis zat dan panjang gelombang tertentu, sedangkan tebal media (sel) dalam prakteknya tetap. Dengan demikian absorbansi suatu spesies akan merupakan fungsi linier dari konsentrasi, sehingga dengan mengukur absorbansi suatu spesies konsentrasinya dapat ditentukan dengan membandingkannya dengan konsentrasi larutan standar.
2.6.2 Instrumentasi Spektrofotometri Serapan Atom
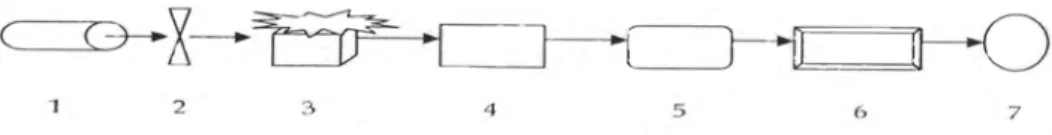
Alat spektrofotometer serapan atom terdiri dari rangkaian dalam diagram skematik berikut:
Gambar 1. Diagram Spektrometer Serapan Atom atau SSA (Syahputra, 2004) Keterangan : 1. Sumber sinar
2. Pemilah (Chopper)
4. Monokromator 5. Detektor 6. Amplifier
7. Meter atau recorder
Komponen-komponen Spektrofotometri Serapan Atom (SSA) 1. Sumber Sinar
Sumber radiasi SSA adalah Hallow Cathode Lamp (HCL). Setiap pengukuran dengan SSA kita harus menggunakan Hallow Cathode Lamp khusus misalnya akan menentukan konsentrasi tembaga dari suatu cuplikan. Maka kita harus menggunakan
Hallow Cathode khusus. Hallow Cathode akan memancarkan energi radiasi yang sesuai
dengan energi yang diperlukan untuk transisi elektron atom.
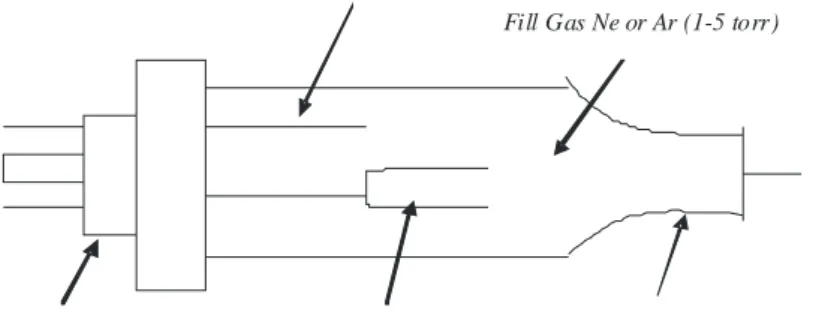
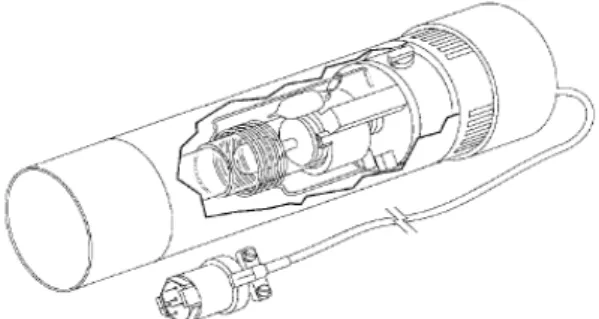
Hallow Cathode Lamp terdiri dari katoda cekung yang silindris yang terbuat dari unsur yang sama dengan yang akan dianalisis dan anoda yang terbuat dari tungsten. Dengan pemberian tegangan pada arus tertentu, logam mulai memijar dan dan atom-atom logam katodanya akan teruapkan dengan pemercikan. Atom akan tereksitasi kemudian mengemisikan radiasi pada panjang gelombang tertentu (Khopkar, 1990). Dan secara jelas dapat dilihat pada Gambar 3.
Socket
Anode
Hollow Cathode Lamp
Fill Gas Ne or Ar (1-5 torr)
Glass Envelope
Sumber radiasi lain yang sering dipakai adalah ”Electrodless Dischcarge Lamp” lampu ini mempunyai prinsip kerja hampir sama dengan Hallow Cathode Lamp (lampu katoda cekung), tetapi mempunyai output radiasi lebih tinggi dan biasanya digunakan untuk analisis unsur-unsur As dan Se, karena lampu HCL untuk unsur-unsur ini mempunyai signal yang lemah dan tidak stabil yang bentuknya dapat dilihat pada Gambar 4.
Gambar 3. Electrodless Dischcarge Lamp (Anonim, 2003)
2. Sumber atomisasi
Sumber atomisasi dibagi menjadi dua yaitu sistem nyala dan sistem tanpa nyala. Kebanyakan instrumen sumber atomisasinya adalah nyala dan sampel diintroduksikan dalam bentuk larutan. Sampel masuk ke nyala dalam bentuk aerosol. Aerosol biasa dihasilkan oleh nebulizer (pengabut) yang dihubungkan ke nyala oleh ruang penyemprot (chamber spray). Jenis nyala yang digunakan secara luas untuk pengukuran analitik adalah udara-asetilen dan nitrous oksida-asetilen. Dengan kedua jenis nyala ini, kondisi analisis yang sesuai untuk kebanyakan analit dapat ditentukan dengan menggunakan metode-metode emisi, absorbsi dan juga fluorosensi.
Gambar 4. Instrumentasi sumber atomisasi (Anonim, 2003)
1. Nyala udara asetilen
Biasanya menjadi pilihan untuk analisis mengunakan SSA. Temperatur nyalanya yang lebih rendah mendorong terbentuknya atom netral dan dengan nyala yang kaya bahan bakar pembentukan oksida dari banyak unsur dapat diminimalkan.
2. Nitrous oksida-asetilen Dianjurkan
dipakai untuk penentuan unsur-unsur yang mudah membentuk oksida dan sulit terurai. Hal ini disebabkan karena temperatur nyala yang dihasilkan relatif tinggi. Unsur-unsur tersebut adalah: Al, B, Mo, Si, So, Ti, V, dan W.
Prinsip dari SSA, larutan sampel
diaspirasikan ke suatu nyala dan unsur-unsur di dalam sampel diubah menjadi uap atom sehingga nyala mengandung atom unsur-unsur yang dianalisis. Beberapa diantara atom akan tereksitasi secara termal oleh nyala, tetapi kebanyakan atom tetap tinggal sebagai atom netral dalam keadaan dasar ( ground
state ). Atom-atom ground state ini kemudian menyerap radiasi yang diberikan
gelombang yang dihasilkan oleh sumber radiasi adalah sama dengan panjang gelombang yang diabsorbsi oleh atom dalam nyala.
3. Monokromator Monokromator
merupakan alat yang berfungsi untuk memisahkan radiasi yang tidak diperlukan dari spektrum radiasi lain yang dihasilkan oleh Hallow Cathode Lamp
4. Detektor
Detektor merupakan alat yang mengubah energi cahaya menjadi energi listrik, yang memberikan suatu isyarat listrik berhubungan dengan daya radiasi yang diserap oleh permukaan yang peka.
5. Sistem pengolah
Sistem pengolah berfungsi untuk mengolah kuat arus dari detektor menjadi besaran daya serap atom transmisi yang selanjutnya diubah menjadi data dalam sistem pembacaan.
6. Sistem pembacaan
Sistem pembacaan merupakan bagian yang menampilkan suatu angka atau gambar yang dapat dibaca oleh mata.
2.7 Kecermatan/ketepatan (accuracy)
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan %perolehan kembali dapat ditentuka dengan cara membuat sampel plasebo kemudian ditambahkan analit dengan konsentrasi
tertentu (biasanya 80% samapi 120% dari kadar analit yang diperkirakan), kemudian dianalisis dengan metode yang akan divalidasi (WHO, 2004).
2.8 Keseksamaan/ketelitian (precision)
Ketelitian adalah ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasi. Individual dari rata – rata jika prosedur ditetapkan secara berulang – ulang pada sampel – sampel yang diambil dari campuran yang homogen. Ketelitian diukur sebagai simpangan baku atau simpangan baku relatif (koefisien variasi). Ketelitian dapat dinyatakan sebagai keterulangan (repeatability) atau ketertiruan (reproducibility). Keterulangan adalah ketelitian metode, jika dilakukan berulang kali oleh analis yang sama pada
2.9 Batas deteksi dan Batas Kuantitasi
Batas deteksi adalah jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko. Batas deteksi merupakan parameter uji batas. Batas kuantitasi merupakan parameter pada analisa renik dan diartikan sebagai kuantitasi terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (WHO,2004).