3
Pengaruh Pemberian Astaxanthin Terhadap Aktivitas Spesifik Enzim Glutation Peroksidase Jaringan Hepar Tikus Putih (Rattus
norvegicus) Jantan Galur Wistar Yang Diinduksi Formaldehid Secara Oral
Meliani Fransiska Andita1, Andriani2, Sari Eka Pratiwi3, Pandu Indra Bangsawan4
Abstrak
Latar Belakang: Di Indonesia, formaldehid merupakan aldehida yang banyak ditemukan sebagai bahan pengawet makanan. Formaldehid dapat meningkatkan radikal bebas hingga menyebabkan stress oksidatif yang dapat merusak hepar. Antioksidan seperti astaxanthin diperlukan untuk menangkal radikal bebas. Astaxanthin diharapkan meningkatkan aktivitas spesifik antioksidan enzimatik glutation peroksidase (GPx). Tujuan:
Mengetahui pengaruh astaxanthin terhadap aktivitas spsesifik enzim GPx jaringan hepar tikus putih (Rattus norvegicus) jantan galur wistar yang diberi formaldehid secara oral. Metodologi: Penelitian eksperimental murni dengan rancangan posttest-only control group design. Penelitian ini menggunakan 30 tikus dibagi 5 kelompok: kelompok kontrol normal; kelompok kontrol negatif hanya diberikan induksi formaldehid; Kelompok dosis 1 diberikan astaxanthin 12 mg/hari; kelompok dosis 2 diberikan astaxanthin 24 mg/hari; kelompok dosis 3 diberikan astaxanthin 48 mg/hari. Jaringan hepar diuji dengan reagen khusus aktivitas spesifik enzim GPx kemudian data dianalisis menggunakan uji Kruskal Wallis dilanjutkan dengan Mann-whitney. Hasil: Aktivitas spesifik kelompok kontrol normal 108,21 U/mg, kelompok negatif 62,83 U/mg, dosis 12 mg/hari 122,48 U/mg, dosis 24 mg/Hari 152,88 U/mg, dosis 48 mg/Hari 175,18 U/mg. Dosis 12 mg/Hari lebih tinggi aktivitas spesifik enzim GPx-nya dibandingkan kelompok kontrol. Pada uji Mann-whitney dosis 24 mg/Hari dan 48 mg/Hari menunjukkan aktivitas spesifik yang berbeda bermakna dibandingkan kelompok kontrol normal (p≤ 0,05). Aktivitas spesifik dosis 12 mg/Hari tidak berbeda bermakna dengan kelompok kontrol normal (p>0,05). Kesimpulan: Astaxanthin dapat berperan sebagai antioksidan dengan meningkatkan aktivitas spsesifik enzim GPx jaringan hepar. Dosis terbaik terdapat pada kelompok dosis 12 mg/hari.
Kata Kunci: Antioksidan, astaxanthin, formaldehid, aktivitas spesifik enzim glutation peroksidase, GPx
1) Program Studi Pendidikan Dokter, Fakultas Kedokteran, Universitas Tanjungpura Pontianak
2) Departemen Biokimia, Program Studi Pendidikan Dokter, Fakultas Kedokteran, Universitas Tanjungpura Pontianak
3) Departemen Patologi Anatomi, Program Studi Pendidikan Dokter, Fakultas Kedokteran, Universitas Tanjungpura Pontianak
4) Departemen Farmakologi, Program Studi Pendidikan Dokter, Fakultas Kedoktearn, Universitas Tanjungpura Pontianak
4 Effect of Astaxanthin on Specific Activity of Glutathione Peroxidase in
Liver Tissues after Oral Induction of Formaldehyde in Male Wistar Rat (Rattus norvegicus)
Meliani Fransiska Andita1, Andriani2, Sari Eka Pratiwi3, Pandu Indra Bangsawan4
Abstract
Background: In Indonesia, formaldehyde is an aldehyde which is found illegally used as a food preservative. Formaldehyde can increase free radicals production leading to cause oxidative stress which can damage liver tissues. Antioxidant like astaxanthin is needed to tackle formaldehyde-induced free radicals. Astaxanthin is expected to increase the spesific activity of enzymatic antioxidant, glutathione peroxidase (GPx). Objective: This study aims to determine the effect of astaxanthin on specific activity of glutathione peroxidase in liver tissues of oral formaldehyde-induced male wistar rats (Rattus norvegicus). Methodology: This study was an experimental study with posttest-only control group design. Thirty rats were divided into 5 groups: normal control group; the negative control group which was given only formaldehyde; Group 1 which was given a 12 mg/day dose of astaxanthin; Group 2 which was given a 24 mg/day dose of astaxanthin; Group 3 which was given 48 mg/day dose of astaxanthin. Samples were tested with specific activity reagents for glutathione peroxidase (GPx). The data were analyzed using Kruskal Wallis followed by Mann-whitney. Results: Specific activity in the normal control was 108,21 U/mg, negative control was 62,83 U/mg, dose I was 122,48 U/mg, dose II was 152,88 U/mg, dose III was 175,18 U/mg. The dose I group showed higher activity than the control normal group. In the test dose I and II showed activity GPx specific liver tissue were significantly different than the normal control group (p≤ 0.05). Levels activity of a specific enzyme dose I doesn’t experience a meaningful difference with normal control (p>0.05). Conclusion: Astaxanthin could act as an antioxidant by increasing spesific activity of glutathione peroxidase in liver tissue. The best dose contained in the dose group 12 mg/day.
Keywords: antioxidant, astaxanthin, formaldehyde, spesific activity of glutathione peroxidase, GPx
1) School of Medicine, Faculty of Medicine, Tanjungpura University Pontianak
2) Department of Biochemistry, Faculty of Medicine, Tanjungpura University Pontianak
3) Department of Pathology Anatomy, Faculty of Medicine, Tanjungpura University Pontianak
4) Department of Farmacology, Faculty of Medicine, Tanjungpura University Pontianak
5
LATAR BELAKANG
Hepar adalah organ terbesar dalam tubuh manusia, dengan massa 1,4 kg pada orang dewasa. Hepar merupakan organ metabolik terbesar dan terpenting di dalam tubuh, antara lain berperan dalam metabolisme karbohidrat, metabolisme lipid dan juga metabolisme protein. Hepar juga berperan dalam biotransformasi serta aktivasi vitamin D dan memiliki fungsi yang sangat kompleks untuk mempertahankan homeostasis tubuh. Kerusakan pada hepar akan memberikan dampak sangat buruk bagi tubuh.1,2
Penyakit hepar adalah penyebab dari beban penyakit yang besar di seluruh Uni Eropa, para peneliti pada tahun 2013, melaporkan hal ini dalam The Journal of Hepatology. Para peneliti menyatakan bahwa terdapat 170.000 kematian setiap tahun yang disebabkan oleh sirosis hepar, dengan 47.000 diantaranya disebabkan oleh kanker hepar, terutama karsinoma hepatoseluler.3 Penyakit hepar di Indonesia umumnya masih tergolong tinggi. Menurut data yang diperoleh Kementrian Kesehatan pada tahun 2010, Indonesia menempati peringkat ketiga penderita penyakit hepar terbanyak di dunia, diperkirakan mencapai 30 juta orang, yang mana setengahnya diduga memiliki penyakit hepar kronis dan 10 persen di antaranya menjadi kanker hepar.4 Data menurut World Health Organization (WHO) pada tahun 2014, angka kematian yang diakibatkan oleh penyakit hepar di Indonesia mencapai 48.858 atau 3,49% dari total kematian.5 Centers for Diseases Control and Prevention (CDC) pada tahun 2012, sirosis hepar termasuk dalam 10 penyakit terbesar penyebab kematian di Indonesia dengan presentase 3%.6
Formaldehid atau yang lebih dikenal dengan sebutan formalin, merupakan aldehida berbentuk gas dengan rumus kimia H2CO yang memiliki berat molekul 30,03.7-10 Formaldehid banyak terdapat pada material konstruksi bangunan dan digunakan dalam rumah sakit, penelitian maupun laboratorium. Di Indonesia, formaldehid telah banyak disalahgunakan sebagai bahan pengawet makanan, walaupun dalam UU
6 Nomor 7/1996 Tentang Pangan, UU Nomor 8/1999 Tentang Perlindungan Konsumen dan PP Nomor 28 tahun 2004 tentang Keamanan Pangan, telah melarang penggunaan formalin dalam makanan.11 Hasil pengambilan sampel dan uji bahan makanan di beberapa pasar tradisional Pontianak dan Mempawah yang dilakukan oleh Badan Pengawas Obat dan Makanan Kalimantan Barat pada tahun 2014, menemukan berbagai jenis makanan yang positif mengandung formaldehid, antara lain tahu, mie kuning, manisan, bihun jagung dan ikan gembung.12
Karena ukurannya yang kecil, molekul ini mudah diabsorpsi dan didistribusikan di dalam sel tubuh dan bila masuk ke dalam tubuh akan mengakibatkan meningkatnya Reactive Oxygen Species (ROS) serta menurunkan antioksidan Superoxyde Dismutase (SOD) dan glutation tereduksi (GSH), sehingga dapat menyebabkan stress oksidatif.7-10
Stres oksidatif adalah suatu gangguan terhadap keseimbangan prooksidan dan oksidan sehingga menyebabkan potensi kerusakan.13 Beberapa studi klinis mencantumkan bahwa formaldehid memiliki efek buruk pada manusia, yaitu pada dosis 200 mg/kgBB,7 dapat menyebabkan kanker pada beberapa organ, seperti otak, paru, hepar, pankreas dan sebagainya.14
Kerusakan oksidatif pada hepar dapat dilihat dari aktivitas spesifik enzim glutation peroksidase (GPx) yang rendah.7 GPx merupakan salah satu antioksidan enzimatik untuk mengkonversi H2O2 menjadi H2O dan O2. GPx membutuhkan GSH sebagai donor elektron yang nantinya akan diubah menjadi glutation teroksida (GSSG), sedangkan GSH merupakan antioksidan non-enzimatik endogen yang memiliki peranan dalam mengikat ROS dan mencegah pembentukan ROS dengan cara mengubah ROS menjadi radikal bebas yang kurang reaktif atau merubahnya menjadi senyawa non radikal.10 GSSG sendiri dapat kembali direduksi menjadi GSH oleh aktivitas dari Glutation Reduktase (GR).14 Keadaan stres oksidatif ini dapat diatasi dengan senyawa antioksidan endogen maupun eksogen.
7 Terapi untuk penyakit hepar dengan antioksidan telah banyak digunakan maupun diteliti, di antaranya dengan menggunakan vitamin E (α-tokoferol), vitamin C (asam askorbat), N-asetil-sistein, silymarin dan probukol.5 Namun, probukol tidak tersedia dan pernah dihentikan pemberiannya di Australia dan Amerika Serikat akibat potensi pro aritmia.6
Astaxanthin (3,3’-dihydroxy-β,β-carotene-4,4’-dione) merupakan antioksidan yang popular saat ini. Astaxanthin merupakan pigmen karotenoid utama dan dapat ditemukan pada hewan yang hidup di air seperti salmon, udang dan lobster. Selain itu astaxanthin juga dapat ditemukan pada mikroalga seperti Haematococcus pluvialis. Astaxanthin memiliki aktivitas antioksidan 10 kali lipat lebih tinggi dari beta karoten dan 1000 kali lipat lebih efektif dari vitamin E.15,16 Astaxanthin tidak pernah menjadi prooksidan yang dapat menyebabkan oksidasi di dalam tubuh. Astaxanthin juga memiliki efek antiinflamasi dan antioksidan dengan menghambat produksi ROS.17 Chan et al pada tahun 2009 telah melakukan penelitian dengan menggunakan astaxanthin sebagai antioksidan dan membuktikan bahwa astaxanthin dapat meningkatkan kembali produksi GSH dan mengurangi produksi ROS.18 Penelitian yang dilakukan oleh Otton et al pada tahun 2012, juga menunjukkan bahwa astaxanthin dapat meningkatkan produksi antioksidan endogen, yaitu GSH, SOD dan GPx.19 Maka dari itu, penelitian ini dibuat untuk mengetahui pengaruh astaxanthin sebagai antioksidan dilihat dari aktivitas spesifik enzim GPx pada jaringan hepar tikus yang diberi formaldehid secara oral.
METODOLOGI
Penelitian ini merupakan penelitian eksperimental dengan desain post-test only control group. Sampel yang digunakan adalah jaringan hepar tikus yang telah diberikan perlakuan. Sebanyak 30 ekor tikus berusia dua hingga tiga bulan dibagi dalam 5 kelompok, yaitu kelompok kontrol normal, kelompok kontrol negatif, kelompok uji dosis 1, kelompok
8 uji dosis 2, dan kelompok uji dosis 3. Tikus diadaptasi selama 14 hari dan diberi perlakuan selama total 28 hari berikutnya. Kelompok kontrol normal hanya diberikan CMC 5% serta pakan dan minum standar. Kelompok kontrol negatif diberikan induksi formaldehid secara oral selama 14 hari, kemudian dibiarkan selama 14 hari. Kelompok uji dosis 1 diberikan induksi formaldehid secara oral selama 14 hari, dilanjutkan dengan pemberian astaxanthin dosis 12 mg/hari selama 14 hari. Kelompok uji dosis 2 diberikan induksi formaldehid secara oral selama 14 hari, dilanjutkan dengan pemberian astaxanthin dosis 24 mg/hari selama 14 hari. Kelompok uji dosis 3 diberikan induksi formaldehid secara oral selama 14 hari, dilanjutkan dengan pemberian astaxanthin dosis 48 mg/hari selama 14 hari. Setelah 7 hari perlakuan, setiap kelompok dibedah di Laboratorium Non-Mikroskopis Fakultas Kedokteran Universitas Tanjungpura dan diambil sampel jaringan hepar. Sampel jaringan hepar kemudian dilakukan uji aktivitas spesifik enzim GPx dengan reagen Ransel (Randox®) GPx dan dibaca pada panjang gelombang 340 nm.
HASIL
Pada penelitian ini dilakukan pemeriksaan kadar protein total jaringan hepar dan aktivitas spesifik enzim GPx pada tikus yang diinduksi formaldehid secara oral. Hasil pengukuran aktivitas spesifik enzim GPx dapat dilihat pada tabel 4.1.
Tabel 4.1 Rerata dan ± SD aktivitas spesifik enzim GPx 6 ekor tikus pada tiap kelompok.
Perlakuan Aktivitas Spesifik Enzim GPx Jaringan Hepar Tikus (Mean±SD)
K(0) K(-) K(1) K(2) K(3)
Hari Ke-7 108,21±29,89 62,83±29,40 122,48±12,64 152,88±31,16 175,18±28,10
Pengukuran kadar protein total jaringan hepar menggunakan metode Biuret. Perhitungan kadar protein total jaringan hepar tikus berbagai kelompok perlakuan dapat dilihat pada gambar 4.2.
9 Gambar 4.2. Kadar protein total.
K(0) = Kontrol Normal, K(-) = Kontrol Negatif, K(1) : Astaxanthin dosis 12 mg/hari, K(2): Astaxanthin dosis 24 mg/hari, K(3): Astaxanthin dosis 48 mg/hari. Rerata kadar protein total antar kelompok tikus menunjukan perbedaan bermakna (Kruskal Wallis, p=0,004); *Mann-whitney (p<0,05 vs K(-)).
Kadar protein total jaringan hepar tikus kelompok yang hanya diinduksi formaldehid cenderung mengalami penurunan dibandingkan dengan tikus kelompok kontrol normal. Kelompok tikus dengan perlakuan dosis 12 mg/hari, 24 mg/hari dan 48 mg/hari secara berurutan mengalami peningkatan. Secara statistik kadar protein total ini berbeda bermakna (Kruskal-wallis, p =0,004).
Pengukuran aktivitas spesifik enzim GPx jaringan menggunakan reagen pemeriksaan glutation peroksidase (GPx) dari Randox® dengan bahan uji homogenat hepar. Hasil yang didapatkan data aktivitas spesifik GPx jaringan hepar tampak pada gambar 4.3.
K(0) K(-) K(1) K(2) K(3)
Kadar Protein Total
(mg/ml) 4,27 3,24 3,96 4,05 4,66 0,00 0,50 1,00 1,50 2,00 2,50 3,00 3,50 4,00 4,50 5,00 * 0 0,1 0,2 0,3 0,4 0,5 0,6 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 * * *
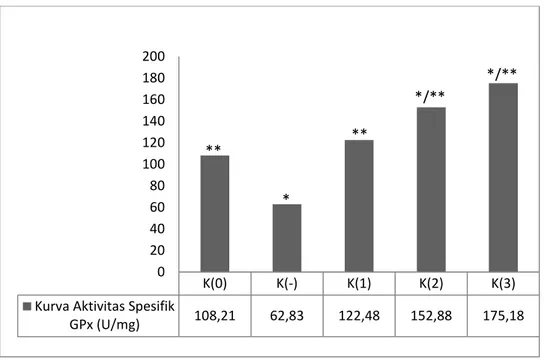
10 Gambar 4.3 Aktivitas Spesifik GPx Jaringan Hepar
K(0) = Kontrol Normal, K(-) = Kontrol Negatif, K(1) : Astaxanthin dosis 12 mg/hari, K(2): Astaxanthin dosis 24 mg/hari, K(3): Astaxanthin dosis 48 mg/hari. Rerata kadar protein total antar kelompok tikus menunjukan perbedaan bermakna (Kruskal Wallis, p=0,000); *Mann-whitney (p≤0,05 vs K(-)); **Mann-whitney (p<0,05 vs K(0)).
Berdasarkan gambar 4.3 terlihat bahwa pemberian astaxanthin berpengaruh terhadap aktivitas spesifik enzim GPx di jaringan hepar (Kruskal-wallis, p=0,000). Nilai aktivitas spesifik pada kontrol normal sebesar 108,21 U/mg protein jaringan, kontrol negatif sebesar 62,83 U/mg protein jaringan, dosis 12 mg/hari sebanyak 122,48 U/mg protein jaringan, dosis 24 mg/hari sebanyak 152,88 U/mg protein jaringan, dosis 48 mg/hari sebanyak 175,18 U/mg.
Gambar 4.3 menunjukkan bahwa pada kelompok perlakuan terjadi peningkatan aktivitas spesifik enzim GPx. Dosis 12 mg/hari lebih tinggi aktivitasnya dibandingkan kelompok kontrol normal. Pada uji mann-whitney tikus kelompok yang diberi perlakuan berupa pemberian astaxanthin dosis 24 mg/hari dan 48 mg/hari menunjukkan aktivitas spesifik GPx jaringan hepar yang berbeda bermakna dibandingkan kelompok kontrol normal (p≤ 0,05). Kadar aktivitas enzim spesifik dosis 12
K(0) K(-) K(1) K(2) K(3)
Kurva Aktivitas Spesifik
GPx (U/mg) 108,21 62,83 122,48 152,88 175,18 0 20 40 60 80 100 120 140 160 180 200 * ** */** */** **
11 mg/hari tidak mengalami perbedaan bermakna dengan kelompok kontrol normal (Mann-whitney, p>0.05).
PEMBAHASAN
Penurunan kadar protein total jaringan hepar terjadi pada kelompok kontrol negatif. Melalui uji statistik hasil pengukuran kadar protein total menunjukkan perbedaan bermakna antar kelompok kontrol normal dan kelompok kontrol negatif. Hal ini menunjukkan bahwa pada kelompok kontrol negatif terjadi kerusakan sel hepar yang lebih banyak jika dibandingkan dengan kelompok kontrol normal. Menurut Trivadi dan Rawal (1998) dalam Panjaitan et al (2011), kerusakan sel hepar akan mengganggu fungsinya dalam menyintesis protein serum yang ditandai dengan rendahnya protein total. Kenaikan kadar enzim di hati (ALT, AST, GPx dan Alkali Fosfatase) juga akan membuat kadar protein total dalam serum menurun.20
Data hasil penelitian menunjukkan peningkatan kadar protein total jaringan hepar pada kelompok uji dosis I, II dan III dibandingkan dengan kelompok kontrol negatif. Uji statistik menunjukkan perbedaan bermakna antara kelompok uji dosis I, II dan III dengan kelompok kontrol negatif. Hal ini menunjukkan bahwa pada kelompok uji dosis I, II dan III terjadi perbaikan sel hepar sehingga dapat kembali memproduksi protein berangsur-angsur kembali mendekati kadar protein total pada kelompok kontrol normal (tidak terdapat perbedaan bermakna pada uji statistik yang membandingkan kelompok uji dosis I, II dan III dengan kelompok kontrol normal). Sehingga dapat dilihat bahwa pada pemberian dosis 12 mg/hari pada tikus yang telah diinduksi formaldehid telah menunjukkan adanya perbaikan sel hepar.
Kadar protein jaringan hepar dikendalikan oleh mekanisme regulasi sel-sel hepar yang bersifat sekretorik (hepatosit). Efektivitas dari antioksidan tergantung pada kapasitasnya menurunkan efek kerusakan
12 oleh radikal bebas atau kemampuannya mengembalikan kemampuan fisiologi normal hepar.21
Protein total yang disekresi oleh sel hati berasal dari aparatus golgi menuju membran sinusoid dari hepatosit. Variasi sintesis dari protein tersebut tergantung pada kondisi hormonal, status nutrisi, umur dan faktor lokal yang lain. Antioksidan alami seperti GSH sangat diperlukan untuk melawan radikal bebas yang berhubungan dengan berbagai penyakit salah satunya inflamasi jaringan hati akibat agen hepatotoksik. GSH merupakan tripeptida yang terdiri dari glutamat, sistein dan glisin. GSH dalam mengkonjugasi ROS seperti radikal bebas dan peroksidase memerlukan enzim GPx sebagai katalisator untuk melindungi sel. GSH dihasilkan oleh sel secara endogen untuk mendetoksifikasi beragam xenobiotik dan karsinogen baik yang organik maupun anorganik. GSH berperan mendasar dalam metabolisme dan reaksi biokimia seperti sintesis DNA, sintesis protein, sintesis prostaglandin, transport asam amino dan aktivasi enzim. Setiap sistem di dalam tubuh dapat dipengaruhi oleh kesatuan sistem glutation khususnya sistem imun. Sehingga untuk melawan kerusakan hati yang diakibatkan oleh radikal bebas, dibutuhkan jalur pembentukan GSH lebih banyak. Asam amino yang digunakan pada pembentukan GSH akan mengurangi kadar pembentukan protein total jaringan hepar.22
Penurunan kadar protein total jaringan hepar dapat disebabkan oleh stres oksidatif. Stres oksidatif terjadi akibat peningkatan radikal bebas atau ketersediaan antioksidan yang tidak adekuat atau kombinasi dari keduanya. Peningkatan radikal bebas merusak biomakromolekul sel seperti lipid dan protein. Radikal bebas memiliki reaktivitas kimia yang sangat tinggi terhadap molekul lain akibat elektronnya yang tidak berpasangan. Keadaan ini juga akan mampu merusak protein-protein yang terdapat di dalam sel hati.23
Aktivitas spesifik enzim GPx pada dosis 12 mg/hari paling mendekati aktivitas spesifik enzim GPx kelompok kontrol normal serta tidak terjadi perbedaan melalui uji statistik. Hal ini menunjukkan bahwa
13 dosis 12 mg/hari merupakan dosis terbaik, dikarenakan pada dosis tersebut telah terjadi peningkatan aktivitas spesifik enzim GPx (Gambar 4.3).
Berdasarkan ketiga tingkatan aktivitas spesifik GPx (Gambar 4.3) menunjukkan bahwa semakin tinggi dosis maka semakin tinggi aktivitasnya. Peningkatan aktivitas spesifik tersebut dikarenakan astaxanthin bekerja dengan memicu nuclear factor E2 related factor 2 (NRF2) dalam memediasi sistem antioksidan endogen dalam tubuh. NRF2 merupakan suatu sistem antioksidan yang berperan dalam mempertahankan reaksi redoks fisiologis sel. Kondisi normal, NRF2 terhambat atau inaktif karena berikatan dengan reseptor spesifik, yaitu Kelch-like ECH-associated protein (Keap1) di sitosol. Namun, saat terpapar bahan kimia atau pada kondisi stres oksidatif yang berlebihan, NRF2 terdisosiasi dari Keap1, bertranslokasi menuju nukleus dan menginisiasi transkripsi enzim-enzim antioksidan. Terjadi 3 mekanisme, antara lain: (1) oksidasi dari thiol Keap untuk membentuk jembatan disulfida, (2) modifikasi residu sistein pada Keap1 dengan elektrofil, (3) fosforilasi NRF2 dengan protein kinase. Ketiga mekanisme tersebut mengakibatkan NRF2 tidak akan dapat berikatan lagi dengan Keap1 dan kemudian akan berdifusi ke dalam nukleus, bersama-sama dengan protein Maf, berikatan dengan sekuens DNA yang mengkode Antioxidant Response Element (ARE), yaitu gen-gen penghasil enzim antioksidan. ARE sendiri merupakan gen-gen penghasil enzim antioksidan yang meliputi GPx, GST dan Glutamyl-Cysteine Ligase (GCL). 24-26
Penelitian Dose J et al pada tahun 2016 menyebutkan bahwa astaxanthin selain dapat meningkatkan pembentukan antioksidan enzimatik, juga berperan sebagai radical scavenger.27 Selain itu, penelitian Chun-Hung Chiu et al pada tahun 2016 juga mendapatkan hasil bahwa pemberian astaxanthin dapat membantu meningkatkan aktivitas spesifik enzim GPx.28
Kemampuan hepatosit untuk beregenerasi mendukung alasan mengapa aktivitas spesifik enzim GPx pada kelompok tikus yang diberikan
14 astaxanthin dapat meningkat. Hepatosit dengan kemampuan proliferasi yang tinggi berperan utama dalam proses regenerasi.29 Pada tikus sendiri, regenerasi hepar yang dilakukan hepatektomi parsial hanya membutuhkan waktu 7-10 hari.30 Ketika sel-sel hepatosit mengalami regenerasi maka akan terjadi peningkatan sintesis GSH dalam sel yang juga akan meningkatkan aktivitas spesifik enzim GPx.19
Penelitian ini sebagaimana yang tampak pada gambar 4.3 menunjukkan nilai aktivitas yang paling mendekati aktivitas spesifik kontrol normal adalah pada dosis 12 mg/hari. Sehingga dosis terbaik yang memiliki fungsi sebagai antioksidan adalah 12 mg/hari.
KESIMPULAN
Astaxanthin dapat meningkatkan aktivitas spesifik enzim glutation peroksidase pada jaringan hepar tikus putih (Rattus norvegicus) jantan galur wistar yang diberi formaldehid secara oral. Dosis terbaik astaxanthin sebagai antioksidan yang dapat meningkatkan aktivitas spesifik enzim glutation peroksidase pada jaringan hepar tikus putih (Rattus norvegicus) jantan galur wistar yang diberi formaldehid secara oral adalah 12 mg/hari.
DAFTAR PUSTAKA
1. Tortora GJ, Derrickson B. Principles of anatomy & physiology. 13th ed. New Jersey: John Wiley & Sons, Inc. 2012.
2. Sherwood L. Fisiologi Manusia Dari Sel Ke Sistem edisi 6. Jakarta: EGC. 2011.
3. Blachier M, Leleu H, Peck-Radosavljevic M, Valla DC, Roudot-Thoraval F. The burden of liver disease in Europe: a review of the available epidemiological data. Journal of Hepatology. 2013; 58: 593-608.
4. Kementerian Koordinator Bidang Kesejahteraan Rakyat Indonesia. Indonesia Peringkat III Hepatitis. Jakarta. 2010. Diakses di: http://2010.kemenkopmk.go.id/content/indonesia-peringkat-iii-hepatitis
15 [18 Juni 2016].
5. WHO. Health Profile: Indonesia. Diakses di http://www.who.int /countries/idn/en/ [20 Juni 2016]
6. CDC. Global Health: Indonesia – Top 10 Cause of Death. Diakses di https://www.cdc.gov/globalhealth/countries/indonesia/ [20 Juni 2016] 7. Mahdi C, Aulaniam, Sumarno, dan Widodo MA. Suplementasi Yoghurt
pada Tikus (Rattus norvegicus) yang Terpapar Formaldehid dalam Makanan terhadap Aktivitas Antioksidan Kerusakan Oksidatif Jaringan Hepar. Natural B. 2011; 1(2).
8. Saito Y, Nishio K, Yoshida Y, Niki E. Cytotoxic Effectof Formaldehyde with Free Radicals via Increment of Cellular Reactive Oxygen Species. Toxicology. 2005; 210(2-3): 235-45.
9. Zararsiz I, Sarsilmaz M, Tas U, Kus I, Meydan S, Ozan E. Protective Effect of Melatonin Against Formaldehyde-Induced Kidney Damage in Rats. Toxicology and Industrial Health. 2007.
10. Harmita. Buku Ajar Analisis Fisikokimia. Depok: Departemen Farmasi FMIPA Universitas Indonesia. 2006.
11. Direktorat Jendral Pengawas Obat dan Makanan. Formalin. Jakarta: Departemen Kesehatan RI. 2003.
12. Badan Pengawas Obat dan Makanan Kalimantan Barat. Laporan Hasil Sampling dan Uji Bahan Makanan yang Mengandung Formalin di Pasar Tradisional Percontohan. 2014.
13. Wojcik M, Burzynska-Pedziwiatr I, Wozniak LA. A review of natural and synthetic antioxidans imoportant fot health and longevity. Curr Med Chem. 2010; 17:3262-88.
14. World Health Oraganization. Concise International Chemical Assessment Document 40: Formaldehyde. World Health Organization, Geneva. 2002. Diakses di: http://www.who.int/ipcs/publications/en/ index.html [15 Juni 2016].
15. Guerin M, Hutley ME, Olaizola M. Haematococcus Astaxanthin: Applications for Human Health and Nutrition. Trends in Biotechnology. 2003; 21:210-15.
16 16. Suseela MR, Toppo K. Haematococcus Pluvialis – A Green Alga, Richest Natural Source of Astaxanthin. Current Science. 2006; 90(12): 1602-3.
17. Santocono M, Zuria M, Berrettini M, Fedeli D, Falcioni, G. Lutein, Zeaxanthin and Astaxanthin Protect Against DNA Damage in SK-N-SH Human Neuroblastoma Cells Induced by Reactive Nitrogen Species. Journal of Photochemistry and Photobiology B. 2007; 88:1-10.
18. Chan KC, Mong MC, Yin MC. Antioxidative and anti-inflammatory neuroprotective effects of astaxanthin and canthaxanthin in nerve growth factor differentiated PC12 cells. J Food Sci. 2009; 74(7): 225-31.
19. Otton R, Bolin AP, Marin DP, Campio TR, Fineto C Jr, de Cassia Santos Macedo R, Guerra BA, Leite JR, Barros MP, Mattei R. Combined fish oil and astaxanthin supplementation modulates rat lymphocyte function. Eur J Nutr. 2012; 51(6): 707-18.
20. Ruqiah Ganda Putri Panjaitan, Wasmen Manalu, Ekowati Handharyani, Chairul. Aktivitas Hepatoprotektor Ekstrak Metanol Akar Pasak Bumi dan Fraksi-Fraksi Turunannya. Jurnal Veteriner. 2011; 12 (4): 319-25.
21. Eesha BR, Mohanbabu Amberkar V , Meena Kumari K, Sarath babu, Vijay M , Lalit M, Rajput R.Hepatoprotective activity of Terminalia paniculata against paracetamol induced hepatocellular damage in Wistar albino rats. Asian Pacific Journal of Tropical Medicine. 2011: 466-69.
22. Sucheta Soma Kirupa dan R.Kavitha. Antioxidant Enhancing Property of Curry Leaf Powder (Murraya Koenigii) in Type 2 Diabetes Mellitus. Int Journal Bio Sci. 2015; 6 (1): 507-14.
23. Murray RK, Granner DK, Rodwell VW.Biokimia Harper ed.27 alih bahasa. Jakarta: EGC. 2009.
24. Yang Y, Seo JM, Nguyen A, Pham TX, Park HJ, Park Y. Astaxanthin rich extract from the green alga Haematococcus pluvialis lowers
17 plasma lipid concentrations and anhances antioxidant defense in apolipoprotein E knockout mice. J Nutr. 2011; 141: 1611-7.
25. Itoh K, Chiba T, Takahashi S, Igarashi K, Katoh Y, et al. An NRF2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme gene through antioxidant response elements. Biochem Biophys Res Commun. 1997; 236: 313-22.
26. Qin S, Liu GX, Hu ZY. The accumulation and metabolism of Astaxanthin in Scenedesmus obliquus. Process bioavailability. 2008; 43: 795-802.
27. Dose J, Matsugo S, Yokokawa H, Koshida Y, Okazaki S, Seidel U, et al. Free Radical Scavenging and Cellular Antioxidant Properties of Astaxanthin. Int. J. Mol. Sci. 2016; 17(1):103.
28. Chiu CH, Chang CC, Lin ST, Chyau HC, Peng RY. Improved
Hepatoprotective Effect of Liposome-Encapsulated Astaxanthin in Lipopolysaccharide-Induced Acute Hepatotoxicity. Int. J. Mol. Sci. 2016, 17(7), 1128.
29. Kobayashi M, Kakizono T, Nishio N, Nagai S. Effects of light intensity, light quality, and illumination cycle on Astaxanthin formation in green alga, Haematococcus pluvialis. J. Ferm. Bioeng. 2009; 74(1): 61-63. 30. Lemuth K, Steuer K, Albermann C. Engineering of a
plasmid-free Escherichia colistrain for improved in vivobiosynthesis of astaxanthin. Microb Cell Fact 2011;10:29.
18