KIMIA UNSUR
Disusun Oleh :
APAKAH ITU KIMIA UNSUR ??
Kimia unsur adalah unsur unsur yang mempunyai sifat kimia Yang berada di lingkungan sekitar kita.
Kimia unsur dalam pelajaran kimia mempelajari tentang unsur – unsur kimia yang mempunyai sifat – sifat khusus
Kimia Unsur
A.
Kelimpahan dan Identifikasi Unsur
B.
Golongan Gas Mulia dan Halogen
C.
Golongan Alkali dan Alkali Tanah
D.
Periode Ketiga dan Periode Keempat
E.
Kegunaan Unsur dan Senyawa Kimia
Golongan gas mulia dan halogen
Beberapa golongan unsur memiliki nama khusus seperti
golongan VIIIA (gas mulia) dan VIIA (halogen).
Golongan tersebut memiliki nama khusus seperti sifat
priodik, sifat fisik dan sifat kimia. Kekhas sifat ke 2
golongan tersebut dapat membantu kita unsur-unsur
yang lain. Dalam 1 golongan (semakin ke atas) dan
dalam 1 periode (semakin ke kanan).
Berlaku :
- jari jari atom
:
semakin kecil
- Keelektronegatifan
:
semakin besar
- Energi ionisasi
:
semakin besar
GAS MULIA
•
Sifat unsur golongan gas mulia
a. sifat periodik unsur golongan gas mulia
b. Sifat fisik gas mulia
SIFAT PERIODIK UNSUR GOLONGAN
GAS MULIA
Gas mulia merupakan unsur yang stabil. Gas mulia sukar
bereaksi dengan unsur lain dan sukar menerima ataupun
melepas elktron.
Dengan elektron valensi yang sudah penuh hal unsur gas
mulia yang sangat sukar menerima elektron. Hal ini dapat
dilihat dari harga afinitas elektronnya yang rendah.
Kesetabilan unsur- unsur golongan gas mulia
menyebabkan unsur- unsur ini sukar membentuk ion,
artinya sukar melepas atau menerima elektron.
Sifat Periodik Unsur Gas Mulia
Dengan konfigurasi elektron yang sudah penuh, gas mulia termasuk unsur yang stabil, artinya sukar bereaksi dengan unsur lain, sukar untuk
menerima elektron maupun untuk melepas elektron. Perhatikanlah data afinitas elektron, energi ionisasi, dan jari-jari atom unsur gas mulia pada Tabel di bawah! Data Fisis He Ne Ar Kr Xe Rn Nomor atom Elektron valensi Jari-jari atom (Ǻ) Titik leleh (0C) Titik didih (0C) Energi ionisasi (kj/mol) Afinitas electron (kj/mol) Kerapatan (g/L) 2 2 0,50 -272,2 -268,9 2640 -48 0,178 10 8 0,65 -248,6 -246,0 2080 -120 0,900 18 8 0,95 -189,4 -185,9 1520 -96 1,78 36 8 1,10 -157,2 -153,4 1350 -96 1,78 54 8 1,30 -111,8 -108,1 1170 -77 5,89 86 8 1,45 -71 -62 1040 - 9,73
Unsur Nomor Atom Konfigurasi Elektron He 2 1s2 Ne 10 [He] 2s2 2p6 Ar 18 [Ne] 3s2 3p6 Kr 36 [Ar] 4s2 3d10 4p6 Xe 54 [Kr] 5s2 4d10 5p6 Rn 86 [Xe] 6s2 5d10 6p6
Keterangan Umum Unsur
Nama, Lambang, Nomor atom helium, He, 2
Deret kimia gas mulia
Golongan, Periode, Blok 18, 1, s Penampilan
Massa atom 4,002602(2)
g/mol
Konfigurasi elektron 1s2
Jumlah elektron tiap kulit 2
HELIUM
2 hidrogenhelium → - ← - ↑ He ↓Ne
Neon
2, 8 Jumlah elektron tiap kulit
1s2 2s2 2p6 Konfigurasi elektron 20.1797(6) g/mol Massa atom takberwarna Penampilan 18, 2, p Golongan, Periode, Blok
gas mulia Deret kimia
neon, Ne, 10 Nama, Lambang, Nomor atom
Keterangan Umum Unsur
Neon adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Ne dan nomor atom 10. Neon termasuk kelompok gas mulia yang tak berwarna dan lembam (inert). Zat ini memberikan pendar khas kemerahan jika digunakan di tabung hampa (vacuum discharge tube) dan lampu neon. Sifat ini membuat neon terutama dipergunakan sebagai bahan pembuatan tanda
ARGON
Keterangan Umum Unsur
Nama, Lambang, Nomor atom argon, Ar, 18 Deret kimia gas mulia Golongan, Periode, Blok 18, 3, p
Penampilan
Massa atom 39,948(1) g/mol Konfigurasi elektron [Ne] 3s2 3p6
Jumlah elektron tiap kulit 2, 8, 8
Ne ↑ Ar ↓ Kr klorin ← argon → - 18
KRIPTON
2, 8, 18, 8 Jumlah elektron tiap kulit
[Ar] 3d10 4s2 4p6 Konfigurasi elektron 83.798(2) g/mol Massa atom Penampilan 18, 4, p Golongan, Periode, Blok
noble gases Deret kimia
krypton, Kr, 36
Nama, Lambang, Nomor atom
XENON
Xenon adalah unsur dengan lambang kimia Xe, nomor atom 54 dan massa
atom relatif 131,29; berupa gas mulia, tak berwarna, tak berbau dan tidak
ada rasanya.
Xenon diperoleh dari udara yang dicairkan. Xenon dipergunakan untuk
mengisi lampu sorot, dan lampu berintensitas tinggi lainnya, mengisi bilik
gelembung yang dipergunakan oleh ahli fisika untuk mempelajari partikel
sub-atom.
RADON
Keterangan Umum Unsur
Nama, Lambang,Nomor atom radon, Rn, 86
Deret kimia gas mulia
Golongan, Periode, Blok 18, 6, p
Penampilan tak berwarna
Massa atom (222) g/mol
Konfigurasi elektron [Xe] 4f14 5d10 6s2 6p6
Jumlah elektron tiap kulit 2, 8, 18, 32, 18, 8
Radon adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Rn dan
nomor atom 86. Radon juga termasuk dalam kelompok gas mulia dan beradioaktif. Radon terbentuk dari penguraian radium. Radon juga gas yang paling berat dan berbahaya bagi kesehatan. Rn-222 mempunyai waktu paruh 3,8 hari dan digunakan dalam radioterapi. Radon dapat menyebabkan kanker paru paru, dan bertanggung jawab atas 20.000 kematian di Uni Eropa setiap tahunnya
SIFAT FISIK GAS MULIA
1.
Tidak Berwarna, tidak berbau, tidak berasa, sedikit larut dalam air.
2.
Mempunyai elektron valensi 8, dan khusus untuk Helium elektronvalensinya 2, maka gas mulia bersifat kekal dan diberi valensi nol.
3.
Molekul-molekulnya terdiri atas satu atom (monoatom).
Unsur
Titik Didih
Titik Leleh
K
0C
K
0C
Helium
Neon
Argon
Kripton
Xenon
Radon
4,2
27,2
87,3
120
165
211
-268,8
-245,8
-185,7
-153
-108
-62
0,8
24,6
83,9
116
161
202
-272,2
-248,4
-189,1
-157
-112
-71
Pembuatan dan reaksi gas mulia
Gas mulia dapat di peroleh dari pendingina udara cair secara bertahap (destilasi bertingkat) Sebab titik didik komponennya bervariasi.• Argon secara khusus dapat diperoleh dari reaksi udara dengan karbit : CaC2 + N2 CaCN2 + C (bebas dari N2)
2CaC2 + O2 2CaO + 4C (bebas dari O2) CaO + CO2 CaCO3 (bebas dari CO2) Sebagai sisanya adalah Ar dan gas mulia lain.
• He dapat diperolah dengan jalan pemisahan dari gas alam, sebab pada sumber gas alam tertentu terdapat He dalam jumlah tidak terlalu rendah
• Rn terdapat dalam rongga-rongga batuab uranium berasal dari peluruhan Ra 226Ra 222 Rn + 4He
88
Sifat kimia usur golongan gas mulia
Biloks Senyawa Penampakan 0C Struktur
+2 XeF2 Kristal tak berwarna 129 Linier KrF2, 2SbF5 Padatan 50 Linier
RnF2 - - Linier
+4 XeF4 Kristal tak berwarna 117 Segiempat datar
KrF4 - - Segiempat datar
+6 XeF6 Kristal tak berwarna 49,6 Pentagonal bipiramidal cacat
+8 XeO4 Gas tak berwarna - Tetrahedral
XeO6-4 Padatan tak
berwarna
Kegunaan Gas Mulia
He
Pengisi balon udara, pencampur oksigen pada tabung penyelam dan sebagai pendingin untuk suhu mendekati 0 KNe
Pengisi bola lampu, lampu TL, lampu reklame, pendingin pada reaktor nuklirAr
Kr
Xe
Sebagai obat biaus pada pembedahan. Senyawa Xe dan oksigen: XeO3, XeO4 merupakan oksdator yang sangat kuatHALOGEN
Halogen artinya pembentuk garam.
Unsur-unsur halogen merupakan unsur yang
bersifat elektropositif dan mudah bereaksi
dengan unsur elektropositif untuk
membentuk garam. Anda dapat lebih
mengenal sifat-sifat unsur halogen dengan
mempelajari urayan berikut.
fluor
clor
brom
SIFAT UNSUR HALOGEN
•
Sifat periodik unsur halogen
•
Sifat fisik unsur halogen
a.Sifat periodik unsur halogen
Sifat unsur Elektron Valensi Jari-jari Atom(Å) Keeletro-negatifan Energi Ionisasi (kJ mol-1) Afinitas Elektron (kJ mol-1) Fluorin 2s2 2p5 0,64 3,98 1.681,0 -328,0 Klorin 3s2 3p5 0,99 3,16 1.251,1 -349,0 Bromin 4s2 4p5 1,14 2,96 1.139,9 -324,7 Iodin 5s2 5p5 1,33 2,66 1.008,4 -295,2 Astatin 6s2 6p5 1,40 2,20 930 -270Unsur Titik didih (‘C) Titik leleh (‘C) Fluorin -188,14 -219.62 Klorin -34,6 -100,98 Bromin 58,78 -7,25 Iodin 184,35 113,5 Astatin 337 302
Membentuk asam oksi kecuali F
12. Pembentukan asam oksi
3X2 + 6MOH ® 5MX + MXO3 + 3H2O (auto redoks) 11. Dengan basa kuat
(panas)
X2 + 2MOH ® MX + MXO + H2O (auto redoks)
10. Dengan basa kuat MOH (dingin)
2 M + nX2 ® 2MXn (n = valensi logam tertinggi)
9. Reaksi dengan logam (M) Tidak dapat mengusir F, Cl, Br X = I Br2 + KX ® 2K Br + X2 X = Br dan I Cl2 + 2KX ® 2KCl + X2 X = Cl, Br, I F2 + 2KX ® 2KF X2 8. Reaksi pengusiran pada
senyawa halogenida
7. Kereaktifan terhadap gas
H2
(makin besar sesuai dengan arah panah) 6. Kelarutan oksidator Ungu Coklat Tak berwarna Tak berwarna
5. Warna larutan (terhadap pelarut 4) CCl4, CS2 4. Pelarutnya (organik) Ungu Coklat merah Kuning hijau Kuning muda 3. Warna gas/uap Padat Cair Gas Gas
2. Wujud zat (suhu kamar)
Diatom 1. Molekulnya Iodium (I2) Brom (Br2) Klor (Cl2) Fluor (F2) X2
+1 +5, +7 + 1 +5, +7 + 1, +3 +5, +7 -1
9. Bilangan Oksidasi Senyawa Halogen
183 58
-34 -188.2
8. Suhu Didih (0o)
114.0 -72
-101.0 -216.6
7. Suhu Lebur (0o)
6. Potensial Reduksi (Eored > 0) 5. Keelektronegatifan
4. Energi Ionisasi dan Afinitas Elektron 3. Jari-jari Atom 2. Massa Atom [X] ns2 , np5 1. Konfigurasi elektron 53I 35Br 17Cl 9F Iodium Brom Klor Fluor UNSUR
HUBUNGAN ANTARA JARI – JARI ATOM, AFINITAS ELEKTRON, DAN KEREAKTIFAN HALOGEN
SIFAT KIMIA UNSUR GOLONGAN HALOGEN
1.
Kelarutan
2.
Kereaktifan dan daya pengoksidasi halogen
3.
Reaksi pendesakan halogen
4.
Sifat asam
halogen molecule structure model d(X−X) / pm (gas phase) d(X−X) / pm (solid phase) fluorine F2 143 149 chlorine Cl2 199 198 bromine Br2 228 227 iodine I2 266 272
HX HF HCl HBr HI Catatan : makin besar/kuat sesuai dengan arah panah Sifat reduktor Keasaman Kepolaran Kestabilan terhadap panas
SIFAT FISIKA DAN KIMIA HIDROGEN HALIDA
HCl HBr HI
1. Bentuk pada suhu
biasa Gas tidak berwarna
2. Dalam pelarut non
polar (Benzana/Toluensa) Larut, tak menghantarkan arus listrik
3. Dalam air Larut, menghantarkan arus listrik 4. Dengan H2SO4, pekat
(oksidator) Tidak teroksidasi Teroksidasi menjadi Br2 Teroksidasi menjadi I2 5. Kestabilan terhadap
pemanasan Tidak terurai Sedikit terurai
Terurai menjadi He dan I2
X2 Fluor (F2) Klor (Cl2) Brom (Br2) Iodium (I2)
1. Molekulnya Diatom
2. Wujud zat (suhu kamar) Gas Gas Cair Padat
3. Warna gas/uap Kuning muda Kuning hijau Coklat merah Ungu
4. Pelarutnya (organik) CCl4, CS2
5. Warna larutan (terhadap pelarut 4) Tak berwarna berwarna Tak Coklat Ungu 6. Kelarutan oksidator
(makin besar sesuai dengan arah panah) 7. Kereaktifan terhadap gas H2
8. Reaksi pengusiran pada senyawa halogenida X = Cl, Br, I F2 + 2KX 2KF X2 X = Br dan I Cl2 + 2KX 2KCl + X2 X = I Br2 + KX 2KBr + X2 Tidak dapat mengusir F, Cl, Br 9. Reaksi dengan logam (M) 2 M + nX2 2MXn (n = valensi logam tertinggi) 10. Dengan basa kuat MOH (dingin) X2 + 2MOH MX + MXO + H2O (auto redoks) 11. Dengan basa kuat (panas) 3X2 + 6MOH 5MX + MXO3 + 3H2O (auto redoks)
12. Pembentukan asam oksi Membentuk asam oksi kecuali F
Catatan :
I2 larut dalam KI membentuk garam poli iodida I2 + KI Kl3
I2 larut terhadap alkohol coklat
Natrium
Na
Magnesium
Mg
Aluminium
Al
Silikon
Si
Fosfor
P
Belerang
S
Klor
Cl
Argon
Ar
Unsur Periode 3
indeksLogam
Metaloid
Non logam
Gas Mulia
Natrium (
Na
)
Sifat Fisis
Nomor atom : 11
Konfigurasi e- : [Ne] 3s1 Massa Atom relatif : 22,98977
Jari-jari atom : 2,23 Å
Titik Didih : 892 C
Titik Lebur : 495 C
Elektronegatifitas : 1
Energi Ionisasi : 495 kJ/mol
Tingkat Oks. Max : 1+
Struktur Atom : Kristal
Logam
Wujud : Padat
Natrium (
Na
)
Kegunaan
•Dipakai dalam pebuatan ester
•NACl digunakan oleh hampir semua makhluk •Na-benzoat dipakai dalam pengawetan makanan •Na-glutamat dipakai untuk penyedap makanan •Isi dari lampu kabut dalam kendaraan bermotor
•NAOH dipakai untuk membuat sabun, deterjen, kertas
•NAHCO3 dipakai sebagai pengembang kue
•Memurnikan logam K, Rb, Cs
•NACO3 Pembuatan kaca dan pemurnian air sadah
Natrium (
Na
)
Catatan
Merupakan logam lunak, bewarna putih keperakan, reaktif
Bereaksi dengan cepat dengan air membentuk sodium hidroksida dan hidrogen Dapat bereaksi dengan Alkohol namun lebih lambat dibanding dengan air
Tidak bereaksi terhadap nitrogen
Merupakan komponen terbesar kedua yang larut di air laut Mudah ditemui pada sumber air alami
Dihasilkan dengan elektrolisis lelehan NaCl Prosesnya disebut proses Downs,
yaitu dengan menambah 58% CaCl2 dan KF pada elektrolisis lelehan NaCL.
Tujuan penambahan untuk
menurunkan titik lebur NaCl hingga mencapai 550 C
Magnesium (
Mg
)
Sifat Fisis
Nomor atom : 12
Konfigurasi e- : [Ne] 3s2 Massa Atom relatif : 24,305
Jari-jari atom : 1,72 Å
Titik Didih : 1107 C
Titik Lebur : 651 C
Elektronegatifitas : 1,25
Energi Ionisasi : 738 kJ/mol
Tingkat Oks. Max : 2+
Struktur Atom : Kristal
Logam
Wujud : Padat
Kegunaan
Dipakai pada proses produksi logam, kaca, dan semen
Untuk membuat konstruksi pesawat. Logamnya disebut magnalum Pemisah sulfur dari besi dan baja
Dipakai pada lempeng yang digunakan di industri percetakan Untuk membuat lampu kilat
Sebagai katalis reaksi organik
Magnesium (
Mg
)
Catatan
Berupa logam bewarna putih keperakan dan sangat ringan
Banyak dipakai di industri karena ringan dan mampu membentuk aloi yang kuat Termasuk unsur reaktif
Sebagian besar logam dapat dihasilkan dengan bantuan magnesium
Banyak ditemukan di alam dan dalam mineral : dolomite, magnetite, olivine, serpentine Senyawa yang terbentuk umumnya ikatan ion, namun ada juga berupa ikatan kovalen Magnesium umumnya dapat diperoleh melalui pengolahan air laut sbg:
-Ca(OH)2 ditambahkan pada air laut agar meganesium mengendap sebagai Mg(OH)2. Asam klorida kemudian ditambahkan sehingga diperoleh kristal magnesium klorida
Ca(OH)2 (S) + Mg2+ Mg(OH)
2 (S) + Ca 2+
Mg(OH)2 (s) + 2H+ + Cl- MgCl
2.6H2O
-Untuk menghindari terbentuknya MgO pada pemanasan
megnesium klorida, sebelum elektrolisis leburan kristal yang terbentuk ditambahkan magnesium klorida yang mengalami hidrolisis sebagian ke dalam campuran leburan natrium dan kalsium klorida
-Magnesium akan diperoleh pada katoda sedangkan pada anoda akan terbentuk Cl2-
Magnesium (
Mg
)
Alluminium (
Al
)
Sifat Fisis
Nomor atom : 13
Konfigurasi e- : [Ne] 3s2 3p 1 Massa Atom relatif : 26,98154
Jari-jari atom : 1,82 Å
Titik Didih : 2467 C
Titik Lebur : 660 C
Elektronegatifitas : 1,45
Energi Ionisasi : 577 kJ/mol
Tingkat Oks. Max : 3+
Struktur Atom : Kristal
Logam
Wujud : Padat
Kegunaan
Banyak dipakai dalam industri pesawat Untuk membuat konstruksi bangunan Dipakai pada berbagai macam aloi Untuk membuat magnet yang kuat Tawas sebagai penjernih air
Untuk membuat logam hybrid yang dipakai pada pesawat luar angkasa Membuat berbagau alat masak
Menghasilkan permata bewarna-warni: Sapphire, Topaz, dll
Allumunium (
Al
)
Catatan
Berupa logam lunak bewarna perak
Merupakan penghantar panas yang sangat baik da dapat menghantar listrik Sulit terkorosi karena membentuk lapisan oksida di permukaannya
Tidak beracun, non-magnetik dan sulit terbakar Sumber utamanya adalah biji bauksit
Alumunium dapat diperoleh melalui proses Hall, yaitu:
-biji bauksit dimurnikan dengan menambah NaOH dan HCl sehingga diperoleh Al2O3 Al2O3 (s) + 2NAOH (aq) 2NaAIO2 (aq) + H2O
2NaAIO (aq) +HCL (aq) Al(OH)3 + NaCl (aq) Al(OH)3 Al2O3 (s) + 3H20
-Al2O3 yang diperoleh kemudian disaring dan dilelehkan baru kemudian dielektrolisis Anoda : 3O2- O2(g) + 6e
Katoda : 2Al3 + 6e 2Al
-Sebelum elektrolisis, ditambahkan kriolit (NaAIF6) untuk menurunkan titik leleh AL2O3
Allumunium (
Al
)
Silikon (
Si
)
Sifat Fisis
Nomor atom : 14
Konfigurasi e- : [Ne] 3s2 3p 2 Massa Atom relatif : 28,0855
Jari-jari atom : 1,46 Å
Titik Didih : 2355 C
Titik Lebur : 1410 C
Elektronegatifitas : 1,74
Energi Ionisasi : 787 kJ/mol
Tingkat Oks. Max : 4+
Struktur Atom : Kristal
Kovalen
raksasa
Wujud : Padat
Kegunaan
Dipaki dalam pembuatan kaca
Terutama dipakai dalam pembuatan semi konduktor
Digunakan untuk membuat aloi bersama alumunium, magnesium, dan tembaga Untuk membuat enamel
Untuk membuat IC
Silikon (
Si
)
Catatan
Merupakan unsur elektropositif yang paling banyak dijumpai
Isotop alaminya terdiri atas isotop 28 (92,2%), isotop 29 (4,7%), isotop 30 (3,1%) Memiliki sifat kimia seperti logam yang lain
Kemampuan semikonduktor akan meningkat jika ditambahkan pengotor suhu
Ditemukan pada banyak senyawa dioksida dan berbagai macam silicate yang ada di alam
Silikon (
Si
)
Fosfor (
P
)
Sifat Fisis
Nomor atom : 15
Konfigurasi e- : [Ne] 3s2 3p 3 Massa Atom relatif : 30,97376
Jari-jari atom : 1,23 Å
Titik Didih : 280 C
Titik Lebur : 44 C
Elektronegatifitas : 2,05
Energi Ionisasi : 1060 kJ/mol
Tingkat Oks. Max : 5+
Struktur Atom : molekul
Poliatom
Wujud : Padat
Catatan
Berupa logam bewarna putih keperakan dan sangat ringan
Banyak dipakai di industri karena ringan dan mampu membentuk aloi yang kuat Termasuk unsur reaktif
Sebagian besar logam dapat dihasilkan dengan bantuan magnesium
Banyak ditemukan di alam dan dalam mineral : dolomite, magnetite, olivine, serpentine Senyawa yang terbentuk umumnya ikatan ion, namun ada juga berupa ikatan kovalen Magnesium umumnya dapat diperoleh melalui pengolahan air laut sbg:
Fosfor (
P
)
Kegunaan
Dipakai pada proses produksi logam, kaca, dan semen
Untuk membuat konstruksi pesawat. Logamnya disebut magnalum Pemisah sulfur dari besi dan baja
Dipakai pada lempeng yang digunakan di industri percetakan Untuk membuat lampu kilat
Sebagai katalis reaksi organik
Fosfor (
P
)
Sulfur (
S
)
Sifat Fisis
Nomor atom : 16
Konfigurasi e- : [Ne] 3s2 3p 4 Massa Atom relatif : 32,066
Jari-jari atom : 1,09 Å
Titik Didih : 445 C
Titik Lebur : 119 C
Elektronegatifitas : 2,45
Energi Ionisasi : 1000 kJ/mol
Tingkat Oks. Max : 6+
Struktur Atom : molekul
poliatom
Wujud : Padat
Kegunaan
Dipakai sebagai bahan dasar pembuatan asam sulfat Digunakan dalam baterai
Dipakai pada fungisida dan pembuatan pupuk Digunakan pada korek dan kembang api
Digunakan sebagai pelarut dalam berbagai proses
Sulfur (
S
)
Catatan
-Zat murninya tidak berbau dan tidak berasa
-Memiliki struktur yang beragam, tergantung konsisi sekitar -Secara alami banyak terdapat di gunung berapi
-Komponen murninya tidak beracun namun senyawa yang terbentuk kebanyakan berbahaya bagi manusia
-Senyawa sulfur yang utama adalah SO2, dan SO3. SO2 berupa gas yang mudah larut
dalam air sehigga menyebabkan hujan asam
-Efek yang ditimbulkan dapat sikurangi dengan cara
melewatkan air yang terkontaminasi pada padatan CaCO3.
SO3 merupakan bahan utama membuat asam sulfat
SO3 diperoleh dari oksidasi SO2 dengan katalis vanadium
Sulfur (
S
)
Chlor (
Cl
)
Sifat Fisis
Nomor atom : 17
Konfigurasi e- : [Ne] 3s2 3p 5 Massa Atom relatif : 35,4527
Jari-jari atom : 0,97 Å
Titik Didih : -35 C
Titik Lebur : -101 C
Elektronegatifitas : 2,85
Energi Ionisasi : 1260 kJ/mol
Tingkat Oks. Max : 7+
Struktur Atom : molekul
diatom
Wujud : gas
Kegunaan
Dipakai pada proses pemurnian air
Cl2 dipakai pada disinfectan
KCl digunakan sebagai pupuk
ZnCl2 digunakan sebagai solder
NH4Cl digunakan sebagai pengisi batere
Digunakan untuk menghilangkan tinta dalam proses daur ulang kertas Dipakai untuk membunuh bakteri pada air minum
Dipakai pada berbagai macam industri
Chlor (
Cl
)
Catatan
Merupakan gas diatomik bewarna kehijauan Termasuk gas yang beracun
Dalam bentuk padat dan cair merupakan oksidator yang kuat Mudah bereaksi dengan unsur lain
Merupakan zat yang paling banyak terkandung di air laut Terdapat juga dalam carnalite dan silvite
Diperoleh dengan cara mengelektrolisis larutan NaCl
Chlor (
Cl
)
Argon (
Ar
)
Sifat Fisis
Nomor atom : 18
Konfigurasi e- : [Ne] 3s2 3p 6 Massa Atom relatif : 39,948
Jari-jari atom : 0,88 Å
Titik Didih : -186 C
Titik Lebur : -189 C
Elektronegatifitas : -
Energi Ionisasi : 1520 kJ/mol
Tingkat Oks. Max : -
Struktur Atom : molekul
monoatom
Wujud : gas
Kegunaan
Sebagai pengisi bola lampu karena Argon tidak bereaksi dengan kawat lampu Dipakai dalam industri logam sebagai inert saat pemotongan dan proses lainnya Untuk membuat lapisan pelindung pada berbagai macam proses
Untuk mendeteksi sumber air tanah Dipakai dalam roda mobil mewah
Argon (
Ar
)
Catatan
Merupakan gas yang tidak bewarna dan berasa Tidak reaktif seperti halnya gas mulia yang lain
Dapat diperoleh dengan cara memaskan udarea dengan CaC2
Terdapat sekitar 1% argon di atmosfer
Terbentuk di atmosfer sebagai akibat dari proses sinar kosmik
Argon (
Ar
)
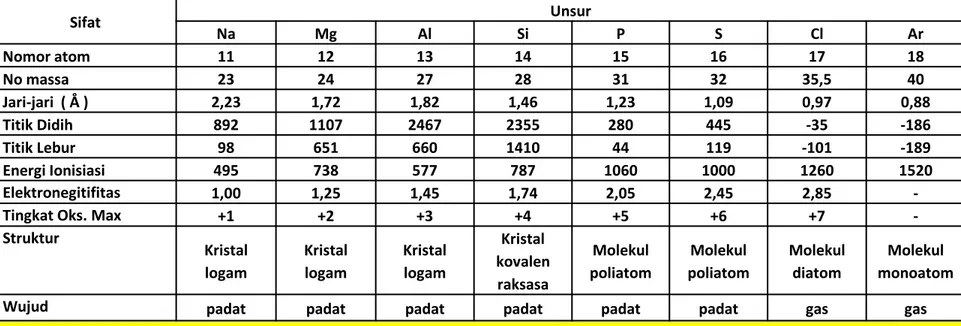
Tabel Perbandingan
Sifat Unsur Na Mg Al Si P S Cl Ar Nomor atom 11 12 13 14 15 16 17 18 No massa 23 24 27 28 31 32 35,5 40 Jari-jari ( Å ) 2,23 1,72 1,82 1,46 1,23 1,09 0,97 0,88 Titik Didih 892 1107 2467 2355 280 445 -35 -186 Titik Lebur 98 651 660 1410 44 119 -101 -189 Energi Ionisiasi 495 738 577 787 1060 1000 1260 1520 Elektronegitifitas 1,00 1,25 1,45 1,74 2,05 2,45 2,85 -Tingkat Oks. Max +1 +2 +3 +4 +5 +6 +7 -
Struktur Kristal logam Kristal logam Kristal logam Kristal kovalen raksasa Molekul poliatom Molekul poliatom Molekul diatom Molekul monoatom Wujud padat padat padat padat padat padat gas gas