25 AKTIVITAS ANTIOKSIDAN BIOPIGMEN Dunaliella salina PADA MEDIA KULTUR
HIPOSLIN DAN HIPERSALIN Oleh
Muhammad Zainuddin
Program Studi Budidaya Perairan, Universitas Islam Nahdlatul Ulama, Jepara. Email : zain_mz86@yahoo.com
Received February 2017, Accepted March 2017 ABSTRAK
Radikal bebas dapat membentuk stress oksidatif yang menyebabkan penyakit kronik degeneratif seperti kanker. Reaktivitas radikal bebas ini dapat diredam oleh senyawa antioksidan. Salah satu senyawa antioksidan alami adalah biopigmen. Mikroalga Dunaliella salina adalah jenis Chlorophyta yang diketahui sebagai sumber biopigmen pada habitat perairan laut. Dalam kultur mikroalga memiliki kendala keterbatasan dalam perekayasaan media dengan tujuan produksi biopigmen. Tujuan penelitian ini untuk mengetahui pengaruh rekayasa media hipersalin dan hiposalin terhadap kandungan biopigmen dan aktivitas antioksidan. Perlakuan perbedaan salinitas (hiposalin dan hipersalin) memberikan pengaruh secara signifikan (p < 0,05) terhadap biomassa basah yaitu terendah pada perlakuan 20 ppt sebesar 9,260 gr/ml sedangkan tertinggi adalah 30 ppt sebesar 10,595 gr/ml. Berdasarkan data kadar air menunjukkan bahwa semakin tinggi salinitas maka kadar air biomassa semakin tinggi (p < 0,05) yaitu sebesar 96,3 – 98,1 %. Perlakuan salinitas 30 ppt memiliki kadar pigmen klorofil a, b dan karotenoid tertinggi (p < 0,05) yaitu sebesar 10,961; 3,636 dan 4,954 mg/l. Semakin tinggi konsentrasi BHT dan pigmen (ditiap salinitas) maka nilai % inhibisi semakin tinggi (p < 0,05). BHT memiliki nilai IC50 sebesar 8,13 ppm
(antioksidan sangat kuat). Sedangkan aktivitas antioksidan pigmen terbaik adalah perlakuan 30 ppt dengan IC50 sebesar 22,860 ppm (antioksidan sangat kuat).
Kata kunci : mikroalga, salinitas, biomassa, pigmen, antioksidan. ABSTRACT
Radicals can form oxidative stress that causes degenerative diseases such as cancer. The reactivity of these free radicals can be mitigated by antioxidant compounds. One of the natural antioxidant compounds is biopigment. Microalgae Dunaliella salina is a type of Chlorophyta that is known as a source of biopigmen in marine waters habitat. In microalgae culture has limited constraints in media engineering with the purpose of biopigment production. The purpose of this study was to determine the effect of hypersalin and hyposaline media engineering on the content of biopigment and antioxidant activity. Treatment of salinity difference (hypocaline and hypersaline) gave significant effect (p <0.05) to the lowest wet biomass at 20 ppt treatment of 9,260 gr / ml while the highest was 30 ppt of 10,595 gr / ml. Based on the data of water content indicated that the higher the salinity, the higher the water content of biomass (p <0,05) that is equal to 96,3 - 98,1%. The 30 ppt salinity treatment had the highest levels of chlorophyll a, b and carotenoid
26
pigments (p <0.05) of 10,961; 3,636 and 4,954 mg / l. The higher the concentration of BHT and pigment (at each salinity) the higher the% inhibition value (p <0.05). BHT has an IC50 value of 8,13 ppm (a very powerful antioxidant). While the best pigment
antioxidant activity is a 30 ppt treatment with IC50 of 22,860 ppm (a very powerful
antioxidant).
Keywords: microalgae, salinity, biomass, pigments, antioxidants. PENDAHULUAN
Dunaliella salina merupakan kelompok alga hijau yang mempunyai kandungan protein, lemak, dan karbohidrat sebagai sumber pangan yang baik (Becker, 2007). Mikrolaga D. salina menghasilkan pigmen (klorofil, karotenoid, β-karoten), asam amino, asam lemak dan gliserol. Secara umum pigmen yang ditemukan adalah klorofil, dan karotenoid. Klorofil a dapat digunakan sebagai pewarna pada bidang farmasi, senyawa turunan dari klorofil juga dapat digunakan sebagai produk kesehatan (Ferruzi & Blakeslee, 2007). Penelitian dari Netherlands Cohort Study menyatakan bahwa dengan mengkonsumsi klorofil dapat menurunkan risiko terkena kanker (Balder et al., 2006).
Karotenoid dimanfaatkan di bidang industri pangan sebagai zat pewarna aditif, antioksidan, dan sebagai pro-vitamin A. Selain itu, β-karoten mempunyai manfaat sebagai obat antikanker, obat penuaan (anti-aging), dan sistem imun (Immunomodulatory properties) (Rock, 2002; Russel, 2002).
Metabolisme mikroalga dipengaruhi oleh faktor fisika, kimia dan biologi lingkungan. Diantaranya adalah intensitas cahaya, nitrogen, nutrient dan suhu. Faktor lingkungan yang diduga mempengaruhi kandungan pigmen, biomassa dan pertumbuhan sel D. salina adalah salinitas. Oleh karena itu perlu adanya penelitian mengenai pengaruh salinitas terhadap kandungan pigmen (klorofil a, b dan karotenoid), biomassa dan pertumbuhan sel pada D. salina.
MATERI DAN METODE Materi Penelitian
Materi penelitian ini adalah mikroalga D. salina dan menggunakan pupuk Walne yang didapatkan dari Laboratorium Pakan Hidup, BBPBAP – Jepara.
27 Metode Penelitian
Penelitian terdiri dari 6 tahap yaitu : (1). Pembuatan media kultur, (2). Kultivasi D. salina (eksperimen salinitas), (3). Pemanenan biomassa D. salina mengacu pada (Amini, 2010). (4). Analisis pigmen klorofil a, b dan karotenoid mengacu pada metode Vo (2014) dan Pisal (2005). (5). Uji aktivitas antioksidan pigmen mengacu pada Hong et al. (2009).
Pembuatan Media Kultur
Media kultur dibuat dengan metode pengenceran dari stok air laut salinitas 32 ppt. Pengenceran dilakukan pada kultur skala laboratorium dengan salinitas 20 ppt, 25 ppt, 30 ppt, 35 ppt, 40 ppt. Setiap perlakuan terdapat 3 pengulangan. Sehingga sebanyak 15 botol kultur masing – masing berkapasitas 500 ml diisi air laut 300 ml yang sudah ditentukan salinitasnya. Masing – masing media air laut ditambahkan 1 ml/l pupuk Walne dan diberi aerasi.
Kultivasi Dunaliella salina pada Salinitas yang Berbeda
Starter D. salina dengan kepadatan awal 112 x 104 sel/ml diinokulasikan kedalam masing – masing botol kultur sehingga mencapai kepadatan 105 sel/ml. Teknik pemberian stater dan pupuk walne dilakukan secara aseptis. Dilakukan pengukuran parameter kualitas media setiap hari sekali pada pukul 15.00 WIB, yaitu pH, DO, salinitas serta memastikan tidak terjadi kontaminan terhadap mikroalga D. salina yang telah dikultivasi.
Pemanenan Biomassa Dunaliella salina
Pemanenan dilakukan pada fase stasioner dengan menggunakan NaOH untuk pengendapan. Masing – masing perlakuan diberi sebanyak 0,3 gram dan dihomogenkan. Selanjutnya hasil kultur tersebut dilakukan inkubasi pengendapan selama 24 jam. Endapan biomassa yang terbentuk dilakukan pemisahan dari cairan jernihnya. Selanjutnya biomassa dicuci dengan aquades untuk menghilangkan kandungan garamnya, kemudian disaring dengan menggunakan kain satin dan dilakukan ekstraksi.
28
Analis Pigmen
Ekstraksi pigmen menggunakan biomassa basah yang mengacu pada Vo (2014) dan Pisal (2005). Biomassa basah D. salina sebesar 0,5 gram dilarutkan ke dalam pelarut aseton 10 ml hancurkan dengan vortex hingga homogen. Selanjutnya di inkubasi pada ruang dan gelap selama 24 jam. Setelah itu disentrifugasi dengan kecepatan 2000 rpm selama 5 menit. Supernatan yang didapatkan dilakukan spektrofotometri. Setelah mendapatkan nilai absorbansinya maka kadar pigmen dapat diketahui melalui perhitungan :
Keterangan : A470, A662, A645, A664, A647, A630 : Nilai absorbansi pada 470, 662, 645, 664, 647, 630 nm,
Ve : Volume ekstrak aseton (ml),
Vs : Volume contoh air yang disaring (liter), d : Lebar diameter cuvet (1cm)
Uji Aktivitas Antioksidan Ekstrak Biopigmen Mikroalgae D. salina
Aktivitas antioksidan ekstrak biopigmen mikroalgae D. salina ditentukan dengan metode DPPH. Larutan pereaksi DPPH yang digunakan dibuat dengan melarutkan kristal DPPH dalam pelarut aseton dengan konsentrasi 0,05 mM yang dibuat segar, dilakukan pada suhu rendah serta terlindung dari cahaya. Perlakuan konsentrasi uji antioksidan menurut Hong et al. (2008) yang dimodifikasi. Uji aktivitas antioksidan dilakukan terhadap ekstrak biopigmen dan kontrol (+) BHT. Ekstrak biopigmen mikroalgae D. salina dan antioksidan sintetik BHT dilakukan pengenceran pada konsentrasi 5, 10, 25, 50 dan 100 ppm. Masing – masing 0,2 ml ekstrak ditambahkan radikal DPPH sebanyak 3,8 ml. Campuran larutan yang telah direaksikan tersebut diinkubasi pada suhu 37 ºC selama 30 menit, kemudian masing-masing larutan diukur absorbansinya menggunakan spektrofotometri UV-Vis pada panjang gelombang 515 nm. Larutan blanko dibuat dengan mencampurkan 0,2 ml
29 metanol dengan 3,8 ml larutan DPPH ditabung reaksi maka menjadi larutan yang mengandung DPPH 0,05 mM. Persentase penghambatan aktivitas radikal bebas diperoleh dari nilai absorbansi sampel.
HASIL DAN PEMBAHASAN
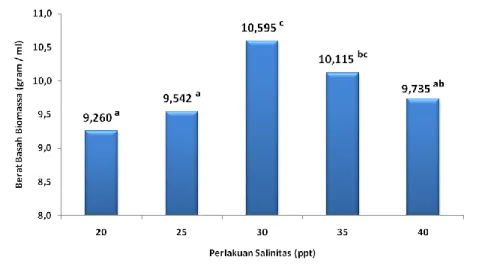
Penelitian telah berhasil dilaksanakan di Laboratorium Budidaya Perairan Universitas Islam Nahdlatul Ulama Jepara. Materi yang digunakan adalah stater mikroalga D salina dari BBPBAP jepara. Penelitian menggunakan perlakuan perbedaan salinitas yaitu 20 ppt, 25 ppt, 30 ppt, 35 ppt dan 40 ppt dalam kultur dengan pupuk walne. Kultur dilakukan panen pada fase pertumbuhan stasioner. Berdasarkan data pertumbuhan pada parameter berat basah biomassa (gambar 1) menunjukkan bahwa perlakuan media hiposalin dan hipersalin memberikan pengaruh terhadap biomassa mikroalga D salina secara signifikan (p < 0,05). Perlakuan salinitas 30 ppt memiliki nilai berat basah biomassa tertinggi yaitu 10,595c yang disebut salinitas optimal dalam pertumbuhan. Perlakuan salinitas hiposalin yaitu 20 dan 25 ppt memiliki nilai berat basah biomassa sebesar 9,260a dan 9,542a berbeda lebih rendah signifikan (p < 0,05) dari 30 ppt. Selain itu perlakuan salinitas hipersalin yaitu 35 dan 40 ppt memiliki nilai berat basah biomassa sebesar 9,735ab dan 10,115bc juga berbeda lebih rendah signifikan (p < 0,05) dari 30 ppt. Hal tersebut diduga karena salinitas berpengaruh terhadap tekanan osmotik. Mikroalga D. salina dapat menolerir terhadap tekanan salinitas yang ekstrim dengan cara membentuk zat organik yang aktif secara osmotik pada sel (Soeder dan Stengel, 1974). Morfologi D. salina yang tidak memiliki dinding sel, sehingga sel dilindungi oleh membran plasma tipis atau disebut dengan periplast yang memungkinkan dapat mengalami perubahan ukuran, bentuk sel dan biomassa sel secara cepat terhadap tekanan osmotik (Venkatsan et al., 2013).
30
Gambar 1. Berat basah biomassa hasil kultur D. salina pada perlakuan perbedaan salinitas.
Gambar 2. Kadar air biomassa D. salina pada perlakuan perbedaan salinitas. Biomassa panen hasil kultur ditiap perlakuan salinitas selanjutnya dilakukan pengeringan dan didapatkan kadar air. Berdasarkan data kadar (gambar 2) menunjukkan bahwa perlakuan media hiposalin dan hipersalin memberikan pengaruh terhadap kadar air mikroalga D salina secara signifikan (p < 0,05) dimana semakin tinggi salinitas maka memiliki kadar air menjadi semakin tinggi. Nilai kadar air yang didapat berkisar 96,3a – 98,1d. Pada salinitas tinggi sel mampu bertahan hidup karena adanya bantuan gliserol yang berfungsi sebagai mendukung tekanan osmotik untuk menyeimbangkan proses osmolaritas pada sel bagian luar (extracellular). Salinitas yang tinggi menyebabkan bertambahnya cairan yang ada pada sel sehingga akan mempengaruhi proses fotosintesis (Avron, 1992).
31 Gambar 3. Kadar pigmen D. salina pada perlakuan perbedaan salinitas.
Biomasa basah yang didapatkan dari hasil kultur dilakukan ekstraksi pigmen dengan menggunakan pelarut organik polar aseton. Selanjutnya dilakukan sentrifugasi dan supernatan disektro untuk deteksi absorbansi pigmen. Berdasarkan data kadar pigmen (gambar 3) menunjukkan bahwa terdeteksi keberadaan pigmen klorofil a, b dan karotenoid. Perlakuan perbedaan salinitas pada media kultur menunjukkan berpengaruh terhadap kadar klorofil a, b dan karotenoid. Perlakuan salinitas 30 ppt memiliki nilai kadar klorofil a, b dan karotenoid tertinggi daripada perlakuan yang lain yaitu sebesar 10,961 mg/l, 3,636 mg/l, 4,954 mg/l. Sedangkan kadar klorofil a, b dan karotenoid terendah terdapat pada perlakuan 40 ppt yaitu sebesar 8,873 mg/l, 2,833 mg/l, 4,095 mg/l. Hal ini didukung dengan pernyataan Heidari et al. (2000); Gomez et al. (2003) yang menyatakan bahwa pigmen klorofil a akan meningkat seiring dengan bertambahnya salinitas. Setelah D. salina memproduksi pigmen klorofil a mencapai optimum, jumlah klorofil a mengalami penurunan pada saat salinitas 35 ppt dan 40 ppt, hal ini dikarenakan adanya pembentukan pigmen karotenoid sebagai metabolit sekunder yang diproduksi oleh sel D. salina pada saat kondisi tekanan yang tinggi sebagai upaya untuk melindungi sel (Pisal, 2005). Ekstrak pigmen pada masing – masing perlakuan salinitas dilakuan uji aktivitas antioksidan. Keberadaan senyawa antioksidan dalam suatu bahan dapat diketahui melalui uji aktivitas antioksidan. Pengujian aktivitas antioksidan dalam ekstrak pigmen D salina dilakukan dengan menggunakan metode DPPH.
32
Pengujian dengan DPPH dapat digunakan untuk menguji kemampuan senyawa antioksidan sebagai proton penangkal senyawa radikal atau donor hidrogin (Singh dan Rajini, 2004).
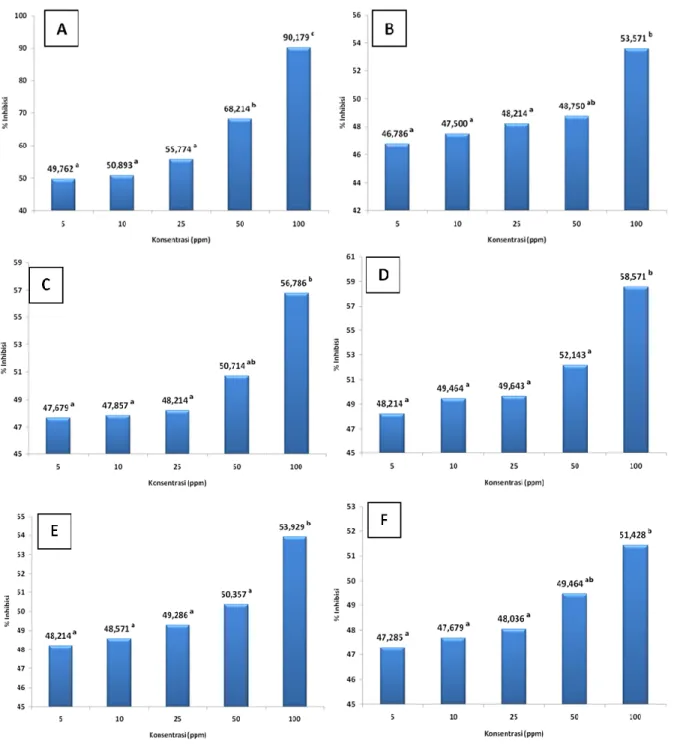
Gambar 4. (a). Persen inhibisi kontrol positif BHT; Persen inhibisi ekstrak pigmen D. salina pada perlakuan : (b). salinitas 20 ppt, (c). salinitas 25 ppt, (d). salinitas 30 ppt, (e). salinitas 35 ppt dan (f). salinitas 40 ppt.
33 Berdasarkan data persen inhibisi gambar 4 menunjukkan bahwa kontrol positif BHT perlakuan perbedaan konsentrasi memberikan aktivitas yang berbeda secara signifikan (p < 0,05). Kontrol positif BHT memiliki hubungan linier antara perbedaan konsentrasi dengan nilai inhibisi yaitu semakin tinggi konsentrasi BHT 5, 10, 25, 50 dan 100 ppm maka nilai persen inhibisi aktivitas antioksidan semakin besar yaitu 49,762a; 50,893a; 55,774a; 68,214b dan 90,179c. BHT adalah antioksidan sintetik yang digunakan sebagai pembanding pada penelitian ini. Antioksidan sintetik ini biasa dicampurkan ke dalam bahan pangan karena efektif menghambat aktivitas radikal bebas dan bersifat sinergis dengan antioksidan lainnya. Namun penggunaan antioksidan sintetik dapat menyebabkan keracunan pada dosis tertentu. Kadar maksimum BHT dalam bahan pangan adalah 200 ppm (Ketaren, 1986). Semakin kecil nilai IC₅₀ maka semakin tinggi aktivitas antioksidannya. Persentase penghambatan tinggi dan nilai IC₅₀ yang rendah membuktikan bahwa BHT bersifat sebagai antioksidan yang kuat. Hal ini disebabkan BHT terbuat dari senyawa-senyawa kimia yang merupakan senyawa antioksidan.
34
Gambar 11. Regresi linier sederhana dari % inhibisi perlakuan perbedaan salinitas. Berdasarkan data pada gambar tersebut menunjukkan bahwa semua perlakuan salinitas memiliki hubungan linier antara perbedaan konsentrasi dengan nilai inhibisi yaitu semakin tinggi ekstrak pigmen 5, 10, 25, 50 dan 100 ppm maka nilai persen inhibisi aktivitas antioksidan semakin besar yaitu untuk salinitas 20 ppt memiliki persen inhibisi sebesar 46,786a; 47,500a; 48,214a; 48,750ab dan 53,571b. Semakin tinggi konsentrasi ekstrak maka persentase aktivitas antioksidannya semakin tinggi pula. Ekstrak pigmen D salina dapat dikatakan memiliki aktivitas antioksidan karena ekstrak tersebut mampu mendonorkan atom hidrogennya ditandai dengan perubahan warna ungu menjadi kuning pucat saat dilakukan pencampuran ke larutan DPPH. Tingkat diskolorisasi warna ungu DPPH mengindikasi aktivitas penghambatan radikal bebas oleh sampel antioksidan. Elektron ganjil pada radikal bebas DPPH menghasilkan penyerapan kuat maksimum pada panjang gelombang 517 nm dan berwarna ungu. Warna ungu berubah menjadi warna kuning ketika elektron ganjil radikal DPPH menjadi berpasangan denga hydrogen dari antioksidan penangkal radikal bebas untuk membentuk DPPH-H (Abdille et al., 2004).
Salinitas 25 ppt memiliki persen inhibisi sebesar 47,679a; 47,857a; 48,214a; 50,714ab dan 56,786b. Salinitas 30 ppt memiliki persen inhibisi sebesar 48,214a; 49,464a; 49,643a; 52,143a dan 59,571b. Salinitas 35 ppt memiliki persen inhibisi sebesar 48,214a; 48,571a; 49,286a; 50,357a dan 53,929b. Salinitas 40 ppt memiliki
35 persen inhibisi sebesar 47,285a; 47,679a; 48,036a; 49,464ab dan 51,428b. Semakin tingginya konsentrasi ekstrak pigmen D salina yang digunakan menghasilkan persentase penghambatan radikal bebas yang tinggi pula. Hal ini sesuai dengan penelitian yang telah dilakukan oleh Hanani (2005) diacu dalam Prabowo (2009), yang menyatakan bahwa persentase penghambatan terhadap aktivitas radikal bebas meningkat dengan meningkatnya konsentrasi ekstrak.
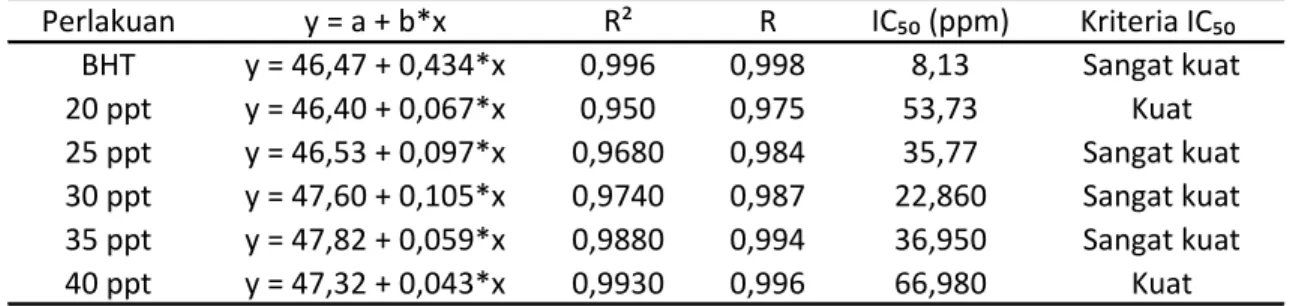
Tabel 1. Nilai IC50 BHT dan ekstrak pigmen D salina pada kultur berbeda salinitas.
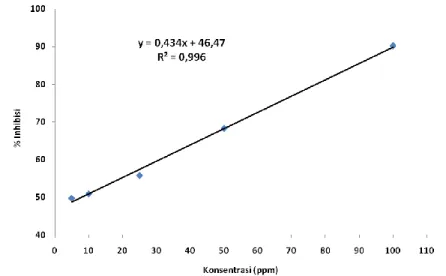
Data persen inhibisi selanjutnya dilakukan analisis regresi linier sederhana untuk melakukan prediksi nilai konsentrasi dalam melakukan peredaman radikal DPPH 50 % (IC50). Analisis regresi linier kontrol positif BHT disajikan pada gambar
10. Persamaan regresi linier kontrol positif BHT adalah y = 0,434*x + 46,47 dengan nilai koefisien determinan (R2) sebesar 0,996 dan koefisien korelasi (R) sebesar 0,998. Berdasarkan tabel 1 menunjukkan bahwa kontrol positif BHT memiliki aktivitas antioksidan yang lebih baik daripada ekstrak pigmen. Nilai IC50 kontrol positif BHT
sebesar 8,13 ppm dengan kriteria tergolong sebagai antioksidan sangat kuat.
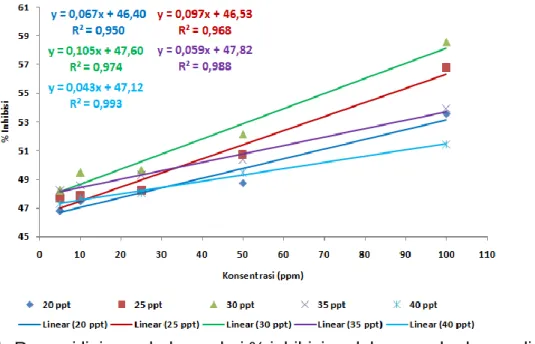
Analisis regresi linier ekrak pigmen D salina pada salinitas 20, 25, 30, 35 dan 40 ppt disajikan pada gambar 10 (a) hingga (f). Data nilai IC50 dan kriteria
antioksidan pada ekstrak pigmen D salina pada salinitas 20, 25, 30, 35 dan 40 ppt disajikan pada tabel 1. Berdasarkan garis linier gambar 10 dan IC50 tabel 1
menunjukkan bahwa perlakuan perbedaan ekstak pigmen dari salinitas berbeda menunjukkan tren linier persen inhibisi yang berbeda dan nilai aktivitas antioksidan yang berbeda. Berdasarkan garis tren linieritas gambar 10 menunjukkan bahkan perlakuan 30 ppt memiliki tren linier persen inhibisi paling tinggi dari pada perlakuan salinitas yang lain. Sedangkan perlakuan salinitas 40 ppt memiliki tren linier persen inhibisi yang paling rendah. Ekstrak pigmen perlakuan salinitas 20 ppt memiliki persamaan regresi linier y = 0,067*x + 46,40 dengan nilai koefisien determinan (R2)
Perlakuan y = a + b*x R² R IC₅₀ (ppm) Kriteria IC₅₀ BHT y = 46,47 + 0,434*x 0,996 0,998 8,13 Sangat kuat 20 ppt y = 46,40 + 0,067*x 0,950 0,975 53,73 Kuat 25 ppt y = 46,53 + 0,097*x 0,9680 0,984 35,77 Sangat kuat 30 ppt y = 47,60 + 0,105*x 0,9740 0,987 22,860 Sangat kuat 35 ppt y = 47,82 + 0,059*x 0,9880 0,994 36,950 Sangat kuat 40 ppt y = 47,32 + 0,043*x 0,9930 0,996 66,980 Kuat
36
sebesar 0,950 dan koefisien korelasi (R) sebesar 0,975. Nilai IC50 ekstrak pigmen
perlakuan salinitas 20 ppt sebesar 53,73 ppm dengan kriteria tergolong sebagai antioksidan kuat. Aktivitas antioksidan ekstrak pigmen D salina dinyatakan dengan persentase penghambatan (% inhibisi) dan nilai IC50. Persentase penghambatan adalah kemampuan suatu bahan untuk menghambat aktivitas radikal bebas, yang berhubungan dengan konsentrasi suatu bahan. IC50 merupakan konsentrasi larutan substrat atau sampel yang akan menyebabkan reduksi terhadap aktivitas DPPH sebesar 50 % (Molyneux, 2004).
Ekstrak pigmen perlakuan salinitas 25 ppt memiliki persamaan regresi linier y = 0,097*x + 46,53 dengan nilai koefisien determinan (R2) sebesar 0,968 dan koefisien korelasi (R) sebesar 0,984. Nilai IC50 ekstrak pigmen perlakuan salinitas 25
ppt sebesar 35,77 ppm dengan kriteria tergolong sebagai antioksidan sangat kuat.Persamaan regresi linier perlakuan salinitas 30 ppt adalah y = 0,105*x + 47,60 dengan nilai koefisien determinan (R2) sebesar 0,974 dan koefisien korelasi (R) sebesar 0,987. Nilai IC50 ekstrak pigmen perlakuan salinitas 30 ppt sebesar 22,86
ppm dengan kriteria tergolong sebagai antioksidan sangat kuat. Persamaan regresi linier perlakuan salinitas 35 dan 40 ppt adalah y = 0,059 *x + 47,82 dan y = 0,043 *x + 47,32 dengan nilai koefisien determinan (R2) sebesar 0,988 dan 0,993 sera koefisien korelasi (R) sebesar 0,994 dan 0,996. Nilai IC50 ekstrak pigmen perlakuan salinitas 35
dan 40 ppt sebesar 36,95 ppm dan 66,98 ppm dengan kriteria tergolong sebagai antioksidan sangat kuat dan kuat. Antioksidan dapat secara efektif mendonorkan sebuah elektron kepada radikal bebas. Apabila radikal bebas telah mendapatkan elektron dari antioksidan maka radikal bebas akan menjadi stabil. Setelah antioksidan mendonorkan sebuah elektronnya, antioksidan akan berubah menjadi radikal bebas, akan tetapi dalam fase ini tidak berbahaya karena mampu menyesuaikan perubahan kehilangan elektron tanpa berubah menjadi reaktif (Helwig, 2008).
37 KESIMPULAN
Berdasarkan data berat basah biomassa, kadar klorofil a, b dan karotenoid serta aktivitas antioksidan maka dapat diketahui bahwa salinitas 30 ppt yang paling optimal untuk melakukan kultur dalam usaha produksi biomassa dan biopigmen sebagai agen antioksidan.
UCAPAN TERIMAKASIH
Penulis mengucapkan terimakasih kepada LPPM UNISNU Jepara yang telah mensuport dalam biaya penelitian pada program penelitian reguler universitas. Selain itu juga, mengucapkan terimakasih kepada Ka Prodi Budidaya Perairan UNISNU Jepara atas kesempatan yang diberikan kepada penulis untuk dapat mengerjakan penelitian ini.
DAFTAR PUSTAKA
Abdille HMD, Singh RP, Jayaprakasha GK, Jena BS. 2004. Antioxidant activity of the extracts from Dillenia indica fruits. Journal of Food Chemistry. 90: 891-896.
Amini, S. dan R. Susilowati. 2010. Produksi Biodiesel dariMikroalgaBotryococcusbraunii. Squalen, 5(1).
Avron, M. 1992. Osmoregularity, in Dunaliella: Physiology, Biochemistry and Biotechnology, edited by M. Avrondan A Ben Amotz. CRC Press, Boca Raton, Florida, 135-164.
Balder, H.F., J. Vogel, M.C.J.F. Jansen, M.P.Weijenberg, P.A. Van den Brandt, S.Westenbrink, R. Van der MeerandR.A. Goldbohm. 2006.Heme and chlorophyll intake and risk of colorectal cancer in the Netherlands cohort study. Cancer Epidemiology Biomarkers andPrevention,15:717-725.
Becker, E.W. 2007. Microalgae as a Source of Protein. Biotechnol. Adv., 25;207-210. Ferruzi, M.G., J. Blakeslee. 2007, Digestion, Absorption, and Cancer Preventive
Activity of Dietary Chlorophyll Derivatives. Nutrition Research,27:1-12.
Gomez, P.I., A. Barriga, A. Cifuentes, dan M.A. Gonzalez. 2003. Effect of Salinity on The Quantity and Quality of Carotenoids Accumulated by Dunaliella salina (Strain CONC-2007) and Dunaliella bardawil (Strain ATCC 30861) Chlorophyta. Bio. Res., 36:185-192.
Hanani E, Mun’im B, Sekarini R. 2005. Identifikasi senyawa antioksidan dalam spons Callispongia sp dari Kepulauan Seribu. Majalah Ilmu Kefarmasian 2(3):127-133.
38
Heidari, R., H. Riahi, dan S. Saadatmand. 2000. Effect of Salt and Irradiance Stress on Photosynthetic Pigments and Proteins in Dunaliella salina Teodoresco. J. Sci. I.R., 11(2):1-5.
Helwig B. 2008. Antioxidants. http://www.exrx.net/nutrition/antioxidants/html. [24 Juli 2016].
Hong Ye, Zhou Chunhong, Sun Yi, Zhang Xin, Liu Jun, Hu Qiuhui, Zeng Xiaoxiong, 2009, Antioxidant Activities Invitro of Ethanol Extract From Brown Seaweed Sargassum pallidum, Eur Food Res Technol 230:101-109.
Ketaren S. 1986. Pengantar Teknologi Minyak dan Lemak Pangan. Jakarta: UI Molyneux P. 2004. The use of stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioksidan activity. Songklanakarin J Sci Technol. 26(2):211-219.
Pisal, S. Dipak and S. S. Lele. 2005. Carotenoid Prodution from Microalga, Dunaliella Salina. Indian Journal of Biotechnology, 10(4):476-483.
Prabowo TT. 2009. Uji aktivitas antioksidan dari keong matah merah (Cerithidea Rock, C.L. 2002. Carotenoids and Cervival, Breast, Ovarian, and Colorectal Cancer. Epidemiology and Clinical Trials. Pure Appl Chem., (74):1451-1459. Russell, R.M. 2002. Β-carotene and Lung Cancer.Pure Appl Chem., (74):1461-1467. Singh RP, Rajini BS. 2004. Antioxidant Activity Of The Extracts From Dillenia
Indica Fruits. Journal of Food Chemistry. 90: 891-896.
Soeder, C. and E. Stengel. 1974. Physico-chemical Factors Affecting Metabolism and Growth Rate. In: Algal physiology and chemistry, pp. 714-740, W. D. P. Stewa rt-red.). Univ. of California Press, Berkeley and Los Angeles, California.
Venkatsen, S., M.S.Swamy, C.Senthil, S.Bhaskar andR. Rengasamy. 2013. Culturing Marine Green Microalgae DunaliellasalinaTeod. And DunaliellatertiolectaMasjuk in Dewalne’s Medium for Valuable Feeds Stock. Journal of Modern Biotechnology, 2(2):40-45.
Vo, Trung and Duc Tran. 2014. Carotene and Antioxidant Capacity of Dunaliellasalina Strains. World Journal of Nutrition and Health, 2 (2):21-23.