UPAYA PELESTARIAN TANAMAN EDELWEISS (Anaphalis javanica) DENGAN
METODE KULTUR JARINGAN
Widi Purwianingsih, Dini Fatwa Kania, R.Kusdianti
Departemen Pendidikan Biologi, Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam, Universitas Pendidikan Indonesia
ABSTRAK
Eksploitasi secara berlebihan pada tumbuhan dapat mengancam kelestarian jenis-jenis tumbuhan tertentu diantaranya edelwis (Anaphalis javanica ). Kerenanya diperlukan upaya untuk melestarikannya. Kultur jaringan dengan berbagai kelebihannya dapat digunakan sebagai salah satu metode untuk upaya pelestarian tanaman. Tujuan dari penelitian ini untuk menganalisis respons pertumbuhan potongan jaringan A. javanicapada medium Murashige-Skoog (MS) dengan penambahan zat pengatur tumbuh (ZPT), sebagai langkah awal perbanyakkan tanaman tersebut. Potongan jaringan yang digunakan berupa daun, buku dan pucuk. ZPT yang digunakan meliputi Benzyl-amino-purine (BAP), Napthalene-acetic-acid (NAA), 2,4-Dichlorophenoxyacetic Napthalene-acetic-acid (2,4-D), kinetin dan Indole-3-butyric Napthalene-acetic-acid (IBA). Hasil penelitian menunjukkan setelah tiga minggu penanaman, terjadi pembentukan tunas dari potongan jaringan buku (BAP 2,5mg/L dan NAA 0 mg/L) dan potongan jaringan pucuk (BAP 0,75mg/L dan kinetin 0,3 mg/L dan BAP 1 mg/L dan kinetin 0,3 mg/L). Tunas yang telah tumbuh selanjutnya disubkultur agar terjadi multiplikasi. Multiplikasi tunas maksimum terjadi pada medium subkultur dengan ZPT berupa BAP 2,5-3,0 mg/L dan NAA 0,5 mg/L setelah 21 hari subkultur. Tunas mengalami pemanjangan setelah 2 minggu penanaman. Selain pembentukkan tunas, juga terbentuk kalus dari eksplan daun (2,4-D 2 mg/L). Penelitian ini menunjukan bahwa potongan jaringan dari Anaphalis
javanicayang ditanam pada medium Murashige-Skoog memberikan respons berupa tunas, perbanyakkan
dan pemanjangan tunas serta pembentukkan kalus.
Kata kunci : Anaphalis javanica, medium Murashige-Skoog, zat pengatur tumbuh (ZPT)
PENDAHULUAN
Sampai saat ini, tumbuhan di Indonesia telah diidentifikasi oleh Lembaga Ilmu Pengetahuan Indonesia (LIPI) berjumlah 8000 spesies, jumlah tersebut diperkirakan masih 20%nya dari yang ada di Indonesia (LIPI, 2013). Disadari atau tidak keanekaragaman hayati adalah pusat dari semua sektor yang penting bagi kehidupan manusia (Walujo, 2001).
Eksploitasi secara berlebihan pada berbagai tumbuhan baik tumbuhan endemik maupun non endemik dapat menyebabkan berkurangnya flora dalam hal ini flora di Indonesia. Salah satu contoh tumbuhan yang sering dieksploitasi yaitu Anpahlais javanica, atau secara umum dikenal dengan bunga edelweis.
Menurut Conqruist (1989), A. javanica termasuk ke dalam familia Asteraceae. Menurut Van Steenis (2006) secara morfologis ciri-ciri dari Anaphalis
javanica adalah, merupakan tumbuhan perdu dengan
bulu putih, bercabang lebat, ranting-rantingnya berdaun kering putih kelabu, bunganya berbentuk bonggol kecil, pada tengah bunga yang berwarna kuning dan daun tidak lengket. Berbagai jenis serangga seperti lebah, diptera, hemiptera dan kupu-kupu menyukai bunga ini.
a b c
Gambar 1. a; Anaphalis javanica (edelweiss) Satu
tangkai Anaphalis javanica, b; Bunga, c;. daun dan buku
A. javanica merupakan tanaman endemik zona
alpine/montana yang terdapat dipegunungan tinggi (Rakhmadani, 2015). Tanaman ini hanya dapat tumbuh pada ketinggian tertentu yaitu pada ketinggian 1600 sampai 3600 mdpl (Van Leeuwen, 1933 dan Van Steenis, 1978). Bunga dari edelweiss merupakan sumber makanan bagi serangga-serangga tertentu, sehingga keberadaannya dapat mempengaruhi kelestarian serangga dan secara tidak langsung berpengaruh terhadap rantai makanan. Van Leeuwen (1933) mengemukakan bahwa terdapat ± 300 spesies serangga yang berasal dari ordo Hemiptera, Thysanoptera, Lepidoptera, Diptera, dan Hymenoptera, yang ditemukan pada bunga tersebut.
Pemanfaatan tanaman A. Javanica diantaranya sebagai tanaman obat dan juga sebagai pelindung untuk menahan hempasan air hujan sehinga dapat mengurangi erosi di lereng pegunungan (Zoditama, 2012). Menurut Messner
et al. (2013) dalam edelweiss terdapat lignin berupa
senyawa 5-Methoxyleoligin yang berfungsi merangsang angiogenesis (proses pembentukan pembuluh darah) pada penyakit myocardial infarction (MI). Penelitian pada jenis lain yaitu edelweiss jenis Leontopodium
alpinum berfungsi sebagai tanaman obat dan kosmetik
(Dweck, 2004).
Sampai saat ini penelitian tentang perbanyakan tanaman edelweiss di Indonesia masih jarang dilakukan, meskipun pada tahun 1990 telah dilakukan penelitian mengenai kemungkinan perbanyakkan terhadap
Anaphalis javanica di Taman Nasional Gede Pangrango.
Hal ini dilakukan untuk mengantisipasi dan mencoba melakukan perbanyakan tersebut yang menjadi salah satu tumbuhan endemik di Indonesia. Hasil penelitian
menunjukkan bahwa mungkin dilakukannya
penangkaran terhadap edelweiss secara stek dengan penyiraman sebanyak dua sampai tiga kali sehari. Jumlah A. javanica yang tumbuh secara stek sebanyak 63,75% dan berakar 41,67% (Aliadi et al., 1990). Dalam skala laboratorium upaya konservasi pernah dilakukan dengan teknik kultur jaringan pada edelweiss jenis lain yaitu Anaphalis elliptica oleh Senthilkumar dan Paulsamy (2010) di India.
Kultur jaringan merupakan suatu teknik untuk mengisolasi sel, protoplasma, jaringan, organ dan menumbuhkan bagian tersebut pada nutrisi yang mengandung zat pengatur tumbuh tanaman pada kondisi aseptik, sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman sempurna kembali (Ekosari, 2014). Salah satu pemanfaatan kultur jaringan adalah untuk pelestarian plasma nutfah. Kultur jaringan dalam pelestarian plasma nutfah ini termasuk salah satu cara praktis untuk menyimpan bibit tanaman dari genotip yang terpilih, karena dalam pelaksanaanya teknik in vitro dapat memodifikasi atau mengatur kondisi yang sesuai untuk tanaman tersebut. Keberhasilan kultur jaringan dipengaruhi oleh beberapa faktor, diantaranya jenis dan komposisi Zat Pengatur Tumbuh (ZPT). Beberapa ZPT yang sering digunakan dalam kultur jaringan adalah dari kelompok auksin (misalnya Benzyl-amino-purine
(BAP), Napthalene-acetic-acid (NAA),
2,4-Dichlorophenoxyacetic acid (2,4-D)dan sitokinin seperti ), kinetin, dan Indole-3-butyric acid (IBA).
Salah satu medium yang paling sering digunakan untuk perbanyakkan tanaman adalah medium Murashige dan Skoog (MS) termasuk dalam perbanyakkan genus Anaphalis. Senthilkumar dan Paulsamy (2010) menggunakan medium ini untuk perbanyakkan tanaman
Anaphalis eliptica, dengan penambahan ZPT berupa
NAA, BAP, 2,4-D, kinetin, dan IBA .
METODE PENELITIAN
Penelitian ini dilaksanakan di Laboraorium Fisiologi Tumbuhan dan Laboratorium Botani Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam
Universitas Pendidikan Indonesia. Desain penelitian menggunakan Rancangan Acak Lengkap (RAL). Tanaman Anaphalis javanica yang digunakan berumur
lima bulan berasal dari Gunung Papandayan Garut Jawa Barat. Potongan jaringan yangdigunakan berupa buku, daun dan pucuk. Buku dan daun yang digunakan merupakan buku ke delapan dari pucuk.
Medium yang digunakan yaitu Medium
Murashige-Skoog (MS 1) dengan penambahan berbagai konsentrasi BAP, NAA, 2,4-D, kinetin dan IBA. (Tabel 1a, Tabel 1b, dan Tabel 1c). Respons terbaik dari setiap potongan jaringan akan dilanjutkan dengan subkultur. Kombinasi konsentrasi subkultur disesuaikan dengan respons yang dihasilkan dari setiap potongan jaringan.
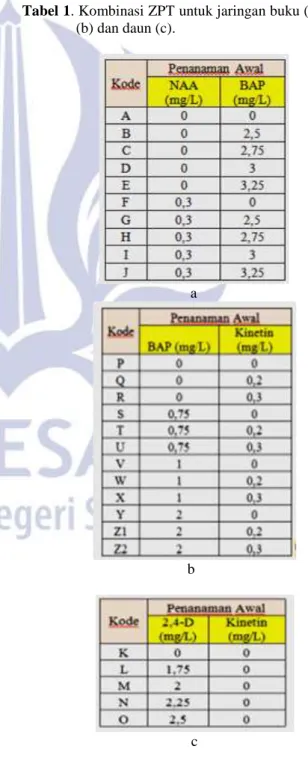
Tabel 1. Kombinasi ZPT untuk jaringan buku (a), pucuk
(b) dan daun (c).
a
b
Sebelum potongan jaringan ditanam pada medium kultur, semua bahan yang akan digunakan pada proses penanaman disiapkan terlebih dahulu diantaranya medium yang telah disterilisasi, potongan jaringan, akuades, alkohol, scalpel, steril blade, cawan petri, plastik tahan panas, spirtus, pinset, karet, kertas saring, dan alumunium foil. Bahan yang telah disiapkan kemudian dimasukan ke dalam laminar air flow dan disinari dengan ultra violet selama kurang lebih 30 menit. Alat dan bahan yang telah disinari dengan ultra violet selanjutnya siap digunakan untuk penanaman potongan jaringan. Potongan jaringan yang telah ditanam pada medium MS kemudian disimpan di ruang kultur yang steril. Suhu yang digunakan pada ruang kultur ± 21 0C. Lemari penyimpanan botol kultur dilap dan disemprot menggunakan alkhol 70% secara berkala. Pengamatan pertumbuhan dilakukan dua hari sekali selama tiga minggu untuk mengetahui respons pertumbuhan terhadap parameter pertumbuhan potongan jaringan edelweiss secara morfologi yang meliputi tumbuhnya pucuk, akar atau kalus dari berbagai potongan jaringan yang berbeda. Selain itu, pada saat pengamatan jika terdapat medium kultur yang kontaminasi langsung dipisahkan.
HASIL DAN PEMBAHASAN
Potongan jaringan yang berbeda-beda (Tabel 1), menghasilkan respons yang berbeda. Respons dari ketiga jenis potongan jaringan didominasi oleh respons tunas dan kalus. Induksi tunas terjadi pada kedua jenis potongan jaringan yaitu buku dan pucuk (tunas yang terbentuk dapat dilihat pada gambar 3.1). Kemunculan tunas ini terjadi pada hari ke enam sampai hari ke-15. Induksi tunas pada potongan jaringan buku paling cepat terjadi pada hari ke enam dengan kombinasi konsentrasi BAP 2,5 mg/L dan NAA 0mg/L (B), BAP 2,75 mg/L dan NAA 0 mg/L (C), BAP 2,75 mg/L dan NAA 0,3 mg/L (H), BAP 3 mg/L dan NAA 0,3 mg/L (I), namun berdasarkan persentase (%) kombinasi konsentrasi ZPT tertinggi yaitu pada BAP 2,5 mg/L dan NAA 0mg/L (B) sebesar 37,5%.
Potongan jaringan pucuk menghasilkan tunas pada hari ke enam pada konsentrasi BAP 0,75 mg/L dan kinetin 0,3 mg/L (U). Persentase yang terjadi pada
potongan jaringan pucuk ini mencapai
66,67%.Berdasarkan data di atas, dapat dilihat bahwa respons terbaik dari kombinasi konsentrasi ZPT pada potongan jaringan buku yaitu BAP 2,5 mg/L dan NAA 0 mg/L (B). Respons yang muncul pada hari ke enam tersebut lebih cepat jika dibandingkan dengan edelweiss species Anaphalis elliptica yang diteliti oleh Senthilkumar dan Paulsamy (2010), yang menunjukkan bahwa respons berupa tunas paling cepat terjadi pada hari ke-17 dengan jenis dan kombinasi konsentrasi ZPT yang sama yaitu BAP 2,5mg/L dan NAA 0 mg/L. Perbedaan respons dalam jangka waktu yang berbeda ini dapat disebabkan oleh pengaruh jenis species tanaman yang digunakan berbeda, kondisi tanaman dilingkungan asli serta pengaruh penggunaan jenis dan kombinasi konsentrasi ZPT yang digunakan berbeda.
Gambar 2. Pembentukan tunas pada hari ke enam pada
kombinasi BAP 2,75 mg/L, NAA 0 mg/L (B)
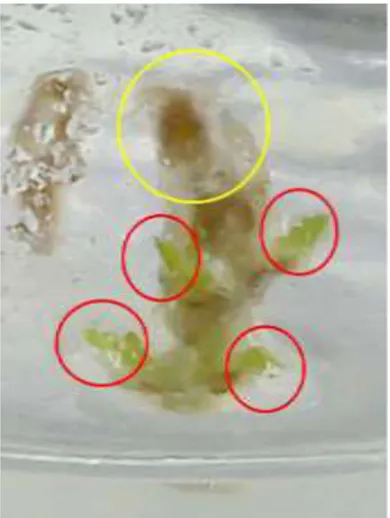
Berbeda dengan kedua potongan jaringan di atas, potongan jaringan daun merespons pertumbuhan berupa kalus (respons pembentukan kalus dapat dilihat pada gambar 3.2.). Respons terjadi rata-rata pada hari ke enam pada konsentrasi 2,4-D 1,75 mg/L dan kinetin 0 mg/L (L), 2,4-D 2 mg/L dan kinetin 0 mg/L (M), 2,4-D 2,25 mg/L dan kinetin 0 mg/L (N), 2,4-D 2,5 mg/L dan kinetin 0 mg/L (O). Namun hanya terdapat dua kombinasi konsentrasi yaitu M dan N yang berhasil sampai umur tiga minggu pengkulturan. Persentase yang paling tinggi terjadi pada konsentrasi M dengan persentase sebesar 75% sedangkan pada konsentrasi N persentase sebesar 25%.
Setelah potongan jaringan menghasilkan respons berupa tunas dan mencapai pertumbuhan optimal pada hari ke 21, selanjutnya tunas yang dihasilkan ditanam pada medium subkultur dengan tujuan agar tunas bermultiplikasi. Untuk tujuan ini, tunas yang dipilih adalah tunas-tunas yang berasal dari medium yang menghasilkan tunas dengan presentase tertinggi yaitu pada BAP 2,5 mg/L dan NAA 0mg/L (B) sebesar 37,5% untuk potongan jaringan buku dan konsentrasi BAP 0,75 mg/L dan kinetin 0,3 mg/L (U) untuk potongan jaringan pucuk.
Gambar 3. Respons Potongan Jaringan Daun yang
Menginduksi Kalus dengan Kombinasi Konsentrasi 2,4D 2,25mg/L dan Kinetin 0 mg/L (M).
Medium subkultur untuk multiplikasi menggunakan kombinasi konsentrasi BAP 3 mg/L dan NAA 0,5 mg/L, untuk tunas yang berasal dari jaringan buku dan BAP 1 mg/L dan Kinetin 0,3 mg/L untuk jaringan pucuk. Multiplikasi merupakan tahap perbanyakan propagul dengan melakukan beberapa kali subkultur (Yusnita, 2003). Kombinasi konsentrasi tersebut diambil dari penelitian yang dilakukan Senthilkumar dan Paulsamy (2010) yang mengkultur
Anaphalis elliptica, konsentrasi tersebut menunjukkan
hasil paling tinggi untuk pemanjangan tunas. Setelah dilakukan multiplikasi dilanjutkan dengan subkultur pemanjangan tunas dengan konsentrasi medium yang digunakan sama dengan sebelumnya yaitu yaitu BAP 3 mg/L dan NAA 0,5 mg/L. Hasil subkultur untuk multiplikasi tunas dapat dilihat pada Tabel 2 dan Gambar 4.
Tabel 2. Rata-rata Jumlah Tunas Hasil Multiplikasi pada
Asal Eksplan Berbeda.
a b c
Gambar 4. Respons Terjadinya Multiplikasi (a & b) dan
Pemanjangan Tunas (c).
Berdasarkan Tabel 2 dan Gambar 4 di atas, ternyata perlakuan subkultur berhasil menumbuhkan perbanyakkan tunas (multiplikasi). Terjadinya hal tersebut menunjukkan bahwa terjadi kesesuaian antara hormon endogen dan eksogen yang diberikan. Pertambahan tunas yang terjadi dipengaruhi oleh hormon endogen dan eksogen yang dimiliki jaringan yaitu sitokinin dan auksin. Secara alamiah sitokinin yang disintesis diakar ditranslokasikan ke bagian batang dan daun melalui xilem. Proses translokasi tersebut bersamaan dengan pengangkutan air dan mineral. Transfer sitokinin dari akar ke pucuk harus memiliki
sebuah regulasi, hal ini diatur melalui perkembangan akar dan pucuk (Taiz dan Zeiger, 2002). Sedangkan mekanisme auksin dalam merangsang pertumbuhan dilakukan dengan cara merangsang sekresi H+ dan K+, ion diambil masuk kedalam sel untung mengimbangi pengeluaran H+ yang menurunkan potensial air sehingga terjadi pengembangan sel (Katuuk, 1989).
Setelah terjadi perbanyakkan tunas, dilakukan subkultur kedua pada medium dengan komposisi ZPT sama, dengan cara memisahkan tunas-tunas tersebut untuk memperoleh perpanjangan tunas. Dari hasil proses ini, ternyata setelah 14 hari terjadi pemanjangan (Gambar 4c). Terjadinya pemanjangan tunas, juga dapat disebabkan oleh kesesuaian komposisi hormon endogen dan eksogen. Pemanjangan terjadi dengan nilai rata-rata pemanjangan 1,1 cm dari panjang awal.
Setelah pemanjangan tunas berhasil dilakukan, tunas disubkultur pada medium perakaran, yaitu medium MS dengan penambahan 1 mg/L IBA (Indole-3-butyric acid). Dari proses tersebut, sampai waktu pengamatan mencapai 4 minggu, tidak terbentuk akar, sehingga dianggap proses perakaran belum berhasil.
Pembentukan tunas secara in vitro sangat menentukan keberhasilan produksi bibit yang cepat dan banyak. Semakin banyak tunas yang terbentuk tentu akan dihasilkan biit yang semakin banyak. Dengan demikian berdasarkan hasil penelitian ini, dapat diharapkan bahwa reproduksi secara in vitro tanaman A.
javanica mempunyai prospek yang baik untuk dikembangkan di masa yang akan datang sebagai salah satu upaya konservasi tanaman tersebut.
KESIMPULAN
Berdasarkan hasil penelitian dapat disimpulkan bahwa potongan jaringan edelweiss (Anaphalis javanica) yang ditanam pada medium Murashige-Skoog menunjukan adanya respons. Respons yang muncul yaitu pembentukkan tunas dari potongan jaringan buku dan pucuk dan kalus dari potongan jaringan daun. Tunas yang terbentuk dari kedua sumber potongan jaringan dapat dimultiplikasi dan diperpanjang dengan disubkultur pada medium yang sama dengan penambahan BAP 3 mg/L dan NAA 0,5 mg/L. Pada tahap perakaran semua potongan jaringan belum bisa terbentuk akar. Oleh karena itu masih perlu dilakukan penelitian lanjutan untuk menghasilkan organogenesis secara lengkap. Dengan demikian berdasarkan hasil penelitian ini, dapat diharapkan bahwa reproduksi secara
in vitro tanaman A. javanica mempunyai prospek yang
baik untuk dikembangkan dimasa yang akan datang sebagai salah satu upaya konservasi tanaman tersebut.
DAFTAR PUSTAKA
Conqruist, A. (1981). An Integrated System Of
Classification Of Flowerung Plants. New York:
Columbia University Press.
Dweck, A.C. (2004). A Review of Edelweiss. Journal of
Ekosari, (2014). Kultur Jaringan. [Online]. Diakses dari : http://staff.uny.ac.id/sites/default/files.
Katuuk, J. (1989). Teknik Kultur Jaringan Dalam
Mikropropagasi Tanaman. Jakarta: Departemen
Pendidikan dan Kebudayaan.
Lembaga Ilmu Pengetahuan Indonesia. (2013).
Bioresources Untuk Pembangunan Ekonomi Hijau, Jakarta:LIPI.
Lestari, G.E. (2011). Peranan Zat Pengatur Tumbuh dalam Perbanyakan Tanaman melalui Kultur Jaringan. Jurnal AgroBiogen. 7(1): Hlmn 63-68. Mesner, B., Kern, J., Wiedemann, D., Schwaiger. S,
Turkcan, A., Ploner, C., Trockenbacher, A., Aumayr, K., Bonaros, N., Laufer, G., Stuner, H., Untergasser, G., Bernhard, D. (2013). 5-Methoxyleoligin, a Lignan from Edelweiss, Stimulates CYP26B1-Dependent Angiogenesis In Vitro and Induces Arteriogenesis in Infarcted Rat Hearts In Vivo. Journal of Edelweis for heart (plosone.org). 8(3).Hlm 1-11.
Pierik, L. M. (1987). In vitro Culture of Higher Plants. Boston: Martinus Nijhoff Publisher.
Rakhmadani, A,N. (2015) Bunga Edelweiss. (Online). Diakses dari http: // biodiversitywarriors. org. Senthilkumar, P., Paulsamy, S. (2010). Conservation of
an endemic medicinal plant, Anaphalis eliptica DC. By employing plant tissue culture technique.
Journal of Applied and natural Science. 2 (1).
Hlm 17-21.
Taiz L, Zeiger E (1998) Plant physiology. 2nd Edition. Sinauer Associates Inc : Sunderland Van Leeuwen,W.M.D. (1933). Biologi of Plant and Animals Pccuring in the higher Parts of Mount Pangrango Gede In West Java.Bogor : Pusat Penelitian Biologi LIPI.
Van Steenis,C.G.G.J.. (2006). Flora Pegunungan Jawa. Bogor : Pusat Penelitian Biologi LIPI.
Walujo, E.B., (2001). Keanekaragaman Hayati Untuk
Pangan. Bogor : Herbarium Bogoriense, Pusat
Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia.
Zoditama, B. (2012). Edelweiss, Tetaplah Abadi. [Online]. Diakses dari http://jelajah. valadoo.com/. Zulkarnain. (2009) Kultur Jaringan Tanaman. Jakarta: