UJI EFEKTIFITAS BEBERAPA MIKROORGANISME ANTAGONIS TERHADAP Pseudomonas solanacearum PENYEBAB PENYAKIT LAYU
PADA TANAMAN PISANG
Oleh :
Ni Made Laksmi Ernawati dan Febriana Tri Wulandari
Staf Pengajar pada Fakultas Pertanian Universitas Mataram
Abstrak : Penelitian bertujuan untuk menguji efektifitas beberapa mikroorganisme antagonis terhadap P. solanacearum pada tanaman pisang. Penelitian dilakukan di Laboratorium Bakteriologi Jurusan HPT
Fakultas Pertanian Universitas Brawijaya Malang. Percobaan dirancang menggunakan Rancangan Acak Lengkap (RAL) dengan 28 perlakuan dan masing-masing perlakuan diulang tiga kali. Hasil penelitian menunjukkan bahwa perlakuan tanpa penambahan mikroorganisme antagonis intensitas serangannya 100% dan tanaman mati 35 hari setelah inokulasi dengan P. solanacearum, sedangkan dengan penambahan mikroorganisme antagonis intensitas serangannya lebih rendah dan tanaman tidak mati. Tidak ada perbedaan penekanan antara 6 mikroorganisme antagonis terpilih terhadap P. solanacearum. Berdasarkan perbedaan tipe koloni dan macam tanah yang digunakan Bacillus subtilis memberikan daya hambat tertinggi yaitu 88,0% terhadap P. solanacearum dengan tipe koloni no 2 pada tanah tidak steril. Efektifitas 6 mikroorganisme antagonis terpilih lebih tingi pada P. solanacearum dengan tipe koloni no 2 dibandingkan dengan no 9, dan efektifitasnya lebih tinggi pada tanah tidak steril dibandingkan dengan tanah steril.
Kata kunci: mikroorganisme antagonis, P. solanacearum, penyakit layu, pisang
PENDAHULUAN
Pisang mempunyai potensi pengembangan yang sangat besar karena daya adaptasinya terhadap zone agroklimat yang cukup tinggi dan merupakan salah satu komoditas hortikultura yang mempunyai arti penting (Satuhu dan Supriadi 1994). Dari sekian banyak penyakit yang menyerang tanaman pisang di Indonesia, salah satu yang penting adalah penyakit layu yang disebabkan oleh bakteri tular tanah
Pseudomonas solanacearum (Semangun, 1991 ;
Muharam dan Subianto 1991).
Kerugian yang dialami akibat serangan penyakit ini cukup tinggi yaitu 10-42 % bahkan dapat sampai 93,1 % pada serangan yang berat (Buddenhagen dan Kelman 1964 ; Rao 1976 ; Rukmana 1997). Penyakit layu bakteri ini penyebarannya sangat luas yaitu di daerah tropik, subtropik, dan daerah-daerah lain di seluruh dunia yang memiliki iklim hangat (Satari dan Sumaraw 1990 dalam Baharuddin 1994).
Salah satu strategi pengelolaan penyakit yang menjanjikan adalah penggunaan mikroorganisme antagonis. Mikroorganisme yang berkolonisasi dengan akar dapat menghambat atau berkompetisi dengan patogen tular tanah yang berada di sekitar daerah perakaran tanaman sehingga dapat menjaga akar tanaman tetap sehat. Secara alami, pada tanah terdapat mikroorganisme yang berpotensi untuk menekan perkembangan patogen tular tanah karena dapat bersifat antagonis (Cook dan Baker 1989). Penambahan mikroorganisme antagonis ke dalam tanah dapat meningkatkan populasi mikroorganisme
antagonis yang sudah ada, sehingga lebih efektif dalam menekan perkembangan patogen tular tanah.
Mikroorganisme antagonis yang penting dari golongan jamur salah satunya adalah Trichoderma spp. Populasi P. solanacearum penyebab penyakit layu pada kentang, dapat ditekan dengan menggunakan Trichoderma spp. sebesar 36 % (Gunawan 1995). Trichoderma spp. juga berpotensi untuk mengendalikan P. solanacearum pada tanaman tomat (menekan 23,4-100 %), dan kacang tanah (menekan 57,8-71,1 %) (Suprapto 1982 ; Paath 1988; dan Yusriadi 1998). Penicillium,
Aspergillus, Fusarium spp. dapat menghambat P. solanacearum secara in vitro (Nesmith dan Jenkins
1985 dalam Paath 1988). P. cepacia, P. fluorescens dan P. gladiol memiliki potensi sebagai agen pengendali hayati untuk menekan pertumbuhan P.
solanacearum sebesar 60-90 % pada tanaman tomat
(Hartman et al. 1992). Shekhawat et al. (1992) juga melaporkan bahwa penggunaan Bacillus sp., B.
subtilis, P. fluorescens dan actinomycetes dapat
mengurangi persentase penyakit layu pada tanaman kentang yang disebabkan oleh P. solanacearum baik secara percobaan laboraturium (menekan 43 – 71 %) maupun di lapang (menekan 52 – 79 %). Selain bakteri tersebut, Kelman ( 1953 dalam Hartman et
al. 1992) mendapatkan bahwa B. mesentericus, B. megaterium, B. mycoides, dan Erwinia merupakan
agen pengendali hayati yang potensial. Diharapkan beberapa agen pengendali hayati tersebut juga dapat
digunakan untuk menekan penyakit layu bakteri pada tanaman pisang. Penelitian ini bertujuan untuk menguji efektifitas beberapa mikroorganisme antagonis terhadap P. solanacearum pada tanaman pisang.
METODE PENELITIAN
Penelitian dilakukan di Laboratorium
Bakteriologi Jurusan HPT Fakultas Pertanian Universitas Brawijaya Malang. Penelitian dilaksanakan dari bulan Oktober sampai Desember 2000.
Rancangan Percobaan. Bakteri dan jamur
antagonis yang diujikan ada 6 yakni Bacillus
subtilis, Bacillus spp., Bacillus megaterium, Pseudomonas putida, Trichoderma viride, dan Aspergillus flavus (hasil isolasi dari tanah di sekitar
perakaran tanaman pisang yang sudah diidentifikasi dan diuji daya antagonisnya secara in vitro). Media tanah yang digunakan ada 2 yaitu tanah steril dan tidak steril dan patogen P. solanacearum ada 2 tipe koloni yang digunakan yaitu tipe no 2 dan no 9 (hasil isolasi dari tanaman pisang sakit), serta kontrol. Percobaan dirancang menggunakan Rancangan Acak Lengkap (RAL) dengan 28 perlakuan dan masing-masing perlakuan diulang tiga kali.
Persiapan bibit pisang. Bibit pisang hasil kultur
jaringan didapatkan dari PT Harakah Kitri Endah Mojokerto. Bibit pisang yang digunakan memiliki genom triploid AAA yaitu pisang Cavendish dan sudah berumur 8 minggu aklimatisasi.
Persiapan Media Tanam Pisang. Bibit pisang
ditanam pada media campuran tanah, pasir, dan serabut kelapa dengan komposisi 2:1:1. Untuk media yang disterilkan dilakukan dengan menggunakan formalin 4%. Media yang sudah disemprot ditutup dengan plastik selama 2 minggu, setelah itu dibuka dan dikeringanginkan. Media tanam yang steril maupun yang tidak kemudian dimasukkan ke dalam polybag dengan ukuran 8x8x15 sebanyak 600 gram/polybag.
Persiapan Inokulum Bakteri Patogen dan Mikroorganisme Antagonis. Inokulum bakteri P.
solanacearum diperbanyak pada media NGA selama
48 jam dan dijadikan suspensi sebelum
diinokulasikan, demikian pula dengan
mikroorganisme antagonis diperbanyak pada media PDA. Konsentrasi suspensi P. solanacearum yang digunakan 108 CFU/ml, 1010 CFU/ml untuk bakteri antagonis, dan untuk jamur konsentrasi sporanya 1010/ml.
Inokulasi. Bibit pisang dengan hati-hati dicabut
dari polybag dan dicuci pada air mengalir sampai tidak ada tanah yang tertinggal di akar, kemudian ujung akar dipotong sedikit untuk jalan masuk
mikroorganisme antagonis. Bibit pisang direndam dalam suspensi mikroorganisme antagonis selama satu jam, setelah itu ditanam kembali ke polybag. Dua hari setelah bibit pisang diinokulasikan dengan mikroorganisme antagonis, dilakukan inokulasi dengan P. solanacearum dengan cara menyiramkan suspensi bakteri di sekitar akar tanaman pisang sebanyak 25-30 ml/tanaman.
Pengamatan.
Pengamatan terhadap perkembangan gejala penyakit dilakukan dua hari sekali sampai tanaman kontrol mati. Intensitas serangan penyakit dihitung pada akhir pengamatan dengan menggunakan rumus (Sastrosiswojo 1992; Baharudin 1994):
∑(n x v)
I =- --- x 100% Z x N
dimana:
I = intensitas serangan penyakit
n = jumlah daun yang diamati tiap kategori serangan
v = nilai numerik dari tiap kategori serangan Z = nilai numerik dari kategori serangan tertinggi N = jumlah daun yang diamati
Skala kerusakan:
0 = tidak timbul gejala (daun sehat) 1 = sebagian daun lengkung dan klorosis 2 = sebagian daun lengkung dan nekrosis 3 = sebagian daun layu dan klorosis 4 = sebagian daun layu dan nekrosis 5 = sebagian daun kering dan mati 6 = tanaman mati
Analisa Data. Data intensitas serangan penyakit
layu dianalisis dengan Analisis Keragaman (Anova) pada taraf nyata 5%. Jika ada perbedaan perlakuan maka diuji lanjut dengan Kontras Ortogonal dan Beda Nyata Terkecil (BNT) pada taraf nyata yang sama.
HASIL
Perkembangan gejala penyakit. Semua
perlakuan dapat menimbulkan gejala penyakit dengan waktu yang berbeda-beda tergantung pada tanah yang digunakan dan tipe koloni dari patogen. Pada penambahan mikroorganisme antagonis gejala muncul lebih lambat dibandingkan dengan tanpa penambahan mikroorganisme antagonis. Gejala muncul sekitar 3-4 hari setelah inokulasi dengan P.
solanacearum dan pada tanah steril gejala muncul
lebih awal dibandingkan pada tanah tidak steril. Meskipun semua perlakuan dapat menimbulkan gejala tetapi tidak semua tanaman mati sampai akhir percobaan kecuali pada kontrol. Tanaman mati antara 16-35 hari setelah inokulasi (hsi) dan tanaman mati lebih awal pada tanah steril dibandingkan pada
tanah tidak steril. Gejala yang muncul secara umum adalah diawali dengan melengkungnya daun dengan sedikit klorosis atau nekrosis, selanjutnya daun menjadi layu dan akhirnya kering dan mati. Perkembangan penyakit pada tipe koloni no 2 lebih lambat dibandingkan no 9.
Intensitas serangan P. solanacearum pada tanaman pisang. Hasil analisis keragaman pada
akhir pengamatan menunjukkan bahwa ada beda nyata antara perlakuan yang diberikan terhadap intensitas serangan penyakit layu yang disebabkan oleh P. solanacearum. Hasil uji kontras ortogonal dari masing-masing perlakuan terhadap intensitas serangan penyakit layu disajikan pada Tabel 1, sedangkan rata-rata intensitas serangan penyakit pada masing-masing perlakuan yang diberikan disajikan pada Tabel 2.
Pada Tabel 1 terlihat bahwa pemberian mikroorganisme antagonis sangat berpengaruh terhadap intensitas serangan P. solanacearum pada pisang dan nampak perbedaan yang nyata dibandingkan dengan kontrol. Meskipun pemberian mikroorganisme antagonis dapat menurunkan intensitas serangan penyakit tetapi efektifitas
mikroorganisme antagonis terhadap P.
solanacearum sama karena intensitas serangan
diantara mikroorganisme antagonis tidak berbeda nyata. Efektifitas mikroorganisme antagonis lebih tinggi pada tipe koloni no2 dibandingkan no 9. Demikian pula efektifitas mikroorganisme antagonis lebih tinggi pada tanah tidak steril dibandingkan pada tanah steril karena intensitas serangannya berbeda nyata.
Tabel 1. Hasil uji kontras ortogonal dari masing-masing perlakuan terhadap
Ket: nilai p<0,05 menunjukkan beda nyata (significance = S) dan p>0,05 tidak berbeda nyata (non significance = NS), analisa dilakukan setelah data di transformasikan pada
√x+0,5
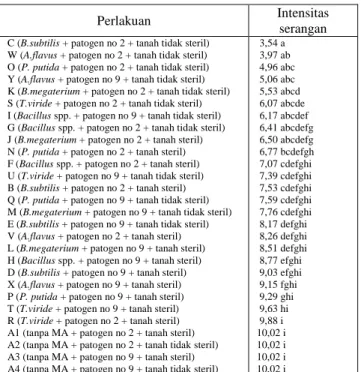
Tabel 2. Rata-rata intensitas serangan penyakit pada masing-masing perlakuan yang diberikan.
Perlakuan Intensitas
serangan C (B.subtilis + patogen no 2 + tanah tidak steril)
W (A.flavus + patogen no 2 + tanah tidak steril) O (P. putida + patogen no 2 + tanah tidak steril) Y (A.flavus + patogen no 9 + tanah tidak steril) K (B.megaterium + patogen no 2 + tanah tidak steril) S (T.viride + patogen no 2 + tanah tidak steril) I (Bacillus spp. + patogen no 9 + tanah tidak steril) G (Bacillus spp. + patogen no 2 + tanah tidak steril) J (B.megaterium + patogen no 2 + tanah steril) N (P. putida + patogen no 2 + tanah steril) F (Bacillus spp. + patogen no 2 + tanah steril) U (T.viride + patogen no 9 + tanah tidak steril) B (B.subtilis + patogen no 2 + tanah steril) Q (P. putida + patogen no 9 + tanah tidak steril) M (B.megaterium + patogen no 9 + tanah tidak steril) E (B.subtilis + patogen no 9 + tanah tidak steril) V (A.flavus + patogen no 2 + tanah steril) L (B.megaterium + patogen no 9 + tanah steril) H (Bacillus spp. + patogen no 9 + tanah steril) D (B.subtilis + patogen no 9 + tanah steril) X (A.flavus + patogen no 9 + tanah steril) P (P. putida + patogen no 9 + tanah steril) T (T.viride + patogen no 9 + tanah steril) R (T.viride + patogen no 2 + tanah steril) A1 (tanpa MA + patogen no 2 + tanah steril) A2 (tanpa MA + patogen no 2 + tanah tidak steril) A3 (tanpa MA + patogen no 9 + tanah steril) A4 (tanpa MA + patogen no 9 + tanah tidak steril)
3,54 a 3,97 ab 4,96 abc 5,06 abc 5,53 abcd 6,07 abcde 6,17 abcdef 6,41 abcdefg 6,50 abcdefg 6,77 bcdefgh 7,07 cdefghi 7,39 cdefghi 7,53 cdefghi 7,59 cdefghi 7,76 cdefghi 8,17 defghi 8,26 defghi 8,51 defghi 8,77 efghi 9,03 efghi 9,15 fghi 9,29 ghi 9,63 hi 9,88 i 10,02 i 10,02 i 10,02 i 10,02 i
Ket: Angka pada kolom yang diikuti huruf yang sama tidak berbeda nyata pada uji
BNT dengan α = 0,05 (data telah
ditransformasikan pada √x+0,5. MA =
mikroorganisme antagonis
Tabel 2 menunjukkan bahwa 10 perlakuan yaitu C, W, Y, O, K, S, I, G, J, dan N berbeda nyata dengan kontrol (tanpa mikroorganisme antagonis). Perlakuan C menunjukkan intensitas serangan terendah dibandingkan 9 perlakuan yang lain.
PEMBAHASAN
Ada kecendrungan bahwa 6 mikroorganisme antagonis yang digunakan menunjukkan efektifitas yang lebih baik terhadap P. solanacearum dengan tipe koloni no 2 pada tanah tidak steril, dan yang terbaik adalah B.subtilis. Hal ini kemungkinan karena keunggulan yang dimiliki kelompok Bacillus sehingga lebih dapat bertahan di dalam tanah dan memberikan perlindungan lebih lama dibandingkan bakteri fluoresen (P. putida). Diduga bahwa pada tanah bakteri fluoresen kehilangan viabilitasnya karena tidak tahan terhadap stres lingkungan. Akibatnya bakteri fluoresen tidak mampu memberikan proteksi yang maksimal lagi. Untuk jamur antagonis, tidak saja menghasilkan antibiotik tetapi juga merupakan kompetitor yang baik sehingga mempunyai daya hambat yang lebih baik dibandingkan bakteri fluoresen.
Tidak adanya perbedaan efektifitas penekanan antara mikroorganisme antagonis yang satu dengan lainnya diduga karena antibiotik yang dikeluarkan oleh 6 mikroorganisme antagonis tersebut tidak jauh berbeda sehingga tidak ada perbedaan intensitas
serangan penyakit. Dengan demikian 6 mikroorganisme antagonis ini memiliki potensi untuk dijadikan agen pengendali hayati terhadap P.
solanacearum pada tanaman pisang.
Efektifitas 6 mikroorganisme antagonis lebih tinggi terhadap P. solanacearum dengan tipe koloni no 2 dibandingkan tipe koloni no 9. Perkembangan penyakit pada tipe koloni no 2 juga lebih lambat dibandingkan tipe koloni no 9. Tipe koloni no 2 dan no 9 sama-sama memiliki virulensi tinggi. Jika koloni tunggal dari tipe koloni no 2 digoreskan kembali ke media TZC, ternyata tumbuh koloni campuran (2, 3, 4, dan 7), sedangkan tipe koloni no 9 hanya tumbuh tipe 9 dan 3. Dengan kata lain, tipe koloni no 2 merupakan koloni campuran sedangkan no 9 hampir merupakan koloni tunggal. Oleh karenanya, diduga mikroorganisme antagonis lebih efektif menekan koloni campuran dibandingkan dengan koloni yang hampir tunggal. Dalam prinsip segitiga penyakit disebutkan bahwa penyakit akan terjadi jika terdapat patogen yang virulen, tanaman yang rentan, dan lingkungan yang mendukung (Agrios 1997). Jadi meskipun kedua tipe koloni patogen memiliki virulensi yang sama tetapi karena faktor lingkungan yang kurang mendukung seperti aktifnya kegiatan mikroorganisme antagonis di sekitar perakaran tanaman, maka tingkat serangan yang terjadi juga berbeda.
Efektifitas 6 mikroorganisme antagonis lebih rendah pada tanah steril dibandingkan pada tanah tidak steril. Hal ini diduga karena pada tanah yang disterilkan mikroorganisme tanah yang ada mati. Pada tanah yang tidak steril, mikroorganisme tanah yang ada kemungkinan ada yang bersifat sinergis sehingga bersama-sama dengan mikroorganisme
antagonis yang diberikan dapat menekan
perkembangan bakteri patogen. Percobaan
pemberian beberapa saprofit tanah terhadap infeksi busuk akar pada bibit gandum yang disebabkan oleh
Helminthosporium sativum, didapatkan bahwa pada
tanah steril tingkat infeksi yang terjadi hampir 50% dan 8% pada tanah tidak steril. Jika pada tanah steril ditambahkan bakteri, jamur, dan aktinomisetes maka tingkat infeksi hanya 2% (Henry dalam Campbell 1989). Hal ini membuktikan bahwa terjadi interaksi diantara mikroorganisme tanah dan kemungkinan peran mikroorganisme antagonis yang ditambahkan dapat ditingkatkan. Cook dan Baker (1989) menyebutkan bahwa di dalam tanah terdapat berbagai tipe interaksi antar mikroorganisme yang
berperan dalam proses untuk mencapai
keseimbangan biologi. Interaksi ini dapat berpengaruh terhadap salah satu atau beberapa mikroorganisme yang berinteraksi. Beberapa akibat interaksinya antara lain: merangsang pertumbuhan
mikroorganisme, menghambat pertumbuhan,
merangsang atau menghambat pembentukan spora
istirahat, menyebabkan kematian bagi
mikroorganisme lain, ataupun bersama-sama dapat mengakibatkan kerusakan tanaman.
PENUTUP a. Simpulan
1. Perlakuan tanpa penambahan mikroorganisme antagonis intensitas serangannya 100% dan tanaman mati 35 hari setelah inokulasi dengan
P. solanacearum, sedangkan dengan
penambahan mikroorganisme antagonis
intensitas serangannya lebih rendah dan tanaman tidak mati.
2. Tidak ada perbedaan efektifitas antara 6 mikroorganisme antagonis yang diujikan terhadap P. solanacearum.
3. Berdasarkan perbedaan tipe koloni dan macam tanah yang digunakan Bacillus subtilis
memberikan daya hambat tertinggi yaitu 88,0% terhadap P. solanacearum dengan tipe koloni no 2 pada tanah tidak steril.
4. Efektifitas 6 mikroorganisme antagonis lebih tinggi pada P. solanacearum dengan tipe koloni no 2 dibandingkan no 9, dan efektifitasnya lebih tinggi pada tanah tidak steril dibandingkan tanah steril.
b. Saran
Perlu dilakukan penelitian lebih lanjut di lapang untuk mengetahui daya antagonisme, cara aplikasi, dan cara perbanyakan masal dari 6 mikroorganisme antagonis tersebut. Perlu juga dicoba penggabungan beberapa mikroorganisme antagonis ini untuk mendapatkan hasil yang lebih baik, atau menggabungkannya dengan cara pengendalian yang lain.
DAFTAR PUSTAKA
Agrios, GN., 1997. Plant Pathology. Fourth Edition. Academic Press. Inc. San Diego California. Baharudin, 1994. Pathological, biochemical, and
serological characterization of blood disease bacterium affecting banana plantain (Musa spp.) in Indonesia. Cuviller Verlag.
Gottongen. Jerman.
Buddenhagen dan Kelman, 1964. Biological and physiological aspects of bacterial wilt caused by Pseudomonas solanacearum.
Annual Review Phytopathology 2. 203-230.
Cook, R.J and K.F. Baker, 1974. Biological Control
of Microbial Plant Pathogen. W.H. Freeman
and Company. San Fransisco.
Gunawan, O.S., 1995. Pengaruh mikroorganisme antagonis dalam mengendalikan bakteri layu
Pseudomonas solanacearum pada tanaman
kentang. Dalam Risalah Kongres Nasional
XIII dan Seminar Ilmiah PFI (Mataram, 25-27 September 1995), p.473-479. Mataram.
NTB.
Hartman, G.L., W.F. Hong, Hanudin, dan A.C. Hayward, 1992. Potential of biological and chemical control of bacterial wilt. Pp.322-326. Proceeding of an International
Conference held at Kaohsiung, Taiwan, 23-31 October 1992.
Muharam dan Subianto, 1991. Status of banana disease in Indonesia. In Proceeding of
Regional Technical Meeting on Disease Affecting Banana and Plantation in Asia and the Pasific. p.44-56. Bribane, Australia.
Paath, J.M., 1988. Pengaruh antagonistic Trichoderma spp. terhadap perkembangan penyakit layu bakteri Pseudomonas solanacearum pada tanaman tembakau dan tomat.Tesis Master. Fakultas Pascasarjana
IPB. Bogor.
Rao, M.V.B., 1976. Bacterial wilt of tomato and eggplant in India. In Proc. 1st International Planning Conference and Workshop on Ecological and Control of Bacterial Wilt Caused by Pseudomonas solanacearum,
pp.92-94. New Delhi, India.
Rukmana, 1997. Penyakit Tanaman dan Teknik Pengendaliannya. Kanisius. Jakarta.
Sastrosiswojo, S., 1992. Buku Panduan Teknis
Pengendalian Hama Terpadu Sayuran
Dataran Tinggi. Program Nasional Pelatihan dan Pengembangan Pengendalian Hama Terpadu. Bandung.
Satuhu dan Supriyadi, 1994. Pisang: Budidaya, Pengolahan, dan Prospek Pasar. Penebar Swadaya. Jakarta.
Semangun, H., 1991. Penyakit-penyakit
Hortikultura. Gajah Mada Univ. Press. Yogyakarta.
Shekawat, G.S., S.K. Chakrabarti, V. Kishore, V. Sunaina, dan Ashok V. Gadewar, 1992. Possibilities of biological management of potato bacterial wilt with strains of Bacillus sp., Bacillus subtilis, Pseudomonas fluorescens, and Actinomycetes.
pp.327-330. In Proceeding of an International
Conference held at Kaohsiung, Taiwan, 23-31 October 1992.
Suprapto, W., 1982. Penelitian jazad-jazad antagonis terhadap bakteri penyebab layu Pseudomonas solanacearum E.F. Smith.
Sripsi. Departemen Ilmu Hama dan Penyakit Tumbuhan. Fakultas Pertanian, IPB. Bogor. Yusriadi, 1998. Dampak introduksi mikroorganisme
antagonis terhadap perkembangan penyakit layu bakteri (Pseudomonas solanacearum E.F. Smith) pada kacang tanah. Tesis. Program Pascasarjana. IPB. Bogor.