Zurai Resti**) Ujang Khairul
Abstract
Bacterial wilt disease caused of Ralstonia solanacearum represent one of the important disease which often attack banana. This dangerous disease enough, because at heavy attack storey; level can cause death of failure and crop harvest so that generating many degradation or loss result of which big relative.
herefore have been done by research with aim to for the screnning of ability of antagonist bacteria from graminae rhizosfer from various sentra produce banana in West Sumatra. This research is done by 2 phase that is I phase : done by laboratory with testing ability of antagonist bacteria from graminae rhizosfer to growth inhibiting of R. solanacearum. Variable perception in research of this I phase is : ( A) Identify to cover ( 1) macroscopic characteristic, ( 2) microscopic characteristic and ( 3) physiological Test which cover : ( a) Test gram, (b ) levan Produce, ( c) Pectinase test, ( d) Pigment fluorescence, ( e) Discharge gelatine, ( f) Reaction of hipersensitif and ( g) Patogenicity test.
Result of research indicate that isolat of Bacillus subtilis, Streptomyces sp dan Pseudomonas flourescens have high population in rhizosfer graminae and decrease the growing of R. solanacearum.
PENDAHULUAN
Tanaman pisang dapat tumbuh dan berkembang diberbagai kondisi agroekologi baik di daerah rendah yang basah di Sumatera dan Kalimantan maupun di dataran tinggi yang kering di daerah-daerah Indonesia Bagian Timur. Tanaman pisang merupakan tanaman unggulan yang mendapat prioritas oleh pemerintah untuk dikembangkan karena sangat berpotensi untuk memenuhi
---*) Didanai oleh Direktorat Jenderal pendidikan Tinggi dengan kontrak No: 005/SP3/PP/DP2M//II/2006
kebutuhan konsumsi dalam negeri ataupun ekspor (Deptan 1999), dengan produksi mencapai 4.384.384 ton (Ditbuah 2003).
Sampai saat ini penyakit layu bakteri masih mewabah hampir diseluruh daerah sentra produksi pisang di Indonesia. Pada tahun 2003, jumlah tanaman pisang terserang yang dilaporkan mencapai 1.864.109 rumpun (Ditlinhorti, 2004). Hal ini menunjukkan bahwa penyakit layu bakteri mempunyai potensi untuk terus berkembang dan menjadi salah satu kendala yang harus dipertimbangkan dalam rangka pengembangan pisang secara besar-besaran di Indonesia.
Beberapa cara telah dilakukan untuk mengendalikan penyakit ini seperti penggunaan bakterisida, kultur teknis, dan kultivar yang resisten, tetapi penyakit ini belum dapat dikendalikan secara efektif.
Penanaman kultivar resisten merupakan pengendalian penyakit yang sangat murah, mudah, aman, dan selektif apabila telah tersedia kultivar tahan, namun bila terus menerus ditanam suatu saat resistensi akan patah karena munculnya strain – strain baru R. solanacearum yang lebih virulen. Sampai saat ini belum diketahui kultivar pisang tahan yang rasa dan penampilannya diminati masyarakat maupun yang dimanfaatkan untuk ekspor (Sahlan dan Nurhadi 1994). Pengendalian penyakit tanaman dengan menggunakan mikroba antagonisme, khususnya mikrob perakaran graminae yang dapat mengkoloni perakaran tanaman merupakan salah satu alternatif pengendalian yang dapat dipandang sebagai cara pendekatan yang ramah lingkungan, berkesinambungan, dan dapat diintegrasikan dalam program pengendalian hama terpadu. Beberapa diantara mikrob antagonis ini adalah sebagai agens biokontrol, pemacu pertumbuhan tanaman, dan penginduksi ketahanan tanaman terhadap patogen (Kloepper et al. 1999). Oleh sebab itu diperlukan penelitian lebih lanjut untuk mempelajari kemampuan bakteri yang diisolasi dari perakaran graminae untuk mengendalikan layu bakteri pada tanaman pisang dan juga diperlukan informasi tambahan mengenai kemampuan bakteri yang diisolasi dari rumput-rumputan kelompok graminae dalam mengendalikan penyakit layu bakteri.
produksi pisang di Sumatera Barat dan menguji kemampuan bakteri tersebut dalam mengendalikan layu bakteri pada tanaman pisang, c) Untuk mendapatkan metoda aplikasi yang lebih efektif dari bakteri rizosfer dan endofit perakaran graminaedalam mengendalikan penyakit layu bakteri pada tanaman pisang METODE PENELITIAN
A. Penelitian Laboratorium
Isolasi dan Perbanyakan R. solanacearum.
Sumber inokulum bakteri penyebab penyakit layu pada tanaman pisang diambil dari tanaman pisang yang menunjukkan gejala penyakit layu bakteri. Gejala penyakit layu bakteri pada tanaman pisang yang terinfeksi Ralstonia solanacearum dicirikan dengan layunya daun-daun tua sebelum waktunya dan daun menguning diikuti oleh nekrosis. Kelayuan yang menyeluruh terjadi pada tanaman muda. Kulit buah sering tampak normal, kadang-kadang ada yang tampak kuning terlalu awal dan menghitam. Kalau buah dipotong, bagian dalam buah kelihatan berwarna coklat kemerahan atau menjadi busuk berlendir (Tjahjono & Eden-Green 1988; Semangun 1994).
Contoh bagian tanaman sakit (bonggol atau tandan) diambil secukupnya dan dibawa ke laboratorium untuk diisolasi patogennya. Isolasi R. solanacearum
Isolasi Bakteri Rhizosfer.
Tanaman graminae yang digunakan dalam percobaan ini adalah jagung, sorgum, padi gogo dan 3 jenis rumput-rumputan kelompok graminae yang ada di sekitar tanaman pisang sehat.
Isolasi Bakteri Endofit.
Bakteri endofit yang digunakan dalam penelitian ini adalah bakteri endofit yang berasal dari perakaran graminae. Bakteri endofit diisolasi dengan menggunakan metode yang dilakukan oleh Zinniel et al. (2000). Sebelum diisolasi akar yang akan digunakan terlebih dahulu disterilisasi permukaannya dengan menggunakan alkohol 70% selama 1 menit, dan clorox (natrium klorida) 2,5% selama 3 menit. Untuk mengetahui apakah sterilisasi permukaan berhasil atau tidak, diuji dengan meletakkan akar yang sudah disteril ke dalam cawan petri yang sudah diisi PDA, diinkubasi selama 3 hari. Untuk akar yang masih ditemukan mikroorganisme yang tumbuh pada permukaan akar, berarti sterilisasi gagal dan bakteri yang didapatkan tidak dapat digunakan. Akar yang sudah steril sebanyak 10 g dihancurkan dengan mortal sampai halus. Ekstrak akar dicampur 90 ml air steril dalam erlenmeyer kapasitas 250 ml. Suspensi tersebut dikocok dengan menggunakan shaker berkecepatan 150 rpm selama 30 menit, selanjutnya dipindahkan sebanyak 1 ml suspensi tersebut ke dalam 9 ml air steril pada tabung reaksi. Dengan demikian diperoleh tingkat pengenceran 10-2 dan sterusnya dilakukan pengenceran dengan cara yang sama dan diperoleh suspensi 10-3 dan 10 -4. Untuk mendapatkan bakteri antagonis caranya sama dengan metoda yang dilakukan untuk mendapatkan bakteri antagonis rizosfer, tetapi pengenceran yang digunakan untuk Bacillus sp. adalah 10-2 dan 10-3, untuk P. fluorescens dan
Serratia sp. 10-3 dan 104.
Peubah yang perlu diamati pada saat mengisolasi bakteri antagonis ini adalah: jumlah populasi bakteri yang didapatkan pada tiap-tiap tanaman; morfologi koloni bakteri yang berbeda kemudian diamati dan dihitung jumlah masing-masing koloni bakteri yang cirinya sama. Dengan cara demikian dapat diestimasi populasi suatu jenis bakteri setiap gram akar. Karakterisasi didasarkan pada ukuran koloni, bentuk koloni, bentuk pinggiran koloni, permukaan koloni, dan warna koloni.
Karakteristik masing – masing isolat
Gram (Swanopel, 1988), b) KOH test (Swanopel, 1988), c) Produksi Levan (Schaad, 1988), d) Pectinase Test , (Schaad, 1988), e) Pigmen fluorescens (Schaad, 1988), f) Reaksi hypersensitif dan g) Uji patogenisitas
Pengujian Pengaruh Bakteri Rizosfer dan Endofit Perakaran Graminae terhadap Pertumbuhan R. solanacearum Secara in vitro
Uji antagonis secara in vitro dimaksudkan untuk melakukan seleksi terhadap isolat-isolat yang sudah didapatkan baik bakteri rizosfer maupun bakteri endofit. Ini hanya salah satu cara untuk melakukan seleksi bakteri yang akan digunakan. Bakteri yang tidak menunjukkan keefektifan menghambat perkembangan R. solanacearum belum tentu tidak efektif karena kemungkinan mekanismenya adalah induksi ketahanan, maka dalam percobaan ini juga digunakan dua isolat yang tidak menunjukkan kemampuan antagonis secara in vitro.
Untuk Skrening ini, masing – masing isolat baik bakteri rizosfer maupun bakteri endofit. yang telah murni yang diisolasi dari beberapa daerah sentra produksi tanaman pisang diuji kemampuannya dalam menekan perkembangan R. solanacearum dengan menggunakan metoda Arwiyanto et al (1993). Masing – masing isolat bakteri rizosfer maupun bakteri endofit dengan kerapatan sel 108 CFU/ml (OD600 = 0.3) dimasukan kedalam erlenmeyer 50 ml, kemudian dilakukan inokulasi secara titik kedalam petridish yang telah berisi 20 ml medium SPA (satu petri untuk satu isolat bakteri rizosfer dan bakteri endofit) kemudian cawan petri dibalik dan pada tutupnya dituangkan 1 ml kloroform. Setelah 2 jam petri dibalik kembali pada posisi semula. Sebanyak 0,2 ml suspensi R. solanacearum
(108 CFU/ml) dituangkan pada medium 0,6% agar cair (450C), dikocok hingga homogen kemudian dituangkan ke dalam cawan petri tersebut di atas. Biakan diinkubasi lagi selama 24 jam pada suhu kamar. Zone hambatan yang terbentuk diukur diameternya. Semakin besar zone hambatan yang terbentuk semakin tinggi pula kemampuan isolat bakteri rizosfer dan bakteri endofit dalam menekan perkembangan R. solanacearum.
Bakteri rizosfer maupun bakteri endofit yang tidak menunjukkan kemampuan antagonis secara in vitro, diuji kemampuannya terhadap pertumbuhan tanaman. Tanaman uji yang digunakan adalah tanaman mentimun. Bakteri yang telah didapatkan diperbanyak pada media TSA, diinkubasi selama 48 jam. Bakteri yang telah tumbuh dipanen dengan menggunakan kuas dan dibuat suspensi bakteri dengan kerapatan 109 cfu/ml. Biji mentimun yang digunakan disterilisasi permukaan dengan menggunakan Clorox 1% selama 60 menit, kemudian dibilas dengan air steril sebanyak tiga kali. Biji yang telah disteril direndam dalam suspensi bakteri selama 24 jam, ditiriskan dan kemudian dikecambahkan pada kertas merang yang telah dilembabkan selama 2 hari dalam ruangan gelap pada suhu ruang. Biji yang telah berkecambah ditanam pada polibag (10x10 cm). percobaan dilakukan dengan Rancangan acak lengkap dengan tiga ulangan.
Peubah yang diamati adalah tinggi tanaman, dan bobot kering dan bobot basah. Untuk menguji pengaruh perlakuan terhadap peubah yang diamati dilakukan analisis ragam dengan menggunakan program Statistical Analysis System (SAS). Selanjutnya tiap perlakuan yang berpengaruh nyata dilakukan uji wilayah berganda Duncan untuk melihat perbedaan tiap perlakuan pada taraf 5%.
HASIL DAN PEMBAHASAN
Karakteristik
Hasil isolasi terhadap bakteri yang terdapat di rizosfer dan endofit perakaran graminae (jagung, rumputan dan padi) dapat dilihat pada Tabel 1. Dari Tabel 1 terlihat ada 3 spesies bakteri yang mendominasi rizosfer graminae yaitu:
Bacillus subtilis, Streptomyces sp dan Pseudomonas flourescens sedangkan dalam jaringan perakaran graminae (endofit) ditemui 2 spesies yaitu: Bacillus subtilis
pada padi adalah P. fluorescens Tidak ditemukan Streptomyces sp. pada jaringan akar ketiga tanaman graminae.
Tabel 1. Karakteristik bakteri yang terdapat di rizosfer perakaran graminae pada medium SPA dan King’s B (umur 72 jam)
Karakteristik Hasil pengamatan
Bacillus subtilis Streptomyces sp. P. flourescens
A. Makroskopis
1. Bentuk koloni 2. Ukuran koloni 3. Warna koloni 4. Permukan koloni 5. Elevasi
B. Mikroskopis 1. Bentuk sel
C. Sifat Fisiologis 1. Reaksi Gram 2. Produksi Levan 3. Pectinase Test 4. Pigment fluourescent 5. Pelelehan gelatin
D. Reaksi hypersesitif E. Uji Patogenisitas
Bulat, berbentuk benang
1 – 4 mm putih kasar cembung batang +
-Bulat, berbentuk benang
1 – 5 mm putih agak kasar agak cembung batang +
-Bulat dan licin
1 – 3 mm putih halus cembung batang -+
(a) (b) (c)
Gambar 1. Bakteri antagonis yang paling dominan di temukan di rizosfer dan endofit perakaran graminae. (a) Streptomyces sp, (b) Bacillus subtilis,
Tabel 2. Kerapatan populasi bakteri antagonis di rizosfer dan endofit tanaman graminae
Bakteri antagonis
Kerapatan Populasi (CFU/ml)
Rizosfer Endofitik
jagung padi rumputan jagung padi rumputan
Bacillus subtilis 8,0 x 106 9,2 x 104 7,8 x 104 6,7 x 106 5,4 x 104 5,6 x 105
Streptomyces sp 6,2x 105 8,3 x 105 6,7 x 104 - -
-Pseudomonas flourescens 5,7x 106 3,5 x 104 5,6x 105 4,5 x 106 4,9 x 105 6.3 x 103
Kelompok bakteri antagonis yang banyak ditemukan di rizosfer dan dalam jaringan akar graminae adalah Bacillus spp, Paenibacillus, Pseudomas,
dan Stenotrophomonas spp (Landa et al. 2001), Pseudomonas kelompok fluorescens (Larkin et al. 1996), dan Serratia marcescens (Press et al. 2001).
Tingginya populasi bakteri antagonis di rizofer jagung disebabkan adanya senyawa DIMBOA (2,4dihidroxy-7 methoxy (2H)-1,4 benzoxazine
-3(4)-one yang dapat menjadi senyawa attraktan bagi bakteri-bakteri ini (Manuwoto,1986) selanjutnya Lemaga et al. (2001) melaporkan pada rizofer jagung ditemukan Pseudomonas cepacia yang bersifat antagonis terhadap R. solanacearum yang dapat menurunkan kerapatan populasi bakteri patogen ini Di Lapangan
Pengujian Pengaruh Bakteri Rizosfer dan Endofit Perakaran Graminae terhadap Pertumbuhan Tanaman
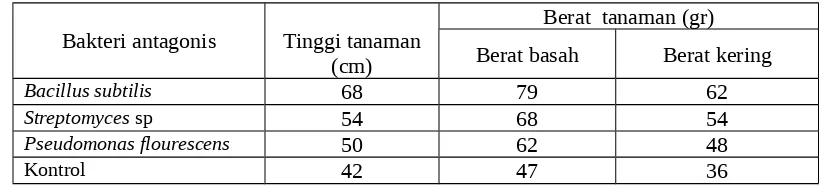
Tabel 3. Pertumbuhan tanaman ketimun dengan aplikasi bakteri rizosfer dan endofit perakaran graminae
Bakteri antagonis Tinggi tanaman (cm)
Berat tanaman (gr) Berat basah Berat kering
Bacillus subtilis 68 79 62
Streptomyces sp 54 68 54
Pseudomonas flourescens 50 62 48
Kontrol 42 47 36
dapat menstimulasi pertumbuhan tanaman. Padua et al. (2001) melaporkan bahwa Bacillus circulans dan B.megaterium mampu memproduksi hormon pertumbuhan indole-3-acetic acid (IAA) sehingga dapat meningkatkan bobot basah tajuk dan akar sampai 53% dan 42%. Shekhawat et al. (1992) juga melaporkan bahwa Bacillus subtilis strain Bs 1 dan Bs 2 mampu meningkat hasil kentang sampai 28,3%.
KESIMPULAN DAN SARAN
Dari penelitian ini dapat disimpulkan : a) Kelompok bakteri yang dominan di rizosfer dan endofit perakaran graminae adalah Bacillus subtilis, Streptomyces
sp dan Pseudomonas flourescens, b) rizosfer jagung mempunyai kerapatan populasi bakteri antagonis yang paling tinggi, dan c) Bakteri antagonis di rizosfer dan endofit perakaran graminae mampu memicu pertumbuhan tanaman.
Dari hasil penelitian ini disarankan untuk meneliti lebih lanjut mekanisme penekanan antara bakteri antagonis ini dengan bakteri patogen layu R.
solanacearum baik di tingkat invitro dan in planta.
DAFTAR PUSTAKA
Agrios GN. 1997. Plant Pathology. Ed ke-3. San Diego: Academic Press. Arwiyanto T, Goto M, Tsuyumu S, Takikawa Y. 1994. Biological control of
bacterial wilt of tomato by an avirulent strain of Pseudomonas solanacearum isolated from Strelitzia reginae. Ann Phytopath Soc Japan
60:421-430.
Benhamou N. Kloepper JW, Quadt-Hallman A, Tuzun S. 1996. Induction of defense-related ultrasructural modifications in pea root tissues inoculated with endophytic bacteria. Plant Physiology 112: 919-929.
Benhamou N, Gagne S, Dominique LG, Dehbi L. 2000. Bacterial-mediated induced resistance in cucumber: Beneficial effect of the endophytic bacterium Serratia plymuthica on the protection against infection by
Pythium ultimum. Phytopathology 90: 45-56.
Bernal G, Illanes A, Ciampi L. 2002. Isolation and partial purification of a metabolite from a mutant strain of Bacillus sp. with antibiotic activity against plant pathogenic agents. Electronic Journal of Biotechnology 5(1). Buddenhagen IW, Kelman A. 1964. Biological and physiological aspects of
bacterial wilt caused by P. solanacearum. Ann Review of Phytopath 2:660 – 664.
Cook RJ and Bakker KF. 1983. The Nature and Practice of Biological Control of Plant Pathogens. St Paul: APS Press. hlm 539-541.
Coventry HS, Dubery IA. 2001. Lipopolysaccharides from Burkholderia cepacia
contribute to an enhanced defensive capacity and the induction of pathogenesis-related protein in Nicotianae tabacum. Physiology Molleculer Plant Pathology 58: 149-158.
Defago. 1990. Suppression of black root rot of tobacco and other root disesae by strain of Pseudomonas fluorescens:potensial aplications and mechanism. Di dalam: Hornby D, editor. Biological Control of Soil-Borne Plant Pathogens. Wallingford: CAB International. hlm. 93-108.
Denny TP, Hayward AC. 2001. Ralstonia. Di dalam: Schaad NW, Jones JB, Chun W, editor. Laboratory Guide for Identification of Plant Pathogenic Bacteria. Ed ke-3. St Paul: APS Press. hlm 151 – 173.
[Deptan] Departemen Pertanian. 1999. Warta penelitian dan pengembangan pertanian. 21(2).
[Ditbuah] Direktorat Tanaman Buah. 2003. Luas Panen, Produktivitas & Produksi Pisang 2002. http://database1.deptan.go.id/ditbuah/index.php?f
=komoditas/ kom_view.php&id=104 [6 Desember 2004].
Direktorat Perlindungan Tanaman Hortikultura [ditlinhorti]. 2003. Luas serangan OPT utama tanaman pisang. www.deptan.go.id/ditlinhorti/data-its-2001. [8
Januari 2003].
[Ditlinhorti] Direktorat Perlindungan Tanaman Hortikultura. 2004. Luas serangan OPT utama tanaman pisang. http://
www.deptan.go.id/ditlinhorti/data-its-2003.its [5 Juli 2004].
Goto M. 1992. Fundamental of Bacterial Plant Pathology. San Diego: Academic Press.
Hallmann J. 2001. Plant interaction with endophytic bacteria. Di dalam: Jeger MJ dan Spence NJ, editor. Biotic Interaction in Plant pathogen Association. Wallingford: CAB International. hlm 87-119.
Hartman GL, Wong WF, Hanudin, Hayward AC. 1992. Potential of biological and chemical control of bacterial wilt. Di dalam: Hartman GL, Hayward AC, editor. Bacterial Wilt; Kaohsiung, 28-30 Okt 1992. Canbera: ACIAR. hlm 232-237.
Hayward AC. 1991. Biology and epidemiology of bacterial wilt caused by
Pseudomonas solanacearum. Annu Rev Phytopath 29:65-87.
Hayward AC, Fegan M. 2004. The Ralstonia solanacearum species complex: Genetic diversity and ecology of bacterial wilt [abstrak]. Di dalam: APS Annual Meeting; Anaheim, 31 Jul – 4 Agu 2004. St Paul: APS. hlm S121. He LY. 1986. Bacterial wilt in people’s of China. Di dalam: Persley GJ, editor.
Bacterial Wilt Disease in Asia and the South Pacific. Proceedings of An International Workshop Held at PCARRD. Los Banos, 8-13 Apr 1984. Los Banos: PCARRD. hlm 101-116.
Kim DS, Cook RJ, Weller DM. 1997. Bacillus sp. for biological control of three root diseases of wheat grown. Phytopathology 87: 551-558.
Kloepper JW et al. 1999. Plant root-bacterial interactions in biological control of soilborne disease and potential extension to systemic and foliar diaseases.
Australasian Plant Pathology 28:21-26.
Landa BB, Navas-Cortes JA, Hervas A, Jimenez-Diaz RM. Influence of temperatur and inoculum density of Fusarium oxysporum f. Sp. ciceris on suppression of Fusarium wilt of chikpea by rhizosphere bacteria. Phytopathology 91: 807- 816.
Larkin R., Hopkins DL, Martin FN. 1996. Suppression of fusarium wilt of watermelon by nonpathogenic Fusarium oxysporum and other microorganisms recovered from a disease-suppresive soil. Phytopathology 86: 812-819.
Lelliot RA, Stead DE. 1987. Methods for the Diagnosis of Bacterial Diseases of Plants. Vol ke-2. London: British Society for Plant Pathology
Lemaga B, Kanzikwera R, Kakuhenzire R, Hakiza JJ, Manzi G. 2001. The effect of crop rotation on bacterial wilt incidence and potato tuber yield. African Crop Science Journal. 9: 257-266.
Li J dan Kremer RJ. 2000. Rhizobacteria associated with weed seedlings in different cropping systems. Weed Science 48: 734-741.
Liu L, Kloepper JW, Tuzun S. 1995. Induction of systemic resistance in cucumber against bacterial angular leaf spot by plant growth-promoting rhizobacteria. Phytopathology 85: 843-847.
Muharam A, Sulyo Y, Djatnika I, Marwoto B. 1992. Identifikasi dan daerah pencar penyakit penting pada tanaman pisang. Di dalam: Muharam A, Djatnika I, Sulyo Y, Sunarjono H, editor. Pisang sebagai Komoditas Andalan Prospek dan Kendalanya. Cianjur, 5 Nop 1992. Segunung: Sub Balai Penelitian Hortikultura Segunung. hlm 23 – 28.
Notz R et al. 2001. Biotic factors affecting expression of the 2,4-diacetylphloroglucinol biosynthesis gene phlA in Pseudomonas fluorescens
biological control strain CHA0 in the rizosphere. Phytopathology 91: 873-881.
Phae CG, Shoda M, Kita N, Nakano M, Ushiyama K. 1992. Biological control of crown and root rot and bacterial wilt of tomato by Bacillus subtilis NB22.
Ann Phytopath Soc Japan 58:329-339
Ploetz RC dan Pegg KG. 2000. Fungal disease of the root, corm and pseudostem: Fusarium wilt. Di dalam: Jones DR, editor. Disease of Banana, Abaca and Enset. Wallingford: CAB International. hlm 143-159.
Press CM, Wilson M, Tuzun S , Kloepper JW. 1997. Salicylic acid produced by
Serratia marcescens 90-166 is not the primary determinant of induced systemic resistance in cucumber or tobacco. Molleculer Plant-Microbe Interaction10: 761-68.
Press CM, Loper JE, Kloepper JW. 2001. Role of iron rhizobacteria-mediated induced systemic resistance of cucumber. Phytopathology 91: 593-598. Rosales AM, Thomashow L, Cook RJ, Mew TW. 1995. Isolation and
identification of antifungal metabolites produced by rice-associated antagonistic Pseudomonas spp. Phytopathology 85: 1028-1032.
Reid LM, Zhu X, Ma BL. 2001. Crop rotation and nitrogen effects on maize susceptibility to gibberella (Fusarium graminearum) ear rot. Plant Soil 237: 1-14.
Sahlan dan Nurhadi. 1994. Inventarisasi penyakit pisang di sentra produksi Sumatera Barat, Jawa Barat dan Lampung. Jurnal Penelitian Hortikultura 6: 29-36
Schaad NW, Jones JB, Chun W. 2001. Laboratory Guide for Identification of Plant Pathogenic Bacteria. Ed ke-3. St Paul: APS Press.
Semangun H. 1991. Penyakit-penyakit Tanaman Hortikultura di Indonesia. Yogyakarta: Gajah Mada Press.
Sequeira L. 1998. Bacterial wilt: the missing element in international banana improvement programs. Di dalam: Prior PH, Allen C, Elphinstone JE, editor.
Bacterial Wilt Disease, Molecular and Ecological Aspects. Gosier, 22-27 Jun 1997. Berlin: INRA. hlm 6-14.
Stoltzfus JR, So R, Malarvithi PP, Ladha JK, de Bruijn FJ. 1997. Isolation of endophytic bacteria from rice and assessment of their potential for supplying rice with biologically fixed nitrogen. Plant Soil 194: 25-36.
Stover RH. 1972. Banana, Plantain and Abaca Disease. London: The Eastern Press. hlm 167-178.
Sturz AV, Christie BR, Matheson BG, Arsenault WJ, Buchanan MA. 1999. Endophytic bacterial communities in the periderm of potato tubers and their potential to improve asistance to soil-borne plant pathogens. Plant Pathology 48: 360-369.
Sulyo Y. 1992. Informasi mengenai hasil-hasil penelitian penyakit pisang mutakhir. Di dalam: Muharam A, Jatnika I, Sulyo Y, Sunarjono H, editor.
Pisang sebagai Komoditas Andalan Prospek dan Kendalanya. Cianjur, 5 Nop 1992. Segunung: Sub Balai Penelitian Hortikultura Segunung. hlm 8-22.
Sumner DR dan Bell D K. 1994. Survival of Rhizoctonia spp. and root disease in rotation of corn, snap bean, and peanut in microplots. Phytopathology 84: 113-118.
Supriadi. 1994. Studies on the characteristics of P. solanacearum and related species from Indonesia, and the potential use of bacterophage and bacteriocin for biological control of bacterial wilt disease [Disertasi]. London: University of London.
Susana. 2000. Analisis introduksi mikroorganisme anragonis untuk pengendalian hayati penyakit layu (Fusarium oxysporum f.sp. cubenser) pada pisang (Musa sapientum L.). [Tesis]. Institut Pertanian Bogor, Pasca Sarjana.
Thwaites R, Eden-Green S, Masfield J, Seal S. 1998. Studies on the molecullar basis for patogenicity and host specificity in strains of Ralstonia solanacearum pathogenic to banana. Di dalam: Prior PH, Allen C, Elphinstone JE, editor. Bacterial Wilt Disease: Molecular and Ecological Aspects. Gosier, 22-27 Jun 1997. Berlin: INRA. hlm 192-194.
Tjahjono B, Eden-Green SJ. 1988. Blood disease of bananas in Indonesia (abstrak). International Congress of Plant Pathology 5th , Kyoto
Wardlaw CW. 1972. Banana Disease. Including Plantains and Abaca. London: Longman, Green and Co LTD. hlm 188-276.
Wei G, Kloepper JW, Tuzun S. 1995. Induced systemic resistance to cucumber disease and increased plant growth by plant growth promoting rhizobacteria under filed condition. Phytopathology 86: 221-224.
Winstead NN, Kelman A. 1952. Inoculation techniques for evaluating resistance to Pseudomonas solanacearum. Phytopathology 42:628-634.
Zehnder GW, Yao C, Murphy JF, Sikora ER, Klopper JW, Schuster DJ, Polstan JE. 2000. Microbe-induced resistance against pathogens and herbivores: evidence of effectiveness in agriculture. Di dalam: Agrawal AA, Tuzun S, Bent E, editor. Induced Plant Defense against Pathogenesis and Herbivores Biochemistry, Ecology, and Agriculture. St Paul: APS Press. hlm 335-355
Zinniel et al.. 2002. Isolation and characterization of endophytic colonizing bacteria from agronomic crops and prairie plants. Apllied Environmental Microbiology 68: 2198-2208.