BAB II
TINJAUAN PUSTAKA
2.1 Pencemaran Logam Berat
Pencemaran logam berat di lingkungan merupakan masalah serius karena kelarutan dan mobilitasnya menimbulkan toksisitas dan ancaman bagi kehidupan makhluk hidup, termasuk manusia [6]. Logam-logam berat tersebut berasal dari aktifitas manusia seperti buangan rumah tangga, buangan sisa industri yang tidak terkontrol yang mengalir ke perairan dan pembakaran hidrokarbon dan batu bara diantaranya ada yang melepaskan senyawa logam berat ke udara kemudian bercampur dengan air hujan dan mengalir juga ke perairan. Logam berat merupakan istilah yang digunakan untuk unsur-unsur transisi yang mempunyai massa jenis atom lebih besar dari 6 g/cm3 . Merkuri (Hg), timbal (Pb), tembaga (Cu), kadmium (Cd) dan stronsium (Sr) adalah contoh logam berat yang berupa kontaminan yang berasal dari luar tanah dan sangat diperhatikan karena berhubungan erat dengan kesehatan manusia, pertanian dan ekotoksikologinya [7].
Penumpukan logam berbahaya pada tumbuhan juga beresiko pada manusia dan hewan [8]. Biota air yang hidup dalam perairan tercemar logam berat, dapat mengakumulasi logam berat tersebut dalam jaringan tubuhnya. Biota air yang hidup dalam perairan tercemar logam berat, dapat mengakumulasi logam berat tersebut dalam jaringan tubuhnya. Makin tinggi kandungan logam dalam perairan akan menyebabkan semakin tinggi pula kandungan logam berat yang terakumulasi dalam tubuh hewan tersebut [9].
Penyebab utama logam berat menjadi bahan pencemar berbahaya yaitu logam berat tidak dapat dihancurkan (non degradable) oleh organisme hidup di lingkungan dan terakumulasi ke lingkungan, terutama mengendap di dasar perairan membentuk senyawa komplek bersama bahan organik dan anorganik secara adsorbsi dan kombinasi [11]
Logam berat berdasarkan sifat racunnya dapat dikelompokkan menjadi empat golongan [12] yaitu :
a. Sangat beracun, dapat mengakibatkan kematian ataupun gangguan kesehatan yang pulih dalam waktu yang lama. logam-logam tersebut adalah Hg, Pb, Cd, Cr dan As.
b. Moderat. yaitu mengakibatkan gangguan kesehatan baik dalam waktu yang relatif lama. logam-logam tersebut adalah Ba, Be, Cu, Au, Li, Mn, Se, Te, Co dan Rb.
c. Kurang beracun. logam ini dalam jumlah besar menimbulkan gangguan kesehatan. logam-logam tersebut adalah Al, Bi, Co, Fe, Ca, Mg, Ni, K, Ag, Ti dan Zn.
d. Tidak beracun. yaitu tidak menimbulkan gangguan kesehatan. Logam-logam tersebut adalah Na, Al, Sr dan Ca.
Logam berat dapat diklasifikasikan menjadi empat kelompok berdasarkan kegunaannya bagi kesehatan [13], yaitu:
Esensial : Cu, Zn, Co, Cr, Mn dan Fe, logam ini juga disebut mikronutrien (zat yang diperlukan tubuh tetapi dalam jumlah yang sangat kecil) dan beracun jika diminum melebihi persyaratan.
2.1.1 Logam Berat Pencemar
a. Kadmium (Cd)
Kadmium murni merupakan logam lembut berwarna perak keputih-putihan. Ciri-ciri fisik dari kadmium adalah nomor atom 48, atom berat 112.411, elektronegatif 1.5 kristal ionik radius (kepala negara valence) 0,97, potensi ionisasi 8.993, pada keadaan oksidasi +2, elektron konfigurasi Kr 4d1 5S2, densitas 8,64 g/cm3, titik leleh 320.9 °C dan titik didih 765 °C pada 100 kPa. Biasanya ditemukan dalam bentuk mineral yang dikombinasikan dengan unsur-unsur lain seperti oksigen (kadmium oksida), klorin (kadmium klorida) atau belerang (kadmium sulfat, kadmium sulfida) [14]. Logam kadmium adalah bahan yang bersifat karsinogen. Organ tubuh yang menjadi sasaran keracunan Cd adalah ginjal dan hati.
Kadmium lebih mudah diakumulasi oleh tanaman dibandingkan dengan ion logam berat lainnya seperti timbal. Menurut badan dunia FAO/ WHO, konsumsi per minggu yang ditoleransikan bagi manusia adalah 400-500 g per orang atau 7 mg per kg berat badan. Kadmium yang terdapat dalam tubuh manusia sebagian besar diperoleh melalui makanan olahan, makanan yang berasal dari perairan, pipa air, kopi, teh, pembakaran batubara dan rokok merupakan sumber Cd yang utama., hanya sejumlah kecil berasal dari air minum dan polusi udara[15]. Menurut penelitian yang dilakukan oleh Laegreid (1999) dalam Charlene (2004), pemasukan Cd melalui makanan adalah 10-40 mg/ hari, sedikitnya 50% diserap oleh tubuh.
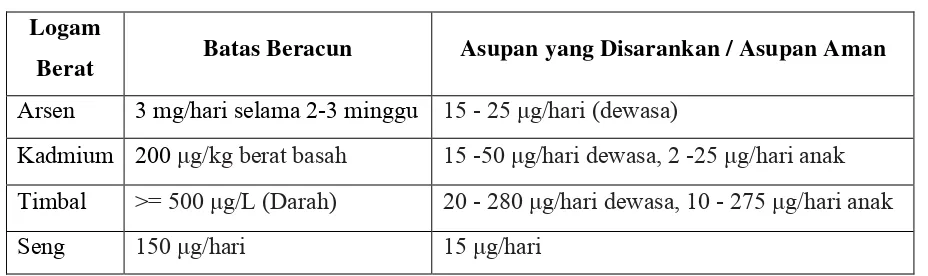
Tabel 2.1 Ambang Batas Racun Yang Ditoleransi / Asupan Aman Logam Berat Logam
Berat Batas Beracun Asupan yang Disarankan / Asupan Aman Arsen 3 mg/hari selama 2-3 minggu 15 - 25 μg/hari (dewasa)
Kadmium 200 μg/kg berat basah 15 -50 μg/hari dewasa, 2 -25 μg/hari anak
Timbal >= 500 μg/L (Darah) 20 - 280 μg/hari dewasa, 10 - 275 μg/hari anak
Seng 150 μg/hari 15 μg/hari
2.2 Adsorpsi
Adsorpsi (penyerapan) merupakan suatu proses pemisahan dimana komponen dari suatu fase fluida berpindah ke permukaan zat padat yang menyerap (adsorben). Biasanya partikel-partikel kecil zat penyerap dilepaskan pada adsorpsi kimia yang merupakan ikatan kuat antara penyerap dan zat yang diserap sehingga tidak mungkin terjadi proses yang bolak-balik. Interaksi yang terjadi akan menyebabkan sifat- sifat logam mengalami modifikasi atau perubahan. Menurut kekuatan interaksinya, ada 2 tipe adsorpsi yaitu adsorpsi fisik (phisisorpsi) dan adsorpsi kimia (khemisorpsi). Dalam adsorpsi fisik kekuatan ikatan antara molekul yang diadsorpsi dan permukaan sangat lemah, atau tipe Van der Waals. Energi yang berasosiasi dengan ikatan tersebut relatif lemah. Sebaliknya dalam adsorpsi kimia ikatan sangat berperan dan merupakan resultan dari suatu transfer atau suatu penempatan elektron dalam reaksi antara adsorbat dan adsorben . Kekuatan ikatan dalam khemisorpsi menjadi lebih penting dibandingkan pada phisisorpsi. Keadaan molekul dari adsorbat akan berbeda dari keadaan awalnya. Atom permukaan mempunyai suatu karakter elektronik tidak jenuh dengan kehadiran beberapa kekosongan (valensi bebas). Pembentukan lapisan sempurna dari molekul yang diadsorpsi secara kimia memungkinkan menjenuhkan secara sempurna pada daerah kekosongan.
yang diadsopsi terurai menjadi molekul lain yang lebih kecil. Sebaliknya dikatakan adsorpsi molekuler bila molekul yang diadsorpsi tidak mengalami disosiasi [17]. Adsorpsi merupakan metode yang paling umum dipakai karena memiliki konsep yang lebih sederhana dan juga ekonomis. Proses adsorpsi yang paling berperan adalah adsorben [18].
2.3 Faktor-faktor yang mempengaruhi Adsorpsi
Faktor-faktor yang mempengaruhi mekanisme adsorpsi adalah agitasi, karakteristik adsorbat, ukuran molekul adsorbat, pH larutan, temperatur dan waktu kontak [19].
1. Agitasi
Jika agitasi yang terjadi antara partikel karbon dengan cairan relatif kecil, permukaan film dari liquid sekitar partikel akan menjadi tebal dan difusi film akan terbatas. Kecepatan pengadukan juga merupakan salah satu faktor penting yang dapat mempengaruhi kemampuan dan kapasitas adsorpsi dari suatu adsorben. Semakin besar kecepatan pengadukan, maka akan semakin besar juga konstanta adsorpsinya. Hal ini disebabkan oleh lapisan film pada adsorben mengalami penipisan maka adsorban akan dapat menembus lapisan filmnya (Drastinawati dan Zultiniar, 2013).
Dalam proses adsorpsi, apabila kecepatan pengadukan kecil, maka adsorban akan sulit menembus lapisan film yang berada di antara permukaan adsorben dan difusi filmnya. Apabila kecepatan pengadukan sesuai, maka akan menaikkan film difusinya sampai ke titik pori difusi (Asip, dkk., 2008).
2. Karakteristik adsorban
3. Ukuran molekul adsorbat
Ukuran molekul merupakan bagian yang penting dalam adsorpsi karena molekul harus memasuki micropore dari partikel adsorban untuk diadsorpsi. Tingkat adsorpsi biasanya meningkat seiring dengan semakin besarnya ukuran molekul dari adsorbat. Kebanyakan limbah terdiri dari bahan-bahan campuran sehingga ukuran molekulnya berbeda-beda. Pada situasi ini akan memperburuk penyaringan molekul karena molekul yang lebih besar akan menutup pori sehingga mencegah jalan masuknya molekul yang lebih kecil.
4. Waktu Kontak
Waktu yang diperlukan untuk mencapai keadaan setimbang pada proses penyerapan ion logam oleh adsorban hanya beberapa menit saja [20]. Jumlah zat yang diadsorpsi pada permukaan adsorban merupakan proses untuk mencapai kesetimbangan karena laju adsorpsi juga diikuti dengan proses desorpsi. Pada saat mula-mula reaksi, proses adsorpsi lebih dominan daripada proses desorpsi sehingga proses adsorpsi berlangsung cepat.
Pada akhir-akhir mencapai keadaan setimbang, peristiwa adsorpsi juga cenderung mengalami perlambatan proses penyerapan pada keadaan setimbang namun hal ini tidak terlihat secara makroskopis. Pada setiap jenis adsorban yang digunakan, waktu untuk mencapai saat setimbang berbeda-beda. Perbedaan waktu untuk mencapai keadaan setimbang dikarenakan jenis interaksi yang terjadi antara adsorban dan adsorbat. Secara umum, waktu untuk mencapai kesetimbangan melalui mekanisme secara fisika (physisorption) lebih cepat bila dibandingkan dengan mekanisme secara kimia (chemisorption) [21].
5. Keasaman (pH)
Tingkat keasaman atau pH mempunyai pengaruh dalam proses adsorpsi. Untuk mencapai pH optimum dalam proses adsorpsi ditandai dengan jumlah maksimum yang dapat diserap adsorban adalah ditetapkan melalui uji laboratorium. Keasaman (pH) akan mempengaruhi sisi aktif biomassa serta berpengaruh pada mekanisme adsorpsi ion logam. Pada pH yang rendah, proses adsorpsi ion logam juga semakin rendah atau lambat. Hal ini dikarenakan pada kondisi asam, gugus fungsi yang terdapat pada adsorban terprotonasi sehingga terjadi pengikatan ion hidrogen (H+) dan ion hidronium [20]. Sementara itu ion-ion logam dalam larutan sebelum teradsorpsi oleh adsorban terlebih dahulu mengalami hidrolisis dan menghasilkan proton [23].
Dalam kondisi pH rendah (<7) permukaan adsorban akan bermuatan positif sehingga mengalami tolakan antara pemukaan adsorban dengan ion logam akibatnya proses adsorpsi menjadi lambat dan rendah. Sementara itu pada pH tinggi (>7), maka proses adsorpsi relatif tinggi, hal ini dikarenakan komplek hidrokso logam (MOH+) yang akan terbentuk di dalam larutan lebih banyak, demikian juga permukaan adsorban akan bermuatan negatif sehingga melepaskan proton sehingga melalui gaya elektrostatik akan terjadi tarik menarik yang menyebabkan peningkatan adsorpsi [24].
2.4 Mekanisme Adsorpsi
Proses adsorpsi molekul adsorbat dari fasa cair ke permukaan adsorben melibatkan tahapan sebagai berikut:
∑ Transfer massa molekul adsorbat ke seluruh lapisan batas eksternal dari partikel padat.
∑ Transportasi molekul adsorbat dari permukaan partikel ke dalam bagian aktif dengan difusi dalam pori berisi cairan dan berpindah keseluruh permukaan padat dari pori-pori.
∑ Adsorpsi molekul terlarut pada bagian aktif pada permukaan bagian dalam dari pori-pori.
2.5 Kinetika Adsorpsi
Jumlah adsorbat yang diserap dalam mg/g pada waktu t dihitung dengan menggunakan persamaan berikut:
[24] Dimana Co dan Ct masing-masing adalah konsentrasi adsorbat mula-mula dan
pada waktu t tertentu dalam mg/L. V adalah volume larutan adsorbat dalam ml dan m adalah massa adsorben dalam mg .
2.6 Pasir
Partikel pasir dibentuk dari pecahan kristal magma beku dan batuan metamorf atau dari batu pasir yang sudah ada. Berdasarkan kandungan mineralnya, pasir umumnya terdiri dari kuarsa, Feldspar, Mika dan kapur (kalsit, dolomit dll). Klasifikasi dari mineral partikel dapat disebut pasir berdasarkan ukurannya. Menurut skema klasifikasi United States Department of Agriculture (USDA), partikel pasir berada pada rentang diameter antara 0,05-2.0 mm. Dengan demikian, bahan mineral yang disebut pasir dapat bervariasi tergantung pada skema klasifikasi yang digunakan [25].
Juga ada, subkategori partikel pasir terutama untuk skema USDA, yaitu pasir sangat halus berkisar 0,05-0,1 mm, pasir halus berkisar dari 0,1-0.25 mm, pasir sedang (medium) berkisar 0.25-0.5 mm, pasir kasar berkisar dari 0,5-1,0 mm, dan pasir sangat kasar berkisar 1.0-2,0 mm. Untuk memahami tentang tren adsorpsi logam dengan menggunakan pasir, pertimbangan hubungan antara jenis ion logam yang akan diserap dengan silika dan feldspar (komponen pasir) akan sangat membantu. Silika (SiO2)
memiliki struktur yang terdiri dari tiga rangkaian dimensi tetrahedron yang tidak terbatas. Setiap atom silikon membentuk empat ikatan tunggal dengan empat atom oksigen yang terletak di empat penjuru tetrahedron [26].
fungsional pada permukaan, yang tidak melibatkan fase atau air cair molekul antara ion dan permukaan . Pasir alam mungkin memiliki pori makro dan mesopori, dan porositas sebagian besar dipengaruhi oleh ukuran partikel, bentuk biji-bijian, dan bentuk batuan [5].
Porositas dapat diklasifikasikan menjadi porositas antar-partikel dan porositas intraparticle. Pori-pori menyebabkan tidak hanya luas permukaan yang besar, tetapi juga tingginya selektivitas adsorpsi [5]. Interaksi antara ion logam dan permukaan pasir akan mempengaruhi karakteristik desorpsi ion logam dalam proses remediasi [5]. Pasir dengan ion logam teradsorpsi disusun oleh proses adsorpsi dan kemudian dikeringkan untuk memungkinkan ion logam untuk berinteraksi dengan permukaan pasir terutama melalui interaksi inner-sphere.
Permukaan kelompok fungsional dari silikat memainkan peran penting dalam proses adsorpsi. Pada bagian ini atom oksigen terikat pada lapisan silika tetrahedral dan kelompok hidroksil berkaitan pada tepi tiap unit dari struktur silikat. Kelompok fungsional ini menyediakan bagian permukaan untuk penyerapan logam transisi dan logam berat secara kimiawi. Permukaan kelompok fungsional ini dapat direpresentasikan sebagai berikut:
[12].
2.7 Surfaktan
Surfaktan adalah molekul amphiphilic memiliki kedua ekor hidrofobik dan kepala hidrofilik. Ketika dilarutkan dalam air pada konsentrasi rendah, molekul surfaktan ada, yang berperan sebagai monomer [27]. Sebagai jenis senyawa amfifilik memiliki konstanta dielektrik rendah dan viskositas lebih tinggi dari air, surfaktan dapat meningkatkan kelarutan senyawa organik dengan menurunkan tegangan antarmuka serta oleh solubilisasi misel [28]. Struktur molekul yang unik dari surfaktan memungkinkan untuk meningkatkan kelarutan kontaminan dalam tanah, terutama untuk senyawa organik hidrofobik[5].
Surfaktan dapat meningkatkan desorpsi polutan dari tanah, dan memacu proses bioremediasi organik dengan meningkatkan bioavailabilitas polutan [5]. Selain kemampuan yang tinggi untuk desorb kontaminan, surfaktan harus memiliki CMC lebih rendah dan aktif dengan dosis kecil sebagai larutan pencuci, untuk mengurangi biaya proses perbaikan dan selanjutnya memastikan ekonomi dari proses keseluruhan [5] .
Struktur molekul surfaktan, yang mengatur sifat-sifat surfaktan, adalah faktor dominan untuk karakteristik adsorpsi. Pada konsentrasi yang lebih tinggi, monomer akan dikelompokkan ke dalam kelompok, yang disebut '' misel ''. Konsentrasi pada saat pengelompokkan '' misel '' ini dikenal sebagai CMC [5].
Menurut (Mulligan, 2004), Jika surfaktan ditambah melebihi CMC, maka jumlah misel akan terus bertambah tetapi ukuran mereka akan hampir tetap konstan. Untuk perubahan konsentrasi dibawah CMC, maka sifat fisik seperti: tegangan permukaan, tegangan antar muka, adsorpsi, dan daya bersih akan terjadi perubahan.
2.7.1 SDS
Sodium lauril sulfat (SLS), natrium laurilsulfate atau natrium dodesil sulfat (SDS atau Nads) (C12H25SO4Na) adalah surfaktan anionik yang digunakan di banyak
rendah dibandingkan dengan kationik dan nonionic [30]. Molekul ini memiliki ekor 12 atom karbon, yang melekat pada kelompok sulfat, memberikan sifat molekul amfifilik diperlukan dari deterjen. SLS adalah surfaktan yang sangat efektif dan digunakan dalam setiap tugas yang memerlukan penghilangan noda berminyak dan residu [31].
Misalnya, ditemukan dalam konsentrasi yang lebih tinggi dengan produk industri termasuk minyak pelumas mesin, pembersih lantai, dan sabun cuci mobil. Hal ini digunakan dalam konsentrasi yang lebih rendah dengan pasta gigi, shampoo, dan busa cukur.Natrium dodesil sulfat (SDS, CH3(CH2)11SO4Na), surfaktan anionik dengan
konsentrasi kritis misel (CMC) dari 8 mM, adalah tingkat nutrisi yang baik dan mudah terurai oleh tanah atau mikroorganisme air.
Seperti semua surfaktan deterjen (termasuk sabun), natrium lauril sulfat menghilangkan minyak dari kulit, dan dapat menyebabkan kulit dan iritasi mata. Konsentrasi misel kritis (CMC) dalam air murni pada 25 ° C adalah 0,0082 M, dan jumlah agregasi pada konsentrasi ini biasanya dianggap menjadi sekitar 62. Fraksi misel ionisasi (α) adalah sekitar 0,3 ( atau 30%) [32].
2.8 Remediasi Logam Berat pada Pasir terkontaminasi
Remediasi/pencucian pasir dapat digunakan sebagai metode untuk
menghilangkan kontaminan [29]. Dalam praktis remediasi, karena kontaminan melekat pada permukaan partikel pasir dan biasanya memiliki kelarutan dalam air yang rendah juga bersifat aditif seperti asam, surfaktan dan agen chelating sering ditambahkan ke dalam cairan pencuci untuk melarutkan kontaminan dari pasir.
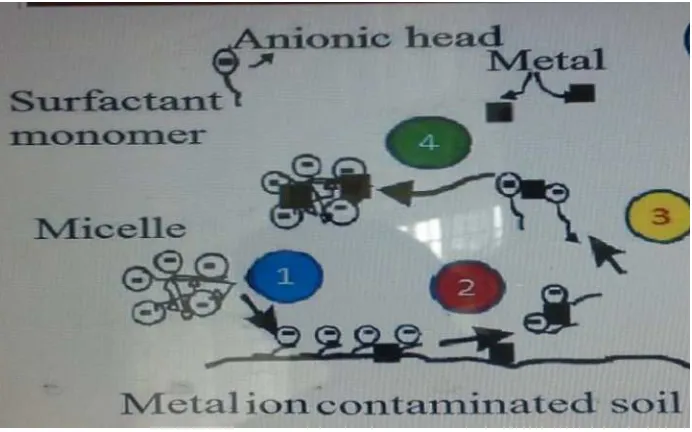
Potensi misel surfaktan dalam menghilangkan ion logam pada permukaan media pasir yang terkontaminasi (Mulligan, 2005).
Gambar 2.1 Interaksi Sodium Dodecyl Sulfatedengan Ion Logam (Mulligan, 2005).
Kontaminan pasir dimobilisasi, oleh larutan pencuci (misalnya pembentukan misel dengan bantuan larutan pencuci) atau melalui interaksi kimia [5]. Kekhawatiran tentang toksisitas surfaktan terutama timbul dari surfaktan sisa dalam tanah setelah mencuci tanah jika mereka tidak mudah terurai. Kehadiran berlebihan surfaktan dalam sistem air dan tanah dapat mempengaruhi ekosistem merugikan karena aktivitas biologis surfaktan. Surfaktan anionik dapat mengikat makromolekul bioaktif seperti peptida, enzim, dan DNA, mengubah fungsi biologis mikroorganisme [32].
sedikit energi untuk mencapai remediasi. Namun, remediasi dengan surfaktan membutuhkan konsumsi besar surfaktan dengan efisiensi penyisihan rendah.
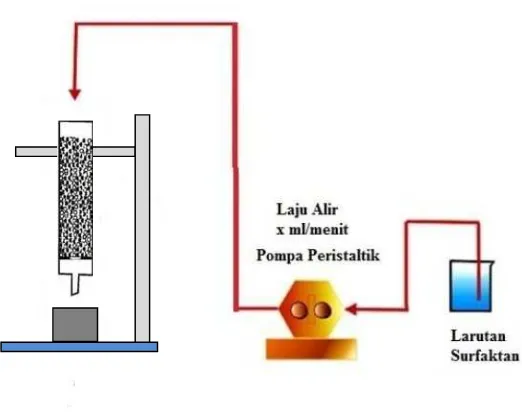
2.9 Rangkaian Percobaan Remediasi Logam Berat pada Pasir Terkontaminasi dengan Kolom
Gambar 2.2 Rangkaian Percobaan Remediasi Logam Berat pada Pasir Terkontaminasi dengan Kolom
Keterangan Gambar: