PEDOMAN PENGGUNAAN SKRIPSI
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT karena atas rahmat dan hidayah-Nya penulis dapat menyelesaikan skripsi yang berjudul “Efektivitas
Organic Loading Rate Terhadap Penyisihan Bahan Organik dengan Media Arang Tempurung Kelapa (Cocos nucifera) Pada Reaktor Anaerobik Kontinyu”.
Skripsi ini terdiri atas beberapa bab, yaitu bab pendahuluan, bab tinjauan pustaka, bab metode penelian, hasil dan pembahasan, kesimpulan dan saran, serta daftar pustaka. Setiap isi dari bab tersebut terangkai secara komprehensif untuk melakukan penelitian Efektivitas Organic Loading Rate Terhadap Penyisihan Bahan Organik dengan Media Arang Tempurung Kelapa (Cocos nucifera) Pada Reaktor Anaerobik Kontinyu.
Skripsi ini merupakan salah satu syarat wajib yang digunakan untuk memperoleh gelar Sarjana Teknik (S.T.). Skripsi ini disusun sesuai dengan ketentuan teknis penyusunan yang ada di Program Studi S1 Ilmu dan Teknologi Lingkungan, Departemen Biologi, Fakultas Sains dan Teknologi, Universitas Airlangga. Segala masukan demi perbaikan kualitas naskah skripsi ini sangat diharapkan. Semoga skripsi ini bermanfaat.
Surabaya, Juni 2016 Penyusun,
UCAPAN TERIMAKASIH
Puji syukur atas rahmat Allah SWT, akhirnya penyusun dapat menyelesaikan naskah skripsi ini dengan baik. Naskah skripsi ini tidak akan selesai tanpa bimbingan, bantuan, doa, dari berbagai pihak. Oleh karena itu, penyusun menyampaikan ucapkan terimakasih yang sebesar-besarnya kepada: 1. Dr. Sucipto Hariyanto, DEA selaku Ketua Departemen Biologi Fakultas Sains
dan Teknologi Universitas Airlangga, yang telah banyak menyediakan fasilitas untuk menunjung skripsi
2. Dr. Eko Prasetyo Kuncoro, S.T., DEA selaku Koordinator Program Studi (Prodi) S1 Ilmu dan Teknologi Lingkungan (ITL), yang telah menyediakan fasilitas untuk menunjang skripsi
3. Prof. Drs. Hery Purnobasuki, M.Si., Ph.D., selaku Ketua Penelitian. Oleh karena skripsi ini merupakan bagian dari penelitian yang berjudul “Kemampuan Arang Tempurung Kelapa (Cocos nucifera) sebagai Penyisih Kadar Ammonia (Inhibitor Produksi Biogas) Pada Pengolahan Air Limbah Anaerobik”. Yang telah memberikan berbagai ilmu dan pengalaman dalam penelitian ini.
4. Nur Indradewi Oktavitri, S.T., M.T. selaku pembimbing I yang selalu membimbing dan mengarahkan penyusun dalam setiap kegiatan dan penyusunan naskah skripsi.
5. Prof. Dr. Bambang Irawan, M.Sc. selaku pembimbing II yang selalu membimbing dan mengarahkan penyusun dalam setiap kegiatan dan penyusunan naskah skripsi.
6. Seluruh staff laboran Laboratorium Ekologi dan Lingkungan Ruang 122, dan Laboratorium Basah, Fakultas Sains dan Teknologi Universitas Airlangga yang telah mendukung pelaksanaan penelitian skripsi
7. Bapak Andi dan Ibu Aisyah, sebagai orang tua yang selalu memberikan doa dan motivasi
8. Attar H, Indah Purnamasari, Mufrihatul Hayati, Siti Mariya Ulfa, Semma, dan Mega selaku rekan penelitian yang telah memberikan dukungan dan motivasi 9. Citra Ayu Nurjanah, sebagai orang terdekat penyusun yang telah selalu
memberikan motivasi dan mengingatkan penyusun
10. Rekan-rekan Ilmu dan Teknologi Lingkungan 2012 yang telah memberikan bantuan dan bertukar informasi
Paramarta Z.P., 2016. Efektivitas Organic Loading Rate Terhadap Penyisihan Bahan Organik dengan Media Arang Tempurung Kelapa (Cocos nucifera) Pada Reaktor Anaerobik Kontinyu. Skripsi ini di bawah bimbingan Nur Indradewi Oktavitri, S.T., M.T., dan Prof. Dr. Bambang Irawan, M.Sc. Program S1 Ilmu dan Teknologi Lingkungan, Departemen Biologi, Fakultas Sains dan Teknologi, Universitas Airlangga
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh organic loading rate (OLR) yang efektif untuk menyisihkan bahan organik menggunakan reaktor anaerobik kontinyu bermedia arang aktif tempurung kelapa (Cocos nucifera). Bahan organik pada penelitian ini diukur dengan parameter TCOD dan SCOD. Pengoperasian reaktor pada penelitian ini menggunakan variasi OLR yaitu OLR 0, 4, 8, dan 16 g/L.hari. Penelitian ini dilakukan selama 15 hari pada tiap OLR dengan volume reaktor 1 liter dan pengambilan sampel air limbah dilakukan setiap 3 hari. Hasil dari penelitian menunjukan penyisihan konsentrasi TCOD dan SCOD ada beda signifikan. Organic loading rate yang efektif untuk penyisihan konsentrasi TCOD dan SCOD adalah OLR 16 g/L.hari yang mampu menyisihkan konsentrasi TCOD sebesar 2.736 mg/L dan menyisihkan konsentrasi SCOD sebesar 2.016 mg/L.
Paramarta Z.P., 2016. The Effectiveness of Organic Loading Rate to Remove The Organic Materials Using Activated Carbon Coconut Shell Media (Cocos nucifera) in Continuous Anaerobic Reactor. This script was supervised by Nur Indradewi Oktavitri, S.T., M.T., and Prof. Dr. Bambang Irawan, M.Sc. Environmental Science and Technology, Departement of Biology, Faculty of Science and Technology, Airlangga University.
ABSTRACT
The aims of this research was to know the effect of Organic Loading Rate that is effectives for removing organic materials in continuous anaerobic reactor using activated carbon coconut shell media (Cocos nucifera). In this research, the parameters that used to measure the organic material were TCOD and SCOD. The operation of the reactor that used in this research using OLR variations, such as 0, 4, 8, and 16 g/L.day. The research was conducted for 15 days on each OLR with 1 liter reactor volume andsampling of wastewater every 3 days. The results of this OLR research were a significant difference OLR in the concentration removal of TCOD and SCOD. The effective OLR for concentration removal of TCOD and SCOD was OLR 16 g/L.day can remove the concentration of TCOD by 2,736 mg/L and remove the concentration of SCOD by 2,016 mg/L.
DAFTAR ISI
JUDUL ... i
LEMBAR PERNYATAAN ... ii
LEMBAR PENGESAHAN ... iii
LEMBAR PEDOMAN PENGGUNAAN SKRIPSI ... iv
PRAKATA ... v
1.4.1 Hipotesis kerja ... 6
1.4.2 Hipotesis statistika ... 7
1.5 Tujuan ... 7
1.6 Manfaat ... 8
BAB II: TINJAUAN PUSTAKA 2.1 Air Limbah ... 9
2.1.1 Karakteristik air limbah ... 9
2.1.2 Bahan organik dalam air limbah ... 11
2.1.3 Air limbah sintetik ... 11
2.2 Pengolahan Air Limbah Secara Anaerobik ... 12
2.3 Sistem Pengolahan Air Limbah Pada Reaktor Anaerobik ... 17
2.3.1 Pengolahan air limbah dengan sistem batch ... 17
2.3.2 Pengolahan air limbah dengan sistem kontinyu ... 17
2.4 Faktor-faktor yang Mempengaruhi Stabilitas Reaktor ... 18
2.4.1 Organic Loading Rate (OLR) ... 18
2.4.2 Derajat keasamaan (pH) ... 19
2.4.3 Alkalinitas ... 19
2.4.4 Suhu... 19
2.4.5 Senyawa racun atau penghambat ... 20
2.5 Seeding dan Aklimatisasi ... 20
2.6 Penggunaan Media... 21
2.6.1 Tempurung kelapa ... 21
2.6.2 Arang aktif Tempurung kelapa ... 22
2.8.1 Total Chemical Oxygen Demand (TCOD) ... 28
2.8.2 Soluble Chemical Oxygen Demand (SCOD) ... 29
2.8.3 Volatile Fatty Acid (VFA) ... 29
BAB III: METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian ... 31
3.1.1 Tempat penelitian ... 31
3.1.2 Waktu penelitian ... 31
3.2 Variabel Penelitian... 31
3.3 Bahan dan Alat Penelitian ... 32
3.3.1 Bahan penelitian ... 32
3.3.2 Alat penelitian ... 32
3.4 Cara Analisis ... 33
3.4.1 Cara kerja... 33
3.4.2 Analisis Data ... 45
BAB IV: HASIL DAN PEMBAHASAN PENELITIAN 4.1 Penyisihan Konsentrasi Total Chemical Oxygen Demand (TCOD) dan Soluble Chemicel Oxygen Demand (SCOD) Pada Tiap Organic Loading Rate (OLR) ... 49
4.2 Beda Efisiensi Penyisihan Bahan Organik Menggunakan Reaktor Anaerobik Kontinyu Bermedia Arang Aktif Tempurung Kelapa (Cocos nucifera) Bila Nilai OLR Berbeda ... 71
4.3 Organic Loading Rate (OLR) Efektif Untuk Menyisihkan Bahan Organik Menggunakan Reaktor Anaerobik Kontinyu Bermedia Arang Aktif Tempurung Kelapa (Cocos nucifer) ... 73
BAB V: KESIMPULAN DAN SARAN 5.1 Kesimpulan... 76
5.2 Saran ... 76
DAFTAR PUSTAKA ... 77
DAFTAR TABEL
Tabel 2.1 Komposisi Limbah Organik ... 11
Tabel 2.2 Karakter Air Limbah Air Sintetik ... 11
Tabel 2.3 Karakter Susu Bubuk ... 12
Tabel 2.4 Komposisi Nutrisi ... 12
Tabel 4.1 Hasil Uji Beda Statistik Penyisihan TCOD dan SCOD Pada OLR 0 g/L.hari ... 51
Tabel 4.2 Hasil Uji Beda Statistik Penyisihan TCOD dan SCOD Pada OLR 4 g/L.hari ... 55
Tabel 4.3 Hasil Uji Beda Statistik Penyisihan TCOD dan SCOD Pada OLR 8 g/L.hari ... 59
Tabel 4.4 Hasil Uji Beda Statistik Penyisihan TCOD dan SCOD Pada OLR 16 g/L.hari ... 63
DAFTAR GAMBAR
Gambar 2.1 Proses Anaerobik ... 14
Gambar 2.2 Struktur Reaktor Fixed Bed... 15
Gambar 2.3 Tempurung Kelapa dan Arang Tempurung Kelapa ... 21
Gambar 2.4 Arang Aktif Tempurung Kelapa ... 22
Gambar 2.5 Adsorpsi ... 24
Gambar 3.1 Bagan Alir Tahapan Penelitian ... 33
Gambar 3.2 Desain Reaktor 1 dengan OLR 0 g/l.hari ... 39
Gambar 3.3 Desain Reaktor 2 dengan Variasi OLR ... 40
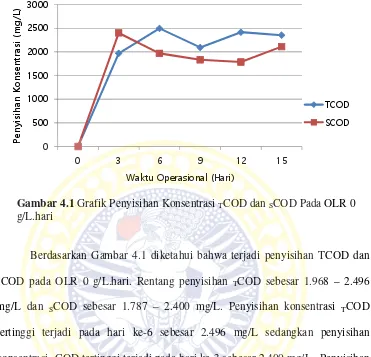
Gambar 4.1 Grafik Penyisihan Konsentrasi TCOD dan SCOD Pada OLR 0 g/L.hari ... 50
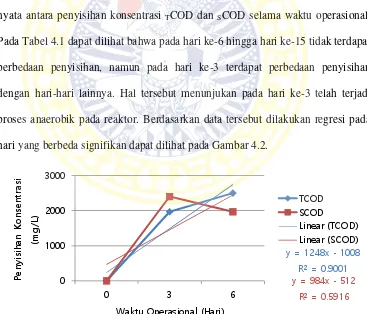
Gambar 4.2 Grafik RegresiPenyisihan Konsentrasi TCOD dan SCOD Pada OLR 0 g/L.hari ... 51
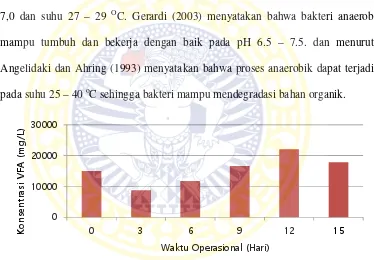
Gambar 4.3 Konsentrasi VFA Pada OLR 0 g/L.hari ... 53
Gambar 4.4 Produksi Biogas Harian Pada OLR 0 g/L.hari ... 54
Gambar 4.5 Grafik Penyisihan Konsentrasi TCOD dan SCOD Pada OLR 4 g/L.hari ... 55
Gambar 4.6 Grafik RegresiPenyisihan Konsentrasi TCOD dan SCOD Pada OLR 4 g/L.hari ... 57
Gambar 4.7 Konsentrasi VFA Pada OLR 4 g/L.hari ... 58
Gambar 4.8 Produksi Biogas Harian Pada OLR 4 g/L.hari ... 59
Gambar 4.9 Grafik Penyisihan Konsentrasi TCOD dan SCOD Pada OLR 8 g/L.hari ... 60
Gambar 4.10 Grafik RegresiPenyisihan Konsentrasi TCOD dan SCOD Pada OLR 8 g/L.hari ... 62
Gambar 4.11 Konsentrasi VFA Pada OLR 8 g/L.hari ... 63
Gambar 4.12 Produksi Biogas Harian Pada OLR 8 g/L.hari ... 64
Gambar 4.13 Grafik Penyisihan Konsentrasi TCOD dan SCOD Pada OLR 16 g/L.hari ... 65
Gambar 4.14 Grafik RegresiPenyisihan Konsentrasi TCOD dan SCOD Pada OLR 16 g/L.hari ... 67
Gambar 4.15 Konsentrasi VFA Pada OLR 16 g/L.hari ... 68
Gambar 4.16 Produksi Biogas Harian Pada OLR 16 g/L.hari ... 68
Gambar 4.17 Nilai pH Pada Semua OLR ... 70
DAFTAR LAMPIRAN
Lampiran 1 Ringkasan Ilmiah ... 83
Lampiran 2 Data Bahan Organik Running ... 93
Lampiran 3 Data VFA, pH, Suhu, dan Biogas Running ... 94
Lampiran 4 Hasil Seeding ... 95
Lampiran 5 Hasil Analisis Data Secara Statistik ... 96
Lampiran 6 Dokumentasi Penelitian ... 99
BAB I
PENDAHULUAN
1.1 Latar Belakang
Air limbah didefinisikan sebagai kombinasi air buangan yang berasal dari tempat tinggal, institusi, bangunan industri, dan komersial yang terbawa oleh air tanah, air permukaan, dan air hujan (Metcalf & Eddy, 2003). Air limbah yang berasal dari air limbah industri pengolahan bahan organik mengandung 70% bahan organik, bahan organik yang terkandung ini akan mengurangi kadar oksigen terlarut di badan air untuk proses degradasi (Templeton & Butler, 2011). Konsentrasi bahan organik dalam air limbah dapat ditunjukan dengan oksidasi kimia menggunakan potassium dibikromat yang disebut Chemical Oxygen Demand (COD). Chemical Oxygen Demand adalah banyaknya oksigen yang dibutuhkan untuk oksidasi sempurna bahan organik dalam air (Wiesmann dkk., 2007).
Limbah yang mengadung bahan organik tinggi dapat menurunkan kualitas badan air. Pengolahan yang tepat untuk mendegradasi bahan organik yang cukup tinggi adalah pengolahan anaerobik (Nadais dkk., 2010). Pengolahan anaerobik adalah pengolahan secara biologi yang memanfaatkan mikroorganisme untuk mendegradasi bahan organik dalam kondisi tidak didapatkan oksigen terlarut (Indriyati, 2005). Menurut Indriyati (2005), pengolahan anaerobik memiliki keuntungan yaitu menghasilkan energi dalam bentuk biogas, dan memiliki kerugian yaitu proses pertumbuhan mikroorganisme lambat dan perlu media sebagai tempat bakteri melekat. Media pada pengolahan anaerobik bermacam-macam, tetapi yang sering digunakan adalah reaktor dengan media tetap atau fixed bed reactor. Reaktor dengan media tetap terdapat dua sistem aliran yaitu sistem diam (batch) dan sistem kontinyu. Salah satu media yang digunakan pada pengolahan anaerobik adalah arang aktif. Bahan yang digunakan untuk arang aktif bermacam-macam, yaitu batok kelapa (Kurniati, 2008), kulit kacang kedelai (Laras dkk., 2015), batang jagung (Suhendra & Gunawan, 2010), dan kulit buah mahoni (Salamah, 2008). Salah satu bahan yang sering digunakan adalah batok kelapa (Kurniati, 2008).
teraktivasi disebut arang aktif batok kelapa (Jamilatun & Setyawan, 2014). Menurut beberapa penelitian arang aktif batok kelapa mampu menyisihkan COD berkisar 75%-80% (Nakhla & Suidan, 1995). Batok kelapa juga mampu menurunkan TSS dan VSS sebesar 87,78% dan 77,38% (Ahmad dkk., 2011). Selain bahan organik batok kelapa mampu menyisihkan ammonia sebesar 30,78% (Harahap, 2013). Kemampuan arang aktif batok kelapa untuk menyerap bahan organik karena arang aktif batok kelapa mempunyai luas permukaan berkisar antara 300 m2/g hingga 3500 m2/g (Jamilatun & Setyawan, 2014). Beberapa penelitian yang telah dilakukan tidak diketahui konsentrasi bahan organik influent dan beban organik yang diolah. Oleh karena itu, pada penelitian yang akan dilakukan konsentrasi bahan organik diketahui untuk menentukan beban organik yang diolah.
Selain media, faktor yang mempengaruhi pengolahan anerobik antara lain laju beban organik atau organic loading rate (OLR) (Indriyati, 2005) dan volatile fatty acids (VFA) (Buyukkamaci & Filibeli, 2004). OLR adalah besaran yang menyatakan jumlah material organik dalam air buangan atau limbah yang diuraikan oleh mikroorganisme dalam reaktor per unit volume per hari (Indriyati, 2005). Besarnya nilai OLR atau laju beban organik yang terdapat didalam reaktor didasarkan pada nilai waktu tinggal hidraulik (Padmono, 2003) dan kondisi influent beban organik yang masuk (Chernicharo, 2007).
mampu menyisihkan COD sebesar 85%. Akram & Stuckey (2008) melakukan penelitian pengolahan anaerobik dengan media biofilter dalam bentuk bubuk arang aktif dengan organic loading rate (OLR) 4 – 16 g/L.hari. Degradasi COD sebesar 98% pada OLR 16g/L.hari. Han dkk., (2010) melakukan penelitian pengolahan anaerobik dengan media butiran arang aktif dengan organic loading rate (OLR) sebesar 4 – 8 g/L.hari. Degradasi COD sebesar 80% pada OLR 4 g/L.hari. Berdasarkan penelitian di atas, OLR berpengaruh terhadap efisiensi penyisihan bahan organik yang terjadi pada pengolahan anaerobik. Penelitian diatas menunjukan perbedaan nilai OLR untuk menyisihkan bahan organik. Akram & Stuckey (2008) menunjukan efisiensi penyisihan tertinggi terjadi saat OLR tinggi, sedangkan Han dkk., (2010) menunjukan efisiensi penyisihan tertinggi saat OLR rendah. Oleh karena itu penelitian yang akan dilakukan menggunakan variasi OLR yaitu 4, 8, dan 16 g/L.hari untuk mengetahui efektivitas OLR dalam menyisihkan bahan organik. Selain organic loading rate (OLR), faktor lain yang berpengaruh terhadap pengolahan anaerobik adalah volatile fatty acids (VFA).
yang besar menghasilkan nilai VFA yang tinggi dan efisiensi penyisihan yang tinggi. Oleh karena itu, penelitian ini juga melakukan pemantauan konsentrasi VFA untuk mengetahui kinerja proses anaerobik yang terjadi pada reaktor.
Berdasarkan pada beberapa penelitian yang telah ada, belum terdapat penelitian penggunaan butiran arang aktif batok kelapa sebagai media biofilter dalam pengolahan anaerobik dengan variasi OLR untuk menurunkan bahan organik dan peningkatan produksi biogas. Oleh karena itu, penelitian ini menggunakan butiran arang aktif batok kelapa sebagai media dengan OLR 16 g/L.hari, 8 g/L.hari, dan 4 g/L.hari menggunakan reaktor anaerobik media tetap secara kontinyu. Parameter yang digunakan dalam penelitian ini untuk mewakili bahan organik adalah CODT, dan CODS. Selain itu dilakukan pemantauan VFA, pH, suhu dan produksi biogas.
1.2 Rumusan Masalah
Rumusan masalah dalam penelitian ini, yaitu :
1. Berapakah konsentrasi penyisihan bahan organik menggunakan reaktor anaerobik kontinyu bermedia arang aktif batok kelapa pada tiap nilai OLR?
2. Apakah ada beda konsentrasi penyisihan bahan organik menggunakan reaktor anaerobik kontinyu bermedia arang aktif batok kelapa bila nilai OLR berbeda?
1.3 Asumsi Penelitian
Asumsi dalam penelitian ini, yaitu :
1. Pada pengolahan anaerobik, OLR mempengaruhi proses penyisihan bahan organik (Ramasamy dkk., 2011)
2. Organic loading rate pada pengolahan anaerobik dipengaruhi oleh HRT (Padmono, 2003), influent bahan organik (Chernicharo, 2007), dan media (Han dkk., 2010).
3. Media butir arang aktif batok kelapa mampu menyisihkan COD (Han dkk., 2010)
Berdasarkan penelitian tersebut, maka dapat diasumsikan bahwa media arang aktif batok kelapa dengan OLR mampu menyisihkan COD pada reaktor anaerobik kontinyu.
1.4 Hipotesis
1.4.1 Hipotesis Kerja
Hipotesis kerja dalam penelitian ini, yaitu :
1. Semakin besar nilai OLR, konsentrasi penyisihan bahan organik semakin tinggi.
1.4.2 Hipotesis Statistika
Hipotesis statistika dalam penelitian ini, yaitu :
H0a = tidak ada perbedaan konsentrasi penyisihan TCOD menggunakan reaktor anaerobik kontinyu bermedia batok kelapa berdasarkan nilai OLR
H1a = ada perbedaan konsentrasi penyisihan TCOD menggunakan reaktor anaerobik kontinyu bermedia batok kelapa berdasarkan nilai OLR
H0b = tidak ada perbedaan konsentrasi penyisihan SCOD menggunakan reaktor anaerobik kontinyu bermedia batok kelapa berdasarkan nilai OLR
H1b = ada perbedaan konsentrasi penyisihan SCOD menggunakan reaktor anaerobik kontinyu bermedia batok kelapa berdasarkan nilai OLR
1.5 Tujuan
Tujuan dalam penelitian ini, yaitu :
1. Mengetahui konsentrasi penyisihan bahan organik menggunakan reaktor anaerobik kontinyu bermedia arang aktif batok kelapa pada tiap nilai OLR dengan parameter TCOD, dan SCOD.
2. Mengetahui perbedaan konsentrasi penyisihan bahan organik menggunakan reaktor anaerobik kontinyu bermedia arang aktif batok kelapa bila nilai OLR berbeda.
1.6 Manfaat
Manfaat dalam penelitian ini, yaitu :
BAB II
TINJAUAN PUSTAKA
2.1 Air Limbah
Air limbah didefinisikan sebagai kombinasi cairan yang berasal dari
tempat tinggal, institusi, bangunan industry, dan komersial yang terbawa oleh air
tanah, air permukaan, dan air hujan (Metcalf & Eddy, 2003). Kontaminan yang
terdapat dalam air limbah meliputi total padatan tersuspensi, komponen organik
terlarut, padatan anorganik, nutrien, logam dan mikroorganisme patogen
(Templeton & Butler, 2011). Menurut Peraturan Pemerintah nomor 82 tahun 2001
tentang kualitas air dan pengendalian pencemaran air, air limbah adalah sisa dari
usaha dan atau kegiatan yang berwujud cair. Komposisi air limbah yaitu 99,9% air
dan 0,1% padatan. Padatan dalam air limbah terdiri dari 70% organik, dan 30%
anorganik (Templeton & Butler, 2011).
2.1.1 Karakteristik Air Limbah
Karakteristik air limbah memberikan gambaran tentang materi yang
menyusun suatu air limbah. Karakteristik air limbah dapat dibedakan dalam tiga
jenis (Risdianto, 2007), yaitu:
1. Karakteristik fisik
Karakteristik fisik air limbah yang digunakan untuk menentukan kualitas
air meliputi suhu, kekeruhan, warna, bau, konduktivitas, dan padatan (Risdianto,
2007). Temperatur (suhu) menunjukkan derajat atau tingkat panas air limbah yang
baru dan lama secara fisik dapat dilihat berdasarkan tingkat kebauan serta warna
limbah tersebut. Limbah yang baru biasanya berwarna abu-abu kecoklatan,
sedangkan air limbah yang sudah membusuk akan berwarna kehitaman (Fitria,
2011). Padatan yang terdapat di dalam air limbah dapat diklasifikasikan menjadi
floating, seattleable, dan suspended (Siregar, 2005).
2. Karakteristik kimia
Karakteristik kimia air limbah meliputi senyawa organik dan senyawa
anorganik. Bahan organik dalam limbah mengandung sekitar 40%-60% protein,
25% - 50% karbohidrat, dan 10% lainnya berupa lemak. Bahan anorganik yang
berperan dalam pengontrolan air limbah antara pH, klor, alkalinitas, sulfur, dan
logam berat (Risdianto, 2007). Bahan organik dan anorganik dalam jumlah
berlebihan akan bersifat toksik dan menghalangi proses biologis. Gas-gas yang
terdapat dalam air limbah biasanya terdiri atas oksigen, nitrogen, karbondioksida,
hidrogen sulfida, amonia, dan metan (Siregar, 2005).
3. Karakteristik biologis
Karakteristik biologi pada air limbah untuk mengetahui potensi
mikoorganisme pathogen pada air limbah sebelum dibuang ke badan air..
Kebanyakan berupa sel tunggal yang bebas ataupun berkelompok dan mampu
melakukan proses kehidupan (tumbuh, metabolisme, dan reproduksi). Keberadaan
bakteri dalam pengolahan air limbah merupakan kunci efisiensi proses biologis
(Siregar, 2005). Mikroorganisme dalam air limbah dan air permukaan
2.1.2 Bahan Organik dalam Air Limbah
Penyusun utama bahan organik biasanya polisakarida (karbohidrat),
polipeptida (protein), lemak (fats), dan asam nukleat (nucleid acid). Salah satu contoh komposisi dan persentase komponen penyusun limbah orgaik dapat dilihat
pada Tabel 2.1.
Tabel 2.1 Komposisi Limbah Organik
No. Jenis Bahan Organik Persentase (%)
1. Lemak 30
2.1.3 Air Limbah Sintetik
Air limbah sintetik yang digunakan dalam penelitian ini memiliki karakter
dan komposisi tertentu. Karakter dan komposisi air limbah sintetik dapat dilihat
pada Tabel 2.2, sedangkan komposisi susu bubuk yang digunakan dapat dilihat
pada Tabel 2.3, dan komposisi nutrisi yang digunakan dapat dilihat pada Tabel
2.4.
Tabel 2.2 Karakter Air Limbah Sintetik
Tabel 2.3 Karakter Susu Bubuk
No. Parameter Nilai Tipikal (mg)
1. Protein 20,5
2. Karbohidrat 52,7
3. Gula 23
4. Lemak 19
Sumber: Dawood dkk. (2011)
Tabel 2.4 Komposisi Nutrisi
No. Kandungan Konsentrasi (g/L)
1. NH4Cl 2,8
2.2 Pengolahan Air Limbah Secara Anaerobik
Proses pengolahan air limbah secara anaerob secara umum digunakan
untuk mengolah limbah padat, limbah pertanian, kotoran hewan, pengolahan
lumpur, dan limbah penduduk. Pada prinsipnya, semua bahan organik dapat
didegradasi pada proses anaerobik dan akan lebih efisien dan ekonomis apabila
limbahnya bersifat biodegradable (mudah terurai). Pengolahan secara anerobik
lebih banyak sesuai untuk negara yang memiliki iklim tropis hingga sub tropis
(Chernicharo, 2007).
Pengolahan air limbah anaerob adalah sebuah metode peruraian bahan
organik atau anorganik tanpa kehadiran oksigen. Produk akhir dari degradasi
anaerob adalah gas, paling banyak metana (CH4), dan karbondioksida (CO2).
Bakteri anaerob tidak memerlukan oksigen bebas dan dapat bekerja dengan baik
anaerob juga akan bekerja dengan baik pada keadaan yang gelap dan tertutup
(Pohan, 2008).
Beberapa keuntungan yang diperoleh dengan menggunakan proses
anaerob, misalnya seperti waktu detensi yang dibutuhkan dalam pengolahan
sangat sedikit, teknologi yang sederhana, murah, dan mempunyai keuntungan
dalam pengoperasian dan perawatan. (Chernicharo, 2007).
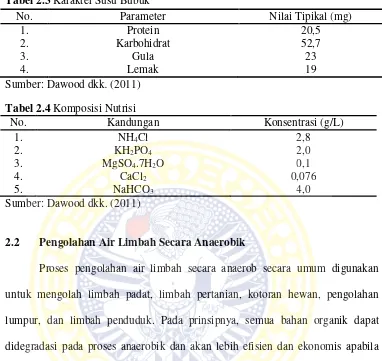
Proses anaerobik secara umum terbagi menjadi 3 tahap yaitu proses
hidrolisis, proses pembentukan asam (Acidogenesis/Acetogenesis), serta proses
pembentukan gas metan (Methanogenesis) (Gerardi, 2003). Gambar 2.1
merupakan skema proses anaerobik. Setiap tahapan dari proses anaerobik
dijelaskan sebagai berikut:
1. Tahap Hidrolisis
Hidrolisis merupakan proses pemecahan senyawa menggunakan air oleh
bakteri hidrolitik atau fakultatif anaerob. Zat-zat organik seperti polisakarida
lemak, dan protein akan dihidrolisa menjadi monosakarida, asam lemak, dan asam
amino. Reaksi hidrolisis merupakan proses dimana pelarutan senyawa organik
yang mulanya tidak larut dan proses penguraian senyawa tersebut menjadi
senyawa dengan berat molekul yang cukup kecil untuk dapat melewati membran
sel. Reaksi ini dikatalis oleh enzim yang dikeluarkan oleh bakteri anaerob
(Gerardi, 2003). Enzim yang dikeluarkan adalah eksoenzim oleh bakteri
2. Tahap Pembentukan Asam
Tahap pembentukan asam, yang meliputi tahap acidogenesis dan
acetogenesis. Tahap acidogenesis, yaitu bahan organik yang telah terhidrolisis secara enzimatik pada tahap hidrolisis akan dikonversi menjadi asam volatil.
Selain pembentukan asam volatil yang dapat dimanfaatkan oleh mikroba sebagai
sumber energi, pada tahap ini juga dihasilkan karbon dioksida (CO2). Salah satu
jalur penting dalam pembentukan asam volatil ini adalah pembentukan H2,
Akumulasi bahan organik yang terurai menjadi asam volatil dapat mengakibatkan
penurunan pH (Padmono, 2007). Tahapan selanjutnya yaitu acetogenesis dimana
asam lemak volatil yang telah terbentuk dikonversi oleh bakteri pembentuk asetat
menjadi asam asetat. Pada tahap ini asam lemak volatil dan alkohol dikonversikan
menjadi asam asetat (Padmono, 2007).
3. Tahap Metanogenik
Tahap ini merupakan tahap yang penting dalam proses dekomposisi bahan
organik secara anaerobik. Hal ini dikarenakan waktu duplikasi bakteri pembentuk
metan sangat lambat yaitu mencapai 3 hari, dibandingkan dengan bakteri
pembentuk asam yang hanya membutuhkan 3 jam. Bakteri pembentuk metan
menghasilkan komponen akhir yang sangat sederhana berupa gas metan (CH4)
dan gas karbon dioksida (CO2) dari hasil reduksi asam asetat yang telah terbentuk
Gambar 2.1 Proses Anaerobik (Sumber : Chenicharo, 2007)
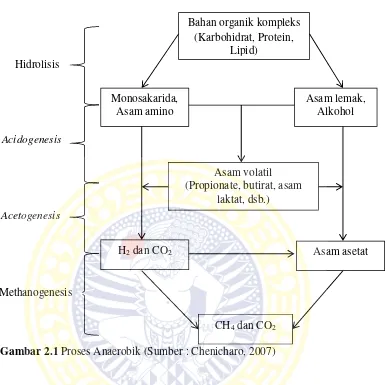
Pengolahan air limbah anaerobik ada dua macam yaitu anaerobic fluidized
bed reactor (reaktor anaerobik dengan media yang bergerak) dan anaerobic fixed bed reactor (reaktor anaerobik dengan media lekat diam). Anaerobic fixed bed reactor merupakan sebuah reaktor biologis tanpa suplai oksigen (anaerobik) yang
menggunakan sistem pertumbuhan mikroba melekat (attached), dimana mikroba
tumbuh dan berkembang dengan menempel pada suatu media (Padmono, 2003).
Media yang digunakan dapat berupa bahan-bahan yang tidak dapat terdegradasi
(inert), seperti plastik, keramik, tanah liat, batu apung, atau bahan alam lainnya.
downflow (aliran ke bawah) atau tanpa resirkulasi efluen. Reaktor dengan sistem upflow, substrat umpan masuk melalui dasar reaktor yang kemudian terdistribusi
diantara media dan keluar melalui bagian atas. Reaktor dengan sistem downflow,
substrat umpan masuk melalui bagian atas reaktor yang kemudian terdistribusi di
antara material penyangga tetap dan keluar melalui bagian bawah (Indriyati,
2005). Struktur reaktor upflow dan downflow dapat dilihat pada Gambar 2.2.
Proses yang terjadi pada reaktor anaerobik tipe fixed bed adalah air limbah
yang akan diolah dialirkan ke dalam reaktor melewati media. Pada reaktor ini
dicapai waktu tinggal yang pendek dan beban organik yang tinggi, akibat
pertumbuhan biofilm pada permukaan media (Indriyati, 2005). Kelebihan reaktor
fixed bed, yaitu media dapat diganti setelah penyerapan maksimum, struktur reaktor yang digunakan tidak rumit, dan biaya operasi yang relatif ekonomis
(Wang dkk., 2011). Karakter reaktor fixed bed yaitu dapat mengolah air limbah
dengan bahan organik tinggi, mempunyai waktu detensi yang singkat, serta
produksi lumpur yang sedikit (Kocadagistan dkk., 2005).
Gambar 2.2 Struktur reaktor fixed bed, A: aliran upflow; B aliran downflow (Sumber : Indriyati, 2005)
2.3 Sistem Pengolahan Air Limbah pada Reaktor Anaerobik
2.3.1 Pengolahan Air Limbah dengan Sistem Batch
Pengolahan anaerobik dengan sistem batch adalah salah satu pengolahan
dengan biaya yang murah, pengoperasian yang mudah, perangkaian reaktor yang
mudah, dan sering diterapkan di daerah pedesaan karena kesederhanaan operasi.
Pengolahan dengan sistem batch banyak dikembangkan pada negara yang sedang
berkembang (Karagianndis, 2012). Pada sistem batch, reaktor diisi dengan bahan
baku (air limbah) selama sekali dengan penambahan inokulum atau tanpa
penambahan inokulum (Nayono, 2009). Reaktor tersebut harus berada dalam
keadaan tertutup dan diberikan waktu retensi dengan periode tertentu, bila telah
melewati waktu retensi maka reaktor dibuka. Air limbah dalam reaktor dibuang
dan diisi kembali dengan air limbah yang baru. Sistem batch merupakan sistem
tanpa aliran, sehingga pengisian hanya dilakukan sekali sebelum operasi dengan
periode tertentu (Nayono, 2009).
2.3.2 Pengolahan Air Limbah dengan Sistem Kontinyu
Pengolahan air limbah dengan sistem kontinyu dikembangkan pada tahun
1986 dengan syarat pengoperasian adalah tersedianya nutria (air limbah) dalam
waktu harian atau berkelanjutan (Agathos & Reineke, 2003). Sistem kontinyu
merupakan cara yang paling fleksibel untuk mengamati jumlah operasi yang
diperlukan dalam proses kontrol untuk pengolahan air limbah. Sistem aliran
kontinyu terbagi menjadi 2 jenis, yaitu aliran bersegmentasi dan tanpa segmen.
Aliran bersegmentasi bercirikan dengan gelembung udara yang diberikan pada
limbah disuntikkan secara berkelanjutan tanpa bersegmentasi oleh gelembung
udara (Korenaga, dkk., 1994).
2.4 Faktor-faktor yang Mempengaruhi Stabilitas Reaktor
Pada proses pengolahan anaerob banyak faktor yang mempengaruhi
stabilitas reaktor, yaitu:
2.4.1 Organic Loading Rate (OLR)
OLR adalah besaran yang menyatakan jumlah material organik dalam air
buangan atau limbah yang diuraikan oleh mikroorganisme dalam reaktor per unit
volume per hari (Indriyati, 2005). Besarnya nilai OLR atau laju beban organik
yang terdapat didalam reaktor didasarkan pada nilai waktu tinggal hidraulik atau
(Padmono, 2003) dan kondisi influent beban organik yang masuk (Chernicharo,
2007). Laju organik yang berbeda memberikan dampak yang berbeda terhadap
laju reaksi (Indriyati, 2005). Nilai OLR dapat dihitung dengan persamaan 2.1
(Cernicharo, 2007).
= (2.1)
Keterangan :
Lv = organic loading rate (kg/m3.hari atau g/L.hari)
Q = debit influen rata-rata (m3/hari atau L/hari)
So = influen COD (kg/m3 atau g/L)
2.4.2 Derajat keasaman (pH)
Derajat keasaman (pH) menunjukan sifat asam atau basa pada suatu
bahan. Derajat keasaman merupakan suatu ekspresi konsentrasi ion hidrogen.
Konsentrasi ion hidrogen merupakan parameter penting pada air dan air limbah.
Rentang pH yang cocok dengan kehidupan biologi adalah 6-9 (Metcalf & Eddy,
2003). Nilai pH berpengaruh terhadap proses anaerob. Harga pH yang rendah
diakibatkan oleh proses dari tahap kedua, yakni terbentuknya asam lemak volatil.
Pada kondisi yang sangat asam, bakteri acetogenic (bakteri pembentuk asam
asetat) mungkin masih bisa bertahan hidup, tetapi bakteri metanogenik (bakteri
pembentuk gas metan) sama sekali tidak bisa bertahan hidup (Padmono, 2007).
2.4.3 Alkalinitas
Alkalinitas pada proses anaerob diperlukan untuk mempertahankan pH
agar tetap di dalam rentang yang optimum sehingga bakteri metan dapat tumbuh
dengan baik dan dapat menghasilkan biogas dengan perbandingan 55-75% gas
metan dan 25-45% gar karbondioksida. Kondisi pH netral dan nilai alkalinitas
pada rentang 500-900 mg/L CaCO3 dibutuhkan untuk menghasilkan perbandingan
gas tersebut (Indriyati, 2005).
2.4.4 Suhu
Menurut Metcalf & Eddy (2003), suhu merupakan faktor lingkungan
terpenting yang mempengaruhi pertumbuhan mikroba karena enzim yang
menjalankan metabolisme sangat peka terhadap suhu. Kondisi optimum yang
mendukung pertumbuhan mikroba adalah sekitar 27-30°C. Suhu optimum untuk
2.4.5 Senyawa racun atau penghambat
Pada proses anaerob, senyawa penghambat dibedakan menjadi dua jenis
yaitu penghambat fisik dan penghambat kimia. Penghambat fisik adalah suhu,
sedangkan penghambat kimia adalah logam berat dan asam lemak volatil (Volatile
Fatty Acid / VFA). Pada proses anaerob, konsentrasi asam volatil dalam rentang 200 – 400 mg/L sebagai asam asetat menunjukan kondisi reaktor yang baik
(Indriyati, 2005). Ketika substrat terdegradasi dan memasuki tahap asidogenesis,
total asam volatil tinggi yaitu lebih dari 10.000 mg/L akan menjadi inhibitor
dalam degradasi anaerob (Wilkie, 2008).
2.5 Seeding dan Aklimatisasi
Seeding merupakan proses pembenihan mikroba yang nantinya akan
mengolah air limbah (Indriyati, 2003). Tujuan proses seeding agar didapatkan
suatu populasi mikroba yang mencukupi dan stabil secara kuantitas. Selain itu
seeding bertujuan untuk menjamin sel-sel mikroba mampu memanfaatkan senyawa-senyawa pencemar pada limbah sebagai nutrisi, sehingga perombakan
dapat berlangsung dengan cepat (Titiresmi, 2007).
Aklimatisasi merupakan proses adaptasi mikroba dengan air limbah yang
akan diolah (Indriyati, 2003). Aklimatisasi bertujuan untuk mendapatkan kultur
biomassa yang telah teradaptasi terhadap air limbah yang akan diteliti. Pada
proses ini dilakukan dengan sistem batch karena mikroba dapat tumbuh dan
2.6 Penggunaan Media
Pengertian media adalah tempat atau sarana untuk melekatkan koloni
mikroba di dalam suatu reaktor atau memperbanyak jumlah bakteri dalam reaktor.
Media dapat berupa berbagai bahan, namun pemilihan media pendukung untuk
tumbuhnya bakteri sangat mempengaruhi kinerja dari reaktor yang akan
digunakan sehingga diperlukan pemilihan media yang tepat. Faktor-faktor yang
mempengaruhi efektivitas media pendukung adalah ukuran dan bentuk,
perbandingan luas permukaan dan volume, porositas dan kekasaran permukaan
media pendukung (Indriyati, 2003).
2.6.1 Tempurung Kelapa
Tanaman kelapa (Cocos nucifera L) merupakan tanaman serbaguna,
karena dari akar sampai ke daun kelapa bermanfaat. Buah kelapa terdiri dari
beberapa komponen, yaitu sabut kelapa, tempurung kelapa, daging buah kelapa,
dan air buah kelapa. Daging buah adalah komponen utama yang dapat diolah
menjadi berbagai produk bernilai ekonomi tinggi. Sedangkan air, tempurung, dan
sabut sebagai hasil samping dari buah kelapa yang juga dapat diolah menjadi
berbagai produk yang juga memiliki nilai ekonomis (Sari, 2011).
Tempurung atau batok kelapa merupakan salah satu bagian dari buah
kelapa dengan presentase 17% dari buah kelapa yang berumur 12 bulan.
Tempurung kelapa biasa disebut juga batok seperti Gambar 2.3. Tempurung
kelapa merupakan lapisan keras dari buah kelapa yang terdiri dari lignin (29,4%),
selulosa (26,60%), pentosan (27,70%), abu (0,6%), nitrogen 0,11%, air (8%), dan
Struktur keras disebabkan oleh silikat (SiO2) yang cukup tinggi kadarnya pada
tempurung kelapa. Berat tempurung kelapa sekitar 15-19% dari berat keseluruhan
buah kelapa (Sari, 2011).
Tempurung kelapa mempunyai jumlah yang berlimpah, bahkan banyak
yang menjadi limbah. Tempurung kelapa yang mempunyai struktur keras di
lingkungan sulit terurai dan waktu yang dibutuhkan sangat lama. Tempurung
kelapa banyak dijadikan arang seperti Gambar 2.3. Arang ini banyak sekali
digunakan sebagai adsorben. Selain itu, tempurung kelapa memiliki kemungkinan
sebagai media filter karena strukturnya stabil, mempunyai daya adsorbsi air yang
tinggi, dan mempunyai pori yang banyak (Okafor dkk., 2012).
Gambar 2.3 Tempurung kelapa dan arang Tempurung kelapa (Asmara, 2014).
2.6.2 Arang Aktif Tempurung Kelapa
Produksi arang aktif di Indonesia dapat mencapai 20.000 ton dengan
konsumsi terbesar di dalam negeri. Tempurung kelapa dapat dimanfaatkan
sebagai arang aktif. Arang aktif adalah karbon tak berbentuk yang diolah secara
khusus untuk menghasilkan luas permukaan yang sangat besar, berkisar antara
menyerap gas-gas dan uap-uap dari gas dan dapat mengurangi zat-zat dari liquida.
Arang yang dimaksud disini adalah arang tempurung kelapa yang sudah
diaktivasi, baik secara fisik maupun kimia. Aktivasi adalah perubahan secara fisik
dimana luas permukaan dari karbon meningkat dengan tajam dikarenakan
terjadinya penghilangan senyawa tar dan senyawa sisa-sisa pengarangan. Arang
aktif seperti Gambar 2.4 dapat dibuat dengan melalui proses karbonisasi pada
suhu 550oC selama kurang lebih tiga jam (Kurniati, 2008).
Gambar 2.4 Arang aktif Tempurung kelapa (Asmara, 2014).
Dua jenis perbedaan dalam pembuatan dan penggunaan karbon aktif, yaitu
(Kurniati, 2008):
1. Fase liquid
Karbon aktif umumnya ringan dan halus berbentuk seperti serbuk.
2. Fase Penyerap uap
Karbon aktif keras, berbentuk butiran atau pil.
Berdasarkan ukuran pori-porinya karbon aktif dikelompokkan menjadi dua
jenis, yaitu (Kurniati, 2008):
1. Mikropori, dengan ukuran pori-pori 10-1000 Å.
2.6.3 Aktivasi Arang Aktif
Proses aktivasi pada material arang aktif ada tiga proses, antara lain proses
fisika, kimia dan kombinasi fisika-kima. Proses pengaktifan secara fisika
dilakukan dengan pembakaran material dalam tungku dengan suhu 850o C. Proses
pengaktifan secara kimia dilakukan dengan menambahkan senyawa kimia tertentu
pada karbon. Senyawa kimia yang dapat digunakan sebagai bahan pengaktif
antara lain, H3PO4, garam mineral lainnya (Meisrilestari dkk., 2013) dan KOH (
Shoumkova & Stoyanova, 2013). Faktor-faktor yang mempengaruhi proses
aktivasi, yaitu waktu perendaman, konsentrasi aktivator, dan ukuran bahan
(Kurniati, 2008). Cara aktivasi secara kimia dengan cara, yaitu material ditimbang
sebanyak 100 g. KOH 10% sebanyak 500 mL direbus dengan suhu 1000 C,
setelah cukup panas, 100 g material dimasukkan dan diaduk selama kurang lebih
4 jam menggunakan stirrer. Setelah itu, material dituang diloyang dan dioven
selama 3 jam pada suhu 2000 C. Setelah dioven, material dikeluarkan dari oven,
dan dinetralkan dengan menggunakan air panas secukupnya. Material segera
disimpan dan diusahakan tidak terkena dengan angin atau udara luar (Boopathy
dkk., 2013).
2.7 Sifat Adsorpsi Arang Aktif
Adsorpsi atau penjerapan secara umum adalah proses mengumpulkan
benda-benda terlarut yang terdapat dalam larutan antara dua permukaan. Pada
karbon aktif yang biasanya terbuat dari Tempurung kelapa. Karbon aktif ini
digunakan baik dari segi aplikasi maupun volume penggunaannya (Sugiharto,
2008).
Adsorpsi dapat dikelompokkan berdasarkan mekanisme terjadinya
adsorpsi, yaitu secara fisik, kimiawi, dan pertukaran ion (Rahayu, 2008). Adsorpsi
fisik disebabkan oleh gaya tarik yang lemah antar molekul. Molekul yang
teradsorpsi bebas bergerak di sekitar adsorben dan tidak hanya menetap pada satu
titik. Apabila gaya tarik molekuler antara zat terlarut dengan adsorben lebih besar
daripada gaya tarik antara zat terlarut dengan muka zat terlarut sehingga zat
terlarut teradsorpsi hanya di permukaan adsorben. Adsorpsi kimiawi merupakan
interaksi secara kimia antara padatan dan zat teradsorpsi, dan biasa disebut dengan
adsorpsi yang diaktifkan. Adsorpsi yang banyak digunakan merupakan adsorpsi
fisik dan untuk mempercepat, digunakan adsorpsi secara kimia. Adsorpsi secara
kimia hanya terjadi pada lapisan tunggal dan zat yang teradsopsi secara kimia
pada permukaan bahan padat sulit untuk disisihkan dengan gaya yang lebih kuat (
Singh & Kaushal, 2013).
Gambar 2.5 Adsorbat yang terjerap pada adsorben(Putro & Ardhiany, 2010)
Adsorben
Pori Adsorpsi
Adsorpsi pertukaran adalah adsorpsi yang diperankan oleh tarikan listrik
antara adsorbat dan permukaan adsorben. Ion dari suatu substansi banyak
berperan dalam adsorpsi ini. Ion akan terkonsentrasi di permukaan adsorben
sebagai hasil tarikan elektrostatistik ke tempat yang bermuatan berlawanan di
permukaan. Pada umumnya ion bermuatan lebih besar akan tertarik lebih kuat ke
tempat yang bermuatan lebih kecil, seperti ion monovalen. Pertukaran ion
termasuk dalam kelompok adsorpsi pertukaran ini.
Sifat karbon aktif yang paling penting adalah daya serap. Dalam hal ini,
ada beberapa faktor yang mempengaruhi daya serap adsorpsi, yaitu (Nugroho,
2008):
a. Sifat Adsorben
Karbon aktif yang merupakan adsorben adalah suatu padatan berpori, yang
sebagian besar terdiri dari unsur karbon bebas dan masing-masing berikatan
secara kovalen. Dengan demikian, permukaan arang aktif bersifat non polar.
Tingkat adsorpsi umumnya sebanding dengan luas permukaan spesifik
(Suzuki,1990). Semakin kecil pori-pori arang aktif, mengakibatkan luas
permukaan semakin besar, dengan demikian kecepatan adsorpsi bertambah. Untuk
meningkatkan kecepatan adsorpsi, dianjurkan agar menggunakan karbon aktif
yang telah dihaluskan.
b. Sifat Serapan
Banyak senyawa yang dapat diadsorpsi oleh karbon aktif, tetapi
Adsorpsi akan bertambah besar sesuai dengan bertambahnya ukuran molekul
serapan dari struktur yang sama, seperti dalam deret homolog.
c. Temperatur
Dalam pemakaian karbon aktif dianjurkan untuk mengetahui temperatur
saat berlangsungnya proses. Tingkat adsorpsi umumnya meningkat dengan
menurunnya suhu, tetapi perubahan kecil dalam suhu cenderung tidak mengubah
proses adsorpsi dalam pengolahan limbah secara signifikan.
d. pH
Untuk asam-asam organik adsorpsi akan meningkat, apabila pH
diturunkan, yaitu dengan penambahan asam-asam mineral. Hal ini disebabkan
karena kemampuan asam mineral dapat mengurangi ionisasi asam organik
adsorben.
e. Waktu Kontak
Jika karbon aktif ditambahkan dalam suatu cairan, dibutuhkan waktu
untuk mencapai keseimbangan. Waktu yang dibutuhkan berbanding terbalik
dengan jumlah yang digunakan. Waktu yang dibutuhkan ditentukan oleh sifat
2.8 Parameter Pengolahan Anaerobik
2.8.1 Total Chemical Oxygen Demand (TCOD)
Chemical Oxygen Demand adalah banyaknya oksigen yang dibutuhkan untuk oksidasi sempurna bahan organik dalam air (Wiesmann dkk., 2007). COD
yang terkandung dalam air limbah disebut total Chemical Oxygen Demand
(TCOD). Total Chemical Oxygen Demand (TCOD) terdiri atas particulate
Chemical Oxygen Demand (PCOD) dan soluble Chemical Oxygen Demand
(SCOD) (Metcalf & Eddy, 2003). Analisis TCOD digunakan untuk menentukan
banyaknya oksigen pada bahan organik yang dapat dioksidasi kimia (Pottasium
dichromate) dalam kondisi asam (Davis, 2010). Penggunaan potassium dikromat
sebagai oksidator, diperkirakan sekitar 95%-100% bahan organik dapat
dioksidasi. Meskipun demikian, terdapat juga bahan organik yang tidak dapat
dioksidasi dengan metode ini, misalnya piridin dan bahan organik yang bersifat
sangat mudah menguap. Glukosa dan lignin dapat dioksidasi secara sempurna.
Asam amino dioksidasi menjadi amonia nitrogen. Nitrogen organik dioksidasi
menjadi nitrit. Reaksi yang terlibat dalam proses penentuan COD ditunjukan
dalam persaamaan 2.2 (Effendi, 2003).
CnHaOb + c Cr2O72- + 8c H+ n CO2 + (a+8c)/2 H2O + 2c Cr3+ (2.2)
Kalium dikromat dapat mengoksidasi bahan organik secara sempurna
apabila berlangsung dalam suasana asam dan suhu tinggi. Oleh karena itu,
menggunakan kondensor refluks. Pada metode refluks, air sampel dapat didihkan
tanpa kehilangan bahan-bahan mudah menguap (Effendi, 2003).
2.8.2 Soluble Chemical Oxygen Demand (SCOD)
Total Chemical Oxygen Demand (TCOD) terdiri atas particulate Chemical
Oxygen Demand (PCOD) dan soluble Chemical Oxygen Demand (SCOD). Soluble
Chemical Oxygen Demand (SCOD) adalah kandungan COD yang terlarut pada air
limbah (Metcalf & Eddy, 2003) dan bahan yang mudah didegradasi secara
biologis (Padmono, 2003). Presentase SCOD pada TCOD adalah 40% dan sisanya
adalah PCOD sebesar 60%. PCOD adalah kandungan COD yang terdapat pada
koloid dan padatan yang tersuspensi pada air limbah. Persentase PCOD yang besar
dapat mudah dihilangkan dengan cara filtrasi atau penyaringan. Persentase SCOD
sebesar 40% terdiri dari 95% mudah terdegradasi dan 5% sukar terdegradasi
(Henze & Comeau, 2008).
Analisis SCOD sama seperti dengan TCOD dengan menggunaan potassium
dikromat sebagai oksidator, diperkirakan sekitar 95%-100% bahan organik dapat
dioksidasi. Air limbah yang akan di uji COD dilakukan penyaringan terlebih
dahulu (Effendi, 2003).
2.8.3 Volatile Fatty Acid (VFA)
Volatile Fatty Acid atau Asam Lemak Volatil (VFA) merupakan hasil biokonversi senyawa organik polimer menjadi monomer pada proses
asidogenesis. VFA adalah senyawa penting dalam proses metabolisme
pembentukan gas methan dan menyebabkan mikroba jenuh dalam konsentrasi
dengan pH (Zhang dkk., 2015). VFA meningkat pada saat pH turun menyebabkan
produksi biogas menurun (Komemoto dkk., 2009). Oleh karena itu, pemantauan
konsentrasi VFA penting untuk mengetahui kinerja proses degradasi anaerobik
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
3.1.1 Tempat Penelitian
Penelitian ini dilakukan di tiga tempat, yaitu :
1. Laboratorium Basah, Fakultas Sains dan Teknologi, Universitas Airlangga
sebagai tempat persiapan dan pengoperasian reaktor anaerobik.
2. Laboratorium Ekologi dan Lingkungan, Fakultas Sains dan Teknologi,
Universitas Airlangga sebagai tempat analisis air limbah.
3. Rumah Potong Hewan (RPH) di Pegirian Surabaya sebagai tempat
pengambilan sludge untuk sumber mikroorganisme.
3.1.2 Waktu Penelitian
Penelitian ini berlangsung selama tujuh bulan dari Desember 2015 hingga
Juni 2016. Penelitian ini meliputi kegiatan persiapan alat dan bahan, penelitian
pendahuluan, penelitian utama, analisis data dan pembahasan serta penyusunan
laporan.
3.2 Variabel Penelitian
Penelitian ini terdapat tiga variabel yaitu,
1. Variabel bebas : variasi Organic Loading Rate (OLR)
2. Variabel terikat : persentase penyisihan bahan organik
Berdasarkan variabel-variabel tersebut diketahui parameter yang akan di
analisis. Parameter utama pada penelitian ini adalah TCOD dan SCOD, sedangkan
parameter pendukung adalah VFA, suhu, pH dan biogas.
3.3 Bahan dan Alat Penelitian
3.3.1 Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah arang aktif tempurung
kelapa 100 g mesh 20, akuades, bahan untuk aktivasi (larutan KOH 10%), bahan
untuk air limbah sintetis (20 g glukosa; 14,4 g KNO3; 30 g Na2S2O3; 100 g
NaHCO3; 2 g NH4Cl; 2 g MgSO4; dan 2 g bubuk susu instan merek Danstart
(Purnobasuki dkk., 2014)), sludge dari rumah pemotongan hewan (RPH) 50 mL,
bahan untuk analisis TCOD dan SCOD (K2Cr2O7 12,259 g; Ag2SO4 10 g; HgSO4
50 g; H2SO4 36 N 100 mL; larutan Fe(NH4)2(SO4)2.6H2O 1 L; indikator feroin
100 mL (SNI-06-6989-15-2004); dan kertas saring Whatmann
42(SNI-06-6989-26-2005)), dan bahan untuk analisis VFA (H2SO4 36 N 1 L; NaOH 0,1 N 2 L; dan
indikator phenolphtalein (PP) 100 mL (Rajakumar & Meenambal, 2008)),
3.3.2 Alat Penelitian
Alat penelitian yang digunakan pada penelitian ini adalah laboratory bottle
ukuran 1 L 2 buah, pompa peristaltik BT100-2J, botol sampel 50 mL bahan kaca 6
buah, pH meter, termometer air raksa 1 buah, test tube COD 6 buah, COD reaktor
dengan range suhu 100 oC dan range waktu 60 – 240 menit 1 buah, labu destilasi ,
gelas ukur Pyrex A 100 mL ± 1,0 mL, spektrofotometer, timbangan analitik, botol
reagen bahan kaca ukuran 500 mL, pengaduk kaca 1 buah, , cawan kaca 5 buah,
penjepit besi 1 buah, krus porselin 25 mL 4 buah, erlenmeyer vakum 1 buah,
corong penghisap 50 mm 2 buah, oven, desikator, pipet ukur Pyrex A 10 mL ±
0,05 mL, dan manometer.
3.4 Cara Analisis
Cara analisis pada penelitian ini disusun untuk membuktikan kebenaran
hipotesis. Cara analisis pada penelitian ini terdapat dua bagian, yaitu cara analisis
parameter yang dipantau dan cara analisis data.
3.4.1 Cara Kerja
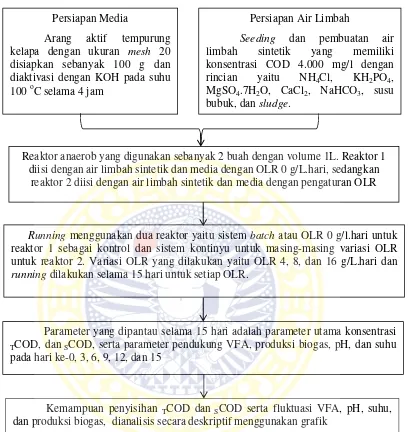
Penelitian ini terdiri dari beberapa tahapan. Tahapan tersebut dilakukan
Gambar 3.1 Bagan alir tahapan penelitian
Persiapan Media
Arang aktif tempurung
kelapa dengan ukuran mesh 20
limbah sintetik yang memiliki
konsentrasi COD 4.000 mg/l dengan
rincian yaitu NH4Cl, KH2PO4,
MgSO4.7H2O, CaCl2, NaHCO3, susu
bubuk, dan sludge.
Reaktor anaerob yang digunakan sebanyak 2 buah dengan volume 1L. Reaktor 1 diisi dengan air limbah sintetik dan media dengan OLR 0 g/L.hari, sedangkan
reaktor 2 diisi dengan air limbah sintetik dan media dengan pengaturan OLR
Running menggunakan dua reaktor yaitu sistem batch atau OLR 0 g/l.hari untuk reaktor 1 sebagai kontrol dan sistem kontinyu untuk masing-masing variasi OLR untuk reaktor 2. Variasi OLR yang dilakukan yaitu OLR 4, 8, dan 16 g/L.hari dan running dilakukan selama 15 hari untuk setiap OLR.
Parameter yang dipantau selama 15 hari adalah parameter utama konsentrasi
TCOD, dan SCOD, serta parameter pendukung VFA, produksi biogas, pH, dan suhu
pada hari ke-0, 3, 6, 9, 12, dan 15
Kemampuan penyisihan TCOD dan SCOD serta fluktuasi VFA, pH, suhu,
dan produksi biogas, dianalisis secara deskriptif menggunakan grafik
Efektivitas OLR yang digunakan untuk pengolahan air limbah dianalisis
1. Seeding
Seeding atau pembenihan merupakan tahapan awal sebelum penelitian. Tujuan dari proses ini adalah untuk mendapatkan suatu populasi mikroorganisme
yang mencukupi untuk memulai penelitian dan mampu mengoksidasi zat-zat
organik yang terkandung di dalam air limbah. Proses seeding pada penelitian ini
dilakukan dengan mengambil sludge rumah potong hewan (RPH) sebagai
inokulum. Inokulum berfungsi sebagai sumber mikroorganisme dalam melakukan
penyisihan TCOD dan SCOD dalam air limbah sintetis.
Analisis awal sludge untuk mengetahui kandungan VSS sebelum proses
seeding dilakukan untuk mengetahui biomassa mikoorganisme. Seeding dilakukan
pada reaktor anaerob 1 L dengan volume sludge yang akan dilakukan proses
seeding sebanyak 1 L. Selanjutnya dilakukan pengamatan nilai VSS setiap hari, hingga nilai VSS mencapai konsentrasi lebih besar dari 3.000 mg/L. Hal tersebut
dikarenakan proses seeding dianggap telah selesai jika konsentrasi VSS lebih
besar dari 3.000 mg/L (Titiresmi, 2007).
Parameter VSS yang dipantau pada tahap seeding dianalisis menggunakan
metode gravimetri (Alaerts & Santika, 1987). Adapun langkah untuk analisis VSS
adalah sebagai berikut:
a. Kertas saring dipanaskan pada suhu 1050C selama 1 jam, kemudian
didinginkan pada desikator selama 15 menit.
b. Kertas saring kemudian ditimbang dan dicatat sebagai berat awal (a gram)
c. Kertas saring kemudian dirangkaikan dengan alat analisis yang terdiri dari
d. Sampel sludge RPH sebanyak 50 mL dituang ke dalam corong penghisap yang telah berisi kertas saring secara bertahap.
e. Kertas saring yang telah mengandung filtrat dan cawan porselen kemudian
dipanaskan menggunakan oven pada suhu 1050C selama 1 jam.
f. Kertas saring beserta filtrat dan cawan porselen didinginkan pada desikator
selama 15 menit. Kertas saring beserta filtrat kemudian ditimbang sebagai
berat akhir (b gram). Cawan porselen kemudian ditimbang sebagai berat awal
cawan porselen (c gram).
g. Kertas saring beserta filtrat kemudian dimasukkan dalam cawan porselen dan
dipanaskan menggunakan furnace pada suhu 5500C selama 1 jam.
h. Cawan porselen yang berisi kertas saring kemudian dipanaskan pada suhu
1050C menggunakan oven selama 15 menit, kemudian didinginkan
menggunakan desikator selama 15 menit.
i. Cawan porselen yang berisi kertas saring kemudian di timbang sabagai berat
akhir (d gram). Besarnya nilai VSS dihitung menggunakan Persamaan 3.1.
VSS (mg/L) = TSS (mg/L) – FSS (mg/L) (3.1)
Keterangan:
TSS = besarnya nilai Total Suspended Solid (TSS) dari sampel yang
sama
FSS = besarnya nilai Fixed Suspended Solid (TSS) dari sampel yang
sama
dimana nilai TSS dihitung menggunakan Persamaan 3.2 dan FSS
menggunakan Persamaan 3.3.
Keterangan:
a : berat awal kertas saring setelah pemanasan 1050C (gram)
b : berat kertas saring beserta filtrat setelah pemanasan 1050C (gram)
FSS (mg/L) = = (3.3)
Keterangan:
c : berat awal cawan porselen sebelum pemanasan 5500C (gram)
d : berat akhir cawan porselen setelah pemanasan 5500C (gram)
2. Persiapan Media
Media yang digunakan sebagai adsorben adalah arang aktif tempurung
kelapa. Arang aktif tempurung kelapa diaktivasi menggunakan KOH 10%.
Pembuatan KOH 10% adalah perkalian persentase KOH dipasaran dengan KOH
yang dibutuhkan. Jumlah KOH yang dibutuhkan untuk membuat KOH 10%
adalah 0,085 g tiap 100 mL. Tahapan proses aktivasi secara berurutan sebagai
berikut (Boopathy, dkk., 2013):
Sebanyak 50 g arang aktif tempurung kelapa dicampur dengan 250 mL
larutan aktivator dan dipanaskan pada suhu 850C selama 4 jam. Setelah proses
pemanasan selesai, arang aktif dan larutan aktivator dipisahkan, kemudian arang
aktif tempurung kelapa dipanaskan menggunakan oven selama 3 jam pada suhu
2000C. Arang aktif tempurung kelapa hasil aktivasi ini memiliki pH basa. Setelah
proses pemanasan menggunakan oven, arang aktif tempurung kelapa dicuci
dengan air panas hingga pHnya netral atau mendekati angka 7. Setelah netral,
1050C. Arang aktif tempurung kelapa teraktivasi segera disimpan dan diusahakan
tidak kontak dengan udara luar.
3. Persiapan Air Limbah
Air limbah yang digunakan adalah air limbah sintetis yang memiliki
konsentrasi COD 4.000 mg/L. Untuk membuat air limbah sintetis per 1 L
dibutuhkan bahan dengan rincian sebagai berikut (Purnobasuki dkk., 2014) :
Komposisi air limbah adalah 14,4 g KNO3, 30 g Na2S2O3, 100 g NaHCO3,
2 g NH4Cl, 2 g MgSO4, 2 g bubuk susu instan dan 5 mL sludge RPH. Komposisi
bubuk susu instan yang digunakan dalam 100 g adalah 10,5 g protein, 26 g lemak,
58 g karbohidrat, 3,2 g asam linoleat, 390 mg asam linolenat, 50 mg DHA, dan 50
mg ARA. Tahapan proses pembuatan air limbah dimulai dengan melarutkan 14,4
g KNO3, 30 g Na2S2O3, 100 g NaHCO3, 2 g NH4Cl, dan 2 g MgSO4 dalam 100
mL akuades dengan labu ukur 100 mL sebagai nutrisi. Susu bubuk sebanyak 2 g
dilarutkan dalam 100 mL akuades dengan labu ukur 500 mL. Larutan 100 mL
nutrisi dimasukkan ke dalam labu ukur 500 mL berisi larutan susu bubuk
kemudian diaduk hingga tercampur merata. Nutrisi dan larutan susu tersebut
dicampurkan dengan 5 mL sludge RPH kemudian ditambahkan hingga volume
500 mL dan dicampur hingga merata.
4. Persiapan dan running reaktor
Pada penelitian ini menggunakan reaktor anaerobik yaitu laboratory bottle
ukuran 1 L dan tertutup. Penelitian ini menggunakan dua reaktor yaitu reaktor 1
yaitu bak ekualisasi inlet dan bak outlet. Bak ekualisasi inlet air limbah memiliki
kapasitas 16 L yang akan dialirkan kedalam reaktor 2 sesuai dengan OLR.
Reaktor 2 dilengkapi dengan katup dan pompa yang berfungsi untuk mengatur
aliran dan outlet untuk mengambil sampel Contoh bentuk reaktor 1 dapat dilihat
pada Gambar 3.2 dan reaktor 2 dapat dilihat pada Gambar 3.3.
Pengaturan OLR dilakukan dengan mengatur debit yang masuk pada
reaktor 2. OLR 4 g/L.hari, 8 g/L.hari, dan 16 g/L.hari menggunakan debit 1
L/hari, 2 L/hari, dan 4 L/hari. OLR diperoleh dengan persamaan 3.4.
Lv =
(3.4)Keterangan :
Lv = organic loading rate ( g/L.hari )
Q = debit influen rata-rata ( L/hari )
So = influen COD ( g/L)
V = total volume ( L )
Penentuan aliran atau debit didapat dari perbandingan volume dengan
HRT. Nilai debit tersebut diaplikasikan dalam pengoperasian reaktor dengan cara
menampung air limbah di gelas ukur dan dicatat waktu yang dibutuhkan untuk
memenuhi volume tersebut. Debit diperoleh dengan persamaan 3.5.
Q = (3.5)
Keterangan :
Waktu operasional untuk masing-masing OLR adalah 15 hari dan
replikasi sebanyak 3 kali. Pengambilan sampel dilakukan pada hari ke 0, 3, 6, 9,
12, dan 15.
Gambar 3.3 Desain reaktor 2 dengan variasi OLR
5. Analisis parameter yang dipantau selama penelitian
Parameter yang dipantau pada penelitian ini adalah TCOD, sCOD, VFA,
produksi biogas, pH, dan suhu
A. Analisis Total Chemical Oxygen Demand (TCOD) dan Soluble Chemical
Oxygen Demand (SCOD)
Pembuatan reagen analisis TCOD dan SCOD meliputi larutan baku kalium
dikromat 0,25 N, larutan asam sulfat-perak sulfat, larutan indicator ferroin, dan
larutan ferro ammonium sulfat (FAS) 0,1 N dengan cara berikut (Alaerts &
Santika, 1987) :
1. Larutan baku kalium dikromat 0,25 N
K2Cr2O7 sebanyak 12,259 g (yang telah dikeringkan pada 150oC selama 2
jam) dilarutkan dengan akuades dan tepatkan sampai 1.000 mL.
2. Larutan Asam sulfat-perak sulfat
Ag2SO4 sebanyak 10 g dilarutkan dalam 1.000 mL asam sulfat pekat.
3. Larutan indikator ferroin
1,10 phenanthrolin monohidrat sebanyak 1,485 g dan FeSO4.7H2O
sebanyak 0,695 g dicampurkan dalam akuades dan diencerkan sampai 100 mL.
4. Larutan fero ammonium sulfat (FAS) 0,1 N
FeSO4.7H2O, Fe(NH4)2(SO4)2.6H2O sebanyak 39 g dilarutkan di dalam 1
L labu takar berisi 500 mL akuades. Ditambahkan 20 mL H2SO4 pekat. Larutan
tersebut didinginkan dengan merendam labu takar di dalam air yang mengalir.
Akuades ditambahkan sampai mencapai 1 L. Larutan FAS harus distandarkan
dengan K2Cr2O7. Larutan FAS ini tidak stabil karena sebagai zat pereduksi akan
dioksidasi sedikit demi sedikit oleh oksigen terlarut di udara. Standardisasi perlu
dilakukan setiap hari sebelum dan sesudah tes COD.
Standarisasi larutan FAS dengan menggunakan beaker tinggi 20 mL untuk
mengencerkan 10 mL larutan standar K2Cr2O7 dengan akuades sampai 100 mL.
Ditambahkan 30 mL H2SO4 pekat. Dinginkan, kemudian dititrasikan dengan fero
ammonium sulfat dengan menggunakan 2-3 tetes indikator feroin. Warna larutan
berubah dari hijau ke biru-biruan menjadi oranye kemerah-merahan. Normalitas
FAS ditentukan dengan persamaan 3.6 (Alerts & Santika, 1987).
Normalitas FAS = !"#$ % " & !"#$
'() * %+ &+ % , % (3.6)
Analisis COD dilakukan analisis TCOD menggunakan metode bikarbonat
yaitu air limbah 0,5 mL dimasukkan ke dalam COD tube ditambahkan 0,4 g
HgSO4, 2 mL K2Cr2O7 dan 2 mL Ag2SO4 kemudian dikocok hingga merata. COD
larutan dimasukan dalam Erlenmeyer 250 mL dan ditambahkan indikator feroin
2-3 tetes lalu di homogenkan. Larutan pada erlenmeyer tersebut dititrasi dengan
larutan standar fero ammonium sulfat (FAS) 0,10 N hingga berwarna merah
kecoklatan. Nilai COD diperoleh dengan perhitungan menggunakan persamaan
3.7.
COD (mg/L) = - . (3.7)
Keterangan:
a : volume titran yang digunakan untuk titrasi blanko (mL) b : volume titran yang digunakan untuk titrasi sampel (mL) N : normalitas FAS
V : volume sampel (mL)
Selain TCOD, sampel dianalisis SCOD langkah kerja yang dilakukan sama
dengan analisis TCOD tetapi air limbah disaring terlebih dahulu. Air hasil
penyaringan dilakukan analisis SCOD.
B. Analisis Volatile Fatty Acid (VFA)
Pembuatan reagen yang dibutuhkan untuk analisis VFA meliputi larutan
NaOH 0,1 N dan larutan Asam Sulfat adalah (Stepnowski dkk., 2008) :
1. Pembuatan larutan NaOH 0,1 N
NaOH 4 g dilarutkan dengan akuades dalam labu ukur 1.000 mL dan
tepatkan sampai tanda batas.
2. Larutan Standard Asam Asetat/Acetic Acid (H2SO4 1 : 1)
Larutan Standard Asam Asetat/Acetic Acid 5.000 ppm adalah dengan
larutkan 1,9 mL Acetic Acid Glacial (s.g. 1,043) dengan 1 L akudes.
Analisis VFA dilakukan dengan cara memasukkan 50 mL sampel ke
sulfat. Labu ukur dirangkaikan dalam alat destilasi untuk diuapkan. Hasil destilasi
(destilat) pertama sebanyak 10-15 mL dibuang, kemudian dilakukan proses
destilasi untuk memperoleh 150 mL destilat dalam Erlenmeyer. Destilat dalam
Erlenmeyer dikocok agar homogen. Destilat dalam Erlenmeyer diberi 3 tetes
indicator PP, kemudian dititrasi menggunakan NaOH 0,1 N. Pada proses titrasi
akan terjadi perubahan warna dari yang tidak berwarna menjadi merah muda.
Hasil volume NaOH yang digunakan titrasi kemudian dicatat dan dilakukan
perhitungan dengan persamaan 3.8.
Kadar VFA = - #/ - " & - #/ 0 . (mg/L) (3.8)
C. Pengukuran pH
Pengukuran pH dilakukan untuk mengetahui fluktuasi nilai pH pada air
limbah sintetis. Pengukuran pH menggunakan metode elektrometri (APHA,
1999). Berikut merupakan langkah-langkah dalam melakukan pengukuran pH.
a. Sebelum digunakan pH meter dikalibrasi terlebih dahulu ke dalam pH 4,
pH 7, dan pH 10.
b. Elektroda dikeringkan dengan kertas tisu dan dibilas dengan akuades.
c. Elektroda dibilas dengan sampel air limbah.
d. Elektroda dicelupkan ke dalam sampel air limbah hingga pH meter
menunjukkan pembacaan yang tetap.
D. Pengukuran suhu
Pengukuran suhu dilakukan untuk mengetahui fluktuasi suhu pada dari air
limbah sintetis. Pengukuran suhu menggunakan termometer air raksa (APHA,
1999). Berikut merupakan langkah-langkah dalam melakukan pengukuran suhu:
a. Termometer dicelupkan ke dalam sampel air limbah dan dibiarkan 2 menit
sampai dengan 5 menit sampai termometer menunjukkan nilai yang stabil.
b. Pembacaan skala termometer dicatat tanpa mengangkat terlebih dahulu
termometer dari sampel air limbah.
E. Pengukuran produksi biogas
Pengukuran biogas dilakukan dengan mengalirkan selang biogas pada
reaktor menuju manometer yang berisi air destilasi. Air destilasi pada manometer
akan terdesak ketika terdapat biogas yang masuk ke dalam manometer.
Permukaan air destilasi berhimpit dengan skala yang ada pada manometer.
Perubahan permukaan air destilasi yang ditunjukkan pada skala dipantau dan
dicatat untuk mengetahui banyaknya produksi biogas selama penelitian.
3.4.2 Analisis Data
Analisa data dilakukan terhadap data yang diperoleh dari hasil analisis
setiap parameter yakni parameter TCOD, SCOD, VFA, pH, dan suhu:
1. Analisis penyisihan konsentrasi TCOD, dan SCOD pada tahap running.
Analisis penyisihan konsentrasi dilakukan terhadap data TCOD dan SCOD
pada konsentrasi OLR tertentu selama tahap running. Data konsentrasi penyisihan
TCOD dan SCOD dilakukan tabulasi data dalam bentuk tabel dan diplotkan dalam