DIRECT LEACHING TORIUM DAN UNSUR TANAH JARANG DARI TERAK PELEBURAN TIMAH DENGAN ASAM SULFAT
SKRIPSI
YANTI HARYANTI
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
DIRECT LEACHING TORIUM DAN UNSUR TANAH JARANG DARI TERAK PELEBURAN TIMAH DENGAN ASAM SULFAT
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh:
YANTI HARYANTI NIM. 11150960000079
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
DIRECT LEACHING TORIUM DAN UNSUR TANAH JARANG DARI TERAK PELEBURAN TIMAH DENGAN ASAM SULFAT
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh:
YANTI HARYANTI NIM. 11150960000079
Menyetujui,
Pembimbing I Pembimbing II
Dr. Hendrawati, M.Si Kurnia Trinopiawan, MT NIP. 19720815 200312 2 001 NIP. 198411112008011008
Mengetahui,
Ketua Program Studi Kimia
Dr. La Ode Sumarlin, M.Si NIP. 19750918 200801 1 007
PENGESAHAN UJIAN SKRIPSI
Skripsi yang berjudul “Direct Leaching Torium Dan Unsur Tanah Jarang Dari Terak Peleburan Timah Dengan Asam Sulfat” telah diuji dan dinyatakan lulus pada Sidang Munaqosah Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada hari Rabu 05 Agustus 2020. Skripsi telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains (S1) Program Studi Kimia.
Menyetujui,
Penguji I, Penguji II,
Dr. Sri Yadial Chalid , M.Si Nurmaya Arafah, M.Eng NIP. 19680313 200312 2 001 NIP.19870610 201903 2 016
Pembimbing I, Pembimbing II,
Dr. Hendrawati, M.Si Kurnia Trinopiawan, MT NIP. 19720815 200312 2 001 NIP. 19841111 200801 1 008
Mengetahui,
Dekan Fakultas Sains dan Teknologi, Ketua Program Studi Kimia,
Prof. Dr. Lily Surayya Eka Putri, M.Env.Stud Dr. La Ode Sumarlin, M.Si NIP. 19690404 200501 2 005 NIP. 19750918 200801 1 007
ABSTRAK
YANTI HARYANTI. Direct Leaching Torium dan Unsur Tanah Jarang dari Terak Peleburan Timah dengan Asam Sulfat. Dibimbing oleh HENDRAWATI dan KURNIA TRINOPIAWAN
Terak timah merupakan hasil samping dari proses peleburan timah yang masih mengandung unsur radioaktif torium, unsur tanah jarang. Terak timah perlu dilakukan upaya pengambilan unsur-unsur tersebut untuk meningkatkan nilai tambah terak timah. Penelitian ini bertujuan untuk memisahkan unsur radioaktif torium dan unsur tanah jarang pada terak timah. Metode yang dilakukan adalah
direct leaching dengan menggunakan beberapa parameter diantaranya yaitu
perbandingan volume air dan asam sulfat, temperatur, ukuran butiran, rasio solid liquid (g/mL), kecepatan pengadukan dan waktu leaching. Analisis kadar unsur radioaktif dan unsur tanah jarang dilakukan secara spektrofotometri UV-Vis serta ICP-OES. Hasil penelitian menunjukkan bahwa recovery torium dan unsur tanah jarang mencapai optimum pada perbandingan volume air dan asam sulfat (3,5:1) didapatkan unsur tanah jarang dan torium masing-masing sebesar 10,58 dan 7,09%, pada temperatur 60 0C didapatkan unsur tanah jarang dan torium masing-masing sebesar 19,28 dan 7,68%, ukuran butiran yang lolos pada saringan 230 mesh dan tertahan pada 325 mesh didapatkan unsur tanah jarang dan torium masing-masing sebesar 41,42 dan 9,52%, rasio solid liquid 10/100 (g/mL) didapatkan unsur tanah jarang dan torium masing-masing sebesar 33,60 dan 19,43%, kecepatan pengadukan 200rpm didapatkan unsur tanah jarang dan torium masing-masing sebesar 36,05 dan 25,36% dan waktu leaching selama 3,5 jam didapatkan unsur tanah jarang dan torium masing-masing sebesar 54,71 dan 16,18%.
ABSTRACT
YANTI HARYANTI. Direct Leaching Torium and Rare Earth Elements from Tin Smelting Slag with Sulfuric Acid. Guided by HENDRAWATI and KURNIA TRINOPIAWAN
Tin slag is a byproduct of the tin smelting process which still contains thorium radioactive elements, rare earth elements. Tin slag needs to be done to take these elements to increase the added value of tin slag. This study aims to separate the thorium radioactive elements and rare earth elements in tin slag. The method used is direct leaching using several parameters including the ratio of water and sulfuric acid, temperature, grain size, ratio solid liquid, stirring speed and leaching time. Analysis of levels of radioactive elements and rare earth elements is carried out by UV-Vis spectrophotometry and ICP-OES. The results showed that the recovery of thorium and rare earth elements reached an optimum in the ratio of water volume and sulfuric acid (3.5: 1) it was obtained that the rare earth elements and thorium were 10.58 and 7.09% respectively, at a temperature of 60 0C rare earth elements and thorium are 19.28 and 7.68% respectively, the grain size that passes through the 230 mesh sieve and is retained at 325 mesh results in rare earth elements and thorium respectively 41.42 and 9.52%, The solid liquid ratio of 10/100 (g / mL) obtained rare earth elements and thorium of 33.60 and 19.43% respectively, the stirring speed of 200rpm obtained rare earth elements and thorium respectively 36.05 and 25.36 %, and the leaching time for 3.5 hours it was found that the rare earth elements and thorium were 54.71 and 16.18% respectively.
KATA PENGANTAR
Assalamu’alaikum Warrahmatullahi Wabarakatuh
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT yang senantiasa melimpahkan berbagai nikmat terutama nikmat sehat sehingga penulis dapat menyelesaikan skripsi ini. Shalawat serta salam semoga selalu tercurahkan kepada junjungan Nabi Muhammad SAW beserta keluarga dan para sahabatnya. Skripsi ini berjudul; Direct Leaching Torium dan Unsur Tanah Jarang dari Terak Peleburan Timah dengan Asam Sulfat dilaksanakan di Laboratorium Pusat Teknologi Bahan Galian Nuklir (PTBGN). Penulis menyadari bahwa terselesaikannya skripsi ini tak lepas dari bantuan dan peranan banyak pihak. Pada kesempatan ini, penulis mengucapkan terima kasih kepada:
1. Dr. Hendrawati, M.Si selaku pembimbing I yang telah membimbing dan mendukung dalam penulisan skripsi ini;
2. Kurnia Trinopiawan, MT selaku pembimbing II yang telah membimbing dan mendukung penulis selama penelitian di PTBGN-BATAN;
3. Dr. Sri Yadial Chalid, M.Si selaku dosen penguji I yang telah memberikan kritik, saran, masukkan serta memberikan bimbingan dan motivasi.
4. Nurmaya Arofah, M.Eng selaku dosen penguji II yang telah memberikan kritik dan saran.
5. Dr. La Ode Sumarlin, M.Si selaku Ketua Program Studi Kimia, Fakultas Sains dan Teknologi, UIN Syarif Hidayatullah Jakarta;
6. Prof. Dr. Lily Surayya Eka Putri, M.Env.Stud selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta;
7. Ibu Yati Rayati dan Bapak Yayan Rukmana yang telah mendukung penuh baik secara materil, moril dan doa yang tiada henti-hentinya;
8. Dosen Program Studi Kimia UIN Syarif Hidayatullah Jakarta yang telah memberikan ilmu serta bimbingan kepada penulis selama perkuliahan.
9. Novita Sari Fatihah dan Anggi Novrianisti sesama teman mahasiswa Kimia UIN Syarif Hidayatullah Jakarta yang juga melakukan penelitian di Laboratorium PTBGN BATAN serta memberikan motivasi dan semangat pada saat penelitian berlangsung;
Penulis menyadari bahwa tanpa adanya dorongan, dukungan, motivasi, doa dan arahan maka skripsi tersebut tidak dapat diselesaikan. Semoga skripsi ini bermanfaat bagi penulis dan umumnya bagi kemajuan ilmu dan teknologi.
Wassalamu’alaikum Warrahmatullahi Wabarakatuh
Ciputat, September 2020
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR GAMBAR ... v DAFTAR TABEL ... vi BAB I PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Rumusan Masalah ... 3 1.3 Hipotesis... 3 1.4 Tujuan Penelitian ... 4 1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Terak Timah ... 5
2.2 Unsur Radioaktif Torium ... 7
2.3 Unsur Tanah Jarang ... 12
2.4 Spektrofotometer UV-Vis ... 15
2.5 Inductively Caupled Plasma Optical Emission Spectroscopy (ICP-OES) ... 19
2.6 Pelindian ... 20
BAB III METODE PENELITIAN ... 22
3.1 Waktu dan Tempat ... 22
3.2 Alat dan Bahan ... 22
3.2.1 Alat ... 22
3.2.2 Bahan ... 22
3.3 Diagram Alir ... 23
3.4 Prosedur Kerja ... 24
3.4.1 Preparasi Terak Timah ... 24
3.4.2 Leaching dalam Asam Sulfat ... 24
3.4.3 Analisis Sampel ... 27
BAB IV HASIL DAN PEMBAHASAN ... 31
4.3 Pengaruh Ukuran Butiran pada Leaching Terak Timah II dengan Asam
Sulfat. ... 38
4.4 Pengaruh Rasio Solid Liquid (S/L) pada Leaching Terak Timah II dengan Asam Sulfat ... 40
4.5 Pengaruh Kecepatan Pengadukan pada Leaching Terak Timah II dengan Asam Sulfat ... 42
4.6 Pengaruh Variasi Waktu pada Leaching Terak Timah II dengan Asam Sulfat……… ... 44 BAB V PENUTUP ... 48 5.1. Simpulan ……….. 48 5.2. Saran ………..…… 48 DAFTAR PUSTAKA ………. 49 LAMPIRAN ……… 57
DAFTAR GAMBAR
Gambar 1. Negara Produsen Timah ……… 5 Gambar 2. Proses Peleburan Timah di PT Timah (Pesero) Tbk …….………… 6 Gambar 3. Pseudo-struktur terak timah ……….….……….... 7 Gambar 4. Skema Peluruhan Radionuklida Torium ……….……… 11 Gambar 5. Skema Peluruhan dari Torium …….………..……. 11 Gambar 6. Absorbsi Sinar UV-Vis oleh larutan sampel pada kuvet ………… 16 Gambar 7. Skema Alat Spektrofotometer UV-Vis (single-beam)……….. 17 Gambar 8. Skema Alat Spektrofotometer UV-Vis yang memiliki sumber cahaya ganda (double beam) ………... 18 Gambar 9. Recovery unsur tanah jarang dan torium pada perbandingan konsentrasi asam sulfat ………. 32 Gambar 10. Recovery unsur tanah jarang dan torium pada berbagai variasi temperatur ………. 36 Gambar 11. Recovery unsur tanah jarang dan torium pada berbagai variasi ukuran butiran ………... 39 Gambar 12. Recovery unsur tanah jarang dan torium pada berbagai variasi rasio solid liquid ……… 41 Gambar 13. Recovery unsur tanah jarang dan torium pada berbagai variasi kecepatan pengadukan (rpm) ………... 43 Gambar 14. Recovery unsur tanah jarang dan torium pada berbagai variasi
DAFTAR TABEL
Tabel 1. Variasi Leaching Terak Timah II dengan Asam Sulfat ……… 22 Tabel 2. Hasil analisis kadar umpan terak timah II ……… 29 Tabel 3. Hasil analisis kadar unsur torium dan unsur tanah jarang pada filtrat
hasil direct leaching terak timah II variasi konsentrasi asam sulfat ..30 Tabel 4. Hasil analisis kadar unsur torium dan unsur tanah jarang pada filtrat
hasil direct leaching terak timah II variasi temperatur ………….… 33 Tabel 5. Hasil analisis kadar unsur torium dan unsur tanah jarang pada filtrat
hasil direct leaching terak timah II variasi ukuran butiran …...…… 36 Tabel 6. Hasil analisis kadar unsur torium dan unsur tanah jarang pada filtrat
hasil direct leaching terak timah II variasi raso solid liquid …….… 38 Tabel 7. Hasil analisis kadar unsur torium dan unsur tanah jarang pada filtrat
hasil direct leaching terak timah II variasi kecepatan pengadukan .. 40 Tabel 8. Hasil analisis kadar unsur torium dan unsur tanah jarang pada filtrat
hasil direct leaching terak timah II variasi waktu ……… 43 Tabel 9. Hasil analisis unsur tanah jarang pada umpan terak timah …..….… 59 Tabel 10. Hasil analisis torium pada umpan terak timah ………..…… 59 Tabel 11. Hasil analisis unsur tanah jarang pada filtrat leaching terak timah
variasi konsentrasi perbandingan air:asam sulfat menggunakan ICP-OES….………... 60 Tabel 12. Hasil analisis torium pada filtrat leaching terak timah variasi
perbandingan air:asam sulfat menggunakan Spektrofotmeter UV-Vis Tabel 13. Hasil analisis unsur tanah jarang pada filtrat leaching terak timah
variasi temperatur menggunakan ICP-OES ….…………...……….. 61 Tabel 14. Hasil analisis torium pada filtrat leaching terak timah variasi
temperatur menggunakan Spektrofotometer UV-Vis …………... 61 Tabel 15. Hasil analisis unsur tanah jarang pada filtrat leaching terak timah
variasi ukuran partikel (mesh) menggunakan ICP-OES …………... 62 Tabel 16. Hasil analisis unsur tanah jarang pada filtrat leaching terak timah
Tabel 17. Hasil analisis unsur tanah jarang pada filtrat leaching terak timah variasi rasio solid liquid (g/mL) menggunakan ICP-OES…………63 Tabel 18. Hasil analisis torium pada filtrat leaching terak timah variasi rasio
solid liquid (g/mL) menggunakan Spektrofotmeter UV-Vis ……… 63 Tabel 19. Hasil analisis unsur tanah jarang pada filtrat leaching terak timah
variasi kecepatan pengadukan (rpm) menggunakan ICP-OES …… 64 Tabel 20. Hasil analisis torium pada filtrat leaching terak timah variasi
kecepatan pengadukan (rpm) menggunakan Spektrofotmeter UV-Vis………..… 64 Tabel 21. Hasil analisis unsur tanah jarang pada filtrat leaching terak timah
variasi waktu menggunakan ICP-OES………...…… 65 Tabel 22. Hasil analisis unsur tanah jarang pada filtrat leaching terak timah variasi waktu menggunakan ICP-OES ………..……… 65
BAB I PENDAHULUAN 1.1 Latar Belakang
Indonesia merupakan negara penghasil bijih timah terbesar kedua setelah China di dunia (Salim et al., 2016). Bijih timah mengalami proses peleburan dan menghasilkan hasil samping berupa terak timah yang mengandung beberapa unsur seperti torium, uranium dan unsur tanah jarang yang memiliki nilai ekonomi sangat tinggi (Anggraini et al., 2015).
Bijih timah berupa mineral kasiterit (SnO2) dengan mineral ikutan seperti
ilmenit (FeTiO3), senotim (YPO4), monasit (Ce, La, Y, Th)PO3, rutil (TiO2) dan
zircon (ZrSiO4). Mineral ikutan dalam bijih timah tersebut mengandung unsur
logam yang bernilai ekonomi sangat tinggi (Maryono et al., 2010).
Terak timah merupakan kumpulan senyawa oksida yang tidak dapat tereduksi pada proses peleburan. Terak timah akan terpisah dari lelehan logam dan membentuk suatu fasa. Terak timah akan mengeras menyerupai batu dan mengandung timah (Sn), silikon (Si), serta unsur radioaktif torium. Terak timah memiliki tingkat kepadatan sebesar 3,076kg/cm3 sehingga dapat dimanfaatkan sebagai bahan campuran aspal maupun beton (Suprapto, 2008).
Proses peleburan bijih timah menghasilkan logam timah dan terak timah. Terak timah yang dihasilkan terdiri dari terak timah 1 dan terak timah II. Terak timah 1 merupakan hasil samping dari proses peleburan bijih timah tahap pertama sedangkan terak timah II hasil samping dari proses peleburan bijih timah tahap kedua. Menurut Butler (1978) terak timah dari proses peleburan timah menghasilkan terak 1 dengan kadar timah 20-40 dan terak timah II dengan kadar
timah di bawah 1 % (w/w) . Terak timah II dengan kadar di bawah 1 % masih dapat dimanfaatkan kembali karena masih memiliki unsur radioaktif dan unsur tanah jarang.
Penjelasan pada Q.S Al-Hadid ayat 25:
هَاللّ َمَلْع ِساَنلِل هعِفاَنَم َو ٌديِدَش ٌسْأَب ِهيِف َديِدَحْلا اَنْل َزْنَأ َو
ٌزي ِزَع ٌّيِوَق َ َاللّ َنِإ ۚ ِبْيَغْلاِب ههَلهس هر َو هه هرهصْنَي ْنَم
Artinya: “Dan Kami ciptakan besi yang padanya terdapat kekuatan yang hebat dan berbagai manfaat bagi manusia, (supaya mereka mempergunakan besi itu) dan supaya Allah mengetahui siapa yang menolong (agama) Nya dan rasul-rasul-Nya padahal Allah tidak dilihatnya. Sesungguhnya Allah Maha Kuat lagi Maha Perkasa”.
Firman Allah di atas menyatakan bahwa besi adalah salah satu unsur logam yang dijelaskan dalam Alquran dengan berbagai manfaat bagi manusia. Unsur logam selain besi adalah unsur tanah jarang dan unsur radioaktif torium juga memiliki banyak manfaat bagi manusia.
Menurut Isyuniarto et al., (1999) manfaat unsur tanah jarang dan torium dapat digunakan diberbagai industri seperti samarium, gadolinium, dysprosium untuk industri nuklir yang mempunyai penampang serapan netron yang besar, unsur yittrium untuk industri elektronika, unsur cerium, lantanum, neodymium untuk industri metalurgi dan unsur torium untuk industri bahan bakar nuklir. Penelitian Anggraeni (2016) recovery pemisahan unsur radioaktif dan unsur tanah jarang pada terak timah II dengan asam sulfat setelah dilakukan fusi dengan alkali
didapatkan hasil sebesar 27.01, 61.67, dan 0 % masing-masing untuk uranium, torium dan unsur tanah jarang. Penelitian Trinopiawan et al., (2016) proses
leaching terak timah II dengan asam klorida setelah proses fusi alkali
menghasilkan recovery tertinggi sebesar 87,5% pada konsentrasi HCl 2 M, temperatur 400C, ukuran butiran 325 mesh, rasio solid liquid 15/100 g/mL, dan kecepatan pengadukan 150 rpm.
Penelitian Teir et al., (2007) melakukan proses leaching bijih saprolit dengan asam sulfat. Asam sulfat tersebut merupakan asam paling efisien digunakan dibandingkan dengan jenis asam yang lain. Menurut Luo et al.,(2010) asam sulfat 10% (v/v) cukup korosif unuk mengubah struktur lizardit dan mampu mendekomposisi silika.
Pembaharuan pada penelitian ini dilakukan dengan metode Direct Leaching menggunakan asam sulfat. Metode direct leaching merupakan metode yang dilakukan tanpa melalui metode fusi alkali dengan NaOH. Metode Direct
Leaching dilakukan untuk mengetahui kondisi optimum pada paramater yang
digunakan yaitu perbandingan volume air dan asam sulfat, temperatur, ukuran partikel (mesh), rasio solid liquid (g/mL), kecepatan pengadukan dan waktu
leaching dengan menggunakan alat instrumen spektrofotometer UV-Vis dan
ICP-Oes.
1.2 Rumusan Masalah
Berapakah kondisi optimum pada variasi perbandingan konsentrasi (air : asam sulfat), temperatur, ukuran partikel, rasio solid liquid (g/mL), kecepatan pengadukan dan waktu leaching pada filtrat hasil direct leaching dengan kadar tertinggi pada unsur torium dan unsur tanah jarang dari terak timah II?
1.3 Hipotesis
Kondisi optimum pada variasi perbandingan konsentrasi (air : asam sulfat), temperatur, ukuran partikel, rasio solid liquid (g/mL), kecepatan pengadukan dan waktu leaching dapat diperoleh dari kadar tertinggi pada unsur torium dan unsur tanah jarang.
1.4 Tujuan Penelitian
Menentukan kondisi optimum pada perbandingan konsentrasi (air : asam sulfat), temperatur, ukuran partikel, rasio solid liquid (g/mL), kecepatan pengadukan dan waktu pelndian dari filtrat hasil direct leaching dengan kadar tertinggi pada unsur tanah jarang dan torium dari terak timah II.
1.5 Manfaat Penelitian
Metode Direct Leaching ini diharapkan dapat digunakan peneliti lain dalam memisahkan unsur tanah jarang dan unsur radioaktif torium dari terak timah II dengan asam sulfat sehingga mampu meningkatkan nilai ekonomi terak tersebut.
BAB II
TINJAUAN PUSTAKA
2.1 Terak Timah
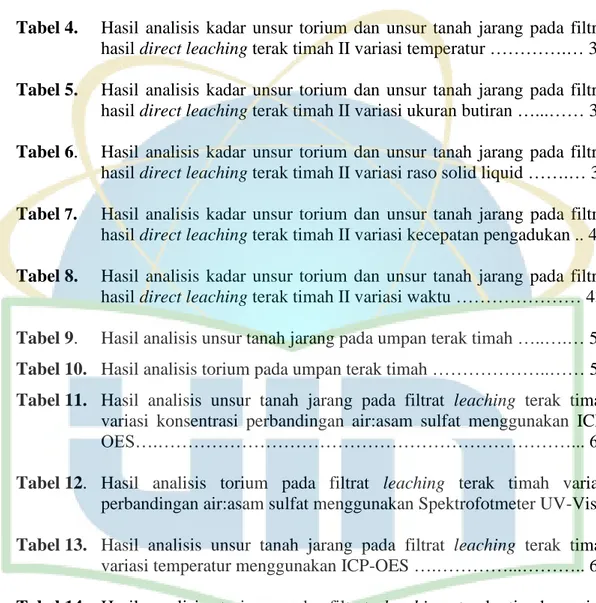
Produksi timah dunia tersebar di seluruh dunia. Produksi timah terbanyak terdapat pada wilayah Indonesia dan China. Kawasan sumber timah terdapat pada Kepulauan Bangka Belitung di Indonesia, Semenanjung Malaya, Thailand, Afrika meliputi Congo, Rwanda, Burundi, Nigeria dan Mesir, Amerika Selatan (Peru, Brazil, dan Bolivia) dan China (Salim et al., 2016).
Gambar 1. Negara Produsen Timah (ITRI, 2012).
Indonesia dan China menguasai lebih dari 65% produksi timah dunia tiap tahunnya. Indonesia dikenal sebagai “The Indonesian Tin Belt” dengan kandungan logam timah terbesar yang berada di Provinsi Kepulauan Bangka Belitung (PT Timah, 2011). Produksi timah di Provinsi Bangka Belitung sekitar 90% dari total produksi 90.000 ton di Indonesia (Haryadi et al., 2010).
Menurut Kementerian ESDM (2013) bahwa Indonesia memiliki cadangan timah sebesar 900.000 ton. Timah tersebut hanya cukup 10 hingga 12 tahun ke depan jika setiap tahunnya ditambang sekitar 60.000 hingga 90.000 ton.
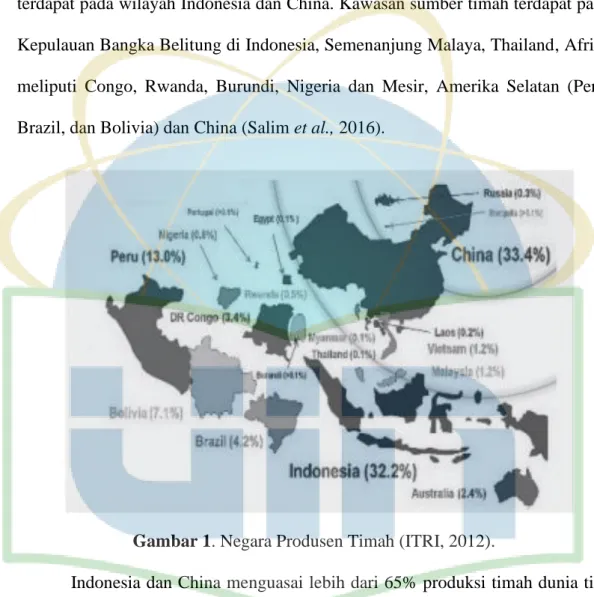
PT. Timah Tbk merupakan Badan Usaha Milik Negara (BUMN) yang bergerak pada bidang pertambangan timah yang meliputi kegiatan eksplorasi, penambangan, peleburan, pengolahan hingga pemasaran dan distribusi (Suprapto, 2008).
Gambar 2. Proses Peleburan Timah di PT Timah (Pesero) Tbk (Adhiutama, 2013).
Ada tiga tahapan proses dalam pengolahan bijih timah menjadi logam timah. Tahapan pertama yaitu tahap konsentrasi, dimana bijih timah dengan kadar timah 20-30 dari mineral lainnya dipisahkan serta meningkatkan kadar timah menjadi 72-74% yang merupakan syarat utama dalam proses. Tahapan selanjutnya yaitu proses peleburan, yang teridiri dari 2 tahap peleburan. Tahap peleburan pertama adalah peleburan konsentrat bijih timah yang menghasilkan timah kasar dan terak 1 atau slag. Slag tersebut nantinya akan mengikat mineral pengotor lain dari unsur Fe yang terdapat pada konsentrat. Tahap peleburan
kedua, slag kembali direduksi sehingga menghasilkan senyawa SnFe atau hard
head sebagai bahan baku untuk peleburan tahap pertama. Proses peleburan
menghasilkan crude tin dengan kadar Sn yang tinggi dan pengotor yang rendah. Tahapan terakhir adalah pemurnian atau refining, crude tin dari hasil peleburan akan dimurnikan melalui kettle refining, eutectic refining dan electrolytic refining. Proses pemurnian akan menghasilkan logam timah dengan kadar Sn 99,93% (Salim et al., 2016).
Hasil samping dari peleburan bijih timah menjadi logam timah adalah terak timah. Terak timah dari proses peleburan timah menghasilkan terak 1 dengan kadar timah 20-40% dan terak timah II dengan kadar timah di bawah 1% (Butler, 1978). Terak timah merupakan senyawa oksida yang berfungsi sebagai penyerap pengotor dalam lelehan logam, sepertiSiO2, TiO2, Al2O3, Nb2O5, Ta2O5, FeO, dan
SnO (Zulhan, 2012). Hasil peleburan bijih timah menghasilkan terak tipe SiO2
-CaO-FeO (Coudurier et al.,1985).
Timah dapat ditemukan pada senyawa kasiterit (SnO2) yang merupakan
mineral oksida dengan kandungan timah yang tinggi sekitar 78% (Salim et al., 2016). Logam timah hasil peleburan bijih timah masih terdapat unsur tanah jarang pada terak peleburan (Saleh et al., 2015).
Terak timah bersifat amorf dan dapat dikarakterisasi menggunakan analisis
microprobe. Data yang dihasilkan dibentuk menjadi Pseudo-struture (struktur
semu). Struktur ini menunjukkan adanya ikatan antar unsur-unsur dalam terak.
Ti Ta, Y, Ti Si Sn-Al-Ca Sn Si
Zr-Ta-Nb Nb-Zr Mn-Ca-Al Si Fe Sn-Al-Ca
Y Y Sn Mn Mn
Gambar 3. Pseudo-struktur terak timah (Gaballah & Allain, 1994)
Manfaat dari mengolah terak timah yaitu dapat meningkatkan nilai tambah terak timah, mendukung industrilisasi unsur tanah jarang di Indonesia, serta mengurangi limbah industri pertambangan (Trinopiawan et al., 2016).
2.2 Unsur Radioaktif Torium
Torium dapat menjadi alternatif bahan bakar nuklir karena keberadaannya di alam sangat melimpah yaitu sekitar 6,6-7,4 juta ton yang tersebar diseluruh dunia. Torium yang dimanfaatkan sebagai bahan bakar nuklir dapat mengurangi limbah radiaoktif yang beraktivitas rendah (IAEA, 2005).
Torium dapat ditemukan pada batuan, tanah dan kerak bumi. Torium yang terkandung dalam tanah rata-rata sekitar 12 ppm sedangkan pada kerak bumi jumLahnya tiga kali lebih banyak dibanding timah dan beberapa ratus kali lebih banyak dibanding U235. Torium terkandung dalam beberapa mineral, seperti thorite (ThO2), thorianite (ThO2+UO2) sekitar 12%, monasit (Ce,La,Th)PO4
sekitar 2,5%, zircon (ZrSiO2) sekitar 0,4%, xenotime (YPO4) dan alanit
(Ca,Ce,La,Y)2(Al,Fe)3(SiO4)3(OH) sekitar 0,1-2% (Morss et al., 2006).
Torium mempunyai konduktivitas panas yang sangat tinggi dan sangat stabil dalam mempertahankan stabilitas dimensinya. Titik leleh torium sekitar 3378 oC lebih tinggi dibanding uranium dioksida hanya sekitar 2865oC. Torium diharapkan mempunyai kinerja yang lebih baik dibanding uranium. Torium bersifat inert dan
tidak dapat mengoksidasi sehingga dalam hal penyimpanan bahan bakar akan jauh lebih mudah. Mekanisme reaksi Th232 menjadi bahan fisil adalah sebagai berikut.
Th232 + n → Th233 (22 m) → Pa233 (27 d) → U233 (73,6 tahun)………….. (1) Torium merupakan bahan non fisil tetapi Th232 akan menyerap neutron lebih
lambat sehingga terbentuk U232 berbahan fisil (Dewita, 2012).
Reaktor berbasis torium tidak dapat menghasilkan Pu239 sehingga tidak dapat digunakan untuk membuat senjata nuklir. Tampang serap netron termal dari torium232 sekitar (7,4 barns) lebih besar dibanding uranium, sehingga konversi torium menjadi U233 lebih tinggi dibanding konversi U238 menjadi Pu239 (IAEA,
2005)
Bahan bakar Pembangkit Listrik Tenaga Nuklir (PLTN) yang bersifat fisil direaksikan dengan neutron akan menghasilkan energi panas dalam jumlah besar. Panas tersebut akan dimanfaatkan untuk memutar turbin dan menghasilkan energi listrik. Pengembangan pembangkit listrik di Indonesia sangat penting karena meningkatnya jumLah industri dan penduduk dari tahun ke tahun yang terus meningkat. Menurut data dari Kementerian ESDM bahwa kebutuhan listrik di Indonesia mencapai 174 TWh pada tahun 2012. Data tersebut meningkat sekitar 10,1% setiap periodenya, sehingga dapat diprediksi pada tahun 2025 mendatang akan mencapai sekitar 520 TWh hingga 2.200 TWh pada tahun 2050 (Nugraha, 2016).
Bahan bakar torium tidak bersifat fisil, akan tetapi semua fisi berasal dari komponen penggeraknya seperti U233 yang menghasilkan jumLah energi hampir
sama dengan U235 yaitu sekitar + 168 sampai + 200 MeV (Schneider et al., 2012). Material fisil dari komponen penggeraknya selain uranium 233 yaitu Plutonium
239. Material tersebut dapat mempertahankan reaksi rantai nuklir. Torium alam (Th232) dapat menjadi fisil U233 yang dapat menghasilkan reaksi berantai reaktor
nuklir juga, sehingga dapat digunakan sebagai bahan bakar nuklir (Ariani et al., 2012). Persamaan reaksi penangkapan neutron oleh torium dinyatakan oleh (Ragheb, 2011) :
... (2) …………... (3)
…………... (4) …… (5)
Torium yang berada di alam seringkali berikatan dengan uranium dan unsur tanah jarang. Torium dapat dipisahkan dari unsur tanah jarang dengan cara ekstraksi dan leaching menggunakan asam sulfat (Iqbal et al., 2017).
JumLah torium yang bereaksi sebagai bahan bakar nuklir mencapai 90% dari total beratnya. Torium lebih efektif digunakan dibandingkan dengan uranium yang hanya berekasi sekitar 3-5%, sehingga torium mampu mengurangi limbah radioaktif. Pengolahan torium sama seperti pengolahan unsur tanah jarang yaitu melalui proses jalur hidrometalurgi. Proses hidrometalurgi terbukti efektif untuk mengolah unsur tanah jarang dan torium yang disebabkan oleh sifat kimia nya yang mudah dilarutkan dalam asam maupun basa dan dapat dipresipitasi secara selektif(Ritcey, 2006).
α, 4.013 α, 5.423
α, 5.685
α, 6.288
α, 6.779
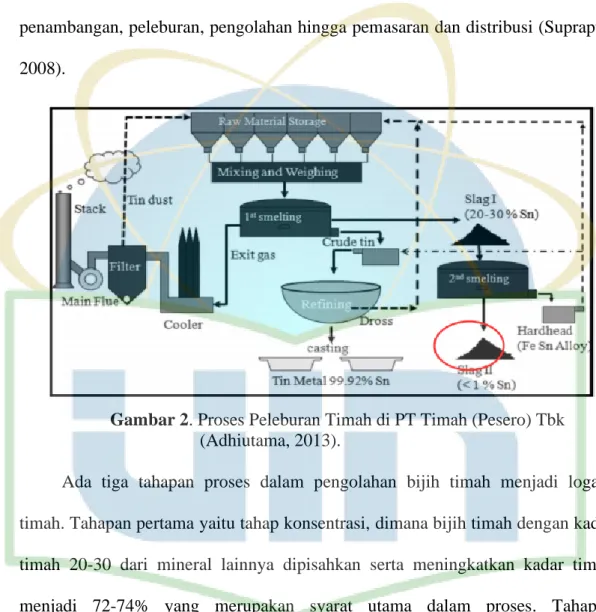
Gambar 4. Skema Peluruhan Radionuklida Torium (Luetzelschwab et al., 1984) Peluruhan torium diawali unsur 232Th (inti induk) dan diakhiri 208Pb. sebagai unsur yang stabil dengan peluruhan α dan 6 peluruhan β. Peluruhan torium yang cukup berbahaya adalah gas thoron (220Rn) (Nugraheni et al., 2012).
Gambar 5. Skema Peluruhan dari Torium (Arthur, 1999) 232Th, 1.405 x 1013y 228Ra 228Ac, 6.15h 228Th, 1.913y 234Ra, 3.66d 220Rn, 55.6s 216Po, 0,145s 212Pb, 212Bi, 208Ti, 3.053m 212Po, 0.299s 208Pb
Radon memiliki 3 macam isotop diantaranya 219Rn disebut Actinon karena berasal dari deret peluruhan Actinium dan memiliki waktu paruh 4 detik. 220Rn
yang disebut dengan Thoron berasal dari deret peluruhan Torium (Th232) memiliki waktu paruh sekitar 55,6 detik. 222Rn disebut dengan radon yang berasal dari deret
peluruhan Uranium (U238) dan memiliki waktu paruh sekitar 3,824 hari (Roth, 2004).
Paparan radiasi yang diterima oleh tubuh manusia scara eksternal dan internal sekitar 2,5 mSv/tahun. Paparan ekternal berasal dari dalam tanah sekitar 20% dan paparan internal berasal dari gas radon dan gas toron sekitar 20%. Gas radon sangat bersifat toksik karena dapat memancarkan sinar radiasi alfa yang berbahaya untuk tubuh manusia. Radiasi tersebut jika masuk ke dalam tubuh akan berinteraksi dengan air serta meghasilkan ion radikal bebas dan peroksida sebagai oksidator kuat. Molekul-molekul yang berada di dalam tubuh seperti protein, lemak, enzim, DNA dan kromosom akan terserang oleh ion radikal bebas dan peroksida. Dampak dari serangan tersebut berefek pada somatik dan genetik (Bestari et al., 2001).
2.3 Unsur Tanah Jarang
Unsur tanah jarang merupakan unsur yang bernilai ekonomi tinggi, karena keberadaannya kebanyakan sebagai mineral ikutan. Unsur tanah jarang terdapat dalam terak peleburan yang bermanfaat untuk aplikasi disejumLah peralatan teknologi. Unsur tanah jarang mempunyai karakteristik yang hampir sama, sehingga sulit untuk dipisahkan antara logam satu dengan logam lainnya (Anggraeni et al., 2017).
Unsur Tanah Jarang (LTJ) merupakan golongan lantanida yang terdiri dari 15 unsur, yaitu lantanum (La), cerium (Ce), praseodymium (Pr), neodymium (Nd), prometium (Pm), samarium (Sm), europium (Eu), gadolium (Gd), terbium (Tb), dysprosium (Dy), holmium (Ho), talium (Tm), erbium (Er), thulium (Tm), ytterbium (Yb) dan lutesium (Lu). Unsur-unsur tersebut memiliki sifat kimia yang mirip seperti pada kulit terluarnya yang memiliki 4f orbital elektron dan memiliki reaktivitas yang tinggi (Balachandran, 2014). Unsur tanah jarang mempunyai elektron terluar yang sama yaitu 6s, dengan jumLah elektron 4f dan 5d yang bervariasi (Cotton et al., 2007).
Unsur tanah jarang memiliki nomor atom 57 sampai 71. Unsur yttrium dengan nomor atom 39 sebenarnya bukan lantanida tetapi memiliki sifat-sifat kimia dan fisika yang mirip sehingga digolongkan sebagai unsur tanah jarang.. Kemiripan tersebut disebabkan oleh konfigurasi elektron yang mempengaruhi tingkat valensi dan kenaikan jumLah elektron yang tidak disertai dengan bertambahnya kulit elektron (Humphries, 2013).
Pemanfaatan unsur tanah jarang semakin meningkat dari tahun ke tahun yang disebabkan banyaknya kebutuhan yang memanfaatkan unsur tanah jarang tersebut. Pemanfaatan unsur tanah jarang yang sederhana yaitu untuk lampu, pelapis gelas, untuk teknologi tinggi seperti fosfor, laser, magnet, baterai, dan teknologi masa depan seperti superkonduktor, pengangkut hidrogen (Kleppe, 1974).
Mineral yang umum sebagai unsur tanah jarang terdiri dari bastnaesit, monasit dan senotim (Jordens et al., 2012).
1. Bastnaesit (CeFCO3) merupakan sumber tanah jarang yang dapat
ditemukan dalam batuan kabonatit yang mengandung 60-70% oksida logam tanah jarang seperti Lanthanum dan Neodimium.
2. Monasit (Ce,La,Y,Th)PO3 merupakan hasil samping dari senyawa
logam berat yang mengandung 50-70% oksida unsur tanah jarang. Monasit dikategorikan sebagai TENORM (Technologically Enhanced
Naturally Occuring Radioactive Material) yaitu zat radioaktif alam yang
mengalami peningkatan paparan potensial dan penanganan TENORM yang harus patuh pada batasan paparan radiasi.
3. Senotim (YPO4) ditemukan dalam mineral pasir berat seperti pegmatite
dan batuan leleh yang juga merupakan senyawa ytrium phospat yang mengandung 54-65% unsur tanah jarang termasuk erbiumm, cerium dan torium.
4. Zirkon merupakan senyawa zirkon-ium silikat yang mengandung torium, ytrium dan cerium.
Aplikasi unsur tanah jarang diantaranya seperti unsur lantanum (La) sebagai pelacak mikroskopis elektron, baterai laptop, lensa kamera, dan aki mobil. Unsur Cerium (Ce) sebagai warna tv, neon, dan pencahyaaan busur karbon. Unsur Yttrium (Y) sebagai filter microwave, warna merah di tv tabung dan superkonduktor suhu tinggi (Humphries, 2013). Penggunaan unsur tanah jarang lainnya seperti unsur Praseodymium (Pr) sebagai magnet, katalis, kacamata tukang las. Unsur Neodymium (Nd) sebagai magnet laser, kaca spion mobil. Unsur Samarium (Sm) berfungsi sebagai cancer treatment, nuclear reactor
control rods, IR absorber. Unsur Dysprosium (Dy) berfungsi sebagai thermal neutron absorber, laser, katalis, metal-halide lamps (King et al., 2016).
2.4 Spektrofotometer UV-Vis
Spektrofotometer UV-Vis adalah suatu alat instrument untuk mengukur panjang gelombang, intensitas sinar ultraviolet dan cahaya tampak yang diabsorpsi oleh sampel. Sinar ultraviolet maupun cahaya tampak memiliki energi untuk mempromosikan elektron terluar ke tingkat lebih tinggi. Alat instrument ini digunakan untuk molekul dan ion anorganik atau kompleks pada larutan sampel (Dachriyanus, 2004).
Elektron yang tereksitasi dari keadaan dasar ke tingkat energi yang lebih tinggi direkam dalam bentuk spektrum dinyatakan sebagai panjang gelombang dan absorbansi sesuai dengan jenis elektron dalam molekul yang akan dianalisis. Elektron yang mudah tereksitasi maka semakin besar panjang gelombang yang diabsorbsi. Elektron yang semakin banyak tereksitasi maka semakin tinggi absorban (Suhartati, 2017).
Spektrofotometri UV-Vis memiliki beberapa istilah yaitu kromofor, auksokrom, efek batokromik (pergeseran merah), efek hipokromik (pergeseran biru), hipsokromik, dan hipokromik. Kromofor adalah bagian molekul yang mengabsorbsi sinar dengan kuat di daerah UV-Vis. Ausokrom adalah gugus fungsi yang mengandung pasangan elektron bebas berikatan kovalen tunggal yang terikat pada kromofor yang mengintensifkan absorbsi sinar UV-Vis, baik pada panjang gelombang maupun intensitas (Suhartati, 2017).
Prinsip kerja spektrofotometer UV-Vis yaitu masuknya cahaya monokromatik pada suatu media (larutan), sebagian cahaya akan diserap, sebagian
cahaya akan dipantulkan dan sebagian cahaya akan dipancarkan. Spektrofotometer digunakan sebagai pengukuran dengan cara menggunakan kurva kalibrasi dari hubungan konsentrasi larutan yang akan dianalisa. Pengukuran tersebut dapat dilakukan secara kuantitatif maupun kualitatif, penentuan secara kuantitatif yaitu berdasarkan niai absorbansi yang dihasilkan spektrum yang menandakan adanya senyawa pengompleks yang dianalisis sedangkan penentuan secara kualitatif berdasarkan puncak-puncak yang dihasilkan spektrum dari suatu larutan yang akan dianalisis pada panjang gelombang tertentu (Yanlinastuti dan Fatimah, 2016).
Menurut Fatimah (2016), hukum Lambert-Beer yaitu masuknya cahaya monokromatis yang dilewatkan pada suatu media transparan sehingga intensitas cahaya ditransmisikan sebanding dengan tebal dan kepekaan media larutan yang digunakan.
Persamaan Hukum Lambert-Beer yaitu :
A = log I/Io atau A = ε.b.C ………..………..………… (6) Dimana A = absorbansi
ε = koefisien serapan molar
b = tebal media cuplikan yang dilewati sinar C = konsentrasi unsur dalam larutan cuplikan Io = intensitas sinar mula-mula
Keterangan : Io = intensitas sinar sebelum melalui sampel I = intensitas sinar setelah melalui sampel
Gambar 6. Absorbsi Sinar UV-Vis oleh larutan sampel pada kuvet (Suhartati, 2017).
Perbandingan logaritma Io dengan I menyatakan seberapa besar sinar tersebut diabsorpsi oleh sampel. Nilai ekstinsi molar (ε) sangat penting dalam penentuan struktur karena terkait dengan transisi elektron yang diperbolehkan atau transisi elektron yang dilarang. Nilai tersebut akan dapat diperkirakan kromofor dari senyawa yang dianalisis (Suhartati, 2017).
Sumber cahaya digunakan sebagai lampu hidrogen atau deuterium untuk pengukuran uv dan lampu tungsten untuk pengukuran pada cahaya tampak. Panjang gelombang cahaya dibagi oleh prisma atau monokromator. Spektrum diperoleh dengan cara scanning oleh wavelength separator (Dachriyanus, 2004).
Spektrofotometer UV-Vis memiliki 2 tipe instrumen spektrofotometer sumber cahaya yaitu sumber cahaya tunggal (single beam) dan sumber ganda
(double beam). Single-beam digunakan untuk mengukur absorbansi pada panjang
gelombang tunggal dan pengukuran sinar ultra violet dan sinar tampak. Panjang gelombang rendah sekitar 190 – 210 nm dan panjang gelombang tinggi sekitar 800 – 1000 nm (Suhartati, 2017).
Gambar 7. Skema Alat Spektrofotometer UV-Vis (single-beam) (Suhartati, 2017).
Sinar polikromatis diperuntukan sinar UV sebagai lampu deuterium, sedangkan sinar Visibel atau sinar tampak sebagai lampu wolfarm. Monokromator digunakan sebagai lensa prisma dan filter optik. Sel sampel berupa kuvet yang terbuat dari kuarsa dengan lebar yang bervariasi. Detektor berupa foto/panas/dioda foto yang berfungsi menangkap cahaya yang diteruskan dan diubah menjadi arus listrik (Suhartati, 2017).
Gambar 8. Skema Alat Spektrofotometer UV-Vis yang memiliki sumber cahaya ganda (double beam)(Suhartati, 2017).
Sumber cahaya ganda (double beam) ini sangat praktis dan mudah digunakan serta mengahsilkan hasil yang optimal. Larutan sampel yang akan dianalisis dimasukkan bersama-sama dengan pelarut yang tidak mengandung sampel (Dachriyanus, 2004).
Double-beam mempunyai dua sinar hasil dari potongan cermin yang
berbentuk V. Sinar pertama melewati larutan blanko dan sinar kedua serentak melewati sampel (Suhartati, 2017).
2.5 Inductively Caupled Plasma Optical Emission Spectroscopy (ICP-OES) ICP-OES merupakan teknik analisis secara simultan dengan tingkat ketelitian dan sensitifitas yang tinggi. Analisis dapat dilakukan dengan mudah, cepat serta tidak memerlukan persiapan pada contoh karena keselektifan yang tinggi dan limit deteksi yang rendah sampai rentang ppb. Penggunaan teknik tersebut hanya untuk analisa logam berat yang memiliki nilai ekonomis tinggi serta konsentrasi yang rendah seperti penentuan lantanida dan aktinida (Taufiq dan Hutagaol 2010).
Teknik spekstroskopi atom yang bersumber eksitasi baru berupa plasma menghasilkan teknik analisis alternatif untuk menentukan kadar logam berat menggunakan Inductively Caupled Plasma Optical Emission Spectroscopy (ICP-OES). Sumber eksitasi tersebut dihasilkan dari gelombang elektromagnetik pembangkit frekuensi radio melalui kumparan induksi serta menghasilkan nyala api bersuhu tinggi yang dapat meminimalkan adanya gangguan kimia dan meningkatkan sensitifitas metode (Archer et al., 2003).
Prinsip kerja alat ICP-OES menggunakan sepasang induksi yaitu induksi medan magnet dan induksi medan listrik sebagai sumber energi untuk
mengeksitasi elektron dari atom yang terdapat pada sampel. Elektron yang tereksitasi dari tingkat rendah ke tingkat yang lebih tinggi akan kembali ke keadaan dasar dengan melepaskan energi yang berupa sinar. Sinar yang dilepaskan akan masuk ke spektrometer dan didispersikan oleh grating menjadi spektrum garis yang spesifik untuk masing-masing atom atau ion yang berada pada sampel (Boss et al., 2004).
Sampel cair dan gas dapat disuntikkan langsung ke dalam instrumen, sedangkan sampel padat membutuhkan ekstraksi terlebih dahulu sehingga unsur dalam larutan terbentuk. Sampel dikonversi menjadi aerosol dan diarahkan ke saluran pusat plasma. Eksitasi dalam plasma memberikan energy tambahan untuk atom untuk ke keadaan tereksitas. Foton memiliki energy karakteristik yang ditentukan oleh struktur tingkat energy terkuantitasi untuk atom atau ion. Panjang gelombang foton dapat digunakan untuk mengidentifikasi unsur-unsur dalam sampel. JumLah foton berbanding lurus dengan konsentrasi unsur dalam sampel. Sebagian foton dipancarkan dan dikumpulkan dengan lensa. Monokromator menghasilkan panjang gelombang dan diubah menjadi sinyal listrik oleh photodetektor. Sinyal diperkuat dan diproses oleh detector elektronik, kemudian ditampilkan dan disimpan oleh computer (Hou dan Jones, 2000).
2.6 Pelindian
Pelindian merupakan metode yang sangat sederhana dan sangat efisien untuk digunakan dalam hal pemisahan unsur logam dari bijihnya. Pelindian memiliki beberapa faktor operasi seperti konsentrasi asam, suhu, rasio solid dan liquid, ukuran partikel, pengadukan, dan waktu (Kulkarni, 2015).
a. Ukuran partikel yang semakin kecil maka areal terbesar antara padatan terhadap cairan memungkinkan terjadi kontak secara cepat dan semakin besar ukuran partikel maka waktu yang diperlukan oleh cairan yang akan mendifusi relatif lebih sama.
b. Kecepatan pengadukan merupakan parameter penting yang dapat dinyatakan dengan gradien kecepatan. Gradien kecepatan merupakan fungsi dari tenaga yang disuplai. Kenaikan kecepatan putaran pengadukan akan menaikan power supply per satuan massa larutan yang akan mengakibatkan kecepatan pelarutan semakin meningkat.
c. Temperatur tinggi akan meningkatkan laju reaksi. Hal tersebut diakibatkan oleh gerak partikel-partikel pereaksi dan energi kinetik partikel akan meningkat. Hubungan antara konstanta kecepatan reaksi dengan temperatur mengikuti persamaan Arrhenius.
Unsur-unsur dalam terak seperti unsur tanah jarang dapat dilindi dengan berbagai asam kuat seperti asam klorida, asam sulfat dan asam nitrat (Gupta et al., 2005).
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian dilaksanakan pada bulan Juli–Desember 2019 di Laboratorium Pengolahan Bahan Galian Nuklir, Pusat Teknologi Bahan Galian Nuklir (PTBGN-BATAN) di kawasan nuklir Jl. Lebak Bulus Raya No. 9 Pasar Jumat, Jakarta Selatan.
3.2 Alat dan Bahan
3.2.1 Alat
Alat yang digunakan adalah ayakan 80, 120, 140, 150, 230 mesh, lemari asam, statif, motor pengaduk, hot plate, waterbath, gelas piala, termometer, sentrifuge, cawan petri, botol vial, labu ukur, pipet volume, pipet gondok, oven, mortar, timbangan analitik, spektrofotometer UV-Vis Shimadzu 2600, ICP-OES Perkin Elmer.
3.2.2 Bahan
Bahan yang digunakan adalah terak timah II hasil peleburan timah dari PT.Timah (Persero) Tbk., Kepulauan Bangka Belitung, H2SO4 pekat teknis,
larutan tri-oocthyl-phospin-oxide (TOPO) 0.05 M Merck, asam askorbat 5 % Merck, larutan kompleks II Merck, larutan buffer pH 8.35 Merck, larutan 2-(5-bromo-2-pyridylozo)-5-diethyl aminophenol (BR-PADAP) Merck 0,05%, larutan thorin Merck, HCl pH 0.8 Merck, larutan campuran HNO3 Merck dan HClO4
Terak Timah Bahan Dasar atau Umpan 3.3 Diagram Alir - Ditambahkan H2SO4dengan berbagai variasi - Disentrifugasi Diambil filtrat - Dilakukan penggerusan
- Diayak dengan 5 variasi ukuran saringan (80 ; 120 ; 150 ; 230 ; 325 ) mesh
- Dihomogenisasi masing-masing ukuran partikel - Ditimbang sebanyak 20 gram pada masing-masing
ukuran partikel
Analisis torium dan UTJ dengan alat UV-Vis dan ICP-Oes
1. C = 1:2,5 ; 1:2 ; 1:1,5 ; 1;1 ; 1:0,5 ; 2,5:1 ; 3:1 ; 3,5:1 ; 4:1 2. T = Ambient ; 40 ; 50 ; 60 ;70 ; 80 ; 90 (0C) 3. Mesh = -80+120 ; -120+150 ; -150+ 230; -230+325 ; -325 4. S/L = 5 ; 10 ; 15 ; 20 ; 25 ; 30 ;40 ;50 (g/100mL) 5. Rpm = 150 ; 200 ; 250 ; 300 6. t = 60, 90, 120,150, 180, 210, 240 menit Analisis
Torium dan UTJ dengan alat UV-Vis dan ICP-Oes
3.4 Prosedur Kerja
3.4.1 Preparasi Terak Timah
Terak timah sebanyak 1 kg dari PT. Timah Tbk dihaluskan menggunakan alat gerus yaitu ball mill. Terak timah yang sudah halus kemudian dilakukan pengayakan dengan 5 variasi ukuran saringan yaitu terak lolos ayakan pada ukuran saringan 80 mesh dan tertampung pada 120 mesh (-80+120), terak lolos ayakan pada ukurn saringan 120 mesh dan tertampung pada 150 mesh (-120+150), terak lolos ayakan pada ukuran saringan 150 mesh dan tertampung pada 230 mesh (-150+230), terak lolos ayakan pada ukuran saringan 230 mesh dan tertampung pada 325 mesh (-230+325), terak lolos ayakan pada ukuran saringan -325 mesh dan semua terak tersebut dihomogenkan. Terak timah yang sudah homogen merupakan umpan dan bahan dasar leaching yang digunakan pada percobaan. Umpan dan bahan dasar leaching tersebut ditimbang sebanyak 20 gram dari masing-masing ukuran partikel.
3.4.2 Leaching dalam Asam Sulfat (Trinopiawan et al., 2016)
Leaching dengan asam sulfat akan dilakukan secara direct leching dengan
berbagai variasi yang digunakan seperti Tabel 1 di bawah ini.
Tabel 1. Variasi Leaching Terak Timah II dengan Asam Sulfat
Parameter Leaching Terak Timah II
Perbandingan volume (H2O;H2SO4) mL 1:2,5 ; 1:2 ; 1:1,5 ; 1;1 ; 1:0,5 ; 2,5:1 ; 3:1 ; 3,5:1 ; 4:1
Temperatur (0C) Ambien, 40, 50, 60, 70, 80, 90
Ukuran Partikel (mesh) -80+120 ; -120+150 ; -150+230 ; -230+325 ; -325 Rasio Solid Liquid (g/mL) 5 ;10 ; 15 ; 20 ; 25 ; 30 ; 40 ; 50
Pengadukan (rpm) 150 ; 200 ; 250 ; 300
Proses leaching dilakukan dengan berbagai variasi leaching agar dapat diketahui kondisi optimum yang memberikan hasil recovery terbesar dalam proses
leaching. Recovery torium dan unsur tanah jarang terlarut dihitung menggunakan
rumus sebagai berikut.
Recovery = ………. (2)
a. Variasi Konsentrasi Asam Sulfat
Leaching ini dilakukan dengan menimbang umpan terak timah dengan
ukuran saringan -80+120 mesh sebanyak 20 gram kemudian ditambahkan 100 mL larutan asam sulfat dengan variasi perbandingan volume air dan asam sulfat yaitu 1:2,5 ; 1:2 ; 1:1,5 ; 1;1 ; 1:0,5 ; 2,5:1 ; 3:1 ; 3,5:1 ; 4:1 (mL). Percobaan ini dilakukan dalam gelas kimia 500 mL dilengkapi dengan motor pengaduk digital dengan impeller jenis 4-blade radial turbinel dan hot plate. Percobaaan dilakukan pada kondisi parameter lain secara tetap seperti pada suhu kamar, rasio solid liquid 20gram/100mL, kecepatan pengadukan 100 rpm dan waktu selama 30 menit. Sampel filtrat dari masing-masing percobaan dianalisis menggunakan spektrofotometer UV-Vis dan ICP-OES. Dari hasil analisis tersebut kemudian ditentukan konsentrasi asam sulfat optimum untuk digunakan pada variasi parameter selanjutnya.
b. Variasi Temperatur
Hasil penentuan konsentrasi optimum kemudian divariasikan kembali dengan perbedaan suhu ambient, 40,50,60,70,80,90 0C. Percobaan ini dilakukan
dalam kondisi parameter yang sama yaitu menggunakan gelas kimia 400 mL dilengkapi dengan motor pengaduk digital dengan impeller jenis 4-blade radial
liquid 20gram/100mL, kecepatan pengadukan 100 rpm dan waktu percobaan selama 30 menit. Sampel filtrat dari masing-masing percobaan dianalisis menggunakan spektrofotometer UV-Vis dan ICP-OES. Dari hasil analisis tersebut kemudian ditentukan kondisi optimum untuk digunakan pada variasi parameter selanjutnya.
c. Variasi Ukuran Butiran
Leaching variasi ukuran butiran dilakukan dengan ukuran saringan
(-80+120 ; -120+150 ; -150+230 ; -230+325 ; -325) mesh dengan kondisi yang sama yaitu menggunakan gelas kimia 400 mL dilengkapi dengan motor pengaduk
impeller jenis 4-blade radial turbine digital dan waterbath, konsentrasi optimum,
suhu optimum, rasio solid liquid 20/100 g/mL, kecepatan pengadukan 100 rpm dan waktu percobaan selama 30 menit. Filtrat yang dihasilkan kemudian dianalisis menggunakan spektrofotometer UV-Vis dan ICP-OES kemudian ditentukan ukuran butiran optimumnya.
d. Variasi Rasio Solid Liquid (g/mL)
Variasi rasio solid liquid (g/mL) dilakukan setelah diketahui kondisi optimum pada konsentrasi asam sulfat, kondisi optimum suhu, kondisi optimum ukuran butiran, kecepatan pengadukan 100 rpm dan waktu selama 30 menit. Rasio solid liquid (g/mL) ini dilakukan dalam percobaan 5/100, 10/100, 15/100, 20/100, 25/100, 30/100, 40/100, 50/100 g/mL.
Filtrat yang dihasilkan dari masing-masing percobaan dianalisis menggunakan spektrofotometer UV-Vis dan ICP-OES. Dari hasil analisis tersebut kemudian ditentukan kondisi rasio solid liquid (g/mL) optimum untuk digunakan pada variasi parameter selanjutnya.
e. Variasi Kecepatan Pengadukan
Kondisi optimum yang sudah diketahui pada variasi sebelumnya yaitu kondisi optimum konsentrasi, suhu, ukuran butiran, rasio solid liquid maka akan dilanjutkan ketahap variasi kecepatan pengadukan yang meliputi 150 ; 200 ; 250 ; 300 rpm. Filtrat yang dihasilkan pada percobaan ini kemudian dianalisis menggunakan spektrofotometer UV-Vis dan ICP-OES kemudian ditentukan kecepatan pengadukan optimumnya untuk divariasikan waktu.
f. Variasi Waktu
Variasi waktu yang digunakan yaitu 30 ; 60 ; 90 ;120 ; 150 ; 180 ; 210, 240 menit. Percobaan ini dilakukan dengan kondisi optimum konsentrasi, suhu, ukuran butiran, rasio solid liquid, dan kecepatan pengadukan. Sampel filtrat dari masing-masing percobaan dianalisis menggunakan spektrofotometer UV-Vis dan ICP-OES. Dari hasil analisis tersebut kemudian ditentukan waktu leaching optimumnya.
3.4.3 Analisis Sampel Unsur Tanah Jarang dan Torium
a. Penetapan Torium dengan Spektrofotometer UV-Vis (Sumiarti dan Alwi 2018a)
Dipipet satu mL larutan yang mengandung 5-100 ppm torium ke dalam labu ukur 50 mL. Setelah itu ditambahkan 15 mL HCl pH 0,8 dan dikocok. Lalu ditambahkan lagi 5 mL Askorbat 5% dan dikocok kembali. Larutan tersebut kemudian ditambahkan 5 mL Thorin, lalu ditepatkan sampai batas tera menggunakan HCl pH 0,8. Larutan yang dihasilkan merupakan larutan komplek stabil selama 30 menit, diukur absorban dengan spektrofotometer pada panjang gelombang 545. Standar torium dibuat dari larutan torium nitrat dengan
konsentrasi 5 sampai 100 ppm. Larutan blank terdiri dari 5 mL thorin dan diperlakukan sama dengan sampel.
Sampel padatan, ditimbang 1 gram sampel yang sudah digerus halus ke dalam gelas kimia. Sampel ditambahkan masing-masing 20 mL asam campuran yaitu HNO3 dan HClO4 dengan perbandingan (1:6) lalu dipanaskan sampai
berbentuk pasta. Sampel yang telah kering ditambahkan lagi H2SO4 1:1 sebanyak
15 mL lalu dipanaskan lagi sampai kering dan dilarutkan kembali dengan HCl 1:1 dan dimasukkan ke dalam labu ukur 50 mL lalu ditepatkan sampai batas tera menggunakan HCl 1:1, kemudian dianalisis.
b. Leaching Residu untuk Analisis UTJ dan Torium pada Umpan Terak Timah (Sumiarti dan Alwi 2018a)
Sampel residu ditimbang sebanyak 1 gram yang sudah digerus halus dan dimasukkan ke gelas teflon, ditambahkan masing-masing 20 mL asam campur yaitu HNO3 dan HClO4 dengan perbandingan (1:6) dipanaskan selama + 2 jam
sampai terbentuk pasta. Pasta ditambahkan H2SO4 (1:1) sebanyak 15 mL,
dipanaskan lagi sampai kering kemudian dilarutkan dengan HCl (1:1) dan dipindahkan ke labu ukur 50 mL lalu ditepatkan sampai tanda garis dengan HCl (1:1).
c. Analisis Unsur Tanah Jarang (Sumiarti dan Alwi 2018b)
Kurva kalibrasi standar dibagi menjadi dua yaitu mayor dan minor. Pembuatan larutan standar mayor yaitu dengan cara dipipet deret standar unsur Ce, Pr, Nd, Sm, Gd, La,Y, Dy dengan kadar 0.5 ; 2 ; 5 ; 10 ; 20 ; 50 ppm ke dalam masing-masing labu ukur. Sampel dipreparasi dengan cara diencerkan sesuai kadar standar kalibrasi 0,5 ppm–50 ppm. Larutan standar diukur pada
masing-masing panjang gelombang yang sudah diatur pada metoda penetapan unsur LTJ dengan menggunakan ICP-OES.
BAB IV
HASIL DAN PEMBAHASAN
Peleburan timah di Industri timah menghasilkan hasil samping berupa terak timah (slag II) yang masih mengandung unsur torium dan unsur tanah jarang. Penelitian ini bertujuan untuk memisahkan unsur tersebut melalui proses leaching dengan pelarut asam yaitu dengan asam sulfat. Menurut Anggraeni (2016) pemisahan unsur radioaktif dan unsur tanah jarang pada terak timah dengan asam sulfat setelah dilakukan proses fusi alkali mampu melarutkan unsur torium lebih tinggi.
Pemisahan unsur radioaktif torium dan unsur tanah jarang pada terak timah II dilakukan secara direct leaching. Leaching tersebut dilakukan dengan asam sulfat dan dianalisis menggunakan alat spektrofotometer UV-Vis untuk torium dan ICP-OES untuk unsur tanah jarang (Trinopiawan et al., 2016).
Adapun hasil analisis umpan terak timah II sebelum dilakukan leaching dapat dilihat pada Tabel 2.
Tabel 2. Hasil analisis kadar umpan terak timah II Ukuran Saringan
(mesh)
Torium (mg)
Unsur Tanah Jarang (mg) -80+120 246,78 406,85 -120+150 91,87 407,22 -150+230 92,30 459,67 -230+325 99,56 460,12 -325 85,02 462,95
Hasil analisis kadar umpan terak timah II pada Tabel 2 di atas ternyata masih mengandung unsur tanah jarang dan torium yang cukup tinggi. Kandungan unsur tanah jarang terbanyak diperoleh pada ukuran partikel lolos ayakan 230 mesh dan tertahan pada 325 mesh (-230+325) rata-rata sebesar 0,4 gram sedangkan kandungan unsur torium terbanyak diperoleh pada ukuran partikel lolos ayakan 80 mesh dan tertahan pada 120 mesh (-80+120) rata-rata sebesar 0,1 gram.
Kandungan unsur torium dan unsur tanah jarang masih dapat dipisahkan dengan proses leaching. Proses leaching merupakan proses ekstraksi padat cair menggunakan suatu pelarut asam, asam yang digunakan adalah asam sulfat karena lebih efisien dibandingkan dengan asam lain dan mampu dilakukan secara direct
leaching tanpa adanya proses dekomposisi pada terak timah II. Menurut (Luo et al., 2010) asam sulfat mampu memecah silika yang terkandung pada terak timah
II. Unsur tanah jarang yang diamati pada penelitian ini adalah unsur Ce, Dy, La, Nd, Pr, Sm, dan Y secara total dimana unsur tersebut terkandung dalam terak timah II.
4.1. Pengaruh Konsentrasi Asam Sulfat pada Leaching Terak Timah II Percobaan Leaching dengan variasi konsentrasi perbandingan air dan asam sulfat yaitu 1:2,5 ; 1:2 ; 1:1,5 ; 1;1 ; 1:0,5 ; 2,5:1 ; 3:1 ; 3,5:1 ; 4:1 (mL) dilakukan dalam gelas kimia 500 mL. Variabel tetap pada percobaan ini adalah temperatur kamar, ukuran partikel lolos ayakan 80 mesh dan tertahan pada 120 mesh (-80+120), rasio solid liquid 10/100 g/mL, kecepatan pengadukan 100 rpm dan waktu 30 menit. Unsur torium dalam filtrat dianalisis menggunakan alat
spektofotometer UV-Vis sedangkan unsur tanah jarang dianalisis menggunakan alat spektrofotometer ICP-OES.
Berikut ini merupakan hasil leaching pada variasi konsentrasi asam sulfat yang dapat dilihat pada Tabel 3 di bawah ini.
Tabel 3. Hasil analisis kadar unsur torium dan unsur tanah jarang pada filtrate hasil direct leaching terak timah II variasi konsentrasi asam sulfat.
Perbandingan H2O : H2SO4 (mL) Hasil Perhitungan Torium (mg) UTJ (mg) 1;2,5 2,93 3,58 1;2 3,49 4,21 1;1,5 7,56 5,50 1;1 3,89 3,05 1;0,5 7,50 11,47 2,5;1 8,33 19,22 3;1 9,25 23,93 3,5;1 6,26 39,48 4;1 4,15 44,62
Semakin rendah konsentrasi asam sulfat menyebabkan recovery unsur Th dan UTJ yang didapat semakin tinggi. Recovery pada masing-masing unsur tersebut disimpulkan dalam bentuk recovery yang dapat dilihat pada Gambar 9 di bawah ini.
Gambar 9. Recovery unsur tanah jarang dan torium pada perbandingan konsentrasi asam sulfat
Gambar 9 di atas menjelaskan perbandingan konsentrasi (H2O : H2SO4)
pada nilai (1:2,5) sampai nilai (3:1). Recovery torium pada nilai tersebut sebesar 3,32% sampai 10,48% sedangkan recovery unsur tanah jarang sebesar 0,96% sampai 6,41%. Recovery torium dan unsur tanah jarang pada nilai tersebut mengalami kenaikan hal ini membuktikan bahwa tingkat konsentrasi larutan jika semakin rendah akan meningkatkan recovery torium dan unsur tanah jarang.
Nilai perbandingan (3,5:1) sampai nilai (4:1) recovery torium mengalami penurunan sedangkan unsur tanah jarang mengalami kenaikan, hal ini disebabkan karena kondisi keasaman pada larutan sulfat yang semakin rendah sehingga menyebabkan torium tidak larut dan unsur tanah jarang tidak mengendap.
Menurut Anggraini et al., (2012) bahwa torium akan larut dalam kondisi keasaman yang tinggi sedangkan unsur tanah jarang pada kondisi keasaman yang tinggi akan mengendap. Nilai optimum yang dipilih dilihat dari recovery terbesar yang terdapat pada unsur torium sebesar 7,09% dan unsur tanah jarang sebesar 10,58%.
Persamaan reaksi unsur tanah jarang dan torium pada leaching terak timah secara direct leaching yaitu:
UTJ/ThO(s) + H2SO4(aq) UTJ/ThSO4(aq) + H2O(l) ……….…... (15)
(Febriana et al., 2018)
Torium yang direaksikan dengan asam sulfat akan terlarut sebagai ion Th4+ yang mengikat SO42-. Reaksi yang terjadi yaitu :
Th4+ + 2SO
42- Th(SO4)2(s) ... (16)
Reaksi 2 merupakan reaksi kesetimbangan, dimana tingkat konsentrasi reagen pada proses pelarutan akan meningkatkan jumLah produk. Konsentrasi ion SO4
2-dalam suatu larutan akan meningkat seiring dengan penambahan asam sulfat. Tingkat konsentrasi semakin rendah maka semakin tinggi unsur yang berada di dalam filtrat dan semakin rendah unsur yang berada di dalam endapan (Trinopiawan dan Sumiarti, 2012). Konsentrasi asam sangat menentukan kesempurnaan suatu reaksi, sehingga jumLah asam sulfat yang ditambahkan akan mempengaruhi hasil yang didapatkan (Anggraini et al., 2012).
Menurut Prassanti (2013) peningkatan yang terjadi pada recovery unsur tanah jarang dan unsur radioaktif disebabkan oleh konsentrasi asam sulfat yang semakin banyak sehingga reaktan yang tersedia juga semakin banyak. Tumbukan antar partikel yang terjadi semakin banyak sehingga mengakibatkan kecepatan reaksi meningkat dan recovery yang dihasilkan semakin besar.
Semakin banyak reagen yang ditambahkan pada proses pelarutan maka semakin banyak pula unsur radioaktif dan unsur tanah jarang yang berikatan dengan sulfat (Sumarni et al., 2011).
4.2. Temperatur pada Leaching Terak Timah II dengan Asam Sulfat
Percobaan leaching dilakukan dalam gelas kimia 500 mL, jumLah terak timah dengan larutan asam sulfat adalah 20g/100mL. Kondisi tetap lainnya yaitu ukuran saringan -80+120 mesh, suhu kamar, kecepatan pengadukan 100 rpm, waktu selama 30 menit dan konsentrasi asam sulfat yang digunakan pada perbandingan (3,5:1).
Berikut merupakan data recovery unsur torium dan unsur tanah jarang hasil
leaching pada variasi temperatur yang disajikan pada Tabel 4 di bawah ini.
Tabel 4. Hasil analisis kadar unsur torium dan unsur tanah jarang pada filtrat hasil direct leaching terak timah II variasi temperatur.
Temperatur ᵒC Hasil Perhitungan Torium (mg) UTJ (mg) 40 5,93 67,58 50 6,73 68,75 60 6,78 66,08 70 5,62 62,33 80 3,22 77,23 90 2,27 12,06
Proses leaching dilakukan dengan variasi berbagai temperatur (0C), variasi tersebut dilakukan agar dapat diketahui kondisi optimum pada variasi berbagai temperatur yang memberikan hasil recovery terbesar dalam proses leaching. Data unsur torium dan unsur tanah jarang pada Tabel 4 dapat disimpulkan dalam bentuk recovery yang dapat dilihat pada Gambar 10 di bawah ini.
Gambar 10. Recovery unsur tanah jarang dan torium pada berbagai variasi temperatur.
Proses leaching dilakukan dengan variasi temperatur, variasi dilakukan agar dapat diketahui temperatur optimum yang dapat memberikan hasil recovery terbesar dalam proses leaching. Recovery pada unsur tanah jarang mengalami kenaikan dari suhu ambien sebesar 11,28% hingga suhu 800C sebesar 23,05% sedangkan Recovery unsur torium pada suhu kamar sebesar 7,09% dan mengalami kenaikan hanya sampai suhu 600C sebesar 7,68%.
Semakin tinggi suhu yang digunakan semakin besar recovery yang didapatkan. Menurut Sumarni et al., (2011) pada persamaan Arrhenius menyatakan bahwa temperatur yang tinggi akan meningkatkan nilai konstanta kecepatan reaksi (k), sehingga produk yang didapatkan juga semakin tinggi. Menurut Nuri et al., (2002) dalam reaksi endotermis semakin tinggi temperatur yang digunakan maka recovery semakin besar karena reaksi tersebut memerlukan energi.
Persamaan Arrhenius yaitu: k =A.exp. (-E/RT) dengan k adalah konstanta laju reaksi, A adalah konstanta integrasi/faktor frekuensi, E adalah energi aktivasi
(kal/mol), R merupakan tetapan gas ideal (1,987 kal/mol.K), dan T adalah temperature (Sajima, 2018). Menurut Zanonato et al., (2016) meningkatnya konstanta kecepatan reaksi (k) pada suhu tinggi juga disebabkan oleh meningkatnya derajat ionisasi air.
Kenaikan temperatur menyebabkan banyak bergerak atau energi kinetik partikel bertambah sehingga menyebabkan tumbukan lebih sering terjadi dan kemungkinan terjadinya tumbukan efektif sehingga mampu menghasilkan reaksi yang sangat besar. Temperatur juga dapat mempengaruhi energi potensial suatu zat, jika suatu zat energi potensialnya kecil maka akan sukar menghasilkan tumbukan yang diakibatkan zat tersebut tidak mampu melampaui energi aktivasi (Haryono, 2017).
Penurunan hasil recovery analisis unsur torium pada suhu 70-90 0C yang sebesar 6,36 - 2,58% dan unsur tanah jarang pada temperatur 900C sebesar 3,77% disebabkan karena semakin tinggi suhu yang digunakan pada proses leaching terak timah II, pelarut yang digunakan mengalami penguapan. Penguapan tersebut mengakibatkan pelarut semakin berkurang sehingga filtrat yang dihasilkan akan semakin sedikit serta mempengaruhi hasil recovery unsur torium dan unsur tanah jarang. Menurut Saleh et al., (2015) penurunan recovery dalam mendekomposisi terak disebabkan oleh penguapan selama proses pelarutan berlangsung.
4.3 Ukuran Butiran pada Leaching Terak Timah II dengan Asam Sulfat Percobaan leaching terak timah II dilakukan dalam gelas kimia 500 mL dengan jumLah terak timah dengan asam sulfat adalah 20g/100mL. Kondisi tetap yang digunakan meliputi konsentrasi perbandingan air:asam sulfat (3,5:1), ukuran partikel lolos ayakan 80 mesh dan tertahan pada 120 mesh (-80+120), kecepatan pengadukan 100 rpm, suhu 600C dan waktu selama 30 menit.
Berikut merupakan data recovery unsur torium dan unsur tanah jarang hasil
leaching pada variasi ukuran butiran yang disajikan pada Tabel 5 di bawah ini.
Tabel 5. Hasil analisis kadar unsur torium dan unsur tanah jarang pada filtrat hasil direct leaching terak timah II variasi ukuran butiran.
Ukuran saringan (mesh) Hasil Perhitungan Torium (mg) UTJ (mg) -80+120 7,87 82,77 -120+150 7,34 134,08 -150+230 8,49 155,98 -230+325 9,47 190,59 -325 6,19 186,58
Proses leaching dilakukan dengan variasi berbagai ukuran butiran partikel (mikrometer), variasi tersebut dilakukan agar dapat diketahui kondisi optimum pada ukuran butiran partikel yang memberikan hasil recovery terbesar dalam proses leaching. Data unsur torium dan unsur tanah jarang pada Tabel 5 di atas dapat disimpulkan dalam bentuk recovery yang dapat dilihat pada Gambar 11 di bawah ini.
Gambar 11. Recovery unsur tanah jarang dan torium pada berbagai variasi ukuran butiran.
Recovery torium dan unsur tanah jarang variasi ukuran butiran yang lolos
ayakan pada saringan 80 mesh dan tertahan pada 120 mesh (-80+120) hingga ukuran butiran yang lolos ayakan pada saringan 230 mesh dan tertahan pada 325 mesh 230+325) mengalami kenaikan. Recovery torium pada ukuran butiran (-80+120) mesh hingga (-230+325) mesh sebesar 3,19 - 9,52% sedangkan recovery unsur tanah sebesar 20,34 - 41,42%. Menurut Prassanti (2013) semakin halus ukuran butiran maka recovery yang dihasilkan akan semakin besar, hal ini disebabkan karena permukaan yang luas mengakibatkan pertumbukan antar partikel semakin banyak sehingga reaksi pun berlangsung lebih cepat dan sempurna.
Recovery ukuran butiran partikel yang tertahan pada saringan 325 mesh
mengalami penurunan, hal ini dapat disebabkan oleh ukuran partikel yang semakin halus dan cenderung dapat membentuk gumpalan sehingga dapat menurunkan luas permukaan kontak antara terak timah dan larutan asam sulfat. Menurut Behera et a.(2017) ukuran partikel yang semakin halus memiliki celah
yang lebih sedikit untuk berdifusi dalam proses leaching. Menurut Prassanti (2013) ukuran butiran partikel yang tertahan pada 325 mesh mengalami penurunan, kemungkinan besar disebabkan oleh unsur-unsur pengotor yang ikut bereaksi dengan asam sulfat, sehingga dapat menurunkan hasil recovery.
Nilai optimum pada variasi ukuran butiran partikel dilihat dari kedua grafik unsur tersebut. Nilai optimum pada variasi ukuran butiran partikel dilihat dari hasil recovery tertinggi yang terdapat pada ukuran saringan (-230+325) mesh dengan recovery torium sebesar 52% dan unsur tanah jarang sebesar 41,42%.
4.4 Rasio Solid Liquid (g/mL) pada Leaching Terak Timah II dengan Asam Sulfat
Percobaan leaching dengan variasi rasio solid liquid (g/mL) yang digunakan yaitu 5/100, 10/100, 15/100, 20/100, 25/100, 30/100, 40/100 50/100. Variabel tetap yaitu konsentrasi air:asam sulfat (3,5:1), ukuran saringan (-230+325) mesh, suhu 60 0C, kecepatan pengadukan 100 rpm dan waktu selama 30 menit. Berikut merupakan data recovery unsur torium dan unsur tanah jarang hasil leaching pada variasi rasio solid liquid yang disajikan pada Tabel 6 di bawah ini.
Tabel 6. Hasil analisis kadar unsur torium dan unsur tanah jarang pada filtrat hasil direct leaching terak timah II variasi raso solid liquid.
Solid Liquid (g/mL) Hasil Perhitungan Torium (mg) UTJ (mg) 5 9,69 53,50 10 12,89 103,07 15 10,46 119,97 20 9,47 190,59 25 7,70 127,24 30 6,64 125,11 40 3,66 66,24 50 2,80 63,46