BAB IV
MANIFESTASI PERMUKAAN PANASBUMI DI DATARAN TINGGI
DIENG DAN SEKITARNYA
4.1 Tinjauan umum
Sistem panasbumi yang ada di Indonesia umumnya berasal dari sistem afiliasi volkanik. Sistem ini ditandai dengan adanya kenampakan berupa manifestasi permukaan yang berada di sekitar daerah tersebut. Menurut Hochstein dan Browne (2000) manifestasi permukaan secara langsung akan banyak ditemukan pada sistem panasbumi yang memiliki temperatur tinggi (> 220 0C). Manifestasi yang berasal dari sistem dengan afiliasi volkanik umunya berupa solfatara, fumarola, danau kawah asam, mata air panas, dan yang jarang ditemukan berupa aliran sungai asam, manifestasi ini berada di daerah pusat volkanik. Pada daerah dengan elevasi yang lebih rendah akan dijumpai mata air dengan temperatur sedang yang memiliki karakter seperti pH yang netral, air klorida, dan air bikarbonat (Hochstein dan Browne, 2000).
4.2 Tujuan penelitian
Tujuan dari penelitian adalah mengetahui asal fluida panasbumi dan proses yang terjadi di bawah permukaan, menduga potensi skaling, menghitung hilang panas alamiah, mengetahui karakteristik fluida panasbumi di reservoir dan menduga hubungan antara sistem panasbumi di daerah penelitian dengan aktivitas volkanisme di sekitarnya.
4.3 Analisis data
4.3.1 Lokasi studi khusus
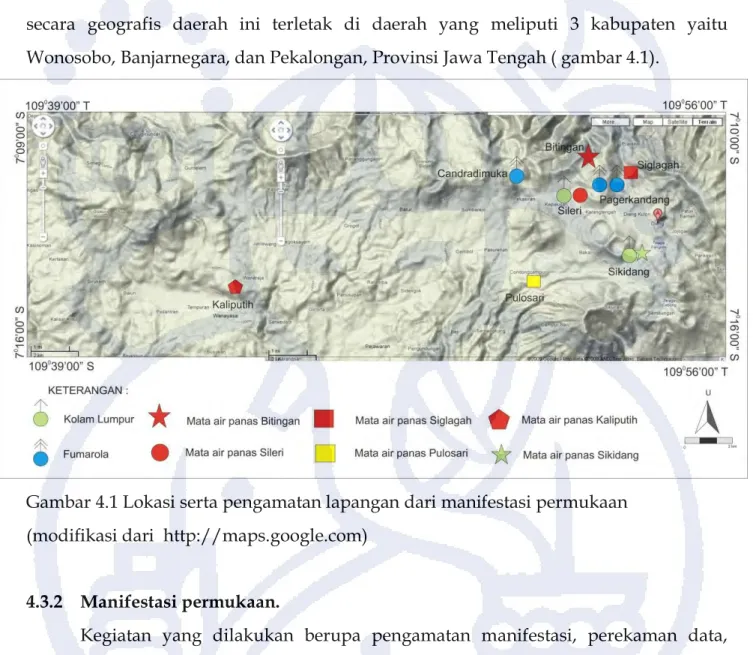
Lokasi untuk manifestasi permukaan berada lebih luas dari daerah pemetaan geologi, yaitu pada koordinat 70 09’00” - 7016’00”LS dan 109039’00” – 109056’00”BT,
secara geografis daerah ini terletak di daerah yang meliputi 3 kabupaten yaitu Wonosobo, Banjarnegara, dan Pekalongan, Provinsi Jawa Tengah ( gambar 4.1).
Gambar 4.1 Lokasi serta pengamatan lapangan dari manifestasi permukaan (modifikasi dari http://maps.google.com)
4.3.2 Manifestasi permukaan.
Kegiatan yang dilakukan berupa pengamatan manifestasi, perekaman data, pengambilan sampel air untuk selanjutnya dianalisis kimia airnya.
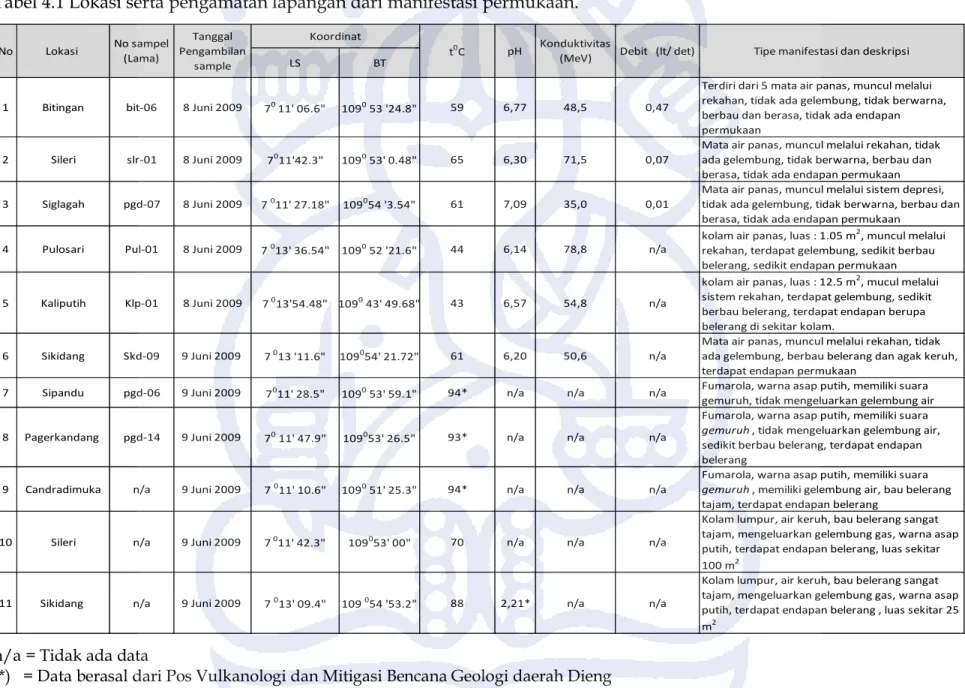
Hasil yang didapatkan dari pengamatan di lapangan terdapat 11 manifestasi panasbumi yang diidentifikasi dari daerah penelitian, terdiri dari 6 mata air panas, 3 fumarola, dan 2 kolam lumpur yang terangkum dalam tabel 4.1.
Tabel 4.1 Lokasi serta pengamatan lapangan dari manifestasi permukaan.
LS BT
1 Bitingan bit-06 8 Juni 2009 70 11' 06.6" 1090 53 '24.8" 59 6,77 48,5 0,47
Terdiri dari 5 mata air panas, muncul melalui rekahan, tidak ada gelembung, tidak berwarna, berbau dan berasa, tidak ada endapan permukaan
2 Sileri slr-01 8 Juni 2009 7011'42.3" 1090 53' 0.48" 65 6,30 71,5 0,07
Mata air panas, muncul melalui rekahan, tidak ada gelembung, tidak berwarna, berbau dan berasa, tidak ada endapan permukaan 3 Siglagah pgd-07 8 Juni 2009 7 011' 27.18" 109054 '3.54" 61 7,09 35,0 0,01
Mata air panas, muncul melalui sistem depresi, tidak ada gelembung, tidak berwarna, berbau dan berasa, tidak ada endapan permukaan
4 Pulosari Pul-01 8 Juni 2009 7 013' 36.54" 1090 52 '21.6" 44 6,14 78,8 n/a
kolam air panas, luas : 1.05 m2, muncul melalui
rekahan, terdapat gelembung, sedikit berbau belerang, sedikit endapan permukaan
5 Kaliputih Klp-01 8 Juni 2009 7 013'54.48" 1090 43' 49.68" 43 6,57 54,8 n/a
kolam air panas, luas : 12.5 m2, mucul melalui sistem rekahan, terdapat gelembung, sedikit berbau belerang, terdapat endapan berupa belerang di sekitar kolam.
6 Sikidang Skd-09 9 Juni 2009 7 013 '11.6" 109054' 21.72" 61 6,20 50,6 n/a
Mata air panas, muncul melalui rekahan, tidak ada gelembung, berbau belerang dan agak keruh, terdapat endapan permukaan
7 Sipandu pgd-06 9 Juni 2009 7011' 28.5" 1090 53' 59.1" 94* n/a n/a n/a Fumarola, warna asap putih, memiliki suara gemuruh, tidak mengeluarkan gelembung air
8 Pagerkandang pgd-14 9 Juni 2009 70 11' 47.9" 109053' 26.5" 93* n/a n/a n/a
Fumarola, warna asap putih, memiliki suara gemuruh , tidak mengeluarkan gelembung air, sedikit berbau belerang, terdapat endapan belerang
9 Candradimuka n/a 9 Juni 2009 7 011' 10.6" 1090 51' 25.3" 94* n/a n/a n/a
Fumarola, warna asap putih, memiliki suara gemuruh , memiliki gelembung air, bau belerang tajam, terdapat endapan belerang
10 Sileri n/a 9 Juni 2009 7 011' 42.3" 109053' 00" 70 n/a n/a n/a
Kolam lumpur, air keruh, bau belerang sangat tajam, mengeluarkan gelembung gas, warna asap putih, terdapat endapan belerang, luas sekitar 100 m2
11 Sikidang n/a 9 Juni 2009 7 013' 09.4" 109 054 '53.2" 88 2,21* n/a n/a
Kolam lumpur, air keruh, bau belerang sangat tajam, mengeluarkan gelembung gas, warna asap putih, terdapat endapan belerang , luas sekitar 25 m2 No Lokasi No sampel (Lama) Tanggal Pengambilan sample Koordinat Konduktivitas
(MeV) Debit (lt/ det) Tipe manifestasi dan deskripsi t0C pH
n/a = Tidak ada data
Gambar 4.2 Mata air panas di (a) Bitingan, (b) Sileri, (c) Siglagah, (d) Pulosari, (e) Kaliputih, (f) Sikidang. Anak panah di (c) menunjukan mata air panas yang tidak
Gambar 4.4 Fumarola di (a) Kawah Pagerkandang, (b) Kawah Siglagah, (c) Kawah Candradimuka.
4.3.3 Geokimia air panas
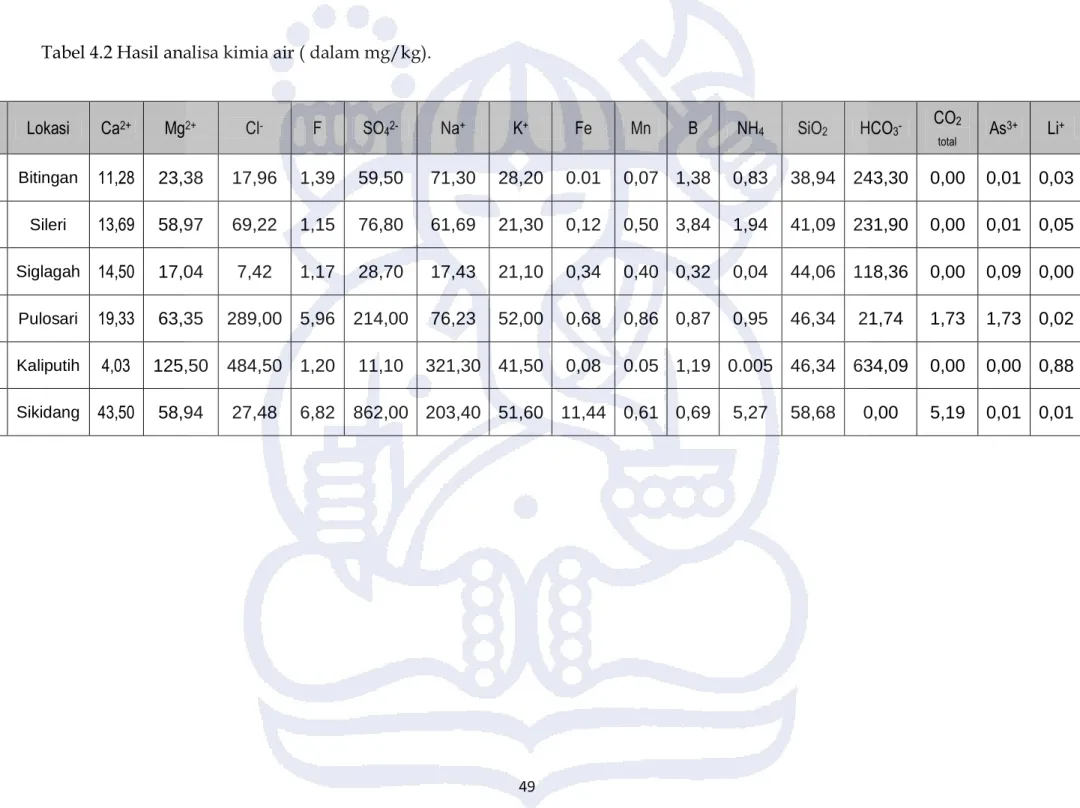
Analisa kimia dilakukan terhadap 6 sampel air panas. Analisa dilakukan melalui dua tahap yaitu pengukuran di lapangan secara langsung untuk mengetahui suhu, pH air, konduktivitas. Dan dari analisa sampel air yang dilakukan di Laboratorium Kimia Air di Program Studi Teknik Lingkungan ITB untuk mengetahui nilai kesadahan (CaCO3), dan 16 unsur yang meliputi anion utama Cl-, SO42- dan HCO3-, dan kation seperti Ca2+, Na+, K+ danMg2+. Analisa juga dilakukan terhadap unsur-unsur netral, seperti SiO2, NH3, dan F, serta unsur kontaminan yang umum dijumpai pada sistem panasbumi, seperti As3+ dan B. Hasil analisa kimia bisa dilihat pada tabel 4.2 dan 4.3.
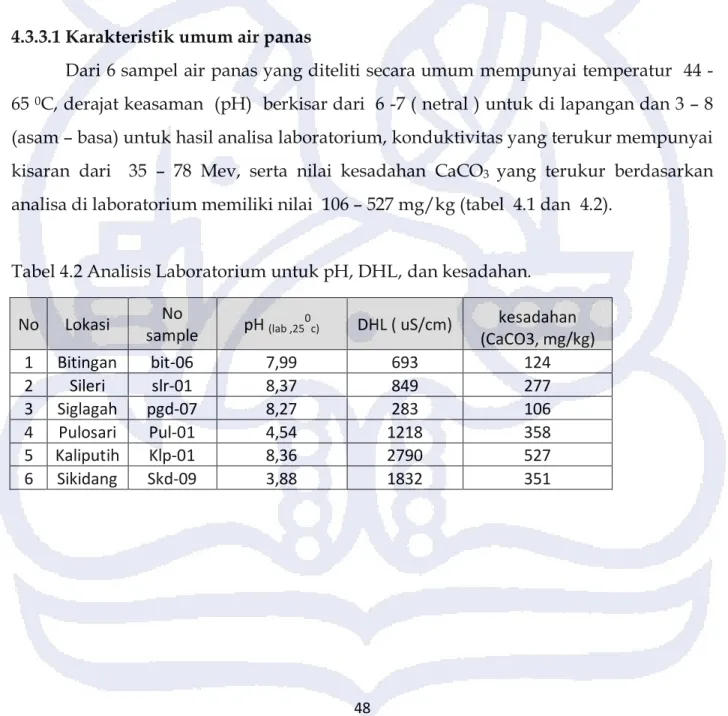
4.3.3.1 Karakteristik umum air panas
Dari 6 sampel air panas yang diteliti secara umum mempunyai temperatur 44 -65 0C, derajat keasaman (pH) berkisar dari 6 -7 ( netral ) untuk di lapangan dan 3 – 8 (asam – basa) untuk hasil analisa laboratorium, konduktivitas yang terukur mempunyai kisaran dari 35 – 78 Mev, serta nilai kesadahan CaCO3 yang terukur berdasarkan analisa di laboratorium memiliki nilai 106 – 527 mg/kg (tabel 4.1 dan 4.2).
Tabel 4.2 Analisis Laboratorium untuk pH, DHL, dan kesadahan.
No Lokasi No sample pH (lab ,25 0 c) DHL ( uS/cm) kesadahan (CaCO3, mg/kg) 1 Bitingan bit-06 7,99 693 124 2 Sileri slr-01 8,37 849 277 3 Siglagah pgd-07 8,27 283 106 4 Pulosari Pul-01 4,54 1218 358 5 Kaliputih Klp-01 8,36 2790 527 6 Sikidang Skd-09 3,88 1832 351
Tabel 4.2 Hasil analisa kimia air ( dalam mg/kg).
No Lokasi Ca2+ Mg2+ Cl- F SO42- Na+ K+ Fe Mn B NH4 SiO2 HCO3- CO2
total As 3+ Li+ 1 Bitingan 11,28 23,38 17,96 1,39 59,50 71,30 28,20 0.01 0,07 1,38 0,83 38,94 243,30 0,00 0,01 0,03 2 Sileri 13,69 58,97 69,22 1,15 76,80 61,69 21,30 0,12 0,50 3,84 1,94 41,09 231,90 0,00 0,01 0,05 3 Siglagah 14,50 17,04 7,42 1,17 28,70 17,43 21,10 0,34 0,40 0,32 0,04 44,06 118,36 0,00 0,09 0,00 4 Pulosari 19,33 63,35 289,00 5,96 214,00 76,23 52,00 0,68 0,86 0,87 0,95 46,34 21,74 1,73 1,73 0,02 5 Kaliputih 4,03 125,50 484,50 1,20 11,10 321,30 41,50 0,08 0.05 1,19 0.005 46,34 634,09 0,00 0,00 0,88 6 Sikidang 43,50 58,94 27,48 6,82 862,00 203,40 51,60 11,44 0,61 0,69 5,27 58,68 0,00 5,19 0,01 0,01
Kesetimbangan Ion
Sebelum dilakukan pengolahan dan analisis data perlu dilakukan uji kualitas terhadap data yang diperoleh sehingga terjamin kelayakan data tersebut dan dapat diintrepetasikan lebih lanjut. Menurut Nicholson (1993), salah satu metoda yang digunakan untuk menguji kelayakan data adalah dengan mengunakan kesetimbangan ion, metoda ini dilakukan dengan cara menghitung jumlah Meq antara kation dan anion yang ada pada sampel. Data yang diuji dikatakan baik jika nilai kesetimbangan ion tidak lebih dari 5 % (Nicholson, 1993) (tabel 4.1).
Perhitungan keseimbangan ion dilakukan dengan menggunakan persamaan berikut (Nicholson, 1993) :
Anion/Kation (meq) = ( konsentrasi (mg/L) / massa atom ) x bilangan oksidasi unsur
Setelah mengubah satuan mg/kg ke meq, berikutnya data tersebut diformulasikan ke dalam persamaan keseimbangan ion di bawah ini (Nicholson, 1993) Σ anion (meq) = Σ kation (meq)
Σ anion (meq) / Σ kation (meq) [(Σ anion – Σ kation) / (Σ anion +Σ kation)]
(Atom yang dibedakan menjadi anion, kation dan netral ) Anion : Cl-, HCO3-, SO4-2, F-, Br-, I-
Kation : Na+, K+, Li+, Ca+2, Mg+2, Rb+, Cs+, Mn+, Fe+ Netral : SiO2, NH3, As, B, gas Nobel
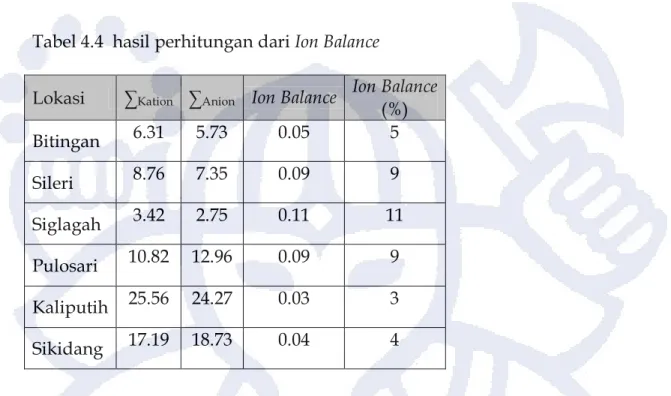
Tabel 4.4 hasil perhitungan dari Ion Balance
Lokasi ∑Kation ∑Anion Ion Balance Ion Balance (%) Bitingan 6.31 5.73 0.05 5 Sileri 8.76 7.35 0.09 9 Siglagah 3.42 2.75 0.11 11 Pulosari 10.82 12.96 0.09 9 Kaliputih 25.56 24.27 0.03 3 Sikidang 17.19 18.73 0.04 4
Hasil dari perhitungan ion balance memiliki nilai 4 – 11 %. Daerah yang memiliki nilai kurang hingga sama dengan 5% terletak di Kaliputih, Bitingan dan Sikidang, sedangkan sisanya memiliki nilai lebih dari 5%. Hasil analisa dikatakan layak jika mempunyai nilai ion balance kurang hingga sama dengan 5 %. Hasil analisa ini ditunjukan oleh air panas yang keluar di Kaliputih, Bitingan dan Sikidang. Meskipun demikian, tidak berarti bahwa hasil analisa air panas lain yang mempunyai kesetimbangan ion di atas 5% tidak layak digunakan dalam interpretasi, kesetimbangan ion yang tinggi dipengaruhi juga oleh tipe dan proses yang dialami air panas (Nicholson, 1993). Nilai kesetimbangan ion di atas 5% diperkirakan akibat adanya pencampuran dengan air meteorik di permukaan atau dengan batuan sekitarnya.
4.3.3.2 Tipe air panas
Tipe air panas ditentukan berdasarkan kandungan relatif anion Cl, SO4, dan HCO3 seperti pada gambar 4.6. Pada daerah penelitian, air panas yang merupakan tipe campuran klorida dan sulfat keluar sebagai mata air panas Pulosari, sedangkan air yang telah mengalami pelarutan dengan bikarbonat ada di mata air panas Kaliputih. Air panas Sikidang memiliki tipe air sulfat dan air panas lainnya memiliki tipe bikarbonat. Meskipun air panas tersebut dipengaruhi oleh asam bikarbonat dan sulfat,
derajat keasaman air panas di daerah penelitian menunjukkan pH di lapangan memiliki nilai sekitar 6 – 7 (tabel 4.1), tetapi menjadi sedikit basa (7,99-8,37) pada temperatur 25°C kecuali pada Mata air panas Pulosari yang memiliki pH 4,54 dan pada Mata air panas Sikidang yang memiliki pH 3,88 pada temperatur 25°C.
Gambar 4.6 diagram Cl-HO3-SO4, umumnya mempunyai tipe bikarbonat.
Air bikarbonat yang terdapat di mata air panas Bitingan, Sileri, Siglagah menandakan terbentuk pada kondisi daerah yang dangkal, air tersebut terbentuk akibat absorbsi gas CO2 serta kondensasi uap air ke dalam air tanah (steam heated water). Air sulfat yang terdapat pada mata air panas Sikidang menandakan terbentuk di bagian paling dangkal dari permukaan, air tersebut terbentuk akibat kondensasi uap air kedalam air meteorik (steam heated water) atau akibat oksidasi H2S pada zona oksidasi dan membentuk H2SO4. Sedangkan untuk air campuran klorida sulfat yang terdapat di mata air panas Pulosari diduga berasal dari campuran air reservoir dengan kondensat. Air yang berasal dari pelarutan klorida bikarbonat pada mata air panas Kaliputih
terbentuk pada kondisi campuran air meteorik yang mengalami kondensasi uap air ke dalam air tanah (steam heated water).
4.3.3.3 Sumber air panas dan reservoir
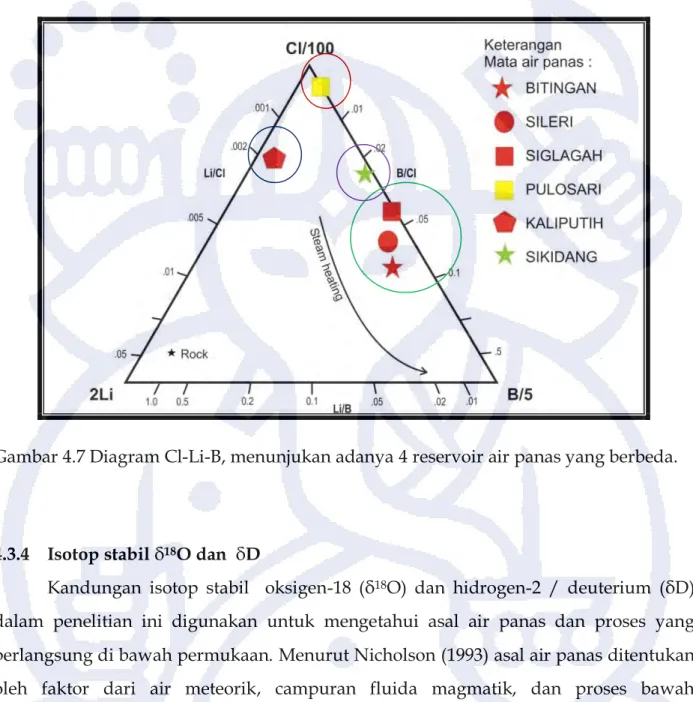
Sumber air yang keluar sebagai mata air panas ditentukan berdasarkan kandungan relatif anion Cl, Li, dan B seperti pada gambar 4.7. Berdasarkan diagram Cl-Li-B, daerah penelitian terbagi atas 4 sumber/reservoir yang berbeda. Reservoir yang pertama adalah yang membentuk mata air panas Pulosari. Mata air ini memiliki nilai Cl yang relatif lebih tinggi dibandingkan dengan B dan Li, hal ini menandakan pengaruh dari proses vulkanomagmatik. Air dari reservoir yang kedua keluar sebagai mata air panas Kaliputih. Mata air panas ini memiliki rasio B/Cl sekitar 0,02 yang menandakan adanya pengaruh dari proses volkanomagmatik tetapi kurang dominan bila dibandingkan dengan air panas Pulosari. Air dari reservoir yang ketiga keluar sebagai mata air panas Bitingan, Sileri, dan Siglagah yang termasuk ke dalam satu kelompok. Mata air panas ini apabila dilihat dari kesamaan nilai Li/B sekitar 0,1- 0,2 menandakan adanya kesamaan reservoir dilihat dari trend steam heating. air dari reservoir yang keempat keluar sebagai mata air panas Sikidang. Mata air panas ini memiliki nilai B/Cl sekitar 0,3 dan dilihat pada gambar 4.7 memiliki reservoir yang berbeda dengan mata air panas lainnya. Perbedaan reservoir air panas juga diperkuat dari pola hidrologi dan perbedaan satuan geologi.
Mata air panas Bitingan, Sileri, Siglagah, Pulosari, dan Sikidang mengandung Li kurang dari 0,1. Hal ini menurut Nicholson (1993) menandakan bahwa air panas tersebut berada di zona Upflow. Sedangkan mata air panas Kaliputih memiliki nilai Li 0,88. Hal ini menurut Nicholson (1993) menandakan bahwa air panas tersebut berada di zona Outflow.
Gambar 4.7 Diagram Cl-Li-B, menunjukan adanya 4 reservoir air panas yang berbeda.
4.3.4 Isotop stabil δ18O dan δD
Kandungan isotop stabil oksigen-18 (δ18O) dan hidrogen-2 / deuterium (δD) dalam penelitian ini digunakan untuk mengetahui asal air panas dan proses yang berlangsung di bawah permukaan. Menurut Nicholson (1993) asal air panas ditentukan oleh faktor dari air meteorik, campuran fluida magmatik, dan proses bawah permukaan meliputi boiling, konduksi, pencampuran, evaporasi dan lain-lain.
Craig (1963) op. cit. Nicholson (1993) menyebutkan, bahwa kandungan δD dalam air panas umumnya sama dengan kandungannya dalam air meteorik lokal, sedangkan kandungan δ18O dalam air panas umumnya lebih positif dibanding air meteorik. Meskipun demikian, adanya pencampuran dengan air magmatik, proses
boiling dan proses lainnya dapat mengakibatkan kandungan isotop stabil δD dan δ18O
Enam sampel air panas yang diteliti dengan menggunakan kandungan isotop stabil δD dan δ18O terdiri dari enam sampel dari dari mata air panas. Hasil analisa dapat dilihat pada tabel 4.5 dan diplot pada gambar 4.8.
Tabel 4.5 komposisi isotop stabil deuterium (δD ) dan oksigen-18 (δ18O) ( dalam ‰)
NO Lokasi Deuterium Oxygen-18
1 Bitingan -46,97 ± 0,3 -7,62 ± 0,2 2 Sileri -49,37 ± 0,8 -6,98 ± 0,4 3 Siglagah -49,57 ± 1,0 -7,59 ± 0,5 4 Pulosari -46,97 ± 0,2 -6,47 ± 0,2 5 Kaliputih -30,87 ± 0,4 -5,03 ± 0,1 6 Sikidang -38,97 ± 0,9 -2,46 ± 0,4
4.3.4.1 Kandungan Isotop δ18O dan δD air panas
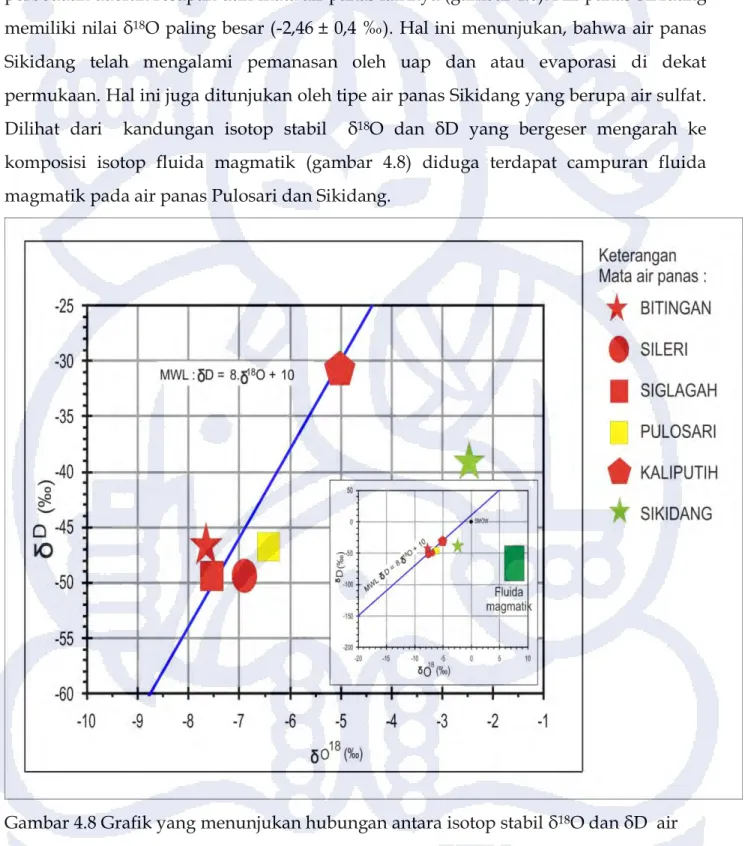
Air panas yang diteliti mempunyai kandungan isotop stabil δD antara -30,87 dan -49,57 ‰ dan isotop stabil δ18O antara -2,46 dan -7,62 ‰ ( tabel 4.5). Kandungan isotop stabil terendah terletak di Kaliputih. Sedangkan kandungan isotop tertinggi terletak di Siglagah dan Sileri (gambar 4.8).
4.3.4.2 Asal air panas
Grafik hubungan antara isotop stabil δD dan δ18O seperti yang ditunjukan pada gambar 4.8 memperlihatkan bahwa air panas di daerah penelitian umumnya mempunyai kandungan isotop δD dan δ18O yang menyerupai kandungan isotop stabil air metorik (garis air metorik global). Sedikit pergeseran kandungan isotop δ18O antara air meteorik dan air panas menunjukan bahwa sistem panasbumi telah berinteraksi dengan batuan sekitannya dan mencapai kesetimbangan (Nicholson,1993). Mata air
Kaliputih memiliki nilai δ18O -30,84±0,4 dan δD -5,03±0,1 menunjukan adanya perbedaan daerah resapan dari mata air panas lainnya (gambar 4.8). Air panas Sikidang memiliki nilai δ18O paling besar (-2,46 ± 0,4 ‰). Hal ini menunjukan, bahwa air panas Sikidang telah mengalami pemanasan oleh uap dan atau evaporasi di dekat permukaan. Hal ini juga ditunjukan oleh tipe air panas Sikidang yang berupa air sulfat. Dilihat dari kandungan isotop stabil δ18O dan δD yang bergeser mengarah ke komposisi isotop fluida magmatik (gambar 4.8) diduga terdapat campuran fluida magmatik pada air panas Pulosari dan Sikidang.
Gambar 4.8 Grafik yang menunjukan hubungan antara isotop stabil δ18O dan δD air panas di daerah penelitian, menunjukan air panas memiliki nilai yang hampir sama
4.3.4.3 Proses bawah permukaan
Interaksi dengan batuan sekitarnya hingga mencapai kesetimbangan menjadi proses bawah permukaan yang mempengaruhi kandungan mata air panas yang keluar di daerah penelitian. Hal ini mengakibatkan kandungan isotop stabil δ18O dan δD cenderung tidak berubah (Nicholson, 1993). Hanya pada mata air panas Sikidang yang dipengaruhi oleh evaporasi (steam heating).
4.3.5 Geotermometer
Geotermometer digunakan untuk menghetaui temperatur reservoir atau bawah permukaan. Perhitungan geotermometer ditentukan dengan dua metoda, yaitu :
a) Dengan melihat manifestasi fumarola kering
Manifestasi berupa fumarola kering (dry fumarol) yang memiliki ciri-ciri kering dan mengeluarkan suara gemuruh terdapat pada Fumarola Pagerkandang dan Sipandu. Menurut Hochstein dan Browne (2000), fumarola kering (dry fumarol) menunjukan temperatur reservoir panasbumi ≥ 225 0C. Dengan demikian dapat diinterpretasikan, bahwa daerah panasbumi di Pagerkandang dan Sipandu memiliki temperatur reservoir ≥ 225 0C.
b) Dengan menggunakan geotermometer Na-K-Ca
Geotermometer Na-K-Ca digunakan untuk menghitung temperatur reservoir pada daerah penelitian, karena air panas pada daerah ini telah mengalami interaksi dengan batuan sekitar dan memiliki kandungan Ca yang tinggi. Perhitungan geotermometer Na-K-Ca menggunakan rumus sbb:
TNa-K-Ca (oC)Fournier (1979) = (1647/(log(Na/K) + [β x log √(Ca/Na)] + 2.24)) – 273
Keterangan:
Na, K, dan Ca = konsentrasi Na, K, Ca dalam mg/kg β = 4/3 apabila ToC < 100 0C
β = 1/3 apabila ToC > 100 0C
Air panas yang digunakan untuk perhitungan geotermometer adalah tipe air klorida (Cl), karena air klorida yang memiliki pH sekitar netral merupakan air yang berasal dari reservoir. Pada daerah penelitian, air panas yang bertipe klorida hanyalah air panas Pulosari yang mengalami campuran dengan air sulfat (Gambar 4.6). Berdasarkan perhitungan geotermometer Na-K-Ca, reservoir air panas daerah penelitian mempunyai temperatur sekitar 295°C
Berdasarkan kedua metoda pendugaan di atas didapatkan, bahwa temperatur panasbumi di daerah penelitian adalah diatas 225 0C, mungkin mencapai 300 0C
4.3.6 Kehilangan panas alamiah total (total natural heat loss)
Kehilangan panas alamiah total (total natural heat loss) digunakan untuk mengetahui seberapa besar potensi cadangan panasbumi di daerah penelitan. Perhitungan untuk kehilangan panas alamiah total adalah penjumlahan dari perhitungan yang berdasarkan kenampakan manifestasi berupa mata air panas, kolam air panas, fumarola, dan kolam lumpur.
Perhitungan untuk kehilangan panas alamiah dihitung berdasarkan rumus (Hochstein, 1994) :
dengan :
m =mass flow rate (kg/s) = V.ρf c = specific heat capacity (kJ/kg K)= 4,2 kJ/kg K ρf = densitas fluida (kg/m3) T = temperatur mata air panas (0C)
V = volume flowrate (m3/s) T0 = temperatur udara rata-rata = 200C hfT, hfT0 = entalpi fluida (kJ/kg)
Tabel 4.6 Hasil perhitungan kehilangan panas alamiah
No Lokasi Jenis Manifestasi
Kehilangan panas alamiah
( KW)
1 Bitingan Mata air 75,24
2 Sileri Mata air 13,16
3 Siglagah Mata air 1,70
4 Pulosari Kolam air panas 0,00
5 Kaliputih Kolam air panas 0,02
6 Sikidang Mata air 0,05
7 Sipandu Dry Fumarol 32,71
8 Pagerkandang Dry Fumarol 32,71
9 Candradimuka Wet Fumarol 39,02
10 Sileri Hot Pools 1700,00
11 Sikidang Hot Pools 550,00
kehilangan panas
Sehingga kehilangan panas alamiah totalnya (total natural heat loss) = 2445,02 kW ≈ 2,4 MW. Menurut Hochstein (1994), kehilangan panas alamiah yang menunjukan sistem temperatur tinggi adalah 30 -300 MW. Meskipun hilang panas alamiah daerah penelitian sekitar 2,4 MW, sistem ini termasuk ke dalam sistem temperatur tinggi dilihat dari kenampakan manifestasi fumarol yang hanya hadir pada sistem panasbumi temperatur tinggi.
4.3.7 Potensi skaling
Skaling adalah mekanisme pengerakan yang terjadi pada sumur saat fluida panasbumi akan dieksploitasi, skaling yang umumnya terbentuk adalah silika, kalsit dan anhidrit. Potensi skaling bisa diprediksi berdasarkan solubilitas mineral kuarsa, kalsit dan anhydrit. Pada bagian ini hanya pembentukan skaling kalsit yang dikaji. Solubilitas kalsit akan meningkat sejalan dengan menurunya temperatur.
Mata air panas yang digunakan adalah air panas Pulosari, karena berupa tipe air panas campuran klorida sulfat yang berasal dari reservoir (tabel 4.7), kemudian diplot kedalam kurva perubahan solubilitas dan temperatur (gambar 4.9)
Tabel 4.7. Nilai kesadahan (CaCO3) untuk temperatur permukaan, boiling, reservoir. Nilai CaCO3 saat boiling dan di reservoir dihitung berdasarkan mass dan heat balance (Nicholson,1993)
No t0C kesadahan (CaCO3, mg/kg) 1 44 358 2 100 320 3 290 197
Gambar 4.9 Kurva perubahan solubilitas kalsit ( CaCO3) dengan temperatur dan tekanan gas CO2 yang berbeda ( Annorson 1989, op.cit. Nicholson, 1993)
Berdasarkan kurva solubilitas kalsit ( CaCO3) dengan temperatur dan tekanan dari CO2 (gambar 4.9), fluida panasbumi di daerah penelitian mempunyai potensi untuk menimbulkan skaling. Hal ini ditunjukan oleh kandungan CaCO3 hasil perhitungan yang lebih besar dibandingkan solubilitas CaCO3 (gambar 4.9).
4.3.8 Model Sistem Panasbumi
Berdasarkan dari tipe air panas, asal air panas serta geotermometer yang didapatkan dan dikorelasikan dengan peta geologi maka akan didapatkan sistem panasbumi seperti pada gambar 4.10, berdasarkan kenampakan manifestasi yang ada diperkirakan resevoir dan sumber panas berada di bawah dari manifestasi fumarol yang berada di Gunung Pagerkandang.
4.3.9 Resume
Berdasarkan data hidrogeokimia pada 6 lokasi mata air panas yang diidentifikasi di daerah penelitian, yaitu Bitingan, Siglagah, Sileri, Pulosari, Kaliputih dan Sikidang, didapatkan kesimpulan sebagai berikut:
Secara umum, air panas di daerah penelitian mempunyai temperatur air di permukaan yang hangat hingga panas, yaitu 44 hingga 65°C, dengan pH netral ( 6 - 7)
Tipe air panas berdasarkan kandungan relatif Cl-HCO3-SO4 menunjukan air panas Pulosari adalah air campuran klorida dan sulfat, air panas Kaliputih adalah air pelarutan klorida dengan bikarbonat, air panas Sikidang merupakan air sulfat, dan air panas lainnya berupa air bikarbonat.
Daerah penelitian mempunyai 4 reservoir yang berbeda berdasarkan diagram Cl-Li-B. Reservoir dari air panas Pulosari dan Reservoir dari air panas Kaliputih diduga dipengaruhi proses vulkanomagmatik. Reservoir pada air panas Sileri, Bitingan, Siglagah menunjukan adanya proses steam heating. Reservoir dari air panas Sikidang merupakan air meteorik yang sudah mengalami terkondensasi sudah mulai mengalami proses steam heating. Hal ini juga diperkuat dengan hasil analisa kandungan isotop stabil. Asal air panas adalah air meteorik yang mengalami pemanasan, tanpa proses pencampuran dengan air magmatik (gambar 4.1).
Perhitungan geotermometer Na-K-Ca dan kehadiran fumarola menunjukan, bahwa temperatur reservoir panasbumi diperkirakan sekitar 225-295 0C.
Dengan menghitung nilai CaCO3 pada fluida reservoir, dapat diperkirakan, bahwa air panasbumi di daerah penelitian berpotensi untuk membentuk skaling kalsit saat dieksploitasi.
Hilang panas alamiah daerah penelitian sekitar 2,4 MW. Sistem panasbumi ini termasuk ke dalam sistem temperatur tinggi yang ditunjukan dengan kenampakan manifestasi fumarol.