BAB I PENDAHULUAN
1.1Tujuan
Menentukan isoterm adsorbsi menurut Freundlinch bagi proses adsorbsi asam asetat oleh arang.
1.2Latar Belakang Teori 1.2.1 Isoterm Adsorpsi
Adsorpsi adalah gejala pengumpulan molekul-molekul suatu zat pada permukaan zat lain, sebagai akibat dari ketidakjenuhan gaya-gaya pada permukaaan zat tersebut. Dalam adsorpsi digunakan istilah adsorbat dan adsorban, dimana adsorbat adalah substansi yang terjerap atau substansi yang akan dipisahkan dari pelarutnya, sedangkan adsorban adalah merupakan suatu media penyerap yang dalam hal ini berupa senyawa karbon.
Adsorpsi terjadi pada permukaan zat padat karena adanya gaya tarik atom atau molekul pada permukaan zat padat. Molekul-molekul pada permukaan zat padat atau zat cair, mempunyai gaya tarik ke arah dalam, karena tidak ada gaya-gaya lain yang mengimbangi. Adanya gaya-gaya-gaya-gaya ini menyebabkan zat padat dan zat cair, mempunyai gaya adsorpsi. Adsorpsi berbeda dengan absorpsi. Pada absorpsi zat yang diserap masuk ke dalam absorbens sedangkan pada adsorpsi zat yang diserap hanya terdapat pada permukaannya (Sukardjo, 1990).
Adsorbsi dapat dikelompokkan menjadi dua, yaitu : 1. Adsorpsi fisik
Yaitu berhubungan dengan gaya Van der Waals dan merupakan suatu proses bolak – balik apabila daya tarik menarik antara zat terlarut dan adsorben
2. Adsorpsi kimia
Yaitu reaksi yang terjadi antara zat padat dan zat terlarut yang teradsorpsi.
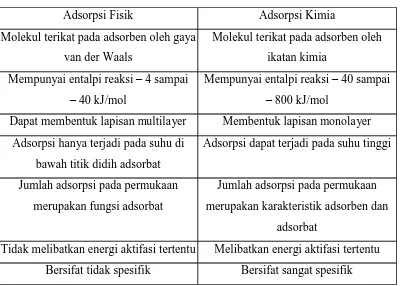
Tabel 1.2.1. Perbedaan adsorpsi fisik dan kimia
Adsorpsi Fisik Adsorpsi Kimia
Molekul terikat pada adsorben oleh gaya van der Waals
Molekul terikat pada adsorben oleh ikatan kimia
Mempunyai entalpi reaksi – 4 sampai – 40 kJ/mol
Mempunyai entalpi reaksi – 40 sampai – 800 kJ/mol
Dapat membentuk lapisan multilayer Membentuk lapisan monolayer
Adsorpsi hanya terjadi pada suhu di bawah titik didih adsorbat
Adsorpsi dapat terjadi pada suhu tinggi
Jumlah adsorpsi pada permukaan merupakan fungsi adsorbat
Jumlah adsorpsi pada permukaan merupakan karakteristik adsorben dan
adsorbat
Tidak melibatkan energi aktifasi tertentu Melibatkan energi aktifasi tertentu
Bersifat tidak spesifik Bersifat sangat spesifik
Proses adsorpsi dalam larutan, jumlah zat teradsorpsi tergantung pada beberapa faktor, yaitu :
a. Jenis adsorben
Apabila adsorbennya bersifat polar, maka komponen yang bersifat polar akan terikat lebih kuat dibandingkan dengan komponen yang kurang polar. b. Jenis adsorbat
c. Luas permukaan adsorben
d. Konsentrasi zat terlarut
Senyawa terlarut memiliki gaya tarik-menarik yang kuat terhadap pelarutnya sehingga lebih sulit diadsorbsi dibandingkan senyawa tidak larut. e. Temperatur
Tingkat adsorbsi naik diikuti dengan kenaikan temperatur dan turun diikuti dengan penurunan temperatur (Atkins, 1990).
1.2.2 Penentuan Adsorpsi Isoterm
Perubahan konsentrasi adsorbat oleh proses adsorpsi sesuai dengan mekanisme adsorpsinya dapat dipelajari melalui penentuan isoterm adsorpsi yang sesuai. Isoterm Langmuir dan Isoterm BET adalah dua diantara isoterm-isoterm adsorpsi yang dipelajari:
1. Isotherm Langmuir
Meskipun terminologi adsorpsi pertama kali diperkenalkan oleh Kayser (1853-1940), penemu teori adsorpsi adalah Irving Langmuir (1881-1957), Nobel laureate in Chemistry (1932). Isoterm adsorpsi Langmuir didasarkan atas beberapa asumsi,yaitu :
(1) Adsorpsi hanya terjadi pada lapisan tunggal (monolayer),
(2) Panas adsorpsi tidak tergantung pada penutupan permukaan, dan (3) Semua situs dan permukaannya
Langmuir mengemukakan bahwa mekanisme adsorpsi yang terjadi adalah sebagai berikut : A(g) + S ↔ AS, dimana A adalah molekul gas dan s adalah permukaan adsorpsi (anonim,2008).
2. Isoterm Branauer, Emmet and Teller (BET)
Isoterm ini berdasar asumsi bahwa adsorben mempunyai nilai permukaan yang homogen. Perbedaan isoterm ini dengan Langmuir adalah BET berasumsi
3. Isoterm Adsorpsi Freundlich
Persamaan isoterm adsorpsi Freundlich didasarkan atas terbentuknya lapisan monolayer dari molekul-molekul adsorbat pada permukaan adsorben. Namun pada adsorpsi Freundlich situs-situs aktif pada permukaan adsorben bersifat heterogen.
Persamaan isoterm adsorpsi Freundlich dapat dituliskan sebagai berikut.
Log (x/m) = log k + 1/n log c
Bagi suatu sistem adsorbsi tertentu, hubungan antara banyaknya zat yang teradsorpsi persatuan luas atau persatuan berat adsorben dengan konsentrasi yang teradsorpsi pada temperatur tertentu disebut dengan isoterm adsorbsi ini dinyatakan sebagai:
x/m = k. Cn dalam hal ini :
x = jumlah zat teradsorbsi (gram) m = jumlah adsorben (gram)
C = konsentrasi zat terlarut dalam larutan, setelah tercapai kesetimbangan adsorpsi
k dan n = tetapan
Maka persamaan diatas menjadi : log x/m = log k + n log c
Persamaan ini mengungkapkan bahwa bila suatu proses adsorbsi menuruti isoterm Freundlich, maka aluran log x/m terhadap log C akan merupakan garis lurus. Dari garis dapat dievaluasi tetapan k dan n (Anonim,2008).
1.2.3 Arang Aktif
pelat-pelat datar yang saling bertumpuk dengan sela-sela di antaranya. Sebagian pori-pori yang terdapat dalam arang masih tertutup oleh hidrokarbon dan senyawa organik lainnya. Komponen arang ini meliputi karbon terikat, abu, air, nitrogen, dan sulfur yang mempunyai luas permukaan dan jumlah pori sangat banyak (Baker 1997).
Karbon aktif dibedakan menjadi 2 berdasarkan fungsinya, yaitu Karbon
DAFTAR PUSTAKA
Anonim.2008. Isoterm Adsorpsi. http://smk3ae.wordpress.com (diakses pada tanggal 22 April 2013)
Anonim.2010. Adsorpsi Isoterm. http://transtutor.com (diakses pada tanggal 22 April 2013).
Atkins PW. 1997. Kimia Fisika. Ed ke-4. Kartohadiprodjo II, penerjemah; Jakarta.
Baker FS, Miller CE, Repik AJ, Tollens ED. 1997. Activated carbon. Di dalam: Ruthven DM, editor. Encyclopedia of Separation Technology, Volume 1 (A kirk-Othmer Encyclopedia). New York: J Wiley.
Perpamsi. 2002. Karbon Aktif (Arang). www.wordpress.com
Sembiring, dkk. 2003. Isoterm Adsorpsi ion Cr3+ oleh abu sekam padi varietas IR 64. Skripsi. Jurusan Pendidikan Kimia FPMIPA Undiksha.
Setyaningsih H. 1995. Pengolahan limbah batik dengan proses kimia dan adsorpsi karbon aktif [tesis]. Jakarta: Program Pascasarjana, Universitas Indonesia.
KATA PENGANTAR
Puji syukur penulis sampaikan kepada Tuhan Yang Maha Esa yang telah memberikan limpahan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan laporan praktikum Kimia Fisika, Isotherm Adsorpsi.
Pada kesempatan ini, kami mengucapkan terima kasih kepada asisten pembinmbing mata kuliah praktikum Kimia-Fisika yang mana telah banyak memberikan arahan sehingga laporan praktikum ini dapat diselesaikan dengan baik.
Kami menyadari dalam menulis makalah ini masih banyak kekurangan, oleh karena itu diharapkan kritik dan saran yang bersifat membangun demi perbaikan penulisan laporan ini.
Pekanbaru, 22 April 2013