TESIS
PERBANDINGAN PEMBERIAN LARUTAN
HYALURONIC ACID
–
CARBOXYMETHYLCELLULOSE
DENGAN LARUTAN
DEXTRAN 40 SECARA INTRAPERITONEAL DALAM
MENURUNKAN KEJADIAN ADHESI
INTRAPERITONEAL PASCALAPAROTOMI PADA
TIKUS WISTAR
CARYL AUGUSTINE JOHANNA
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
TESIS
PERBANDINGAN PEMBERIAN LARUTAN
HYALURONIC ACID
–
CARBOXYMETHYLCELLULOSE
DENGAN LARUTAN
DEXTRAN 40 SECARA INTRAPERITONEAL DALAM
MENURUNKAN KEJADIAN ADHESI
INTRAPERITONEAL PASCALAPAROTOMI PADA
TIKUS WISTAR
CARYL AUGUSTINE JOHANNA NIM . 1014024842
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
DENPASAR
PERBANDINGAN PEMBERIAN LARUTAN
HYALURONIC ACID
–
CARBOXYMETHYLCELLULOSE
DENGAN LARUTAN DEXTRAN 40 SECARA
INTRAPERITONEAL DALAM MENURUNKAN
KEJADIAN ADHESI INTRAPERITONEAL
PASCALAPAROTOMI PADA
TIKUS WISTAR
Tesis untuk memperoleh Gelar Magister
Pada Program Magister, Program Studi Ilmu Biomedik Program Pascasarjana Universitas Udayana
CARYL AUGUSTINE JOHANNA NIM 1014024842
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
DENPASAR
2016
TESIS INI TELAH DISETUJUI
PADA TANGGAL 18 MEI 2016
Mengetahui,
Tesis Ini Telah Diuji pada
Tanggal 18 Mei 2016 Pembimbing I,
Dr. dr. I Ketut Sudartana, SpB-KBD NIP. 196005151988021001
Pembimbing II,
dr. I Made Mulyawan, SpB-KBD NIP. 197111112000121003
Ketua Program Studi Ilmu Biomedik Program Pascasarjana
Universitas Udayana,
Dr. dr. Gde Ngurah Indraguna Pinatih, M.Sc, SpGK NIP. 195805211985031002
Direktur
Program Pascasarjana Universitas Udayana,
Panitia Penguji Tesis Berdasarkan SK Rektor Universitas Udayana,
Nomor : 2125/UN14.4/HK/2016, Tertanggal : 12 Mei 2016
Ketua : Dr. dr. I Ketut Sudartana, SpB-KBD
Anggota :
1. dr. I Made Mulyawan, SpB-KBD
2. dr. I. B. Darma Putra, SpB-KBD
3. Dr. dr. I Ketut Widiana, SpB(K) Onk
4. Dr. dr. Nyoman Putu Riasa, SpBP-RE(K)
UCAPAN TERIMA KASIH
Pertama-tama penulis memanjatkan puji syukur kepada Tuhan Yang Maha
Esa atas berkat dan rahmat–Nya, sehingga penulis dapat menyelesaikan karya
akhir ini dengan baik. Penulis menyadari bahwa tanpa bimbingan, pengarahan,
berharga dari semua pihak, karya akhir ini tidak akan terlaksana dengan baik dan
lancar. Oleh karena itu, pada kesempatan ini penulis menyampaikan rasa terima
kasih yang setulus-tulusnya dan penghargaan yang setinggi-tingginya kepada:
Rektor Universitas Udayana, Prof. Dr. dr. Ketut Suastika, SpPD–KEMD,
dan Dekan Fakultas Kedokteran Universitas Udayana, Prof. Dr. dr. Putu Astawa,
SpOT(K), yang telah memberikan kesempatan dan fasilitas pada penulis untuk
mengikuti dan menyelesaikan Program Pendidikan Dokter Spesialis I di
Universitas Udayana.
Direktur Program Pascasarjana Universitas Udayana, Prof. Dr. dr. A.A.
Raka Sudewi, SpS(K), atas kesempatan yang telah diberikan kepada penulis untuk
menjadi mahasiswa Program Pascasarjana, Program Studi Ilmu Biomedik
Kekhususan Kedokteran Klinik (combined degree).
Ketua Program Studi Ilmu Biomedik Program Pascasarjana Kekhususan
Kedokteran Klinik (combined degree), Dr. dr. Gde Ngurah Indraguna Pinatih,
MSc, Sp.GK, atas kesempatan yang telah diberikan kepada penulis untuk menjadi
mahasiswa Program Pascasarjana Kekhususan Kedokteran Klinik (combined
degree).
Direktur RSUP Sanglah Denpasar, dr. Anak Ayu Sri Saraswati, M.Kes atas
kesempatan dan fasilitas yang diberikan untuk melanjutkan pendidikan di Bagian/
SMF Ilmu Bedah di RSUP Sanglah Denpasar.
Kepala Bagian/ SMF Ilmu Bedah FK UNUD/ RSUP Sanglah, Prof. Dr. dr.
untuk mengikuti Program Pendidikan Dokter Spesialis I di Bagian/ SMF Ilmu
Bedah FK UNUD/ RSUP Sanglah dan telah memberikan dukungan, semangat,
serta masukan selama pembuatan karya akhir ini.
Kepala SMF Bedah Umum FK UNUD/ RSUP Sanglah, dr. I. B. Darma
Putra, SpB-KBD atas kesempatan yang telah diberikan kepada penulis untuk
menyelesaikan karya akhir ini
Pembimbing utama penelitian, Dr. dr. I Ketut Sudartana, SpB-KBD, yang
dengan penuh perhatian dan kesabaran telah memberikan inspirasi, bimbingan,
dan nasehat sehingga mempermudah saya dalam menyelesaikan karya tulis ini.
Pembimbing kedua dalam penelitian ini, dr. I Made Mulyawan, SpB-KBD,
yang telah memberikan bimbingan dan masukan untuk memperlancar
penyelesaian karya akhir ini.
Para penguji karya akhir, Dr. dr. I Ketut Sudartana, SpB-KBD, dr. I Made
Mulyawan, SpB-KBD, dr. I. B. Darma Putra, SpB-KBD, Dr. dr. I Ketut Widiana,
SpB(K)Onk, Dr. dr. Nyoman Putu Riasa, SpBP-RE(K), yang telah banyak
memberikan saran dan masukan untuk penyempurnaan karya akhir ini.
Ketua Program Studi Ilmu Bedah FK UNUD/ RSUP Sanglah, dr. Ketut
Wiargitha, SpB(K) Trauma, dan Sekretaris Program Studi Ilmu Bedah FK
UNUD/ RSUP Sanglah, dr. Putu Anda Tusta Adiputra, SpB(K)Onk, yang
memberikan dukungan dan semangat dalam menyelesaikan pendidikan.
Seluruh Staf Pengajar Departemen/SMF Bedah FK UNUD/ RSUP Sanglah
banyak memberikan bimbingan dan dukungan kepada saya selama mengikuti
pendidikan Bedah Umum dan dalam menyelesaikan karya akhir ini.
Staf pengajar Universitas Udayana, terutama Dr. drh. I.B. Oka Winaya,
MKes, Prof. Dr. drh. I.B. Komang Ardana, MKes, dan Pak Gede Wiranatha yang
setia membantu serta semua pihak yang tidak bisa penulis sebutkan satu persatu
yang juga telah membantu penulis dalam menyelesaikan karya akhir ini.
Orang tua saya, dr. Djohan Zen, Esther Chen, BA, Suami saya dr. Albert
Daru Buwono, putri saya Calysta Emmanuella, atas cinta kasih, motivasi, dan
dukungan yang tiada henti selama saya menjalani pendidikan spesialis ini.
Seluruh sahabat dan rekan PPDS I Bedah Umum atas kerja sama, dukungan
dan bantuannya dalam proses penelitian serta selama proses pendidikan.
Seluruh staf dan paramedis di Instalasi Bedah Sentral RSUP Sanglah,
seluruh staf sekretariat Bedah, serta paramedis di Instalasi Rawat Inap Bedah,
Instalasi Rawat Jalan Bedah RSUP Sanglah Denpasar.
Akhir kata, semoga karya akhir ini dapat bermanfaat,dan penulis memohon
maaf atas segala kekurangan dalam karya akhir ini.
Denpasar, Mei 2016
Caryl Augustine
ABSTRAK
PERBANDINGAN PEMBERIAN LARUTAN HYALURONIC ACID –
CARBOXYMETHYLCELLULOSE DENGANLARUTAN DEXTRAN 40
SECARA INTRAPERITONEALDALAM MENURUNKAN KEJADIAN ADHESIINTRAPERITONEAL PASCALAPAROTOMI
PADATIKUS WISTAR
Latar Belakang : Sembilan puluh tiga persen dari pasien yang menjalani pembedahan abdomen mengalami adhesi intraperitoneal. Adhesi intraperitoneal sangat mempengaruhi kualitas hidup dari jutaan orang dan mengakibatkan pengeluaran biaya yang cukup tinggi di seluruh dunia. Penelitian ini bertujuan untuk membuktikan bahwa pemberian larutan HA – CMC secara intraperitoneal menurunkan kejadian adhesi intraperitoneal.
test untuk data kejadian adhesi, dan, analisis perbandingan rerata untuk membandingkan rerata jumlah makrofag dan fibroblas.
Hasil : Hasil penelitian menunjukkan tidak ada perbedaan kejadian adhesi intraperitoneal antara kelompok perlakuan dengan kelompok kontrol. Adapun pemberian larutan HA-CMC menurunkan infiltrasi makrofag dan fibroblast secara bermakna dibandingkan dengan kontrol.
Kesimpulan : Penelitian ini mendapatkan bahwa pemberian larutan HA-CMC dan pemberian larutan dextran 40 memiliki kemampuan yang sama sebagai antiadhesi. Adapun penelitian lebih lanjut diperlukan sebelum bahan ini dapat diujicobakan pada manusia.
Kata kunci : adhesi intraperitoneal, larutan HA-CMC, makrofag, fibroblas
ABSTRACT
COMPARISON OF INTRAPERITONEAL HYALURONIC ACID – CARBOXYMETHYLCELLULOSE SOLUTION AND DEXTRAN 40
SOLUTION IN DECREASING POST-LAPAROTOMY INTRAPERITONEAL ADHESION RATE IN WISTAR RAT
Background : Ninety three percent of patients undergone abdominal surgery developed intraperitoneal adhesion. Intraperitoneal adhesion affected the quality of life of millions of people and costed large amount of money all over the world. This study aimed to prove that intraperitoneal HA-CMC solution decreased intraperitoneal adhesion rate.
Methods : This is an experimental study with randomized post test only control group design. Twenty 3-month-old male Wistar rats, weighing 200-250 g were placed in controlled and clean cages with free access to food and drink. They were laparatomized under general anesthesia. The caecum of the rats were abraded until spots of haemmorage were seen. Experimental group was given 0,5 cc of HA-CMC solution on the abraded site, while the control group was given 1,5 cc of dextran 40 solution intraperitoneally. The fascia and the skin was then sutured layer per layer. On post-operative day 14, relaparotomy was done to assess the adhesion rate and obtain the abraded caecal tissue to count the infiltrating macrophage and fibroblast. Descriptive statistic analysis using cross table followed by non-parametric inferential statistic analysis using Chi-square test was done to assess the adhesion rate, and, mean comparison analysis was done to assess the means of macrophage and fibroblast.
lowered macrophage and fibroblast infiltration significantly compared to the control group.
Conclusion : This study concluded that HA-CMC solution and dextran 40 solution had the same ability in preventing adhesion. Further study was needed before this solution could be applied on human.
Keywords : intraperitoneal adhesion, HA-CMC solution, macrophage, fibroblast
DAFTAR ISI
Halaman
SAMPUL DALAM ... i
PRASYARAT GELAR ... ii
LEMBAR PERSETUJUAN... iii
PENETAPAN PANITIA PENGUJI ... iv
SURAT PERNYATAAN BEBAS PLAGIAT... v
1.3.2 Tujuan Khusus ... 4
1.4 Manfaat Penelitian ... 5
1.4.1 Manfaat Ilmiah ... 5
1.4.2 Manfaat Klinik ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Adhesi Intraperitoneal dan Epidemiologinya... 6
2.1.1 Adhesi Intraperitoneal ... 6
2.1.2 Epidemiologi Adhesi Intraperitoneal ... 6
2.2 Penyembuhan Peritoneum dan Patofisiologi Adhesi Intraperitoneal7 2.2.1 Penyembuhan Peritoneum ... 7
2.2.2 Patofisiologi Adhesi Intraperitoneal ... 10
2.3 Etiologi dan Faktor Resiko Adhesi Intraperitoneal ... 13
2.4 Konsekuensi dan Derajat dari Adhesi Intraperitoneal ... 14
2.4.1 Konsekuensi Klinis, Ekonomis, dan Medikolegal dari Adhesi Intraperitoneal ... 14
2.4.2 Derajat dari Adhesi Intraperitoneal ... 16
2.5 Pencegahan Adhesi Intraperitoneal ... 18
2.5.1 Pendekatan Pembedahan ... 18
2.5.2 Teknik Pembedahan ... 19
2.5.3 Adjuvan Pembedahan... 20
2.6 Pemisahan Secara Mekanis ... 22
2.6.1 Peran HA-CMC(Hyaluronic acid-Carboxymethylcellulose) dalam Mencegah Adhesi Intraperitoneal ... 24
2.6.1.1Hidrogel Berbasis Polisakarida ... 24
2.6.1.2Hyaluronic acid-Carboxymethylcellulose (HA-CMC) sebagai Hidrogel Berbasis Polisakarida ... 25
2.6.2 Peran Dextran Dalam Mencegah Adhesi Intraperitoneal .. 30
BAB III KERANGKA BERPIKIR, KONSEP, DAN HIPOTESIS PENELITIAN.32 3.1 Kerangka Berpikir ... 32
3.2 Kerangka Konsep ... 35
3.3 Hipotesis Penelitian ... 35
BAB IV METODE PENELITIAN ... 37
4.1 Rancangan Penelitian ... 37
4.2 Tempat dan Waktu Penelitian ... 38
4.2.1 Tempat Penelitian... 38
4.2.2 Waktu Penelitian ... 38
4.3 Penentuan Sumber Data ... 38
4.3.1 Populasi dan Sampel ... 38
4.3.2 Kriteria Eligibilitas ... 38
4.3.2.2Kriteria Eksklusi... 39
4.3.3 Besar Sampel ... 39
4.3.4 Teknik Pengambilan Sampel... 40
4.3.5 Cara Pengumpulan Data ... 41
4.4 Variabel Penelitian ... 41
4.4.1 Klasifikasi Variabel ... 41
4.4.2 Definisi Operasional Variabel ... 41
4.5 Bahan dan Instrumen Penelitian... 43
4.6 Alur Penelitian ... 44
4.7 Skema Alur Penelitian... 46
4.8 Analisis Data ... 47
BAB V HASIL DAN PEMBAHASAN ... 50
5.1 Hasil ... 50
5.1.1 Kejadian Adhesi Intraperitoneal ... 50
5.1.2 Jumlah Infiltrasi Makrofag ... 51
5.1.3 Jumlah Infiltrasi Fibroblas ... 52
5.2 Pembahasan ... 53
5.2.1 Kejadian Adhesi Intraperitoneal ... 53
5.2.2 Jumlah Infiltrasi Makrofag ... 57
5.2.3 Jumlah Infiltrasi Fibroblas ... 59
BAB VI SIMPULAN DAN SARAN ... 61
6.1 Simpulan ... 61
6.2 Saran ... 61
DAFTAR PUSTAKA ... 62
DAFTAR GAMBAR
Halaman
2.1 Keseimbangan antara Plasminogen Aktivator dan Plasminogen Inhibitor.... 11
2.2 Struktur Kimia Hidrogel Polisakarida yang Sering Digunakan: HYAL (Hyaluronic Acid) dan CMC (Carboxymethylcellulose)... 26
3.1 Konsep Penelitian... 35
4.1 Rancangan Penelitian ... 36
DAFTAR TABEL
Halaman
2.1 Faktor-faktor yang Mempengaruhi Kapasitas Fibrinolitik dari Mesotel ... 12
2.2 Sistem Derajat Adhesi Intraperitoneal ... 17
2.3 Sistem Derajat Adhesi Intraperitoneal Berdasarkan Densitas ... 17
2.4 Sistem Derajat Adhesi Intraperitoneal Berdasarkan Area Cedera ... 18
2.5 Sistem Derajat Adhesi Intraperitoneal Berdasarkan Vaskularitas dan Densitas ... 18
2.6 Adjuvan dalam Mencegah Adhesi Postoperatif ... 20
4.1 Tabulasi Silang Gambaran Kejadian Adhesi Intraperitoneal Berdasarkan Kelompok Perlakuan ... 46
5.1 Perbedaan Larutan Anti-adhesi dan Kejadian Adhesi pada Hari ke-14 ... 49
5.2 Jumlah Infiltrasi Makrofag antara Kelompok pada Hari ke-14 ... 50
DAFTAR SINGKATAN
SINGKATAN
ASA : American Society of Anesthesiologit
CARE : Clinical Adhesion Research and Evaluation
CI : Confidence Interval
CMC : Carboxymethylcellulose
ECM : Extracellular Matrix
EGF : Epidermal Growth Factor
FDA : Food and Drug Administration
HA : Hyaluronic Acid
HA-CMC : Hyaluronic Acid - Carboxymethylcellulose
HAPBS : HA with phosphate-buffered-saline
ICAM : Intracellular Adhesion Molecule
IL : Interleukin
IVF : In Vitro Fertilization
MCP : Monocyte Chemotactic Protein
MMP : Matrix Metalloprotease
MPA : Medroxyprogesterone acetate
MPS : Medical Protection Society
NHSLA : National Health Service Ligitation Authority
NK – 1 : Neurokinin-1 receptor
NOCC : N,O-carboxymethyl chitosan
NSAID : Non-Steroidal Anti-Inflammatory Drugs
ORC : Oxidized-regenerated Cellulose
PAI : Plasminogen Activating Inhibitor
PAR : Protease-activated receptor
PF : Preventable Fraction
PMN : Polymorphonuclear
RANTES : Regulated Upon Activation Normal T-Cell Expressed and
Presumably Secreted
RR : Resiko Relatif
SB : Simpangan Baku
SCAR : Surgical and Clinical Adhesion Research
SP : Substance P
TGF : Transforming Growth Factor
TIMP : Tissue Inhibitors of Metalloproteinases
TNF : Tumor Necrotizing Factor
tPA : tissue type Plasminogen Activator
uPA : urokinase-type Plasminogen Activator
uPAI : urokinase Plasminogen Activator Inhibitor
VCAM : Vascular cell adhesion molecule
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Keterangan Kelaikan Etik ... 67
Lampiran 2 Surat Ijin Penelitian ... 68
Lampiran 3 Amandemen Perubahan Judul Penelitian ... 69
Lampiran 4 Makroskopis Kejadian Adhesi Intraperitoneal pada Kelompok Perlakuan (HA-CMC) ... 70
Lampiran 5 Makroskopis Kejadian Adhesi Intraperitoneal pada Kelompok Kontrol (Dextran 40) ... 71
Lampiran 6 Gambaran Histopatologi Caecum Pada Kelompok Perlakuan ... 72
Lampiran 7 Gambaran Histopatologi Caecum Pada Kelompok Kontrol... 73
Lampiran 8 Jumlah Infiltrasi Makrofag Dan Fibroblas pada Hari ke-14... 74
Lampiran 9 Analisis Data... 75
BAB I
PENDAHULUAN
1.1 Latar Belakang
Sembilan puluh tiga persen dari pasien yang menjalani pembedahan
abdomen mengalami adhesi intraperitoneal. Adhesi intraperitoneal sangat
mempengaruhi kualitas hidup dari jutaan orang dan mengakibatkan pengeluaran
biaya yang cukup tinggi di seluruh dunia. Usaha untuk menangani adhesi
intraperitoneal dengan adhesiolisis bahkan diikuti dengan terbentuknya adhesi
kembali. Berbagai usaha telah dilakukan untuk memahami patogenesis
terbentuknya adhesi, dan mencegah atau menurunkan kejadian adhesi.
Adhesi intraperitoneal pertama kali disebutkan pada pemeriksaan
postmortem pada pasien dengan tuberkulosis peritoneal pada tahun 1836.
Beberapa penelitian yang dilakukan pada tahun 1849 menyebutkan bahwa cairan
limfe yang terkoagulasi berubah menjadi adhesi yang berfibrin. Pada tahun 1872,
Bryant melaporkan kasus obstruksi usus halus fatal yang terjadi karena adhesi
intraperitoneal yang terjadi setelah eksisi kista ovarium (Ergul dan Korukluoglu,
2008).
Pada tahun 1994 di Amerika Serikat, adhesiolisis merupakan alasan dari
303.836 pasien dirawat inapkan, menghabiskan biaya sebesar 1,33 milyar dolar,
dan total rawat inap selama 846.415 hari. Adapun pada tahun 2004, sebanyak
342.000 prosedur adhesiolisis telah dilakukan di Amerika Serikat. Bahkan setelah
Diketahui bahwa kematian terjadi pada 3% sampai 5% pasien dengan obstruksi
sederhana, dan meningkat menjadi sebesar 30% jika usus terstrangulasi, nekrosis,
dan perforasi. Sehingga dapat disimpulkan bahwa pencegahan adhesi
intraperitoneal berpotensi memperbaiki hidup dari ratusan ribu warga Amerika
Serikat, dan menghemat pengeluaran biaya sebesar milyaran dolar pertahunnya
(Ergul dan Korukluoglu, 2008).
Di Inggris, dengan bantuan Medical Protection Society (MPS) dan
National Health Service Ligitation Authority (NHSLA), dilakukan pendataan
klaim kasus yang berhubungan dengan adhesi. Dalam periode 1995 sampai 2007,
ditemukan 79 kasus yang berhubungan dengan adhesi, di mana 41 di antaranya
adalah kasus ginekologi, dan 26 sisanya adalah kasus bedah umum. Dari 41 kasus
pembedahan ginekologi, 33 kasus telah ditutup dengan 19 klaim berhasil dan 8
kasus masih belum ditutup. Dari kasus bedah umum, 24 kasus telah ditutup
dengan 10 kasus sukses diklaim, dan 2 kasus masih belum ditutup (Ellis dan
Crowe, 2009).
Sebagai akibat dari adhesi yang terjadi, adhesiolisis menjadi prosedur yang
sering dilakukan. Adapun adhesi ini sering terbentuk kembali, sehingga
pencegahan lebih dipilih (Bove dan Chapelle, 2011). Pencegahan adhesi
intraperitoneal meliputi pencegahan berdasarkan pendekatan operasi
(Laparoskopik versus laparotomi), teknik operasi (konvensional versus
mikrosurgikal), dan adjuvant pembedahan. Terbentuknya adhesi intraperitoneal
masih tidak dapat dihindari walau dengan teknik laparoskopi yang baik,
pembedahan yang dapat mencegah pembentukan adhesi (Kamel, 2010). Banyak
usaha telah dilakukan untuk menemukan bahan kimia ataupun barrier (pelindung)
untuk mencegah adhesi dan rekurensinya. Usaha ini diharapkan dapat mencegah
tingginya morbiditas dan beban ekonomi (Bove dan Chapelle, 2011).
Adapun pemisahan permukaan peritoneum yang terbuka selama proses
penyembuhan merupakan metode yang ideal dalam mencegah adhesi postoperatif.
Hal ini dapat dilakukan dengan instilasi peritoneum (hydrofloatation) atau dengan
menggunakan barrier (pelindung) (Kamel, 2010).
Pemisahan secara instilasi diketahui mengakibatkan komplikasi yang tidak
sedikit. Adapun larutan dextran masih digunakan di Bali sampai saat ini untuk
pemisahan secara instilasi. Di sisi lain, pemisahan dengan menggunakan barrier
hyaluronic acid dan carboxymethylcellulose (HA-CMC) dengan merek dagang
Seprafilm telah disetujui penggunaannya oleh badan Food and Drug
Administration (FDA) namun bentuknya yang berupa lembaran menyulitkan
penggunaannya. Dalam penelitian ini, penulis mengharapkan HA-CMC dalam
bentuk larutan (Guardix Sol) ini dapat menjadi barrier yang aman dan efektif
dalam mencegah adhesi intraperitoneal sehingga menurunkan biaya dan
1.2 Rumusan Masalah
Berdasarkan latar belakang tersebut di atas, maka masalah penelitian ini
adalah :
1. Apakah pemberian larutan HA – CMC secara intraperitoneal
menurunkan kejadian adhesi intraperitoneal pascalaparotomi pada
tikus Wistar?
2. Apakah pemberian larutan HA – CMC secara intraperitoneal
menurunkan infiltrasi makrofag pascalaparotomi pada tikus Wistar?
3. Apakah pemberian larutan HA – CMC secara intraperitoneal
menurunkan infiltrasi fibroblas pascalaparotomi pada tikus Wistar?
1.3 Tujuan Penelitian
1.3.1 Tujuan Umum
Untuk membuktikan bahwa pemberian larutan HA – CMC secara
intraperitoneal menurunkan kejadian adhesi intraperitoneal pada tindakan
laparotomi tikus Wistar.
1.3.2 Tujuan Khusus
a. Untuk mengetahui kejadian adhesi intraperitoneal dengan pemberian
larutan HA - CMC intraperitoneal pada tindakan laparotomi tikus Wistar.
b. Untuk mengetahui infiltrasi makrofag pada lamina propria caecum yang
diabrasi dengan pemberian larutan HA - CMC intraperitoneal pada
c. Untuk mengetahui infiltrasi fibroblas pada lamina propria caecum yang
diabrasi dengan pemberian larutan HA - CMC intraperitoneal pada
tindakan laparotomi tikus Wistar.
1.4 Manfaat penelitian
1.4.1 Manfaat Ilmiah
Penelitian ini dapat menambah kasanah keilmuan mengenai efek
pemberian larutan HA - CMC intraperitoneal terhadap infiltrasi makrofag dan
fibroblas, dan, terjadinya adhesi intraperitoneal pada tindakan laparotomi.
1.4.2 Manfaat Klinik
Ahli bedah dapat menggunakan larutan HA - CMC intraperitoneal sebagai
protokol dalam tindakan laparotomi khususnya untuk menurunkan kejadian adhesi
6
BAB II
TINJAUAN PUSTAKA
2.1 Adhesi Intraperitoneal dan Epidemiologinya
2.1.1 Adhesi Intraperitoneal
Adhesi intraperitoneal adalah ikatan patologis yang biasanya terjadi antara
omentum, usus, dan dinding abdomen. Ikatan ini dapat berupa lapisan jaringan
ikat tipis, sambungan fibrous tebal yang berisi pembuluh darah dan saraf, atau
perlengketan langsung antara kedua organ. Berdasarkan etiologinya, adhesi
intraperitoneal dibagi menjadi kongenital dan didapat, yang bisa diakibatkan
radang atau post operasi (Arung et al., 2011).
2.1.2 Epidemiologi Adhesi Intraperitoneal
Penilaian insiden yang sebenarnya dari terbentuknya adhesi intraperitoneal
sangat sulit dilakukan karena adhesi intraperitoneal yang asimptomatik jarang
ditemukan kecuali pada pasien yang menjalani pembedahan abdomen di
kemudian hari atau menjalani otopsi (Lauder et al., 2010).
Adhesi intraperitoneal kebanyakan diinduksi oleh prosedur pembedahan
dalam cavum peritoneum, dengan prevalensi sebesar 63%-97% setelah prosedur
operasi abdomen mayor. Survei di Inggris pada tahun 1992 melaporkan total
12.000 – 14.400 kasus obstruksi karena adhesi intestinal pertahunnya.
Pembedahan kolorektal sebagai jenis pembedahan yang paling sering
Pada tahun 1994 di Amerika Serikat, ditemukan bahwa adhesiolisis
merupakan alasan 303.836 dari seluruh pasien dirawatinapkan (1% dari
keseluruhan rawat inap di Amerika Serikat pada tahun 1994), menghabiskan biaya
sebesar 1,33 milyar dolar, dan rawat inap selama 846.415 hari. Adapun pada
tahun 2004, sebesar 342.000 prosedur adhesiolisis telah dilakukan di Amerika
Serikat. Bahkan setelah dilakukan adhesiolisis, obstruksi yang rekuren sering
terjadi (8% sampai 32%). Diketahui bahwa kematian terjadi pada 3% sampai 5%
pasien dengan obstruksi sederhana, dan meningkat menjadi sebesar 30% jika usus
terstrangulasi, nekrosis, dan perforasi (Ergul dan Korukluoglu, 2008).
Penelitian oleh Surgical and Clinical Adhesion Research (SCAR) dengan
mengikuti 29,790 pasien yang telah menjalani operasi abdomen dan pelvis di
Skotlandia, dalam kurun waktu 10 tahun, dan diikuti readmisi ke rumah sakitnya.
Sekitar sepertiga pasien direadmisi dengan rata-rata 2,1 kali, untuk komplikasi
yang berhubungan langsung atau kemungkinan berhubungan dengan adhesi atau
telah menjalani operasi yang dikomplikasikan oleh adhesi intraperitoneal yang
terjadi dalam kurun waktu 10 tahun. Dan ditemukan pula bahwa resiko adhesi
tertinggi diakibatkan oleh prosedur pembedahan kolon dan rektum di bidang
bedah umum dan, ovarium dan tuba fallopi pada pembedahan ginekologi (Pados
et al., 2010).
2.2 Penyembuhan Peritoneum dan Patofisiologi Adhesi Intraperitoneal
2.2.1 Penyembuhan Peritoneum
Pembentukan adhesi sangat erat hubungannya dengan penyembuhan luka.
fase. Fase pertama, inflamasi, ditandai dengan hemostasis dan inflamasi, aktivasi
kaskade pembekuan, vasodiloatasi yang terjadi karena pelepasan histamine dan
pelepasan vasokonstriktor seperti thromboxane A2 dan prostaglandin-2a. Fase
kedua, proliferasi, ditandai dengan epitelialisasi, angiogenesis, pembentukan
jaringan granulasi dan deposisi kolagen. Fase ketiga, maturasi, ditandai dengan
kontraksi luka membentuk jaringan parut, penggantian kolagen tipe III oleh
kolagen tipe I yang lebih kuat dan pembuangan pembuluh darah yang tidak lagi
diperlukan melalui apoptosis (Vaze et al.,2010).
Perbedaan penyembuhan peritoneum dengan penyembuhan luka pada kulit
adalah di mana penyembuhan peritoneum terjadi epitelialisasi pada keseluruhan
permukaan secara simultan, sedangkan pada kulit terjadi epidermalisasi secara
bertahap dari tepi luka. Mesotel baru timbul pada pertengahan luka yang besar
pada waktu yang sama dengan mesotel baru timbul pada pertengahan luka yang
kecil (diZerega dan Campeau, 2001).
Sel yang pertama kali muncul saat peritoneum cedera asalah sel
Polymorphonuclear (PMN). Sel mesotel yang cedera menghasilkan kemokin
interleukin-8 (IL-8) yang menarik sel PMN. Dua puluh empat sampai 36 jam
setelah cedera, jumlah sel PMN menurun, dan monosit berubah menjadi makrofag
yang direkrut oleh monocyte chemotactic protein-1(MCP-1) dan regulated upon
activation normal T-cell expressed, and presumably secreted (RANTES) - yang
juga disekresi oleh sel mesotel yang cedera. Asal makrofag ini adalah dari area
submesotel di mana mereka diam sebagai monosit yang tidak aktif. Makrofag
yang cedera dengan mengsekresi sitokin-sitokin, seperti IL-1β dan tumor
necrotizing factor α (TNFα) yang merangsang mesotel menghasilkan IL-6.
Makrofag tetap berada pada lokasi cedera sampai 10-14 hari setelah cedera
(Akerberg, 2013).
Setelah 3 sampai 4 hari, muncul sel-sel mesenkim punca yang primitif
pada luka yang berfungsi merestorasi peritoneum yang cedera. Pada saat yang
sama, fibroblas yang berproliferasi muncul, yang diperkirakan berasal dari area
lapisan submesotel atau dapat berasal dari sel mesenkim punca. Makrofag
kemudian menstimulasi fibroblas melalui transforming growth factor β (TGFβ)
dan substansi lain untuk menghasilkan extracellular matrix (ECM). Fibroblas
penting untuk remodelling jaringan dan pembangunan ECM (Akerberg, 2013).
Secara bertahap, matriks lapisan submesotel dibangun, sel mesotel mulai
muncul secara tersebar pada permukaan luka dan menyatu antara 5 sampai 7 hari
setelah cedera (Akerberg, 2013). Adapun sumber sel mesotel baru yang mengisi
defek peritoneum masih merupakan kontroversi. Penelitian-penelitian
memperkirakan bahwa sumber sel mesotel adalah transformasi dari sel-sel di
dalam cairan peritoneum, transformasi sel-sel mesenkim punca di dasar dan atau
transformasi sel-sel darah menjadi sel mesotel (Akerberg, 2013).
Lapisan mesotel penting dalam deposisi dan pembersihan fibrin local
dalam rongga serosal. Lapisan mesotel menghasilkan macam-macam faktor
seperti Plasminogen Activating Inhibitor (PAI) dan urokinase Plasminogen
Activator Inhibitor (uPAI). Penyembuhan lapisan mesotel merupakan tahap
Akhirnya, segala tipe cedera jaringan akan berujung pada satu dari empat
kemungkinan. Pertama, tercapainya kesamaan jaringan melalui mekanisme
perbaikan normal. Kedua, regenerasi yang terjadi dengan penggantian. Ketiga,
kurangnya penyembuhan, seperti yang terjadi pada ulkus kronis. Terakhir,
penyembuhan yang berlebihan, seperti yang terjadi pada jaringan parut dan
kontraktur (Vaze et al., 2010).
2.2.2 Patofisiologi Adhesi Intraperitoneal
Sampai saat ini, patofisiologi adhesi intraperitoneal masih belum jelas dan
menjadi kontroversi (Arung et al., 2011). Secara umum, keseimbangan antara
deposisi fibrin dan degradasinya yang akan menentukan mekanisme
penyembuhan peritoneum apakah akan berjalan normal atau terbentuk adhesi.
Waktu yang dibutuhkan oleh mesotel untuk mengalami regenerasi komplit adalah
8 hari (Kamel, 2010).
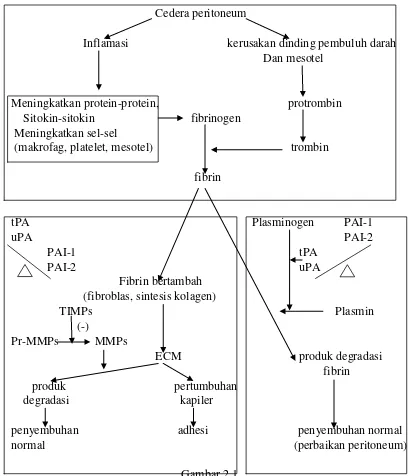
Cedera peritoneum akan merangsang terjadinya radang, dan kemudian
mengaktivasi kaskade koagulasi, membentuk trombin, yang akan mengubah
fibrinogen menjadi fibrin. Pada pembedahan abdomen, terjadi gangguan
keseimbangan sehingga sistem koagulasi lebih besar pengaruhnya daripada sistem
fibrinolisis. Fibroblas menginvasi matriks fibrin dan membentuk ECM yang
kemudian dikumpulkan. ECM ini masih dapat didegradasi oleh proenzim dari
matriks metalloproteinase sehingga penyembuhan peritoneal menjadi normal. Jika
proses ini diinhibisi oleh tissue inhibitor dari matriks metalloproteinase, maka
terjadilah pembentukan adhesi. Secara umum, jika fibrinolisis tidak terjadi dalam
kolagen, membentuk adhesi, yang kemudian diikuti oleh tumbuhnya pembuluh
darah baru yang dimediasi oleh faktor angiogenik (Arung et al., 2011).
Cedera peritoneum
Inflamasi kerusakan dinding pembuluh darah
Dan mesotel
Keseimbangan antara plasminogen activator dan plasminogen inihibitor. TIMP:
Tissue inhibitors of metalloproteinases; MMP: Matrix metalloproteinase; ECM:
Extracellular matrix; tPA: Tissue-type plasminogen activator; uPA: Urokinase-type plasminogen Activator; PAI: Plasminogen-activating inhibitor(Arung et al.,
2011).
Faktor-faktor yang mempengaruhi kapasitas fibrinolitik dari mesotel (Brugmann
Plasminogen activation inhibitors (PAI 1/ 2) ↓
Mechanical destruction of mesothelium ↓
Transforming growth factor β (TGF β) ↓
Intracellular adhesion molecule (ICAM 1) ↓
Vascular cell adhesion molecule (VCAM) ↓
Di sisi lain, aktivasi sistem fibrinolitik mengubah plasminogen menjadi
plasmin yang bekerja mendegradasi fibrin. Plasminogen aktivator terdiri dari
tissue type plasminogen activator (tPA) dan urokinase-type plasminogen
Activator (uPA), yang diekspresikan oleh sel endotel, sel mesotel, dan makrofag.
Di dalam peritoneum, 95% dari pengaktifan plasminogen diakibatkan oleh tPA.
fibrinnya lebih rendah, sehingga perannya lebih sedikit dalam mengaktivasi
plasminogen (Arung et al., 2011).
Aktivasi plasminogen dihambat oleh plasminogen activator inhibitor
(PAI)–1 dan -2, dimana PAI–1 adalah glikoprotein yang lebih kuat dalam
menginhibisi tPA dan uPA. PAI-1 dan PAI-2 diproduksi oleh sel endotel, sel
mesotel, monosit, makrofag, dan fibroblas. Plasminogen activator inhibitor lain
yang teridentifikasi yaitu PAI-3 dan protease nexin 1. Keseimbangan antara
plasminogen activator dan plasminogen inhibitor penting dalam menentukan
penyembuhan peritoneum. PAI-1 penting dalam pembentukan adhesi dan
konsentrasi PAI -1 ditemukan tinggi pada pasien dengan adhesi yang luas (Arung
et al., 2011).
2.3 Etiologi dan Faktor Resiko Adhesi Intraperitoneal
Adhesi intraperitoneal dapat terjadi sebagai respon terhadap cedera, di
mana pembedahan sebagai penyebab terseringnya. Prosedur pembedahan yang
sering menyebabkan adhesi intraperitoneal yaitu kolesistektomi, appendisektomi,
repair hernia, pembedahan kanker, pembedahan hepar, dan pembedahan sistem
reproduksi pelvis. Ovarium sering menjadi tempat terjadinya adhesi karena
letaknya yang dekat dengan permukaan peritoneum lainnya (Kamel, 2010).
Faktor resiko adhesi yaitu manipulasi kasar saat pembedahan, hipoksia dan
iskemia jaringan, diseksi tumpul adhesi sebelumnya, keringnya permukaan
jaringan dan serosa, infeksi, endometriosis peritoneal, adanya benda asing, dan
2.4 Konsekuensi dan Derajat dari Adhesi Intraperitoneal
2.4.1 Konsekuensi klinis, ekonomis, dan medikolegal dari Adhesi
Intraperitoneal
Konsekuensi adhesi intraperitoneal secara klinis adalah obstruksi karena
adhesi usus halus, nyeri pelvis atau abdomen, dan infertilitas. Adhesi
intraperitoneal juga mempersulit pembedahan selanjutnya (Arung et al., 2011).
Pasien dengan adhesi intraperitoneal dapat menunjukkan gejala
meteorismus, gerakan usus yang tidak teratur, nyeri abdomen kronis, gangguan
pencernaan, infertilitas, dan obstruksi intestinal. Adhesi postoperatif ditemukan
mengakibatkan 40% dari semua kasus obstruksi saluran cerna dan 65% sampai
75% dari semua kasus obstruksi usus halus. Tindakan kolektomi, dengan luka
insisi peritoneum yang besar, meningkatkan kejadian obstruksi intestinal sebesar
11% (Brugmann et al., 2010). Penelitian oleh Sastry et al menemukan bahwa
waktu rata-rata yang dibutuhkan dari operasi sampai terjadinya obstruksi usus
halus adalah 24 bulan. Peningkatan resiko obstruksi usus halus terjadi dengan
peningkatan lama operasi dan adanya operasi sebelumnya, sedangkan resiko
obstruksi usus halus menurun pada pasien dengan kondisi fisik berdasarkan
American Society of Anesthesiologist (ASA) lebih dari 3 (Sastry et al., 2015).
Adhesi intraperitoneal juga merupakan penyebab dari 15% sampai 20%
kasus inferitilitas wanita sekunder. Adhesi paratubal dan paraovarian
mengakibatkan terjebaknya folikel dan menurunkan mobilitas dan blokade dari
tuba fallopi, sehingga membatasi gerakan oosit, meningkatkan resiko kehamilan
Nyeri kronis perut bagian bawah menurunkan kualitas hidup dan
merupakan alasan dilakukannya 30% sampai 50% dari semua laparoskopi dan 5%
histerektomi. Penelitian oleh DiZerega menemukan bahwa adhesi merupakan
penyebab dari hanya 40% nyeri kronis perut bagian bawah pada wanita yang
sebelumnya menjalani operasi, dan 25% kasus masih belum jelas penyebabnya
(Brugmann et al., 2010). Keltz, et al (2006) menemukan pula bahwa gejala nyeri
perut kronis menurun secara signifikan setelah dilakukan adhesiolisis parakolik
sisi kanan, namun penelitian lain oleh Swank, et al (2003) menemukan tidak
adanya penurunan gejala nyeri perut setelah adhesiolisis secara laparoskopik.
Suatu penelitian menemukan adanya serat saraf secara histologi, ultrastruktural,
dan imunohistokimia pada semua adhesi intraperitoneal yang diperiksa. Dan serat
saraf ini mengekspresikan protein yang berhubungan dengan gen calcitonin dan
substansi P - penanda neuron sensoris. Penelitian ini mensugesti bahwa struktur
ini mempunyai kemampuan mengkonduksi nyeri dengan stimulasi yang sesuai
(Arung et al., 2011).
Seorang ahli bedah memiliki tanggung jawab untuk memberikan informasi
yang cukup sehubungan dengan resiko operasi abdomen termasuk resiko adhesi
intraperitoneal. Ini memiliki implikasi langsung untuk praktek klinis dan klaim
medikolegal (Rajab et al., 2009; Solomon et al., 2010). Pasien yang akan
menjalani operasi juga harus diinformasikan dengan pemahaman secara tertulis
mengenai kemungkinan operasi ulangan adhesiolisis dan komplikasinya, dengan
menyebutkan pula ekstensi operasi, lama anestesi, kehilangan darah, dan resiko
enterotomi sebesar 20%. Dan adhesi intraperitoneal akan menyulitkan operasi
ataupun tindakan minimal invasif berikutnya, ultrasonografi diagnostik,
pengambilan oosit untuk IVF (In Vitro Fertilization), pemberian kemoterapi
intraperitoneal, dan dialisis peritoneal (Brugmann et al., 2010). Penelitian oleh
Van Goor menginformasikan bahwa hanya 25% dari pasien yang menjalani
operasi yang diberitahu akan kemungkinan terjadinya adhesi intraperitoneal dan
kemungkinan perlunya dilakukan adhesiolisis di masa yang akan datang, dan
adhesi hanya disebutkan pada 10% persetujuan praoperasi (Van Goor, 2007).
Dari sudut pandang ekonomi, adhesi intraperitoneal menghabiskan dana
sebesar $13 juta pertahunnya di Swedia dan $1,3 miliar pertahunnya di Amerika
(Arung et al., 2011). Klaim medikolegal sehubungan dengan adhesi
intraperitoneal yang berhasil di Inggris di antaranya yaitu kasus perforasi usus
saat dilakukan adhesiolisis secara laparoskopik, keterlambatan diagnosis obstruksi
usus halus karena adhesi, dan infertilitas dan nyeri akibat adhesi (Ellis dan Crowe,
2009).
Adapun dampak yang diakibatkan oleh adhesi intraperitoneal adalah
signifikan, namun Clinical Adhesion Research and Evaluation (CARE) di Jerman
menemukan bahwa tidak semua, yaitu sebesar 83,1% ahli bedah memberitahu
pasien mereka akan resiko terjadinya adhesi intraperitoneal sebelum melakukan
pembedahan (Hackethal et al., 2010).
2.4.2 Derajat dari Adhesi Intraperitoneal
Ada beberapa sistem derajat yang digunakan untuk menilai beratnya
sampai saat ini adalah sistem derajat berdasarkan Zulhke et al., di mana derajat 0
berarti tidak ada adhesi, dan derajat 4 berarti adhesi yang kuat dan luas yang
hanya dapat dipisahkan dengan instrumen tajam dan tidak dapat dipisahkan tanpa
merusak organ.
Tabel 2.2
Sistem Derajat Adhesi Intraperitoneal (Zulhke et al., 1990)
Derajat Observasi
0 Tidak ada adhesi
1 Adhesi tipis, mudah dipisahkan dengan diseksi tumpul, tanpa vaskularisasi
2 Adhesi yang lebih kuat, sebagian dapat dipisahkan dengan diseksi tumpul dan sebagian lagi dengan diseksi tajam, mulai ada vaskularisasi
3 Adhesi yang kuat, lisis hanya bisa dilakukan dengan diseksi tajam, vaskularisasi jelas
4 Adhesi sangat kuat, lisis hanya bisa dilakukan dengan diseksi tajam, organ melekat kuat dan tidak dapat dipisahkan tanpa merusak organ
Tabel 2.3
Sistem Derajat Adhesi Intraperitoneal Berdasarkan Densitas (Frederick et al., 1986)
Derajat Observasi
0 Tidak ada adhesi
1 Adhesi terlokalisir dan tipis
2 Adhesi terlokalisir dan padat
3 Adhesi luas dan tipis
Tabel 2.4
Sistem Derajat Adhesi Intraperitoneal Berdasarkan Area Cedera (Guvenal et al.,2001)
Sistem Derajat Adhesi Intraperitoneal Berdasarkan Vaskularitas dan Densitas (Canbaz et al., 2005)
Derajat Observasi
0 Tidak ada adhesi
1 Adhesi tipis, mudah dipisahkan dengan jari
2 Adhesi ringan, berkelanjutan tanpa vaskuler, dapat dipisahkan secara tumpul
3 Adhesi sedang, berserat, vaskularisasi sedang, memerlukan diseksi tajam
4 Jaringan parut padat, di mana bidang jaringan tidak jelas
2.5 Pencegahan Adhesi Intraperitoneal
Pencegahan adhesi intraperitoneal postoperative meliputi 3 tahap yaitu:
pendekatan operasi (laparoskopik versus laparotomi), teknik operasi
(konvensional versus mikrosurgikal), dan adjuvan pembedahan (Kamel, 2010).
2.5.1 Pendekatan Pembedahan
Laparaskopik dengan akses minimal ke cavum abdomen atau pelvis
berhubungan dengan adhesi postoperatif yang lebih rendah dibandingkan dengan
laparoskopik yaitu kecilnya insisi peritoneum parietal, benda asing yang lebih
sedikit, lingkungan yang lembab, trauma dan pendarahan jaringan yang lebih
sedikit, lebih sedikit manipulasi struktur lain yang jauh, lebih cepat kembalinya
motilitas usus dan ambulasinya (Kamel, 2010).
Adapun kekurangan pendekatan secara laparoskopik yaitu cedera jaringan
karena kesalahan pemilihan dan pemakaian instrumen, adhesi masih terjadi
setelah laparoskopik, pneumoperitoneum dengan gas CO2 yang tidak
dihumidifikasi adalah kofaktor adhesi, pembentukan adhesi berhubungan dengan
lama pneumoperitoneum, dan iskemia subserosal sebagai konsekuensi tekanan
tinggi gas intraperitoneal (Kamel, 2010). Gas CO2 berhubungan dengan
penurunan kadar oksigen jaringan, asidosis, dan pelepasan spesies oksigen reaktif
yang diperkirakan adhesiogenik (Pados et al., 2013).
2.5.2 Teknik Pembedahan
William Steward Halsted, seorang ahli bedah Amerika, menyatakan
prinsip-prinsip pembedahan, yang akhirnya disebut “Prinsip Halsted”, yang
meliputi teknik aseptik, penanganan jaringan dengan halus, diseksi tajam jaringan,
hemostasis dengan menggunakan seminimal mungkin jahitan yang non-iritatif,
menghilangkan ruang kosong, dan, menghindari ketegangan. Sebagai tambahan
adalah irigasi yang terus-menerus, mempertahankan kelembaban jaringan,
penggunaan instrumen mikro dan atraumatik, yang juga terbukti efektif (Omer
dan Al-Harizi, 2014).
Tambahan terhadap teknik pembedahan yaitu teknik pembedahan mikro
mikrosurgikal yaitu dengan pembesaran untuk visualisasi yang lebih baik,
menggunakan instrumen yang lebih kecil, dan jahitan yang lebih halus. Prinsip
pembedahan mikro lainnya termasuk penanganan jaringan yang lebih minimal,
mencegahnya mengeringnya jaringan, menghindari benda asing, dan hemostasis
yang lebih baik (Kamel, 2010).
Teknik pembedahan baru saat ini yaitu penggunaan laser, kebanyakannya
ultra-pulse carbon dioxide. Menghilangkan jahitan peritoneum adalah salah satu
upaya untuk menghindari adanya benda asing dalam cavum peritoneum dan
ditemukan menurunkan durasi operasi, kejadian demam, dan menurunkan
penggunaan analgetik serta kembalinya aktivitas usus yang lebih cepat (Kamel,
2010).
i Tabel 2.6
Adjuvan dalam mencegah adhesi postoperatif (Kamel, 2010)
Agen Fibrinolitik
Thrombokinase, fibrinolysin, streptokinase, urokinase, hyaluronidase, chymotrypsin, trypsin, papain and pepsin.
Anti-inflammatory peptides: retinoic acid, quinacrine, or dipyridamole Antihistamines: Promethazine
Corticosteroids: dexamethasone, hydrocortisone and prednisolone
Non-steroidal anti-inflammatory drugs (NSAID): Ketorolac, Tolmetin, Ibuprofen and Indomethacin
Crystalloid solutions: normal saline and Ringer’s lactate
Viscous solutions: 32% Dextran-70 (Hyskon 1)
Carboxymethylcellulose (CMC): high MW polysaccharide gel Hyaluronic acid (HA): a naturally occurring glycosaminoglycan HA with phosphate-buffered-saline HAPBS: (Sepracoat 1) HA with iron 0.5% ferric hyaluronate gel: (Lubricoat 1) Auto-cross-linked hyaluronan solution or gel (ACP-gel) N,O-carboxymethyl chitosan (NOCC): gel and solution Barrier
0.5% ferric hyaluronate gel (Intergel 1): withdrawn from market HA with carboxymethylcellulose HA-CMC: (Seprafilm 1) AdhibitTM: gel used after cardiac surgery
Adept 1: is an intra-peritoneal fluid Polyethylene glycol-PEG: (SprayGel 1) Poloxamer 407 of (FlowGel 1)
Polytetrafluoroethylene: (Gore-Tex 1)
Interceed 1 (TC7)
Modified neutralized Interceed (nTC7)
Mineral oil, silicone, vaseline, gelatin, rubber sheets, metal foils, plastic hoods (abandoned) Agen Baru
Films of polyethylene oxide and carboxymethylcellulose: (Oxiplex 1) Shelhigh dome pericardial patch no-react
Pluronic F127/F68 alginate–buprofen mixture (Sol–Gel 1) Aloe vera gel
Agen yang masih diteliti
Colchicine
Terbentuknya adhesi intraperitoneal masih tidak dapat dihindari pada
pembedahan pelvis reproduktif walau dengan teknik laparoskopi yang baik,
pembedahan mikro, dan penggunaan laser, sehingga dicari bahan yang dapat
mencegah pembentukan adhesi (Kamel, 2010).
Macam-macam adjuvan pembedahan ditemukan untuk mencegah
pembentukan adhesi intraperitoneal, namun tidak semuanya efektif. Adjuvan yang
dapat digunakan untuk mencegah adhesi di antaranya adalah agen fibrinolitik,
antikoagulan, agen antiinflamasi, antibiotik, pemisahan secara mekanis, penghalang
(barrier), agen-agen baru maupun agen-agen yang masih dalam penelitian (Kamel,
2010). Suatu penelitian yang dikerjakan oleh Clinical Adhesion Research and
Evaluation (CARE) di Jerman, mendapatkan bahwa 38,4% ahli bedah menggunakan
agen antiadhesi secara rutin (Hackethal et al., 2010).
Pemisahan permukaan peritoneum yang telanjang pada awal proses
penyembuhan adalah metode yang ideal dalam pencegahan adhesi intraperitoneal.
Larutan kristaloid banyak digunakan untuk instilasi cavum abdomen setelah
pembedahan. Ringer laktat yang dimasukkan ke dalam intraperitoneal hewan
mempunyai efek penyeimbang yang lebih baik, ditemukan menurunkan pembentukan
adhesi dibandingkan normal saline. Sayangnya cairan ini diserap dengan kecepatan
35 ml/jam, sehingga jika dihitung maka diperlukan 5 liter cairan untuk
mempertahankan kondisi pemisahan sampai 6 hari postoperasi. Kendala lainnya yaitu
resiko infeksi, edema paru, dan kebocoran pada lokasi punksi. Untuk memperpanjang
lama cairan di intraperitoneal maka digunakan larutan dengan viskositas yang lebih
tinggi, seperti dextran, yang bekerja melapisi peritoneum yang telanjang dan sebagai
larutan osmotik yang mengakibatkan melayangnya (hydrofloatation) viscera.
Selanjutnya, ditemukan pula CMC yang lebih efektif dibandingkan dextran. Larutan
lain yang termasuk dalam pemisah mekanis yaitu Hyaluronic acid dan
N,O-carboxymethyl chitosan (NOCC) (Kamel, 2010).
Selain instilasi peritoneal di atas, mekanisme pemisahan lain yaitu dengan
memberi barrier (pelindung). Pelindung mekanis yang ideal harus aman dan efektif,
tidak merangsang peradangan, tidak merangsang reaksi imun, bertahan selama masa
kritis penyembuhan peritoneum, terfiksasi pada lokasi aplikasinya tanpa dijahit atau
distapler, tetap aktif walaupun ada darah, dan dapat didegradasi secara biologis tanpa
perlu dikeluarkan. Sebagai tambahan, barrier tidak boleh menghalangi penyembuhan
eksogen yang bisa digunakan yaitu graft membran amnion dan transplan peritoneum
autolog. Sedangkan barrier eksogen contohnya gel 0,5% ferric hyaluronate, dan gel
HA-CMC (Kamel, 2010).
Penelitian-penelitian menemukan bahwa kebanyakan adhesi adalah sementara
dan lisis secara alami dalam waktu 72 jam. Pembentukan adhesi yang menetap terjadi
3 hari setelah operasi, sehingga agen barrier diharapkan dapat bertahan pada tempat
cedera selama beberapa hari setelah operasi (Cimen et al., 2013).
2.6.1 Peran HA – CMC (Hyaluronic acid – Carboxymethylcellulose) dalam
Mencegah Adhesi Intraperitoneal
2.6.1.1 Hidrogel Berbasis Polisakarida
Hidrogel adalah materi yang terbentuk dengan interaksi fisik atau ikatan
kimiawi rantai polimer yang hidrofilik, memampukannya menyerap air dalam jumlah
banyak. Molekul air berpenetrasi ke dalam ruang interstisial dari jaringan polimer
tiga dimensi, membuat hidrogel menyerupai jaringan biologis. Jumlah air yang
terabsorbsi tergantung pada seberapa berporinya hidrogel dan seberapa hidrofilnya
kelompok fungsional polimer tersebut (Camponeschi et al., 2015).
Hidrogel dibagi menjadi hidrogel fisik, di mana ikatan polimer dipegang oleh
kaitan-kaitan molekul dan atau interaksi ion, ikatan hidrogen, dan atau dipolar, dan,
hidrogel kimiawi, yang terdiri dari jaringan yang terikat kovalen dari ikatan kimia
rantai polimer melalui tambahan agen-agen lain yang diikat bersama yang mampu
tambahan, hidrogel kimiawi juga menunjukkan interaksi fisik sampai batas tertentu
sebagai bagian dari polimer tersebut. Tidak seperti hidrogel fisik, ikatan mekanis
hidrogel kimiawi dapat terbentuk kembali dengan baik, memungkinkannya untuk
dimodulasi dari derajat ikatannya, sehingga hidrogel kimiawi lebih disukai
(Camponeschi et al., 2015).
Hidrogel berbasis polisakarida adalah hidrogel kimiawi yang sangat
menjanjikan dalam dunia kedokteran. Bahan ini digunakan dari pembuatan jaringan
sampai mengendalikan pelepasan obat untuk terapi lokal. Bagian paling menarik dari
bahan ini adalah bahwa bahan ini mampu diaplikasikan tanpa mengubah struktur
kimia, mekanis, dan biologisnya. Hal ini dikarenakan sifatnya yang thixotropic.
Thixotropic adalah sifat cairan di mana jika diaduk maka viskositasnya turun dan
semakin kuat pengadukannya maka viskositasnya akan semakin turun. Apabila
pengadukan dihentikan, viskositas cairan akan naik kembali. Modulasi kekentalan
dan fisik kimia bahan ini dapat dilakukan dengan mengikatnya dengan agen-agen lain
dan memanfaatkan sifat thixotropic-nya (Camponeschi et al., 2015).
2.6.1.2 Hyaluronic Acid – Carboxymethylcellulose (HA-CMC) sebagai
Hidrogel Berbasis Polisakarida
Beberapa polimer alami dapat digunakan sebagai bahan hidrogel kimiawi.
Polisakarida adalah salah satu yang paling baik karena mereka memiliki kelompok
ionik, memudahkan modifikasi struktur kimianya dengan kelompok fungsional baru
atau enzim lainnya. Hidrogel polisakarida yang diikat secara kimia menunjukkan
ikatan, bahwa mereka mampu menyerap banyak air sesuai berat (kemampuan
membengkak) mereka menentukan sifat mekanis dan kimianya, dan, bahwa
kebanyakan bersifat thixotrophic, membuatnya memungkinkan untuk diinjeksi
melalui jarum suntik, sehingga cocok untuk aplikasi biomedis (Camponeschi et al.,
2015).
Hidrogel berbasis polisakarida saat ini banyak diminati penggunaannya
sebagai matriks untuk perbaikan dan regenerasi macam-macam jaringan dan organ.
Karakteristik hidrogel ini yaitu permeabilitasnya yang tinggi sehingga mengizinkan
pertukaran oksigen, nutrisi, dan metabolit larut air, yang penting dalam mendukung
pertumbuhan sel (Camponeschi et al., 2015).
Hyaluronic acid (HA) adalah polisakarida linier dengan unit disakarida
berulang yang terdiri dari D-glucuronate dan N-acetyl-D-glucosamine. HA
merupakan komponen yang alami ada di dalam jaringan dan cairan tubuh seperti
Gambar 2.2
Struktur Kimia Hidrogel Polisakarida yang Sering Digunakan: HYAL (Hyaluronic Acid) dan CMC (Carboxymethylcellulose) (Camponeschi et al., 2015)
mekanis, lubrikasi sel, dan menopang secara fisik (Pados et al., 2010; Primariawan,
2010). HA dalam bentuk alami adalah cairan yang akan termetabolisme setelah 12
jam di dalam tubuh. HA ini bisa diikat secara kimiawi (cross-linked), menjadi bentuk
gel. Kepadatan gel tergantung dari derajat ikatan tiap rantai HA yang membuat
metabolismenya lebih lambat di dalam tubuh, sehingga efek HA lebih lama (Mettler,
2014). Suatu penelitian menemukan bahwa larutan HA berdosis kecil (0,2 dan 0,4%)
mengurangi kejadian adhesi intraperitoneal secara signifikan, adapun efektivitas
sebagai anti-adhesi dari larutan HA ini adalah bergantung pada volume, di mana
volume tinggi terlihat paling efektif (Reijnen et al., 2001).
Carboxymethylcellulose (CMC) adalah polisakarida dengan berat molekul
tinggi, derivat dari cellulose. Mekanisme absorpsinya belum jelas (Pados et al.,
2010). CMC tersedia dalam berbagai macam berat molekul, dan diformulasikan
berfungsi sebagai lubrikan mengakibatkan hydrofloatation. Karena cairan ini mudah
keluar dari rongga peritoneal secara in vivo, sehingga saat ini banyak dikembangkan
barrier membrane berbasis CMC (Primariawan, 2010). Penelitian menemukan bahwa
efektivitas sebagai anti-adhesi dari 1,7% larutan CMC, yang kekentalannya setara
dengan 0,4% larutan HA, tidak bergantung pada volume (Reijnen et al., 2001).
Campuran hidrogel diperoleh dengan mengikat 2 polimer berbeda melalui
reaksi kimia. Hyaluronic acid dan carboxymethylcellulose (HA-CMC) adalah
kombinasi dari hyaluronic acid dan carboxymethylcellulose, yang dapat diserap yang
larut dan membentuk gel yang hidrofilik lebih kurang 24 jam setelah diaplikasikan.
Dia merupakan barrier yang spesifik terhadap lokasi dan bekerja secara mekanik
memisahkan jaringan yang bersebelahan dan bertahan 7 hari. HA akan dieliminasi
dalam tubuh setelah 4 minggu, namun absorpsi CMC masih belum diketahui jelas
(Pados et al., 2010).
Penelitian oleh Reijnen et al.(2001) menemukan bahwa Larutan HA dan CMC
konsentrasi rendah dapat pula menurunkan pembentukan abses intraabdomen.
Kemampuan menurunkan kejadian abses oleh larutan HA maupun CMC ini tidak
tergantung pada volum, malah ditemukan bahwa volum larutan CMC yang kecil
menurunkan kejadian dan ukuran abses lebih baik dibandingkan dengan volum yang
besar. Kelihatannya penurunan pembentukan abses tidak dapat diaplikasikan seperti
konsep hydrofloatation pada pencegahan adhesi. Kemampuan HA dalam mengurangi
abses diketahui merupakan bagian dari peran biologisnya dibandingkan peran
dalam mendukung dan menjaga batas proses radang. HA dapat memperkuat respon
imun humoral dan menginduksi pembentukan interleukin (IL)-1, IL-8 dan tumor
necrosis factor. HA diketahui pula mempunyai efek antioksidan, membantu dalam
pembuangan radikal bebas, dan menghambat proteinase radang. HA ditemukan
meningkatkan proliferasi sel mesotel peritoneum manusia dan menurunkan produksi
PAI. Kerja terhadap PAI inilah yang berperan utama dalam pendauran fibrin,
mendukung pencegahan pembentukan abses (Reijnen, 2001).
Seprafilm merupakan bahan yang mengandung HA dan CMC dalam bentuk
membran. Seprafilm ini telah disetujui penggunaannya oleh FDA pada tahun 1996
dan banyak digunakan untuk mencegah adhesi. Bahan ini bersifat biokompatibel,
nonimunogenik, dan melekat pada permukaan jaringan. Bahan ini dapat digunakan
walau ada darah dan irigasi. Perlindungan permukaan jaringan terjadi selama 7 hari
dengan pembentukan gel gelatin yang kental dan hidrofilik yang akan terabsorpsi
seluruhnya setelah 28 hari (Primariawan, 2010; Chu et al., 2010, Akerberg, 2013,
Omer dan Al-Harizi, 2014). Penelitian menunjukkan bahwa Seprafilm tidak
mengganggu pelepasan TGF-β dan serine protease jaringan yang berperan dalam
memperbaiki jaringan (Akerberg, 2013).
Kekhawatiran sehubungan dengan penggunaan Seprafilm adalah peningkatan
kejadian abses dan kebocoran anastomosis saat reseksi dan anastomosis usus. Untuk
menurunkan kejadian kebocoran anastomose, disarankan agar anastomose tidak
Namun penelitian keamanan dan efikasi seprafilm menunjukkan bahwa tidak ada
perubahan yang signifikan akan morbiditas secara keseluruhan, kebocoran
anastomose, dan pembentukan abses, antara pemakaian Seprafilm dengan placebo
(Kumar et al., 2009). Pembentukan fistula, reaksi benda asing, terkumpulnya cairan
intraperitoneal adalah komplikasi lain yang dilaporkan (Omer dan Al-Harizi, 2014).
Guardix-sol merupakan bahan yang mengandung HA dan CMC dalam bentuk
cair. Bahan ini mempunyai biokompatibilitas, non-imunogenik, dapat diserap dan
mudah diaplikasikan (Primariawan, 2010). Bahan ini membentuk barrier dengan cara
disemprotkan ke tempat cedera peritoneum yang rentan terhadap adhesi. Larutan
yang sangat kental ini melekat ke jaringan tersebut, dan setelah beberapa hari,
terhidrolisis, terabsorpsi, dan diekskresi oleh ginjal. Bahan ini juga bersifat spesifik
terhadap lokasi aplikasi sehingga bisa digunakan untuk cedera peritoneum yang
multiple (Park et al., 2011).
2.6.2 Peran Dextran dalam Mencegah Adhesi Intraperitoneal
Dextran merupakan larutan yang larut dalam air. Dengan berat molekul yang
besar sehingga dextran tidak langsung diserap dari permukaan peritoneum, ia
mengakibatkan terjadinya hydrofloatation (melalui osmosis) dan memisahkan
jaringan-jaringan yang cedera (Akerberg, 2013). Selain itu, perubahan struktur fibrin
yang terjadi akibat pemberian dextran juga turut berperan dalam mencegah adhesi,
sehingga dextran pernah sering digunakan secara intraperitoneal dalam pembedahan
fertilitas sebagai bagian dari protokol pencegahan adhesi pada tahun 1980-an (Cimen
Efek samping yang dilaporkan sehubungan dengan penggunaan dextran yaitu
ascites, syok anafilaktik, dan koagulopati. Kondisi yang terakhir diperkirakan terjadi
karena peningkatan tPA dan penurunan faktor koagulasi yang terjadi setelah
pemberian dextran (Akerberg, 2013). Dextran diperkirakan mempunyai efek
antitrombotik dan antiplatelet, namun mekanismenya belum diketahui dengan jelas.
Dextran diperkirakan menghambat uptake tPa oleh mannose receptor pada lapisan
endotel, sehingga tPA terus mengaktivasi fibrinolisis dengan mengubah plasminogen
menjadi plasmin. Plasmin mengandung pula von Willebrand factor (vWF) dan
platelet protease-activated receptor-1 (PAR-1), yang mendesensitisasi respon platelet
terhadap thrombin (Jones et al., 2008).
Dextran dapat melepaskan TGF β dari bentuk tidak aktifnya yang terikat
plasma, sehingga meningkatkan efeknya dan malah meningkatkan kejadian adhesi.
Dextran dapat pula mengaktivasi dan menginduksi pelepasan IL-1β oleh peritoneum,
mengaktivasi sel imun di daerah tersebut, sehingga memodulasi respon imun ketika