BAB I PENDAHULUAN
Pada tumbuhan tingkat tinggi, regulasi dan koordinasi metabolisme, pertumbuhan, dan morfogenesis sering bergantung pada sinyal kimia dari satu bagian tanaman yang lain. Ide ini berasal dari abad kesembilan belas dengan Jerman botani Julius von Sachs (1832-1897). Sachs mengusulkan bahwa pembawa pesan kimia yang bertanggung jawab untuk pembentukan dan pertumbuhan organ tanaman yang berbeda. Dia juga menyarankan bahwa faktor-faktor eksternal seperti gravitasi bisa mempengaruhi distribusi zat ini dalam tanaman. Meskipun Sachs tidak tahu identitas pembawa pesan kimia ini, ide-idenya akhirnya dapat menyebabkan penemuan tentang pesan kimia itu.
Banyak konsep-konsep tentang komunikasi yang terjadi pada tanaman telah diturunkan dari penelitian serupa pada hewan. Pada hewan pembawa pesan kimia yang memediasi komunikasi disebut hormon. Hormon berinteraksi dengan protein seluler tertentu yang disebut reseptor. Kebanyakan hormon hewan disintesis dan disekresi di salah satu bagian tubuh dan ditransfer ke situs target tertentu di bagian lain dari tubuh melalui aliran darah. Hormon hewan jatuh ke dalam empat kategori umum: protein, peptida kecil, turunan asam amino, dan steroid.
Tanaman juga memproduksi molekul sinyal yang disebut hormon, yang memiliki efek mendalam pada pengembangan pada konsentrasi makin rendah. Sampai baru-baru ini, perkembangan tanaman dianggap diatur hanya oleh lima jenis hormon: auksin, giberelin, sitokinin, etilen, dan asam absisat. Namun, sekarang ada bukti kuat untuk keberadaan hormon steroid tanaman, brassinosteroids, yang memiliki berbagai efek pada morfologi perkembangan tanaman. (Brassinosteroids sebagai hormon tanaman dibahas di Web Essay 19.1.)
Berbagai molekul sinyal lain yang berperan dalam resistensi terhadap patogen dan pertahanan terhadap herbivora juga telah diidentifikasi, termasuk asam jasmonic, asam salisilat, dan systemin polipeptida (lihat Bab 13). Dengan demikian jumlah dan jenis hormon dan agen sinyal seperti hormon pada tanaman terus berkembang.
Selain itu, baik auksin dan sitokinin berbeda dari hormon tanaman lain dan agen sinyal dalam satu hal penting: Mereka diperlukan untuk kelangsungan hidup. Sejauh ini, tidak ada mutan kurang baik dari auksin atau sitokinin yang telah ditemukan, menunjukkan bahwa mutasi menghilangkan sifat mereka yang mematikan. Sedangkan hormon tanaman lain tampaknya untuk bertindak sebagai on / off switch yang mengatur proses perkembangan tertentu, auksin dan sitokinin tampaknya diperlukan pada tingkat tertentu lebih atau kurang terus-menerus.
BAB II PEMBAHASAN
A. Munculnya Konsep Auksin
Selama bagian akhir abad kesembilan belas, Charles Darwin dan putranya Francis mempelajari fenomena pertumbuhan tanaman yang melibatkan tropisme. Salah satu minat mereka adalah membengkonya tanaman ke arah cahaya. Fenomena ini, yang disebabkan oleh pertumbuhan diferensial, disebut fototropisme. Dalam beberapa eksperimen Darwin menggunakan bibit rumput kenari (Phalaris canariensis), di mana, seperti di banyak rumput lain, daun termuda yang dilapisi organ pelindung yang disebut koleoptil (Gambar 19.1).
Koleoptil sangat sensitif terhadap cahaya, terutama cahaya biru (lihat Bab 18). Jika di sinari pada satu sisi dengan pulse pendek cahaya biru redup, mereka akan berusaha (tumbuh) menuju sumber pulse cahaya dalam waktu satu jam. Darwin menemukan bahwa ujung koleoptil dikenakan cahaya, karena jika mereka menutupi ujung dengan foil, koleoptil tidak akan membungkuk. Tapi kawasan dari koleoptil yang bertanggung jawab untuk membengkok terhadap cahaya, yang disebut zona pertumbuhan, adalah beberapa milimeter di bawah ujung.
Dengan demikian mereka menyimpulkan bahwa semacam sinyal diproduksi di ujung, perjalanan ke zona pertumbuhan, dan menyebabkan sisi teduh untuk tumbuh lebih cepat dari sisi diterangi. Hasil eksperimen mereka dipublikasikan pada tahun 1881 dalam sebuah buku yang luar biasa berjudul The Power of Mutasi Tanaman.
Pada periode panjang eksperimentasinya diikuti oleh banyak peneliti pada sifat stimulus pertumbuhan coleoptiles. Penelitian ini memuncak dalam demonstrasi pada tahun 1926 oleh Frits Went kehadiran bahan kimia mempromosikan pertumbuhan di ujung oat (Avena sativa) coleoptiles. Hal itu diketahui bahwa jika ujung koleoptil telah dihapus, pertumbuhan koleoptil berhenti. Pekerja sebelumnya telah berusaha untuk mengisolasi dan mengidentifikasi bahan kimia mempromosikan pertumbuhan dengan menumbuk koleoptil dan menguji aktivitas ekstrak. Pendekatan ini gagal karena menumbuk jaringan dilepaskan ke zat ekstrak penghambatan yang biasanya telah terkotak dalam sel.
kemampuan mereka untuk menyebabkan membungkuk dalam ketiadaan sumber cahaya unilateral (lihat Gambar 19.1). Karena zat tersebut mempromosikan pemanjangan bagian koleoptil (Gambar 19.2), Zat itu akhirnya disebut auksin dari auxein Yunani, yang berarti "untuk meningkatkan" atau "untuk tumbuh."
Dari percobaan pada koleoptil phototropism, Darwin menyimpulkan pada tahun 1880 bahwa stimulus pertumbuhan diproduksi di ujung koleoptil dan ditularkan ke zona pertumbuhan.
Pada tahun 1913, P. Boysen-Jensen menemukan bahwa stimulus pertumbuhan melewati gelatin tetapi tidak melalui hambatan air impermeabel seperti mika.
Pada tahun 1919, A. Paal memberikan bukti bahwa pertumbuhan mempromosikan stimulus yang diproduksi di ujung adalah senyawa kimia di alam.
Pada tahun 1926, FW Went menunjukkan bahwa pertumbuhan aktif mengirimkan zat yang dapat berdifusi ke blok gelatin. Dia juga merancang uji
koleoptil-pembengkokan untuk
analisis kuantitatif auksin.
Went mempelajari dengan blok agar menunjukkan dengan tegas bahwa pertumbuhan-mempromosikan "pengaruh" menyebar dari ujung koleoptil adalah zat kimia. Fakta bahwa zat tersebut diproduksi di satu lokasi dan diangkut dalam waktu singkat ke tempat kerjanya memenuhi syarat sebagai hormon tanaman otentik.
Dalam tahun-tahun berikutnya, identitas kimia dari "pertumbuhan substansi" ditentukan, dan karena menggunakan potensinya pertanian, banyak analog kimia terkait diuji. Tes ini menyebabkan generalisasi tentang persyaratan kimia untuk aktivitas auksin. Sejalan dengan penelitian ini, teknik difusi agar blok sedang diterapkan untuk masalah transportasi auksin. Kemajuan teknologi, khususnya penggunaan isotop sebagai pelacak, memungkinkan ahli biokimia tanaman untuk mengungkap jalur biosintesis auksin dan kerusakan.
Diskusi kita dimulai dengan sifat kimia auksin dan berlanjut dengan deskripsi biosintesis, transportasi, dan metabolisme. Metode analisis semakin kuat dan penerapan pendekatan biologi molekular baru-baru ini memungkinkan para ilmuwan untuk mengidentifikasi prekursor auksin dan mempelajari pergerakan auksin dan distribusi di dalam tanaman.
C. Materi Utama Auksin pada Tumbuhan Tinggi Adalah Asam Indole-3-asetat Pada pertengahan 1930-an ditetapkan bahwa auksin adalah asam indol-3acetic (IAA). Beberapa auksin lain pada tanaman yang lebih tinggi ditemukan kemudian (Gambar 19.3), tapi IAA adalah yang paling berlimpah dan fisiologis yang relevan. Karena struktur IAA relatif sederhana, laboratorium akademik dan industri dengan cepat mampu membuat dalam skala luas berbagai molekul dengan aktivitas auksin. Beberapa di antaranya digunakan sebagai herbisida dalam hortikultura dan pertanian (Gambar 19.4) (untuk auksin sintetis tambahan, lihat Web Topik 19.1).
2,4-Dichlorophenoxyacetic acid (2,4-D) 2-Methoxy-3, 6-dichlorobenzoic acid (dicamba)
Definisi awal auksin mencantumkan semua zat kimia alami dan sintetis yang merangsang pemanjangan di coleoptiles dan bagian batang. Namun, auksin mempengaruhi banyak proses perkembangan selain pemanjangan sel. Dengan demikian auksin dapat didefinisikan sebagai senyawa dengan aktivitas biologis yang mirip dengan IAA, termasuk kemampuan untuk mempromosikan pemanjangan sel pada koleoptil dan bagian batang, pembelahan sel dalam kultur kalus di hadapan sitokinin, pembentukan akar adventif pada daun dan batang terpisah, dan fenomena perkembangan lain yang terkait dengan tindakan IAA.
GAMBAR 19.2 Auksin merangsang pemanjangan gandum bagian koleoptil. Ini bagian koleoptil diinkubasi selama 18 jam baik dalam air (A) atau auksin (B). Warna kuning jaringan di dalam koleoptil transparan adalah daun primer. (Foto © M. B. Wilkins.)
Meskipun mereka secara kimiawi beragam, bentuk umum dari semua auksin aktif adalah jarak molekul sekitar 0,5 nm antara muatan positif pecahan pada cincin aromatik dan gugus karboksil bermuatan negatif (lihat Web Topik 19.2).
Cl
H
D. Auksin dalam Sampel Biologi Bisa diukur
Tergantung pada informasi bahwa kebutuhan peneliti, jumlah dan / atau identitas auksin dalam sampel biologis dapat ditentukan dengan uji hayati, spektrometri massa, atau enzyme-linked immunosorbent assay, yang disingkat sebagai ELISA (lihat Web Topik 19.3).
Bioassay adalah suatu pengukuran data tentang efek dari yang diketahui atau diduga zat aktif biologis pada materi hidup. Dalam karya rintisannya lebih dari 60 tahun yang lalu, Went digunakan Avena sativa (gandum) coleoptiles dalam teknik yang disebut Avena uji kelengkungan koleoptil (lihat Gambar 19.1). Koleoptil melengkung karena peningkatan auksin di satu sisi mendorong perpanjangan sel, dan penurunan auksin di sisi lain (karena tidak adanya ujung koleoptil) menyebabkan penurunan tingkat pertumbuhan fenomena yang disebut pertumbuhan diferensial.
Went menemukan bahwa ia bisa memperkirakan jumlah auksin dalam sampel dengan mengukur dihasilkan kelengkungan koleoptil. Auksin bioassay masih digunakan saat ini untuk mendeteksi adanya aktivitas auksin dalam sampel. Tanaman Avena koleoptil uji kelengkungan adalah ukuran sensitif aktivitas auksin (itu efektif untuk konsentrasi IAA dari sekitar 0,02-0,2 mg L-1). Bioassay lain mengukur perubahan auksin yang diinduksi dalam pertumbuhan lurus Avena coleoptiles mengambang dalam larutan (lihat Gambar 19.2). Kedua bioassay ini dapat membangun kehadiran auksin dalam sampel, tetapi mereka tidak dapat digunakan untuk kuantifikasi yang tepat atau identifikasi senyawa tertentu.
E. IAA disintesis di meristem, daun muda, dan Pengembangan Buah dan Benih
IAA biosintesis dikaitkan dengan membelah dengan cepat dan tumbuh cepat jaringan, terutama di tunas. Meskipun hampir semua jaringan tanaman tampaknya mampu menghasilkan rendahnya tingkat IAA, menembak meristem apikal, daun muda, dan mengembangkan buah-buahan dan biji-bijian adalah situs utama dari sintesis IAA (Ljung et al. Dalam pers).
Dalam primordia daun sangat muda dari Arabidopsis, auksin disintesis di ujung. Selama perkembangan daun ada pergeseran bertahap dalam tempat produksi auksin basipetally sepanjang tepi, dan kemudian, di wilayah tengah lamina. Pergeseran basipetal dalam produksi auksin berkorelasi erat dengan, dan mungkin kausal berkaitan dengan, urutan pematangan basipetal pengembangan daun dan diferensiasi vaskular (Aloni 2001).
Dengan menggabungkan GUS ((3-glukuronidase) gen pelapor ke promotor yang mengandung unsur respon auksin, dan mengubah daun Arabidopsis dengan konstruksi ini dalam Ti plasmid menggunakan Agrobacterium, adalah mungkin untuk memvisualisasikan distribusi auksin bebas muda, mengembangkan daun. Dimanapun auksin bebas diproduksi, ekspresi GUS terjadi dan dapat dideteksi histokimia. Dengan menggunakan teknik ini, baru-baru ini menunjukkan bahwa auksin diproduksi oleh sekelompok sel yang terletak di lokasi di mana hydathodes akan berkembang (Gambar 19.5).
Hydathodes adalah modifikasi seperti kelenjar dari tanah dan jaringan vascular, biasanya pada margin daun, yang memungkinkan pelepasan air cair (cairan guttation) melalui pori-pori di epidermis di hadapan tekanan akar (lihat Bab 4). Seperti ditunjukkan dalam Gambar 19.5, selama tahap-tahap awal diferensiasi hydathode pusat sintesis auksin tinggi terbukti sebagai terkonsentrasi biru GUS noda gelap (tanda panah) di lobus dari bergerigi daun Arabidopsis (Aloni et al. 2002). Jejak difus aktivitas GUS menuju ke diferensiasi unsur pembuluh dalam untai vaskular berkembang. Ini mikrograf yang luar biasa menangkap proses diferensiasi vaskular auksin diatur dalam tindakan yang sangat!
GAMBAR 19,5 Deteksi situs sintesis auksin dan pengangkutan dalam primordial daun muda DR5 Arabidopsis melalui seorang reporter gen GUS dengan promotor auksin-sensitif. Selama tahap awal diferensiasi hydathode, pusat auksin sintesis terbukti sebagai terkonsentrasi biru GUS noda gelap (tanda panah) di lobus dari margin daun bergerigi. Sebuah gradien aktivitas GUS diencerkan memanjang dari margin menuju untai vaskular diferensiasi (panah), yang berfungsi sebagai penyerap untuk aliran auksin berasal lobus. (Courtesy of R. Aloni dan C. I. Ullrich.)
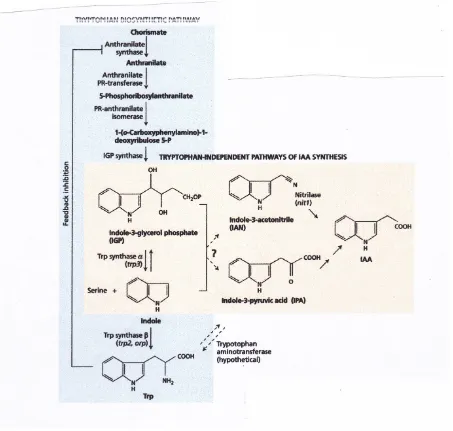
F. Beberapa jalur untuk Biosintesis IAA
IAA secara struktural terkait dengan asam amino triptofan, dan studi awal auksin biosintesis difokuskan pada triptofan sebagai kemungkinan prekursor. Namun, penggabungan eksogen berlabel triptofan (misalnya, [3H] triptofan) menjadi IAA oleh jaringan tanaman telah terbukti sulit untuk menunjukkan. Namun demikian, sebuah badan besar bukti kini telah terkumpul menunjukkan bahwa tanaman mengkonversi tryptophan ke IAA oleh beberapa jalur, yang dijelaskan dalam paragraf berikut.
Jalur IPA . Asam indole-3-piruvat (IPA) jalur (lihat Gambar 19.6C), mungkin yang paling umum dari jalur triptofan-dependen. Ini melibatkan reaksi deaminasi untuk membentuk IPA, diikuti oleh reaksi dekarboksilasi untuk membentuk indole-3-asetaldehida (IAld). Indole-3 indole-3-asetaldehida kemudian dioksidasi menjadi IAA oleh dehidrogenase spesifik.
Jalur IAN . Dalam indole-3-asetonitril (IAN) jalur (lihat Gambar 19.6B), triptofan pertama-tama diubah indole-3-acetaldoxime dan kemudian ke indole-3-asetonitril. Enzim yang mengubah IAN ke IAA disebut nitrilase. The IAN jalur mungkin penting dalam hanya tiga keluarga tanaman: Brassicaceae (keluarga mustard), Poaceae (keluarga rumput), dan Musaceae (keluarga pisang). Namun demikian, gen atau kegiatan nitrilase-seperti baru-baru ini telah diidentifikasi dalam Cucurbitaceae (keluarga labu), Solanaceae (keluarga tembakau), Fabaceae (kacang-kacangan), dan Rosaceae (keluarga mawar).
Empat gen (NIT1 melalui NIT4) yang menyandikan enzim nitrilase kini telah diklon dari Arabidopsis. Ketika NIT2 diungkapkan dalam tembakau transgenik, tanaman yang dihasilkan diperoleh kemampuan untuk menanggapi IAN sebagai auksin dengan hidrolisis untuk IAA (Schmidt et al. 1996).
Biosintesis lain dari triptofan pathwayone tergantung yang menggunakan indole-3-asetamida (IAM) sebagai perantara (lihat Figure19.6A)-digunakan oleh berbagai bakteri patogen, seperti Pseudomonas savastanoi dan Agrobacterium tumefaciens. Jalur ini melibatkan dua enzim triptofan monooxygenase dan IAM hidrolase. Para auksin yang dihasilkan oleh bakteri ini sering menimbulkan perubahan morfologi di tempat tanaman mereka.
GAMBAR 19.6 Jalur Tryptophan tergantung dari IAA biosintesis pada tumbuhan dan bakteri. Enzim-enzim yang hadir hanya dalam bakteri ditandai dengan tanda bintang. (Setelah Bartel 1997.)
G. IAA Apakah Juga disintesis dari Indole atau dari Indole-3-fosfat Gliserol
triptofan eksogen untuk bertahan hidup. Namun, baik bibit orp maupun bibit jenis liar dapat mengubah tryptophan ke IAA, bahkan ketika bibit mutan diberikan cukup triptofan untuk membalikkan efek mematikan dari mutasi.
Meskipun blok triptofan biosintesis, yang orp mutan mengandung jumlah IAA 50 kali lipat lebih tinggi daripada tanaman jenis liar (Wright et al. 1991). Signficantly, ketika bibit orp diberi makan [15N] anthranilate (lihat Gambar 19.8), label kemudian muncul di IAA, tapi tidak di triptofan. Hasil ini memberikan bukti eksperimental yang terbaik untuk jalur triptofan-independen IAA biosintesis.
Penelitian lebih lanjut menetapkan bahwa titik cabang untuk biosintesis IAA adalah salah indole atau prekursor, indole-3 gliserol fosfat (lihat Gambar 19.8). IAN dan IPA yang mungkin intermediet, tetapi prekursor langsung dari IAA di jalur triptofan-independen belum teridentifikasi.
Penemuan jalur triptofan-independen telah berubah drastis pandangan kita tentang biosintesis IAA, tetapi kepentingan relatif dari dua jalur (triptofan tergantung vs triptofan-independen) adalah kurang dipahami. Dalam beberapa tanaman telah menemukan bahwa jenis IAA jalur biosintesis bervariasi antara jaringan yang berbeda, dan di antara waktu yang berbeda pembangunan. Sebagai contoh, selama embriogenesis pada wortel, jalur tergantung triptofan penting sangat awal dalam pembangunan, sedangkan jalur triptofan-independen mengambil alih segera setelah sumbu akar-tunas dibentuk. (Untuk bukti lebih dari biosintesis triptofan-independen IAA, lihat Web Topik 19.4.)
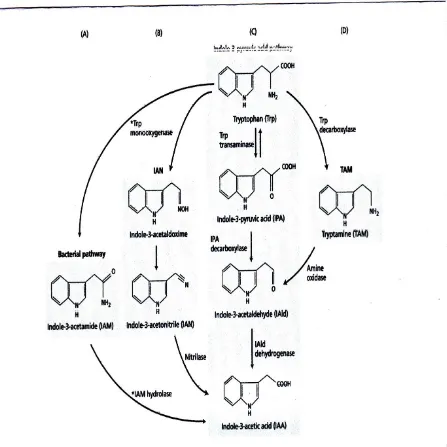
H. Kebanyakan IAA di Tanaman Berbentuk Ikatan Kovalen
Meski bebas IAA adalah bentuk biologis aktif hormon, sebagian besar auksin pada tanaman ini ditemukan dalam keadaan ikatan kovalen . Ini terkonjugasi, atau "terikat," auksin telah diidentifikasi dalam semua tanaman yang lebih tinggi dan dianggap hormon aktif.
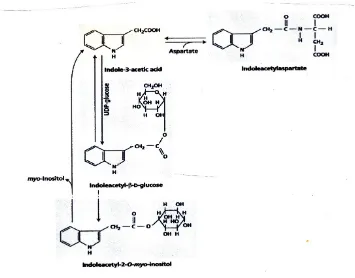
IAA telah ditemukan konjugasi kedua senyawa tinggi dan rendah molekul-berat. • auksin terkonjugasi rendah molekul-berat meliputi ester IAA dengan glukosa atau
konjugasi myo-inositol dan amida seperti IAA-N-aspartat (Gambar 19.9).
• Tinggi-berat molekul IAA konjugat termasuk IAA glukan (unit glukosa 7-50 per IAA) dan IAA-glyco-protein yang ditemukan dalam biji serealia.
Senyawa yang IAA adalah terkonjugasi dan tingkat konjugasi tergantung pada enzim konjugasi tertentu. Reaksi paling dipelajari adalah konjugasi IAA menjadi glukosa di Zea mays.
Konsentrasi tertinggi auksin gratis di tanaman hidup berada di meristem apikal tunas dan daun muda karena ini adalah situs utama dari sintesis auksin. Namun, auksin didistribusikan secara luas di tanaman. Metabolisme auksin konjugasi mungkin merupakan faktor utama dalam regulasi tingkat auksin bebas. Sebagai contoh, selama perkecambahan biji Zea mays, IAA-myo-inositol translokasi dari endosperm ke koleoptil melalui floem. Setidaknya sebagian dari IAA bebas yang dihasilkan dalam tips koleoptil dari Zea mays diyakini berasal dari hidrolisis IAA-myo-inositol.
Selain itu, rangsangan lingkungan seperti cahaya dan gravitasi telah ditunjukkan untuk mempengaruhi baik tingkat auksin konjugasi (pengangkatan auksin gratis) dan laju pelepasan gratis auksin (hidrolisis auksin terkonjugasi). Pembentukan auksin terkonjugasi dapat melayani fungsi lain juga, termasuk penyimpanan dan perlindungan terhadap degradasi oksidatif.
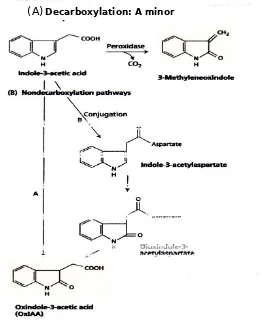
I. IAA didegradasi oleh Beberapa jalur
perubahan dalam tingkat IAA tanaman transgenik diamati dengan baik sepuluh kali lipat peningkatan dalam ekspresi peroksidase atau sepuluh kali lipat represi aktivitas peroksidase (Normanly et al. 1995).
Atas dasar pelabelan isotop dan identifikasi metabolit, dua jalur oksidatif lain yang lebih mungkin untuk terlibat dalam degradasi dikendalikan IAA (lihat Gambar 19.10B). Produk akhir dari jalur ini adalah asam asetat-oxindole3 (OxIAA), senyawa alami dalam endosperm dan menuju jaringan Zea mays. Dalam satu jalur, IAA teroksidasi tanpa dekarboksilasi untuk OxIAA.
Di jalur lain, IAA-aspartat konjugat teroksidasi pertama ke menengah dioxindole-3-acetylaspartate, dan kemudian ke OxIAA.
In vitro, IAA dapat dioksidasi nonenzymatically bila terkena cahaya intensitas tinggi, dan photodestruction in vitro dapat dipromosikan oleh pigmen tumbuhan seperti riboflavin. Meskipun produk auksin fotooksidasi telah diisolasi dari tanaman, peran, jika ada, dari jalur fotooksidasi in vivo diduga menjadi kecil.
J. Ada dua Tempat/ Pools Subselular IAA: Sitosol dan Kloroplas
Distribusi IAA dalam sel tampaknya diatur terutama oleh pH. Karena IAA-tidak melintasi membran tanpa bantuan, sedangkan IAAH mudah berdifusi melintasi membran,auksin cenderung terakumulasi dalam kompartemen lebih basa dari sel.
Distribusi IAA dan metabolitnya telah dipelajari dalam sel tembakau. Sekitar sepertiga dari IAA ditemukan dalam kloroplas, dan sisanya terletak di sitosol. IAA konjugat berlokasi secara eksklusif dalam sitosol. IAA dalam sitosol dimetabolisme baik oleh konjugasi atau katabolisme nondecarboxylative (lihat Gambar 19.10). IAA dalam kloroplas dilindungi dari proses ini, tetapi diatur oleh jumlah IAA dalam sitosol, yang mana berada dalam ekuilibrium (Sitbon et al. 1993).
Faktor-faktor yang mengatur konsentrasi steady-state auksin bebas dalam sel tanaman diagram diringkas dalam Web Topik 19,5.
GAMBAR 19.10 Biodegradasi IAA. (A) peroksidase rute (jalur dekarboksilasi) memainkan
K. Pengangkutan Auksin
Sumbu utama tunas dan akar, bersama dengan cabang-cabang mereka, menunjukkan polaritas struktural puncak-dasar, dan polaritas struktural ini berawal pada polaritas transportasi auksin. Segera setelah Pergi mengembangkan tes kelengkungan koleoptil untuk auksin, ditemukan bahwa IAA bergerak terutama dari apikal ke basal akhir (basipetally) di bagian koleoptil dipotong oat. Jenis transportasi searah disebut transportasi kutub. Auksin adalah satu-satunya hormon pertumbuhan tanaman yang dikenal untuk diangkut polarly.
Karena apeks pucuk berfungsi sebagai sumber utama auksin untuk seluruh tanaman, transportasi kutub telah lama diyakini menjadi penyebab utama dari gradien auksin membentang dari ujung akar ke ujung akar. The memanjang gradien auksin dari tunas ke akar mempengaruhi berbagai proses perkembangan, termasuk pemanjangan batang, dominasi apikal, penyembuhan luka, dan penuaan daun.
Baru-baru ini telah diakui bahwa sejumlah besar auksin transportasi juga terjadi pada floem, dan floem mungkin adalah rute utama dimana auksin diangkut acropetally (yaitu, menuju ujung) di root. Dengan demikian, lebih dari satu jalur bertanggung jawab untuk distribusi auksin di tanaman.
1. Transportasi kutub Membutuhkan Energi dan bebas dari Gravitasi
Untuk mempelajari transportasi kutub, para peneliti telah menggunakan metode blok agar donor-penerima (Gambar 19.11): Sebuah blok agar yang mengandung radioisotop-berlabel auksin (blok donor) ditempatkan pada salah satu ujung segmen jaringan, dan blok penerima ditempatkan pada ujung lainnya. Pergerakan auksin melalui jaringan ke blok penerima dapat ditentukan dari waktu ke waktu dengan pengukuran radioaktivitas di blok penerima.
Dari banyak studi tersebut, sifat-sifat umum transportasi IAA kutub telah muncul. Jaringan berbeda dalam derajat polaritas transportasi IAA. Dalam coleoptiles, batang vegetatif, dan tangkai daun, transportasi basipetal mendominasi. Transportasi kutub tidak terpengaruh oleh orientasi jaringan (setidaknya selama periode waktu yang singkat), sehingga tidak tergantung pada gravitasi.
peningkatan konsentrasi auksin, auksin harus diangkut basipetally di batang bahkan ketika pemotongan yang berorientasi terbalik.
Hasil transportasi kutub secara sel-sel, daripada melalui symplast tersebut. Artinya, auksin keluar sel melalui membran plasma, berdifusi melintasi kompleks tengah lamella, dan memasuki sel bawah melalui membran plasma. Hilangnya auksin dari sel disebut auksin penghabisan, masuknya auksin ke dalam sel disebut auksin serapan atau masuknya. Proses keseluruhan membutuhkan energi metabolik, sebagaimana dibuktikan oleh sensitivitas transportasi kutub ke O2 kekurangan dan inhibitor metabolik.
Kecepatan transportasi auksin polar adalah 5 sampai 20 cm h-1-lebih cepat dari laju difusi (lihat Web Topik 3.2), tapi lebih lambat daripada tingkat translokasi floem (lihat Bab 10). Transportasi kutub juga spesifik untuk auksin aktif, baik alam dan sintetis. Baik analog auksin tidak aktif atau metabolit auksin diangkut polarly, menunjukkan bahwa transportasi kutub melibatkan operator protein spesifik pada membran plasma yang dapat mengenali hormon dan analog aktif.
Tempat utama basipetal transportasi auksin kutub di batang dan daun adalah jaringan parenkim pembuluh angkut. Coleoptiles tampaknya menjadi pengecualian dalam transportasi kutub basipetal terjadi terutama di jaringan nonvascular. Transportasi kutub Acropetal di root secara khusus terkait dengan xilem parenkim dari prasasti (Palme dan Galweiler 1999). Namun, seperti yang akan kita lihat nanti dalam bab ini, sebagian besar auksin yang mencapai ujung akar translokasi melalui floem.
GAMBAR 19.11 Metode standar untuk mengukur transportasi auksin polar. Polaritas transportasi adalah independen dari orientasi terhadap gravitasi.
GAMBAR 19,12 Akar tumbuh dari ujung basal dari bagian bambu, bahkan ketika mereka terbalik. Bentuk akar di ujung basal karena transportasi auksin polar sekali di dalam jerami adalah independen dari gravitasi. (Foto © M. B. Wilkins.)
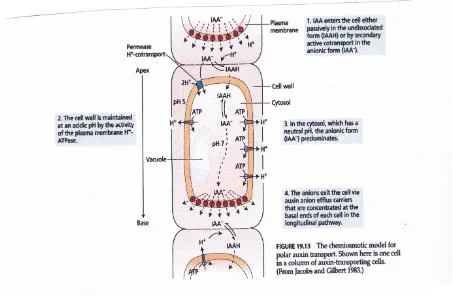
Penemuan mekanisme kemiosmotik transportasi zat terlarut pada akhir tahun 1960 (lihat Bab 6) menyebabkan penerapan model ini untuk transportasi auksin polar. Menurut model kemiosmotik sekarang berlaku umum untuk transportasi auksin polar, auksin serapan didorong oleh proton kekuatan motif (AE + APH) melintasi membran plasma, sedangkan auksin penghabisan didorong oleh potensial membran, AE. (Kekuatan motif Proton dijelaskan secara lebih rinci dalam Web 6.3 dan Topik Bab 7.)
Sebuah fitur penting dari model transportasi kutub adalah bahwa auksin penghabisan pembawa dilokalisasi di ujung basal sel melakukan (Gambar 19.13). Bukti untuk setiap langkah dalam model ini dianggap terpisah dalam pembahasan berikut ini.
Masuknya Auksin . Langkah pertama dalam transportasi kutub adalah auksin masuknya. Menurut model, auksin dapat memasuki sel-sel tumbuhan dari segala arah oleh salah satu dari dua mekanisme:
1. Difusi pasif dari terprotonasi (IAAH) bentuk di seluruh lapisan ganda fosfolipid 2. Transpor aktif sekunder dipisahkan (IAA-) bentuk melalui 2H +-IAA-symporter
Ganda jalur auksin serapan muncul karena permeabilitas membran pasif untuk auksin sangat tergantung pada pH apoplastic.
Bentuk terdisosiasi asam indol-3-asetat, di mana kelompok karboksil terprotonasi, adalah lipofilik dan mudah berdifusi melintasi membran lipid bilayer. Sebaliknya, bentuk dipisahkan dari auksin bermuatan negatif dan karena itu tidak melintasi membran tanpa bantuan. Karena membran plasma H +-ATPase biasanya mempertahankan solusi dinding sel pada sekitar pH 5, sekitar setengah dari auksin (pKa = 4,75) di apoplast akan dalam bentuk terdisosiasi dan akan berdifusi pasif melintasi membran plasma menuruni gradien konsentrasi. Dukungan eksperimental untuk tergantung pH, serapan auksin pasif pertama kali diberikan oleh demonstrasi yang IAA serapan oleh sel tanaman meningkat sebagai pH ekstraselular diturunkan dari netral ke nilai lebih asam.
Sebuah carrier-mediated, mekanisme serapan aktif sekunder terbukti saturable dan spesifik untuk auksin aktif (Lomax 1986). Dalam percobaan di mana APH dan nilai-nilai AE terisolasi membran vesikel dari zucchini (Cucurbita pepo) hipokotil dimanipulasi artifisial, penyerapan auksin radiolabeled terbukti dirangsang dengan adanya gradien pH, seperti pada serapan pasif, tetapi juga ketika bagian dalam vesikel tersebut bermuatan negatif relatif terhadap luar.
Ini dan lainnya percobaan menyarankan bahwa H +-IAA-symporter cotransports dua proton bersama dengan anion auksin. Ini transpor aktif sekunder auksin memungkinkan untuk akumulasi auksin lebih besar daripada difusi sederhana tidak karena didorong melintasi membran oleh kekuatan motif proton.
Auksin penghabisan. Setelah IAA memasuki sitosol, yang memiliki pH sekitar 7,2, hampir semua itu akan memisahkan ke bentuk anionik. Karena membran kurang permeabel terhadap IAA-daripada IAAH, IAA-akan cenderung menumpuk dalam sitosol. Namun, banyak dari auksin yang memasuki sel lolos melalui anion pembawa penghabisan auksin. Menurut model kemiosmotik, transportasi IAA-keluar dari sel didorong oleh bagian dalam potensial membran negatif.
Seperti disebutkan sebelumnya, ciri utama dari model kemiosmotik untuk transportasi kutub adalah bahwa IAA-penghabisan berlangsung istimewa pada akhir basal setiap sel. Pengulangan auksin serapan pada akhir apikal pelepasan sel dan preferensial dari dasar setiap sel dalam jalur menimbulkan total efek transportasi kutub. Sebuah keluarga diduga auksin pembawa penghabisan dikenal sebagai protein PIN (dinamai perbungaan pin berbentuk dibentuk oleh mutan pin1 dari Arabidopsis, Gambar 19.14A) terlokalisasi tepat seperti model akan memprediksi-yaitu, pada ujung basal melakukan sel (lihat Gambar 19.14B).
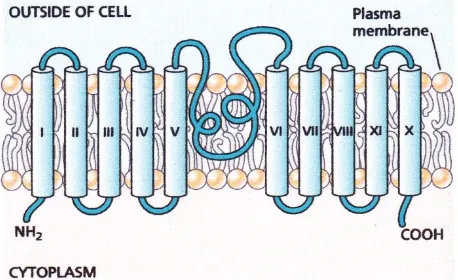
Protein PIN memiliki 10 sampai 12 transmembran daerah karakteristik dari superfamili utama bakteri dan eukariotik transporter, yang meliputi protein resistensi obat dan gula transporter (Gambar 19.15). Meskipun kesamaan topologi untuk transporter lain, studi terbaru menunjukkan bahwa PIN mungkin memerlukan protein lain untuk kegiatan, dan dapat menjadi bagian dari kompleks protein yang lebih besar.
GAMBAR 19.15 Topologi dari PIN1 protein dengan sepuluh segmen transmembran dan loop hidrofilik besar di tengah. (Setelah Palme dan Galweiler 1999.)
3. Inhibitor Auksin Transportasi Blok Auxin penghabisan
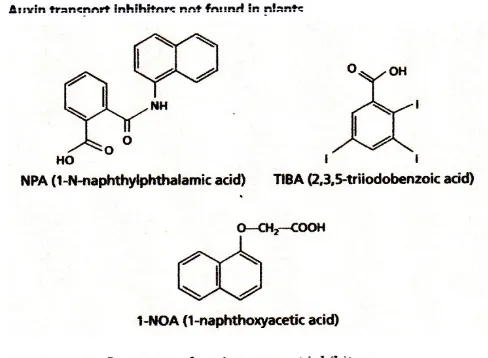
Beberapa senyawa telah disintesis yang dapat bertindak sebagai auksin inhibitor transport (ATIS), termasuk NPA (1-Nnaphthylphthalamic asam) dan TIBA (asam 2,3,5-Triiodobenzoic) (Gambar 19.16). Inhibitor ini memblokir transportasi kutub dengan mencegah auksin penghabisan. Kita dapat menunjukkan fenomena ini dengan memasukkan NPA atau TIBA menjadi baik donor atau blok penerima dalam percobaan transportasi auksin. Kedua senyawa menghambat auksin penghabisan ke blok penerima, tetapi mereka tidak mempengaruhi penyerapan auksin dari blok donor. Beberapa ATIS, seperti TIBA, yang memiliki aktivitas auksin lemah dan diangkut polarly, dapat menghambat transportasi kutub sebagian oleh bersaing dengan auksin untuk situs mengikat pada operator penghabisan. Lainnya, seperti NPA, tidak diangkut polarly dan diyakini mengganggu transportasi auksin dengan mengikat protein yang terkait dalam kompleks dengan pembawa penghabisan. NPA protein mengikat seperti ini juga ditemukan di ujung basal sel melakukan, konsisten dengan lokalisasi protein PIN (Jacobs dan Gilbert 1983).
(1-KKP) (lihat Gambar 19.16) blok auksin penyerapan ke dalam sel, dan ketika diterapkan pada tanaman Arabidopsis menyebabkan akar agravitropism mirip dengan yang ada pada aux1 mutan. Seperti aux1 mutasi, baik 1NOA maupun dari inhibitor AUX1-spesifik lainnya memblokir transportasi auksin polar.
Gambar 19.16 Struktur auksin transportasi penghambat
4. Protein PIN Cepat berputar menuju dan dari Plasma Membran
Lokalisasi dasar auksin penghabisan pembawa melibatkan ditargetkan sekresi vesikel ke ujung basal sel melakukan. Baru-baru ini telah menunjukkan bahwa protein PIN, meskipun stabil, tidak tetap pada membran plasma secara permanen, tetapi cepat bersepeda ke sebuah ruang endosom tak dikenal melalui vesikel endocytotic, dan kemudian didaur ulang kembali ke membran plasma (Geldner et al. 2001).
(lihat Gambar 19.17C). Tapi ketika cytochalasin D, penghambat polimerisasi aktin, termasuk dalam larutan buffer washout, relocalization normal PIN ke membran plasma dicegah (lihat Gambar 19.17D). Hasil ini menunjukkan PIN yang cepat bersepeda antara membran plasma di dasar sel dan endosomal kompartemen tak dikenal dengan mekanisme aktin-dependen.
Meskipun mereka mengikat target yang berbeda, baik TIBA dan NPA mengganggu lalu lintas vesikel ke dan dari membran plasma. Cara terbaik untuk menunjukkan fenomena ini adalah untuk menyertakan TIBA dalam larutan washout setelah perawatan BFA. Dengan kondisi tersebut, TIBA mencegah relocalization normal PIN pada membran plasma setelah pengobatan washout (lihat Gambar 19.17E) (Geldner et al. 2001).
Efek dari TIBA dan NPA berputar tidak spesifik untuk protein PIN, dan telah diusulkan bahwa ATIS dapat benar-benar mewakili inhibitor umum membran bersepeda (Geldner et al. 2001). Di sisi lain, baik TIBA atau NPA saja menyebabkan delokalisasi PIN, meskipun mereka memblokir auksin penghabisan. Oleh karena itu, TIBA dan NPA juga harus mampu secara langsung menghambat aktivitas transportasi kompleks PIN pada membran plasma-dengan mengikat baik ke PIN (sebagai TIBA tidak) atau untuk satu atau lebih protein regulasi (seperti NPA tidak).
washout dengan cytochalasin D. (E) Setelah penghanyutan BFA dengan auksin transportasi inhibitor TIBA. (Foto courtesy of Klaus Palme 1999.)
Sebuah disederhanakan model efek TIBA dan NPA di PIN bersepeda dan auksin penghabisan ditunjukkan pada Gambar 19.18. Sebuah model yang lebih lengkap yang menggabungkan banyak temuan baru-baru ini disajikan di Web Essay 19.2.
5. Auksin dapat Diangkut secara Nonpolarly di Floem
Sebagian besar IAA yang disintesis dalam daun dewasa tampaknya diangkut ke seluruh tanaman nonpolarly melalui floem. Auksin, bersama dengan komponen lain dari cairan floem, dapat berpindah dari ini daun atas atau bawah tanaman dengan kecepatan jauh lebih tinggi dibandingkan transportasi kutub (lihat Bab 10). Auksin translokasi dalam floem sebagian besar pasif, tidak membutuhkan energi secara langsung.
Meskipun pentingnya keseluruhan jalur floem dibandingkan sistem transportasi kutub untuk gerakan jarak jauh dari IAA pada tanaman masih belum terselesaikan, bukti menunjukkan bahwa transportasi auksin jarak jauh dalam floem adalah penting untuk mengendalikan proses seperti sel cambial divisi, akumulasi kalosa atau penghapusan dari unsur-unsur tabung saringan, dan pembentukan akar cabang. Memang, floem muncul untuk mewakili jalur utama untuk jarak jauh auksin translokasi ke akar (Aloni 1995;. Swarup et al, 2001).
Transportasi kutub dan transportasi floem tidak independen satu sama lain. Penelitian terbaru dengan IAA radiolabeled menunjukkan bahwa dalam kacang, auksin dapat ditransfer dari jalur floem nonpolar dengan jalur transportasi kutub. Transfer ini terjadi terutama di jaringan belum matang dari apeks pucuk.
Contoh kedua dari transfer auksin dari jalur floem nonpolar ke sistem transportasi kutub baru-baru ini telah didokumentasikan dalam Arabidopsis. Hal ini menunjukkan bahwa permease AUX1 yang asimetris terlokalisasi pada membran plasma di ujung atas sel protophloem root (yaitu, ujung distal dari ujung) (Gambar 19.19).
Telah diusulkan bahwa asimetris berorientasi AUX1 permease mempromosikan gerakan acropetal auksin dari floem ke akar puncak (Swarup et al. 2001). Jenis transportasi auksin polar berdasarkan lokalisasi asimetris AUX1 berbeda dari transportasi kutub yang terjadi di wilayah tunas dan akar basal, yang didasarkan pada distribusi asimetris kompleks PIN.
GAMBAR 19.19 auksin permease AUX1 secara khusus dinyatakan dalam subset dari columella, lateralis topi akar, dan jaringan bintang. (A) Diagram jaringan di ujung akar Arabidopsis. (B) immunolocalization dari AUX1 dalam sel protophloem dari prasasti, sebuah cluster pusat sel dalam columella, dan sel-sel topi akar lateral. (C) lokalisasi asimetris AUX1 dalam file sel protophloem. Skala bar adalah 2 m di C. (Dari Swarup et al. 2001.)
L. EFEK FISIOLOGIS AUKSIN: Pemanjangan Sel
Auksin ditemukan sebagai hormon yang terlibat dalam pembengkokan coleoptiles menuju terang. Tikungan koleoptil karena harga tidak merata pemanjangan sel pada berbayang versus sisi diterangi (lihat Gambar 19.1). Kemampuan auksin untuk mengatur laju pemanjangan sel telah lama terpesona ilmuwan tanaman. Pada bagian ini kita akan meninjau fisiologi pemanjangan sel auksin diinduksi, beberapa aspek yang dibahas dalam Bab 15.
Auxins Promosikan Pertumbuhan Batang dan Coleoptiles, Sementara Pertumbuhan Akar Terhambat.
Sebagaimana telah kita lihat, auksin disintesis di daerah apeks pucuk dan diangkut basipetally ke jaringan di bawah ini. The pasokan auksin tiba di wilayah subapical dari batang atau koleoptil diperlukan untuk perpanjangan lanjutan atau sel hese. Karena tingkat auksin endogen di wilayah pemanjangan tanaman yang sehat yang normal hampir optimal untuk pertumbuhan, penyemprotan tanaman dengan eksogen auksin hanya menyebabkan stimulasi sederhana dan singkat dalam pertumbuhan, dan bahkan mungkin penghambatan dalam kasus bibit darkgrown, yang lebih sensitif terhadap konsentrasi auksin supraoptimal dibandingkan tanaman tumbuh cahaya berada.
Namun, ketika sumber endogen auksin dihapus oleh eksisi bagian yang berisi zona elongasi, tingkat pertumbuhan cepat berkurang menjadi tarif dasar rendah. Bagian dipotong tersebut akan sering merespon secara dramatis untuk eksogen auksin dengan meningkatkan cepat laju pertumbuhan mereka kembali ke tingkat di tumbuhan utuh.
Penghambatan luar konsentrasi optimal umumnya dikaitkan dengan auksin diinduksi etilen biosintesis. Sebagaimana akan kita lihat dalam Bab 22, etilena hormon gas menghambat pemanjangan batang di banyak spesies.
[image:31.595.211.388.320.545.2]Kontrol auksin pertumbuhan pemanjangan akar telah lebih sulit untuk menunjukkan, mungkin karena auksin menginduksi produksi etilen, inhibitor pertumbuhan akar. Namun, bahkan jika etilena biosintesis secara khusus diblokir, konsentrasi rendah (10-10 ke 10-9 M) auksin mendorong pertumbuhan akar utuh, sedangkan konsentrasi yang lebih tinggi (10 6 M) menghambat pertumbuhan. Dengan demikian, akar mungkin memerlukan konsentrasi minimum auksin untuk tumbuh, tetapi pertumbuhan akar sangat dihambat oleh konsentrasi auksin yang mempromosikan pemanjangan pada batang dan coleoptiles.
GAMBAR 19.20 Waktu kursus untuk pertumbuhan auksin diinduksi Avena (oat) bagian koleoptil. Pertumbuhan diplot sebagai persen peningkatan panjang. Auksin ditambahkan pada waktu nol. Ketika
sukrosa (Suc) termasuk dalam medium, respon dapat terus selama 20 jam. Sukrosa memperpanjang respon pertumbuhan auksin terutama dengan memberikan zat terlarut osmotik aktif yang dapat diambil untuk pemeliharaan tekanan turgor selama pemanjangan sel. KCl dapat menggantikan sukrosa. Inset menunjukkan waktu kursus jangka pendek diplot dengan transduser posisi-sensing elektronik. Dalam grafik ini, pertumbuhan direncanakan sebagai panjang mutlak dalam milimeter terhadap waktu. Kurva menunjukkan jeda waktu sekitar 15 menit untuk pertumbuhan
GAMBAR 19,21 Khas dosis-respons kurva pertumbuhan IAA-induced di
batang kacang atau oat bagian koleoptil. Pertumbuhan Pemanjangan bagian dipotong dari coleoptiles atau batang muda yang diplot terhadap peningkatan konsentrasi IAA eksogen. Pada konsentrasi yang
lebih tinggi (di atas 10-5 M), IAA menjadi kurang dan kurang efektif, di atas sekitar 10 ~ 4 M itu menjadi penghambat, seperti yang ditunjukkan oleh fakta bahwa kurva jatuh di bawah garis
putus-putus, yang merupakan pertumbuhan dalam ketiadaan ditambahkan IAA.
M. Para Jaringan Terluar Batang dikotil Adalah Target Auxin Aksi
Batang dikotil terdiri dari berbagai jenis jaringan dan sel, hanya beberapa yang dapat membatasi tingkat pertumbuhan. Hal ini digambarkan oleh eksperimen sederhana. Ketika batang bagian dari wilayah tumbuh dari sebuah batang dikotil etiolated, seperti kacang, dibagi memanjang dan diinkubasi dalam buffer, kedua bagian luar tikungan.
pada jaringan luar dari zona elongasi. Dalam coleoptiles, di sisi lain, semua jaringan nonvascular (epidermis ditambah mesofil) yang mampu mengangkut auksin, serta menanggapinya.
N. Selang Waktu minimal untuk Auxin menginduksi pertumbuhan adalah Sepuluh Menit
Ketika batang atau bagian koleoptil dipotong dan dimasukkan ke dalam perangkat pertumbuhan ukur sensitif, respon pertumbuhan auksin dapat dipantau pada resolusi sangat tinggi. Tanpa auksin dalam medium, tingkat pertumbuhan menurun dengan cepat. Penambahan auksin nyata merangsang laju pertumbuhan setelah periode lag hanya 10 sampai 12 menit (lihat inset pada Gambar 19.20).
Kedua Avena (oat) coleoptiles dan Glycine max (kedelai) hipokotil (batang dikotil) mencapai laju pertumbuhan maksimum setelah 30 sampai 60 menit pengobatan auksin (Gambar 19.22). Maksimum ini merupakan lima sampai sepuluh kali lipat meningkat selama tingkat dr dasarnya. Oat koleoptil bagian dapat mempertahankan tingkat ini maksimum sampai 18 jam di hadapan zat terlarut osmotik aktif seperti sukrosa atau KCl.
Seperti bisa diduga, stimulasi pertumbuhan dengan auksin membutuhkan energi, dan inhibitor metabolik menghambat respon dalam beberapa menit. Pertumbuhan auksin diinduksi juga sensitif terhadap inhibitor sintesis protein seperti cycloheximide, menunjukkan bahwa protein dengan tingkat turnover tinggi yang terlibat. Inhibitor sintesis RNA juga menghambat pertumbuhan auxininduced, setelah penundaan sedikit lebih panjang (Cleland 1995).
O. Auksin Mempercepat peningkatkan Perluasan dari Dinding sel
Bagaimana auksin menyebabkan lima sampai sepuluh kali lipat peningkatan dalam tingkat pertumbuhan hanya dalam 10 menit? Untuk memahami mekanisme, pertama kita harus meninjau proses pembesaran sel pada tumbuhan (lihat Bab 15). Sel tumbuhan berkembang dalam tiga langkah:
1. Serapan osmotik air melintasi membran plasma didorong oleh gradien potensial air (AYw).
2. Tekanan turgor menumpuk karena kekakuan dinding sel.
3. Biokimia melonggarkan dinding terjadi, memungkinkan sel untuk memperluas dalam menanggapi tekanan turgor.
Efek dari parameter ini pada tingkat pertumbuhan yang dirumuskan dalam persamaan laju pertumbuhan:
GR = m (YP - Y) mana GR adalah laju pertumbuhan, Yp adalah tekanan turgor, Y adalah ambang hasil, dan m adalah koefisien (diperpanjang dinding) yang berhubungan dengan tingkat pertumbuhan dengan perbedaan antara Yp dan Y.
Pada prinsipnya, auksin dapat meningkatkan laju pertumbuhan dengan meningkatkan m, peningkatan Yp, atau menurun Y. Meskipun percobaan yang luas telah menunjukkan bahwa auksin tidak meningkatkan tekanan turgor ketika merangsang pertumbuhan, hasil yang bertentangan telah diperoleh mengenai penurunan auxininduced di Y. Namun, ada kesepakatan umum bahwa auksin menyebabkan peningkatan parameter diperpanjang dinding, m.
Auksin-Induced Proton Ekstrusi acidifies Wall Cell dan Meningkatkan Perpanjangan your
Menurut diterima secara luas hipotesis pertumbuhan asam, ion hidrogen bertindak sebagai penengah antara auksin dan melonggarkan dinding sel. Sumber ion hidrogen membran plasma H +-ATPase, yang aktivitasnya dianggap meningkatkan dalam menanggapi auksin. Hipotesis Pertumbuhan Asam memungkinkan lima prediksi utama:
1. Buffer asam saja harus mempromosikan pertumbuhan jangka pendek, asalkan kutikula telah terkelupas untuk memungkinkan proton akses ke dinding sel.
2. Auksin harus meningkatkan laju proton ekstrusi (pengasaman dinding), dan kinetika ekstrusi proton erat harus sesuai dengan pertumbuhan auksin-induced.
Kelima prediksi ini telah dikonfirmasi. Buffer asam menyebabkan peningkatan yang cepat dan segera dalam tingkat pertumbuhan, asalkan kutikula telah terkelupas. Auksin merangsang ekstrusi proton ke dalam dinding sel setelah 10 sampai 15 menit waktu lag, konsisten dengan kinetika pertumbuhan (Gambar 19.23).
Pertumbuhan auksin diinduksi juga telah terbukti dihambat oleh buffer netral, asalkan kutikula telah abraided. Fusicoccin, sebuah phytotoxin jamur, menstimulasi kedua ekstrusi proton dan pertumbuhan sementara dalam batang dan koleoptil bagian (lihat Web Topik 19,6). Dan akhirnya, protein wallloosening disebut expansins telah diidentifikasi dalam dinding sel berbagai jenis tanaman (lihat Bab 15). Pada pH asam, expansins melonggarkan dinding sel dengan memperlemah ikatan hidrogen antara komponen polisakarida dinding.
GAMBAR 19,23 Kinetika auksin-induced perpanjangan dan pengasaman dinding sel dalam coleoptiles jagung. PH dari dinding sel diukur dengan microelectrode pH. Perhatikan waktu lag sama (10 sampai 15 menit) untuk kedua pengasaman dinding sel dan peningkatan tingkat elongasi. (Dari Jacobs dan Ray 1976.)
Auksin-Induced Proton Ekstrusi Mei Libatkan Kedua Aktivasi dan Sintesis
[image:35.595.89.328.322.507.2]1. Aktivasi yang sudah ada sebelumnya membran plasma H + ATPase
2. Sintesis baru H +-ATPase pada membran plasma
H +-ATPase aktivasi. Ketika auksin ditambahkan langsung ke terisolasi vesikel membran plasma dari sel tembakau, stimulasi kecil (sekitar 20%) dari ATP-driven aktivitas proton-memompa diamati, menunjukkan bahwa auksin langsung mengaktifkan H +-ATPase. Suatu stimulasi yang lebih besar (sekitar 40%) diamati jika sel-sel hidup diobati dengan IAA sebelum membran diisolasi, menunjukkan bahwa faktor seluler juga diperlukan (Peltier dan Rossignol 1996).
Meskipun reseptor auksin belum tegas diidentifikasi (seperti yang dibahas kemudian dalam bab ini), berbagai protein auksin-binding (ABPS) memiliki
telah diisolasi dan muncul untuk dapat mengaktifkan membran plasma H +-ATPase dengan adanya auksin (Steffens et al. 2001).
GAMBAR 19,24 Model untuk aktivasi membran plasma (PM) H +-ATPase oleh ABP57 dan auksin.
H +-ATPase sintesis. Kemampuan inhibitor sintesis protein, seperti cycloheximide, dengan cepat menghambat auxininduced ekstrusi proton dan pertumbuhan menunjukkan auksin yang mungkin juga merangsang proton memompa dengan meningkatkan sintesis H +-ATPase. Peningkatan jumlah membran plasma ATPase dalam coleoptiles jagung terdeteksi imunologis setelah hanya 5 menit pengobatan auksin, dan dua kali lipat dari H +-ATPase diamati setelah 40 menit perawatan. A tiga kali lipat stimulasi oleh auksin dari mRNA untuk H +-ATPase ditunjukkan secara khusus dalam jaringan nonvascular dari coleoptiles.
Hipotesis Aktivasi: Auxin mengikat protein auxinbinding (ABP1) terletak baik pada permukaan sel atau sitosol. ABP1-IAA kemudian berinteraksi langsung dengan membran plasma H +-ATPase untuk merangsang proton memompa (langkah 1). Second messenger, seperti kalsium atau pH intraseluler, juga bisa dilibatkan.
[image:38.595.82.440.258.559.2]Sintesis hipotesis: IAA-induced second messenger mengaktifkan ekspresi gen (langkah 2) yang menyandikan membran plasma H +-ATPase (langkah 3). Protein disintesis pada retikulum endoplasma kasar (langkah 4) dan ditargetkan melalui jalur sekresi ke membran plasma (langkah 5 dan 6). Peningkatan hasil ekstrusi proton dari peningkatan jumlah pompa proton pada membran.
P. EFEK FISIOLOGIS AUKSIN: PHOTOTROPISM DAN GRAVITROPISM Tiga sistem bimbingan utama mengendalikan orientasi pertumbuhan tanaman:
1. Fototropisme, atau tumbuh terhadap cahaya, diungkapkan dalam semua tunas dan beberapa akar, memastikan bahwa daun akan menerima sinar matahari yang optimal untuk fotosintesis.
2. Gravitropism, pertumbuhan dalam menanggapi gravitasi, memungkinkan akar untuk tumbuh ke bawah ke tanah dan tunas tumbuh ke atas jauh dari tanah, yang sangat penting selama tahap awal perkecambahan.
3. Thigmotropism, atau pertumbuhan sehubungan dengan sentuhan, memungkinkan akar tumbuh di sekitar batu dan bertanggung jawab atas kemampuan tunas tanaman merambat untuk membungkus struktur lain untuk dukungan.
Pada bagian ini kita akan membahas bukti bahwa membungkuk sebagai respon terhadap cahaya atau gravitasi hasil dari redistribusi lateral auksin. Kami juga akan mempertimbangkan mekanisme seluler yang terlibat dalam menghasilkan gradien auksin lateral yang selama pertumbuhan lentur. Sedikit yang diketahui tentang mekanisme thigmotropism, meskipun juga, mungkin melibatkan gradien auksin. 1. Phototropism diperantarai oleh redistribtion auksin ke arah samping
Seperti yang kita lihat sebelumnya, Charles Darwin dan Francis memberikan petunjuk pertama mengenai mekanisme fototropisme dengan menunjukkan bahwa situs persepsi dan perbedaan pertumbuhan (bending) terpisah: Cahaya dirasakan di ujung, tapi lentur terjadi di bawah ujung. The Darwin mengusulkan bahwa beberapa "pengaruh" yang diangkut dari ujung ke wilayah tumbuh membawa respon pertumbuhan asimetris diamati. Pengaruh ini kemudian terbukti menjadi indole-3-acetic acid-auksin.
Ketika tunas tumbuh vertikal, auksin diangkut polarly dari ujung tumbuh ke zona pemanjangan. Itu polaritas transportasi auksin dari ujung ke basa perkembangan ditentukan dan tidak tergantung pada orientasi terhadap gravitasi. Namun, auksin juga dapat diangkut lateral, dan gerakan ini lateral auksin terletak di jantung model untuk tropisme awalnya diusulkan secara terpisah oleh ahli fisiologi tanaman Rusia, Nicolai Cholodny dan Frits Pergi dari Belanda pada tahun 1920.
1. Produksi auksin
2. Persepsi dari stimulus cahaya unilateral
3. Pengangkutan lateral IAA dalam menanggapi stimulus phototropic
Dengan demikian, dalam menanggapi rangsangan cahaya directional, auksin yang dihasilkan di ujung, bukannya diangkut basipetally, diangkut lateral ke arah sisi teduh.
Tempat yang tepat produksi auksin, persepsi cahaya, dan lateral transportasi telah sulit untuk menentukan. Dalam coleoptiles jagung, auksin diproduksi di atas 1 sampai 2 mm dari ujung. Zona transportasi photosensing dan lateral memperpanjang lebih jauh, dalam atas 5 mm dari ujung. Tanggapan ini juga sangat tergantung pada Fluence cahaya (lihat Web Topik 19,7).
Dua flavoproteins, phototropins 1 dan 2, adalah fotoreseptor untuk jalur sinyal cahaya biru (lihat Web Essay 19.3) yang menginduksi phototropic lentur pada hipokotil Arabidopsis dan coleoptiles oat bawah kedua-dan tinggi rendah kondisi-fluence (Briggs dkk. 2001) .
Phototropins yang autophosphorylating protein kinase yang aktivitasnya dirangsang oleh cahaya biru. Tindakan spektrum untuk aktivasi biru terang aktivitas kinase sangat cocok dengan spektrum aksi untuk phototropism, termasuk beberapa puncak di daerah biru. Phototropin 1 menampilkan gradien lateral dalam fosforilasi selama paparan cahaya biru rendah Fluence unilateral.
Menurut hipotesis saat ini, gradien dalam fosforilasi phototropin menginduksi pergerakan auksin ke sisi berbayang koleoptil (lihat Web Topik 19,7). Setelah auksin mencapai sisi teduh dari ujung, diangkut basipetally ke zona elongasi, di mana ia merangsang pemanjangan sel. Percepatan pertumbuhan di sisi teduh dan perlambatan pertumbuhan di sisi diterangi (pertumbuhan diferensial) menimbulkan kelengkungan menuju cahaya (Gambar 19.26).
Konsisten dengan baik Cholodny-Went hipotesis dan hipotesis pertumbuhan asam, pH apoplastic di sisi teduh dari batang phototropically membungkuk atau koleoptil lebih asam dibandingkan sisi menghadap cahaya (Mulkey et al. 1981).
GAMBAR 19,26 Waktu kursus pertumbuhan di sisi diterangi dan teduh koleoptil yang menanggapi pulsa 30 detik cahaya biru searah. Coleoptiles kontrol tidak diberi perawatan ringan. (Setelah Iino dan Briggs 1984.)
[image:41.595.146.350.152.383.2] [image:41.595.146.559.496.691.2]2. Gravitropism Juga Melibatkan Redistribusi lateral Auxin
Ketika gelap tumbuh bibit Avena yang berorientasi horizontal, coleoptiles menekuk ke atas dalam menanggapi gravitasi. Menurut Cholodny-Pergi Model, auksin di ujung koleoptil berorientasi horizontal diangkut lateral ke sisi bawah, menyebabkan sisi bawah koleoptil tumbuh lebih cepat dari sisi atas. Bukti eksperimental awal menunjukkan bahwa ujung koleoptil dapat melihat gravitasi dan mendistribusikan auksin ke sisi bawah. Misalnya, jika ujung koleoptil berorientasi horizontal, jumlah yang lebih besar dari auksin berdifusi dari bagian bawah dari bagian atas (Gambar 19.28).
GAMBAR 19.28 Auksin diangkut ke sisi bawah dari oat berorientasi horizontal koleoptil tip. (A) Auksin dari bagian atas dan bawah dari ujung horizontal diperbolehkan untuk berdifusi ke dalam dua blok agar. (B) agar blok dari bagian bawah (kiri) menginduksi kelengkungan yang lebih besar dalam koleoptil dipenggal daripada blok agar dari bagian atas (kanan). (Foto © M. B. Wilkins.)
[image:42.595.145.543.304.483.2]auksin dapat terjadi dalam jaringan di bawah ujung, meskipun ujung masih diperlukan untuk produksi auksin.
Redistribusi lateral auksin dalam meristem tunas apikal lebih sulit untuk menunjukkan daripada di coleoptiles karena kehadiran daun. Dalam beberapa tahun terakhir, penanda molekuler telah banyak digunakan sebagai gen reporter untuk mendeteksi gradien auksin lateral pada batang horizontal ditempatkan dan akar.
Dalam hipokotil kedelai, gravitropism menyebabkan cepat asimetri dalam akumulasi sekelompok mRNA auksin-merangsang disebut SAURs (auksin kecil up-diatur RNA) (McClure dan Guilfoyle 1989). Dalam bibit vertikal, ekspresi gen Saur yang simetris didistribusikan. Dalam waktu 20 menit setelah bibit berorientasi horizontal, SAURs mulai menumpuk di bagian bawah hipokotil tersebut. Dengan kondisi tersebut, gravitropic lentur pertama menjadi jelas setelah 45 menit, baik setelah induksi SAURs (lihat Web Topik 19,8). Adanya gradien lateral dalam ekspresi gen Saur adalah bukti tidak langsung bagi keberadaan gradien lateral auksin terdeteksi dalam waktu 20 menit dari stimulus gravitropic.
Q. Statoliths Sajikan sebagai Sensor Gravity di Tunas dan Akar
Tidak seperti cahaya sepihak, gravitasi tidak membentuk gradien antara sisi atas dan bawah dari organ. semua bagian tanaman mengalami stimulus gravitasi sama. Bagaimana sel-sel tumbuhan mendeteksi gravitasi? Satu-satunya cara bahwa gravitasi dapat dirasakan adalah melalui gerakan tubuh yang jatuh atau sedimenting.
[image:44.595.90.497.364.653.2]Kandidat yang jelas untuk sensor gravitasi intraseluler pada tanaman yang besar, amyloplasts padat yang hadir dalam banyak sel tumbuhan. Ini amyloplasts khusus adalah kepadatan cukup tinggi dibandingkan dengan sitosol bahwa mereka siap sedimen ke dasar sel (Gambar 19.30). Amyloplasts yang berfungsi sebagai sensor gravitasi disebut statoliths, dan sel-gravitasi penginderaan khusus dalam mana mereka terjadi disebut statocytes. Apakah statocyte mampu mendeteksi gerakan ke bawah dari statolith saat melewati sitoskeleton atau apakah stimulus dianggap hanya ketika statolith datang untuk beristirahat di bagian bawah sel belum terselesaikan.
1. Tunas dan Coleoptiles.
Dalam tunas dan coleoptiles, gravitasi dirasakan dalam selubung pati, lapisan sel yang mengelilingi jaringan vaskular menembak. Pati selubung kontinu dengan endodermis akar, tetapi tidak seperti endodermis yang dikandungnya amyloplasts. Arabidopsis mutan kurang amyloplasts di pati selubung tampilan agravitropic pertumbuhan tunas tapi pertumbuhan akar gravitropic normal (Fujihira et al. 2000).
Seperti tercantum dalam Bab 16, orang-orangan sawah (scr) mutan Arabidopsis yang hilang baik endodermis dan selubung pati. Sebagai hasilnya, hipokotil dan perbungaan dari scr mutan agravitropic, sedangkan akar menunjukkan respon gravitropic normal. Atas dasar fenotip dari dua mutan, kita bisa menyimpulkan sebagai berikut:
• pati selubung diperlukan untuk gravitropism di tunas.
• Akar endodermis, yang tidak mengandung statoliths, tidak diperlukan untuk gravitropism di akar.
2. Akar
Situs persepsi gravitasi di akar primer adalah tutup root. Besar, amyloplasts graviresponsive terletak di statocytes (lihat Gambar 19.30A dan B) dalam silinder pusat, atau columella, dari tutup root. Pemindahan tutup akar dari akar dinyatakan utuh menghapuskan gravitropism root tanpa menghambat pertumbuhan.
Tepatnya bagaimana statocytes merasakan statoliths mereka jatuh masih kurang dipahami. Menurut salah satu hipotesis, kontak atau tekanan yang dihasilkan dari amyloplast beristirahat di retikulum endoplasma di sisi bawah dari sel memicu respon (lihat Gambar 19.30C). Retikulum endoplasma sel columella secara struktural unik, terdiri dari lima sampai tujuh lembar kasar ER melekat pada pusat nodal batang dalam suatu lingkaran, seperti kelopak pada bunga. Ini khusus "nodal ER" berbeda dari lebih tubular kortikal ER cisternae dan mungkin terlibat dalam respon gravitasi (Zheng dan Staehelin 2001).
meskipun pati diperlukan untuk respon gravitropic normal, mekanisme persepsi gravitasi pati-independen juga mungkin ada.
Organel lain, seperti inti, mungkin cukup padat untuk bertindak sebagai statoliths. Ini bahkan mungkin tidak diperlukan untuk statolith untuk datang untuk beristirahat di bagian bawah sel. Jaringan cytoskeletal mungkin dapat mendeteksi perpindahan vertikal parsial organel.
Terakhir Andrew Staehelin dan rekan mengusulkan sebuah model baru untuk gravitropism, disebut model tensegrity (Yoder et al. 2001). Tensegrity adalah istilah-kontraksi arsitektur tensional integritas diciptakan oleh arsitek inovatif R. Buckminster Fuller. Pada intinya, tensegrity mengacu pada integritas struktural yang diciptakan oleh ketegangan interaktif antara komponen struktural. Dalam hal ini komponen struktural terdiri dari meshwork mikrofilamen aktin yang merupakan bagian dari sitoskeleton sel columella tengah tutup root. Jaringan aktin diasumsikan berlabuh ke reseptor peregangan diaktifkan pada membran plasma. Reseptor peregangan pada sel hewan biasanya saluran ion mechanosensitive, dan saluran kalsium stretch-activated telah dibuktikan pada tanaman.
Menurut model tensegrity, sedimentasi dari statoliths melalui sitosol lokal mengganggu meshwork aktin, mengubah distribusi tegangan ditransmisikan ke saluran kalsium pada membran plasma, sehingga mengubah kegiatan mereka. Yoder dan rekan (2001) lanjut mengusulkan bahwa nodal ER, yang juga terhubung ke saluran melalui mikrofilamen aktin, dapat melindungi sitoskeleton dari yang terganggu oleh statoliths di daerah tertentu, sehingga memberikan sinyal untuk pengarahan stimulus.
Persepsi gravitasi tanpa statoliths? Mekanisme alternatif persepsi gravitasi yang tidak melibatkan statoliths telah diusulkan untuk raksasa air tawar bersel alga Chara. Lihat Topik Web 19,8 untuk rincian.
R. Auksin Apakah Redistribusi Secara lateral di tutup Akar
GAMBAR 19,31 percobaan Mikro menunjukkan bahwa tudung akar menghasilkan inhibitor yang mengatur gravitropism root. (Setelah Shaw dan Wilkins 1973.)
Meskipun topi akar mengandung sejumlah kecil IAA dan asam absisat (ABA) (lihat Bab 23), IAA lebih hambat terhadap pertumbuhan akar dari ABA bila diterapkan secara langsung ke zona elongasi, menunjukkan bahwa IAA adalah inhibitor topi root. Konsisten dengan kesimpulan ini, mutan Arabidopsis ABA-kekurangan memiliki gravitropism akar normal, sedangkan akar mutan cacat auksin transportasi, seperti aux1 dan agr1, adalah agravitropic (Palme dan Galweiler 1999). The Agr mutan tidak memiliki pembawa penghabisan auksin berhubungan dengan protein PIN (Chen et al, 1998;. Muller et al 1998;.. Utsuno et al 1998). Protein AGR1 terlokalisir di basal (distal) akhir sel kortikal dekat ujung akar Arabidopsis.
floem ke sekelompok sel dalam columella topi. Auksin kemudian diangkut ke sel radial topi akar lateral, dimana AUX1 juga dinyatakan kuat (lihat Gambar 19.19).
Sel-sel akar lateral yang tutup overlay zona perpanjangan distal (DEZ) dari akar-wilayah pertama yang merespon gravitasi. Auksin dari tutup diambil oleh parenkim kortikal DEZ dan diangkut basipetally melalui zona pemanjangan akar. Ini transportasi basipetal, yang terbatas pada zona perpanjangan, difasilitasi oleh auksin operator anion berkaitan dengan keluarga PIN (disebut AGR1), yang terlokalisasi di ujung basal sel-sel parenkim korteks.
[image:48.595.208.439.358.641.2]The basipetally diangkut auksin terakumulasi di zona elongasi dan tidak melampaui batas wilayah ini. Flavonoid mampu menghambat auksin penghabisan disintesis di daerah ini dari akar dan mungkin meningkatkan retensi auksin oleh sel-sel (Gambar 19.32) (Murphy et al. 2000).
pengalihan sebagian besar auksin ke sisi bawah, sehingga menghambat pertumbuhan sisi yang lebih rendah (lihat Gambar 19.33B). Konsisten dengan ide ini, pengangkutan [3H] IAA di topi akar berorientasi horizontal adalah polar, dengan gerakan ke bawah preferensial (Young et al. 1990).
GAMBAR 19.33 Diusulkan model untuk redistribusi auksin selama gravitropism di akar jagung. (Setelah Hasenstein dan Evans 1988.)
Terakhir mekanisme lateral auksin redistribusi dalam topi akar telah baru telah dijelaskan (Friml et al. 2002). Salah satu anggota keluarga protein PIN auksin penghabisan operator, pin3, tidak hanya diperlukan untuk kedua gravitropism photoand dalam Arabidopsis, tetapi telah terbukti relocalized ke sisi bawah dari sel columella selama gravitropism root (Gambar 19.34) .
Seperti disebutkan sebelumnya, protein PIN terus-menerus bersepeda antara membran plasma dan kompartemen sekresi intraseluler. Bersepeda ini memungkinkan beberapa protein PIN ditargetkan untuk sisi tertentu dari sel dalam menanggapi
untuk stimulus terarah. Dalam akar berorientasi vertikal, pin3 terdistribusi secara seragam di seluruh sel columella (lihat Gambar 19.34A). Tapi ketika akar ditempatkan pada sisinya, pin3 yang istimewa ditargetkan untuk sisi bawah sel (lihat Gambar 19.34B). Akibatnya, auksin diangkut polarly ke bagian bawah tutup.
Sensing gravitasi Mei Libatkan Kalsium dan pH sebagai Second Messenger
Berbagai eksperimen telah menyarankan bahwa kalsium-kalmodulin diperlukan untuk gravitropism akar pada tanaman jagung. Beberapa percobaan ini melibatkan EGTA (etilen glikol-bis ([3aminoethyl eter)-N, N, N ', N'-tetraacetic acid), suatu senyawa yang dapat khelat (membentuk kompleks dengan) ion kalsium, sehingga mencegah penyerapan kalsium oleh sel. EGTA menghambat baik gravitropism akar dan distribusi asimetris auksin dalam menanggapi gravitasi (Young dan Evans 1994).
Menempatkan blok agar yang mengandung ion kalsium pada sisi tutup akar jagung berorientasi vertikal menginduksi akar tumbuh ke arah sisi dengan balok agar-agar (Gambar
19,35). Seperti dalam kasus [+ H] IAA, 45Ca2 + adalah polarly trans porting ke bagian bawah tutup akar dirangsang oleh
gravitasi. Namun, sejauh ini tidak ada perubahan dalam distribusi kalsium intraseluler telah terdeteksi dalam sel columella dalam menanggapi stimulus gravitasi.
The alkalinisasi sitosol dikombinasikan dengan pengasaman apoplast menunjukkan bahwa aktivasi membran plasma H +-ATPase adalah salah satu peristiwa awal yang memediasi akar persepsi gravitasi atau transduksi sinyal.
S. EFEK PEMBANGUNAN OLEH AUKSIN
Meskipun awalnya ditemukan dalam kaitannya dengan pertumbuhan, auksin mempengaruhi hampir setiap tahap siklus hidup tanaman dari perkecambahan untuk penuaan. Karena efek yang menghasilkan auksin tergantung pada identitas jaringan target, respon jaringan untuk auksin diatur oleh program genetik perkembangan ditentukan dan juga dipengaruhi oleh ada atau tidak adanya molekul sinyal lain. Sebagaimana akan kita lihat dalam bab ini dan selanjutnya, interaksi antara dua atau lebih hormon adalah tema yang berulang dalam perkembangan tanaman.
Pada bagian ini kita akan membahas beberapa proses perkembangan tambahan diatur oleh auksin, termasuk dominasi apikal, amputasi daun, pembentukan akar lateral, dan diferensiasi vaskular. Sepanjang pembahasan ini kita menganggap bahwa mekanisme utama aksi auksin sebanding dalam semua kasus, melibatkan reseptor yang sama dan jalur transduksi sinyal. Keadaan saat pengetahuan kita tentang sinyal jalur auksin akan dipertimbangkan pada akhir bab ini.
T. Auksin Mengatur Dominasi apikal
GAMBAR 19.36 Auksin menekan pertumbuhan tunas ketiak dalam kacang (Phaseolus vulgaris) tanaman. (A) tunas ketiak ditekan dalam tanaman utuh karena dominasi apikal. (B) Penghapusan terminal tunas melepaskan tunas ketiak dari dominasi apikal (panah). (C) Menerapkan IAA di lanolin pasta (yang terkandung dalam kapsul gelatin) ke permukaan memotong mencegah perkembangan dari tunas ketiak. (Foto © M. B. Wilkins.)
Hasil ini segera dikonfirmasi untuk banyak lainnya spesies tanaman, yang mengarah ke hipotesis bahwa perkembangan dari tunas ketiak adalah dihambat oleh auksin yang diangkut basipetally dari tunas apikal. Untuk mendukung ide ini, sebuah cincin dari auksin transportasi inhibitor TIBA di lanolin pasta (sebagai pembawa) ditempatkan di bawah apeks pucuk merilis tunas ketiak dari inhibisi.
[image:52.595.90.427.68.377.2]Jika model langsung penghambatan dominasi apikal benar, konsentrasi auksin di tunas ketiak harus mengurangi pemenggalan berikut dari apeks pucuk. Namun, sebaliknya tampaknya benar. Hal ini ditunjukkan dengan tanaman transgenik yang mengandung gen reporter luciferase bakteri (LUXA dan LUXB) di bawah kendali kontrol promotor auksin-responsif (Langridge et al. 1989). Gen reporter memungkinkan peneliti untuk mempelajari tingkat auksin dalam jaringan yang berbeda dengan memantau jumlah cahaya yang dipancarkan oleh reaksi luciferase-katalis.
Ketika tanaman transgenik dipenggal, ekspresi gen LUX meningkat di dan sekitar tunas ketiak dalam waktu 12 jam. Percobaan ini menunjukkan bahwa setelah dipenggal, isi auksin dari tunas ketiak meningkat daripada menurun.
Pengukuran fisik langsung tingkat auksin di tunas juga menunjukkan peningkatan auksin dari tunas ketiak setelah dipenggal. Konsentrasi IAA dalam tunas ketiak dari Phaseolus vulgaris (kacang) meningkat lima kali lipat dalam waktu 4 jam setelah dipenggal (Gocal dkk. 1991). Ini dan lainnya hasil yang sama membuat tidak mungkin bahwa auksin dari apeks pucuk menghambat tunas ketiak langsung.
Hormon lainnya, seperti sitokinin dan ABA, mungkin terlibat. Penerapan langsung sitokinin untuk merangsang pertumbuhan tunas ketiak tunas di banyak spesies, mengesampingkan efek penghambatan dari apeks pucuk. Auksin membuat apeks pucuk wastafel untuk sitokinin disintesis dalam akar, dan ini mungkin salah satu faktor yang terlibat dalam dominasi apikal (lihat Web Topik 19,10).
Akhirnya, ABA telah ditemukan di tunas lateral dorman pada tanaman utuh. Ketika apeks pucuk dihapus, tingkat ABA di tunas lateral menurun. Tingginya kadar IAA dalam menembak dapat membantu menjaga kadar ABA tinggi di tunas lateral. Menghapus puncak menghilangkan sumber utama IAA, yang yang dapat memungkinkan tingkat pertumbuhan tunas inhibitor menurun (lihat Web Topik 19,11).
U. Auksin Mempromosikan Pembentukan Akar Lateral dan Adventif
membentuk menjadi apeks akar, dan akar lateral yang tumbuh melalui korteks akar dan epidermis.
Akar adventif (akar yang berasal dari jaringan bukan akar) dapat timbul di berbagai lokasi jaringan dari kelompok sel matang yang memperbaharui aktivitas pembelahan sel mereka. Sel-sel membagi berkembang menjadi akar meristem apikal dalam cara yang agak analog dengan pembentukan akar lateral. Dalam hortikultura, efek stimulasi dari auksin pada pembentukan akar adventif telah sangat berguna untuk perbanyakan tanaman secara vegetatif dengan stek.
[image:54.595.127.388.361.666.2]Serangkaian mutan Arabidopsis, bernama alf (pembentukan akar lateral yang menyimpang), telah memberikan beberapa wawasan ke dalam peran auksin dalam inisiasi akar lateral. The alf1 mutan pameran proliferasi ekstrim akar adventif dan lateral, ditambah dengan peningkatan 17 kali lipat dalam auksin endogen (Gambar 19.37).
Mutan lain, alf4, memiliki fenotipe yang berlawanan: Hal ini benar-benar tanpa akar lateral. Analisis mikroskopis dari alf4 akar menunjukkan bahwa primordia lateral akar yang absen. Alf4 fenotip tidak dapat dibalik dengan aplikasi eksogen IAA. Namun lain mutan, alf3, yang rusak dalam pengembangan primordia lateral akar ke akar lateral matang. Akar utama ditutupi dengan ditangkap primordia lateral akar yang tumbuh sampai mereka menonjol melalui lapisan sel epidermis dan kemudian berhenti tumbuh. Ditangkap pertumbuhan dapat diatasi dengan penerapan eksogen IAA.
Atas dasar fenotip mutan alf, sebuah model di mana IAA diperlukan untuk setidaknya dua langkah dalam pembentukan akar lateral telah diusulkan (Gambar 19.38) (Celenza et al 1995.):
1. IAA diangkut acropetally (menuju ujung) di prasasti yang diperlukan untuk memulai pembelahan sel dalam Pericycle tersebut.
2. IAA diperlukan untuk mempromosikan pembelahan sel dan mempertahankan kelangsungan hidup sel di akar lateral yang berkembang
[image:55.595.113.407.392.528.2],
V. Penundaan Auksin menyebabkan Daun menciptakan daerah pengguguran. Pembuangan daun, bunga, dan buah-buahan dari tanaman hidup dikenal sebagai amputasi. Bagian-bagian abscise di wilayah yang disebut zona absisi, yang terletak dekat dasar tangkai daun daun. Pada kebanyakan tanaman, amputasi daun didahului oleh diferensiasi lapisan sel yang berbeda, lapisan absisi, dalam zona amputasi. Selama penuaan daun, dinding sel di lapisan absisi dicerna, yang menyebabkan mereka menjadi lunak dan lemah. Daun akhirnya istirahat turun di lapisan absisi sebagai akibat dari stres pada dinding sel melemah.
Tingkat auksin yang tinggi pada daun muda, semakin menurun dalam daun jatuh tempo, dan relatif rendah senescing daun saat proses amputasi dimulai. Peran auksin di amputasi daun bisa ditunjukan dengan eksisi pisau dari daun matang, meninggalkan tangkai daun utuh pada batang. Sedangkan penghapusan helai daun mempercepat pembentukan lapisan absisi pada tangkai daun, aplikasi IAA di lanolin tempel ke