PERLAKUAN BENIH CABAI (Capsicum annuum L.) DENGAN
RIZOBAKTERI SECARA TUNGGAL ATAUPUN KOMBINASI
UNTUK MENGENDALIKAN Phytophthora capsici DAN
MENINGKATKAN PERTUMBUHAN TANAMAN
FARIH NAJAH ROSADIAH
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Perlakuan Benih Cabai (Capsicum annuum L.) dengan Rizobakteri secara Tunggal ataupun Kombinasi untuk Mengendalikan Phytophthora capsici dan Meningkatkan Pertumbuhan Tanaman adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Farih Najah Rosadiah
ABSTRAK
FARIH NAJAH ROSADIAH. Perlakuan Benih Cabai (Capsicum annuum L.) dengan Rizobakteri secara Tunggal ataupun Kombinasi untuk Mengendalikan
Phytophthora capsici dan Meningkatkan Pertumbuhan Tanaman. Dibimbing oleh
SATRIYAS ILYAS dan DYAH MANOHARA.
Perlakuan benih cabai menggunakan rizobakteri merupakan alternatif pengganti fungisida dalam mengendalikan penyakit busuk phytophthora yang disebabkan oleh cendawan patogen Phytophthora capsici. Penelitian ini bertujuan (1) mengevaluasi keefektifan kombinasi isolat rizobakteri dalam menghambat pertumbuhan P. capsici, dan (2) mengetahui pengaruh perlakuan benih dengan rizobakteri dalam meningkatkan vigor benih dan pertumbuhan tanaman, serta dalam mengurangi kejadian penyakit busuk phytophthora. Penelitian ini terdiri atas tiga tahap percobaan, ketiganya menggunakan rancangan acak lengkap satu faktor. Percobaan pertama (in vitro) terdiri atas sembilan taraf yaitu tujuh kombinasi isolat rizobakteri, metalaksil dan tanpa perlakuan (kontrol). Percobaan kedua (persemaian) terdiri atas lima taraf perlakuan benih yaitu rizobakteri ST116B, CM8, ST116B + CM8, metalaksil, dan kontrol. Percobaan ketiga (di rumah kaca) terdiri atas enam taraf perlakuan benih yaitu rizobakteri ST116B, CM8, ST116B + CM8, metalaksil, kontrol positif dan kontrol negatif. Hasil percobaan in vitro, semua perlakuan rizobakteri baik tunggal maupun yang dikombinasikan mampu menghambat pertumbuhan patogen P. capsici. Persentase daya hambat tertinggi berturut-turut ditunjukkan oleh isolat rizobakteri CM8, kombinasi isolat rizobakteri ST116B + CM8 dan isolat rizobakteri ST116B. Perlakuan benih dengan rizobakteri ST116B, CM8 dan ST116B + CM8 tidak dapat meningkatkan vigor benih, namun secara nyata meningkatkan pertambahan jumlah daun pada minggu keenam setelah pindah tanam, dan menurunkan kejadian penyakit busuk phytophthora. Tidak terdapat perbedaan nyata pengaruh rizobakteri yang diaplikasikan secara tunggal maupun kombinasi dua isolat. Rizobakteri ST116B disarankan untuk digunakan dalam perlakuan benih cabai sebelum tanam.
Kata kunci: agens hayati, metalaksil, penyakit busuk phytophthora, isolat rizobakteri
ABSTRACT
FARIH NAJAH ROSADIAH. Seed Treatments of Hot Pepper (Capsicum annuum L.) using Rhizobacteria Singly or in Combination to Control Phytophthora capsici and Improve Plant Growth. Supervised by SATRIYAS ILYAS and DYAH MANOHARA.
Seed treatment of hot pepper using rhizobacteria is an alternative to fungicide in controlling phytophthora blight disease that caused by Phytophthora
effectiveness of rhizobacteria isolates in inhibiting P. capsici growth, and (2) the effect of seed treatment using rhizobacteria on seed vigor and plant growth, and incidence of phytophthora blight disease. This research consisted of three experiments, all experiments were arranged in completely randomized design using one factor. The first experiment (in vitro) consisted of nine levels i.e. seven combination isolates of rhizobacteria, metalaxyl and untreated control. The second experiment (on the seedbed) consisted of five levels of seed treatments i.e. ST116B rhizobacteria, CM8 rhizobacteria, ST116B + CM8 rhizobacteria, metalaxyl and control. The third experiment (in the green house) consisted of six levels of seed treatments i.e. ST116B rhizobacteria, CM8 rhizobacteria, ST116B + CM8 rhizobacteria, metalaxyl, positive and negative control. Results of in vitro experiment showed that all rhizobacteria, single or combinations, were able to inhibit P. capsici growth. The highest inhibitions were shown by CM8, ST116B, and ST116B + CM8 consequtively. Seed treatments of hot pepper using ST116B, CM8 and ST116B + CM8 rhizobacteria did not increase seed vigor but increased the number of leaves 6 weeks after transplanting, and reduced the incidence of phytophthora blight disease. There were no significant differences whether the rhizobacteria was applied singly or in combination of the two isolates. Rhizobacteria ST116B is suggested to be used in hot pepper seed treatment before planting.
Keywords: biological agents, metalaxyl, phytophthora blight disease, rhizobacteria isolates
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
PERLAKUAN BENIH CABAI (Capsicum annuum L.) DENGAN
RIZOBAKTERI SECARA TUNGGAL ATAUPUN KOMBINASI
UNTUK MENGENDALIKAN Phytophthora capsici DAN
MENINGKATKAN PERTUMBUHAN TANAMAN
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan April 2014 ini berjudul Perlakuan Benih Cabai (Capsicum annuum L.) dengan Rizobakteri secara Tunggal ataupun Kombinasi untuk Mengendalikan Phytophthora capsici dan Meningkatkan Pertumbuhan Tanaman.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Ir Satriyas Ilyas, MS dan Ibu Dr Ir Dyah Manohara, MS selaku pembimbing skripsi, Bapak Dr Ir Iskandar Lubis, MS selaku pembimbing akademik dan Bapak Candra Budiman, SP MSi selaku dosen penguji. Di samping itu, penghargaan penulis sampaikan kepada Bapak Sutrasman dari Balai Penelitian Tanaman Rempah dan Obat, kelompok peneliti hama dan penyakit dan Bapak Mamad dari tim pengelola rumah kaca Cikabayan yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga dan teman-teman Agonomi dan Hortikultura 47 (EDELWEISS) atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi PENDAHULUAN 1 Latar Belakang 1 Tujuan Penelitian 2 TINJAUAN PUSTAKA 2Penyakit Busuk Phytophthora 2
Rizobakteri sebagai Pemacu Pertumbuhan Tanaman Cabai 3 Rizobakteri sebagai Agens Pengendali Patogen secara Hayati 4
Perlakuan Benih untuk Meningkatkan Mutu Benih 5
BAHAN DAN METODE 5
Tempat dan Waktu 5
Percobaan 1. Evaluasi keefektifan kombinasi isolat rizobakteri sebagai
antagonis P. capsici secara in vitro 6
Percobaan 2. Pengaruh perlakuan benih terhadap peningkatan vigor benih 7 Percobaan 3. Pengaruh perlakuan benih dalam meningkatkan pertumbuhan tanaman dan mengurangi persentase kejadian penyakit di rumah kaca 7
HASIL DAN PEMBAHASAN 8
Percobaan 1. Evaluasi keefektifan kombinasi isolat rizobakteri sebagai
antagonis P. capsici secara in vitro 8
Percobaan 2. Pengaruh perlakuan benih terhadap peningkatan vigor benih 11 Percobaan 3. Pengaruh perlakuan benih dalam meningkatkan pertumbuhan tanaman dan mengurangi persentase kejadian penyakit di rumah kaca 11
KESIMPULAN DAN SARAN 15
Kesimpulan 15
Saran 15
DAFTAR PUSTAKA 15
DAFTAR TABEL
1 Kemampuan isolat rizobakteri menghambat pertumbuhan Phytophthora
capsici secara in vitro 6 hari setelah inkubasi 10
2 Pengaruh perlakuan benih dengan rizobakteri terhadap viabilitas dan vigor benih cabai di persemaian sampai 14 hari setelah semai 11 3 Pengaruh perlakuan benih dengan rizobakteri terhadap pertambahan
jumlah daun 2-6 minggu setelah pindah tanam di polybag 12 4 Pengaruh perlakuan benih dengan rizobakteri terhadap pertambahan tinggi
tanaman 2-6 minggu setelah pindah tanam di polybag 13 5 Pengaruh perlakuan rizobakteri pada benih terhadap kejadian penyakit
saat 28 hari setelah infestasi inokulum Phytophthora capsici ke tanah 14
DAFTAR GAMBAR
1 Pertumbuhan koloni P. capsici dan perbedaan daya hambat beberapammn
rizobakteri terhadap P. capsici 9
2 Keragaan pertumbuhan hifa P. capsici pada media PDA 10 3 Perkecambahan benih cabai yang telah dilapisi rizobakteri atau metalaksil
dan tanpa perlakuan (kontrol) di persemaian 11
PENDAHULUAN
Latar BelakangPenggunaan benih bermutu rendah dan terinfeksi penyakit merupakan salah satu penyebab produktivitas cabai rendah di Indonesia. Phythoptora capsici merupakan patogen penyebab busuk phytophthora pada cabai, tomat, ketimun, labu-labuan dan terong (Louws et al. 2002). Pengendalian patogen ini masih sulit karena patogen bersifat terbawa benih dan juga bersifat tular tanah (Miller et al. 1996; Roberts et al. 2000; Louws et al. 2002). Menurut Ilyas (2006), keberadaan patogen terbawa benih dapat menghambat perkecambahan dan mengakibatkan epidemi penyakit karena transmisi patogen dari benih ke tanaman, sehingga dapat menimbulkan dampak negatif pada kualitas dan hasil tanaman. Menurut Wiyono (2011) kehilangan hasil cabai di daerah dataran tinggi Tegal pada tahun 2010 akibat serangan cendawan P. capsici mencapai 100%. Penyakit busuk phytophthora juga merupakan penyakit penting di beberapa negara. Granke et al. (2012) menyebutkan bahwa patogen ini telah tersebar di beberapa daerah di Amerika dan dunia. Kehilangan hasil akibat serangan P. capsici pada tanaman labu siap panen seluas 32 hektar mencapai 90% di Michigan.
Benih unggul bermutu merupakan kunci utama keberhasilan suatu usaha tani. Mutu benih menyangkut mutu genetis, fisik, fisiologis dan patologis (kesehatan benih) (Ilyas 2012). Peningkatan mutu benih dan bibit dapat dilakukan melalui perlakuan benih (seed treatment). Salah satu tujuan perlakuan benih adalah untuk memperbaiki perkecambahan benih dan melindungi benih dari hama dan penyakit. Saat ini perlakuan benih umumnya menggunakan fungisida sintesis, akan tetapi seiring kesadaran masyarakat akan bahaya lingkungan dan kesehatan, maka penggunaannya mulai dikurangi dan beralih pada penggunaan agens hayati antagonis yang dapat menghambat pertumbuhan patogen serta meningkatkan vigor benih dan pertumbuhan tanaman.
Beberapa jenis rizobakteri dilaporkan mampu menghasilkan hormon tumbuh seperti IAA, melarutkan fosfat, serta memproduksi enzim ekstraseluler (kitinase, protease dan selulase), HCN, dan senyawa siderofor. Kemampuan rizobakteri tersebut berhubungan dengan peran rizobakteri sebagai pemacu pertumbuhan tanaman serta perannya sebagai agens antagonis dalam menghambat patogen tanaman (Sutariati et al. 2006a; Syamsuddin 2010).Menurut Ilyas et al. (2014), aplikasi biopriming dengan Bacillus polymixa BG25 dan Pseudomonas
fluorescens PG01 pada benih cabai terinfeksi Colletotrichum capsici terbukti
mampu meningkatkan persen perkecambahan dari 56% menjadi 78%, meningkatkan indeks vigor dari 18% menjadi 37%, meningkatkan hasil buah cabai dari 10 buah menjadi 17 buah, serta mengurangi kejadian penyakit antraknosa dari 81% hingga menjadi 9% di lapangan.
Penelitian Ibrahim et al. (2014) menyebutkan bahwa perlakuan benih menggunakan rizobakteri ST116B, ST156 dan E3 nyata meningkatkan vigor benih cabai pada tolok ukur indeks vigor. Rizobakteri ST116B mampu meningkatkan pertumbuhan tanaman pada tolok ukur jumlah daun dan berpotensi mengendalikan penyakit busuk phytophthora pada tanaman cabai. Penelitian ini melanjutkan
2
penelitian Ibrahim et al. (2014) dengan mengkombinasikan rizobakteri ST116B dan ST156 serta satu rizobakteri koleksi Balittro lainnya, yakni rizobakteri CM8.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi keefektifan kombinasi isolat rizobakteri ST116B, ST156 dan CM8 dalam menghambat pertumbuhan P. capsici secara in vitro. Tiga kombinasi rizobakteri terbaik yang efektif menghambat pertumbuhan P. capsici secara in vitro digunakan untuk melapisi benih cabai (seed
treatment) dengan tujuan untuk meningkatkan vigor benih dan pertumbuhan
tanaman cabai serta untuk mengendalikan P. capsici.
TINJAUAN PUSTAKA
Mutu benih merupakan faktor penentu keberhasilan pertanaman secara ekonomis. Mutu benih mencakup mutu fisik, fisiologis, genetis dan patologis (kesehatan benih) (Ilyas 2012). Mutu fisik benih diukur dari kebersihan benih, bentuk dan warna cerah yang homogen serta benih tidak mengalami kerusakan mekanis atau kerusakan karena serangan hama dan penyakit. Mutu fisiologis benih diukur dari viabilitas benih, kadar air, maupun daya simpan benih, sedangkan mutu genetik diukur dari tingkat kemurniannya (Widajati et al. 2013).
Menurut Ilyas (2012), salah satu karakteristik benih bermutu tinggi adalah bebas dari penyakit seedborne, yaitu infeksi berasal dari tanaman yang menghasilkan benih terinfeksi. Patogen ini dapat menginfeksi benih yang sedang berkecambah sehingga benih mati. Jika perkecambahan dapat terjadi namun patogen berkembang biak, maka kecambah/bibit yang dihasilkan akan tumbuh abnormal.
Keberadaan patogen terbawa benih selain menghambat perkecambahan juga dapat menyebabkan epidemi penyakit karena transmisi penyakit dari benih ke tanaman. Hal ini mengakibatkan dampak negatif pada kualitas dan hasil produksi tanaman. Oleh karena itu, penggunaan benih yang sehat dari awal merupakan hal yang penting (Ilyas 2006). Louws et al. (2002) melaporkan bahwa P. capsici penyebab penyakit busuk phytophthora pada cabai merupakan salah satu patogen terbawa benih (seedborne) dan juga bersifat tular tanah (soilborne).
Penyakit Busuk Phytophthora
Penyakit busuk phytophthora merupakan salah satu penyakit penting pada cabai yang disebabkan oleh serangan cendawan P. capsici. Kerusakan akibat penyakit busuk phytophthora telah banyak dilaporkan pada banyak pertanaman cabai di Indonesia maupun dunia. Kehilangan hasil cabai akibat serangan penyakit ini mencapai 100% pada pertanaman cabai di dataran tinggi Tegal pada tahun 2010 (Wiyono 2011) dan juga mencapai 100% pada pertanaman cabai di Urbana, Illinois (Babadoost 2001). Patogen P. capsici tidak hanya menyerang cabai, namun juga beberapa tanaman lain seperti tomat, mentimun, labu-labuan dan terong (Lows et
3
al. 2002). Kehilangan hasil akibat serangan P. capsici pada tanaman labu siap
panen seluas 32 hektar mencapai 90% di Michigan (Granke et al. 2012).
Phytophthora capsici merupakan cendawan tular tanah yang dapat
membentuk struktur istirahat yang mampu bertahan dalam waktu cukup lama. Serangan P. capsici banyak terjadi pada musim hujan. Penyebarannya dapat terbawa air, angin yang terjadi selama hujan, bahan tanaman, ternak/hewan, manusia dan alat pertanian (Manohara et al. 2005). Hujan, tanah basah, dan suhu di antara 24-29 0C merupakan lingkungan yang baik untuk perkembangan penyakit busuk phytophtora. Inisiasi infeksi terjadi ketika zoospora dilepaskan ke dalam air, berenang dan mengadakan kontak dengan jaringan inang. Proses infeksi berikutnya yakni pembentukan luka pada pangkal batang dekat permukaan tanah (Zitter 1989; Babadoost 2004).
Cendawan P. capsici dapat menyerang semua umur/stadia tanaman lada, mulai dari pembibitan sampai tanaman produktif. Serangan yang paling membahayakan adalah pada pangkal batang atau akar karena menyebabkan kematian tanaman dengan cepat. Gejala berupa kelayuan tanaman secara mendadak (daun tetap berwarna hijau) akan nampak apabila terjadi serangan patogen pada pangkal batang (Manohara et al. 2005).
Gejala awal pada tanaman cabai di lapangan yang terserang penyakit busuk phytophthora biasanya berupa akar yang berwarna cokelat kehitaman. Fase ini pada umumnya terjadi di bawah permukaan tanah (Louws et al.2002). Gejala pada daun ditandai dengan adanya bercak kecil berwarna hijau kehitaman kemudian meluas dan menjadi putih seperti terbakar, kemudian setelah 15 hari akan terbentuk warna cokelat pada pinggir daun (Roberts et al.2000). Patogen P. capsici yang menyerang daun dapat berpindah menyerang batang, sehingga pada fase ini tanaman akan mati (Uchida 2005). Gejala pada batang ditandai adanya luka luas berwarna hitam (Louwset al. 2002), sedangkan gejala pada akar ditandai dengan akar yang berwarna cokelat kehitaman (Syamsuddin 2010). Gejala pada buah ditandai adanya bercak gelap yang terus berkembang, bagian buah menjadi berair yang kemudian diselimuti oleh spora cendawan berwarna putih. Buah yang terinfeksi menyebabkan benih juga terinfeksi oleh patogen ini (Zitter 1989).
Rizobakteri sebagai Pemacu Pertumbuhan Tanaman Cabai
Rizobakteri merupakan bakteri yang hidup pada rizosfer tanaman. Rizosfer merupakan daerah di sekitar perakaran tanaman tempat terjadinya interaksi antara agensia pengendali hayati dan patogen tanaman (Soesanto 2008). Interaksi tersebut secara signifikan dapat mempengaruhi pertumbuhan dan hasil tanaman. Rizosfer mengandung berbagai macam komunitas mikroorganisme yang saling berinteraksi dan bersaing (Dardanelli et al. 2010).
Beberapa rizobakteri berperan sebagai plant growth promoting rhizobacteria (PGPR) atau agens pemacu pertumbuhan tanaman. Penggunaan rizobakteri untuk memacu pertumbuhan berbagai tanaman telah banyak dikembangkan di berbagai belahan dunia. Rizobakteri dapat mempengaruhi pertumbuhan tanaman dengan memproduksi dan melepaskan senyawa metabolit sekunder yang dapat mengurangi atau mencegah efek kerusakan dari patogen dalam rizosfer (Dardanelli et al. 2010). Sebagai pemacu pertumbuhan tanaman, rizobakteri secara kompetitif mengkolonisasi akar dan memanfaatkan eksudat dan lisat yang dikeluarkan akar
4
tanaman (Antoum dan Prevost 2006). Eksudat akar merupakan bahan yang dikeluarkan dari aktivitas sel akar hidup seperti gula, asam amino, asam organik, asam lemak dan sterol, faktor tumbuh, nukleotida, sedangkan lisat akar merupakan bahan yang dikeluarkan secara pasif saat autolisis sel akar (Soemarno 2010). Kemampuan rizobakteri mengkolonisasi akar merupakan tahap penting sehubungan dengan perannya sebagai pemacu pertumbuhan tanaman. Kemampuan memfiksasi nitrogen, melarutkan fosfat, dan produksi hormon tumbuh (auksin, giberelin, sitokinin) telah banyak dilaporkan sebagai mekanisme rizobakteri dalam perannya sebagai agens pemacu pertumbuhan dan produksi tanaman (Syamsuddin 2010).
Sutariati et al. (2006b) melaporkan, perlakuan benih cabai menggunakan isolat rizobakteri Bacillus sp., Pseudomonas sp. dan Serratia sp. secara signifikan meningkatkan viabilitas benih. Persentase kenaikan perkecambahan benih jika dibandingkan dengan benih tanpa perlakuan rizobakeri mencapai lebih dari 27%, potensi tumbuh maksimum 11%, indeks vigor 31%, spontanitas tumbuh 29%, kecepatan tumbuh 29% dan penurunan T50 (waktu yang diperlukan untuk mencapai
50% perkecambahan) 0.75 hari. Semua rizobakteri tersebut dilaporkan dapat mensintensis indole acetic acid (IAA) yang berperan sebagai PGPR.
Syamsuddin (2010) juga melaporkan, sebagian besar isolat rizobakteri yang berasal dari rizosfer tanaman cabai sehat diantara tanaman cabai terserang busuk phytophthora mampu memproduksi IAA. Perlakuan benih dengan isolat B.
megaterium BSKW03, B. brevis BSKW21 dan B. alvei BSPJG20 dari kelompok Bacillus spp., P. fluoroscens PSPJG05, P. aeruginosa PSKW07 dan P. putida
PSKW12 dari kelompok Pseudomonas spp. memberikan dampak yang lebih baik dalam meningkatkan vigor, viabilitas dan pertumbuhan bibit cabai dibandingkan dengan isolat lainnya dalam kelompok yang sama. Sebagian besar isolat rizobakteri dari masing-masing kelompok rizobakteri yang diuji juga memiliki kemampuan melarutkan fosfat. Terdapat kecenderungan peningkatan pertumbuhan bibit yang lebih baik pada isolat rizobakteri yang mampu melarutkan fosfat dibandingkan dengan yang tidak mampu melarutkan fosfat.
Rizobakteri sebagai Agens Pengendali Patogen secara Hayati
Rizobakteri juga berperan sebagai agens pengendali patogen secara hayati. Syamsuddin dan Ulim (2013) melaporkan, terdapat tiga dari 18 rizobakteri yang diisolasi dari rizosfer tanaman tomat sehat di antara tanaman tomat berpenyakit busuk phytophthora berpotensi sebagai agens hayati karena mampu menghambat pertumbuhan koloni patogen P. capsici yaitu isolat RBBM36, RBBM18 dan RBBM35. Ibrahim et al. (2014) juga melaporkan bahwa rizobakteri ST116B berpotensi mengendalikan penyakit busuk phytophthora pada tanaman cabai.
Isolat rizobakteri yang didapat dari rizosfer tanaman cabai sehat mampu mensekresikan enzim ekstraseluler serta memproduksi HCN dan siderofor sehingga dapat menghambat pertumbuhan patogen P. capsici (Syamsuddin 2010). Rizobakteri kelompok P. fluorescens PG01 mampu menghambat pertumbuhan
Colletotrichum capsici melalui sintesis senyawa HCN yang bersifat toksik bagi
patogen (Sutariati et al. 2006a).
Ilyas et al. (2014) melaporkan, biomatriconditioning dengan biofungisida berupa minyak cengkeh 0.06% atau 0.1% dapat mengurangi persentase kejadian
5 penyakit C. capsici. Biomatriconditioning menggunakan bubuk daun cengkeh terbukti lebih baik daripada matriconditioning dengan fungisida dalam mengurangi tingkat infeksi C. capsici pada cabai. Hasil percobaan di lapangan menunjukkan bahwa biopriming dengan campuran B. polymixa BG25 dan P. fluoroscens PG01 dapat mengurangi kejadian penyakit antraknosa dari 81% hingga menjadi 9%, sedangkan pada perlakuan tunggal baik B. polymixa BG25 maupun P. fluoroscens PG01 dapat mengurangi kejadian penyakit antraknosa dari 81% hingga menjadi 12%.
Perlakuan Benih untuk Meningkatkan Mutu Benih
Invigorasi benih merupakan perlakuan yang diberikan terhadap benih dengan tujuan memperbaiki vigor benih. Ada berbagai teknik invigorasi benih pratanam, tetapi secara umum terbagi menjadi dua kategori, yaitu penyerapan air secara terkontrol dan tidak terkontrol. Penyerapan air terkontrol terdiri atas dua macam, yaitu priming dan matriconditioning. Priming adalah perlakuan hidrasi benih terkontrol dengan larutan berpotensial osmotik rendah, sedangkan potensial matriks dapat diabaikan selama periode tertentu dengan tertundanya perkecambahan (Ilyas 2012), sedangkan biopriming merupakan integrasi agens biokontrol pada perlakuan priming (Ilyas et al. 2014).
Syamsuddin (2010) melaporkan, perlakuan benih cabai menggunakan agens biokontrol B. megaterium BSKW03, B. brevis BSKW21, B. alvei BSPJG20,
P. flurescens PSPJG05, P. aeruginosa PSKW07 dan P. putida PSKW12 efektif
mengendalikan penyakit busuk phytophthora pada stadia bibit serta meningkatkan pertumbuhan dan hasil cabai.
Ilyas et al. (2014) melaporkan bahwa biomatriconditioning dengan biofungisida berupa minyak cengkeh 0.06% atau 0.1% merupakan perlakuan benih yang efektif untuk meningkatkan indeks vigor dan kecepatan tumbuh relatif.
Biomatriconditioning menggunakan bubuk daun cengkeh juga terbukti lebih baik
dalam meningkatkan vigor dan viabilitas benih selama 24 minggu penyimpanan dalam ruang kamar. Hasil percobaan di lapangan, biopriming dengan campuran B.
polymixa BG25 atau P. fluoroscens PG01 terbukti dapat meningkatkan
pertumbuhan tanaman, hasil buah, serta mutu benih hasil panen.
BAHAN DAN METODE
Tempat dan WaktuPenelitian ini dilaksanakan di Laboratorium Penyakit Balai Penelitian Tanaman Rempah dan Obat (Balittro), Laboratorium Kesehatan Benih, Departemen Agronomi dan Hortikultura dan Rumah Kaca Cikabayan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilaksanakan pada bulan April hingga Desember 2014.
6
Percobaan 1. Evaluasi keefektifan kombinasi isolat rizobakteri sebagai antagonis P. capsici secara in vitro
Suspensi sel rizobakteri ST116B, ST156 dan CM8 (koleksi Balittro) dikombinasikan dengan cara mencampurkan dua atau tiga suspensi sel rizobakteri yang masing-masing berjumlah 50 mL ke dalam sebuah erlenmeyer, kemudian erlenmeyer dikocok hingga suspensi sel tercampur merata. Perlakuan kombinasi rizobakteri secara rinci adalah sebagai berikut:
1. Rizobakteri ST116B 2. Rizobakteri ST156 3. Rizobakteri CM8 4. Kombinasi ST116B + ST156 5. Kombinasi ST116B + CM8 6. Kombinasi ST156 + CM8 7. Kombinasi ST116B + ST156 + CM8 8. Metalaksil, dijadikan sebagai pembanding 9. Kontrol
Uji keefektifan kombinasi isolat rizobakteri sebagai antagonis P. capsici dilakukan dengan metode dual culture. Isolat P. capsici yang telah ditumbuhkan pada media PDA (potato dextrose agar) dipotong dengan diameter 0.5 cm kemudian dipindahkan ke media PDA baru dengan jarak 2 cm dari tepi cawan petri menggunakan jarum inet. Isolat rizobakteri yang diuji digoreskan memanjang dengan jarak 5 cm dari isolat P. capsici menggunakan jarum ose. Untuk perlakuan metalaksil (Saromil berbahan aktif 35% metalaksil) dilakukan dengan merendam
paper disk Ø 0.5 cm ke dalam suspensi metalaksil 800 ppm selama 5 menit,
kemudian diletakkan dengan jarak 5 cm dari isolat P. capsici. Sebagai kontrol, isolat P. capsici ditumbuhkan pada media PDA tanpa perlakuan rizobakteri ataupun perlakuan metalaksil. Pengamatan dilakukan pada hari ke-3, hari ke-6 dan hari ke-8 terhadap pertumbuhan koloni patogen P. capsici dan zona penghambatan (ruang di antara pertumbuhan P. capsici dan rizobakteri). Pengamatan zona penghambatan dilakukan dengan mengukur jarak antara ujung hifa P. capsici dan goresan rizobakteri menggunakan penggaris (cm). Persentase daya hambat (DH) rizobakteri terhadap pertumbuhan patogen P. capsici dihitung dengan rumus yang merujuk pada Syamsuddin (2010), yaitu:
Keterangan:
R1 = jari-jari pertumbuhan patogen tanpa rizobakteri (kontrol); R2 = jari-jari pertumbuhan patogen ke arah rizobakteri.
Percobaan in vitro ini menggunakan rancangan acak lengkap (RAL) satu faktor yaitu isolat rizobakteri terdiri atas sembilan taraf: tujuh perlakuan kombinasi isolat rizobakteri, perlakuan metalaksil dan kontrol. Setiap perlakuan diulang lima kali sehingga terdapat 45 satuan percobaan. Tiga perlakuan isolat rizobakteri terbaik yang berpotensi menghambat P. capsici kemudian digunakan untuk percobaan selanjutnya.
7 Percobaan 2. Pengaruh perlakuan benih terhadap peningkatan vigor benih
Sumber benih
Benih yang digunakan pada penelitian ini adalah benih cabai varietas Laris produksi PT. East West Seed Indonesia yang diperoleh dari salah satu toko pertanian di Lampung pada bulan Mei 2014 dengan masa kadaluarsa sampai bulan Mei 2015. Daya berkecambah awal benih sebesar 78%, sedangkan daya berkecambah benih sesaat sebelum benih digunakan yakni 63%. Varietas Laris dipilih karena rentan terhadap serangan patogen P. capsici (Yunianti et al. 2007).
Perlakuan benih dengan rizobakteri
Perlakuan benih dengan cara direndam dalam suspensi rizobakteri disebut sebagai biopriming (Ilyas et al. 2014). Sebelum diberi perlakuan, benih terlebih dahulu didisinfeksi dengan merendam benih dalam alkohol 70% selama 3 menit. Selanjutnya benih dicuci sebanyak tiga kali dengan akuades steril dan dikering-anginkan dalam laminar air flow cabinet selama 60 menit. Benih yang telah dikering-anginkan diberi perlakuan dengan cara merendam benih dalam 50 mL suspensi isolat rizobakteri atau 50 mL suspensi metalaksil (800 ppm) atau 50 mL air steril (sebagai kontrol) selama 24 jam pada suhu 26 0C. Benih yang telah diberi
perlakuan selanjutnya dikering-anginkan selama 60 menit sebelum ditanam (Syamsuddin 2010). Suspensi sel rizobakteri yang digunakan dibuat dengan menginkubasi masing-masing rizobakteri dalam 50 mL potato dextrose (PD) selama 48 jam, kemudian dilihat nilai optical density (OD) dengan menggunakan
spektrofotometer agar diketahui kerapatan rizobakteri tersebut. Kerapatan populasi
ketiga rizobakteri tersebut adalah 109 cfu mL-1.
Benih yang sudah diberi perlakuan pelapisan rizobakteri kemudian disemai pada tray semai yang berisi campuran tanah dan pupuk kandang (1:1 v/v) di rumah kaca. Pengamatan kecambah normal benih cabai dilakukan setiap hari hingga 14 hari setelah tanam (HST), kemudian bibit dirawat di persemaian hingga berumur 35 HST. Pengamatan dilakukan pada tolok ukur: (1) daya tumbuh, (2) indeks vigor (IV), (3) keserempakan tumbuh (KST), dan (4) kecepatan tumbuh (KCT).
Percobaan kedua ini menggunakan RAL satu faktor yaitu perlakuan benih dengan isolat rizobakteri terdiri atas lima taraf: isolat rizobakteri ST116B, isolat rizobakteri CM8, isolat rizobakteri ST116B + CM8, perlakuan metalaksil, dan kontrol negatif (tanpa perlakuan benih dan tanpa inokulasi P. capsici). Setiap perlakuan diulang empat kali sehingga terdapat 20 satuan percobaan. Setiap satuan percobaan menggunakan 25 benih sehingga terdapat 500 satuan pengamatan. Bibit berumur 35 HST dari hasil percobaan kedua dipindahkan ke polybag untuk digunakan dalam percobaan ketiga.
Percobaan 3. Pengaruh perlakuan benih dalam meningkatkan pertumbuhan tanaman dan mengurangi persentase kejadian penyakit di rumah kaca
Penanaman bibit di polybag
Sebanyak 30 bibit per perlakuan kemudian dipindahkan ke polybag (satu bibit per polybag) berukuran 30 cm x 35 cm. Khusus pada perlakuan kontrol,
8
dipindahkan 30 bibit untuk bibit tanpa perlakuan dan tanah tidak diinokulasi P.
capsici (kontrol negatif), dan 30 untuk bibit tanpa perlakuan rizobakteri tetapi
tanah diinokulasi P. capsici (kontrol positif). Media tanam yang digunakan adalah campuran tanah dan pupuk kandang (4:1 v/v). Media tanam yang berisi bibit tersebut diletakkan secara teratur berjarak 30 cm x 50 cm. Penyiraman dilakukan setiap hari agar pertumbuhan dan perkembangan bibit normal. Pemupukan tanaman dilakukan saat 2 dan 6 minggu setelah pindah tanam (MSP) menggunakan pupuk NPK Mutiara (15:15:15) sebanyak 50 mL per tanaman dengan dosis 2 g l-1.
Penyiapan tanah inokulum dan infestasi tanah pada tanaman
Tanah inokulum dibuat dengan mengering-anginkan tanah sebanyak 4 kg, kemudian dicampur dengan 4% oat meal dan diberi air secukupnya hingga membasahi seluruh campuran tanah dan oat meal. Tanah tersebut kemudian disterilkan dengan autoklaf suhu 120°C selama 30 menit. Potongan biakan diinfestasikan ke tanah yang sudah steril dan diinkubasi pada ruangan suhu 23-25
oC selama 2 minggu (Manohara 1988). Infestasi tanah inokulum dilakukan saat
bibit berumur 2 MSP, dengan cara sebanyak 10 g tanah inokulum disebar di sekeliling tanaman dan pangkal batang tidak dilukai (Ibrahim et al. 2014). Pengamatan dilakukan 1-6 MSP pada tolok ukur pertambahan tinggi tanaman dan pertambahan jumlah daun, dan 1-4 MSI (minggu setelah infestasi tanah inokulum) pada tolok ukur kejadian penyakit.
Percobaan ketiga menggunakan RAL satu faktor yaitu perlakuan benih dengan isolat rizobakteri terdiri atas enam taraf: isolat rizobakteri ST116B, isolat rizobakteri CM8, isolat rizobakteri ST116B + CM8, metalaksil, tanpa perlakuan benih dan tanpa inokulasi P. capsici (kontrol negatif), tanpa perlakuan benih dan diinokulasi P. capsici (kontrol positif). Setiap perlakuan diulang tiga kali sehingga terdapat 18 perlakuan. Setiap satuan percobaan menggunakan 10 bibit sehingga dibutuhkan 180 bibit cabai.
HASIL DAN PEMBAHASAN
Kondisi UmumDaya berkecambah benih cabai sesaat sebelum benih ditanam adalah sebesar 63%. Penyiraman dilakukan satu kali sehari saat pagi hari untuk menjaga kelembaban tanah. Suhu rata-rata dalam rumah kaca saat siang hari mencapai 41
oC dengan suhu tertinggi mencapai 50 oC. Pengendalian hama dilakukan dengan
menyemprotkan insektisida berbahan aktif deltametrin 25 g l-1 dengan konsentrasi 0.5 mll-1 setiap dua minggu sekali. Pengendalian gulma dilakukan secara manual yakni dengan pencabutan.
Percobaan 1. Evaluasi keefektifan kombinasi isolat rizobakteri sebagai antagonis P. capsici secara in vitro
Daya hambat isolat rizobakteri terhadap pertumbuhan P. capsici terlihat pada pertumbuhan koloni P. capsici pada perlakuan rizobakteri yang lebih lambat
9 dibandingkan kontrol (P. capsici ditumbuhkan pada media PDA tanpa perlakuan rizobakteri ataupun metalaksil) (Gambar 1A). Saat 8 hari setelah inkubasi, jari-jari koloni P. capsici pada kontrol telah memenuhi permukaan media tumbuh, sedangkan pertumbuhan jari-jari koloni P. capsici pada perlakuan rizobakteri dan metalaksil terhambat, sehingga terbentuk zona penghambatan (ruang kosong di antara pertumbuhan P. capsici dan rizobakteri) (Gambar 1A).
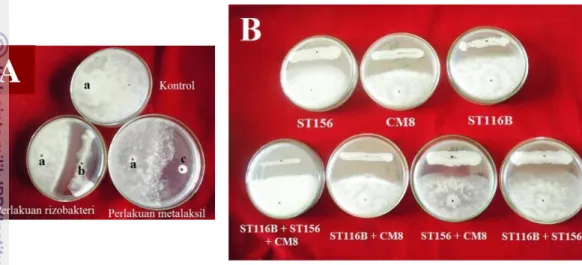
Gambar 1 Pertumbuhan koloni P. capsici (a), rizobakteri ST116B (b) dan paper disc Ø 0.5 cm yang telah direndam metalaksil 800 ppm (c) pada media PDA (A); perbedaan daya hambat beberapa rizobakteri terhadap P. capsici (B)
Lebar zona penghambatan pertumbuhan dari P. capsici atau daya antagonisme yang terbentuk pada beberapa perlakuan rizobakteri yang diuji berbeda-beda (Gambar 1B), hal ini menunjukkan bahwa setiap rizobakteri memiliki kemampuan yang berbeda-beda dalam menghasilkan senyawa metabolit sekunder yang bersifat antagonis terhadap P. capsici. Menurut Syamsuddin (2010), efektifitas penghambatan rizobakteri terhadap patogen melibatkan banyak mekanisme, salah satunya yakni berhubungan dengan kemampuan isolat rizobakteri dalam mensekresikan enzim ekstraseluler (kitinase, protease dan selulase) khususnya protease dan selulase, serta produksi HCN.
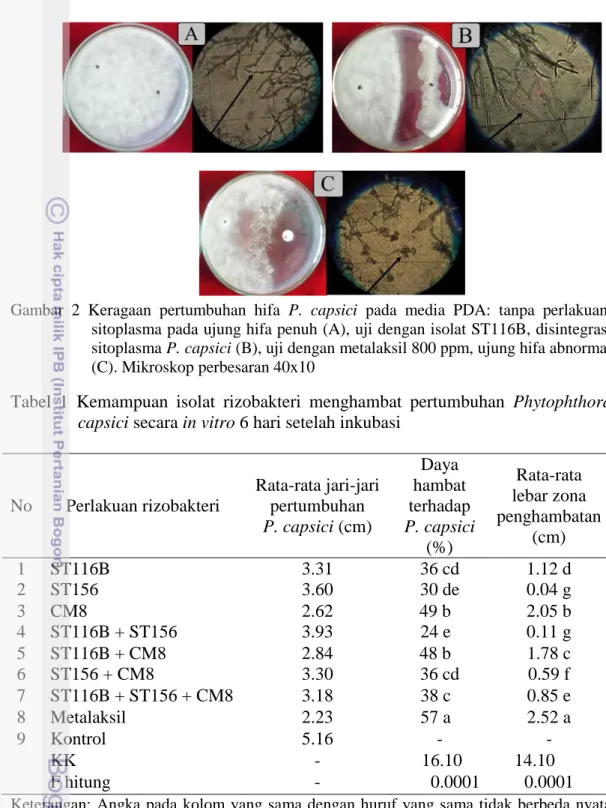
Secara mikroskopis terlihat perbedaan bentuk antara ujung hifa cendawan
P. capsici pada perlakuan rizobakteri, perlakuan metalaksil dan kontrol (Gambar
2). Diby et al. (2005) menjelaskan bahwa beberapa strain P. fluoroscens dan
Trichoderma spp. mampu berperan sebagai agens antagonis terhadap patogen P. capsici dengan menghasilkan enzim mycolytic viz. β-1,3 glucanase, β-14
glucanase dan lipase. Beberapa strain P. fluoroscens menyebabkan koagulasi sitoplasma miselium P. capsici dan menghancurkan keseluruhan isi sitoplasma setelah dikulturkan secara bersama-sama setelah 72 jam.
10
Gambar 2 Keragaan pertumbuhan hifa P. capsici pada media PDA: tanpa perlakuan, sitoplasma pada ujung hifa penuh (A), uji dengan isolat ST116B, disintegrasi sitoplasma P. capsici (B), uji dengan metalaksil 800 ppm, ujung hifa abnormal (C). Mikroskop perbesaran 40x10
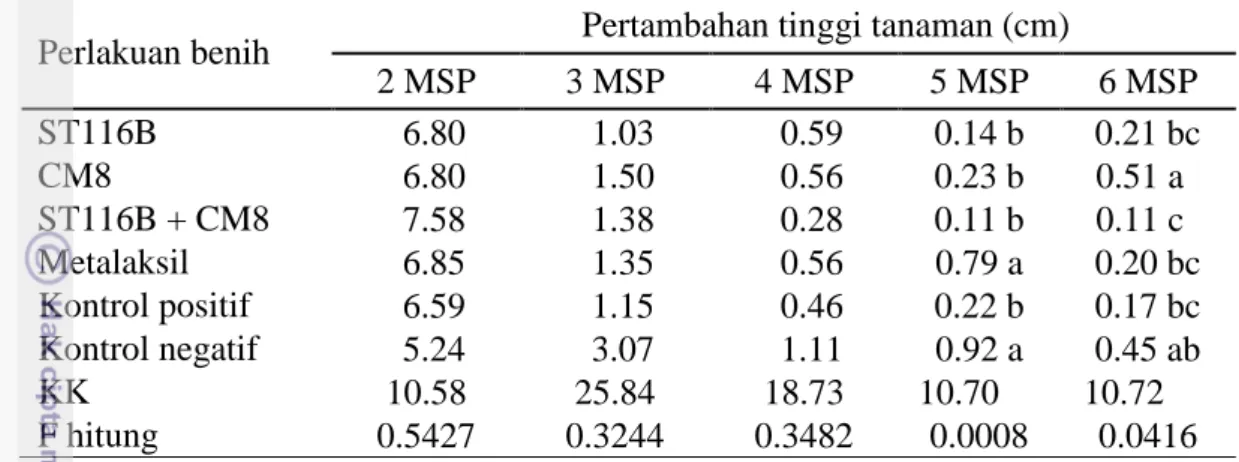
Tabel 1 Kemampuan isolat rizobakteri menghambat pertumbuhan Phytophthora
capsici secara in vitro 6 hari setelah inkubasi
No Perlakuan rizobakteri Rata-rata jari-jari pertumbuhan P. capsici (cm) Daya hambat terhadap P. capsici (%) Rata-rata lebar zona penghambatan (cm) 1 ST116B 3.31 36 cd 1.12 d 2 ST156 3.60 30 de 0.04 g 3 CM8 2.62 49 bb 2.05 b 4 ST116B + ST156 3.93 24 ee 0.11 g 5 ST116B + CM8 2.84 48 bb 1.78 c 6 ST156 + CM8 3.30 36 cd 0.59 f 7 ST116B + ST156 + CM8 3.18 38 cc 0.85 e 8 Metalaksil 2.23 57 aa 2.52 a 9 Kontrol 5.16 - - KK - 16.10 14.10 F hitung - 0.0001 0.0001
Keterangan: Angka pada kolom yang sama dengan huruf yang sama tidak berbeda nyata berdasarkan Duncan multiple range test (DMRT) pada taraf α = 5%
Daya hambat isolat rizobakteri yang diuji berkisar antara 24% - 49% setelah enam hari inkubasi (Tabel 1). Daya hambat tertinggi ditunjukkan oleh isolat CM8. Perlakuan kombinasi rizobakteri tidak menunjukkan persentase daya hambat yang lebih tinggi dibandingkan perlakuan rizobakteri tunggal. Dari hasil Percobaan ini, rizobakteri CM8, kombinasi ST116B + CM8 dan rizobakteri ST116B dipilih untuk digunakan dalam melapisi benih pada percobaan berikutnya.
11 Percobaan 2. Pengaruh perlakuan benih terhadap peningkatan vigor benih Tabel 2 Pengaruh perlakuan benih dengan rizobakteri terhadap viabilitas dan vigor
benih cabai di persemaian sampai 14 hari setelah semai
Perlakuan benih Daya tumbuh (%) Indeks vigor (%) Keserempakan tumbuh (%) Kecepatan tumbuh (% etmal-1) ST116B 51 b 3 b 32 b 5.19 b CM8 27 c 0 b 6 d 1.87 c ST116B + CM8 23 c 0 b 10 cd 1.86 c Metalaksil 37 bc 5 b 23 bc 3.73 bc Tanpa perlakuan 65 a 21 a 56 a 8.08 a KK 31.75 3.33 41.22 34.53 F hitung 0.0018 0.0001 0.0001 0.0001 Keterangan: Angka pada kolom yang sama diikuti dengan huruf yang sama tidak berbeda nyata berdasarkan DMRT pada taraf α = 5%; data Indeks Vigor sebelum diolah ditransformasi dengan rumus
Tabel 2 menunjukkan bahwa perlakuan rizobakteri maupun perlakuan metalaksil tidak mampu meningkatkan viabilitas dan vigor benih di persemaian pada tolok ukur daya berkecambah, indeks vigor, keserempakan tumbuh dan kecepatan tumbuh. Hal tersebut diduga disebabkan oleh rendahnya viabilitas benih cabai yang digunakan. Daya berkecambah benih cabai sesaat sebelum benih ditanam adalah 63%. Beberapa benih yang digunakan diduga sudah tidak viabel lagi, sehingga perlakuan rizobakteri tidak dapat menunjukkan adanya persentase kenaikan vigor benih secara nyata. Kondisi perkecambahan benih cabai dapat dilihat pada Gambar 3.
Gambar 3 Perkecambahan benih cabai yang telah dilapisi rizobakteri atau metalaksil dan tanpa perlakuan (kontrol) di persemaian. A = CM8; B = ST116B; C = ST116B + CM8; D = metalaksil; E = kontrol
Percobaan 3. Pengaruh perlakuan benih dalam meningkatkan pertumbuhan tanaman dan mengurangi persentase kejadian penyakit di rumah kaca
Tabel 3 menunjukkan bahwa seluruh perlakuan rizobakteri maupun metalaksil tidak memberikan pengaruh yang nyata terhadap pertambahan jumlah daun cabai saat 2-5 MSP. Benih dengan perlakuan isolat ST116B, CM8 dan ST116B + CM8 mampu meningkatkan pertambahan jumlah daun yang sangat nyata lebih tinggi dibandingkan kontrol positif (benih tanpa perlakuan rizobakteri
12
dan tanah diinokulasi P. capsici) saat 6 MSP. Hal tersebut diduga berhubungan dengan peranan rizobakteri sebagai pemacu pertumbuhan tanaman atau PGPR. Tabel 3 Pengaruh perlakuan benih dengan rizobakteri terhadap pertambahan
jumlah daun 2-6 minggu setelah pindah tanam di polybag
Perlakuan benih Pertambahan jumlah daun
2 MSP 3 MSP 4 MSP 5 MSP 6 MSP
ST116B a2.5 a0.7 a1.8 a5.3 8.4 a
CM8 a2.3 a0.9 a2.7 a3.7 6.5 a
ST116B + CM8 a3.2 a1.0 a2.7 a8.4 9.0 a
Metalaksil a2.8 a1.0 a4.1 a7.2 2.1 b
Kontrol positif a2.5 a1.7 a1.7 10.2 2.8 b
Kontrol negatif a3.1 a2.3 a2.4 a6.4 9.0 a
KK 17.06 21.00 37.23 24.06 9.53a
F hitung 0.9359 0.1637 0.8877 0.3121 0.0001
Keterangan: Angka pada kolom yang sama diikuti dengan huruf yang sama tidak berbeda nyata berdasarkan DMRT pada taraf α = 5%; data pada tabel sebelum diolah
ditransformasi dengan rumus ; kontrol positif (tanpa perlakuan rizobakteri dan tanah
diinokulasi P. capsici), kontrol negatif (tanpa perlakuan rizobakteri dan tanah tidak diinokulasi P. capsici); MSP = minggu setelah pindah tanam; pengamatan dilakukan terhadap 10 tanaman per ulangan, setiap perlakuan terdiri atas tiga ulangan; pertambahan jumlah daun 2 MSP merupakan selisih jumlah daun antara pengamatan 1 MSP dan 2 MSP
Menurut Tenuta (2004), kemampuan rizobakteri sebagai PGPR berhubungan erat dengan kemampuannya dalam memproduksi fitohormon seperti IAA, sitokinin, giberelin dan etilen dalam peranannya sebagai biostimulant. Selain itu, menurut McMillan (2007), kemampuan rizobakteri dalam menyediakan hara (biofertilizer) dengan menambatkan N2 dari udara secara asimbiosis, kemampuan
melarutkan fosfat serta kemampuan mengoksidasi sulfur juga merupakan karakteristik rizobakteri dalam peranannya sebagai PGPR. Penelitian sebelumnya telah dilaporkan bahwa inokulasi benih dengan rizobakteri isolat Bacillus spp.,
Pseudomonas spp. dan Serratia spp. nyata meningkatkan jumlah daun cabai saat 6
MSP (Syamsuddin 2010). Ibrahim et al. (2014) juga melaporkan bahwa perlakuan benih dengan rizobakteri ST116B mampu meningkatkan pertumbuhan tanaman cabai pada tolok ukur jumlah daun.
Hasil pengamatan saat 6 MSP (Tabel 3) juga menunjukkan bahwa perlakuan rizobakteri mampu mempertahankan laju pertumbuhan tanaman yang sakit seperti laju pertumbuhan tanaman yang sehat. Hal tersebut terlihat pada tanaman yang diinokulasi P. capsici dengan isolat ST116B, CM8 dan ST116B + CM8 memiliki laju pertambahan jumlah daun yang tidak berbeda nyata dengan kontrol negatif (tanaman yang tidak diinokulasi P. capsici namun benih tidak diberi perlakuan). Benih dengan perlakuan metalaksil menunjukkan nilai yang tidak berbeda nyata dengan kontrol positif (benih tanpa perlakuan dan tanah diinokulasi P. capsici), namun nyata lebih rendah dibandingkan benih dengan perlakuan rizobakteri. Hal tersebut diduga disebabkan karena metalaksil tidak dapat memproduksi senyawa PGPR sebagaimana yang bisa diproduksi oleh rizobakteri.
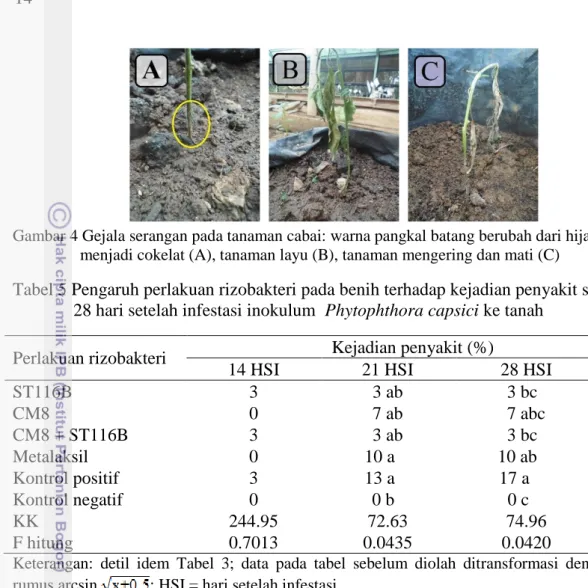
13 Tabel 4 Pengaruh perlakuan benih dengan rizobakteri terhadap pertambahan tinggi
tanaman 2-6 minggu setelah pindah tanam di polybag
Perlakuan benih Pertambahan tinggi tanaman (cm)
2 MSP 3 MSP 4 MSP 5 MSP 6 MSP
ST116B a6.80 a1.03 a0.59 0.14 b 0.21 bc
CM8 a6.80 a1.50 a0.56 0.23 b 0.51 aa
ST116B + CM8 a7.58 a1.38 a0.28 0.11 b 0.11 ca
Metalaksil a6.85 a1.35 a0.56 0.79 a 0.20 bc
Kontrol positif a6.59 a1.15 a0.46 0.22 b 0.17 bc Kontrol negatif a5.24 a3.07 a1.11 0.92 a 0.45 ab
KK 10.58 25.84 18.73 10.70 aa 10.72aaa
F hitung 0.5427 0.3244 0.3482 0.0008 0.0416
Keterangan: detil idem Tabel 3; pertambahan tinggi tanaman saat 2 MSP merupakan selisih tinggi tanaman antara pengamatan 1 MSP dan 2 MSP
Tabel 4 menunjukkan perlakuan rizobakteri maupun metalaksil tidak berpengaruh secara nyata terhadap pertambahan tinggi tanaman cabai umur 2-4 MSP. Pertambahan tinggi tanaman saat 5 MSP pada perlakuan kontrol negatif (benih tanpa perlakuan dan tanah tidak diinokulasi P. capsici) dan metalaksil menunjukkan nilai yang sangat nyata lebih tinggi dibanding perlakuan lainnya. Perlakuan rizobakteri dengan pertambahan tinggi tanaman yang lebih rendah daripada perlakuan lainnya diduga karena fitohormon IAA yang dihasilkan oleh rizobakteri lebih banyak terkonsentrasi pada daerah pertumbuhan daun daripada daerah pertumbuhan tinggi tanaman. Menurut Darmawan dan Baharsjah (2010) penyebaran auksin yang tidak merata dapat mengakibatkan terjadinya perbedaan rangsangan perpanjangan sel. Harjadi (1996) juga menjelaskan bahwa dominansi pucuk (apical dominance) merupakan penghambatan oleh titik tumbuh pada pertumbuhan tunas-tunas dibawahnya yang merupakan fungsi dari distribusi auksin.
Benih dengan perlakuan rizobakteri CM8 yang diinokulasi P. capsici memiliki nilai pertambahan tinggi tanaman saat 6 MSP yang tidak berbeda nyata dengan kontrol negatif (benih tanpa perlakuan dan tanah tidak diinokulasi P.
capsici). Hal tersebut menunjukkan bahwa perlakuan benih dengan rizobakteri
CM8 mampu mempertahankan kemampuan tanaman cabai yang sakit untuk melakukan pertumbuhan sama dengan kemampuan pertumbuhan tanaman cabai yang sehat.
Pengamatan terhadap persentase kejadian penyakit dilakukan selama 28 hari sejak infestasi tanah inokulum P. capsici pada pangkal batang tanaman cabai. Gejala serangan P. capsici mulai terlihat 14 hari setelah infestasi (HSI). Persentase kejadian penyakit yang rendah disebabkan karena suhu rumah kaca yang tinggi selama percobaan, yakni mencapai 41-50 oC pada siang hari. Gambar 4 menunjukkan gejala serangan pada batang bagian bawah yang mengalami perubahan warna dari hijau menjadi cokelat, tanaman tersebut kemudian menjadi layu dan mati. Menurut Ibrahim et al. (2014), gejala serangan P. capsici berupa pangkal batang yang mengalami perubahan warna dari hijau menjadi cokelat kemudian seluruh bagian daun layu, tanaman mengering dan selanjutnya tanaman mati.
14
Gambar 4 Gejala serangan pada tanaman cabai: warna pangkal batang berubah dari hijau menjadi cokelat (A), tanaman layu (B), tanaman mengering dan mati (C) Tabel 5 Pengaruh perlakuan rizobakteri pada benih terhadap kejadian penyakit saat
28 hari setelah infestasi inokulum Phytophthora capsici ke tanah Perlakuan rizobakteri Kejadian penyakit (%)
14 HSI 21 HSI 28 HSI
ST116B 3 3 ab 3 bcc
CM8 0 7 ab 7 abc
CM8 + ST116B 3 3 ab 3 bcc
Metalaksil 0 10 aaa 10 abbb
Kontrol positif 3 13 aaa 17 aaaa
Kontrol negatif 0 0 bb 0 ccc
KK 244.95 72.63 74.96
F hitung 0.7013 0.0435 0.0420
Keterangan: detil idem Tabel 3; data pada tabel sebelum diolah ditransformasi dengan
rumus arcsin ; HSI = hari setelah infestasi
Perlakuan benih dengan rizobakteri terbukti mampu mengurangi tingkat serangan patogen P. capsici pada tanaman (Tabel 5). Saat 21 HSI, persentase kejadian penyakit pada benih yang mendapat perlakuan menunjukkan nilai yang lebih rendah dibandingkan tanaman cabai pada kontrol positif (tanpa perlakuan rizobakteri dan tanah diinokulasi P. capsici). Saat 28 HSI, persentase kejadian penyakit pada perlakuan rizobakteri juga menunjukkan nilai yang lebih rendah dibandingkan kontrol positif. Benih dengan perlakuan rizobakteri sebelum tanam terbukti mampu menurunkan persentase kejadian penyakit dan tumbuh sebagaimana tanaman sehat (kontrol negatif). Hal tersebut menunjukkan bahwa perlakuan rizobakteri berpengaruh terhadap pertumbuhan bibit dan menghambat serangan patogen P. capsici.
Penurunan kejadian penyakit pada perlakuan rizobateri diduga karena kemampuan rizobakteri dalam menghasilkan enzim ekstraselular, senyawa siderofor dan senyawa HCN. Penelitian Syamsuddin (2010) menyebutkan bahwa isolat rizobakteri yang didapat dari rizosfer tanaman cabai sehat mampu mensekresikan enzim ekstraselular serta memproduksi HCN dan siderofor sehingga mampu menghambat pertumbuhan patogen P. capsici. Enzim ekstraselular yang paling berperan ialah protease dan lipase.
Jika dibandingkan kontrol positif, perlakuan benih dengan metalaksil menunjukkan persentase kejadian penyakit busuk phytophthora yang tidak berbeda
15 nyata (Tabel 5). Perlakuan benih dengan rizobakteri terbukti mampu menurunkan persentase kejadian penyakit yang lebih baik dibandingkan perlakuan benih dengan metalaksil. Menurut Syamsuddin (2010) meskipun metalaksil merupakan fungisida yang bersifat sistemik, namun efek pengendalian metalaksil berdurasi singkat tidak seperti halnya efek pengendalian yang diberikan oleh agens biokontrol yang bersifat lama dan mampu menginduksi ketahanan tanaman secara sistemik serta secara tidak langsung juga berperan sebagai pemacu pertumbuhan.
Perlakuan metalaksil juga menunjukkan nilai yang tidak berbeda nyata dengan perlakuan rizobakteri (Tabel 5), namun jika ditinjau dari aspek keramahan terhadap lingkungan, penggunaan rizobakteri ini tentu lebih disarankan dibandingkan dengan penggunaan fungisida metalaksil. Rizobakteri ST116B dapat digunakan untuk melapisi benih karena kemampuannya dalam meningkatkan pertambahan jumlah daun dan mengurangi persentase kejadian penyakit busuk phytophthora di lapangan. Selain itu, karena perlakuan campuran rizobakteri ST116B + CM8 tidak berbeda nyata dengan ST116B, maka disarankan agar rizobakteri ST116B diaplikasikan secara tunggal.
KESIMPULAN DAN SARAN
KesimpulanTiga isolat rizobakteri baik yang dikombinasikan maupun yang tunggal secara in vitro mampu menghambat pertumbuhan patogen P. capsici. Persentase daya hambat tertinggi secara in vitro ditunjukkan oleh isolat rizobakteri CM8. Perlakuan CM8 nyata meningkatkan pertambahan jumlah daun dan pertambahan tinggi tanaman, namun tidak dapat menurunkan persentase kejadian penyakit secara nyata dibandingkan kontrol positif. Perlakuan ST116B dan kombinasi ST116B + CM8 nyata meningkatkan pertambahan jumlah daun dan menurunkan persentase kejadian penyakit busuk phytophthora dari 17% pada benih tanpa perlakuan yang diinfeksi penyakit hingga menjadi 3%. Tidak terdapat perbedaan nyata pengaruh rizobakteri yang diaplikasikan secara tunggal maupun kombinasi dua isolat rizobakteri.
Saran
Perlakuan benih sebelum tanam menggunakan rizobakteri ST116B disarankan untuk meningkatkan mutu benih cabai karena sifatnya yang ramah lingkungan dibandingkan dengan metalaksil.
DAFTAR PUSTAKA
Antoum H, Prevost D. 2006. Ecology of plant growth promoting rhizobacteria. In: Siddiqui, Z.A, editor. PGPR: Biocontrol and Biofertilization. Springer, Dordrecht, p. 1-38.
16
Babadoost M. 2001. Phytophthora blight of pepper. Department of Crop Science. University of Illinois, Urbana-Champaign.
Babadoost M. 2004. Phytophthora blight: a serious threat to cucurbit industries. American Phytopathological Society, St. Paul, MN.
Dardanelli MS, Carletti SM, Paulucci NS, Medeot DB, Caseres EAR, Vita FA, Bueno M, Fumero MF, Garcia MB. 2010. Plant Growth and Health Promoting Bacteria: Benefit of plant growth-promoting rhizobacteria and rhizobia in agriculture. Dinesh K. Maheswari, editor. Berlin: Springer. Darmawan J, Baharsjah JS. 2010. Dasar Dasar Fisiologi Tanaman. Jakarta (ID):
SITC.
Diby P, Saju KA, Jisha PJ, Sarma YR, Kumar A, Anandaraj M. 2005. Mycolytic enzymes produced by Pseudomonas fluoroscens and Trichoderma spp. against Phytophthora capsici, the foot rot pathogen of black pepper (Piper
nigrum L.). Annals of Microbiology. 55(2):129-133.
Granke LL, Ocampo LQ. 2012. Advances in research on Phytophthora capsici on vegetable crops in the United States. Plant Disease. 95(11):1588-1600. Harjadi SS. 1996. Pengantar Agronomi. Jakarta (ID): PT Gramedia.
Ibrahim A, Ilyas S, Manohara D. 2014. Perlakuan benih cabai (Capsicum annuum L.) dengan rizobakteri untuk mengendalikan Phytophthora capsici, meningkatkan vigor benih, dan pertumbuhan tanaman. Bul Agrohorti. 2(1):22-30.
Ilyas S. 2006. Seed treatments using matriconditioning to improve vegetable seed quality [ulas balik]. Bul Agron. 34(2):124-132.
Ilyas S. 2012. Ilmu dan Teknologi Benih: Teori dan Hasil-Hasil Penelitian. Bogor (ID): IPB Press.
Ilyas S, Asie KV, Sudarsono. 2014. Biomatriconditioning or biopriming with biofungicide or biological agent applied on hot pepper (Capsicum annuum L.) seeds reduced seedborne Colletotrichum capsici and increased seed quality and yield. Presented at the 29th International Horticultural Congress 2014. Brisbane, 17-22 August 2014.
Louws FJ, Holmes GJ, Ristaino JB. 2002. Phytophthora blight of pepper and cucurbits. Vegetable disease information Note 27. College of Agriculture and Life science, Plant Pathology Extension, North Carolina State University: p:14.
Manohara D. 1988. Ekologi Phytophthora palmivora (Bulter), Penyebab Penyakit Busuk Pangkal Batang Lada (Piper nigrum L.) [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Manohara D, Wahyuno D, Noveriza R. 2005. Penyakit busuk pangkal batang lada dan strategi pengendaliannya. Edsus Balittro. 17:41-51.
McMillan S. 2007. Promoting growth with PGPR. Soil Foodweb. Canada Ltd. Soil Biology Laboratory and Learning Center.
Miller SA, Randall CR, Richard MR. 1996. Phytophthora blight of pepper and cucurbits HYG-3116-96. Plant Pathology. The Ohio State University Extension, 2021 Coffey Road, Columbus, OH 43210-1087.
Roberts PD, McGovern RJ, Kucharek TA, Mitchell DJ. 2000. Vegetable diseases caused by Phytophthora capsici in Florida. Plant Pathology Department, University of Florida, Gainesville.
17 Soemarmo. 2010. Ekologi Tanah.Bahan kajian MK. Manajemen Agroekosistem FPUB [internet]. Juni 2010: [diunduh 2015 Agustus 7]. Tersedia pada: marno.lecture.ub.ac.id/files/2012/01/EKOLOGI-TANAH.doc.
Soesanto L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Jakarta (ID): PT Raja Grafindo Persada.
Sutariati GAK, Widodo, Sudarsono, Ilyas S. 2006a. Karakter fisiologis dan keefektifan isolat rizobakteri sebagai agens antagonis Colletotrichum
capsici dan rizobakteri pemacu pertumbuhan tanaman cabai. Jurnal Ilmiah Pertanian KULTURA. 41(1):28-34.
Sutariati GAK, Widodo, Sudarsono, Ilyas S. 2006b. Pengaruh perlakuan rizo-bakteri pemacu pertumbuhan tanaman terhadap viabilitas benih serta pertumbuhan bibit tanaman cabai. Bul Agron. 34(1):46-54.
Syamsuddin. 2010. Perlakuan benih untuk pengendalian penyakit busuk phytophthora, peningkatan hasil dan mutu benih cabai merah (Capsicum
annuum L) [disertasi]. Bogor (ID). Institut Pertanian Bogor.
Syamsuddin, Ulim MA. 2013. Daya hambat rizobakteri kandidat agens biokontrol terhadap pertumbuhan koloni patogen Phytophthora capsici secara in vitro.
J Floratek. 8:64-72.
Tenuta M. 2004. Plant growth promoting rhizobacteria: prospects for increasing nutrient acquisition and disease control [internet]. Department of Soil Science, University of Manitoba. [diunduh 2015 Maret 28]. Tersedia pada: http://www.umanitoba.ca/faculties/afs/MAC_proceedings/2003/pdf/tenuta_ rhizo bacteria.pdf.
Ucida JY. 2005. Master knowledge: Phytophthora capsici. [Internet]. [diakses 2014 Januari 24]. Tersedia pada: http://www.extento.hawaii.eu.
Wiyono S. 2011. Liputan khusus: kendalikan hama dan penyakit, harga cabai terkendali. Tabloid Agrina [internet]. 17 Januari 2011; [diunduh 2015 April 3]. Tersedia pada: http://www.agrina-online.com/redesign2.php?rid=19&ai d=2813.
Widajati E, Murniati E, Palupi ER, Kartika T, Suhartanto MR, Qadir A. 2013.
Dasar Ilmu dan Teknologi Benih. Bogor [ID]: IPB Press.
Yunianti R, Sastrosumarjo S, Sujiprihati S, Surahman M, Hidayat SH. 2007. Ketahanan 22 genotipe cabai (Capsicum spp.) terhadap Phytophthora
capsici Leonian dan keragaman genetiknya. Bul Agron. (35) (2) 103 – 111.
Zitter TA. 1989. Phytophthora blight of cucurbits, pepper, tomato, and egg plant. Departement of Plant Pathology. New York (US). Cornell University Ithaca.
19
RIWAYAT HIDUP
Penulis dilahirkan di Kediri, Jawa Timur pada tanggal 15 Januari 1992. Penulis merupakan putri ketiga dari empat bersaudara pasangan Rosyidin dan Siti Jariyah. Penulis lulus dari MTs Taufiqiyatul Asna di Kediri pada tahun 2007 dan melanjutkan pendidikan di MAN 3 Kediri. Tahun 2010 penulis lulus dari MAN 3 Kediri kemudian diterima di program S1 Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur SNMPTN (Seleksi Nasional Masuk Perguruan Tinggi Negeri).
Selama mengikuti perkuliahan, penulis aktif dalam beberapa organisasi kemahasiswaan dan kepantiaan. Tahun 2011-2012, penulis merupakan sekretaris departemen tahfidz Lembaga Pengajaran Qur’an (LPQ) Al-Hurriyyah sekaligus menjadi staf departemen PSDM Badan Eksekutif Mahasiswa (BEM) Fakultas Pertanian. Tahun 2012-2013, penulis merupakan bendahara LPQ Al-Hurriyyah. Tahun 2013-2014, penulis merupakan staf departemen PSDM Lembaga Dakwah Kampus (LDK) Al-Hurriyyah. Selain itu, penulis juga aktif menjadi pengajar
tahsin (bina baca Al-Qur’an) di LPQ Al-Hurriyyah dari tahun 2011-2015.
Beberapa kepanitiaan yang pernah penulis ikuti di antaranya yakni anggota divisi Humas Open House IPB 2011, penanggung jawab administrasi dan keuangan seleksi Beastudi Etos Bogor tahun 2011-2012, dan sekretaris divisi acara Festival Anak Sholeh (FAS) 5 tahun 2013.