METODE CEPAT KUANTIFIKASI TERFENADIN DALAM
SEDIAAN FARMASI SECARA
SPEKTROFOTOMETRI DERIVATIF ULTRAVIOLET
NOVIE YANTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2006
ABSTRAK
NOVIE YANTI. Metode Cepat Kuantifikasi Terfenadin dalam Sediaan Farmasi secara Spektrofotometri Derivatif UV. Dibimbing oleh TUTI SETIAWATI dan MOHAMAD RAFI.
Terfenadin ialah antihistamin dengan efektivitas tinggi yang telah digunakan secara luas untuk mengatasi alergi. Metode cepat dan dapat dipercaya untuk menentukan terfenadin sangat dibutuhkan dalam mendukung kontrol mutu obat. Metode spektrofotometri derivatif ultraviolet (UV) turunan pertama telah dikembangkan untuk menentukan terfenadin dalam sediaan farmasi dan dibandingkan dengan kromatografi cair kinerja tinggi (KCKT).
Kuantifikasi terfenadin secara spektrofotometri derivatif UV (SDUV) dilakukan berdasarkan pengukuran amplitudo puncak ke garis dasar pada panjang gelombang 225.2 nm. Hasil analisis terfenadin secara SDUV pada Terfin® dan Rhinofed® menunjukkan kadar berturut-turut sebesar 60.14 mg/tablet dan 39.90 mg/tablet. Hasil analisis terfenadin secara KCKT pada Terfin® dan Rhinofed® menunjukkan kadar berturut-turut 70.79 mg/tablet dan 47.49 mg/tablet. Analisis secara statistik dengan menggunakan uji t-student dan F menunjukkan perbedaan yang nyata pada tingkat kepercayaan 95% di antara hasil analisis kedua metode. Uji linearitas pada metode SDUV menghasilkan koefisien korelasi (r) sebesar 0.9994 pada kisaran 2-10 ppm. Nilai simpangan baku relatif adalah 4.79% untuk tablet Terfin® dan 7.94% untuk tablet Rhinofed®. Nilai perolehan kembali berdasarkan metode penambahan standar adalah 81.30-110.30%, limit deteksi 1.31 ppm, dan limit kuantitasi 3.98 ppm.
ABSTRACT
NOVIE YANTI. A Rapid Method for the Quantification of Terfenadine in Pharmaceutical Dosage Form by Ultraviolet Derivative Spectrophotometry. Supervised by TUTI SETIAWATI and MOHAMAD RAFI.
Terfenadine, a high effective antihistamine, has been widely used for allergy treatment. A fast and reliable method for the determination of terfenadine is highly desirable to support its quality control. A first derivative ultraviolet (UV) spectrophotometry method was developed for terfenadine determination in the pharmaceutical dosage form and was compared with high performance liquid chromatography (HPLC).
Terfenadine quantification using ultraviolet derivative spectrophotometry (UVDS) method was based on the measurement of peak to baseline amplitude at wavelength of 225.2 nm. Terfenadine analysis using UVDS method on Terfin® and Rhinofed® showed the concentration of 60.14 mg/tablet and 39.90 mg/tablet, respectively. Terfenadine analysis using HPLC method on Terfin® and Rhinofed® showed the concentration of 70.97 mg/tablet and 47.49 mg/tablet, respectively. Statistical analysis by t-student and F test at 95% confidence level showed a significant difference between the results of the two methods. The linearity test of the UVDS method presented a correlation coefficient (r) of 0.9994 in the range of 2–10 ppm. Relative standard deviation were 4.79% for Terfin® and 7.94% for Rhinofed®. Recovery was 81.30–110.30% according to standard addition method, the limit of detection was 1.31 ppm, and the limit of quantification was 3.98 ppm.
METODE CEPAT KUANTIFIKASI TERFENADIN DALAM
SEDIAAN FARMASI SECARA
SPEKTROFOTOMETRI DERIVATIF ULTRAVIOLET
NOVIE YANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2006
Judul : Metode Cepat Kuantifikasi Terfenadin dalam Sediaan Farmasi secara Spektrofotometri Derivatif Ultraviolet
Nama : Novie Yanti
NIM : G44201026
Disetujui :
Pembimbing I,
Dra. Tuti Setiawati S, MS NIP 132053496
Pembimbing II,
Mohamad Rafi, SSi
Mengetahui :
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, MS NIP 131473999
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Karya ilmiah yang berjudul Metode Cepat Kuantifikasi Terfenadin dalam Sediaan Farmasi secara Spektrofotometri Derivatif UV disusun berdasarkan penelitian yang dilakukan oleh penulis di Laboratorium Kimia Analitik, Departemen Kimia, dan Lembaga Penelitian dan Pengabdian Masyarakat Pusat Studi Biofarmaka IPB.
Terima kasih penulis ucapkan kepada Ibu Tuti Setiawati dan Bapak Mohamad Rafi sebagai pembimbing atas arahan, saran, dan dorongan semangat yang telah diberikan kepada penulis dalam pelaksanaan penelitian dan penulisan skripsi. Terima kasih disampaikan pula kepada Hibah Penelitian A2 dari Program Hibah Kompetisi A2 Departemen Kimia, Institut Pertanian Bogor yang telah mendanai penelitian ini. Ungkapan terima kasih juga disampaikan kepada Papa, Mama, serta seluruh keluarga atas segala doa dan kasih sayangnya. Terima kasih juga disampaikan kepada Bapak Eman, semua laboran Laboratorium Kimia Analitik, staf Pusat Studi Biofarmaka, Mas Heri, Ka Atep, Pak Herry, rekan Kimia 38, tim derivatif, sahabat-sahabat terbaikku Indah dan Inul, serta Abang Mei atas kasih sayang, doa, dan dorongan semangat yang tiada henti.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Januari 2006
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 5 November 1983 dari ayah Suryadi dan ibu Turwasih. Penulis merupakan putri kedua dari lima bersaudara.
Tahun 2001 penulis lulus dari SMU Negeri 3 Bogor dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum mata kuliah Kimia Dasar 1 pada tahun ajaran 2003/2004, Kimia Analitik untuk Program Studi Biokimia dan Teknologi Pangan dan Gizi pada tahun ajaran 2004/2005, serta Elektroanalitik untuk Program Studi D3 Analisis Kimia pada tahun ajaran 2004/2005. Penulis aktif sebagai Kepala Departemen Chemistry English Club dalam kepengurusan Ikatan Mahasiswa Kimia periode 2002-2003. Pada bulan Juni 2004 penulis melaksanakan Praktik Lapangan di PT ISM Bogasari Flour Mills dan menulis Laporan Ilmiah dengan judul Analisis Protein dan Gluten serta Kaitannya dengan Sifat Reologi pada Tepung Terigu.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vii
DAFTAR TABEL... viii
DAFTAR LAMPIRAN... ix PENDAHULUAN ... 1 TINJAUAN PUSTAKA Terfenadin………... 1 Sediaan farmasi……… 2 Spektrofotometri……….. 2
Spektrofotometri derivatif ultraviolet……….………. 2
Kromatografi cair kinerja tinggi……….. 3
Pengembangan dan validasi metode analisis……….….. 4
Parameter-parameter validasi……….. 4
BAHAN DAN METODE Bahan dan Alat………..….. .. 5
Metode Penelitian……….……... 5
HASIL DAN PEMBAHASAN Spektrofotometri derivatif ultraviolet………...………. 6
Kromatografi cair kinerja tinggi……….… 8
Validasi metode………... 9
SIMPULAN DAN SARAN Simpulan……….. 10
Saran……… 10
DAFTAR PUSTAKA ... 10
DAFTAR GAMBAR
Halaman
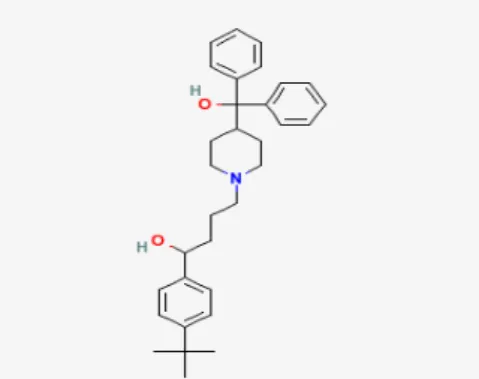
1 Struktur kimia terfenadin... 1
2 Spektrum turunan dari serapan Pita Gauss... 3
3 Spektrum serapan standar dan obat terfenadin ... 6
4 Spektrum turunan pertama standar dan obat terfenadin ... 6
5 Kurva standar terfenadin... 8
6 Kurva larutan standar terfenadin pada analisis KCKT ... 8
7 Kurva standar terfenadin pada penentuan linearitas ... 9
DAFTAR TABEL
Halaman 1 Kondisi optimum pada penentuan terfenadin secara spektrofotometri derivatif ultraviolet... 72 Waktu retensi dan luas puncak pada analisis KCKT ... 8
3 Kadar terfenadin dalam obat pada analisis KCKT... 9
4 Hasil uji t-student dan F... 9
5 Parameter statistika kurva standar pada penentuan linearitas ... 10
6 Kadar terfenadin dalam obat pada analisis spektrofotometri derivatif ultraviolet ... 10
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 13
2 Penentuan kadar terfenadin secara KCKT ... 14
3 Spektrum serapan pada kecepatan penyapuan a. 100 nm/menit; b. 200 nm/menit; c. 400 nm/menit; d. 800 nm/menit; e. 1200 nm/menit ... 15
4 Spektrum serapan larutan standar 2-10 ppm pada contoh sediaan farmasi pada ulangan a. 1; b. 2; c. 3; d. 4; e. 5; f. 6 ... 17
5 Spektrum larutan standar 2-10 ppm dan contoh sediaan farmasi pada kondisi optimum ulangan a. 1; b. 2; c. 3; d. 4; e. 5; f. 6 ... 19
6 Amplitudo standar pada analisis terfenadin secara spektrofotometri derivatif ultraviolet... 21
7 Persamaan kurva standar pada analisis terfenadin secara spektrofotometri derivatif ultraviolet... 22
8 Penentuan kadar terfenadin secara spektrofotometri derivatif ultraviolet ... 23
9 Uji F dan t-student ... 24
10 Kromatogram standar terfenadin pada konsentrasi a. 300 ppm; b. 600 ppm; c. 900 ppm ... 25
11 Kromatogram contoh Terfin® 600 ppm pada ulangan a. 1; b. 2; c. 3 ... 26
12 Kromatogram contoh Rhinofed® 600 ppm pada ulangan a. 1; b. 2; c. 3 ... 27
13 Penentuan linearitas ... 28
14 Penentuan simpangan baku relatif ... 29
15 Penentuan akurasi ... 30
PENDAHULUAN
Kesehatan merupakan salah satu kebutuhan pokok manusia yang berpengaruh pada kualitas dan produktivitas sumber daya manusia dalam rangka memperoleh kesejahteraan hidup. Untuk memperoleh kesehatan yang optimal bagi masyarakat, diselenggarakan berbagai upaya kesehatan secara menyeluruh, terpadu,dan berkesinam-bungan. Penyediaan obat-obatan yang bermutu tinggi dengan harga yang terjangkau oleh masyarakat luas merupakan salah satu upaya yang dilakukan pemerintah untuk meningkatkan derajat kesehatan masyarakat. Melihat banyaknya obat-obatan yang beredar di pasaran, maka jenis dan kadar zat aktif perlu diketahui agar kualitas, khasiat, dan keamanannya terjamin saat dikonsumsi oleh masyarakat.
Terfenadin merupakan zat antihistamin yang digunakan secara luas oleh masyarakat untuk mengatasi alergi. Umumnya penentuan kuantitatif senyawa ini menggunakan metode yang cukup rumit. Hal ini tentu saja akan memperbesar biaya yang harus dikeluarkan. Oleh karena itu, dibutuhkan pengembangan metode baru yang cepat, mudah, dan selektif sehingga dapat mereduksi biaya yang harus dikeluarkan.
Beberapa teknik analisis telah digunakan untuk penentuan terfenadin dan kontrol mutu dari produk yang mengandung senyawa tersebut. Beberapa metode yang telah digunakan untuk analisis terfenadin antara lain KCKT (Coutant et al. 1991), spektrofotometri (Kelani et al. 1999), dan voltametri (Ghoneim et al. 2001). Metode yang sering digunakan adalah kromatografi cair kinerja tinggi. Teknik kromatografi menggunakan peralatan yang mahal dan banyak bahan kimia. Spektrofotometri merupakan teknik yang cepat dan sederhana untuk penentuan senyawa kimia akan tetapi teknik ini memiliki kelemahan, yaitu tidak dapat digunakan dalam contoh dengan matriks yang kompleks, sedangkan biasanya obat-obatan terdiri atas campuran beberapa zat yang mempunyai sifat penyembuhan atau pencegahan suatu penyakit (Purwanto 2002). Teknik spektrofotometri ultraviolet (UV)-tampak (Vis) seringkali membutuhkan tahap pemisahan awal untuk menghilangkan senyawa pengganggu yang mungkin terdapat dalam contoh.
Teknik spektrofotometri derivatif UV yang merupakan perkembangan dari teknik spektrofotometri UV konvensional dapat
digunakan untuk penentuan kuantitatif senyawa kimia dengan matriks yang kompleks. Metode ini memiliki beberapa kelebihan, yaitu dapat meningkatkan perbeda-an diperbeda-antara spektrum sehingga meningkatkperbeda-an resolusi dari spektrum yang tumpang tindih, mengurangi efek gangguan dari penghambur-an, matriks dan serapan senyawa lain dalam analisis kuantitatif (Owen 1996). Teknik ini telah diuji coba terhadap tablet Terfin® dan Rhinofed® yang mengandung terfenadin 60 mg/tablet dan 40 mg/tablet.
Penelitian ini bertujuan menentukan kadar terfenadin dalam sediaan farmasi, dan dibandingkan dengan metode KCKT, melakukan proses validasi untuk melihat ketelitian dan keakuratannya, serta mengembangkan metode analisis cepat, mudah dan murah untuk analisis kuantitatif terfenadin secara spektrofotometri derivatif UV.
TINJAUAN PUSTAKA
Terfenadin
Terfenadin merupakan zat antihistamin yang digunakan sebagai obat untuk mengatasi alergi. Rumus kimia dari zat ini adalah C32H41NO2, sedangkan bobot molekulnya sebesar 471.673 g/mol. Zat ini berbentuk serbuk berwarna putih, larut dalam etanol, dan sulit larut dalam air.
Gambar 1 Struktur kimia terfenadin. Terfenadin dapat mengobati alergi dengan memblokade kerja histamin, yaitu senyawa kimia yang dilepaskan oleh tubuh selama alergi. Sediaan farmasi yang digunakan dalam penelitian berbentuk tablet. Umumnya tablet terfenadin mengandung laktosa dan pati.Efek dapat terjadi bila meng-konsumsi terfenadin antara lain sakit kepala,
diare, gangguan penglihatan, denyut jantung yang tidak normal, dan gangguan hati.
Dosis pemberian obat yang mengandung terfenadin tidak sama untuk semua pasien. Sebelum mengkonsumsinya ada beberapa hal yang perlu diperhatikan seperti usia, obat-obatan lain, dan masalah kesehatan.
Sediaan Farmasi
Obat merupakan senyawa yang memiliki komponen aktif. Penggunaan obat yang diberikan dalam jumlah yang berlebihan atau tidak sesuai dengan dosis, maka hal tersebut dapat membahayakan penderita. Efektivitas obat tergantung terhadap pengaturan dosis dan bentuk sediaan.
Bentuk sediaan antara lain tablet, kapsul, inhalasi, infus, dan salep (Ansel 1989). Tablet adalah bentuk sediaan padat yang dibuat dengan cara dicetak dan mengandung zat obat dengan atau tanpa pengencer yang cocok, zat penghancur, zat penyalut, zat pemberi warna, dan zat pembantu lainnya. Kapsul merupakan sediaan padat dimana zat obat dan bahan bahan farmasi yang layak sebagai pengisi ditempatkan dalam suatu “kulit” yang keras atau lunak. Inhalasi adalah sediaan obat dalam bentuk larutan yang terdiri atas satu atau lebih bahan obat yang diberikan melalui saluran nafas hidung atau mulut untuk memperoleh efek lokal atau sistemik. Infus adalah sediaan cair yang dibuat dengan mengekstraksi simplisia nabati dengan air pada suhu 90 ºC selama 15 menit, sedangkan salep adalah sediaan setengah padat yang ditujukan untuk pemakaian topikal pada kulit atau selaput lendir.
Spektrofotometri
Spektrofotometri merupakan suatu metode analisis berdasarkan interaksi antara radiasi elektromagnetik dan materi. Berdasar-kan panjang gelombang yang digunaBerdasar-kan, spektrofotometri dibedakan menjadi spektro-fotometri ultraviolet (UV), tampak (Vis), infra merah dan lain-lain. Teknik spektrofotometri UV dan Vis terutama digunakan untuk penentuan kuantitatif komponen dengan konsentrasi rendah, selain itu teknik ini juga dapat digunakan untuk analisis kualitatif.
Penyerapan sinar tampak atau ultraviolet oleh suatu molekul akan menghasilkan transisi tingkat energi elektronik molekul tersebut (Sudjadi 1983). Transisi elektronik pada umumnya terjadi antara orbital ikatan atau orbital pasangan bebas dan orbital bukan
ikatan atau orbital anti ikatan. Jika suatu molekul menyerap cahaya pada daerah UV dan Vis, elektron valensi atau elektron ikatan berpindah ke tingkat energi yang lebih tinggi. Penyerapan radiasi dapat dihubungkan dengan kandungan analit dalam contoh. Dua hukum empiris telah merumuskan tentang intensitas serapan. Hukum Lambert menyatakan bahwa fraksi penyerapan sinar tidak tergantung dari intensitas sumber cahaya. Hukum Beer menyatakan bahwa penyerapan sebanding dengan molekul yang menyerap. Dari hukum Lambert-Beer dapat diketahui hubungan antara transmitans, tebal cuplikan dan konsentrasi. Hubungan ini dinyatakan sebagai berikut:
Log I/I0 = εbc = A Keterangan:
I0 = intensitas berkas cahaya rujukan I = intensitas berkas cahaya contoh ε = tetapan karakteristik
c = konsentrasi b = tebal sel A = serapan
Spektrofotometer adalah suatu instrumen yang digunakan untuk mengukur transmitan atau serapan dari suatu contoh. Komponen-komponen penting yang terdapat pada spektrofotometer adalah (1) sumber energi cahaya, (2) monokromator yaitu piranti untuk memencilkan pita sempit panjang gelombang dari spektrum lebar yang dirancang oleh sumber cahaya, (3) wadah untuk tempat contoh, (4) detektor yang mengubah energi cahaya menjadi suatu sinyal listrik, (5) amplifier atau penguat sinyal yang sampai ke detektor (6) suatu piranti baca yang memperlihatkan besarnya sinyal listrik.
Spektrofotometri Derivatif Ultraviolet
Spektrofotometri derivatif ultraviolet (UV) merupakan perkembangan dari spektrofoto-metri UV konvensional. Teknik ini memiliki beberapa kelebihan antara lain dapat memilih puncak yang tajam diantara spektrum yang lebar, meningkatkan resolusi dari spektrum yang tumpang tindih, mereduksi pengaruh dari gangguan-gangguan seperti penghambur-an, matriks atau serapan senyawa lain (Owen 1996). Spektrum terdiri atas suatu seri puncak atau garis. Setiap puncak diperoleh dari serapan karakteristik atau karakteristik senyawa. Dalam kebanyakan kasus, puncak serapan terdistorsi karena berbagai alasan diantaranya noise dan tumpang tindih diantara puncak yang bersebelahan. Hal ini biasanya terjadi bila contoh yang digunakan memiliki
matriks yang kompleks, sehingga penentuan secara kuantitatif untuk contoh seperti ini sulit dilakukan. Masalah tersebut dapat diatasi dengan menggunakan metode spektrofoto-metri derivatif UV. Teknik ini merupakan kombinasi spektrofotometri UV dan analisis data kimia. Kombinasi dari dua metode ini menghasilkan suatu metode analisis penentu-an kadar zat dengpenentu-an ketelitipenentu-an dpenentu-an keakuratpenentu-an cukup tinggi. Dalam metode ini dilakukan derivatisasi spektrum. Penurunan spektrum di-lakukan dengan menggunakan fungsi matematika yaitu dengan memplot slope/gradient dari serapan dengan nilai panjang gelombang (Skujins 1986). Rumus yang digunakan adalah sebagai berikut: Spektrum awal A = εbc Turunan pertama dA = dε bc dλ dλ Turunan ke-n dnA = dnε bc dλn dλn
Spektrum turunan lebih kompleks dibandingkan spektrum aslinya seperti ditunjukkan pada Gambar 2 (Owen 1996). A A λ λ dA d2A dλ dλ2 λ λ d3A d4A dλ3 dλ4 λ λ
Gambar 2 Spektrum turunan dari serapan
KCKT merupakan salah satu contoh kromatografi cair. Keuntungan menggunakan KCKT antara lain jumlah sampel yang diperlukan sedikit, menghasilkan pemisahan yang sangat cepat, sensitif, akurat, zat-zat yang tidak mudah menguap atau tidak tahan panas dapat dipisahkan tanpa peruraian atau tanpa perlunya membuat turunan yang dapat menguap dan batas deteksinya sampai nanogram perliter. Akan tetapi teknik ini memiliki beberapa kekurangan antara lain menggunakan peralatan yang mahal dan menggunakan banyak bahan kimia. Tiga bentuk kromatografi cair kinerja tinggi yang paling banyak digunakan adalah penukar ion, partisi dan adsorpsi. Dalam analisis obat-obatan, pemisahan dilakukan dengan partisi senyawa dalam larutan uji antara fase gerak dan fase diam (Farmakope Indonesia 1995). Pita Gauss.
Analisis kuantitatif dilakukan dengan pengukuran antara amplitudo terhadap konsentrasi. Penentuan secara kuantitatif dari satu atau beberapa senyawa mematuhi hukum Lambert-Beer pada spektrum serapan (zero order), yaitu konsentrasi analit berhubungan secara linier dengan serapan pada panjang gelombang tertentu. Dalam spektrofotometri derivatif UV, hukum Lambert-Beer
menyatakan bahwa konsentrasi analit berhubungan secara linier terhadap amplitudo pada panjang gelombang tertentu. Dalam spektrofotometri derivatif UV dikenal tiga macam amplitudo, yaitu Dz (amplitudo yang
diukur dari garis nol), DS (amplitudo yang
diukur pada panjang gelombang pendek, DL (amplitudo yang diukur pada panjang gelombang panjang).
Spektrofotometri derivatif UV telah banyak digunakan untuk analisis senyawa baik satu ataupun multikomponen dan golongan senyawa seperti: vitamin C (Aydogmus & Cetin 2002), kafein (Alpdogan et al. 2002), flavonoid total (Rolim et al. 2005, siap terbit), antosianida dan β karoten (Souri et al. 2005), dan vitamin C dan asam salisilat (Dinc et al. 2005). Beberapa tahun belakangan ini penggunaan teknik spektrofotometri derivatif UV lebih praktis karena dapat dihubungkan dengan komputer dengan penggunaan perangkat lunak yang sesuai (El-Sayed & El-Salem 2005).
Kromatografi Cair Kinerja Tinggi
Kromatografi adalah metode pemisahan dimana komponen-komponen yang akan dipisahkan didistribusikan diantara dua fase, salah satunya merupakan fase diam dengan permukaan luas dan fase lain berupa zat alir yang mengalir lambat menembus atau sepanjang fase diam. Berdasarkan jenis fase gerak yang digunakan, kromatografi dibagi menjadi dua, yaitu kromatografi gas dan kromatografi cair.
Instrumen dasar KCKT terdiri atas reservoir yang berisi fase gerak, pompa untuk mendorong fase gerak melalui sistem pada
tekanan tinggi, prakolom, injektor untuk memasukkan contoh ke dalam fase gerak, kolom kromatografi, detektor, penguat sinyal dan perekam. Kolom merupakan tempat berlangsungnya pemisahan komponen cam-puran. Pemisahan yang hanya menggunakan pelarut tunggal dengan komposisi tetap disebut elusi isokratik. Sedangkan jika menggunakan dua atau lebih sistem pelarut dengan polaritas yang berbeda disebut elusi gradien. Perekam yaitu alat untuk mencetak hasil percobaan pada lembaran kertas yang berupa kumpulan puncak yang disebut kromatogram (Hendayana et al. 1994).
Pengembangan dan Validasi Metode Analisis
Validasi metode analisis adalah proses untuk menunjukkan bahwa prosedur analisis sesuai dengan tujuan yang diharapkan. Menurut Garfield (1992) validasi metode merupakan proses penetapan dan evaluasi unjuk kerja sebuah metode analisis sesuai cara-cara yang ditentukan oleh konsensus bersama organisasi internasional. Validasi metode biasanya dilakukan jika prosedur akan digunakan secara rutin untuk analisis contoh tertentu, ketika kondisi analisis telah berubah dari kondisi metode yang telah divalidasi, validasi juga perlu dilakukan jika metode yang digunakan telah berubah dari metode standar.
Metode yang memerlukan validasi antara lain metode yang baru dikembangkan untuk suatu permasalahan yang khusus, metode standar yang dimodifikasi untuk penggunaan lain, metode yang digunakan di laboratorium lain, analis lain, atau menggunakan instrumen yang lain dan metode yang unjuk kerjanya dibandingkan dengan metode standar yang sudah divalidasi atau sudah diketahui kemampuan maupun keterbatasannya.
Pengembangan metode uji biasanya didasarkan pada pengalaman sebelumnya atau literatur yang ada, menggunakan peralatan yang sama atau hampir sama. Pengembangan metode dapat dilakukan dengan beberapa cara, yaitu menggunakan metode yang sudah ada dengan membuat perubahan-perubahan kecil sehingga sesuai dengan aplikasinya atau menggunakan metode yang benar-benar baru.
Tujuan dari proses validasi adalah (1) untuk menjamin prosedur analisis yang akurat, (2) untuk menekan sekecil mungkin resiko penyimpangan yang timbul, jika prosedur yang lazim digunakan dibandingkan dengan prosedur yang sudah divalidasi (3)
untuk menjamin kedapatulangan selama proses produksi.
Parameter-Parameter Validasi
Validasi metode memiliki beberapa parameter penting. Parameter-parameter tersebut meliputi linearitas, presisi, akurasi, limit deteksi, dan limit kuantitasisi.
Linearitas
Linearitas adalah kemampuan metode analisis untuk mendapatkan hasil uji yang proporsional terhadap konsentrasi analit. Linearitas diukur dengan menghitung koefisien korelasi (r) yang didapat dari kurva hubungan antara kadar analit dengan respon detektor. Koefisien korelasi adalah kemampuan dari metode analisis untuk menghasilkan angka analisis yang proporsional terhadap konsentrasi analit dalam contoh pada interval konsentrasi tertentu.
Presisi
Presisi merupakan suatu ukuran kedekatan suatu hasil pengukuran yang satu dengan yang lainnya (SAC-SINGLAS 2002). Terdapat dua jenis presisi, yaitu keterulangan dan ketertiru-an. Keterulangan adalah presisi yang diperoleh dari hasil pengulangan dengan menggunakan metode, operator, peralat-an, laboratorium dan waktu yang sama, sedangkan ketertiruan adalah presisi yang dihitung dari hasil penetapan ulangan dengan menggunakan metode yang sama, namun dilakukan oleh operator, peralatan, laboratorium yang berbeda (Hidayat 1989). Presisi dinyatakan dalam persen simpangan baku relatif (%SBR). Rumus simpangan baku relatif adalah sebagai berikut:
σ = {Σi[XI-X]2}1/2 (n-1)1/2 SBR = σ x 100% rata-rata Keterangan : σ : simpangan baku
Xi : kadar zat aktif pada setiap pengulangan X : kadar zat aktif rata-rata
n : jumlah pengulangan
Akurasi
Akurasi adalah perbedaan antara rata-rata hasil dengan nilai absolut dari contoh yang dianalisis. Parameter yang digunakan dalam penentuan akurasi adalah perolehan kembali (recovery). Perolehan kembali adalah angka yang menunjukkan besarnya penambahan
standar yang mampu diidentifikasi kembali dengan suatu metode. Rumus perolehan kembali adalah sebagai berikut:
Perolehan kembali : C1-C2 x 100% C3 Keterangan:
C1 : konsentrasi analit dalam campuran contoh ditambah sejumlah tertentu analit.
C2 : :konsentrasi analit dalam contoh. C3 : konsentrasi analit yang ditambahkan ke
dalam contoh.
Limit deteksi (LOD)
Limit deteksi adalah konsentrasi terendah yang dapat ditentukan tetapi tidak perlu dikuantitasi di bawah kondisi uji yang tetap. Apabila nilai konsentrasi analit berada di bawah limit deteksi suatu metode, maka keberadaannya dapat menjadi tidak terdeteksi atau data konsentrasi yang diperoleh dapat menjadi tidak sesuai dengan kenyataan. Rumus perhitungan limit deteksi berdasarkan ICH (1996) adalah sebagai berikut:
Limit deteksi = 3.3 x σ s Keterangan:
σ : simpangan baku intersep dari kurva standar
s : kemiringan kurva atandar
Limit kuantitasi (LOQ)
Limit kuantitasi adalah jumlah terendah analit dalam contoh yang secara kuantitatif dapat ditetapkan dengan ketelitian dan ketepatan yang sesuai dibawah kondisi tes yang tetap. Rumus perhitungan limit kuantitasi berdasarkan ICH (1996) adalah sebagai berikut:
Limit kuantitasi = 10 x σ s Keterangan:
σ : simpangan baku intersep dari kurva standar
s : kemiringan kurva atandar
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah tablet Terfin®, Rhinofed®, standar terfenadin, etanol, air bebas ion, metanol, trietilamin, dan asam fosfat. Alat-alat yang digunakan adalah spektrofotometer UV-Vis Hitachi U 2800 dengan lebar celah 1.5 nm, sumber cahaya deuterium, kuvet kuarsa berukuran 1 cm, piranti lunak UV solutions versi 2.0 keluaran Hitachi, labu takar, mortar, kertas saring, gelas pengaduk, KCKT Thermofiniggan yang dilengkapi dengan detektor UV (235 nm) dan kolom Chromosorb C-8, pH meter, pipet tetes, pipet volumetrik dan penyaring vakum.
Metode Penelitian
Preparasi Standar Terfenadin dan
Contoh Sediaan Farmasi. Larutan stok
standar terfenadin 100 ppm disiapkan dengan melarutkan 0.01 g standar dalam 100 ml etanol pada labu takar. Contoh sediaan farmasi masing-masing sebanyak sepuluh tablet digerus. Tablet Terfin® dan Rhinofed® ditimbang berturut-turut 0.0164 g dan 0.0142 g, lalu dilarutkan dengan etanol dan distirer selama satu jam, kemudian ditera ke dalam labu takar 50 ml sehingga diperoleh larutan dengan konsentrasi setara terfenadin 50 ppm.
Penentuan Kecepatan Penyapuan.
Larutan standar dan contoh dengan konsentrasi 50 ppm diukur menggunakan spektrofotometer dengan kecepatan penyapu-an 100 nm/menit, 200 nm/menit, 400 nm/menit, 800 nm/menit, dan 1200 nm/menit.
Pengukuran Standar (Kurva Standar) dan Contoh. Larutan stok standar terfenadin
100 ppm diencerkan dengan konsentrasi 2 ppm, 4 ppm, 6 ppm, 8 ppm, 10 ppm, lalu dianalisis menggunakan spektrofotometer untuk mendapatkan kisaran konsentrasi standar dengan linearitas terbaik. Contoh sediaan farmasi dianalisis menggunakan spektrofotometer dengan konsentrasi setara terfenadin 5 ppm. Analisis dilakukan sebanyak 6 kali ulangan.
Uji Presisi. Contoh dengan konsentrasi
setara terfenadin 5 ppm diukur masing-masing sebanyak 6 kali ulangan pada hari yang sama.
Uji Akurasi. Larutan stok standar
terfenadin dan contoh sediaan farmasi (Terfin® dan Rhinofed®) dibuat dengan masing-masing dengan konsentrasi 100 ppm dan 50 ppm. Sebanyak 1.5 ml larutan stok
contoh sediaan farmasi dimasukkan ke dalam labu takar 25 ml, kemudian ditambahkan masing-masing 0.25 ml, 0.75 ml, dan 1.25 ml larutan standar pada labu tersebut. Penambahan larutan stok standar dilakukan masing-masing tiga kali ulangan, kemudian diukur menggunakan spektrofotometer.
Uji Linearitas. Tiga seri deret standar
dengan konsentrasi 2 ppm, 4 ppm, 6 ppm, 8 ppm, dan 10 ppm diukur menggunakan spektrofotometer.
Uji Limit Deteksi dan Limit Kuantisasi.
Tiga seri deret standar dengan konsentrasi 2 ppm, 4 ppm, 6 ppm, 8 ppm, dan 10 ppm diukur menggunakan spektrofotometer. Limit deteksi dan limit kuantitasi dihitung dari rerata simpangan baku dan kemiringan larutan standar pada kurva standar (ICH 1996).
Kromatografi Cair Kinerja Tinggi.
Metode yang digunakan berdasarkan US Pharmacopeia. Fase gerak yang digunakan adalah campuran metanol dan larutan buffer trietilamonium fosfat 0.1 M (80:20), sedangkan fase diamnya adalah kolom C8. Untuk preparasi contoh, tablet Terfin® dan Rhinofed® ditimbang berturut-turut 0.3929 g dan 0.3413 g sebanyak tiga kali ulangan, lalu dilarutkan dalam fase gerak kemudian distirer selama satu jam. Setelah itu dimasukkan ke dalam labu takar 100 ml dan ditambahkan fase gerak sampai tanda tera. Untuk preparasi standar, ditimbang sebanyak 0.05 g standar, lalu dilarutkan dalam fase gerak kemudian distirer selama satu jam. Setelah itu dimasukkan ke dalam labu takar 50 ml dan ditambahkan fase gerak sampai tanda tera. Larutan stok standar diencerkan menjadi konsentrasi 300 ppm, 600 ppm, dan 900 ppm. Laju alir dan volume injeksi yang digunakan adalah 1 ml/menit dan 10 μl.
HASIL DAN PEMBAHASAN
Spektrofotometri Derivatif Ultraviolet
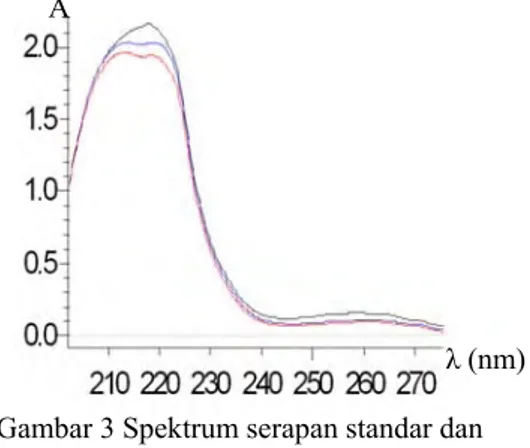
Metode spektrofotometri ultraviolet konvensional dengan pengukuran pada panjang gelombang maksimum tidak dapat digunakan secara langsung untuk penentuan terfenadin dalam sediaan farmasi. Hal ini dikarenakan adanya matriks dan serapan senyawa lain yang dapat mengganggu penentuan terfenadin. Efek ini dapat dilihat pada Gambar 3 yang menunjukkan spektrum serapan dari obat Terfin®, Rhinofed®, dan standar terfenadin.
A
λ (nm) Gambar 3 Spektrum serapan standar dan
obat terfenadin.
Keterangan: merah: standar terfenadin biru : obat Terfin®
hitam: obat Rhinofed®
Berdasarkan Gambar 3 diketahui bahwa dengan konsentrasi yang sama, besarnya serapan contoh selalu lebih besar dibandingkan dengan serapan standar. Hal tersebut dikarenakan dalam obat terdapat berbagai macam senyawa yang dapat memberikan serapan pada panjang gelombang yang sama dengan serapan terfenadin. Apabila dilakukan pengukuran secara spektrofotometri konvensional, maka akan diperoleh hasil yang tidak akurat. Kesulitan ini dapat diatasi dengan melakukan derivatisasi spektrum. Teknik ini dapat meningkatkan resolusi dari spektrum yang tumpang tindih dan mengurangi efek gangguan dari matriks dan serapan senyawa lain. Pengaruh derivatisasi spektrum dapat dilihat pada Gambar 4. Berdasarkan Gambar 4 diketahui bahwa dengan melakukan derivatisasi, diperoleh spektrum yang lebih tajam dan berhimpit antara contoh dan standar yang dibuat dengan konsentrasi sama. Konsentrasi standar dan contoh yang digunakan adalah 50 ppm dan penyapuan dilakukan pada kisaran panjang gelombang 200-370 nm.
dA/dλ
λ (nm)
Gambar 4 Spektrum turunan pertama standar dan obat terfenadin.
Bagan alir penelitian dapat dilihat pada Lampiran 1. Pencarian kondisi optimum dalam penentuan terfenadin secara spektrofotometri derivatif UV perlu dilakukan untuk mendapatkan resolusi yang baik. Parameter-parameter yang digunakan dalam pemilihan kondisi optimum, yaitu kecepatan penyapuan, turunan, orde penghalusan, dan jumlah jendela. Pada tahap awal dilakukan penentuan kecepatan penyapuan. Kecepatan yang diuji yaitu 100 nm/menit, 200 nm/menit, 400 nm/menit, 800 nm/menit, dan 1200 nm/menit. Berdasarkan spektrum yang diperoleh, terdapat perbedaan yang dihasilkan oleh masing-masing kecepatan penyapuan. Kecepatan penyapuan yang dipilih adalah 200 nm/menit, karena apabila kecepatannya lebih dari 200 nm/menit, spektrum yang dihasilkan akan sangat halus sehingga dapat mengurangi informasi yang dibutuhkan, sedangkan apabila kecepatannya kurang dari 200 nm/menit, maka akan membutuhkan waktu yang lebih lama. Pengaruh kecepatan penyapuan terhadap bentuk spektrum dapat dilihat pada Lampiran 3.
Penentuan kondisi optimum untuk parameter lain dilakukan bersamaan dengan penentuan kadar terfenadin dalam obat. Persamaan regresi linear larutan standar diperoleh pada kisaran konsentrasi 2-10 ppm, sedangkan larutan contoh disiapkan masing-masing dengan konsentrasi setara terfenadin 5 ppm. Analisis untuk contoh dilakukan sebanyak enam kali ulangan. Spektrum yang diperoleh, kemudian diderivatisasi. Spektrum serapan standar dan contoh dapat dilihat pada Lampiran 4.
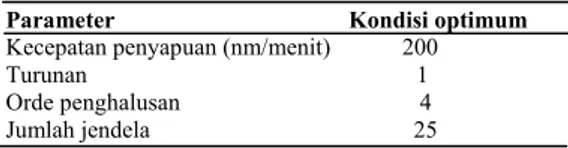
Faktor penghalusan spektrum ditentukan dalam penelitian ini, yaitu orde penghalusan dan jumlah jendela. Orde penghalusan dan jumlah jendela memberikan pengaruh terhadap bentuk dan besarnya amplitudo spektrum. Pengaruh orde penghalusan terhadap besarnya amplitudo, yaitu semakin tinggi orde penghalusan, amplitudo yang diperoleh semakin besar. Pengaruh jumlah jendela terhadap besarnya amplitudo, yaitu semakin banyak jumlah jendela, maka semakin banyak pula data yang diolah untuk menghaluskan spektrum.Hal ini menyebab-kan nilai amplitudo amenyebab-kan semakin kecil. Dalam analisis kuantitatif, spektrum yang diperoleh diharapkan tidak kasar karena banyak noise juga tidak terlalu halus. Hal ini dikarenakan apabila spektrum terlalu kasar, maka sulit untuk menentukan serapan sebenarnya dari terfenadin, sedangkan jika terlalu halus, maka informasi yang diperlukan dapat berkurang karena adanya distorsi spektrum. Apabila distorsi spektrum terjadi, maka terjadi penurunan tinggi puncak, sedangkan lebar puncak akan meningkat. Kondisi optimum untuk penentuan terfenadin secara spektrofotometri derivatif UV disajikan pada Tabel 1.
Spektrum turunan pertama memiliki sensitivitas dan linearitas yang tinggi, sehingga turunan pertama yang dipilih untuk analisis kuantitatif. Walaupun spektrum dengan tingkat derivatisasi yang tinggi memiliki linearitas yang tinggi pula, spektrum tersebut tidak dipilih untuk analisis karena semakin tinggi tingkat derivatisasi, maka noise dari instrumen semakin besar, sehingga mempengaruhi amplitudo dari standar dan contoh. Amplitudo merupakan respon yang terukur. Besarnya nilai amplitudo dari standar dapat dilihat pada Lampiran 6.
Larutan standar dengan konsentrasi 2-10 ppm memberikan linearitas yang tinggi. Tumpang tindih spektrum antara standar dan contoh sediaan farmasi pada spektrum turunan pertama dipilih sebagai daerah untuk pengukuran amplitudo. Amplitudo yang digunakan untuk mendapatkan persamaan regresi linear adalah D
Turunan 1
Z, yaitu amplitudo yang
besarnya dihitung dari garis nol. Larutan standar dan contoh memberikan serapan yang maksimum pada panjang gelombang 225.2 nm. Panjang gelombang ini digunakan untuk penentuan terfenadin dalam obat. Tumpang tindih yang terjadi menandakan efek matriks telah hilang dan hanya serapan terfenadin saja yang terjadi pada daerah tersebut. Persamaan kurva standar pada analisis terfenadin secara spektrofotometri derivatif UV dapat dilihat pada Lampiran 7.
Dalam analisis kimia sangat penting untuk menghilangkan atau meminimalisasi noise tanpa mengurangi informasi yang ada, oleh karena itu diperlukan proses penghalusan yang sesuai sebelum atau selama derivatisasi.
Tabel 1 Kondisi optimum pada penentuan terfenadin secara spektrofotometri derivatif ultraviolet
Parameter Kondisi optimum
Kecepatan penyapuan (nm/menit) 200 Orde penghalusan 4 Jumlah jendela 25
Persamaan regresi larutan standar 2-10 ppm adalah Y= -1.36x10-4 + 9.46x10-4X dengan koefisien korelasi sebesar 0.9998. Kurva larutan standar terfenadin dapat dilihat pada Gambar 5. Spektrum standar dan contoh pada
kondisi optimum dapat dilihat pada Lampiran 5. Kadar terfenadin dalam obat diperoleh dengan memasukkan nilai amplitudo contoh yang sudah diderivatisasi sesuai kondisi optimum ke dalam persamaan tersebut.
Y = -1.36x10-4 + 9.46x10-4X r = 0.9998
Gambar 5 Kurva standar terfenadin.
Nilai rerata kadar terfenadin yang diperoleh dengan pengukuran sebanyak enam kali ulangan dalam obat Terfin® dan Rhinofed® berturut-turut adalah 60.14 mg dan 39.90 mg. Nilai-nilai tersebut berada dalam kisaran 100.22% dan 99.75% apabila dibandingkan dengan kadar terfenadin dalam sampul obat. Nilai ini dekat dengan kandungan terfenadin yang tercantum dalam sampul obat. Kesalahan analisis dapat disebabkan oleh kondisi alat yang tidak stabil serta kesalahan pada saat preparasi standar maupun contoh.
Spektrofotometri derivatif UV merupakan metode yang murah, cepat, dan mudah untuk kuantifikasi terfenadin. Biaya yang diperlukan untuk penggunaan alat spektrofotometri derivatif UV lebih murah apabila dibandingkan dengan KCKT. Preparasi standar dan contoh dapat dilakukan dengan cepat dan mudah karena standar dan contoh hanya dilarutkan dengan pelarut kemudian dapat diukur.
Kromatografi Cair Kinerja Tinggi
KCKT digunakan sebagai metode referensi untuk analisis terfenadin dalam sediaan farmasi. Analisis kualitatif dilakukan dengan membandingkan waktu retensi contoh dengan standar, sedangkan analisis kuantitatif dilakukan dengan menghitung konsentrasi contoh berdasarkan kurva standar yang diperoleh dari hasil plot antara luas puncak dengan konsentrasi larutan standar. Kondisi KCKT untuk analisis terfenadin menggunakan sistem fase terbalik, kolom C-8, fase gerak
metanol : larutan buffer trietilamonium fosfat 0.1 M (80:20), detektor UV pada panjang gelombang 235 nm, sistem pompa isokratik dengan laju alir 1.0 ml/menit, dan volume injeksi 10 μl.
Contoh yang digunakan dalam penelitian ini adalah sediaan farmasi berbentuk tablet. Kurva standar dibentuk dari larutan standar dengan konsentrasi 300 ppm, 600 ppm, dan 900 ppm. Penentuan kadar terfenadin dalam tablet Terfin® dan Rhinofed® dilakukan dengan melarutkannya ke dalam fase gerak sehingga diperoleh larutan contoh sediaan farmasi dengan konsentrasi setara terfenadin 600 ppm, kemudian dilakukan analisis sebanyak tiga kali ulangan untuk masing-masing contoh. Standar maupun contoh terfenadin tidak larut dalam fase gerak, maka dilakukan proses pelarutan dengan menggunakan pengaduk magnet. Data kromatogram larutan standar dan contoh sediaan farmasi disajikan pada Tabel 2 dan kromatogramnya dapat dilihat pada Lampiran 10, 11, dan 12.
Tabel 2 Waktu retensi dan luas puncak pada analisis KCKT
Sampel Waktu retensi Luas (menit) puncak Standar 300 ppm 3.843 1810512 Standar 600 ppm 3.835 3445860 Standar 900 ppm 3.832 4734927 Terfin® (1)a 3.827 3853465 Terfin® (2) 3.828 3839330 Terfin® (3) 3.845 3806369 Rhinofed® (1) 3.843 3964664 Rhinofed® (2) 3.840 3906150 Rhinofed® (3) 3.857 3786787 a ulangan
Berdasarkan Tabel 2 diketahui bahwa puncak standar dan contoh terfenadin berada pada waktu retensi 3.8 menit. Hal ini menandakan bahwa pada waktu retensi 3.8 menit hanya respon terfenadin yang terukur.
Y = 406018 + 4874.025 X r = 0.9977
Gambar 6 Kurva standar terfenadin pada analisis KCKT.
Pada Gambar 6 diperoleh persamaan garis y = 406018 + 4874.025 x dengan nilai regresi sebesar 0.9977. Nilai regresi tersebut mendekati satu sehingga dapat dikatakan bahwa kurva memiliki kelinearan yang tinggi.
Kadar terfenadin dalam contoh diperoleh dengan memasukkan nilai luas puncak contoh ke dalam persamaan garis kurva standar. Kadar terfenadin dalam obat disajikan pada Tabel 3.
Tabel 3 Kadar terfenadin dalam obat pada analisis KCKT
Ulangan Terfenadin/tablet Terfenadin/tablet Terfin® (mg) Rhinofed® (mg)
1 70.67 48.61
2 70.43 47.75 3 71.81 46.12 70.97±0.74 47.49±1.26
Berdasarkan Tabel 3 diperoleh nilai rerata kadar terfenadin dalam obat Terfin® dan Rhinofed® berturut-turut 70.97 mg dan 47.49 mg. Nilai-nilai tersebut berada dalam kisaran 118.28 % dan 118.72 % apabila dibandingkan dengan kadar terfenadin dalam sampul obat. Hasil ini lebih besar apabila dibandingkan dengan analisis secara spektrofotometri dan kadar yang tercantum dalam sampul obat. Hal ini dapat dikarenakan tidak dilakukannya uji kesesuaian sistem pada analisis KCKT, sehingga kondisi operasional yang tepat tidak dapat ditentukan. Metode KCKT dilakukan berdasarkan prosedur dalam US Pharmacopeia.
Hasil penentuan terfenadin dalam obat secara KCKT dan spektrofotometri derivatif UV diuji secara statistik untuk melihat apakah hasil analisis yang diperoleh kedua metode berbeda nyata. Uji yang digunakan, yaitu uji t-student dan uji F. Uji t-student dilakukan untuk membandingkan nilai rataan dari hasil yang diperoleh kedua metode, sedangkan uji F dilakukan untuk membandingkan dua ragam. Ragam adalah ukuran yang menggambarkan besarnya perbedaan antara satu pengukuran dengan pengukuran lainnya. Penentuan uji t-student dan F disajikan pada Lampiran 9. Hasil uji t-student dan uji F dapat dilihat pada tabel 4.
Tabel 4 Hasil uji t-student dan F
Parameter Terfin® Rhinofed®
t hitung 8.666 5.102 t tabel 2.447 2.365 F hitung 15.271 6.297 F tabel 5.786 5.786
Berdasarkan Tabel 4, diketahui nilai thitung lebih besar dibandingkan dengan nilai ttabel. Uji secara statistik bisa diterima apabila nilai thitung dan Fhitung lebih kecil daripada nilai ttabel dan Ftabel. Hal ini menunjukkan bahwa rataan hasil yang diperoleh kedua metode berbeda nyata, sedangkan uji F memberikan hasil yang menyatakan bahwa ragam dari kedua metode juga berbeda nyata. Perbedaan antara nilai tabel dengan nilai hitung dikarenakan adanya variasi pengukuran yang disebabkan oleh kesalahan pengukuran maupun perbedaan antara metode yang digunakan.
Validasi Metode
Validasi metode dilakukan karena metode spektrofotometri derivatif UV merupakan metode standar namun dibuat perubahan-perubahan tertentu sehingga sesuai dengan aplikasinya. Dalam penelitian ini, validasi metode tetap dilakukan walaupun secara statistik memberikan hasil yang berbeda nyata dengan metode referensi karena hasil yang diperoleh dengan metode ini dekat dengan nilai yang terdapat pada sampul obat. Parameter-parameter validasi yang diuji antara lain linearitas, presisi, akurasi, limit deteksi, dan limit kuantitasi.
Linearitas ditentukan dengan mengukur larutan standar 2-10 ppm, kemudian spektrum yang diperoleh diderivatisasi sesuai kondisi optimum. Persamaan kurva standar yang diperoleh yaitu Y = 2,83x10-4 + 9,985x10-4X dengan nilai regresi 0.9994. Metode ini memiliki kelinearan yang baik karena menghasilkan koefisien korelasi yang cukup tinggi. Hal ini menandakan bahwa metode ini mampu menghasilkan angka analisis yang proporsional terhadap konsentrasi terfenadin dalam contoh. Penentuan linearitas ditunjukkan pada Lampiran 13. Kurva larutan standar pada penentuan linearitas dapat dilihat pada Gambar 7,
sedangkan parameter statis-tika kurva standar disajikan pada Tabel 5. Y = 2.83x10-4 + 9.985x10-4X r = 0.9994
Gambar 7 Kurva standar terfenadin pada penentuan linearitas.
Tabel 5 Parameter statistika kurva standar pada penentuan linearitas
Parameter statistika Metode SDUV
Kisaran konsentrasi (ppm) 2-10 Persamaan regresi Y=2.83x10-4+9.985x10-4X
σ intersep 0.00040
σ kemiringan 0.00005
Koefisien korelasi 0.99940 Keterangan: σ: simpangan baku
Presisi ditentukan dengan menghitung nilai SBR hasil pengukuran contoh yang dilakukan sebanyak enam kali ulangan. Penentuan kadar terfenadin secara spektrofotometri derivatif ultraviolet dapat dilihat pada Lampiran 8. Kadar terfenadin dalam contoh disajikan pada Tabel 6.
Tabel 6 Kadar terfenadin dalam obat pada analisis spektrofotometri derivatif ultraviolet
Ulangan Terfenadin/tablet Terfenadin/tablet Terfin® (mg) Rhinofed® (mg) 1 57.07 36.80 2 63.14 39.10 3 57.70 43.82 4 58.05 39.76 5 63.49 36.45 6 61.38 43.48 60.14 ± 2.88a 39.90 ± 3.17 a simpangan baku
Berdasarkan tabel 6 diperoleh nilai SBR untuk obat Terfin® adalah 4.79%, sedangkan nilai SBR untuk obat Rhinofed® adalah 7.94%. Penentuan simpangan baku relatif dapat dilihat pada Lampiran 14.
Akurasi dilakukan dengan menghitung nilai perolehan kembali standar yang ditambahkan ke dalam contoh. Penentuan akurasi disajikan pada Lampiran 15. Nilai perolehan kembali dapat dilihat pada Tabel 7. Tabel 7 Data perolehan kembali pada penentuan akurasi
Contoh Jumlah Perolehan ditambahkan ditemukan kembali (µg) (µg)a (%)a Terfin® 25 26.66±2.43 106.63±9.71 75 82.74±2.62 110.30±3.48 125 133.98±4.13 107.19±3.30 Rhinofed® 25 20.32±2.61 81.30±10.44 75 76.07±1.46 101.43±1.96 125 127.98±1.50 102.38±1.20 a rerata dari tiga kali ulangan
Berdasarkan Tabel 7 diketahui bahwa nilai perolehan kembali berada dalam kisaran 81.30%-110.30%. Data perolehan kembali yang didapatkan cukup tinggi.
Nilai limit deteksi dan limit kuantitasi ditentukan berdasarkan kemiringan dan rerata
simpangan baku dari kurva standar. Limit deteksi yang diperoleh yaitu 1.31 ppm, sedangkan limit kuantitasi yang diperoleh yaitu 3.98 ppm. Hal ini menandakan konsentrasi terendah dari analit yang dapat dideteksi dengan metode ini adalah 1.31 ppm, sedangkan konsentrasi terendah analit yang dapat dikuantitasi adalah 3.98 ppm. Penentuan limit deteksi dan limit kuantitasi disajikan pada Lampiran 16. Nilai limit kuantitasi terfenadin lebih besar daripada konsentrasi terendah dari standar terfenadin yang diukur (2 ppm), sehingga dapat menyebabkan penyimpangan dari hasil analisis.
SIMPULAN DAN SARAN
Simpulan
Penentuan terfenadin secara KCKT pada sediaan farmasi memberikan hasil sebesar 70.79 mg dan 47.49 mg sedangkan secara spektrofotometri derivatif UV memberikan hasil sebesar 60.14 mg dan 39.90 mg. Hasil ini berbeda nyata apabila diuji secara statistik. Pengukuran validasi metode menberikan hasil linearitas sebesar 0.9994, presisi dengan nilai SBR 4.79% dan 7.94%, akurasi dengan nilai perolehan kembali 81.30%-110.30%, limit deteksi 1.31 ppm, serta limit kuantitasi 3.98 ppm. Metode spektrofotometri derivatif UV merupakan metode yang murah, cepat, dan mudah untuk kuantifikasi terfenadin dalam sediaan farmasi.
Saran
Perlu dilakukan kembali tahap optimali-sasi spektrofotometri derivatif UV untuk analisis terfenadin dengan memperhatikan parameter delta lambda (∆λ) dan menggunakan kisaran konsentrasi yang lebih besar dari limit kuantitasinya. Selain itu perlu dilakukan verifikasi alat dan penentuan parameter-parameter validasi yang lain, seperti kisaran, presisi tengah, dan robustness.
DAFTAR PUSTAKA
Alpdogan G, Karabina K, Sungur S. 2000. Derivative spectrophotometry determi-nation of caffein in some beverages. Turk J Chem 26:295-302.
American Medical Association. 1986. Drugs Evaluations. 6th Edition. Philadelphia: WB Saunders.
Anonim. 1989. The Merck Index. Eleventh Edition. New York: Merck & Co.
Ansel HC. 1989. Pengantar Bentuk Sediaan Farmasi. Edisi ke-4. Farida Ibrahim; penerjemah. Jakarta: Universitas Indonesia Press. Terjemahan dari Introduction to Pharmaceutical Dosage Forms.
Aydogmus Z, Cetin SM. 2002. Determination of ascorbic acid in vegetables by derivative spectrophotometry. Turk J Chem 26:697-704.
Coutant JE et al. 1991. Determination of terfenadine and terfenadine acid metabolite in plasma using solid phase extraction and high performance liquid chromatography with fluorescence detection. J Chromatogr 18:139-48.
Departemen Kesehatan, Dit Jen. POM. 1995. Farmakope Indonesia. Edisi ke-4. Jakarta: Departemen Kesehatan.
Dinc E, Ozdemir A, Baleanu D. 2005. Comparative study of the continous wavelet transform, derivative and partial least square methods applied to the overlapping spectra for the simultaneous quantitative resolution of ascorbic acid and acetylsalicylic acid in effervescent tablets. J Pharm Biomed Anal 37:569-575.
El-Sayed AAY, El-Salem NA. 2005. Recent development of derivative spectrophoto-metry and their analytical applications [ulasan]. Anal Sci 21:595-614.
Garfield FM. 1992. Qualitical Assurance Principle for Analytical Laboratories. Parlington: AOAC International.
Ghoneim M et al. 2001. Assay of terfenadine in pharmaceutical formulation and human plasma by adsorptive stripping voltam-metry. J Pharm Biomed Anal 4:593-598. Hendayana S, Kadarohman A, Sumarna A,
Supriatna A. 1994. Kimia Analatik Instrumen. Semarang: IKIP Semarang Press.
Hidayat A. 1989. Pengendalian dan Evaluasi Unjuk Kerja Metode Analisis Kimia. Warta Akab 1:58-61.
[ICH] International Conference on Harmoni-sation. 1996. Validation of Analytical Procedures. http://www.nihs.go.jp/drug/ validation/q2bwww.html. [20 Desember
2005].
Kelani K et al. 1999. Determination of astemizole, terfenadine, and flunarizine hydrochloride by ternary complex formation with eosin and lead (II). J Pharm Biomed Anal 18:985-992.
MS Sudjadi. 1985. Penentuan Struktur Senyawa Organik. Jakarta: Ghalia Indonesia.
Owen T. 1996. Fundamentals of UV-Visible Spectroscopy. Waldbronn: Hewlett-Packard.
Purwanto H, Gunadi B, SU Sembiring, Insan K. 2002. Data Obat di Indonesia. Edisi ke-10. Jakarta: Grafidian Medipress. Rolim A et al. 2005. Total flavonoids
quantification from O/W emulsion with extract of Brazilian plants. Intl J Pharmaceutics, siap terbit.
[SAC-SINGLAS] Singapore Accreditation Council-Singapore Laboratory Accredita-tion Scheme. 2002. Method ValidaAccredita-tion for Chemical Testing. Singapore: SPRING Singapore.
Schunack W, Klaus M, Manfred H. 1990. Pengantar Kimia Farmasi. Yoke Rwattinema & Sriewolan Soebito; penerjemah. Yogyakarta: Universitas Gajah Mada Press. Terjemahan dari Lehrburch der Pharmazeutischen Chemie. Skujins S. 1986. Applications of UV-Visible
Derivative Spectrophotometry. Stenhaus-trasse: Varian AG.
Souri E, Jalalizadeh H, Farsam H, Rezwani H, Amanlou M. 2005. Simultaneous determination of anthocyanide and beta-carotene by third-derivative ultraviolet spectrophotometry. DARU 13:11-16.
[USP] United State Pharmacopeia. 1995. The United State Pharmacopeia. Rockville: USP Convention.
Lampiran 1 Bagan alir penelitian
Contoh Sediaan Farmasi
Spektrofotometri
(Penentuan kecepatan penyapuan)
KCKT
Pengukuran Standar (Kurva Standar) dan Contoh
Pengolahan Sinyal
Validasi Metode (Uji Linearitas, Presisi, Akurasi, Limit Deteksi, dan Limit Kuantitasi)
Kadar Terfenadin
Standar Terfenadin
Lampiran 2 Penentuan kadar terfenadin secara KCKT Data penimbangan contoh sediaan farmasi
Contoh sediaan farmasi (ulangan) Bobot (g) Terfin® (1) 0.3933 Terfin® (2) 0.3930 Terfin® (3) 0.3930 Rhinofed® (1) 0.3418 Rhinofed® (2) 0.3422 Rhinofed® (3) 0.3422 Contoh perhitungan :
Persamaan Kurva Standar : y = 406018 + 4874.025x r = 0.9977
Terfin® (1): 3853405 = 406018 + 4874.025x
x = 707.2978 ppm = 707.2978 mg = 70.73 mg 1000 ml 100 ml Kadar Terfenadin/10 tablet = 70.73 mg = 393.3 mg x 3929.5 mg x = 706.67 mg Kadar Terfenadin/tablet = 706.67 mg = 70.67 mg 10 Rhinofed® (1): 3964664 = 406018 + 4874,025x x = 730.1247 ppm = 730.1247 mg = 73.01 mg 1000 ml 100 ml Kadar Terfenadin/10 tablet = 73.01 mg = 341.8 mg x 2275.7 mg x = 486.09 mg Kadar Terfenadin/tablet = 486.09 mg = 48.61 mg 10
Lampiran 3 Spektrum serapan pada kecepatan penyapuan a. 100 nm/menit; b. 200 nm/menit; c. 400 nm/menit; d. 800 nm/menit; e. 1200 nm/menit
a
2 1 0 2 2 0 2 3 0 2 4 0 2 5 0 2 6 0 2 70 n m 0 .0 0 .5 1 .0 1 .5 2 .0210 220 230 240 250 260 270
nm
0.0
0.5
1.0
1.5
2.0
A
2 1 0
2 2 0
2 3 0
2 4 0
2 5 0
2 6 0
2 7 0
n m
0 . 0
0 . 5
1 . 0
1 . 5
2 . 0
λ
b
A
λ
c
A
λ
Lanjutan
d
A
2 1 0
2 2 0
2 3 0
2 4 0
2 5 0
2 6 0
n m
0 .0
0 .5
1 .0
1 .5
2 .0
λ ( )
e
2 .
2 1 0
2 2 0
2 3 0
2 40
2 5 0
2 6 0
2 7 0
n m
0 .0
0 .5
1 .0
1 .5
0
A
λ (
)
Keterangan: merah: standar 50 ppm biru: Terfin® 50 ppm hitam: Rhinofed® 50 ppm
Lampiran 4 Spektrum serapan larutan standar 2-10 ppm dan contoh sediaan farmasi pada ulangan a. 1; b. 2; c. 3; d. 4; e. 5; f. 6
a
A
λ (nm)
Keterangan: hitam: standar 2 ppm biru muda: standar 4 ppm merah: standar 6 ppm biru tua: standar 8 ppm coklat: standar 10 ppm
hijau muda: contoh Terfin® 5 ppm hijau tua: contoh Rhinofed® 5 ppm
b
A
λ (nm)
c
A
λ (nm)
Lanjutan
d
A
λ (nm)
e
A
λ (nm)
f
A
λ (nm)
Lampiran 5 spektrum larutan standar 2-10 ppm dan contoh sediaan farmasi pada kondisi optimum ulangan a. 1; b. 2; c. 3; d. 4; e. 5; f. 6
a
dA/dλ
λ (nm
b
dA/dλ
λ (nm)
c
dA/dλ
λ (nm)
Lanjutan
d
dA/dλ
λ (nm)
e
dA/dλ
λ (nm)
f
dA/dλ
λ (nm)
Lampiran 6 Amplitudo standar pada analisis terfenadin secara spektrofotometri derivatif ultraviolet
Amplitudo standar 2-10 ppm pada turunan pertama
Dz 2 ppm 4 ppm 6 ppm 8 ppm 10 ppm 1-2-19 0.00160 0.00342 0.00524 0.00704 0.00868 1-2-21 0.00157 0.00336 0.00516 0.00695 0.00857 1-2-23 0.00154 0.00331 0.00508 0.00684 0.00844 1-2-25 0.00150 0.00324 0.00500 0.00673 0.00830 1-2-27 0.00149 0.00320 0.00491 0.00662 0.00815 1-2-29 0.00146 0.00313 0.00483 0.00650 0.00801 1-2-31 0.00142 0.00307 0.00473 0.00638 0.00786 1-3-19 0.00173 0.00371 0.00561 0.00759 0.00925 1-3-21 0.00172 0.00370 0.00560 0.00756 0.00927 1-3-23 0.00172 0.00368 0.00560 0.00753 0.00926 1-3-25 0.00171 0.00366 0.00558 0.00750 0.00925 1-3-27 0.00171 0.00365 0.00557 0.00748 0.00922 1-3-29 0.00173 0.00364 0.00555 0.00745 0.00917 1-3-31 0.00172 0.00362 0.00553 0.00742 0.00914 1-4-19 0.00173 0.00371 0.00561 0.00759 0.00928 1-4-21 0.00172 0.00370 0.00560 0.00756 0.00925 1-4-23 0.00172 0.00368 0.00560 0.00753 0.00926 1-4-25 0.00171 0.00366 0.00558 0.00750 0.00925 1-4-27 0.00171 0.00365 0.00557 0.00748 0.00922 1-4-29 0.00173 0.00364 0.00555 0.00745 0.00919 1-4-31 0.00172 0.00362 0.00553 0.00742 0.00914
Amplitudo standar 2-10 ppm pada turunan kedua
Dz 2 ppm 4 ppm 6 ppm 8 ppm 10 ppm 2-2-19 0.00021 0.00035 0.00052 0.00066 0.00082 2-2-21 0.00020 0.00034 0.00051 0.00063 0.00077 2-2-23 0.00019 0.00032 0.00046 0.00060 0.00074 2-2-25 0.00017 0.00030 0.00044 0.00057 0.00071 2-2-27 0.00016 0.00029 0.00042 0.00055 0.00067 2-2-29 0.00015 0.00028 0.00040 0.00052 0.00064 2-2-31 0.00015 0.00025 0.00038 0.00049 0.00060 2-3-19 0.00021 0.00035 0.00052 0.00066 0.00082 2-3-21 0.00020 0.00034 0.00049 0.00063 0.00078 2-3-23 0.00019 0.00032 0.00046 0.00060 0.00074 2-3-25 0.00017 0.00030 0.00044 0.00057 0.00071 2-3-27 0.00016 0.00029 0.00042 0.00055 0.00067 2-3-29 0.00015 0.00028 0.00040 0.00052 0.00064 2-3-31 0.00015 0.00025 0.00038 0.00049 0.00060 2-4-19 0.00027 0.00044 0.00066 0.00081 0.00106 2-4-21 0.00027 0.00043 0.00065 0.00081 0.00104 2-4-23 0.00026 0.00042 0.00063 0.00079 0.00102 2-4-25 0.00026 0.00041 0.00061 0.00077 0.00099 2-4-27 0.00025 0.00041 0.00060 0.00077 0.00096 2-4-29 0.00024 0.00041 0.00059 0.00076 0.00093 2-4-31 0.00024 0.00040 0.00057 0.00073 0.00090
Lampiran 7 Persamaan kurva standar pada analisis terfenadin secara spektrofotometri derivatif ultraviolet
Persamaan kurva standar 2-10 ppm pada turunan pertama
Dz Persamaan Kurva Standar Koefisien Korelasi (r)
1-2-19 Y=-1.38x10-4 + 8.89x10-4X 0.99979 1-2-21 Y=-1.55x10-4 + 8.795x10-4X 0.99980 1-2-23 Y=-1.57x10-4 + 8.665x10-4X 0.99980 1-2-25 Y=-1.13x10-4 + 8.555x10-4X 0.99946 1-2-27 Y=-1.48x10-4 + 8.37x10-4X 0.99977 1-2-29 Y=-1.55x10-4 + 8.235x10-4X 0.99977 1-2-31 Y=-1.65x10-4 + 8.095x10-4X 0.99977 1-3-19 Y=-9.8x10-5 + 9.46x10-4X 0.99954 1-3-21 Y=-1.1x10-4 + 9.46x10-4X 0.99964 1-3-23 Y=-1.21x10-4 + 9.465x10-4X 0.99975 1-3-25 Y=-1.36x10-4 + 9.46x10-4X 0.99981 1-3-27 Y=-1.29x10-4 + 9.425x10-4X 0.99979 1-3-29 Y=-9.9x10-5 + 9.345x10-4X 0.99979 1-3-31 Y=-1.06x10-4 + 9.32x10-4X 0.99980 1-4-19 Y=-9.8x10-4 + 9.46x10-4X 0.99954 1-4-21 Y=-1.1x10-4 + 9.46x10-4X 0.99964 1-4-23 Y=-1.21x10-4 + 9.465x10-4X 0.99975 1-4-25 Y=-1.36x10-4 + 9.46x10-4X 0.99981 1-4-27 Y=-1.29x10-4 + 9.425x10-4X 0.99979 1-4-29 Y=-9.9x10-5 + 9.345x10-4X 0.99979 1-4-31 Y=-1.06x10-4 + 9.32x10-4X 0.99980
Persamaan kurva standar 2-10 ppm pada turunan kedua
Dz Persamaan Kurva Standar Koefisien Korelasi (r)
2-2-19 Y=5.3x10-5 + 7.65x10-5X 0.99959 2-2-21 Y=6.1x10-5 + 7.15x10-5X 0.99876 2-2-23 Y=4.8x10-5 + 6.9x10-5X 0.99989 2-2-25 Y=4.05x10-5 + 6.825x10-5X 0.99792 2-2-27 Y=3.4x10-5 + 6.4x10-5X 0.99988 2-2-29 Y=3.2x10-5 + 6.1x10-5X 0.99987 2-2-31 Y=3.2x10-5 + 5.7x10-5X 0.99938 2-3-19 Y=5.3x10-5 + 7.65x10-5X 0.99959 2-3-21 Y=5.3x10-5 + 7.25x10-5X 0.99993 2-3-23 Y=4.8x10-5 + 6.9x10-5X 0.99989 2-3-25 Y=3.3x10-5 + 6.75x10-5X 0.99992 2-3-27 Y=3.4x10-5 + 6.4x10-5X 0.99988 2-3-29 Y=3.2x10-5 + 6.1x10-5X 0.99987 2-3-31 Y=3.2x10-5 + 5.7x10-5X 0.99938 2-4-19 Y=6.3x10-5 + 9.76x10-5X 0.99738 2-4-21 Y=6.4x10-5 + 9.6x10-5X 0.99816 2-4-23 Y=5.7x10-5 + 9.45x10-5X 0.99817 2-4-25 Y=6.2x10-5 + 9.1x10-5X 0.99813 2-4-27 Y=6.4x10-5 + 8.9x10-5X 0.99962 2-4-29 Y=6.7x10-5 + 8.65x10-5X 0.99995 2-4-31 Y=7.3x10-5 + 8.25x10-5X 0.99994
Amplitudo contoh pada kondisi optimum No Contoh (ulangan) Amplitudo 1 Terfin® (1) 0.00448 2 Terfin® (2) 0.00488 3 Terfin® (3) 0.00442 4 Terfin® (4) 0.00456 5 Terfin® (5) 0.00503 6 Terfin® (6) 0.00477 7 Rhinofed® (1) 0.00427 8 Rhinofed® (2) 0.00461 9 Rhinofed® (3) 0.00511 10 Rhinofed® (4) 0.00469 11 Rhinofed® (5) 0.00438 12 Rhinofed® (6) 0.00414
Data penimbangan contoh obat
No Rhinofed® (g) Terfin® (g) 1 0.0144 0.0168 2 0.0146 0.0165 3 0.0144 0.0164 4 0.0146 0.0168 5 0.0149 0.0169 6 0.0148 0.0166 Contoh perhitungan:
Persamaan Kurva Standar Y=-1.36x10-4 + 9.46x10-4X, r = 0.99981
Terfin® (1) 0.00448 = -1.36 x10-4 + 9.46x10-4X
X = 4.8795 ppm = 0.24397 mg x fp(10) = 2.4397 mg 50 ml
Kadar Terfenadin/10 tablet = 2.4397 mg = 16.8 mg X 3929.5 mg x = 570.6429 mg Kadar Terfenadin/tablet = 570.6429 mg = 57.07 mg 10 Rhinofed ® (1) 0.00427 = -1.36 x10-4 + 9.46x10-4X X = 4.6575 ppm = 0.23288 mg x fp(10) = 2.3288 mg 50 ml
Kadar Terfenadin/10 tablet = 2.3288 mg = 14.4 mg X 2275.7 mg x = 368.0313 mg
Kadar Terfenadin/tablet = 368.0313 mg = 36.80 mg 10
Lampiran 9 Uji F dan t-student
Ulangan Kadar terfenadin/tablet Terfin® (mg) |Xi -X| |Xi -X|2
1 57.07 3.07 9.4249 2 63.14 3.00 9.0000 3 57.70 2.44 5.9536 4 58.05 2.09 4.3681 5 63.49 3.35 11.2225 6 61.38 1.24 1.5376 Jumlah 360.83 15.19 41.5067 X1 : 360.83 mg : 6 = 60.14 X2 : 212.91 mg : 3 = 70.97 mg σ : [ Σ (Xi – X)2 ]1/2 = [ 41.5067 ]1/2 = 2.8820 n – 1 6 - 1 S22 = 1.0872 = 0.5436 2 S12 = 41.5067 = 8.3013 5 t = x1 – x2 = 60.14 – 70.97 = 8.666 (S12/ n1+ S22/n2)1/2 (8.3013/6+0.5346/3)1/2 F = S12 = 8.3013 = 15.2710 S22 0.5436
Keterangan: X1 : rerata kadar terfenadin dalam contoh secara spektrofotometri derivatif
ultraviolet
X2 : rerata kadar terfenadin dalam contoh secara KCKT
σ : simpangan baku
S12: ragam kadar terfenadin dalam contoh secara spektrofotometri derivatif
ultraviolet
Lampiran 10 Kromatogram standar terfenadin pada konsentrasi a. 300 ppm; b. 600 ppm; c. 900 ppm
a
b
Lampiran 11 Kromatogram contoh Terfin® 600 ppm pada ulangan a. 1; b. 2; c. 3
a
b
c
Lampiran 12 Kromatogram contoh Rhinofed® 600 ppm pada ulangan a. 1; b.2; c. 3
a
b
Lampiran 13 Penentuan linearitas
Amplitudo standar pada penentuan linearitas
Ulangan 2 ppm 4 ppm 6 ppm 8 ppm 10 ppm
1 0.00274 0.00453 0.00638 0.00879 0.01031
2 0.00223 0.00390 0.00585 0.00792 0.00986
3 0.00226 0.00406 0.00625 0.00827 0.01075
rerata 0.00241 0.00416 0.00616 0.00833 0.01031 Persamaan regresi kurva standar: Y = 2.83x10-4+9.985x10-4X, r = 0.9994
Lampiran 14 Penentuan simpangan baku relatif Kadar terfenadin pada contoh sediaan farmasi
Ulangan Terfenadin/tablet Terfin® (mg) Terfenadin/tablet Rhinofed® (mg) 1 57.07 36.80 2 63.14 39.10 3 57.70 43.82 4 58.05 39.76 5 63.49 36.45 6 61.38 43.48 Rerata±Simpangan baku 60.14±2.88 39.90±3.17 - Terfin® SBR: σ x 100 % = 2.8820 x 100 % = 4.79 % rerata 60.14
Lampiran 15 Penentuan akurasi Data amplitudo contoh
Standar yang ditambahkan
(μg)-ulangan Amplitudo Terfin
® Amplitudo Rhinofed® 25-1 0.00445 0.00421 25-2 0.00432 0.00404 25-3 0.00426 0.00402 75-1 0.00650 0.00634 75-2 0.00670 0.00625 75-3 0.00655 0.00636 125-1 0.00882 0.00833 125-2 0.00854 0.00839 125-3 0.00853 0.00845 -Terfin®-1 Amplitudo contoh: 0,00445
Persamaan regresi kurva standar: Y = 2,83x10-4+9.985x10-4X
0.00445 = 2.83x10-4+9.985x10-4X X = 4.1733 ppm = 4.1733 µg/ml x 25 ml = 104.3325 µg % Perolehan kembali = C1-C2 x 100% C3 = 104.3325 µg – 75 µg x 100% 25 µg = 117.32 %
Lampiran 16 Penentuan limit deteksi dan limit kuantitasi Data pengukuran standar
Ulangan Persamaan Regresi Koefisien Korelasi
1 Y = 7.3x10-4+9.7x10-4X 0.9981 2 Y = 1.68x10-4+9.64x10-4X 0.9994 3 Y = -3.9 x10-5+1.0595x10-3X 0.9986 LOD = 3.3 σ = 3.3 x (3.97 x 10-4) = 1.31 ppm s 9.98x10-4 LOQ = 10 σ = 10 x (3.97 x 10-4) = 3.98 ppm s 9.98x10-4
Keterangan: σ : simpangan baku intersep s : kemiringan